1.本发明涉及药物制剂技术领域,具体涉及一种水溶性大麻素制剂及其制备方法,特别是一种水溶性大麻素固体制剂及其制备方法。
背景技术:
2.环糊精(cyclodextrin,简称cd)是直链淀粉在由芽孢杆菌产生的环糊精葡萄糖基转移酶作用下生成的一系列环状低聚糖的总称。包合物是指一种(药物)分子被包嵌于另一物质分子(构成)的空穴结构中形成的包合体,或称为“分子胶囊”。其中,具有空穴结构的包合分子称为主分子,被包嵌的分子称为客分子。不同类型的主分子,可形成不同结构的包合物,如管状、层状、笼状、单分子包合物、分子筛包合物或高分子包合物等。环糊精包合物是一种(药物)分子被包嵌于环糊精分子的空穴结构中形成的包合体。
3.环糊精包合物具有以下特点:增加药物的溶解度和溶出度;能够将液体药物粉末化并防止挥发;掩盖药物的不良气味并降低刺激性;提高药物的稳定性;制备缓控释制剂。
4.环糊精包合物的制备技术包括:饱和水溶液法、溶液-搅拌法、研磨法、超声波法、冷冻干燥法、喷雾干燥法、液-液或气-液法。
5.聚合物胶束是由两亲性嵌段共聚物在水中溶解后自发形成核壳结构的高分子胶束。其两亲性是由亲水性嵌段和疏水性嵌段实现的。亲水性嵌段包括聚乙二醇(peg)、聚氧乙烯(peo)以及聚乙烯吡咯烷酮(pvp),疏水嵌段包括聚丙烯、聚氨基酸以及聚乳酸等。疏水性药物可以被包埋在疏水核心,亲水性链段组成的外壳形成水化层屏障来提供胶束稳定性。聚合物胶束中单一线性共聚物分子存在两种或两种以上结构不同的链段,可根据需要合成具有特定化学结构、分子量的共聚物,也可以在溶液中自组装成特定的超分子有序聚集体。
6.聚合物胶束能够增加难溶性药物在水中的溶解度,还能够利用其具有极小粒径的特性增强药物对肿瘤组织血管壁的渗透,实现对肿瘤的被动靶向性释药,延长体内循环时间。聚合物胶束的载体多为人工合成,可生物降解,在水性介质中热力学稳定。
7.聚合物胶束的制备技术包括:直接溶解法,透析法,水包油乳化法、溶剂挥发法。
8.大麻素为脂溶性物质,几乎不溶于水,极大制约了其在制剂领域的发展。大麻制剂多为油溶液,服用不方便,稳定性差,吸收生物利用度低。
9.专利文献cn 109953951 a公开了一种可增加难溶性药物大麻二酚生物利用度的水包油型纳米乳及其制备方法。
10.专利文献cn 110177543 a公开了先将维生素e琥珀酸酯用聚乙二醇1000酯化(维生素e tpgs),再将大麻素包含在维生素e tpgs的胶团内,从而得到一种大麻素的水溶性制剂。
11.专利文献cn 109476625 a和专利文献cn 101998855a都公开了通过环糊精包含大麻素的方式得到大麻素的水溶性制剂。
12.虽然大麻素包含在纳米乳、纳米囊、纳米微球或者环糊精中,能够提高大麻素的生
物利用度,但是这些已知的方法普遍存在载药量低、稳定性差、工艺复杂、成本高等缺点。
技术实现要素:
13.为克服现有技术的不足,本发明提供一种水溶性大麻素固体颗粒,其包含:大麻素、两亲性高分子聚合物、环糊精;其中,所述大麻素的重量百分比含量为1-40%,所述两亲性高分子聚合物的重量百分比含量为1-90%,所述环糊精的重量百分比含量为1-90%。
14.具体地,所述大麻素选自:cbd、cbdv、cbg、cbc、cbn、cbdb、cbe、cbl和cbnd纯品中的一种或两种以上的组合;或,
15.具体地,所述大麻素为大麻提取物,其包含cbd、cbdv、cbg、cbc、cbn、cbdb、cbe、cbl和cbnd中的一种或两种以上的组合。
16.具体地,所述两亲性高分子聚合物选自:泊洛沙姆、聚乙二醇-聚乳酸羟基乙酸共聚物、聚乙二醇-聚己内脂嵌段共聚物、聚乙二醇-聚乳酸嵌段共聚物和聚乙二醇-聚苯乙烯嵌段共聚物的一种或两种以上的组合;
17.优选地,所述泊洛沙姆选自:泊洛沙姆188、338、407、124、215和237中的一种或两种以上的组合;
18.优选地,所述聚乙二醇-聚乳酸羟基乙酸嵌段共聚物、聚乙二醇-聚己内酯嵌段共聚物、聚乙二醇-聚乳酸嵌段共聚物、聚乙二醇-聚苯乙烯嵌段共聚物的数均分子量为500-50000,其中,聚乙二醇为聚乙二醇单甲醚,聚乙二醇部分的数均分子量为200-12000。
19.具体地,所述环糊精选自:α-环糊精、β-环糊精、γ-环糊精、α-环糊精衍生物、β-环糊精衍生物、γ-环糊精衍生物。
20.具体地,所述环糊精选自:β-环糊精、羟丙基-β-环糊精、甲基-β-环糊精、环氧丙烷-β-环糊精。
21.本发明还提供一种水溶性大麻素制剂及其制备方法。
22.具体地,上述水溶性大麻素制剂包含:大麻素、两亲性高分子聚合物、环糊精,以及任选地,药学上可接受的冻干保护剂、ph调节剂,其通过包括如下步骤的方法制备:
23.(1)将大麻素、两亲性高分子聚合物和环糊精加入水中,制备水溶性复合物溶液,其中物料与水的质量比为1:(1-6);
24.(2)将步骤(1)所得水溶性复合物溶液干燥得到水溶性大麻素固体颗粒;
25.(3)将步骤(2)所得大麻素固体颗粒制备成水溶性大麻素制剂。
26.具体地,上述水溶性大麻素制剂中,大麻素的重量百分比含量为1-40%(具体如,1%、5%、10%、15%、20%、25%、30%、35%、40%)。
27.具体地,上述水溶性大麻素制剂中,两亲性高分子聚合物的重量百分比含量为1-90%(具体如,1%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%)。
28.具体地,上述水溶性大麻素制剂中,环糊精的重量百分比含量为1-90%(具体如,1%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%)。
29.在本发明的一个实施方式中,上述大麻素选自:cbd、cbdv、cbg、cbc、cbn、cbdb、cbe、cbl和cbnd纯品中的一种或两种以上的组合,其可为植物提取类大麻素或合成类大麻
素,优选为植物提取类大麻素。
30.在本发明的另一个实施方式中,上述大麻素为大麻提取物,其包含cbd、cbdv、cbg、cbc、cbn、cbdb、cbe、cbl和cbnd中的一种或两种以上的组合。
31.在本发明的一个实施方式中,上述两亲性高分子聚合物为两亲性高分子聚合物嵌段共聚物,其为两种以上聚合物组成的嵌段聚合物,其亲水部分可为聚乙二醇、聚氧乙烯、聚维酮等,其疏水部分可为聚氧丙烯、聚乳酸、聚苯乙烯、聚己内酯、聚氨基酸、聚乳酸羟基乙酸、聚丙烯酸等,例如,泊洛沙姆(peo-ppo-peo,poloxamer)、聚乳酸-聚乙二醇-聚乳酸三嵌段共聚物(pla-peg-pla)、聚乙二醇-聚丙烯酸嵌段共聚物(peg-paa)、聚乙二醇-聚天冬氨酸嵌段共聚物(peg-pasp)、聚乙二醇-聚乳酸羟基乙酸嵌段共聚物(peg-plag)、聚乙二醇-聚己内酯嵌段共聚物(peg-pcl)、聚乙二醇-聚乳酸嵌段共聚物(peg-pla/ptx)、聚乙二醇-聚苯乙烯嵌段共聚物(peg-b-ps)等中的一种或两种以上的组合。
32.具体地,上述泊洛沙姆选自:泊洛沙姆188、338、407、124、215、237等中的一种或两种以上的组合。
33.具体地,上述聚乙二醇-聚乳酸羟基乙酸嵌段共聚物、聚乙二醇-聚己内酯嵌段共聚物、聚乙二醇-聚乳酸嵌段共聚物、聚乙二醇-聚苯乙烯嵌段共聚物的数均分子量为500-50000(具体如,500、1000、2000、3000、4000、5000、6000、8000、10000、12000、14000、16000、18000、20000、22000、24000、26000、28000、30000、32000、34000、36000、38000、40000、42000、44000、46000、48000、50000);其中,聚乙二醇为聚乙二醇单甲醚,聚乙二醇部分的数均分子量可为200-12000(具体如,200、400、500、600、750、1000、2000、4000、5000、6000、8000、10000、12000)。
34.在本发明的一个实施方式中,上述环糊精包括环糊精及其衍生物。
35.具体地,上述环糊精选自:α-环糊精、β-环糊精、γ-环糊精、α-环糊精衍生物、β-环糊精衍生物、γ-环糊精衍生物。
36.具体地,上述环糊精选自:β-环糊精、羟丙基-β-环糊精、甲基-β-环糊精、环氧丙烷-β-环糊精中的一种或两种以上的组合。
37.在本发明的一个实施方式中,上述水溶性大麻素制剂还包含药学上可接受的冻干保护剂。
38.具体地,上述水溶性大麻素制剂中,冻干保护剂的重量百分比含量为0-20%(具体如1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%)。
39.具体地,上述冻干保护剂选自:硫代硫酸钠、亚硫酸氢钠、亚硫酸钠、焦亚硫酸钠、维生素c、乳糖、甘露醇、山梨醇、edta-2na、海藻糖、葡萄糖、木糖醇、麦芽糖中的一种或多种;
40.在本发明的一个实施方式中,上述水溶性大麻素制剂还包含ph调节剂。
41.具体地,上述水溶性大麻素制剂中,ph调节剂的重量百分比含量为0-40%(具体如0.01%、0.05%、0.1%、0.2%、0.3%、0.4%、0.5%、1%、2%、3%、4%、5%、10%、15%、20%、25%、30%、35%、40%)。
42.具体地,上述ph调节剂选自:枸橼酸、枸橼酸钠、酒石酸、酒石酸钠、醋酸、醋酸钠、磷酸二氢钠、磷酸氢二钠、盐酸、乳酸、氢氧化钠中的一种或多种。
43.在本发明的一个实施方式中,上述步骤(1)包括如下步骤:
44.(1-1)将两亲性高分子聚合物、环糊精、冻干保护剂、ph调节剂加入溶剂中溶解;
45.(1-2)将大麻素单一组分或提取物溶解到步骤(1-1)所得混合液中,得到澄清透明水溶性复合物溶液。
46.在本发明的一个实施例中,步骤(1-1)中的溶剂为水,如注射用水。
47.具体地,步骤(1-1)中溶剂用量为原料组分的1-6倍(质量比,具体如,1、2、3、4、5、6倍)。
48.具体地,步骤(1-2)中搅拌时间为1-24小时(具体如,1、2、4、6、8、10、12、14、16、18、20、22、24小时)。
49.具体地,步骤(1-2)中,搅拌温度为15-85℃(具体如,15、20、25、30、35、40、45、50、55、60、65、70、75、80、85℃)。
50.具体地,上述水溶性复合物溶液粒径为1-500nm(具体如,1、10、50、100、150、200、250、300、350、400、450、500nm)。
51.具体地,步骤(2)中的干燥为冷冻干燥或减压干燥。
52.具体地,上述冷冻干燥包括:预冻、升华干燥和解析干燥步骤;其中,预冻温度为-30~-50℃(具体如-30、-35、-40、-45、-50℃),预冻时间为0.5-3h(具体如0.5、1、2、3h),预冻步骤中真空度控制为1-100pa(1、10、20、30、40、50、60、80、100pa);升华干燥温度为-20~10℃(具体如-20、-10、-5、0、5、10℃),升华干燥时间为1-36h(具体如1、6、12、18、24、30、36h);解析干燥温度为10℃-30℃(具体如10、15、20、25、30℃),解析干燥时间为1-24h(具体如1、6、12、18、24h)。
53.具体地,上述减压干燥包括:减压和干燥步骤;其中,减压步骤中真空度为0.08mpa以下(具体如0.01、0.02、0.03、0.04、0.05、0.06、0.07、0.08mpa),干燥步骤中干燥温度为10-50℃(具体如10、15、20、25、30、35、40、45、50℃),干燥时间为1-48h(具体如1、6、12、18、24、30、36、42、48h)。
54.具体地,上述水溶性大麻素制剂为固体制剂或半固体制剂。
55.在本发明的一个实施方式中,上述水溶性大麻素制剂为口服制剂,如泡腾片、缓释片、崩解片、滴丸等。
56.在本发明另一个实施方式中,上述水溶性大麻素制剂为吸入制剂,如吸入粉雾剂等。
57.在本发明另一个实施方式中,上述水溶性大麻素制剂为肠溶制剂,如肠溶胶囊等。
58.在本发明的一个实施例中,上述水溶性大麻素制剂为吸入剂,其粒径为1-2μm(具体如1、1.5、2μm),其中上述步骤(2)中的干燥为冷冻干燥或减压干燥。
59.在本发明的另一个实施例中,上述水溶性大麻素制剂为泡腾片、崩解片,其中上述步骤(2)中的干燥为冷冻干燥或减压干燥。
60.在本发明的另一个实施例中,上述水溶性大麻素制剂为肠溶胶囊,其中上述步骤(2)中的干燥为冷冻干燥或减压干燥。
61.本发明提供的水溶性大麻素制剂的制备方法包括如下步骤:
62.(1)将大麻素、两亲性高分子聚合物和环糊精加入水中,制备水溶性复合物溶液,其中物料与水的质量比为1:(1-6);
63.(2)将步骤(1)所得水溶性复合物溶液干燥得到水溶性大麻素固体颗粒;
64.(3)将步骤(2)所得大麻素固体颗粒制备成水溶性大麻素制剂。
65.在本发明的一个实施方式中,上述步骤(1)包括如下步骤:
66.(1-1)将两亲性高分子聚合物、环糊精、冻干保护剂、ph调节剂加入溶剂中溶解;
67.(1-2)将大麻素单一组分或提取物溶解到步骤(1-1)所得混合液中,得到澄清透明水溶性复合物溶液。
68.在本发明的一个实施例中,步骤(1-1)中的溶剂为水,如注射用水。
69.具体地,步骤(1-1)中溶剂用量为原料组分的1-6倍(质量比,具体如,1、2、3、4、5、6倍)。
70.具体地,步骤(1-2)中搅拌时间为1-24小时(具体如,1、2、4、6、8、10、12、14、16、18、20、22、24小时)。
71.具体地,步骤(1-2)中,搅拌温度为15-85℃(具体如,15、20、25、30、35、40、45、50、55、60、65、70、75、80、85℃)。
72.具体地,上述水溶性复合物溶液粒径为1-500nm(具体如,1、10、50、100、150、200、250、300、350、400、450、500nm)。
73.具体地,步骤(2)中的干燥为冷冻干燥或减压干燥。
74.具体地,上述冷冻干燥包括:预冻、升华干燥和解析干燥步骤;其中,预冻温度为-30~-50℃(具体如-30、-35、-40、-45、-50℃),预冻时间为0.5-3h(具体如0.5、1、2、3h),预冻步骤中真空度控制为1-100pa(1、10、20、30、40、50、60、80、100pa);升华干燥温度为-20~10℃(具体如-20、-10、-5、0、5、10℃),升华干燥时间为1-36h(具体如1、6、12、18、24、30、36h);解析干燥温度为10℃-30℃(具体如10、15、20、25、30℃),解析干燥时间为1-24h(具体如1、6、12、18、24h)。
75.具体地,上述减压干燥包括:减压和干燥步骤;其中,减压步骤中真空度为0.08mpa以下(具体如0.01、0.02、0.03、0.04、0.05、0.06、0.07、0.08mpa),干燥步骤中干燥温度为10-50℃(具体如10、15、20、25、30、35、40、45、50℃),干燥时间为1-48h(具体如1、6、12、18、24、30、36、42、48h)。
76.在本发明的一个实施方式中,水溶性复合物溶液的制备方法包括:将β-环糊精(重量百分比含量为0-3%)、羟丙基-β-环糊精(重量百分比含量为1-40%)、甲基-β-环糊精(重量百分比含量为1-40%)、环氧丙烷-β-环糊精(重量百分比含量为1-40%)、泊洛沙姆(重量百分比含量为1-40%)、peg-plag(重量百分比含量为1-3%)、peg-pcl(重量百分比含量为1-2%)、peg-pla/ptx(重量百分比含量为1-2%)、peg-b-ps(重量百分比含量为1-2%)、edta-2na(重量百分比含量为0-1%)、硫代硫酸钠(重量百分比含量为0-1%)、甘露醇(重量百分比含量为0-1%)、枸橼酸(重量百分比含量为0-2%)中的一种或几种加入1-6倍水中,溶解;
77.再向混合液中加入大麻素单一组分或提取物(重量百分比含量为1-20%),45℃-85℃搅拌0-2h,搅拌后溶液为澄清透明水溶性复合物溶液,溶液粒径小于500nm。
78.在本发明的一个实施方式中,水溶性复合物溶液的制备方法包括:将β-环糊精(重量百分比含量为0-3%)、羟丙基-β-环糊精(重量百分比含量为1-40%)、甲基-β-环糊精(重量百分比含量为1-40%)、环氧丙烷-β-环糊精(重量百分比含量为1-40%)、泊洛沙姆(重量百分比含量为1-40%)、peg-plag(重量百分比含量为1-3%)、peg-pcl(重量百分比含量为
1-2%)、peg-pla/ptx(重量百分比含量为1-2%)、peg-b-ps(重量百分比含量为1-2%)、edta-2na(重量百分比含量为0-1%)、硫代硫酸钠(重量百分比含量为0-1%)、甘露醇(重量百分比含量为0-1%)、枸橼酸(重量百分比含量为0-2%)中的一种或几种加入1-6倍水中,溶解;
79.再向混合液中加入cbd(重量百分比含量为1-20%),45℃-85℃搅拌0-2h,搅拌后溶液为澄清透明水溶性复合物溶液,溶液粒径小于500nm。
80.在本发明的一个实施方式中,水溶性复合物溶液的制备方法包括:将β-环糊精(重量百分比含量为0-3%)、羟丙基-β-环糊精(重量百分比含量为1-40%)、甲基-β-环糊精(重量百分比含量为1-40%)、环氧丙烷-β-环糊精(重量百分比含量为1-40%)、泊洛沙姆(重量百分比含量为1-40%)、peg-plag(重量百分比含量为1-3%)、peg-pcl(重量百分比含量为1-2%)、peg-pla/ptx(重量百分比含量为1-2%)、peg-b-ps(重量百分比含量为1-2%)、edta-2na(重量百分比含量为0-1%)、硫代硫酸钠(重量百分比含量为0-1%)、甘露醇(重量百分比含量为0-1%)、枸橼酸(重量百分比含量为0-2%)中的一种或几种加入1-6倍水中,溶解;
81.再向混合液中加入大麻素单一组分或提取物乙醇溶液(重量百分比含量为1-20%),常温搅拌1-24h,搅拌后溶液为澄清透明水溶性复合物溶液,溶液粒径小于500nm。
82.在本发明的一个实施方式中,水溶性复合物溶液的制备方法包括:将β-环糊精(重量百分比含量为0-3%)、羟丙基-β-环糊精(重量百分比含量为1-40%)、甲基-β-环糊精(重量百分比含量为1-40%)、环氧丙烷-β-环糊精(重量百分比含量为1-40%)、泊洛沙姆(重量百分比含量为1-40%)、peg-plag(重量百分比含量为1-3%)、peg-pcl(重量百分比含量为1-2%)、peg-pla/ptx(重量百分比含量为1-2%)、peg-b-ps(重量百分比含量为1-2%)、edta-2na(重量百分比含量为0-1%)、硫代硫酸钠(重量百分比含量为0-1%)、甘露醇(重量百分比含量为0-1%)、枸橼酸(重量百分比含量为0-2%)中的一种或几种加入1-6倍水中,溶解;
83.再向混合液中加入cbd乙醇溶液(重量百分比含量为1-20%),常温搅拌1-24h,搅拌后溶液为澄清透明水溶性复合物溶液,溶液粒径小于500nm。
84.在本发明的一个实施方式中,大麻素固体颗粒的制备方法包括:将所述的水溶性复合物溶液放入冷冻干燥箱内,-40℃冷冻0.5-3h,真空度控制1-100pa,一次干燥温度-20-10℃,干燥1-36h;二次干燥温度10℃-30℃,干燥1-24h;干燥后物料过1-5号筛整粒;
85.在本发明的一个实施方式中,大麻素固体颗粒的制备方法包括:将所述的水溶性复合物溶液放入减压干燥箱内,温度20-50℃,真空度≤0.08mpa以下干燥1-48h,干燥后物料过1-5号筛整粒。
86.在本发明的一个实施方式中,大麻素吸入粉雾剂的制备方法包括:将所述的大麻素固体颗粒用球磨法粉碎,直接粉碎为10um以下,制备大麻素雾化吸入粉末;将大麻素雾化吸入粉末灌装至2号至00号胶囊、泡囊中、贮存罐中直接用粉末吸入给药。
87.在本发明的一个实施方式中,大麻素口腔崩解片的制备方法包括:将所述的大麻素雾化吸入粉末(重量百分比含量为1-90%)、低取代羟丙纤维素(重量百分比含量为1-80%)、甘露醇(重量百分比含量为0-80%)、微晶纤维素(重量百分比含量为0-80%)、预交化淀粉(重量百分比含量为0-80%)、微粉硅胶(重量百分比含量为0-10%)、硬脂酸镁(重量
百分比含量为0-10%)混匀后直接压片,片重0.5g崩解片。
88.在本发明的一个实施方式中,大麻素口腔崩解片的制备方法包括:将所述的大麻素雾化吸入粉末(重量百分比含量为1-90%)、低取代羟丙纤维素(重量百分比含量为1-80%)、甘露醇(重量百分比含量为0-80%)、微晶纤维素(重量百分比含量为0-80%)、预交化淀粉(重量百分比含量为0-80%)、微粉硅胶(重量百分比含量为0-10%)、硬脂酸镁(重量百分比含量为0-10%用湿法或一步制粒制成颗粒,压制成片重0.5g崩解片。
89.在本发明的一个实施方式中,大麻素泡腾片的制备方法包括:将dl酒石酸(重量百分比含量为0-20%)、枸橼酸(重量百分比含量为0-35%)、甘露醇(重量百分比含量为0-3%)、乳糖(重量百分比含量为0-1%)、氯化钠(重量百分比含量为0-2%)、蔗糖(重量百分比含量为0-1%)、聚乙二醇(重量百分比含量为0-15%)用流化床或湿法制粒制成颗粒1;将碳酸氢钠(重量百分比含量为0-1%)、阿斯帕坦(重量百分比含量为0-1%)、乳糖(重量百分比含量为0-1%)、木糖醇(重量百分比含量为0-3%)、香精(重量百分比含量为0-3%)、羧甲基纤维素钠(重量百分比含量为0-1%)、聚乙二醇(重量百分比含量为0-15%)流化床或湿法制粒制成颗粒2,将颗粒1、颗粒2、所述的大麻素固体颗粒(重量百分比含量为1-15%)、亮氨酸(重量百分比含量为0-1%)、香精(重量百分比含量为0-2%)、胡萝卜素(重量百分比含量为0-2%)、维生素c(重量百分比含量为0-10%)混匀后压制成泡腾片,片重控制0.1-10g。
90.在本发明的一个实施方式中,大麻素泡腾片的制备方法包括:将dl酒石酸(重量百分比含量为0-20%)、枸橼酸(重量百分比含量为0-35%)、甘露醇(重量百分比含量为0-3%)、乳糖(重量百分比含量为0-1%)、氯化钠(重量百分比含量为0-2%)、蔗糖(重量百分比含量为0-1%)、碳酸氢钠(重量百分比含量为0-1%)、阿斯帕坦(重量百分比含量为0-1%)、木糖醇(重量百分比含量为0-3%)、香精(重量百分比含量为0-3%)、聚乙二醇(重量百分比含量为0-15%)、所述的大麻素固体颗粒(重量百分比含量为1-15%)、亮氨酸(重量百分比含量为0-1%)、胡萝卜素(重量百分比含量为0-2%)、维生素c(重量百分比含量为0-10%)混匀后压制成泡腾片,片重控制0.1-10g。
91.在本发明的一个实施方式中,大麻素肠溶胶囊的制备方法包括:取空白丸芯,置包衣锅内,将所述的大麻素固体颗粒(重量百分比含量为1-20%)、羟丙基甲纤维素(重量百分比含量为1-25%)、交联聚乙烯吡咯烷酮(重量百分比含量为1-25%)溶解,溶液喷洒置空白丸芯,35℃-55℃干燥0-12h;取羟丙甲纤维素(重量百分比含量为0-25%)、甘露醇(重量百分比含量为0-12%),加水搅匀,溶液喷洒置含药丸芯,35℃-55℃干燥0-12h;取羟丙甲纤维素(重量百分比含量为0-25%)、二乙酰甘油单酯(重量百分比含量为0-5%)、滑石粉(重量百分比含量为0-1%),加水搅匀,溶液喷洒置含药丸芯,35℃-55℃干燥0-12h;取丙烯酸树脂(重量百分比含量为0-15%),加水搅匀,溶液喷洒置含药丸芯,35℃-55℃干燥0-12h;加滑石粉(重量百分比含量为0-1%),灌装胶囊。
92.本发明还提供一种预防和/或治疗疾病的方法,其包括向由此需要的受试者给与有效量的本发明上述水溶性大麻素制剂的步骤。
93.具体地,上述方法中,水溶性大麻素制剂具有本发明上述定义。
94.具体地,上述方法中,所述疾病为上述水溶性大麻素制剂中相应大麻素的适应症,如疼痛(如慢性疼痛)、炎症(如皮炎)、肿瘤(如神经胶质瘤、白血病、前列腺癌等)、肝损伤(如缺血型肝损伤、慢性酒精中毒引起的肝损伤)、神经系统疾病(如癫痫、多发性硬化症、帕
金森氏病、阿尔茨海默症等)等(参见例如,“郭蓉,陈璇,郭鸿彦.四氢大麻酚和大麻二酚的药理研究进展.天然产物研究与开发,2017,29:449-1453.”)。
95.具体地,上述受试者为哺乳动物,特别是人。
96.具体地,上述水溶性大麻素制剂的有效量取决于诸多因素,包括患者的年龄、体重、性别、自然健康状况、营养状况、服用时间、代谢速率、病症的严重程度以及诊治医师的主观判断,等。
97.本发明还提供一种保健品,其包含本发明上述水溶性大麻素制剂。
98.本发明还提供一种提高免疫力、抗氧化的方法,其包括向由此需要的受试者给与有效量的上述保健品的步骤。
99.本发明所提供的水溶性大麻素制剂,有效成分包裹率和转移率高,载药量高,稳定性强,采用新的常温自组装技术,避免活性成分大麻素在高温下降解变色;活性成分的生物利用度高,可降低单次服用量。特别是吸入粉雾剂,载药量高(10%以上),稳定性强(保质期:2-3年),体外沉积率高(排空率可达95%,有效沉积率可达45%),吸入起效快,可提供持续稳定的血药浓度。
具体实施方式
100.除非另有定义,本发明中所使用的所有科学和技术术语具有与本发明涉及技术领域的技术人员通常理解的相同的含义,如在本发明中出现的以下缩写及其对应的物质为:
101.cbdv
ꢀꢀ
次大麻二酚
102.cbd
ꢀꢀ
大麻二酚
103.cbg
ꢀꢀ
大麻萜酚
104.cbn
ꢀꢀ
大麻酚
105.cbc
ꢀꢀ
大麻色原烯
106.cbdb
ꢀꢀ
4-butyl-5
′‑
methyl-2
′‑
(prop-1-en-2-yl)-1
′
,2
′
,3
′
,4
′‑
tetrahydro-(1,1
′‑
biphenyl)-2,6-diol,cannabidibutol
107.cbe
ꢀꢀ
大麻艾尔松(cannabielsoin)
108.cbl
ꢀꢀ
大麻环酚
109.cbnd
ꢀꢀ
脱氢大麻二酚
110.tpgs
ꢀꢀ
维生素e琥珀酸聚乙二醇酯
111.poloxamer
ꢀꢀ
泊洛沙姆
112.peg-paa
ꢀꢀ
聚乙二醇-聚丙烯酸嵌段共聚物
113.peg-pasp
ꢀꢀ
聚乙二醇-聚天冬氨酸嵌段共聚物
114.peg-plag
ꢀꢀ
聚乙二醇-聚乳酸羟基乙酸嵌段共聚物
115.peg-pcl
ꢀꢀ
聚乙二醇-聚己内酯嵌段共聚物
116.peg-pla/ptx
ꢀꢀ
聚乙二醇-聚乳酸嵌段共聚物
117.peg-b-ps
ꢀꢀ
聚乙二醇-聚苯乙烯嵌段共聚物
118.sfd
ꢀꢀ
喷雾冷冻干燥
119.cd
ꢀꢀ
环糊精
120.β-cd
ꢀꢀ
β-环糊精
121.hp-β-cd 羟丙基-β-环糊精
122.methyl-β-cd
ꢀꢀ
甲基-β-环糊精
123.propylene oxide-β-cd
ꢀꢀ
环氧丙烷-β-环糊精
124.edta-2na
ꢀꢀ
乙二胺四乙酸二钠
125.在本发明中,术语“大麻素”指大麻植物中特有的含有烷基和单萜基团分子结构的一类次生代谢产物,例如,cbd、cbdv、cbg、cbc、cbn、cbdb、cbe、cbl、cbnd等(如“陈璇,杨明,郭鸿彦.大麻植物中大麻素成分研究进展,植物学报,2011,46(2):197-205”所描述)。
126.在本发明中,cbd、cbdv、cbg、cbc、cbn、cbdb、cbe、cbl以及cbnd的纯品是指上述化合物的纯净物产品,特别是相应的市售产品,其中化合物纯度至少为99.5%以上,特别是99.9%以上(其余为杂质)。
127.在本发明中,所述的大麻为工业大麻,所述的工业大麻是指四氢大麻酚含量低于0.3%的大麻。本发明中对工业大麻的获取、加工和研究均获得法律许可。
128.下面将结合本发明实施例,对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
129.实施例1:水溶性复合物溶液制备
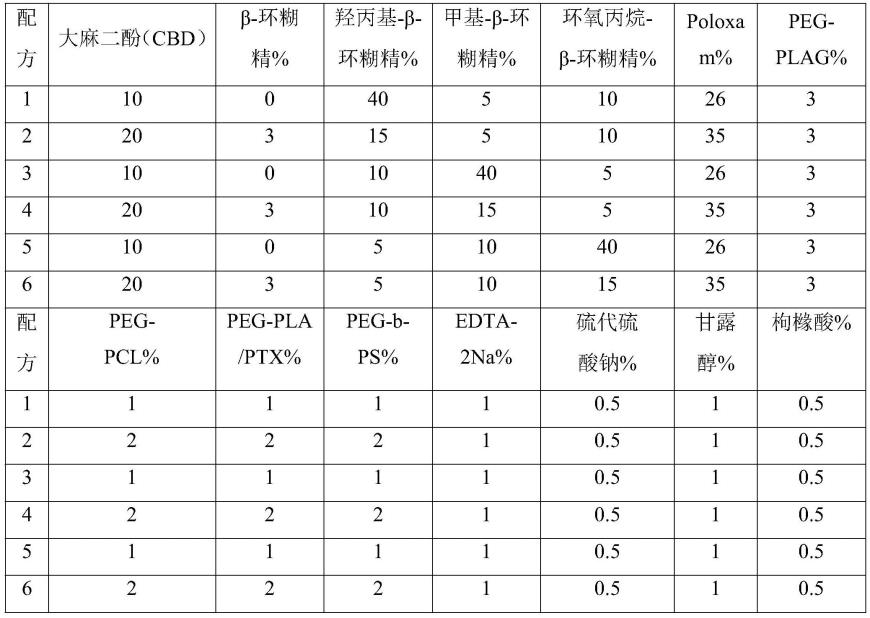
130.1、水溶性复合物溶液的具体配方见表1:
131.表1水溶性复合物溶液配方表
[0132][0133]
2、制备工艺
[0134]
(1)第一组制备工艺(工艺1)
[0135]
按配方1-6的配比投料进行水溶性复合物溶液制备,具体如下:
[0136]
a、溶解:β-环糊精、羟丙基-β-环糊精、甲基-β-环糊精、环氧丙烷-β-环糊精、泊洛沙姆、peg-plag、peg-pcl、peg-pla/ptx、peg-b-ps、edta-2na、硫代硫酸钠、甘露醇、枸橼酸中的一种或几种加入3倍水中,溶解;
[0137]
b、混合溶解:加入大麻二酚(cbd),85℃搅拌2h,搅拌后溶液为澄清透明水溶性复合物溶液,溶液粒径小于500nm。
[0138]
上述制备工艺所得水溶性复合物溶液质量对比见表2:
[0139]
表2水溶性复合物溶液质量对比
[0140][0141]
(注:有效成分包合率是指cbd在纯化水中检测量与甲醇中检测量百分比;有效成分转移率是指cbd的实际检测量与加入量百分比。)
[0142]
(2)第二组制备工艺(工艺2)
[0143]
按配方1-6的配比投料进行水溶性复合物溶液制备,具体如下:
[0144]
a、溶解:β-环糊精、羟丙基-β-环糊精、甲基-β-环糊精、环氧丙烷-β-环糊精、泊洛沙姆、peg-plag、peg-pcl、peg-pla/ptx、peg-b-ps、edta-2na、硫代硫酸钠、甘露醇、枸橼酸中的一种或几种加入3倍水中,溶解;
[0145]
b、混合溶解:加入大麻二酚(cbd)乙醇溶液,常温搅拌24h,搅拌后溶液为澄清透明水溶性复合物溶液,溶液粒径小于500nm。
[0146]
上述制备工艺所得水溶性复合物溶液质量对比见表3:
[0147]
表3水溶性复合物溶液质量对比
[0148][0149]
由表2和表3结果可知,相同配方下第一组工艺比第二组工艺制备有效成分包合率及转移率基本一致,但加热条件下可以缩短包合时间。
[0150]
实施例2:大麻素固体颗粒制备
[0151]
将实施例1所得水溶性复合物溶液干燥得到水溶性大麻素固体颗粒,所述的干燥为冷冻干燥或减压干燥。
[0152]
1、冷冻干燥工艺:将实施例1中的水溶性复合物溶液放入冷冻干燥箱内,-40℃冷冻3h,真空度100pa,一次干燥温度10℃,干燥36h;二次干燥温度30℃,干燥24h;干燥后物料过5号筛整粒;
[0153]
2、减压干燥工艺:将实施例1中的水溶性复合物溶液放入减压干燥箱内,温度50℃,真空度0.04mpa,干燥48h,干燥后物料过5号筛整粒。
[0154]
冷冻干燥工艺与减压干燥工艺对比见表4:
[0155]
表4冷冻干燥工艺与减压干燥工艺对比
[0156]
干燥工艺性状工艺可控度溶解性冷冻干燥类白色颗粒简单可控溶液澄清减压干燥类白色颗粒简单可控溶液澄清
[0157]
由表4结果可知,减压干燥工艺与冷冻干燥工艺制备颗粒性状、溶解度一致,减压干燥成本低。
[0158]
实施例3:大麻素吸入粉雾剂制备
[0159]
1、微粉化:
[0160]
将实施例2中用减压干燥法制备的水溶性大麻素固体颗粒经球磨法粉碎,直接粉碎为10um以下,制备雾化吸入粉末;
[0161]
2、灌装:
[0162]
将雾化吸入粉末灌装至2号至00号胶囊、泡囊中、贮存罐中直接用粉末吸入给药。
[0163]
大麻素吸入粉雾剂质量研究见表5:
[0164]
表5大麻素吸入粉雾剂质量研究
[0165][0166]
大麻素固体颗粒直接微粉化制备吸入粉末,工艺简单可控,成本低。制备的大麻素吸入粉末可用于癫痫、抑郁、慢性疼痛等疾病,起效快,无肝脏首过效应,无胃肠道刺激或降解作用。
[0167]
实施例4:大麻素泡腾片制备
[0168]
1、配方:大麻素固体颗粒(实施例2制备得到),dl酒石酸、枸橼酸、碳酸氢钠、甘露醇、乳糖、阿斯帕坦、木糖醇、聚乙二醇、亮氨酸、香精、氯化钠、蔗糖。
[0169]
表6大麻素泡腾片配方表
[0170][0171]
规格:片重1g
[0172]
2、制备工艺
[0173]
(1)第一组制备工艺(工艺1)
[0174]
根据表6配方,将dl酒石酸、枸橼酸、甘露醇、乳糖、氯化钠、蔗糖、聚乙二醇用流化床或湿法制粒制成颗粒1。将碳酸氢钠、阿斯帕坦、乳糖、木糖醇、香精、羧甲基纤维素钠、聚乙二醇流化床或湿法制粒制成颗粒2,将颗粒1、颗粒2、大麻素固体颗粒、亮氨酸、香精、胡萝卜素、维生素c混匀后压制成泡腾片,片重控制1g。
[0175]
(2)第二组制备工艺(工艺2)
[0176]
根据表6配方,将大麻素固体颗粒、dl酒石酸、枸橼酸、甘露醇、乳糖、氯化钠、蔗糖、碳酸氢钠、阿斯帕坦、乳糖、木糖醇、香精、聚乙二醇、亮氨酸、香精、胡萝卜素、维生素c直接混匀,压制成泡腾片,片重控制1g。
[0177]
不同配方泡腾片质量对比研究见表7:
[0178]
表7不同配方泡腾片质量对比研究
[0179]
配方崩解时间min分散均匀性泡腾后溶液状态含量稳定性13合格澄清透明片剂加速6个月含量稳定23合格澄清透明片剂加速6个月含量稳定35合格澄清透明片剂加速6个月含量稳定
[0180]
由表7结果可知,几种载药配方泡腾片均符合泡腾片质量标准要求,溶水迅速,使用、携带方便,可增加大麻素固体颗粒的溶解速度,泡腾后的大麻素溶液可直接服用,生物利用度高,能提高临床疗效。
[0181]
大麻素泡腾片优势,泡腾片溶水迅速,使用、携带方便,可增加大麻素固体粉末的溶解速度。
[0182]
实施例5:大麻素肠溶胶囊制备
[0183]
1、配方:
[0184]
大麻素固体颗粒(实施例2制备得到)、甘露醇、羟丙甲纤维素、交联聚乙烯吡咯烷酮、丙烯酸树脂、二乙酰甘油单酯、滑石粉。具体配方见表8:
[0185]
表8大麻素肠溶胶囊配方表
[0186][0187]
2、工艺:(根据表8配方)
[0188]
a、负载主药:取空白丸芯,置包衣锅内,将大麻素固体颗粒、羟丙基甲纤维素溶解,溶液喷洒置空白丸芯,55℃干燥12h;
[0189]
b、保护性包衣:取羟丙甲纤维素、甘露醇,加水搅匀,溶液喷洒置含药丸芯,55℃干燥12h;
[0190]
c、内聚包衣:取羟丙甲纤维素、二乙酰甘油单酯、滑石粉,加水搅匀,溶液喷洒置含药丸芯,55℃干燥12h;
[0191]
d、肠溶包衣:取丙烯酸树脂,加水搅匀,溶液喷洒置含药丸芯,55℃干燥12h;
[0192]
e、灌装:加滑石粉,灌装胶囊。
[0193]
不同大麻素肠溶胶囊,质量对比研究见表9:
[0194]
表9大麻素肠溶胶囊质量对比
[0195]
配方装量差异体外溶出度稳定性1
±
3.0%线性释放,累计释放度93%加速6个月稳定2
±
2.5%线性释放,累计释放度92%加速6个月稳定3
±
2.6%线性释放,累计释放度92%加速6个月稳定
[0196]
由表9结果可知,大麻素缓释胶囊,配方对比装量差异、溶出度、稳定性均符合要求。大麻素在肠道内缓慢释放,进入血液后,胶束及环糊精包合的大麻素水溶性复合物可以缓慢释放大麻素,使大麻素在体内持久维持平稳的血药浓度,对慢性疼痛持久起效。
[0197]
大麻素肠溶胶囊,可以定位释放,保护胃黏膜,同时大麻素在肠道内缓慢释放,进入血液后,胶束及环糊精复合物的大麻素可以缓慢释放大麻素,使大麻素在体内持久维持平稳的血药浓度,对慢性疼痛持久起效。
[0198]
实施例6:大麻素口腔崩解片制备
[0199]
1、配方:
[0200]
大麻素吸入粉末(实施例3制备)(1-90%)、低取代羟丙纤维素(1-80%)、甘露醇(0-80%)、微晶纤维素(0-80%)、预交化淀粉(0-80%)、微粉硅胶(0-10%)、硬脂酸镁(0-10%)
[0201]
具体配方见表10:
[0202]
表10大麻素口腔崩解片配方表
[0203][0204]
2、制备工艺:(根据表10的配方)
[0205]
(1)第一组制备工艺(工艺1)
[0206]
将大麻素吸入粉末(实施例3制备)、低取代羟丙纤维素、甘露醇、微晶纤维素、预交化淀粉、微粉硅胶、硬脂酸镁按配方比例混匀后直接压片,片重0.5g崩解片。
[0207]
(2)第二组制备工艺(工艺2)
[0208]
将大麻素吸入粉末(实施例3制备)、低取代羟丙纤维素、甘露醇、微晶纤维素、预交化淀粉、微粉硅胶、硬脂酸镁用湿法或一步制粒制成颗粒,压制成片重0.5g崩解片。
[0209]
不同配方速释片,质量对比研究见表11
[0210]
表11大麻素口腔崩解片质量对比
[0211]
配方性状崩解时限s片重差异稳定性1白色至棕色片45
±
2.3%加速6个月稳定2白色至棕色片45
±
2.5%加速6个月稳定
[0212]
由表11结果可知,配方中口崩片性状、片重差异、崩解时限、片重差异、稳定性均符合要求。口腔崩解片可在唾液中快速溶解,或在口腔内快速崩解,对肿瘤患者、儿童、老年、卧床不起和严重伤残病人最适宜。
[0213]
大麻素口腔崩解片可在唾液中快速溶解,或在口腔内快速崩解,对肿瘤患者、儿童、老年、卧床不起和严重伤残病人最适宜。
[0214]
实施例7:实验结果
[0215]
实施例所提供的水溶性大麻素制剂,有效成分包裹率和转移率高,载药量高,稳定性强,采用新的常温自组装技术,避免活性成分大麻素在高温下降解变色;活性成分的生物利用度高,可降低单次服用量。特别是吸入粉雾剂,载药量高(10%以上),稳定性强(保质期:2-3年),体外沉积率高(排空率可达95%,有效沉积率可达45%),吸入起效快,可提供持续稳定的血药浓度。
[0216]
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。