1.本发明涉及一种中药技术领域,具体涉及具有抗肿瘤活性的苦参提取物及其质量检测方法与应用。
背景技术:
2.液质联用技术以液相色谱作为分离系统,质谱作为检测系统,利用色谱分离技术将混合样品分离成单一物质,进入质谱系统后,这些物质被离子化,经质谱质量分析器将不同质量数的离子碎片分开,通过质谱检测器分析其物质结构,利用判断化学键的断裂方式,通过对照图库中的质荷比,判断离子碎片的结构,从而对未知样品进行定性量。液质联用技术将高效液相对复杂样品的高分离能力与质谱的高选择性、高灵敏度及能够提供相对分子质量和结构信息的优点相结合。中药化学成分复杂多样,如何高效分离识别中药化学成分是中药药效物质基础研究中的一个关键性难题,液质联用技术的使用使得这个难题迎刃而解。通过简单的前处理后,将少量的药品上机检测,简单高效、易于操作地对中药成分进行快速准确的分析,因此,液质联用技术是中药药效物质基础研究中不可或缺的一种实验方法。
3.苦参为豆科植物苦参(sophora flavescens ait.)的干燥根。其主要含有苦参碱、氧化苦参碱、槐定碱、甲基金雀花碱、槐果碱、粉防己碱等生物碱成分与苦参素等黄酮类成分,具有抗炎解热、抗菌止痒、抗肿瘤、抗心律失常和心肌缺血等作用。
4.本发明在苦参现有活性的基础上,开发具有抗结肠癌活性的苦参提取物和其质量检测方法。
技术实现要素:
5.发明目的:本发明的目的是解决现有技术的不足,经过大量实验筛选,开发具有抗结肠癌活性的苦参提取物和其质量检测方法。
6.技术方案:为了实现以上目的,本发明采取的技术方案为:
7.一种具有抗肿瘤活性的苦参提取物,其特征在于,它是通过以下方法制备得到的:取苦参药材,先加适量水浸泡,再加水提取,合并提取液,浓缩,既得。
8.作为优选方案,以上所述的具有抗肿瘤活性的苦参提取物,它是通过以下方法制备得到的:取苦参药材,加适量水浸泡0.5~1小时,再加5~20倍量水提取1~2次,每次0.5~1.5小时,合并提取液,浓缩,既得。
9.一种具有抗肿瘤活性的苦参提取物的质量检测方法,包括以下步骤:
10.步骤(1)生物碱对照品溶液的制备
11.精密称取槐果碱、苦参碱、槐定碱、氧化槐果碱、氧化苦参碱,加甲醇制成生物碱混合标准储备溶液,4℃保存;
12.步骤(2)黄酮对照品溶液的制备
13.精密称取三叶豆紫檀苷、苦参酮、苦参醇i、高丽槐素,加甲醇制成黄酮混合标准储
备溶液,4℃保存;
14.步骤(3)供试品溶液的制备
15.取苦参药材,加适量水浸泡0.5~1小时,再加5~20倍量水提取1~2次,每次0.5~1.5小时,合并提取液,浓缩,进样之前过微孔滤膜;
16.步骤(4)线性回归方程的建立
17.取步骤(1)生物碱混合标准储备溶液和步骤(2)黄酮混合标准储备溶液,依次稀释5倍,通过0.22μm纤维素膜过滤,得到系列浓度的混合对照品溶液,依次注入uplc-tq-ms,以系列对照品浓度作为横坐标x,对应的峰面积为纵坐标y,对各化学成分进行线性回归分析并计算线性回归方程;
18.步骤(5)含量测定
19.取步骤(2)的苦参供试品溶液,注入uplc-tq-ms进行生物碱的分析,将峰面积代入步骤(3)的线性回归方程,计算供试品溶液中各生物碱成分的含量;
20.取步骤(2)的苦参供试品溶液,注入hplc进行黄酮成分的分析,将峰面积代入步骤(3)的线性回归方程,计算供试品溶液中各黄酮成分的含量。
21.作为优选方案,所述的具有抗肿瘤活性的苦参提取物的质量检测方法,步骤(1)生物碱对照品溶液的制备方法为:
22.精密称取称取槐果碱、苦参碱、槐定碱、氧化槐果碱、氧化苦参碱,加甲醇制成浓度分别为300、600、600、600、600μg/ml的混合标准储备溶液,4℃保存,进样前,过0.22μm微孔滤膜。
23.作为优选方案,所述的具有抗肿瘤活性的苦参提取物的质量检测方法,步骤(2)黄酮对照品溶液的制备
24.精密称取三叶豆紫檀苷、苦参酮、苦参醇i、高丽槐素,加甲醇制成浓度分别为7.1、72.0、33.2、16.8μg/ml的黄酮混合标准储备溶液,4℃保存。
25.作为优选方案,所述的具有抗肿瘤活性的苦参提取物的质量检测方法,步骤(3)和步骤(4)中测定生物碱的uplc-tq-ms的色谱条件为:
26.色谱条件:waters acquity hss t3色谱柱,规格1.8μm,2.1mm,100mm;0.1%甲酸水溶液为a相,乙腈为b相,梯度洗脱:0~1min,15%b、1~5min,15%b
→
50%b,5~7min,50%b、7~10min,50%b
→
15%b、10~13min,15%b;流速:0.3ml/min;柱温:35℃;进样量:2μl;
27.质谱条件:电喷雾离子化,多反应监测离子扫描模测定,主要质谱参数为:毛细管电压5500v,脱溶剂温度550℃;采用正、负离子检测模式,选择的检测离子质荷比分别为:槐果碱m/z 247.2/996.1:苦参碱m/z 249.2/148.3,槐定碱m/z 249.3/152.1,氧化槐果碱m/z 263.3/245.1,氧化苦参碱m/z 265.3/205.2;
28.待测物去簇电压/v碰撞电压/v槐果碱4040苦参碱5040槐定碱5040氧化槐果碱4020氧化苦参碱7640
29.;
30.步骤(3)和步骤(4)中测定黄酮的色谱条件为:waters2695高效液相色谱仪、waters2998dad检测器、色谱柱:purospherstar lp rp-c18 endcapped,规格250mm
×
4.6mm,5μm;流动相乙腈为a相,0.1%甲酸水溶液为b相,梯度洗脱:0-15min,5%-10%a;15-35min,10%-20%a;35-50min,20%-40%a;50-70min,40%-60%a;70-75min,60%-5%a;流速1.0ml/min;检测波长280nm;进样量10μl;柱温30℃。
31.作为优选方案,所述的具有抗肿瘤活性的苦参提取物的质量检测方法,其特征在于,步骤(3)中生物碱对照品的线性回归方程如下表:
32.。
33.作为优选方案,所述的具有抗肿瘤活性的苦参提取物的质量检测方法,步骤(3)中黄酮对照品的线性回归方程如下表:
34.三叶豆紫檀苷回归方程:y=9639.6x-23860;苦参酮回归方程:y=40986x-94757;
35.苦参醇i回归方程:y=18945x-38705;高丽槐回归方程:y=16304x-35955。
36.本发明所述的具有抗肿瘤活性的苦参提取物在制备抗肿瘤的药物中的应用,更优选为在制备抗结肠癌的药物中的应用。
37.有益效果:本发明提供的苦参提取物和现有技术相比具有以下优点:
38.本发明根据苦参中生物碱成分的结构及其性质特点,通过大量实验筛选出最佳的流动相组成,洗脱程序、流速,色谱柱、质谱条件等分析条件。经多次实验验证表明,本发明能够同时检测5种不同结构生物碱化合物和4种不同的黄酮化合物,该方法检测灵敏度高,稳定性好,可以客观、全面、准确的评价苦参药材及其提取物与制剂的质量,对控制质量和保证临床疗效具有重要意义。
39.并且本发明通过实验筛选发现苦参提取物对结肠癌具有很好的治疗作用。
附图说明
40.图1为5生物碱化合物的质谱图。
41.图2为苦参提取物抑制sw620细胞增殖,诱导自噬结果图。
42.图3为苦参提取物通过激活自噬通量抑制sw620细胞增殖结果图。
43.图4为苦参提取物通过诱导sw620细胞自噬抑制细胞生长结果图。
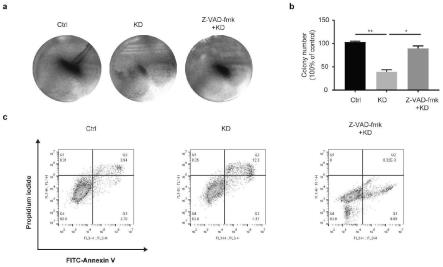
44.图5为苦参提取物诱导sw620细胞caspase-8依赖性凋亡结果图。
45.图6为苦参提取物通过激活自噬诱导sw620细胞结果图。
具体实施方式
46.下面结合具体实施例进一步阐明本发明,应理解这些实施例仅用于说明本发明而不用于限制本发明的范围,在阅读了本发明之后,本领域技术人员对本发明的各种等价形式的修改均落于本技术所附权利要求所限定的范围。
47.一种具有抗肿瘤活性的苦参提取物的质量检测方法,包括以下步骤:
48.步骤(1)对照品溶液的制备
49.精密称取称取槐果碱、苦参碱、槐定碱、氧化槐果碱、氧化苦参碱,加甲醇制成浓度分别为300、600、600、600、600μg/ml的混合标准储备溶液,4℃保存,进样前,过0.22μm微孔滤膜。
50.步骤(2)黄酮对照品溶液的制备
51.精密称取三叶豆紫檀苷、苦参酮、苦参醇i、高丽槐素,加甲醇制成浓度分别为7.1、72.0、33.2、16.8μg/ml的黄酮混合标准储备溶液,4℃保存。
52.步骤(3)供试品溶液的制备
53.取5批次的苦参药材,分别加适量水浸泡0.5小时,再加10倍量水煎煮提取2次,每次1小时,合并提取液,浓缩,进样之前过微孔滤膜;
54.步骤(4)线性回归方程的建立
55.取步骤(1)的混合标准储备溶液,依次稀释5倍,通过0.22μm纤维素膜过滤,得到系列浓度的混合对照品溶液,依次注入uplc-tq-ms,以系列对照品浓度作为横坐标x,对应的峰面积为纵坐标y,对各化学成分进行线性回归分析并计算线性回归方程如下表1:
56.表1标准曲线方法与各化合物的含量
[0057][0058]
。
[0059]
步骤(4)含量测定
[0060]
取步骤(2)的苦参供试品溶液,注入uplc-tq-ms进行生物碱的分析,将峰面积代入
步骤(3)的线性回归方程,计算供试品溶液中各生物碱成分的含量,如表1。
[0061]
取步骤(2)的苦参供试品溶液,注入hplc进行黄酮成分的分析,将峰面积代入步骤(3)的线性回归方程,计算供试品溶液中各黄酮成分的含量。
[0062]
其中步骤(3)和步骤(4)中的uplc-tq-ms的色谱条件为:
[0063]
色谱条件:waters acquity hss t3色谱柱,规格1.8μm,2.1mm,100mm;0.1%甲酸水溶液为a相,乙腈为b相,梯度洗脱:0~1min,15%b、1~5min,15%b
→
50%b,5~7min,50%b、7~10min,50%b
→
15%b、10~13min,15%b;流速:0.3ml/min;柱温:35℃;进样量:2μl;
[0064]
质谱条件:电喷雾离子化,多反应监测离子扫描模测定,主要质谱参数为:毛细管电压5500v,脱溶剂温度550℃;采用正、负离子检测模式,选择的检测离子质荷比分别为:槐果碱m/z 247.2/996.1:苦参碱m/z 249.2/148.3,槐定碱m/z 249.3/152.1,氧化槐果碱m/z 263.3/245.1,氧化苦参碱m/z 265.3/205.2;
[0065]
待测物去簇电压/v碰撞电压/v槐果碱4040苦参碱5040槐定碱5040氧化槐果碱4020氧化苦参碱7640
[0066]
;
[0067]
步骤(3)和步骤(4)中测定黄酮的色谱条件为:waters2695高效液相色谱仪、waters2998dad检测器、色谱柱:purospherstar lp rp-c18 endcapped,规格250mm
×
4.6mm,5μm;流动相乙腈为a相,0.1%甲酸水溶液为b相,梯度洗脱:0-15min,5%-10%a;15-35min,10%-20%a;35-50min,20%-40%a;50-70min,40%-60%a;70-75min,60%-5%a;流速1.0ml/min;检测波长280nm;进样量10μl;柱温30℃。
[0068]
步骤(3)中黄酮对照品的线性回归方程如下表:
[0069]
三叶豆紫檀苷回归方程:y=9639.6x-23860;苦参酮回归方程:y=40986x-94757;
[0070]
苦参醇i回归方程:y=18945x-38705;高丽槐回归方程:y=16304x-35955。
[0071]
供试品中黄酮三叶豆紫檀苷含量为0.703mg/g、苦参酮7.046mg/g、苦参醇i3.246 mg/g、高丽槐素1.640mg/g。
[0072]
实施例2苦参提取物体外抗结直肠癌药效实验
[0073]
一、受试药物
[0074]
将苦参药材浸泡0.5小时,加10倍量水提取2次,每次1小时,合并滤液,浓缩至生药量浓度约为1g/ml。
[0075]
二、实验方法
[0076]
1、细胞增殖检测(细胞克隆)
[0077]
取对数生长期的sw620细胞,用0.25%胰蛋白酶消化并吹打成单个细胞,把细胞悬浮在10%胎牛血清的rpmi1640培养液中备用。将细胞悬液作梯度倍数稀释,以适当的细胞密度(根据增殖能力)接种于培养皿中。每皿50、100、200个细胞的梯度密度分别接种含10ml 37℃预温培养液的皿中,并轻轻转动,使细胞分散均匀。置37℃5%co2环境下,静置培养1周
左右。经常观察,当培养皿中出现肉眼可见的克隆时,终止培养。弃去上清液,用pbs小心浸洗2次。加多聚甲醛覆盖细胞,固定15分钟。然后去固定液,加适量giemsa染色液(或结晶紫染色液)染10分钟,然后用流水缓慢洗去染色液,空气干燥。将平皿在显微镜(低倍镜)计数大于10个细胞的克隆数,并拍照。最后计算克隆形成率。克隆形成率=接种细胞数/菌落形成
×
100%。预实验后,按照实验分组处理细胞,并重新进行细胞克隆实验。
[0078]
2、自噬流检测方法
[0079]
细胞培养后,消化细胞,悬浮细胞,悬浮细胞计数,用单培稀释细胞,将细胞的密度调到5
×
105个/ml,将该浓度的细胞接种于放置在6孔板中的灭菌后的盖玻片上,每孔1ml,每组设置3个复孔,不同指标的实验分组不同,孵育6小时细胞贴壁后,pbs缓冲液清洗三遍,参考说明书加入20doi的mcherry-gfp-lc3b腺病毒,腺病毒以单培稀释。孵育12小时后,丢弃上清液,各孔中加入含有对应药物的单培养基2ml,对照组加入单培养基2ml,按不同需求培养不同时间(转染后72小时内荧光表达不会衰弱),pbs缓冲液清洗三遍,之后加入4%多聚甲醛,室温固定30分钟。在载玻片上滴加抗荧光猝灭封片液,盖玻片封片后,避光保存。荧光显微镜拍照。
[0080]
3、细胞凋亡检测(tunel)
[0081]
a.取洁净盖玻片在70%乙醇中浸泡5分钟或更长时间,无菌超净台内吹干或用无菌的pbs或0.9%nacl等溶液洗涤三遍,再用细胞培养液洗涤一遍。将盖玻片置于六孔板内,种入细胞培养过夜,使约为50%-80%满。b.刺激细胞发生凋亡后,吸尽培养液,加入0.5ml固定液,固定10分钟或更长时间(可4℃过夜)。c.去固定液,用pbs或0.9%nacl洗两遍,每次3分钟,吸尽液体。洗涤时用摇床,或手动晃动。d.滴加tunel染色工作液室温孵育一小时。e.去工作液,用pbs或0.9%nacl洗两遍,每次3分钟,吸尽液体。洗涤时用摇床,或手动晃动。f.滴一滴抗荧光淬灭封片液于载玻片上,盖上贴有细胞的盖玻片,让细胞接触封片液,尽量避免气泡。g.荧光显微镜可检测到呈蓝色的细胞核及绿色的tunel阳性表达点。
[0082]
4、细胞凋亡检测方案(流式细胞术)
[0083]
用适当的方法建立检测模型,同时设立阴性对照组,并收集细胞.
[0084]
a.在进行完细胞凋亡刺激后,1000g离心5分钟,弃上清,收集细胞,用pbs轻轻重悬细胞并计数。注意:pbs重悬不能省略,pbs重悬的过程同时也起到了洗涤细胞的作用,可以保证后续annexin v-fitc的结合。b.取5-10万重悬的细胞,1000g离心5分钟,弃上清,加入195μl annexin v-fitc结合液轻轻重悬细胞。c.加入5μlannexin v-fitc,轻轻混匀。d.加入10μl碘化丙啶染色液,轻轻混匀。e.室温(20-25℃)避光孵育10-20分钟,随后置于冰浴中。可以使用铝箔进行避光。孵育过程中可以重悬细胞2-3次以改善染色效果。f.如果用于流式细胞仪检测,可立即上机检测,annexin v-fitc为绿色荧光,碘化丙啶(pi)为红色荧光,流式检测细胞凋亡的效果。
[0085]
5、自噬小体检测(透射电镜)
[0086]
sw620细胞经含kd的血清处理6h后收集,以含10%胎牛血清的培养液作为对照组。用戊二醛固定细胞,离心后用锇酸重新固定。将细胞悬浮并吸干,然后将细胞滴在带膜的铜网上,加入染色液并干燥。用透射电子显微镜拍摄图像。
[0087]
6、westerm blot检测方法
[0088]
细胞培养后,消化细胞,悬浮细胞,悬浮细胞计数,用单培稀释细胞,将细胞的密度
调到2.5
×
105个/ml,将该浓度的细胞接种于6孔板中,每孔2ml,每组设置3个复孔,共5组,24小时细胞孵育贴壁后,弃去原培养液,各组加入含有对应药物的单培养基2ml,对照组加入单培养基2ml,按需求刺激不同时间后,胰蛋白酶消化收集细胞,收集各组细胞至新的ep管内。对于移植瘤小鼠组织样本,按照组织重量50mg:1ml裂解液的比例,加入裂解液。
[0089]
三.实验结果
[0090]
1、苦参提取物抑制sw620细胞增殖,诱导自噬,如图2所示,苦参提取物能够抑制sw620细胞增殖,且随浓度、作用时间增加抑制率增加(a,b),同时,苦参提取物增加sw620细胞自噬小体数量(c),促进自噬流(d,e)。
[0091]
2、苦参提取物通过激活自噬通量抑制sw620细胞增殖,如图3,所示,将苦参提取物与自噬抑制剂3ma同时作用于sw620细胞,苦参提取物抑制sw620细胞增殖的作用被剥夺(a),同时,苦参提取物增加自噬流作用被3ma抑制(b,c)。
[0092]
3、苦参提取物通过诱导sw620细胞凋亡,如图4所示,细胞克隆、流式细胞术和tunel染色实验结果表明,苦参提取物能够诱导sw620细胞凋亡(a,b,c)
[0093]
4、苦参提取物诱导sw620细胞caspase-8依赖性凋亡,如图,5所示,使用caspase-8抑制剂z-vad-fmk与苦参提取物同时作用于sw620细胞,细胞克隆和流式细胞术实验结果表明,苦参提取物诱导sw620凋亡作用被z-vad-fmk抑制(a-c)。
[0094]
5、苦参提取物通过激活自噬诱导sw620细胞,如图6所示,使用atg5 sirna敲低自噬关键蛋白atg5表达后,苦参提取物抑制sw620细胞增殖作用被逆转(a,b)。
[0095]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
