1.本发明属于基因工程技术领域。更具体地,涉及一种利用聚球藻基因的启动子检测水体营养盐生物可利用度的方法。
背景技术:
2.营养盐是浮游植物生长的物质基础,其含量高低直接影响海洋初级生产力,对海洋生态系统具有十分重要的意义。在生物地球化学循环的过程中,营养盐与生物活动、环境要素等有着密切的联系。近年来,随着研究的深入,营养盐与生态环境之间的关系日益受到重视。
3.水体营养盐的生物可利用度是控制浮游植物生物量的关键因素,对水环境生态学的研究具有重要意义。但现有水体营养盐的研究主要集中在对营养盐浓度的检测上,忽略了水体营养盐的生物可利用性浓度。现有营养盐浓度检测均是根据营养盐元素的物理化学特性,通过某些理化反应,使其成为适用于仪器检测的物质形式,经过吸光度、质谱或色谱等技术计算获得营养盐浓度。营养盐浓度虽在环境学上具有一定的参考价值,但从生物学角度来看,特定环境中某种营养盐元素的总含量无法尽数被浮游植物利用,营养盐的可利用度会随着外在条件的变化而变化,所以其测得的营养盐浓度并不能代表生物可利用度。因此,需要一种检测水体营养盐生物可利用度的方法。
技术实现要素:
4.本发明要解决的技术问题是克服现有上述技术的缺陷和不足,提供一种利用聚球藻基因的启动子检测水体营养盐生物可利用度的方法。
5.本发明的第一个目的是提供一种转基因聚球藻。
6.本发明的第二个目的是提供所述转基因聚球藻在检测水体营养盐生物可利用度中的应用。
7.本发明的第三个目的是提供一种利用所述转基因聚球藻检测水体营养盐生物可利用度的方法。
8.本发明上述目的通过以下技术方案实现:
9.聚球藻7002是一种能够利用无机氮磷进行光合作用并产生有机质的原核生物,是蓝藻(也被称为蓝细菌)中的一种,对环境有着极强的适应能力。本发明通过构建含有对水体营养盐缺乏敏感的聚球藻基因的启动子序列和荧光蛋白基因片段组成的重组表达元件的转基因聚球藻,实现了聚球藻7002中对营养盐元素缺乏敏感的基因的启动子与荧光蛋白的融合表达,即可通过启动子调控其下游荧光报告基因的表达,获得可检测的荧光信号。当水体中的营养盐缺乏时,会诱导聚球藻中对营养盐元素缺乏敏感的基因及荧光报告基因的表达,通过测定荧光值,可间接的反应出环境中可利用的营养盐元素的浓度,也可以更加真实的反映出样本水体中对于浮游植物本身而言更有参考意义的生物可利用度。
10.本发明首先提供了一种转基因聚球藻,所述转基因聚球藻中含有对水体营养盐缺乏敏感的聚球藻基因的启动子序列和荧光蛋白基因片段组成的重组表达元件。
11.具体地,所述重组表达元件为含有对水体营养盐缺乏敏感的聚球藻基因的启动子序列和荧光蛋白基因片段的重组表达载体。
12.具体地,所述表达载体为paqe19。
13.paqe19是以聚球藻7002中原有的基因组质粒paqe1为基础,经过插入多克隆位点、抗生素抗性基因等步骤构建得到的,其具有与聚球藻7002的基因组高度同源并能在藻细胞中长期稳定遗传的特性,是在聚球藻7002中进行外源基因表达的优良载体。
14.具体地,所述对水体营养盐缺乏敏感的聚球藻基因为对氮、磷或铁元素缺乏敏感的聚球藻基因。
15.在全球大部分的大洋海域生态系统中,限制浮游植物生长的元素主要是氮(n)、磷(p)和铁(fe)三种。而在淡水生态系统中,水体污染引起的富营养化通常是n、p元素过量。为检测淡水中的富营养化情况和大洋中营养盐元素受限制情况,本发明选择了聚球藻7002中对n、p和fe三种元素较敏感的基因的启动子构建重组表达载体,并通过转化获得了相应的转基因聚球藻。
16.具体地,所述对氮元素缺乏敏感的聚球藻基因为a1821或d0010,所述对磷元素缺乏敏感的聚球藻基因为a2284或a2352,所述对铁元素缺乏敏感的聚球藻基因为a1291或g0079。
17.上述基因的核苷酸序列可通过网站(网址:www.kegg.jp)检索得到。具体地,在网站搜索界面中输入“synpcc7002_a1821”即可出现a1821基因的核苷酸序列,其他基因只需更改后面的基因编号即可搜索得到。
18.具体地,所述a1821基因的启动子序列如seq id no.1所示,d0010基因的启动子序列如seq id no.2所示;a2284基因的启动子序列如seq id no.3所示,a2352基因的启动子序列如seq id no.4所示;a1291基因的启动子序列如seq id no.5所示,g0079基因的启动子序列如seq id no.6所示。
19.具体地,本发明所述聚球藻为聚球藻7002。
20.本发明还提供了一种利用上述转基因聚球藻检测水体营养盐生物可利用度的方法,包含以下步骤:
21.s1.确定待测的营养盐元素,配制含不同浓度梯度的待测营养盐元素的培养基,将含有对待测营养盐元素缺乏敏感的聚球藻基因的启动子序列和荧光蛋白基因片段组成的重组表达元件的转基因聚球藻置于所述不同浓度梯度的培养基中培养,测定荧光值,绘制营养盐浓度与荧光值关系标准曲线;
22.s2.将与步骤s1相同的转基因聚球藻置于待测水体样品中,用与步骤s1相同的条件培养后测定荧光值,利用步骤s1所得标准曲线计算所测水体样品中与标曲对应的营养盐元素的浓度。
23.由于浮游植物对营养盐的吸收具有偏好性,不同形式的营养盐(如同样的氮源,可分为有机和无机,而浮游植物更偏向于吸收无机氮)对浮游植物来说可利用性是不同的,相同含量不同种类的氮源带来的水体富营养化效应是截然不同的。具体地,本发明检测的是水体中no
3-
当量的n浓度、po
43-
当量的p浓度及fe
3
当量的fe浓度。
24.具体地,转基因聚球藻的培养温度为28~30℃,光照条件为100
±
10μe m-2
s-1
。
25.具体地,转基因聚球藻在110rpm条件下振荡培养。
26.具体地,在绘制标准曲线前,先将转基因聚球藻置于对应的缺素培养基中培养,进行饥饿处理。
27.具体地,所述饥饿处理的方法为:将培养到对数期的转基因聚球藻分别用相应的缺素培养基洗脱,然后在相应的缺素培养基中培养,光照条件为100
±
10μe m-2
s-1
,温度为30℃,110rpm振荡培养;培养24小时后离心去上清,分别用对应的缺素培养基清洗两遍(加入培养基重悬、离心、弃上清),去除藻细胞外的营养元素,再次接入对应的缺素培养基中培养24小时。
28.本发明具有以下有益效果:
29.本发明以聚球藻7002为核心反应体系,通过诱导聚球藻7002中对水体营养盐(n、p和fe)缺乏敏感的基因表达,来间接的反应出水体中浮游植物实实在在可利用的营养盐的浓度,本发明所述方法相较于现有通过营养盐元素的物理化学特性检测获得营养盐浓度的方法来说,可以更加真实的反映水体中营养盐的生物可利用度,有利于生态环境研究。
附图说明
30.图1为paqe19-luciferase重组载体的构建示意图。
31.图2为含有启动子序列的paqe19-luciferase重组表达载体的构建示意图。
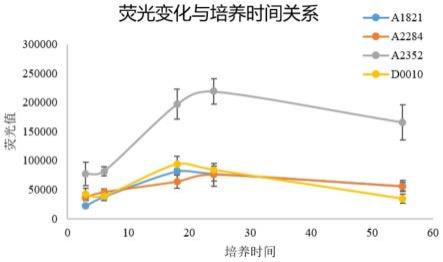
32.图3为不同转基因聚球藻的荧光值预实验结果。
33.图4为利用对缺n敏感的转基因聚球藻nbu1042绘制得到的标准曲线。
34.图5为利用对缺p敏感的转基因聚球藻nbu1046绘制得到的标准曲线,图中左侧标注的1、2、3、4和5分别与横坐标的数值对应,其中1:0表示该点对应的p浓度为0,2:0.37μm代表该点对应的p浓度为0.37μm,依次类推。
35.图6为利用对缺fe敏感的转基因聚球藻nbu1462和转基因聚球藻nbu1050绘制得到的标准曲线,图中蓝色线为利用转基因聚球藻nbu1462绘制得到的标准曲线,黄色线为利用转基因聚球藻nbu1050绘制得到的标准曲线;图中左侧标注的1、2和3分别与横坐标的数值对应,1:0.1μm代表该点对应的fe浓度为0.1μm,2:1μm代表该点对应的fe浓度为1μm,3:10μm代表该点对应的fe浓度为10μm。
具体实施方式
36.以下结合说明书附图和具体实施例来进一步说明本发明,但实施例并不对本发明做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
37.除非特别说明,以下实施例所用试剂和材料均为市购。
38.实施例1聚球藻7002中对营养盐元素缺乏敏感的基因的筛选
39.在全球大部分的大洋海域生态系统中,限制浮游植物生长的元素主要是氮(n)、磷(p)和铁(fe)三种。而在淡水生态系统中,水体污染引起的富营养化通常是n、p元素过量。因此,为检测淡水中的富营养化情况和大洋中营养盐元素受限制情况,本发明对聚球藻7002中对n、p和fe三种元素缺乏敏感且特异性较高的进行进行了筛选。聚球藻7002是一种能够
利用无机氮磷进行光合作用并产生有机质的原核生物,是蓝藻(也被称为蓝细菌)中的一种,对环境有着极强的适应能力,这种适应能力表现在分子层面即为基因的表达调节。同时作为模式生物的一种,聚球藻7002的遗传背景清晰,而且其生长繁殖迅速,因此本发明选择聚球藻7002作为工程藻株。
40.本发明通过大量实验,从聚球藻7002的基因组中筛选得到了在n、p和fe缺乏时能够进行调节表达的基因,即对n、p和fe缺乏敏感的基因,且基因的特异性较高。
41.本发明获得的对n元素敏感的基因的编号为a1821和d0010;其中,a1821基因的启动子序列如下(seq id no.1)所示:
42.cagtgctgccttcgtggttttcatcgtctttgtcccattgcatcgtgccagcccaggtgacataggagccgccgacgctgaggctagcgtccatgtcgtgcatctggcaaatttcaatgatgcgggggtcgtctttttcgagggtttcgacttggatattcgaaccaccggattcggctcgccggaaggggaggtggtgggtaacgcgtcgagactgccattgtccggcactgtattggaaaaattccttggcatccgcaaagctttgcatatcgaaaaattgtcctctgggtcttggctgattacaaaaatatcgttttatcggtgtttgttaaaaacatctttcagcttaacgaatttcgggccgctccctggaaaataggcgatcgccccattgtttctttttgtttcaattttgacagaacgattgacagaggttagattaaatgcagtagagacattcgcaatattcgccagaattattggcaaggagctgccc
43.d0010基因的启动子序列如下(seq id no.2)所示:
44.gtccctgatgttgggaatactcttgatgacaattgtgattgctcaaagaagaaagaaatttggagtaaatctctaaaaggggactgaaatatttgtatggtcagcatgaccactgaaatggagagaagtctaagacagtagatgtcttagatataagcctcattagaagccatgccataaaacagattttgtggatgaaacaacttgaaatagttcagttgtagaccatgttataaacatttattcttaacacagtgacacattaatgactcatatatccgtccaaaaaaaactaaaatgtttgtaaatttagtttttttgtgtcgtcaaatatacggtttatttcgtcttcacatcttatctttattttagtaagctgcagaaaaaacgatataagttaatttgagtcatattgtccttttcgatgttgtgatgagctatctaacaaagcagttttttaatataaatccaattgataaatttagagctagataggtgttttatggaggataaaatct
45.本发明获得的对p元素敏感的基因的编号为a2284和a2352;其中,a2284基因的启动子序列如下(seq id no.3)所示:
46.cgcgatttaagtcagtccttcaaaaaaagattacttcttgaaccatcaacaatctaaatgcctcccatgctgccctgaatgtcgtctaagatttttagcagtcaaatcaaattaaactggtcactgccttgatatttggctgaaaatctccccctgaatttacctcgacttttgcaaagattaaccttcatttaacctccctaaaaactttgcttaaggctgatggactttttggagagaggagagaaaaaacaaacataaattctgcattgattttctgtagttatggtataaacatcttgaaaagttttgtgaatctcaattcattttttcgaagatttacaaattcatcagagcttcagagagtttaagtctagaaaaatcgctctaatcttaatctctgactagcagtcaatgcctgaaagcctcgatctcgctaaaaagttttaatccatcgctcacttacgcttaattgcacagtacacaatagaggaaact
47.a2352基因的启动子序列如下(seq id no.4)所示:
48.cgtggtgatctcgccatctagattgacccccgcaaaggaaccgcgccagttccccagattttttagaaaattttcccactgactggccatcgttatgtttccctgactaaactgcacggtcttctattgtgccggagaaagaaaagggaaagcaactccatcatggatccatgcgggaaggtcaaggttaacaatgcttcagcatggctctaatcccttcgcttaatgtaagacattatcttcttgatttaattacttttagttgcaccttagctaaaaaatatttgactaaaaaacaataataaaatcacaaaaaatagtctttacaaaatctaaaattaaactttgcttagtttctttttaactcaagcaattctctttccattgtatcgttggggtcgtggtattaatcaaataaatattaggta
49.本发明获得的对对fe敏感的基因的编号为a1291和g0079;其中,a1291基因的启动子序列如下(seq id no.5)所示:
50.ctgatacctaggcgatcgccttttattgcatgaacaccaactgataattaatagtgataaaacttgtctgaaataattattgggtttcttcatatcaaaactgattagcaaaaaagacgtgatcgttgcggcgagaagtggagcgagaaattcgtaaaaactcctattttctttgcagagataaggtttttggtctcatggagtgattggccagggcaactttttacaaaagttaacttgactttactgagaataattgtaggataaagccaatcctttattgccaaatatatgcgataagtgattagcctgattagttttaacgaccactctttttaaaatcacgatgcaaacctacgataatccagacgttaaatacgaatggtgggcaggcaatgcccggtttgctgacctttccggtcagtttattggtgcccacgtggcccatgctgccttaattgttttctgggcaggggccttcacgttgttcgaaatttcttactttgacccgaccctaccc
51.g0079基因的启动子序列如下(seq id no.6)所示:
52.ccgaccgaaaggttgagcagtagagccgatgtcgccaaatctcttgcgaacctattgagattgtttttggctgacatctgacttatttatcaatataaagctaattagttatgtagtcaacatctttggcttgctttggtttgtccacttgcccaagcagaattcagcgcaaaacgccttaaatcttgttctgacctgacttgggtagctagcgatgtcgatccagctttaattgaaaaagatttctagtagtttgcttgacaggacaagaatgatccactaaagtctctaagttaatgccaattaattgcaacttcagggagatgtcatcaaccccatgacattagtcaatcgcggttaatgggccatggggtttttatttcagttaagtcatcgacggttatttttctaaggttttaaaacgtcctaggcccagtcaatatttctgggctgtttatcagtggactttaatttttgctattaaatttcaactatttagatcg
53.实施例2重组表达载体的构建及转化
54.本发明通过构建含有对水体营养盐缺乏敏感的聚球藻基因的启动子序列和荧光蛋白基因片段的重组表达载体,再通过将构建得到的重组表达载体转入工程藻株,即聚球藻7002获得相应的转基因聚球藻。
55.本实施例以seq id no.1所示启动子序列为例说明本发明所述重组表达载体以及转基因聚球藻的制备方法。
56.1、重组表达载体的构建
57.(1)以seq id no.1所示启动子序列为模板设计引物,在扩增得到启动子片段的同时在启动子片段两端分别引入kpnⅰ和salⅰ酶切位点;
58.(2)从聚球藻7002中获取paqe1载体,通过在载体中添加酶切位点和抗生素抗性基因,构建得到paqe19载体,本发明所述paqe19载体由赵进东院士惠赠,所述paqe1载体中添加的酶切位点为ecorⅰ和salⅰ,引入的抗生素抗性基因为amp(氨苄)和km(卡那);
59.(3)用ecorⅰ和salⅰ对构建得到的paqe19载体进行双酶切,酶切后纯化获得大小为7.2k的线性化载体;
60.(4)用ecorⅰ和salⅰ对puc-luciferase载体进行双酶切,纯化获得荧光蛋白基因(luciferase,即luxab荧光蛋白基因)片段;
61.(5)将(3)中获得的线性化的paqe19载体与(4)中获得的luciferase片段进行连接,获得paqe19-luciferase(9.4k)重组载体,paqe19-luciferase(9.4k)重组载体的构建示意图如图1所示;
62.(6)用kpnⅰ和salⅰ分别对(1)中扩增得到的启动子片段和(5)中构建得到的paqe19-luciferase重组载体进行双酶切,酶切后纯化回收线性化的载体和启动子片段,将启动子片段与线性化的paqe19-luciferase载体经连接构建获得重组表达载体,构建示意
图如图2所示。
63.2、转基因聚球藻的制备
64.(1)取1ml生长至对数期的野生型聚球藻7002藻液,6000rpm离心2分钟,弃上清;
65.(2)加入培养基重悬藻细胞,吹打混匀,6000rpm离心2min,弃上清;
66.(3)再次加入培养基重悬藻细胞,吸取少量重悬好的藻液至新的1.5ml ep管中,加入适量培养基将藻液稀释至浅绿色;
67.(4)取200μl稀释后的藻液至新的ep管中,加入1.5μl构建好的重组表达载体,吸打混匀;
68.(5)把(4)中获得的藻-重组表达载体混合物置于30℃弱光照培养箱中培养4小时;
69.(6)准备好平板,从培养箱内取出藻-重组表达载体混合物,取200μl混合物滴于平板中的膜上并均匀涂布;
70.(7)待板内液体吹干后,封板,放置于30℃光照培养箱中培养至长出单克隆,对长出的单克隆进行鉴定并传代。
71.本发明通过上述方法,分别获得了对缺n敏感的转基因聚球藻nbu1042(含有a1821启动子-luxab荧光蛋白基因)和转基因聚球藻nbu1048(含有d0010启动子-luxab荧光蛋白基因),对缺p敏感的转基因聚球藻nbu1044(含有a2284启动子-luxab荧光蛋白基因)和转基因聚球藻nbu1046(含有a2352启动子-luxab荧光蛋白基因),以及对缺fe敏感的转基因聚球藻nbu1462(含有a1291启动子-luxab荧光蛋白基因)和转基因聚球藻nbu1050(含有g0079启动子-luxab荧光蛋白基因)。
72.实施例3营养盐生物可利用度调查
73.本实施例以测定n、p、fe的生物可利用度为例说明本发明所述检测营养盐生物可利用度的方法。由于浮游植物对营养盐的吸收具有偏好性,不同形式的营养盐(如同样的氮源,可分为有机和无机,而浮游植物更偏向于吸收无机氮)对浮游植物来说可利用性是不同的,相同含量不同种类的氮源带来的水体富营养化效应是截然不同的。因此,本发明检测水体中no
3-
当量的n浓度、po
43-
当量的p浓度以及fe
3
当量的fe浓度。
74.本发明培养聚球藻所用培养基为丰富营养盐(a
)培养基,正常a
培养基中所含有的营养盐成分及其浓度分别为:nacl为0.307m,kcl为8mm,nano3为12mm,mgso4为20mm,cacl2为2.5mm,tris-hcl为8.3mm,kh2po4为370μm,fecl3为10μm,edta为80μm,vb
12
为3nm,h3bo3为0.55μm,znso4为2.3μm,cuso4为12nm,mncl2为20nm,cocl2为50nm。
75.为选择荧光表达较高的转基因聚球藻进行实验,本发明通过预实验测试了不同转基因聚球藻的荧光值,结果如图3所示。由图3所示结果可知,对缺n敏感的转基因聚球藻nbu1042和对缺p敏感的转基因聚球藻nbu1046的荧光值相对更高,因此,本发明后续选用对缺n敏感的转基因聚球藻nbu1042和对缺p敏感的转基因聚球藻nbu1046检测营养盐生物可利用度。
76.为提高转基因聚球藻的响应速度,本发明在绘制营养盐浓度与荧光值关系标准曲线前,先对转基因聚球藻进行了饥饿处理,使荧光值达到最高,然后再将饥饿处理后的转基因聚球藻置于营养液浓度梯度培养基中,使转基因聚球藻的响应更加迅速,达到短时、快速检测的目的。
77.将培养到对数期的转基因聚球藻(即实施例2中获得的对缺n敏感的转基因聚球藻
nbu1042、对缺p敏感的转基因聚球藻nbu1046和对缺fe敏感的转基因聚球藻nbu1462)分别用不含n、p、fe的培养基洗脱,然后在相应的缺n、p和fe的培养基中培养,光照条件为100
±
10μe m-2
s-1
,温度为30℃,110rpm振荡培养,分别用thermo多功能酶标仪于1、3、6、12、24小时测量荧光值,至荧光值达到最高值。
78.荧光值测量方法为:吸取200μl培养后的藻液至白色不透光的96孔板,在测量前加入5μl含0.1mm癸醛的dmso溶液,迅速放入酶标仪中,于1分钟内完成测量,读取并记录数据。
79.在上述培养条件下,对缺n敏感的转基因聚球藻nbu1042在18小时达到最高荧光值,对缺p敏感的转基因聚球藻nbu1046和对缺fe敏感的转基因聚球藻nbu1462在36小时达到最高荧光值。后续检测水体营养盐生物可利用度时,对转基因聚球藻的饥饿处理时间为48h,饥饿处理分两次进行。
80.具体为:将培养到对数期的转基因聚球藻分别用相应的缺素培养基洗脱,然后在相应的缺素培养基中培养,光照条件为100
±
10μe m-2
s-1
,温度为30℃,110rpm振荡培养;培养24小时后离心去上清,再分别用对应的缺素培养基清洗两遍(加入培养基重悬、离心、弃上清),去除藻细胞外的营养元素,再次接入对应的缺素培养基中培养24小时
81.在饥饿处理后,即可进行标准曲线的绘制:
82.将对缺n敏感的转基因聚球藻nbu1042、对缺p敏感的转基因聚球藻nbu1046、对缺fe敏感的转基因聚球藻nbu1462和对缺fe敏感的转基因聚球藻nbu1050分别在对应的缺n、p和fe的丰富营养盐(a
)培养基(例如培养对缺n敏感的转基因聚球藻nbu1042,则a
培养基中不添加n元素)中培养(光照条件为100
±
10μe m-2
s-1
,温度为30℃,110rpm振荡培养)24小时后离心去上清,分别用对应的缺素培养基清洗两遍(加入对应的缺素培养基重悬、离心、弃上清),去除藻细胞外的营养元素,调od
730
为0.1,再次接入对应的缺乏n、p、fe的a
培养基中进行培养;
83.再次培养24h后,将培养所得的转基因聚球藻培养液稀释分装到对应的含不同浓度梯度的培养基中进行培养(此时od
730
为0.02),测定荧光值并绘制标准曲线图。本实施例设置的营养盐浓度梯度分别如下所示;
84.n的浓度梯度为:12mm、1.2mm、120μm、12μm、0μm;
85.p的浓度梯度为:370μm、37μm、3.7μm、0.37μm、0μm;
86.fe的浓度梯度为:1000nm、100nm、10nm、1nm、0nm。
87.本发明利用对缺n敏感的转基因聚球藻nbu1042绘制得到的标准曲线如图4所示;利用对缺p敏感的转基因聚球藻nbu1046绘制得到的标准曲线如图5所示;利用对缺fe敏感的转基因聚球藻nbu1462和转基因聚球藻nbu1050绘制得到的标准曲线如图6所示,图中蓝色线为利用转基因聚球藻nbu1462绘制得到的标准曲线,黄色线为利用转基因聚球藻nbu1050绘制得到的标准曲线。
88.由图4可知,对缺n敏感的转基因聚球藻nbu1042在不同n浓度梯度下培养24小时的荧光值与n浓度呈较为良好的线性关系。由图5可知,对缺p敏感的转基因聚球藻nbu1046在不同p浓度梯度下培养24小时的荧光值与p浓度呈较为良好的线性关系。而由图6可知,对缺fe敏感的转基因聚球藻nbu1462和转基因聚球藻nbu1050在不同fe浓度梯度下培养24小时的荧光值与fe浓度的线性关系虽不如n和p,但也能满足后续实验需求。
89.s2.在绘制得到标准曲线后,将与绘制标准曲线时相同的转基因聚球藻置于待测
水体样品中,用与绘制标准曲线时相同的条件培养后测定荧光值,利用所得标准曲线即可计算得到所测水体样品中与标曲对应的营养盐元素的浓度。
90.上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。