β-内酰胺抗生素衍生化为质谱测量中的校准品/istd
本发明涉及一种复合物、组合物、试剂盒以及该复合物或该组合物的用途,该复合物由抗生素物质和亲核衍生化试剂形成,该组合物包括该复合物,该试剂盒包括该复合物或组合物。
背景技术:
β-内酰胺类抗生素是最常作为特定抗生素或广谱抗生素而开处方给感染细菌的患者的一类抗生素。此类抗生素通过干扰革兰氏阳性菌中占主导作用的肽聚糖层的交联而起作用。它们表现出浓度依赖性的杀菌作用。因此,将抗生素浓度保持在mic以上至关重要。然而,较高的浓度会导致不良影响。此外,据报道,这些化合物的药代动力学是高度可变的,因此无法预测(ronilda d
′
cunha等人;2018;antimicrobial agents and chemotherapy 62(9))。这些抗生素的作用机理是通过四元β-内酰胺环与d-丙氨酰-d-丙氨酰-转肽酶反应,从而抑制外细胞壁的肽聚糖聚合物之间形成交联。因此,相对不稳定的内酰胺部分负责这些抗生素的作用机理。然而,这种不稳定性也导致这些化合物在溶解于质子溶剂中时发生部分水解。更重要的是,水解自然会在酸或碱的存在下进一步被催化,并随着温度升高而增强。显然,水解抗生素不再是可以抑制细菌生长的活性化合物。术语“水解”和术语“水解作用”在本公开中可以互换使用。术语“水解作用”对于技术人员来说是已知的并且因此不进行详细解释。治疗药物监测(tdm)是一个医学领域,其旨在量化人类样品材料中的药物,以监测体内药物浓度。由于水解在患者取样(例如血液采集)后继续进行,因此不可能获得天然β-内酰胺抗生素的确切浓度。已经做出了相当大的努力来研究和解决治疗药物监测(tdm)领域的β-内酰胺不稳定性的问题,主要专注于旨在将化合物保持在其天然(即未水解)形式的储存条件(zander等人;2016;clinical chemistry and laboratory medicine;54(2))。由于仔细监测抗生素浓度至关重要,因此需要一种有效且稳定的方法对来自人类和动物基质的这些化合物进行定量。目前,可以通过lc-ms/ms对这些抗生素进行定量。对于这种方法,使用目标抗生素作为校准品来校准系统至关重要。最常见的是使用已知浓度的同位素标记内标(istd)来说明在通过ms测量化合物之前在对该化合物进行处理/纯化中发生的分析物损失。istd还可以校正不同样品的电离偏差。因此,此方法的先决条件是校准品和istd二者的浓度是已知的。由于这些化合物已经在非常温和的条件下发生了水解(wiedemann等人;2015;chempluschem,80),因此很难将这些校准品和istd保持完好无损直至它们被用于测量时。这导致了校准品和istd浓度的偏差,并意味着无法准确对患者样本中的目标分析物进行定量。因此,迫切需要稳定的校准品和istd,以便能够测量β-内酰胺抗生素水平,而不会由不稳定的istd和校准品引起的妨碍测量的准确性。在这里,我们首次能够揭示可以使β-内酰胺类抗生素稳定化,以便用作稳定的校准品和istd,进而确保准确的样品测量。
技术实现要素:
在第一方面,本发明涉及了一种由抗生素物质和亲核衍生化试剂形成的复合物。在第二方面,本发明涉及一种包含第一方面的所述复合物的组合物。在第三方面,本发明涉及一种试剂盒,所述试剂盒包含a)第一方面的所述复合物或第二方面的所述组合物,以及b)包装插页。在第四方面,本发明涉及第一方面的所述复合物或第二方面的所述组合物用于质谱测量的用途。在第五方面,本发明涉及亲核衍生化试剂稳定化抗生素物质的用途,所述抗生素物质特别是适合作为质谱测量中的istd和/或校准品。在第六方面,本发明涉及一种经衍生化的抗生素物质,所述经衍生化的抗生素物质适合作为质谱测量中的istd和/或校准品。在第七方面,本发明涉及经衍生化的抗生素作为质谱测量中的istd和/或校准品的用途。在第八方面,本发明涉及一种生产经稳定的抗生素物质的方法,所述方法包括用亲核衍生化试剂对所述抗生素物质进行衍生化。
附图说明
图1:哌拉西林(化合物5)水解途径的示意图。图2:a)天然哌拉西林(化合物5);和b)单独的水解的哌拉西林(化合物9a或化合物9b,图1)在室温下在水中经过16h的测量峰面积。以置信度拟合和f检验进行描述。为清楚起见,已通过平均面积值对参考线进行绘制。图3:美罗培南(化合物1)与不同试剂的衍生化反应顺序示意图:a)丙胺;b)丁胺,c)戊胺图4.哌拉西林(化合物5)与不同试剂的衍生化反应顺序示意图:a)丙胺;b)丁胺,c)戊胺图5:经双衍生化的哌拉西林(化合物7)在室温下在水中进行了两个mrm转换经过16h的测量峰面积。以置信度拟合和f检验进行描述。为清楚起见,已通过平均面积值对参考线进行绘制。图6:哌拉西林-d5一水合物(8)和哌-正丁酰胺-5
(9)的合成路线图7:美罗培南-13c2-15
n(7)和美罗培南-正丁酰胺-13c2-15
n(8)的合成路线。图8:氘化哌拉西林istd(化合物11)的示意图图9:单独的经衍生化的哌拉西林-d5(化合物11,图8)在室温下在水中经过16h的测量峰面积。为清楚起见,已通过平均面积值对参考线进行绘制。以置信度拟合和f检验进行描述图10:在不同反应条件下用试剂丙胺、丁胺和戊胺衍生化的美罗培南(例如,如图3所示的化合物2、化合物3或化合物4)的测量峰面积图11:在不同反应条件下用试剂丙胺、丁胺和戊胺衍生化的哌拉西林(例如,如图4所示的化合物6、化合物7或化合物8)的测量峰面积
具体实施方式
在下文详细描述本发明之前,应当理解,本发明不限于本文所述的特定方法、方案和试剂,因为这些方法、方案和试剂可以变化。还应当理解,本文所用的术语仅出于描述特定实施例的目的,并非旨在限制本发明的范围,本发明的范围仅受所附权利要求的限制。除非另外指明,否则本文所用的所有科学技术术语具有如本领域的普通技术人员通常理解的相同意义。在本说明书全文中引用了若干文档。本文所引用的文献(包括所有专利、专利申请、科学出版物、制造商的说明书、使用说明等)中的每一篇,无论上文或下文中引用,均通过引用而以其整体并入本文。在此类并入的参考文献的定义或教导与本说明书中引用的定义或教导之间矛盾时,以本说明书文本为准。下面将描述本发明的元件。这些元件与具体实施例一起列出,然而,应理解,它们可以任何方式和任何数目组合以创建另外的实施例。各种描述的实例和优选实施例不应解释为仅将本发明限制为明确描述的实施例。此描述应理解为支持并且涵盖将明确描述的实施例与任何数目的所公开和/或优选元件组合的实施例。此外,除非上下文另有指示,否则本技术中所有所描述元件的任何排列和组合均应视为由本技术的说明书公开。定义词语“包括(comprise)”以及变体诸如“包括(comprises)”和“包括(comprising)”应理解为暗示包括所陈述的整数或步骤或者整数或步骤组,但不排除任何其他整数或步骤或者整数或步骤组。如在本说明书和所附权利要求中所用,除非内容另外明确规定,否则单数形式“一个”、“一种”、“该”和“所述”包括复数指代物。百分比、浓度、量和其他数值数据在本文中可以“范围”格式表达或呈现。应当理解,此类范围格式仅出于方便和简洁而使用,因此应灵活地解释为不仅包括明确列举为范围限值的数值,而且包括该范围所涵盖的所有单独的数值或子范围,就如同明确列举出每个数值和子范围一样。作为例示,数值范围“4%至20%”应解释为不仅包括明确列举出的4%至20%的值,而且包括所示范围内的各个值和子范围。因此,此数值范围中包括个体值诸如4、5、6、7、8、9、10、
…
18、19、20%和子范围诸如4-10%、5-15%、10-20%等。此相同原则适用于引用最小值或最大值的范围。此外,无论所述范围或特征的广度如何,均适用此类解释。当与数值相连使用时,术语“约”意为涵盖处于一定范围内的数值,该范围具有比所指示的数值小5%的下限和比所指示的数值大5%的上限。术语“测量(measurement)”、“测量(measuring)”或“确定”优选地包括定性、半定量或定量的测量。术语“自动化的”是指主要由自动化设备操作的方法或过程,即由机器或计算机操作的方法或过程,以便减少人工完成的工作量和完成工作所花费的时间。因此,在自动化的方法中,以前由人类执行的任务现在由机器或计算机执行。通常,用户只需要配置工具和定义流程。本领域技术人员清楚地知道,在一些次要点上可能仍需要人工干预,但是该方法的很大程度上是自动执行的。术语“质谱分析”(“mass spec”或“ms”)涉及通过化合物的质量用于鉴别化合物的
分析技术。ms是基于离子的质荷比或“m/z”来过滤、检测和测量离子的方法。ms技术通常包括(1)将化合物离子化以形成带电化合物;以及(2)检测该带电化合物的分子量并计算质荷比。化合物可通过任何合适的手段来离子化并检测。“质谱仪”通常包括电离器和离子检测器。通常,将一个或多个目标分子离子化,后续将离子引入质谱仪器中,在该仪器中,由于磁场和电场的组合,离子遵循取决于质量(“m”)和电荷(“z”)的空间路径。术语“离子化”或“电离”是指生成具有等于一个或多个电子单位的净电荷的分析物离子的过程。负离子是那些具有一个或多个电子单位的净负电荷的离子,而正电荷是那些具有一个或多个电子单位的净正电荷的离子。ms方法既可以在生成并且检测负离子的“负离子模式”下执行,也可以在生成并且检测正离子的“正离子模式”下执行。“串联质谱分析”或“ms/ms”包括多个质谱分析选择步骤,其中分析物的裂解在各级之间发生。在串联质谱仪中,离子在离子源中形成,并且在第一级质谱(ms1)中按质荷比将其分离。选择特定质荷比的离子(前体离子或母离子),并通过碰撞诱导解离、离子-分子反应或光解离产生碎片离子(或子离子)。然后,在二级质谱分析(ms2)中分离并检测所得离子。ms中的大多数样品工作流程进一步包括样品制备和/或富集步骤,其中例如使用例如气相色谱法或液相色谱法将一种或多种目标分析物从基质中分离出来。通常,在质谱测量中执行以下三个步骤:1.将包含目标分析物的样品离子化,一般通过与阳离子形成加合物来进行,经常通过质子化生成阳离子。离子化源包括但不限于电喷雾离子化(esi)和大气压化学离子化(apci)。2.根据离子的质量和电荷对离子进行分选和分离。可使用高场不对称波形离子迁移谱(faims)作为离子过滤器。3.然后,例如以多反应模式(mrm)检测所分离的离子,并将结果展示在图表上。术语“电喷雾电离”或“esi”是指如下方法:在该方法中,溶液沿着短毛细管行进至被施加高正电位或高负电位的末端。到达该管末端的溶液被蒸发(雾化)成在溶剂蒸汽中存在非常小的溶液液滴的喷射或喷雾。此液滴雾流经蒸发室,将该蒸发室略微加热以防止冷凝并且蒸发溶剂。随着液滴变得更小,表面电荷密度增加,直到同类电荷之间的天然斥力造成离子以及中性分子得以释放。术语“大气压化学电离”或“apci”是指类似于esi的质谱法;但是,apci通过离子-分子反应产生离子,这些反应在大气压下发生在等离子体内。通过喷雾毛细管与对电极之间的放电来维持等离子体。然后,通常使用一组差分泵分级分离器将离子提取至质量分析仪中。可使用干燥且预热的ni气体逆流以改善溶剂的移除。对于分析极性较低的实体,apci中的气相离子化可能比esi更有效。“多反应模式”或“mrm”是ms仪器的一种检测模式,在该模式下,选择性地检测前体离子和一种或多种碎片离子。“串联质谱分析”或“ms/ms”包括多个质谱分析选择步骤,其中分析物的裂解在各级之间发生。在串联质谱仪中,离子在离子源中形成,并且在第一级质谱(ms1)中按质荷比将其分离。选择特定质荷比的离子(前体离子或母离子),并通过碰撞诱导解离、离子-分子反应或光解离产生碎片离子(或子离子)。然后,在二级质谱分析(ms2)中分离并检测所得离
子。由于质谱仪分离并检测质量略有差异的离子,它容易区分给定元素的不同同位素。因此,质谱分析是对包括但不限于低分子量分析物、肽、多肽或蛋白质的分析物进行精确质量测定和表征的重要方法。其应用包括蛋白质及其翻译后修饰的鉴别;蛋白质复合物、其亚基和功能性相互作用的阐明;以及蛋白质组学中蛋白质的全局测量。通常地,可通过质谱分析执行对肽或蛋白质的从头测序而无需事先知晓氨基酸序列。质谱测定可与另外的分析方法联用,包括色谱方法诸如气相色谱(gc)、液相色谱(lc)特别是hplc和/或基于离子迁移的分离技术。在本公开的上下文中,术语“分析物”、“分析物分子”或“目标分析物”可互换使用,其是指待分析的化学物质。适合于分析的化学物质,即分析物,可以是在活生物体中存在的任何种类的分子,包括但不限于核酸、氨基酸、肽、蛋白质、脂肪酸、脂质、碳水化合物、类固醇、酮类固醇、开环甾类化合物分子。分析物也可以是已被生物体内在化的任何物质,例如但不限于治疗药物、滥用药物、毒素或此类物质的代谢物。治疗药物包括抗生素,即“抗生素分析物”。抗生素是对细菌有活性的物质。抗生素通常基于其作用机理、化学结构或活性谱进行分类。一类抗生素是β-内酰胺类抗生素。β-内酰胺类抗生素(β-内酰胺类抗生素)都是其分子结构中含有β-内酰胺环的抗生素剂。这些包括但不限于青霉素衍生物(青霉烷类)、头孢菌素(头孢烯)、单环内酰胺类、碳青霉烯类和碳头孢烯类。大多数β-内酰胺类抗生素通过抑制细菌生物体中的细胞壁生物合成起作用,并且是最广泛使用的抗生素组。这些抗生素的有效性取决于它们到达pbp完整的能力以及它们与青霉素结合蛋白(pbp)结合的能力。分析物可以存在于目标样品(例如生物样品和临床样品)中。术语“样品”或“目标样品”在本文中可互换使用,其是指组织、器官或个体的一部分或切片,通常小于这种组织、器官或个体,旨在代表整个组织、器官或个体。在分析时,样品提供关于组织状态或者器官或个体的健康或患病状态的信息。样品的实例包括但不限于:流体样品,诸如血液、血清、血浆、滑液、脊髓液、尿液、唾液和淋巴液;或固体样品,诸如干血斑和组织提取物。样品的其他实例是细胞培养物或组织培养物。在本公开的上下文中,样品可以衍生自“个体”或“受试者”。通常地,受试者是哺乳动物。哺乳动物包括但不限于驯养的动物(例如牛、绵羊、猫、犬和马)、灵长类动物(例如人和非人灵长类动物,诸如猴)、兔以及啮齿类动物(例如小鼠和大鼠)。在经由质谱进行分析之前,可按照针对特定样品和/或分析物的方式对样品进行预处理。在本公开的上下文中,术语“预处理”是指允许经由质谱分析对所期望的分析物进行后续分析所需的任何措施。预处理措施通常包括但不限于,洗脱固体样品(例如,洗脱干血斑)、将溶血试剂(hr)添加到全血液样品中、以及将酶试剂添加到尿液样品中。添加内部标准(istd)也被视为样品的预处理。通常地,内标(istd)是已知量的物质,当经历质谱检测工作流程(即,包括任何预处理、富集和实际检测步骤)时,其表现出与目标分析物类似的特性。尽管istd表现出与目标分析物类似的特性,它仍可明显地与目标分析物区分开来。举例而言,在色谱分离诸如气相色谱和液相色谱过程中,istd具有大致与来自样品中的目标分析物相同的保留时间。因此,分析物和istd两者均同时进入质谱仪中。然而,istd表现出与来自样品的目标分析物不同的分子质量。这使得在来自istd的离子与来自分析物的离子之间能够通过其不同的质荷
(m/z)比进行质谱区分。两者均经历裂解并提供子离子。这些子离子可通过其m/z比而彼此区分并与各自的母离子区分。因此,可对istd和分析物的信号进行单独的测定和定量。由于istd的添加的量是已知的,因此来自样品的分析物的信号强度可归因于该分析物的具体定量性的量。因此,添加istd允许对所检测的分析物的量进行相对比较,并且当一种或多种分析物到达质谱仪时,能够对样品中存在的一种或多种目标分析物进行明确鉴定和定量。通常但不一定,istd是目标分析物的同位素标记的变体(包含例如2h、
13
c或
15
n等标记)。术语“校准品”是指用作标准物或对照物的复合物或组合物,通常是用于构建校准曲线,从而允许确定给定样品中目标分析物的未知的浓度或量。校准品在预定义的线性动态浓度范围内连续运行。来自校准品测试的响应绘制在信号与浓度y-x轴图上。通常,校准品的化学结构与目标分析物的化学结构相同或非常相似(表现出非常相似的特性)。术语“色谱”是指一种过程,在该过程中,随着由液体或气体携带的化学混合物在液体或固体固定相周围或上方流动,作为化学实体的差异性分布的结果,该化学混合物被分离为多种组分。术语“液相色谱”或“lc”是指,随着流体均匀地渗透通过细碎物质填充的柱或通过毛细管道,该流体溶液中的一种或多种组分选择性滞后的过程。随着此流体相对于固定相移动,混合物组分在一种或多种固定相与体相流体(即,流动相)之间的分布导致该滞后。固定相的极性高于流动相(例如,甲苯作为流动相,二氧化硅作为固定相)的方法称为正相液相色谱(nplc),而固定相的极性小于流动相(例如,水-甲醇混合物作为流动相,而c18(十八烷基硅烷基)作为固定相)的方法称为反相液相色谱(rplc)。“高效液相色谱”或“hplc”是指一种液相色谱方法,在该方法中,通过迫使流动相在压力下经过固定相,通常为密集填充柱,从而增加分离程度。通常地,使用由不规则形状或球形的颗粒、多孔整体层或多孔膜构成的固定相来填充柱。过去,hplc根据流动相和固定相的极性分为两个不同的亚类。固定相的极性高于流动相(例如,甲苯作为流动相,二氧化硅作为固定相)的方法称为正相液相色谱(nplc),反之(例如,水-甲醇混合物作为流动相,而c18(十八烷基硅烷基)作为固定相)则称为反相液相色谱(rplc)。微流lc是指使用具有窄的内柱直径(通常低于1mm,例如约0.5mm)的柱的hplc方法。“超高效液相色谱”或“uhplc”是指使用120mpa(17,405lb所n2)或约1200大气压的hplc方法。快速lc是指使用具有如上所述的内径且长度短(<2cm,例如1cm)的柱的lc方法,其采用如上所述的流速并使用如上所述的压力(微流lc、uhplc)。短快速lc方案包括使用单个分析柱的捕捉/洗涤/洗脱步骤,并在《1min的极短时间内实现lc。其他众所周知的lc模式包括亲水作用色谱(hilic)、体积排阻lc、离子交换lc和亲和lc。lc分离可为单通道lc或包括多个平行布置的lc通道的多通道lc。在lc中,可根据分析物的极性或log p值、尺寸或亲和力来分离该分析物,如技术人员通常所知。在本发明的上下文中,术语“复合物”是指具有具体化学结构的化学物质。所述复合物可包含一个或多个功能性单元。每个单元履行不同的功能性,或者两个或更多个功能性单元可履行相同功能。在本发明的上下文中,术语“亲核体”是指提供电子对以形成化学键的化学物质。在水介质中存在的亲核体包括但不限于-nh2、-oh、-sh、-se、(r’、r”、r
”’
)p、n
3-、rcooh、f-、
cl-、br-、i-。在本发明的上下文中,术语“亲核衍生化试剂”或“亲核体衍生化试剂”是指包含此类亲核体的试剂。亲核衍生化试剂能够与目标物质,例如目标分析物反应,从而形成包含亲核单元和分析物单元的新复合物。术语“亲核体”和“亲核的”可以在此处使用并且在下文中可互换使用。“试剂盒”是包含至少一种本发明试剂的任何制品(例如,包装或容器),该试剂例如是用于治疗病症的药品,或用于特异性地检测生物标志物基因或蛋白质的探针。试剂盒优选作为用于执行本发明方法的单元来推销、分发或贩售。通常,试剂盒可进一步包括被分隔开的载体装置以在紧密的限定空间中接纳一个或多个容器装置,诸如小瓶、管等。特别地,每个容器意味着或包含将在第一方面的方法中使用的单独元件之一。试剂盒可进一步包含一个或多个包含其他材料的其他容器,该其他材料包括但不限于缓冲剂、稀释剂、过滤器、针头、注射器和带有使用说明书的包装插页。标签可存在于容器上以指示将组合物用于具体应用,并且也可指示体内或体外使用的指南。计算机程序代码可提供于数据存储介质或装置诸如光学存储介质(例如,光盘)上或直接提供于计算机或数据处理装置上。此外,试剂盒可包含如本文别处所述的用于校准目的生物标志物的标准量。“包装插页”用于指治疗产品或药品的商业包装中通常包括的说明书,其含有关于涉及此类治疗产品或药品的使用的适应症、用法、剂量、施用、禁忌症、待与所包装产品联用的其他治疗产品和/或警告的信息。实施例测量抗生素(特别是β-内酰胺类抗生素)的常用方法旨在消除它们的不稳定性。相反,通过使用抗生素与合适的亲核体反应并由此提供稳定的istd和校准品来确保对患者样品中的抗生素的准确测量,本发明并不消除抗生素的反应性而是对其进行利用。因此,在第一方面,本发明涉及了一种由抗生素物质和亲核衍生化试剂形成的复合物。通过使抗生素物质与衍生化试剂反应形成酰胺而获得该复合物。在实施例中,其中抗生素是含有β-内酰胺的抗生素,当酰胺形成时β-内酰胺部分被破坏。所得的复合物包含抗生素单元和亲核衍生化单元。在实施例中,亲核衍生化试剂是包含胺基的试剂,特别是伯胺或仲胺。在特定实施例中,亲核衍生化试剂是伯胺基团。与仲胺相比,伯胺基团的优点是可以减少孵育时间。在实施例中,亲核衍生化试剂包含多于3个c-原子,特别是3至20个c-原子。在特定实施例中,亲核衍生化试剂包含3至10个c-原子,特别是3至5个c-原子。在特定实施例中,亲核衍生化试剂包含4个c-原子。在实施例中,亲核衍生化试剂是直链或支链的,特别是直链胺,特别是直链伯胺。在特定实施例中,亲核衍生化试剂是包括3至5个c-原子的直链伯胺。因此,可以减少或避免ms干扰。在实施例中,亲核衍生化试剂选自由以下项组成的组:丙胺、丁胺和戊胺。在特定实施例中,亲核衍生化试剂是直链伯丁胺。在实施例中,抗生素物质是包含β-内酰胺部分的抗生素物质,即在实施例中,抗生素物质是β-内酰胺类抗生素。在实施例中,所述抗生素物质选自由以下项组成的组:阿莫西林、氨苄西林、巴坎西林、羧苄青霉素、氯唑西林、双氯西林、氟氯西林、美洛西林、萘夫西林、苯甲异噁唑青霉
素、替莫西林、非奈西林、青霉素g、青霉素v、哌拉西林、阿洛西林、匹氨西林、匹美西林、替卡西林、头孢乙腈(氰甲基头孢菌素)、头孢拉定(cefadroxil)(头孢羟氨苄(cefadroxyl))、头孢氨苄(先锋霉素)、头孢氨苄(先锋霉素)、头孢来星(头孢菌素(cephaloglycin))、头孢洛宁(头孢烟酰(cephalonium))、头孢噻啶(头孢氯雷他定(cephaloradine))、头孢噻吩(先锋霉素i(cephalothin))、头孢噻吩(先锋霉素i)、头孢匹林(头孢吡林)、头孢曲嗪、头孢氮氟、头孢西酮、头孢唑啉(头孢唑林)、头孢拉定(头孢拉啶)、头孢拉定(头孢拉啶)、头孢甲氧环烯胺、头孢甲氧环烯胺、头孢替唑、头孢克洛、头孢孟多、头孢美唑、头孢尼西、头孢替坦、头孢西丁、头孢丙烯(头孢罗齐)、头孢呋辛、头孢唑南、头孢卡品、头孢达肟、头孢地尼、头孢托仑、头孢他美、头孢克肟、头孢甲肟、头孢地嗪、头孢噻肟、头孢咪唑、头孢泊肟、头孢特仑、头孢布烯、头孢噻呋、头孢噻林、头孢唑肟、头孢曲松、头孢哌酮、头孢他啶、头孢替啶、头孢吡肟、头孢瑞南、头孢噻利、头孢唑兰、头孢匹罗、头孢喹肟、头孢托罗、头孢洛林、头孢氯嗪、头孢洛仑、头孢帕罗、头孢卡奈、头孢屈洛、头孢吡酮、头孢三唑、头孢维曲、头孢马替林、头孢氯铵、头孢维星、头孢恶唑、头孢罗替、头孢舒米、头孢呋汀、头孢噻氧、头孢唑烷、亚胺培南、多利培南、厄他培南、美罗培南、氨曲南和美西林。在特定实施例中,抗生素物质是美罗培南或哌拉西林。在实施例中,复合物包含一个或多个同位素标记。在特定实施例中,该一种或多种同位素标记可包含在复合物的亲核试剂衍生化单元和/或抗生素单元中。在特定实施例中,该一种或多种同位素标记包含在复合物的抗生素单元中。在特定实施例中,该一种或多种同位素标记物是氘、
13
c、
15
n、和/或
18
o。在特定实施例中,所有同位素标记是相同的标记。在可替代的实施例中,同位素标记可以是不同的,即可以包括两种、三种或四种不同的同位素标记。在特定实施例中,复合物的抗生素单元包含1至10个同位素标记,特别是它们都是相同的。在特定实施例中,复合物的抗生素单元包含1至8个同位素标记,特别是包含1至5个同位素标记。在特定实施例中,复合物的抗生素单元包含1个、2个、3个、4个或5个同位素标记。在特定实施例中,复合物的抗生素单元包含5个氘标记。在第二方面,本发明涉及了一种包含由抗生素物质和亲核衍生化试剂形成的复合物的组合物。在实施例中,该组合物进一步包含溶剂,特别是选自由以下项组成的组的容积:水、ch3cn、thf、二噁烷、dmf、dmso、丙酮、叔丁醇、二甘醇二甲醚、dme、meoh、etoh、1-proh、2-proh、乙二醇、六甲基磷酰胺(hmpa)、六甲基亚磷酰三胺(hmpt)和甘油。在特定实施例中,溶剂选自由以下项组成的组:水、ch3cn、thf、二噁烷、dmf、dmso、丙酮、叔丁醇、二甘醇二甲醚和dme。在实施例中,该组合物进一步包含稳定且可与水混溶的非亲核碱。在特定实施例中,该非亲核碱选自由以下项组成的组:dbu、na3po4、na2co3、和cs2co3。通过使抗生素物质与衍生化试剂反应形成酰胺而获得该复合物。在实施例中,其中抗生素是含有β-内酰胺的抗生素,当酰胺形成时β-内酰胺部分被破坏。所生成的复合物包含抗生素单元和亲核衍生化单元。在实施例中,亲核衍生化试剂是包含胺基的试剂,特别是伯胺或仲胺。在特定实施例中,亲核衍生化试剂是伯胺基团。在实施例中,亲核衍生化试剂包含多于3个c-原子,特别是3至20个c-原子。在特定
实施例中,亲核衍生化试剂包含3至10个c-原子,特别是3至5个c-原子。在特定实施例中,亲核衍生化试剂包含4个c-原子。在实施例中,亲核衍生化试剂是直链或支链的,特别是直链胺,特别是直链伯胺。在特定实施例中,亲核衍生化试剂是包括3至5个c-原子的直链伯胺。在实施例中,亲核衍生化试剂选自由以下项组成的组:丙胺、丁胺和戊胺。在特定实施例中,亲核衍生化试剂是直链伯丁胺。在实施例中,抗生素物质是包含β-内酰胺部分的抗生素物质,即在实施例中,抗生素物质是β-内酰胺类抗生素。在实施例中,所述抗生素物质选自由以下项组成的组:阿莫西林、氨苄西林、巴坎西林、羧苄青霉素、氯唑西林、双氯西林、氟氯西林、美洛西林、萘夫西林、苯甲异噁唑青霉素、替莫西林、非奈西林、青霉素g、青霉素v、哌拉西林、阿洛西林、匹氨西林、匹美西林、替卡西林、头孢乙腈(氰甲基头孢菌素)、头孢拉定(cefadroxil)(头孢羟氨苄(cefadroxyl))、头孢氨苄(先锋霉素)、头孢氨苄(先锋霉素)、头孢来星(头孢菌素(cephaloglycin))、头孢洛宁(头孢烟酰(cephalonium))、头孢噻啶(头孢氯雷他定(cephaloradine))、头孢噻吩(先锋霉素i(cephalothin))、头孢噻吩(先锋霉素i)、头孢匹林(头孢吡林)、头孢曲嗪、头孢氮氟、头孢西酮、头孢唑啉(头孢唑林)、头孢拉定(头孢拉啶)、头孢拉定(头孢拉啶)、头孢甲氧环烯胺、头孢甲氧环烯胺、头孢替唑、头孢克洛、头孢孟多、头孢美唑、头孢尼西、头孢替坦、头孢西丁、头孢丙烯(头孢罗齐)、头孢呋辛、头孢唑南、头孢卡品、头孢达肟、头孢地尼、头孢托仑、头孢他美、头孢克肟、头孢甲肟、头孢地嗪、头孢噻肟、头孢咪唑、头孢泊肟、头孢特仑、头孢布烯、头孢噻呋、头孢噻林、头孢唑肟、头孢曲松、头孢哌酮、头孢他啶、头孢替啶、头孢吡肟、头孢瑞南、头孢噻利、头孢唑兰、头孢匹罗、头孢喹肟、头孢托罗、头孢洛林、头孢氯嗪、头孢洛仑、头孢帕罗、头孢卡奈、头孢屈洛、头孢吡酮、头孢三唑、头孢维曲、头孢马替林、头孢氯铵、头孢维星、头孢恶唑、头孢罗替、头孢舒米、头孢呋汀、头孢噻氧、头孢唑烷、亚胺培南、多利培南、厄他培南、美罗培南、氨曲南和美西林。在特定实施例中,抗生素物质是美罗培南或哌拉西林。在实施例中,复合物包含一个或多个同位素标记。在特定实施例中,该一种或多种同位素标记可包含在复合物的亲核试剂衍生化单元和/或抗生素单元中。在特定实施例中,该一种或多种同位素标记包含在复合物的抗生素单元中。在特定实施例中,该一种或多种同位素标记物是氘、
13
c、
15
n、和/或
18
o。在特定实施例中,所有同位素标记是相同的标记。在可替代的实施例中,同位素标记可以是不同的,即可以包括两种、三种或四种不同的同位素标记。在特定实施例中,复合物的抗生素单元包含1至10个同位素标记,特别是它们都是相同的。在特定实施例中,复合物的抗生素单元包含1至8个同位素标记,特别是包含1至5个同位素标记。在特定实施例中,复合物的抗生素单元包含1个、2个、3个、4个或5个同位素标记。在特定实施例中,复合物的抗生素单元包含5个氘标记。在第三方面,本发明涉及一种试剂盒,所述试剂盒包含a)第一方面的复合物或第二方面的组合物,以及b)包装插页。在第四方面,本发明涉及第一方面的复合物、或第二方面的组合物、或第三方面试剂盒用于质谱测量的用途。
在特定实施例中,复合物或组合物或试剂盒用于通过质谱确定患者样品中抗生素分析物的量或浓度。在特定实施例中,复合物或组合物用于作为在通过质谱测量患者样品中抗生素分析物的量或浓度中的内标(istd)。在特定实施例中,第一方面的复合物或第二方面的组合物通过向目标样品添加预定的量或浓度而用作istd。特别地,第一方面的复合物或第二方面的组合物在样品测量之前添加到样品中。在特定实施例中,复合物或组合物用于作为在通过质谱测量患者样品中抗生素分析物的量或浓度中的校准品。在特定实施例中,使用第一方面的复合物或第二方面的组合物。在第五方面,本发明涉及亲核衍生化试剂稳定化抗生素物质的用途。特别地,亲核衍生化试剂用于衍生并由此稳定将适于作为质谱测量中的istd和/或校准品的抗生素物质。在实施例中,亲核衍生化试剂防止抗生素物质的水解。亲核衍生化试剂通过与抗生素物质反应形成复合物来防止水解。在实施例中,其中抗生素是含有β-内酰胺的抗生素,当复合物形成时β-内酰胺部分被破坏。所生成的复合物包含抗生素单元和亲核衍生化单元。在实施例中,亲核衍生化试剂使抗生素物质稳定化超过超过12个小时、超过24个小时、超过48个小时、超过7天、超过2周、超过4周、超过2个月、超过3个月、超过4个月、超过5个月或超过6个月。在特定实施例中,亲核衍生化试剂使抗生素物质稳定化超过12个小时。在特定实施例中,亲核衍生化试剂使抗生素物质稳定化超过24个小时,特别是超过48个小时。在特定实施例中,亲核衍生化试剂使抗生素物质稳定化超过2周。在特定实施例中,亲核衍生化试剂使抗生素物质稳定化超过2个月。在特定实施例中,亲核衍生化试剂使抗生素物质稳定化至少16个小时。在特定实施例中,亲核衍生化试剂使抗生素物质稳定化16个小时。在实施例中,亲核衍生化试剂用于稳定化抗生素物质,这允许使用经衍生化的抗生素物质作为质谱测量的内标(istd)。在实施例中,亲核衍生化试剂是包含胺基的试剂,特别是伯胺或仲胺。在特定实施例中,亲核衍生化试剂是伯胺基团。在实施例中,亲核衍生化试剂包含多于3个c-原子,特别是3至20个c-原子。在特定实施例中,亲核衍生化试剂包含3至10个c-原子,特别是3至5个c-原子。在特定实施例中,亲核衍生化试剂包含4个c-原子。在实施例中,亲核衍生化试剂是直链或支链的,特别是直链胺,特别是直链伯胺。在特定实施例中,亲核衍生化试剂是包括3至5个c-原子的直链伯胺。在实施例中,亲核衍生化试剂选自由以下项组成的组:丙胺、丁胺和戊胺。在特定实施例中,亲核衍生化试剂是直链伯丁胺。在实施例中,抗生素物质是包含β-内酰胺部分的抗生素物质,即,抗生素物质是β-内酰胺类抗生素。在实施例中,所述抗生素物质选自由以下项组成的组:阿莫西林、氨苄西林、巴坎西林、羧苄青霉素、氯唑西林、双氯西林、氟氯西林、美洛西林、萘夫西林、苯甲异噁唑青霉素、替莫西林、非奈西林、青霉素g、青霉素v、哌拉西林、阿洛西林、匹氨西林、匹美西林、替卡西林、头孢乙腈(氰甲基头孢菌素)、头孢拉定(cefadroxil)(头孢羟氨苄(cefadroxyl))、头孢氨苄(先锋霉素)、头孢氨苄(先锋霉素)、头孢来星(头孢菌素(cephaloglycin))、头孢洛
宁(头孢烟酰(cephalonium))、头孢噻啶(头孢氯雷他定(cephaloradine))、头孢噻吩(先锋霉素i(cephalothin))、头孢噻吩(先锋霉素i)、头孢匹林(头孢吡林)、头孢曲嗪、头孢氮氟、头孢西酮、头孢唑啉(头孢唑林)、头孢拉定(头孢拉啶)、头孢拉定(头孢拉啶)、头孢甲氧环烯胺、头孢甲氧环烯胺、头孢替唑、头孢克洛、头孢孟多、头孢美唑、头孢尼西、头孢替坦、头孢西丁、头孢丙烯(头孢罗齐)、头孢呋辛、头孢唑南、头孢卡品、头孢达肟、头孢地尼、头孢托仑、头孢他美、头孢克肟、头孢甲肟、头孢地嗪、头孢噻肟、头孢咪唑、头孢泊肟、头孢特仑、头孢布烯、头孢噻呋、头孢噻林、头孢唑肟、头孢曲松、头孢哌酮、头孢他啶、头孢替啶、头孢吡肟、头孢瑞南、头孢噻利、头孢唑兰、头孢匹罗、头孢喹肟、头孢托罗、头孢洛林、头孢氯嗪、头孢洛仑、头孢帕罗、头孢卡奈、头孢屈洛、头孢吡酮、头孢三唑、头孢维曲、头孢马替林、头孢氯铵、头孢维星、头孢恶唑、头孢罗替、头孢舒米、头孢呋汀、头孢噻氧、头孢唑烷、亚胺培南、多利培南、厄他培南、美罗培南、氨曲南和美西林。在特定实施例中,抗生素物质是美罗培南或哌拉西林。在实施例中,抗生素物质和/或亲核衍生化试剂包含一种或多种同位素标记。在特定实施例中,该一种或多种同位素标记可包含在复合物的亲核试剂衍生化单元和/或抗生素单元中。在特定实施例中,该一种或多种同位素标记包含在复合物的抗生素单元中。在特定实施例中,该一种或多种同位素标记物是氘、
13
c、
15
n、和/或
18
o。在特定实施例中,所有同位素标记是相同的标记。在可替代的实施例中,同位素标记可以是不同的,即可以包括两种、三种或四种不同的同位素标记。在特定实施例中,复合物的抗生素单元包含1至10个同位素标记。在特定实施例中,复合物的抗生素单元包含1至8个同位素标记,特别是包含1至5个同位素标记。在特定实施例中,复合物的抗生素单元包含1个、2个、3个、4个或5个同位素标记。在特定实施例中,复合物的抗生素单元包含5个氘标记。在第六方面,本发明涉及一种经衍生化的抗生素物质,特别是适合用作质谱测量中的istd和/或校准品的经衍生化的抗生素物质。在实施例中,抗生素物质由亲核衍生化试剂衍生。在实施例中,亲核衍生化试剂通过与抗生素物质反应形成复合物来防止水解。在实施例中,其中抗生素是含有β-内酰胺的抗生素,当复合物形成时β-内酰胺部分被破坏。所得的复合物包含抗生素单元和亲核衍生化单元。在实施例中,亲核衍生化试剂使抗生素物质稳定化超过超过12个小时、超过24个小时、超过48个小时、超过7天、超过2周、超过4周、超过2个月、超过3个月、超过4个月、超过5个月或超过6个月。在特定实施例中,亲核衍生化试剂使抗生素物质稳定化超过12个小时。在特定实施例中,亲核衍生化试剂使抗生素物质稳定化超过24个小时,特别是超过48个小时。在特定实施例中,亲核衍生化试剂使抗生素物质稳定化超过2周。在特定实施例中,亲核衍生化试剂使抗生素物质稳定化超过2个月。在特定实施例中,亲核衍生化试剂使抗生素物质稳定化至少16个小时。在特定实施例中,亲核衍生化试剂使抗生素物质稳定化16个小时。在实施例中,亲核衍生化试剂是包含胺基的试剂,特别是伯胺或仲胺。在特定实施例中,亲核衍生化试剂是伯胺基团。在实施例中,亲核衍生化试剂包含多于3个c-原子,特别是3至20个c-原子。在特定实施例中,亲核衍生化试剂包含3至10个c-原子,特别是3至5个c-原子。在特定实施例中,亲
核衍生化试剂包含4个c-原子。在实施例中,亲核衍生化试剂是直链或支链的,特别是直链胺,特别是直链伯胺。在特定实施例中,亲核衍生化试剂是包括3至5个c-原子的直链伯胺。在实施例中,亲核衍生化试剂选自由以下项组成的组:丙胺、丁胺和戊胺。在特定实施例中,亲核衍生化试剂是直链伯丁胺。在实施例中,抗生素物质是包含β-内酰胺部分的抗生素物质,即,抗生素物质是β-内酰胺类抗生素。在实施例中,所述抗生素物质选自由以下项组成的组:阿莫西林、氨苄西林、巴坎西林、羧苄青霉素、氯唑西林、双氯西林、氟氯西林、美洛西林、萘夫西林、苯甲异噁唑青霉素、替莫西林、非奈西林、青霉素g、青霉素v、哌拉西林、阿洛西林、匹氨西林、匹美西林、替卡西林、头孢乙腈(氰甲基头孢菌素)、头孢拉定(cefadroxil)(头孢羟氨苄(cefadroxyl))、头孢氨苄(先锋霉素)、头孢氨苄(先锋霉素)、头孢来星(头孢菌素(cephaloglycin))、头孢洛宁(头孢烟酰(cephalonium))、头孢噻啶(头孢氯雷他定(cephaloradine))、头孢噻吩(先锋霉素i(cephalothin))、头孢噻吩(先锋霉素i)、头孢匹林(头孢吡林)、头孢曲嗪、头孢氮氟、头孢西酮、头孢唑啉(头孢唑林)、头孢拉定(头孢拉啶)、头孢拉定(头孢拉啶)、头孢甲氧环烯胺、头孢甲氧环烯胺、头孢替唑、头孢克洛、头孢孟多、头孢美唑、头孢尼西、头孢替坦、头孢西丁、头孢丙烯(头孢罗齐)、头孢呋辛、头孢唑南、头孢卡品、头孢达肟、头孢地尼、头孢托仑、头孢他美、头孢克肟、头孢甲肟、头孢地嗪、头孢噻肟、头孢咪唑、头孢泊肟、头孢特仑、头孢布烯、头孢噻呋、头孢噻林、头孢唑肟、头孢曲松、头孢哌酮、头孢他啶、头孢替啶、头孢吡肟、头孢瑞南、头孢噻利、头孢唑兰、头孢匹罗、头孢喹肟、头孢托罗、头孢洛林、头孢氯嗪、头孢洛仑、头孢帕罗、头孢卡奈、头孢屈洛、头孢吡酮、头孢三唑、头孢维曲、头孢马替林、头孢氯铵、头孢维星、头孢恶唑、头孢罗替、头孢舒米、头孢呋汀、头孢噻氧、头孢唑烷、亚胺培南、多利培南、厄他培南、美罗培南、氨曲南和美西林。在特定实施例中,抗生素物质是美罗培南或哌拉西林。在实施例中,抗生素物质和/或亲核衍生化试剂包含一种或多种同位素标记。在特定实施例中,该一种或多种同位素标记可包含在经衍生化的抗生素物质的亲核试剂衍生化单元和/或抗生素单元中。在特定实施例中,该一种或多种同位素标记包含在经衍生化的抗生素物质的抗生素单元中。在特定实施例中,该一种或多种同位素标记物是氘、
13
c、
15
n、和/或
18
o。在特定实施例中,所有同位素标记是相同的标记。在可替代的实施例中,同位素标记可以是不同的,即可以包括两种、三种或四种不同的同位素标记。在特定实施例中,经衍生化的抗生素物质的抗生素单元包含1至10个同位素标记。在特定实施例中,经衍生化的抗生素物质的抗生素单元包含1至8个同位素标记,特别是包含1至5个同位素标记。在特定实施例中,经衍生化的抗生素物质的抗生素单元包含1个、2个、3个、4个或5个同位素标记。在特定实施例中,经衍生化的抗生素物质的抗生素单元包含5个氘标记。在特定实施例中,其旨在使用经衍生化的抗生素物质作为校准品,该经衍生化的抗生素物质不包含同位素标记。在特定实施例中,其旨在使用经衍生化的抗生素物质作为istd,该经衍生化的抗生素物质包含至少一个同位素标记。
在第七方面,本发明涉及经衍生化的抗生素作为质谱测量中的istd和/或校准品的用途。在实施例中,抗生素物质由亲核衍生化试剂衍生。在特定实施例中,亲核衍生化试剂使抗生素物质稳定化。在实施例中,亲核衍生化试剂通过与抗生素物质反应形成复合物来防止水解。在实施例中,其中抗生素是含有β-内酰胺的抗生素,当复合物形成时β-内酰胺部分被破坏。所生成的复合物包含抗生素单元和亲核衍生化单元。在实施例中,亲核衍生化试剂使抗生素物质稳定化超过超过12个小时、超过24个小时、超过48个小时、超过7天、超过2周、超过4周、超过2个月、超过3个月、超过4个月、超过5个月或超过6个月。在特定实施例中,亲核衍生化试剂使抗生素物质稳定化超过12个小时。在特定实施例中,亲核衍生化试剂使抗生素物质稳定化超过24个小时,特别是超过48个小时。在特定实施例中,亲核衍生化试剂使抗生素物质稳定化超过2周。在特定实施例中,亲核衍生化试剂使抗生素物质稳定化超过2个月。在特定实施例中,亲核衍生化试剂使抗生素物质稳定化至少16个小时。在特定实施例中,亲核衍生化试剂使抗生素物质稳定化16个小时。在实施例中,亲核衍生化试剂是包含胺基的试剂,特别是伯胺或仲胺。在特定实施例中,亲核衍生化试剂是伯胺基团。在实施例中,亲核衍生化试剂包含多于3个c-原子,特别是3至20个c-原子。在特定实施例中,亲核衍生化试剂包含3至10个c-原子,特别是3至5个c-原子。在特定实施例中,亲核衍生化试剂包含4个c-原子。在实施例中,亲核衍生化试剂是直链或支链的,特别是直链胺,特别是直链伯胺。在特定实施例中,亲核衍生化试剂是包括3至5个c-原子的直链伯胺。在实施例中,亲核衍生化试剂选自由以下项组成的组:丙胺、丁胺和戊胺。在特定实施例中,亲核衍生化试剂是直链伯丁胺。在实施例中,抗生素物质是包含β-内酰胺部分的抗生素物质,即,抗生素物质是β-内酰胺类抗生素。在实施例中,所述抗生素物质选自由以下项组成的组:阿莫西林、氨苄西林、巴坎西林、羧苄青霉素、氯唑西林、双氯西林、氟氯西林、美洛西林、萘夫西林、苯甲异噁唑青霉素、替莫西林、非奈西林、青霉素g、青霉素v、哌拉西林、阿洛西林、匹氨西林、匹美西林、替卡西林、头孢乙腈(氰甲基头孢菌素)、头孢拉定(cefadroxil)(头孢羟氨苄(cefadroxyl))、头孢氨苄(先锋霉素)、头孢氨苄(先锋霉素)、头孢来星(头孢菌素(cephaloglycin))、头孢洛宁(头孢烟酰(cephalonium))、头孢噻啶(头孢氯雷他定(cephaloradine))、头孢噻吩(先锋霉素i(cephalothin))、头孢噻吩(先锋霉素i)、头孢匹林(头孢吡林)、头孢曲嗪、头孢氮氟、头孢西酮、头孢唑啉(头孢唑林)、头孢拉定(头孢拉啶)、头孢拉定(头孢拉啶)、头孢甲氧环烯胺、头孢甲氧环烯胺、头孢替唑、头孢克洛、头孢孟多、头孢美唑、头孢尼西、头孢替坦、头孢西丁、头孢丙烯(头孢罗齐)、头孢呋辛、头孢唑南、头孢卡品、头孢达肟、头孢地尼、头孢托仑、头孢他美、头孢克肟、头孢甲肟、头孢地嗪、头孢噻肟、头孢咪唑、头孢泊肟、头孢特仑、头孢布烯、头孢噻呋、头孢噻林、头孢唑肟、头孢曲松、头孢哌酮、头孢他啶、头孢替啶、头孢吡肟、头孢瑞南、头孢噻利、头孢唑兰、头孢匹罗、头孢喹肟、头孢托罗、头孢洛林、头孢氯嗪、头孢洛仑、头孢帕罗、头孢卡奈、头孢屈洛、头孢吡酮、头孢三唑、头孢维曲、头孢马替林、头孢氯铵、头孢维星、头孢恶唑、头孢罗替、头孢舒米、头孢呋汀、头孢噻氧、头孢唑烷、亚胺培南、
多利培南、厄他培南、美罗培南、氨曲南和美西林。在特定实施例中,抗生素物质是美罗培南或哌拉西林。在实施例中,抗生素物质和/或亲核衍生化试剂包含一种或多种同位素标记。在特定实施例中,该一种或多种同位素标记可包含在复合物的亲核试剂衍生化单元和/或抗生素单元中。在特定实施例中,该一种或多种同位素标记包含在复合物的抗生素单元中。在特定实施例中,该一种或多种同位素标记物是氘、
13
c、
15
n、和/或
18
o。在特定实施例中,所有同位素标记是相同的标记。在可替代的实施例中,同位素标记可以是不同的,即可以包括两种、三种或四种不同的同位素标记。在特定实施例中,复合物的抗生素单元包含1至10个同位素标记。在特定实施例中,复合物的抗生素单元包含1至8个同位素标记,特别是包含1至5个同位素标记。在特定实施例中,复合物的抗生素单元包含1个、2个、3个、4个或5个同位素标记。在特定实施例中,复合物的抗生素单元包含5个氘标记。在特定实施例中,经衍生化的抗生素物质用作校准品并且不包含同位素标记。在特定实施例中,经衍生化的抗生素物质用作istd并且包含至少一个同位素标记。在第八方面,本发明涉及一种生产经稳定的抗生素物质的方法,所述方法包括用亲核衍生化试剂衍生化所述抗生素物质。在实施例中,与存在的抗生素物质的量相比,以至少2.5e8的过量,特别是1e5和1e10之间的过量提供亲核衍生化试剂。在实施例中,亲核衍生化试剂是包含胺基的试剂,特别是伯胺或仲胺。在特定实施例中,亲核衍生化试剂是伯胺基团。在实施例中,亲核衍生化试剂包含多于3个c-原子,特别是3至20个c-原子。在特定实施例中,亲核衍生化试剂包含3至10个c-原子,特别是3至5个c-原子。在特定实施例中,亲核衍生化试剂包含4个c-原子。在实施例中,亲核衍生化试剂是直链或支链的,特别是直链胺,特别是直链伯胺。在特定实施例中,亲核衍生化试剂是包括3至5个c-原子的直链伯胺。在实施例中,亲核衍生化试剂选自由以下项组成的组:丙胺、丁胺和戊胺。在特定实施例中,亲核衍生化试剂是直链伯丁胺。在实施例中,抗生素物质是包含β-内酰胺部分的抗生素物质,即,抗生素物质是β-内酰胺类抗生素。在实施例中,所述抗生素物质选自由以下项组成的组:阿莫西林、氨苄西林、巴坎西林、羧苄青霉素、氯唑西林、双氯西林、氟氯西林、美洛西林、萘夫西林、苯甲异噁唑青霉素、替莫西林、非奈西林、青霉素g、青霉素v、哌拉西林、阿洛西林、匹氨西林、匹美西林、替卡西林、头孢乙腈(氰甲基头孢菌素)、头孢拉定(cefadroxil)(头孢羟氨苄(cefadroxyl))、头孢氨苄(先锋霉素)、头孢氨苄(先锋霉素)、头孢来星(头孢菌素(cephaloglycin))、头孢洛宁(头孢烟酰(cephalonium))、头孢噻啶(头孢氯雷他定(cephaloradine))、头孢噻吩(先锋霉素i(cephalothin))、头孢噻吩(先锋霉素i)、头孢匹林(头孢吡林)、头孢曲嗪、头孢氮氟、头孢西酮、头孢唑啉(头孢唑林)、头孢拉定(头孢拉啶)、头孢拉定(头孢拉啶)、头孢甲氧环烯胺、头孢甲氧环烯胺、头孢替唑、头孢克洛、头孢孟多、头孢美唑、头孢尼西、头孢替坦、头
孢西丁、头孢丙烯(头孢罗齐)、头孢呋辛、头孢唑南、头孢卡品、头孢达肟、头孢地尼、头孢托仑、头孢他美、头孢克肟、头孢甲肟、头孢地嗪、头孢噻肟、头孢咪唑、头孢泊肟、头孢特仑、头孢布烯、头孢噻呋、头孢噻林、头孢唑肟、头孢曲松、头孢哌酮、头孢他啶、头孢替啶、头孢吡肟、头孢瑞南、头孢噻利、头孢唑兰、头孢匹罗、头孢喹肟、头孢托罗、头孢洛林、头孢氯嗪、头孢洛仑、头孢帕罗、头孢卡奈、头孢屈洛、头孢吡酮、头孢三唑、头孢维曲、头孢马替林、头孢氯铵、头孢维星、头孢恶唑、头孢罗替、头孢舒米、头孢呋汀、头孢噻氧、头孢唑烷、亚胺培南、多利培南、厄他培南、美罗培南、氨曲南和美西林。在特定实施例中,抗生素物质是美罗培南或哌拉西林。在实施例中,抗生素物质和/或亲核衍生化试剂包含一种或多种同位素标记。在特定实施例中,该一种或多种同位素标记可包含在复合物的亲核试剂衍生化单元和/或抗生素单元中。在特定实施例中,该一种或多种同位素标记包含在复合物的抗生素单元中。在特定实施例中,该一种或多种同位素标记物是氘、
13
c、
15
n、和/或
18
o。在特定实施例中,所有同位素标记是相同的标记。在可替代的实施例中,同位素标记可以是不同的,即可以包括两种、三种或四种不同的同位素标记。在特定实施例中,复合物的抗生素单元包含1至10个同位素标记。在特定实施例中,复合物的抗生素单元包含1至8个同位素标记,特别是包含1至5个同位素标记。在特定实施例中,复合物的抗生素单元包含1个、2个、3个、4个或5个同位素标记。在特定实施例中,复合物的抗生素单元包含5个氘标记。本发明进一步涉及以下项目:1)一种复合物,所述复合物由抗生素物质和亲核衍生化试剂形成。2)根据项目1所述的复合物,其中,所述亲核衍生化试剂是包含胺基,特别是伯胺或仲胺,特别是包含伯胺基团的试剂。3)根据项目1或2所述的复合物,其中所述亲核衍生化试剂包含超过3个c-原子,特别是3至20个c-原子,特别是3至10个c-原子,特别是3至5个c-原子,特别是4个c-原子。4)根据项目1至3中任一项所述的复合物,其中所述亲核衍生化试剂是直链或支链的,特别是直链胺,特别是直链伯胺,特别是包含3至5个c-原子的直链伯胺。5)根据项目1至4中任一项所述的复合物,其中所述衍生化试剂选自由以下项组成的组:丙胺、丁胺或戊胺,特别是直链伯丁胺。6)根据项目1至5中任一项所述的复合物,其中所述抗生素物质是β-内酰胺类抗生素物质。7)根据项目1至6中任一项所述的复合物,所述抗生素物质选自由以下项组成的组:阿莫西林、氨苄西林、巴坎西林、羧苄青霉素、氯唑西林、双氯西林、氟氯西林、美洛西林、萘夫西林、苯甲异噁唑青霉素、替莫西林、非奈西林、青霉素g、青霉素v、哌拉西林、阿洛西林、匹氨西林、匹美西林、替卡西林、头孢乙腈(氰甲基头孢菌素)、头孢拉定(cefadroxil)(头孢羟氨苄(cefadroxyl))、头孢氨苄(先锋霉素)、头孢氨苄(先锋霉素)、头孢来星(头孢菌素(cephaloglycin))、头孢洛宁(头孢烟酰(cephalonium))、头孢噻啶(头孢氯雷他定(cephaloradine))、头孢噻吩(先锋霉素i(cephalothin))、头孢噻吩(先锋霉素i)、头孢匹林(头孢吡林)、头孢曲嗪、头孢氮氟、头孢西酮、头孢唑啉(头孢唑林)、头孢拉定(头孢拉啶)、头孢拉定(头孢拉啶)、头孢甲氧环烯胺、头孢甲氧环烯胺、头孢替唑、头孢克洛、头孢孟
多、头孢美唑、头孢尼西、头孢替坦、头孢西丁、头孢丙烯(头孢罗齐)、头孢呋辛、头孢唑南、头孢卡品、头孢达肟、头孢地尼、头孢托仑、头孢他美、头孢克肟、头孢甲肟、头孢地嗪、头孢噻肟、头孢咪唑、头孢泊肟、头孢特仑、头孢布烯、头孢噻呋、头孢噻林、头孢唑肟、头孢曲松、头孢哌酮、头孢他啶、头孢替啶、头孢吡肟、头孢瑞南、头孢噻利、头孢唑兰、头孢匹罗、头孢喹肟、头孢托罗、头孢洛林、头孢氯嗪、头孢洛仑、头孢帕罗、头孢卡奈、头孢屈洛、头孢吡酮、头孢三唑、头孢维曲、头孢马替林、头孢氯铵、头孢维星、头孢恶唑、头孢罗替、头孢舒米、头孢呋汀、头孢噻氧、头孢唑烷、亚胺培南、多利培南、厄他培南、美罗培南、氨曲南和美西林。8)根据项目1至6中任一项所述的复合物,其中所述抗生素物质是美罗培南或哌拉西林。9)根据项目1至8中任一项所述的复合物,其包含同位素标记。10)一种包含根据项目1至9中任一项所述的复合物的组合物。11)包括根据项目1至9中任一项所述的复合物的组合物,其中所述组合物进一步包括溶剂,特别是选自由以下项组成的组的溶剂:水、ch3cn、thf、二噁烷、dmf、dmso、丙酮、叔丁醇、二甘醇二甲醚、dme、meoh、etoh、1-proh、2-proh、乙二醇、六甲基磷酰胺(hmpa)、六甲基亚磷酰三胺(hmpt)和甘油。12)根据项目11所述的组合物,其中所述溶剂选自由以下项组成的组:水、ch3cn、thf、二噁烷、dmf、dmso、丙酮、叔丁醇、二甘醇二甲醚和dme。13)根据项目11或12中任一项所述的组合物,所述组合物进一步还包括稳定且可与水混溶的非亲核碱,特别是选自由以下项组成的组:dbu、na3po4、na2co3、和cs2co3。14)一种试剂盒,所述试剂盒包括a)根据项目1至9中任一项所述的复合物或根据仙姑10至13中任一项所述的组合物,以及b)包装插页。15)根据项目1至9中任一项所述的复合物、或根据项目10至13中任一项所述的组合物、或根据项目14所述的试剂盒用于质谱测量的用途。16)根据项目1至9中任一项所述的复合物、或根据项目10至13中任一项所述的组合物、或根据项目14所述的试剂盒作为用于质谱测量的内标和/或校准品的用途。17)亲核衍生化试剂稳定化抗生素物质的用途,所述抗生素物质特别是适合作为质谱测量中的istd和/或校准品。18)根据项目17所述的用途,其中,所述亲核衍生化试剂是包含胺基,特别是伯胺或仲胺,特别是包含伯胺基团的试剂。19)根据项目17或18所述的用途,其中亲核衍生化试剂包含超过3个c-原子,特别是3至20个c-原子,特别是3至10个c-原子,特别是3至5个c-原子,特别是4个c-原子。20)根据项目17至19中任一项所述的用途,其中所述亲核衍生化试剂是直链或支链的,特别是直链胺,特别是直链伯胺,特别是包含3至5个c-原子的直链伯胺。21)根据项目17至20中任一项所述的用途,其中所述衍生化试剂选自由以下项组成的组:丙胺、丁胺或戊胺,特别是直链伯丁胺。22)根据项目17至21中任一项所述的用途,其中所述抗生素物质是β-内酰胺类抗生素物质。23)根据项目17至22中任一项所述的用途,所述抗生素物质选自由以下项组成的组:阿莫西林、氨苄西林、巴坎西林、羧苄青霉素、氯唑西林、双氯西林、氟氯西林、美洛西林、
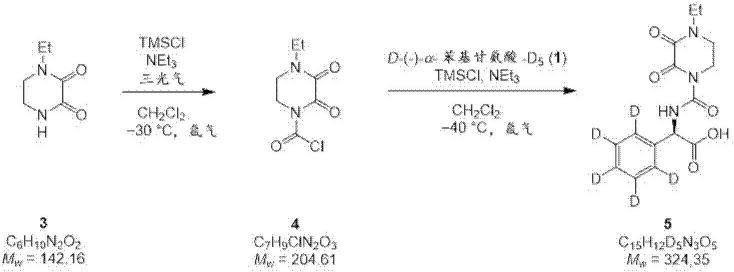
萘夫西林、苯甲异噁唑青霉素、替莫西林、非奈西林、青霉素g、青霉素v、哌拉西林、阿洛西林、匹氨西林、匹美西林、替卡西林、头孢乙腈(氰甲基头孢菌素)、头孢拉定(cefadroxil)(头孢羟氨苄(cefadroxyl))、头孢氨苄(先锋霉素)、头孢氨苄(先锋霉素)、头孢来星(头孢菌素(cephaloglycin))、头孢洛宁(头孢烟酰(cephalonium))、头孢噻啶(头孢氯雷他定(cephaloradine))、头孢噻吩(先锋霉素i(cephalothin))、头孢噻吩(先锋霉素i)、头孢匹林(头孢吡林)、头孢曲嗪、头孢氮氟、头孢西酮、头孢唑啉(头孢唑林)、头孢拉定(头孢拉啶)、头孢拉定(头孢拉啶)、头孢甲氧环烯胺、头孢甲氧环烯胺、头孢替唑、头孢克洛、头孢孟多、头孢美唑、头孢尼西、头孢替坦、头孢西丁、头孢丙烯(头孢罗齐)、头孢呋辛、头孢唑南、头孢卡品、头孢达肟、头孢地尼、头孢托仑、头孢他美、头孢克肟、头孢甲肟、头孢地嗪、头孢噻肟、头孢咪唑、头孢泊肟、头孢特仑、头孢布烯、头孢噻呋、头孢噻林、头孢唑肟、头孢曲松、头孢哌酮、头孢他啶、头孢替啶、头孢吡肟、头孢瑞南、头孢噻利、头孢唑兰、头孢匹罗、头孢喹肟、头孢托罗、头孢洛林、头孢氯嗪、头孢洛仑、头孢帕罗、头孢卡奈、头孢屈洛、头孢吡酮、头孢三唑、头孢维曲、头孢马替林、头孢氯铵、头孢维星、头孢恶唑、头孢罗替、头孢舒米、头孢呋汀、头孢噻氧、头孢唑烷、亚胺培南、多利培南、厄他培南、美罗培南、氨曲南和美西林。24)根据项目17至23中任一项所述的用途,其中所述抗生素物质是美罗培南或哌拉西林。25)根据项目17至24中任一项所述的用途,其中所述亲核衍生化试剂防止所述抗生素物质水解。26)根据项目17至25中任一项所述的用途,其中所述亲核衍生化试剂稳定所述抗生素物质超过12个小时。27)一种经衍生化的抗生素物质,其适合作为质谱测量中的istd。28)经衍生化的抗生素作为质谱测量中的istd和/或校准品的用途。29)一种生产经稳定的抗生素物质的方法,所述方法包括用亲核衍生化试剂对所述抗生素物质进行衍生化。30)根据项目29所述的方法,其中与存在的抗生素物质的量相比,以至少2.5e8的过量,特别是1e5和1e10之间的过量提供亲核衍生化试剂。实例提供以下实施例以说明本发明,但不限制受权利要求书保护的本发明。通用方法:所有反应采用标准schlenk技术在惰性气体(n2或氩气)的正压下磁力搅拌和进行。玻璃器皿在使用前在620℃真空下反复干燥。液体试剂和溶剂借助注射器或烘干的不锈钢套管通过橡胶隔片进行添加。固体在惰性气体逆流下进行添加或将其溶解在合适的溶剂中。低温反应在装有以下冷却剂的杜瓦瓶中进行:丙酮/干冰(-78℃)或h2o/冰(0℃)。高于室温的反应温度在加热的油浴中进行。如果遵循文献已知的程序,则将相应的参考添加到实验细节中。如果没有另外说明,则产率是指分离的均质和光谱纯材料。溶剂和试剂:干燥的溶剂,例如二氯甲烷(ch2cl2)、四氢呋喃(thf)、吡啶、n,n-二甲基甲酰胺(dmf)以及乙腈(mecn)购自商业供应商并按原样使用。用于萃取和快速柱色谱的溶剂以hplc等级购买。d-(-)-α-苯基甘氨酸-d5(1,图6)购自toronto research chemicals(加拿大多伦多研究化学)。化合物s2(图7)购自ambeed inc.(安比德公司)。化合物2(图6)根据de rosa等人(molecules 2015,20,22044-22057)由( )-6-氨基青霉烷酸(s1,图6)进
行合成。所有其他试剂和溶剂均购自化学品供应商(sigma-aldrich(西格玛奥德里奇)、acros有机物、阿法埃莎、tci欧洲、abcr)并按原样使用。核磁共振光谱:nmr光谱是在配备了onenmr探针的安捷伦400-mr dd2400mhz光谱仪上进行测量的,该探头在400mhz下运行,用于质子核(100mhz用于碳核)。dmso-d6和cdcl3购自西格玛奥德里奇。1h的nmr位移以ppm为单位进行报告,与tms的残余位移有关。将1h的nmr位移校准到残余溶剂共振:dmso-d6(2.50ppm)以及cdcl3(7.26ppm)。将
13
c nmr位移校准到残余溶剂共振的多重信号的中心:dmso-d6(29.84ppm)以及cdcl3(77.16ppm)。1h的nmr光谱数据报告如下:以ppm为单位的化学位移(多重性、耦合常数j、积分强度)。多重性缩写为s(单峰)、br(宽信号)、d(双重峰)、t(三重峰)、q(四重峰)、m(多重峰)和mc(中心对称多重峰)。在组合多重性的情况下,首先表述具有较小耦合常数的多重性。除多重峰外,所有信号,以及除中心对称多重峰外的化学位移被报告为共振范围的中心。耦合常数j以hz为单位进行报告。使用来自化学新技术开发公司的acd/spectrus处理器2015.2.7程序来分析所有nmr光谱。质谱:低分辨率质谱(lrms)记录在来自waters gmbh(沃特斯股份有限公司)的hplc-ms系统(2695分离模块,996光电二极管阵列检测器,micromasszq,grace vydac 218tp c18 5u)上,该系统通过waters(沃特斯)masslynx v4.1进行计算机控制。每种分析物仅表明特征分子片段或分子离子峰。实例1:天然哌拉西林(化合物5,参见图1)的稳定性研究了天然哌拉西林及其水解形式的稳定性(分别为化合物5、化合物9a、化合物9b和化合物10。从哌拉西林(化合物5,参见图1中的示意图)的水解途径可以明显看出,该化合物在哌嗪环和内酰胺部分均发生水解,仅监测两种化合物中的一种以解释天然哌拉西林的损失或降解(化合物5))。为此,将这些化合物新鲜称量并通过在室温下翻滚或搅拌15分钟以1mg/ml的浓度溶解在水中。随后,将这些化合物稀释至5μg/ml,并在0、2、4、6、8和16小时的时间点使用合适的lc-ms/ms方法进行测量。为此,将含有溶剂a:含0.1%hcooh的水和溶剂b:含0.1%的hcooh的ch3cn且流量为每分钟0.6ml的sunshell(桑莎)c18(2.6μm,2.1mm
×
50mm)色谱柱用于连接至ab sciex(爱博才思)6500 ms的安捷伦infinity ii多进样器/泵系统上。使用multiquant(多组分定量)软件对这些峰进行积分,这些峰的面积在图2a和图2b的图表中进行描绘。图2a和图2b分别示出了天然哌拉西林(化合物5)及其水解形式(化合物9a/9b)的一个mrm转换所获得的面积。很明显,所获得的峰面积随时间显着变化(f检验,得到的p值《0.0001),天然形式的峰面积减小,水解形式的峰面积(化合物9a/9b)显著增加(f检验,得到的p值<0.0001)。其原因在于水解或水解反应(如图1所示意性地描绘的)。实例2:哌拉西林-d5一水合物(8)及其一正丁胺加成产物(9)(示意图和化合物编号参见图6)所有反应采用标准schlenk技术在惰性气体(n2或氩气)的正压下磁力搅拌和进行。玻璃器皿在使用前在620℃真空下反复干燥。液体试剂和溶剂借助注射器或烘干的不锈钢套管通过橡胶隔片进行添加。固体在惰性气体逆流下进行添加或将其溶解在合适的溶剂中。低温反应在装有以下冷却剂的杜瓦瓶中进行:丙酮/干冰(-78℃)或h2o/冰(0℃)。高于室温的反应温度在加热的油浴中进行。如果遵循文献已知的程序,则将相应的参考添加到
实验细节中。如果没有另外说明,则产率是指分离的均质和光谱纯材料。溶剂和试剂:干燥的溶剂,诸如二氯甲烷(ch2cl2)、四氢呋喃(thf)和乙腈(mecn)购自商业供应商并按原样使用。用于萃取和快速柱色谱的溶剂以hplc等级购买。d-(-)-α-苯基甘氨酸-d5(1)购自toronto rsearch chemicals(加拿大多伦多研究化学)。化合物2根据de rosa等人2015(molecules 2015,20,22044-22057)由( )-6-氨基青霉酸(s1)来合成。所有其他试剂和溶剂均购自化学品供应商(sigma-aldrich(西格玛奥德里奇)、acros有机物、阿法埃莎、tci欧洲、abcr)并按原样使用。合成程序酸(5):在氩气气氛下在室温下,将1-乙基哌嗪-2,3-二酮(455mg,3.20mmol,1.00eq.)溶解在干燥的二氯甲烷(8.9ml)中。冷却至0℃后,添加干燥的三乙胺(616μl,4.42mmol,1.38eq.),然后添加tmscl(447μl,3.53mmol,1.10eq.)并将所得的混合物在室温下搅拌1小时。然后将反应冷却至-30℃,一次性添加三光气(361mg,1.21mmol,0.38eq.),再继续搅拌1小时。在真空中彻底干燥所得的为湿敏泡沫的中间体4,将其直接重新溶解在干燥的二氯甲烷(8.9ml)中用于进一步合成。同时,将d-(-)-α-苯基甘氨酸(1,500mg,3.20mmol1.00eq.)在室温下在氮气气氛下溶解在干燥的二氯甲烷(8.9ml)中。另外,添加干燥的三乙胺(693μl,6.72mmol,2.10eq.),然后添加tmscl(894μl,7.04mmol,2.20eq.),并将所得的混合物在室温下搅拌两小时。之后,在-40℃下添加预先制备的中间体4溶液,搅拌反应30分钟,升温至0℃,再搅拌一小时。通过添加去离子水(约10ml)来淬灭反应。在真空中除去二氯甲烷后,将所得水性悬浮液与乙酸乙酯(约50ml)混合。通过添加固体nahco3将水相的ph调节至8.0,然后分离各层。将水层用乙酸乙酯(20ml,三次)洗涤。然后在用乙酸乙酯(50ml,5次)萃取之前,通过添加浓hcl水溶液而将水相调节至ph=2.0。将合并的有机层经na2so4干燥,过滤,并且在真空中浓缩。因此,获得酸5(1.04g,3.04mmol,95%),为具有残余含量的乙酸乙酯(约5wt-%)的无色泡沫。1h nmr(cdcl3,400
°
mhz):δ=9.88(d,j=6.52hz,1h),5.49(d,6.52hz,1h),4.15-3.99(m,2h),3.60-3.48(m,4h),1.20(t,j=7.65hz,3h)ppm。
13
c nmr(cdcl3,100mhz):δ=173.2、159.1、155.7、152.2、134.9、128.7-126.5(3c)、55.8、43.5、42.6、40.3、12.0ppm。用于c
15h13
d5n3o
5
[mh
]的esi-lrms:计算。325.2发现值325.2.
酯(6):将酸5(932mg,2.87mmol,1.00eq.)和hatu(1.26g,3.30mmol,1.15eq.)在氩气气氛和室温下悬浮在干燥的四氢呋喃(9.4ml)中。冷却至0℃后,添加干燥的dipea(538μl,3.09mmol,1.08eq.)的干燥的四氢呋喃(3.0ml)溶液并将所得的混合物搅拌5分钟。此后,缓慢添加物质2(880mg,2.87mmol,1.00eq.)的干燥四氢呋喃(3.0ml)溶液,并在0℃下继续搅拌三小时。通过添加乙酸乙酯(100ml)、磷酸盐缓冲液水溶液(0.2m,ph=7.0,40ml)和盐水(40ml)的搅拌双相混合物来淬灭反应。分离各层,并用乙酸乙酯(50ml,三次)萃取水相。在合并有机层后,经na2so4干燥,随后在真空中过滤并浓缩,得到呈淡黄色的泡沫的粗酯6。通过hplc(c-18反相硅胶,mecn:h2o)实现最终纯化,得到呈无色泡沫的酯6(1.34g,2.19mmol,76%)。1h nmr(cdcl3,400mhz):δ=9.93(d,j=6.52hz,1h),7.40-7.32(m,5h),6.46(d,j=9.16hz,1h),5.64(dd,j=4.02,9.16hz,1h),5.45(d,j=3.64hz,1h),5.44(d,j=6.52hz,1h),5.16(s,2h),4.39(s,1h),4.18-4.12(m,1h),3.99-3.93(m,1h),3.55(mc,4h)1.48(s,3h),1.34(s,3h),1.21(t,j=7.63hz,3h)ppm。
13
c nmr(cdcl3,100mhz):δ=173.3、168.9、167.5、159.4、155.8、152.6、136.2、134.8、128.9-128.8、134.9、127.4-126.9(3c)、70.1、68.2、67.7、64.9、59.2、58.9、43.8、42.8、40.8、31.8、26.9、12.3ppm。用于c
30h29
d5n5o7s
[mh
]的esi-lrms:计算。613.2发现值613.2.丁酰胺(7):将酯6(100mg,0.16mmol,1.00eq.)在室温下在氩气气氛下溶解在干燥的ch3cn(2.5ml)中。另外,添加正丁胺(161μl,1.63mmol,10.0eq.)在干燥的ch3cn(2.5ml)中的溶液,并将所得的混合物搅拌两小时,直到对照通过lcms表明物质6完全消耗。通过添加乙酸乙酯(40ml)、磷酸盐缓冲液水溶液(0.2m,ph=7.0,10ml)和盐水(10ml)的搅拌双相混合物来淬灭反应。分离各层,并用乙酸乙酯(30ml,四次)萃取水相。在合并有机层后,经na2so4干燥,随后在真空中过滤并浓缩,得到呈淡黄色的泡沫的粗丁酰胺7。通过hplc(c-18
反相硅胶,mecn:h2o,标准梯度洗脱)实现最终纯化,在7:7’=95:5(通过1h nmr测定)的非对映异构体混合物中得到呈无色固体的丁酰胺7(99.2mg,0.15mmol,89%)。1h nmr(cdcl3,400mhz):δ=9.88(d,j=7.53hz,1h),7.44-7.29(m,5h),6.70-6.55(m,2h),5.33(d,j=5.90hz,1h),5.25-5.11(m,3h),4.41(dd,j=4.96,7.53hz,1h),4.09(ddd,j=3.64,7.03,13.8hz,2h),3.96(ddd,j=3.89,8.09,13.8hz,2h),3.60-3.45(m,4h),3.42-3.29(m,2h),3.27-3.14(m,2h),1.50-1.42(m,2h),1.38-1.26(m,2h),1.34(s,3h),1.21(t,j=7.22hz,3h),1.05(s,3h),0.89(t,j=7.34hz,3h)ppm。非对映异构体17
‘
的特征信号:δ=6.78(d,j=7.15hz,1h),6.52-6.46(m,1h),5.38(d,j=6.02hz,1h),1.12(s,3h)ppm。
13
c nmr(cdcl3,100mhz):δ=169.8、169.2、168.8、159.4、155.8、152.7、136.2、135.1、128.9、128.8、128.8、72.7、67.4、64.9、59.6、58.3、57.4、43.8、42.8、40.7、39.7、31.6、26.4、26.3、20.2、13.9、12.3ppm。备注:由于谱线增宽,氘取代的碳原子无法被检测到,这是由与氘的邻耦而导致的。用于c
34h40
d5n6o7s
[mh
]的esi-lrms:计算。686.3发现值686.3.哌拉西林-d5一水合物(8):将酯6(340mg,0.56mmol,1.00eq.)在室温下在氩气气氛下溶解在干燥的四氢呋喃(17ml)中。另外,添加脱气的去离子水(8.5ml)和钯/碳(10wt-%pd,200mg,0.18mmol,0.33eq.pd)。在剧烈搅拌下,将所得的悬浮液用氢气吹扫(1个大气压,3次),然后氢化一小时。经硅藻土塞过滤(用h2o:ch3cn=1∶1,约50ml进行洗涤)后,将所得的双相混合物在真空中浓缩(最高30℃),得到无色泡沫。将由此获得的粗品8重新溶解在去离子水(3.4ml)、甲酸(105μl,2.78mmol,5.00eq.)和乙腈(1.7ml)的混合物中,并通过hplc(c-18反相硅胶,mecn:h2o,标准梯度洗脱)进行纯化。浓缩并在真空中彻底干燥(最高30℃)后,将半纯物质8(50.0mg)溶解在甲醇(1.00ml)中。在搅拌下逐滴加入去离子水(1.85ml),直到混合物慢慢变浑浊。冷却至0℃30分钟后,逐滴加入另外的去离子水(1.00ml)并将悬浮液冷却至0℃保持30分钟。然后,从形成的晶体中除去上清液。用冰冷的去离子水(1.00ml,2次)洗涤后,将剩余的固体在真空中彻底干燥(最高30℃),得到纯度为95.7%(通过hplc/uv-vis进行测量)的呈无色固体的哌拉西林-d5一水合物(8,234mg,0.43mmol,77%)。1h nmr(dmso-d6,400mhz):δ=13.35(br,s,1h),9.84(d,j=7.28hz,1h),9.31(d,j=7.78hz,1h),5.71(d,j=7.28hz,1h),5.53(dd,j=5.53,7.78hz,1h),5.38(d,j=4.14hz,1h),4.19(s,1h),3.89(mc,2h),3.56(t,j=5.53hz,2h),3.39(q,j=7.07hz,2h),
1.54(s,3h),1.39(s,3h),1.08(t,j=7.07hz,3h)ppm.
13
c nmr(cdcl3,100mhz):δ=173.2、169.4、168.9、159.5、1554、1519、1377、703、670、637、581、565、428、416、302、26.6、16.0、11.9ppm。备注:由于谱线增宽,氘取代的碳原子无法被检测到,这是由与氘的邻耦而导致的。用于c
23h23
d5n5o7s
[mh
]的esi-lrms:计算。523.2发现值523.2.哌拉西林-正-丁酰胺-d5(9):将丁酰胺7(95.0mg,0.14mmol,1.00eq.)在室温下在氩气气氛下溶解在干燥的四氢呋喃(4.0ml)中。另外,添加脱气的去离子水(2.0ml)和钯/碳(10wt-%pd,74.2mg,0.07mmol,0.50eq.pd)。在剧烈搅拌下,将所得的悬浮液用氢气吹扫(1个大气压,3次),然后氢化一小时。经硅藻土塞过滤(用h2o:ch3cn=1∶1,约25ml进行洗涤)后,将所得的双相混合物在真空中浓缩(最高30℃),得到无色泡沫。将由此获得的粗品9重新溶解在去离子水(0.5ml)、甲酸(26.2μl,0.70mmol,5.00eq.)和乙腈(1.0ml)的混合物中,并通过hplc(c-18反相硅胶,mecn:h2o)进行纯化。在真空中(最高30℃)浓缩并彻底干燥后,在9:9’=70:30(通过hplc/uv-vis进行测量)的非对映异构体混合物中获得纯度为95.8%(通过hplc/uv-vis进行测量)的呈无色固体的哌拉西林-正-丁酰胺-d5(9,52.4mg,0.08mmol,63%)。1h nmr(dmso-d6,400mhz):δ=12.86(br,s,1h,19 19’),9.84(d,j=7.53hz,1h,19’),9.84(d,j=7.53hz,1h,19),8.84(d,j=8.78hz,1h,19’),8.72(d,j=9.03hz,1h,19),8.18(t,j=6.02hz,1h,19’),8.02(t,j=5.77hz,1h,19),5.72(d,j=7.53hz,1h,19 19’),4.84(d,j=6.40hz,1h,9),4.71(br,d,j=5.90hz,1h,19’),4.63(dd,j=6.40,8.78hz,1h,19’),4.34(dd,j=7.03,9.03hz,1h,19’),3.92-3.87(m,2h,19 19’),3.57-3.53(m,2h,19 19’),3.44-3.36(m,4h,19 19’),3.16-2.95(m,2h,19 19’),1.48(s,3h,19’),1.40-1.23(m,4h,19 19’),1.30(s,3h,19),1.10(s,3h,19),1.08(t,j=7.40hz,1h,19 19’),0.93(s,3h,19’),0.86(t,j=7.22hz,1h,19 19’)ppm.用于c
27h34
d5n6o7s
[mh
]的esi-lrms:计算。596.3发现值596.3.实例3:美罗培南-13c2-15n1三水合物(7)、美罗培南-13c2-15n-正-丁酰胺(8)的合成(示意图和化合物编号参见图7)所有反应采用标准schlenk技术在惰性气体(n2或氩气)的正压下磁力搅拌和进行。玻璃器皿在使用前在620℃真空下反复干燥。液体试剂和溶剂借助注射器或烘干的不锈钢套管通过橡胶隔片进行添加。固体在惰性气体逆流下进行添加或将其溶解在合适的溶剂中。低温反应在装有以下冷却剂的杜瓦瓶中进行:丙酮/干冰(-78℃)或h2o/冰(0℃)。高于
室温的反应温度在加热的油浴中进行。如果遵循文献已知的程序,则将相应的参考添加到实验细节中。如果没有另外说明,则产率是指分离的均质和光谱纯材料。溶剂和试剂:干燥的溶剂,诸如二氯甲烷(ch2cl2)、四氢呋喃(thf)和乙腈(mecn)购自商业供应商并按原样使用。用于萃取和快速柱色谱的溶剂以hplc等级购买。所有其他试剂和溶剂均购自化学品供应商(sigma-aldrich(西格玛奥德里奇)、acros有机物、阿法埃莎、tci欧洲、abcr)并按原样使用。
[0001]
:将反式-4-羟基-l-脯氨酸(s1,1.0g,7.6mmol,1.0eq.)溶解在naoh水溶液中(0.5m,34ml)并在冰浴中冷却。在0-5℃下,逐滴加入溶于甲苯(25ml)中的4-硝基苯甲酰氯甲酸酯(1.9g,8.6mmol,1.1eq.)。将两相混合物搅拌两小时,然后加入甲苯(30ml)并将各相分离。用甲苯萃取水相,且合并的有机相用naoh水溶液(0.5m)进行萃取。合并水相,通过加入浓hcl溶液调节至ph=1,并用乙酸乙酯萃取(3次)。萃取物经硫酸钠干燥、过滤,并且在真空中浓缩。因此,获得化合物1(1.89g,6.1mmol,80%),为灰白色固体。用于c
13h15
n2o
7
[mh
]的esi-lrms:计算。311.1发现值311.2
[0002]
:将物质1(1.4g,4.5mmol,1.0eq.)溶解在乙腈(70ml)和1.7g hbtu(1.7g,4.5mmol,1.0eq.)中,并在氮气气氛在室温下依序加入416mg的二甲基胺-13c2-15
n盐酸盐(0.4g,5.1mmol,1.1eq.)和2.6ml的三乙基胺(2.6ml,19mmol,4.2eq.)。将该混合物搅拌90分钟。然后将乙腈蒸发。将粗产物悬浮在乙酸乙酯(20ml)中并过滤。滤液用饱和碳酸氢盐溶液洗涤数次。将乙酸乙酯蒸发,并将所得的固体储存在-20℃下。将产物再次悬浮在乙酸乙酯(20ml)中并过滤。将滤液浓缩至10ml的体积,并将溶液冷却至0℃。将形成的沉淀过滤,并在真空中干燥,得到呈灰白色固体的物质2(1.27g,3.7mmol,83%)。用于c
1313
c2h
20n215
no
6
[mh
]的esi-lrms:计算。341.3发现值341.1
[0003]
:将物质2(1.16g,3.41mmol,1.00eq.)在真空中干燥,并在氩气气氛下溶解在无水吡啶(9.0ml)中。加入甲磺酰氯(0.53ml,6.82mmol,2.00eq.)并将所得的混合物在室温下搅拌45分钟。在真空中除去吡啶,并加入乙酸乙酯(200ml)和饱和碳酸氢盐水溶液(100ml)。将层混合、分离并用饱和碳酸氢盐水溶液(100ml)萃取有机相。有机相经硫酸钠干燥,过滤并在真空中浓缩,得到呈灰白色固体的物质3(1.44g,3.4mmol,99%)。用于c
1413
c2h
22n215
no8s
[mh
]的esi-lrms:计算。419.4发现值419.3
[0004]
:将物质3(1.42g,3.39mmol,1.00eq.)在真空中干燥,并在氮气气氛下与无水dmf(23ml)转移至转移到火焰干燥的压力管中。加入775mg硫代乙酸钾(0.78g,6.78mmol,2.00eq.)并将所得混合物加热至70℃持续一小时。通过hplc监测反应,并加入额外量的硫代乙酸钾(0.78g,6.78mmol,2.00eq),并重复加热直至>95%的起始材料被消耗。将吡啶在真空中除去,并加入乙酸乙酯(200ml)。所得的悬浮液用去离子水(100ml)和盐水(100ml)洗涤。有机层经硫酸钠干燥,过滤并在真空中浓缩,得到呈无色固体的物质4(1.19g,3.0mmol,88%)。用于c
1513
c2h
22n215
no6s
[mh
]的esi-lrms:计算。399.4发现值399.5
[0005]
:将物质4(1.12g,2.81mmol,1.00eq.)溶解在meoh(47ml)中,并冷却至0℃。加入naoh水溶液(1m,2.7ml)并将反应混合物搅拌三小时。然后,通过加入hcl水溶液(0.5m)而将混合物酸化至ph=2并在真空中除去甲醇。将残余物溶解在乙酸乙酯(350ml)中,分离各层并将有机层用盐水(100ml)洗涤。有机相经硫酸钠干燥,过滤,并且在真空中浓缩。将粗产物通过hplc(c-18反相硅胶,mecn:h2o)进行纯化。因此,分离呈灰白色固体的化合物5(0.45g,1.26mmol,45%)分离。用于c
1313
c2h
19n215
no5s
[mh
]的esi-lrms:计算。356.4发现值356.5
[0006]
:用于合成物质7的水合缓冲液:样n-甲基吗啉(720μl)和乙酸(360μl)添加到去离子水(19.0ml)中,并通过加入乙酸将ph调节至6。
[0007]
(美罗培南m-13c2-15
n三水合物):将物质5(0.48g,1.36mmol,1.00eq.)溶解在乙酸乙酯(15ml)和dmf(3.0ml)的混合物中。将所得的溶液冷却至<5℃。然后,逐滴加入化合物s2(0.89g,1.50mmol,1.10eq.)和dipa(0.26ml,1.86mmol,1.36eq.)。此后,将混合物在0-5℃下搅拌3.5小时。通过hplc监测反应。在物质5完全转化后,将水合缓冲液(12ml)加入到反应混合物中。将混合物搅拌三小时,并随后转移到水合装置中。加入钯/碳(10wt-%pd,0.74g,0.69mmol,0.50eq.pd),并用氢气(4.8bar)吹扫反应容器。将反应混合物氢化三小时。之后,分离有机层并通过过滤除去催化剂。将粗产物通过hplc(c-18反相硅胶,mecn:h2o)进行纯化。因此,分离呈灰白色固体的化合物5(71.9mg,0.16mmol,12%)分离。用于c
1513
c2h
26n215
no5s
[mh
]的esi-lrms:计算。387.4发现值387.3
[0008]
美罗培南-丁酰胺-13c2-15
n:在氮气气氛下在室温下将美罗培南-13c2-15
n三水合物(7,50mg,0.13mmol,1.0eq.)溶解在水中(0.5ml)。加入正-丁胺(4.5m,0.12ml,0.5mmol,3.8eq.)并将所得的混合物搅拌30分钟。之后,将反应进行冻干。将剩余的固体通过hplc(c-18反相硅胶,mecn:h2o)进行纯化。因此,获得化合物8(40mg,0,08mmol,67%),为灰白色固体。用于c
1913
c2h
37n315
no5s
[mh
]的esi-lrms:计算。460.3发现值460.2
[0009]
丁酰胺:将酯6(100mg,0.29mmol,1.00eq.)在室温下在氩气气氛下溶解在干燥的ch3cn(4.0ml)中。另外,加入正丁胺(282μl,2.85mmol,10.0eq.)在干燥的ch3cn(2.5ml)中的溶液,并将所得的混合物搅拌两小时,直到对照通过lcms表明物质6完全消耗。通过加入乙酸乙酯(60ml)、磷酸盐缓冲液水溶液(0.2m,ph=7.0,20ml)和盐水(20ml)的搅拌双相混合物来淬灭反应。分离各层,并用乙酸乙酯(30ml,三次)萃取水相。在合并有机层后,并经na2so4干燥,随后在真空中过滤并浓缩,得到呈褐色的泡沫的粗丁酰胺9。通过hplc(c-18反相硅胶,mecn:h2o)实现最终纯化,在非对映异构体混合物中获得呈无色泡沫的丁酰胺9(164mg,0.21mmol,73%)。用于c
3413
c2h
47n515
no
11s
[mh
]的esi-lrms:计算。774.3发现值774.3
[0010]
美罗培南-丁酰胺-13c2-15
n:将丁酰胺9(100mg,0.13mmol,1.00eq.)在室温下在氩气气氛下溶解在干燥的四氢呋喃(4.0ml)中。另外,添加脱气的去离子水(2.0ml)和钯/碳
(10wt-%pd,68.9mg,0.07mmol,0.50eq.pd)。在剧烈搅拌下,将所得的悬浮液用氢气吹扫(1个大气压,三次),然后氢化三小时。经硅藻土塞过滤(用h2o:ch3cn=1∶1,约25ml进行洗涤)后,将所得的双相混合物在真空中浓缩(最高30℃),得到淡黄色的泡沫。将由此获得的粗品8重新溶解在去离子水(0.8ml)、甲酸(15.7μl,0.42mmol,3.00eq.)和乙腈(0.8ml)的混合物中,并通过hplc(c-18反相硅胶,mecn:h2o)进行纯化。浓缩并在真空中(最高30℃)彻底干燥后,在超纯的非对映异构体混合物中获得呈轻微淡黄色固体的美罗培南-丁酰胺-13c2-15
n(8,23.3mg,0.05mmol,39%)。用于c
1913
c2h
37n315
no5s
[mh
]的esi-lrms:计算。460.3发现值460.2实例4:经衍生化的哌拉西林的稳定性为了评估使用简单的丙胺、丁胺或戊胺是否可以实现完全的β-内酰胺衍生化,将这些亲核体高过剩地加入到美罗培南(化合物1,图3)和哌拉西林(化合物5,图1或图4,1μg/ml)的溶液中。参见图3和图4,分别是对于美罗培南和哌拉西林的化学反应示意图。使用与实例1中相同的方案在2个mrm下研究哌拉西林(化合物7,参见图4)的双丁酰胺变体的稳定性。图5示出了化合物7的两个mrm转换获得的峰面积。观察到所获得的峰面积不随时间显着变化,即经衍生化的哌拉西林不发生水解。通过f检验进一步证实了这一点,得到的p值为0.08和0.14。实例5:使患者样品中的美罗培南(化合物1)和哌拉西林(化合物5)稳定化将溶解在水中的衍生化试剂(丙胺、丁胺或戊胺)加入到100μl样品中(血清中掺有1μg/ml的哌拉西林(化合物5)和美罗培南(化合物1)二者)。相对于100μl的1μg/ml(1.9*10-9
m)的哌拉西林(化合物5),将5*108,2.5*108或者2.5*106当量(分别为9.8*10-5
,4.8*10-5
,1.9*10-7
摩尔)的相应的衍生化试剂(20μl)加入到掺杂的血清中。随后将该混合物孵育3分钟,之后加入ph调节剂(40μl的1m的hcooh(ph 2.5)或500mm的na3po4/na2hpo4(ph为12)的水溶液)。随后,加入磁珠(40μl,50mg/ml)并孵育3分钟。接下来除去上清液,用水(150μl)洗涤珠子两次。接下来,加入洗脱溶液(50μl含有100mm的hcooh、100mm的吡咯烷或不含ph调节剂的不同乙腈水平(10-90%,v/v)的溶液。接下来用水(20μl)稀释上清液(20μl)。为了将天然(完整的)美罗培南(化合物1)和哌拉西林(化合物5)二者,以及它们的衍生产物和水解化合物进行定量,设计了lc-ms/ms方法,该方法包括为所有化合物调整mrm转换。将含有溶剂a:含0.1%hcooh的水和溶剂b:含0.1%的hcooh的ch3cn且流量为每分钟0.6ml的cortecs c18 c18,2.6μm,2.1mm
×
50mm的色谱柱用于连接至爱博才思6500 ms的安捷伦infinity ii多进样器/泵系统上。对于每种经衍生化的抗生素(即,用丙胺、丁胺或戊胺衍生化的美罗培南(a386)和哌拉西林(a0387)),使用了三个mrm转换。天然美罗培南(化合物1)和哌拉西林(化合物5),以及它们的水解形式(每种分析物2个mrm转换)也包括在该测量中。
对于美罗培南(化合物1),当使用戊胺时,获得了具有最高峰面积的结果。在这种抗生素的血清浓度为1μg/ml时,使用戊胺和最佳工作流程,大约3e6的面积应该是可能的。使用丁胺,在最佳条件下可实现1e6的面积。参见图6。对于哌拉西林(化合物5),当使用丁胺时,获得了具有最高峰面积的结果。在这种抗生素的血清浓度为1μg/ml时,使用丁胺和最佳工作流程(参见最佳流程的下一部分),2e7的面积应该是可能的。参见图7。值得注意的是,当使用2.5e8当量的试剂时,在洗脱液中没有发现残留的天然化合物(完整的美罗培南(化合物1)或哌拉西林(化合物5))。这表明在这种短时间内的反应是定量的。此外,我们观察到水解的化合物的量没有增加,这表明亲核体的添加不会催化这些化合物中内酰胺部分的水解,使得能够区分和定量完整的内酰胺化合物与水解的化合物。该专利申请请求欧洲专利申请19209520.6的优先权,其中该欧洲专利申请的内容
通过引用并入本文。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
