系统性红斑狼疮中的i型干扰素抑制
技术领域
1.本披露内容涉及用于治疗系统性红斑狼疮(sle)的方法和组合物。具体地,本披露内容涉及包括向有需要的受试者施用i型ifn受体抑制剂、任选阿尼鲁单抗(anifrolumab)的方法。
背景技术:
2.系统性红斑狼疮(sle)是自身免疫疾病,其导致显著的发病和死亡1。尽管sle临床试验活动非常活跃,但在过去60年中只有一种药物贝利单抗(belimumab)已获得了监管部门的批准。已导致sle药物开发失败的因素很多,包括试验设计挑战、各种各样的患者群体以及缺乏稳健的终点。
3.sle的临床表现包括但不限于全身症状、脱发、皮疹、浆膜炎、关节炎、肾炎、血管炎、淋巴结病、脾肿大、溶血性贫血、认知功能障碍和其他神经系统受累。这些疾病表现导致显著的疾病负担,并可能导致身体机能下降、失业、健康相关生活质量(qol)降低以及寿命缩短10年。增加的住院治疗以及药物治疗(包括长期口服皮质类固醇(ocs)或糖皮质激素以及其他免疫抑制治疗)的副作用增加了sle的疾病负担。
4.sle的治疗具有挑战性,因为标准疗法的功效有限且耐受性较差2。当前用于治疗sle的所有疗法均具有众所周知的不良作用谱,因此存在鉴定新的靶向疗法、特别是可降低对皮质类固醇和细胞毒性剂需求的药剂的医学需要。
5.寻找针对sle的治疗的挑战
6.新药物的临床开发是漫长而昂贵的过程,并且成功几率低。对于进入临床开发的分子,将有少于10%最终得到卫生监管机构的批准3。此外,生物治疗剂、尤其是单克隆抗体的临床开发并不比小分子药物更快或更便宜。生物治疗剂的早期临床开发要比小分子漫长得多。
7.ii期试验是在少量患有目的疾病的志愿者中进行的。它们旨在测试安全性、药代动力学和药效动力学。ii期试验可提供药物功效的初步证据。然而,ii期试验中参与者人数少和主要的安全性问题通常限制了其建立功效的能力。需要进行iii期试验以证明临床候选物的功效和安全性。极为重要的是,许多在ii期显示出希望的临床候选物在iii期没有成功。多于90%的进入i期试验的新型治疗剂在临床开发期间失败,主要是因为功效或安全性失败。ii期成功之后iii期成功的可能性小于50%4。
8.对于sle,药物开发的过程尤其困难。这是因为与诸如类风湿性关节炎(ra)和强直性脊柱炎等疾病相比,sle是特别复杂且知之甚少的疾病。与其他疾病相比,不仅我们对sle的遗传学的理解处于最初阶段,而且我们对于大多数临床表现的发病机制的洞察仍然相对有限。
9.sle的复杂性为那些希望开发新治疗剂的人带来了患者群体具有广泛异质性的问题5。这使得对于sle的临床试验、例如关于选择纳入标准以及主要和次要终点的方案设计甚至更加困难。预测每名患者中的疾病过程更加困难。这不可避免地增加了背景噪声,从而
降低了试验的统计检力。高安慰剂反应率限制了测试新药可以显示出功效信号的范围,从而使临床试验甚至更加难以进行和解释。
10.与针对其他适应症的治疗剂相比,开发针对sle的有效治疗剂的难度导致该领域中的治疗剂在临床试验中的失败率甚至更高。自从羟氯喹被批准用于盘状狼疮和sle以来,在大约50年中只有1种针对sle的新治疗(贝利单抗)得到了美国食品药品管理局(us food and drug administration,fda)和欧洲药品管理局(european medicines agency,ema)的批准。然而,贝利单抗并不是在任何地方都得到了批准,并且吸收不高。当前用于治疗sle的许多药剂(如硫唑嘌呤、环磷酰胺和霉酚酸酯/霉酚酸)尚未被批准用于该疾病。此外,这些药物全部都存在证据充分的安全性问题,并且对于狼疮的所有表现,并不是在所有患者中都有效。抗疟疾剂(例如羟氯喹)和皮质类固醇可以用于控制关节痛、关节炎和皮疹。其他治疗包括非甾体抗炎药(nsaid);用于发热、关节痛和关节炎的镇痛药;和局部防晒霜以最小化光敏性。通常难以使患有中度或重度疾病的患者逐渐完全停用ocs,这导致长期发病并且可能促成早期心血管病死亡。即使长期使用的5到10mg泼尼松的小日剂量也会带来副作用(如白内障、骨质疏松和冠状动脉疾病)增加的风险。
11.非甾体抗炎药(nsaid)通常用于患有sle的患者中的关节痛、轻度关节炎、肌痛、浆膜炎和发热的对症管理。它们没有任何免疫抑制特性。nsaid只能短期使用,并且不适用于有肾脏受累、高血压和已确定的心脏病的患者。nsaid可能引起液体潴留、肾脏损害和间质性肾炎。
12.霉酚酸酯(mmf)是肌苷一磷酸脱氢酶的特异性抑制剂。mmf损害从头嘌呤合成。肌苷一磷酸脱氢酶是激活的淋巴细胞的必要途径。因此,mmf抑制t和b两种淋巴细胞增殖并减少抗体合成。一项370名患有活动性肾炎的sle患者的随机盲法多中心国际试验,所述sle患者被随机分配以接受mmf(2-3g/d)或标准静脉内环磷酰胺疗法持续6个月,mmf的功效与环磷酰胺(其在该研究之前一直是标准照护)相似。然而,在非洲裔美国人、西班牙人和拉丁美洲人中的反应显著不同6。
13.因此,开发用于治疗sle的新型疗法被证明是极其困难的。有许多临床候选物的实例在ii期显示出希望,但在随后的时期或iii期试验中未能显示出功效和/或安全性。
14.他巴鲁单抗
15.他巴鲁单抗(tabalumab)(ly2127399)是人igg4单克隆抗体,其结合可溶性和膜结合两种b细胞激活因子(baff)。在患有中度至重度sle的患者的两项52周iii期多中心随机双盲安慰剂对照试验(illuminate-1和illuminate-2)中评估了他巴鲁单抗的功效和安全性。主要终点是在第52周时实现sle反应指数5(sri-5)反应的患者的比例。
16.在illuminate-1(nct01196091)中,未满足主要终点。尽管具有他巴鲁单抗生物活性的药效动力学证据(抗dsdna、总b细胞和免疫球蛋白的显著降低),但关键的次要功效终点(ocs节制(sparing)、严重发作(flare)的时间、过去24小时内最严重的疲劳)也没有实现统计显著性7。
17.在illuminate-2(nct01205438)中,在较高剂量组(每2周一次他巴鲁单抗120mg)中满足了主要终点。然而,没有满足次要终点,包括ocs节制8。在illuminate-1和illuminate-2之后,由于效应量小和无法满足其他重要的临床终点,因此暂停了他巴鲁单抗的开发。
18.布利比莫德
19.布利比莫德(blisibimod)是由与人igg1 ig的n末端fc片段融合的四个baff结合结构域组成的融合蛋白。用于治疗sle的布利比莫德具有有希望的ii期结果,但在iii期中不成功。
20.在2期双盲随机安慰剂对照临床试验(pearl-sc)中,将患有血清学活动性sle且selena-sledai得分≥6分的患者随机化为3种不同剂量的布利比莫德或安慰剂(nct01162681)。在第24周时,最高剂量组(每周一次200mg)比安慰剂组具有显著更高的sri-5反应率9。
21.然而,在对具有持续高疾病活动性(selena-sledai≥10分)的血清反应阳性sle患者进行的随后的安慰剂对照iii期随机双盲研究(chablis-sc1)中,未满足主要终点(sri-6)(nct01395745)。也未达到次要终点(sri-4和sri-8)
10
。
22.阿塞西普
23.阿塞西普(taci-ig)是中和baff和april两者的完全人重组融合蛋白。在两项ii/iii期安慰剂随机对照试验(april-ln和april-sle)中评价了阿塞西普用于治疗sle的功效。april-ln试验比较了在患有sle肾炎的患者中对阿塞西普相比于安慰剂加标准照护(新开始的mmf和糖皮质激素)的肾脏反应。在报告严重的不良事件后,中止了该试验。
24.在april-sle中,在较低剂量(75mg)组中未满足主要终点,其被定义为根据bilag a或bilag b域得分发生新发作的患者的比例显著降低(nct00624338)。由于严重ae,中止了较高剂量(150mg)组的患者的治疗
11
。
25.阿贝莫司
26.阿贝莫司(ljp 394)包含附接至三甘醇骨架的四个合成寡脱氧核苷酸,其中多于97%的这些寡核苷酸源自dsdna。该药物被设计为中和抗dsdna抗体。在sle患者的双盲安慰剂对照研究中,在具有针对其dna表位的高亲和力抗体的患者中使用ljp 394进行治疗延长了肾脏发作的时间、减少了肾脏发作的次数
12
。然而,在使用较高剂量的阿贝莫司的随后的iii期试验(nct00089804)中,其中主要终点为肾脏发作的时间,当中期分析未能显示出功效时,中止了研究和进一步的药物开发
13
。
27.利妥昔单抗
28.利妥昔单抗是嵌合抗cd20单克隆抗体。利妥昔单抗有效地治疗多种自身免疫疾病,包括类风湿性关节炎和anca血管炎。狼疮性肾炎的少量非对照试验表明,利妥昔单抗在患有狼疮性肾炎的患者中也可能潜在地有效。在随机双盲安慰剂对照iii期试验中评估了利妥昔单抗在同时用霉酚酸酯(mmf)和皮质类固醇(lunar)治疗的患有狼疮性肾炎的患者中的功效和安全性(nct00282347)。在治疗1年后利妥昔单抗疗法并未改善临床结局
14
。
29.在多中心安慰剂随机对照ii/iii期试验(explorer)中评价了利妥昔单抗在患有中度至重度sle的患者中的功效和安全性。该研究将患有基线活动性sle(定义为≥1个新bilag a得分或≥2个bilag b得分)的患者随机化为利妥昔单抗或安慰剂。主要终点是在第52周时实现完全临床反应(ccr)、部分临床反应(pcr)或无反应的利妥昔单抗相比于安慰剂治疗的患者的比例。未满足主要终点,其中在52周时利妥昔单抗和安慰剂组中的完全和部分反应率相似。首次中度或重度发作的时间差异以及hrqol的变化也并不显著
15
。
30.阿巴西普
31.阿巴西普是ctla-4融合蛋白,其与抗原呈递细胞表面上的cd80/86结合并阻断t细胞激活所需的通过cd-28的信号传导。在临床前研究中,已证明阿巴西普在狼疮的nzb/nzw鼠模型中具有免疫调节活性
16
。在iib期随机双盲安慰剂对照试验
17
(nct00119678)中评价了用于治疗非肾脏sle的阿巴西普。主要终点是在开始类固醇逐渐减量(taper)后根据关于大不列颠群岛狼疮评估组(british isles lupus assessment group,bilag)指数的a/b得分具有新发作(已裁定)的患者的比例。未满足主要终点和次要终点。
32.依帕珠单抗
33.依帕珠单抗(epratuzumab)是通过结合成熟b细胞表面上的cd22来调节b细胞活性的单克隆抗体。依帕珠单抗最初在ii期试验时显示出在治疗sle方面的功效,但这在后续第二个iib期试验或随后的iii期试验中并未得到证实。
34.两项iib期试验用基于bilag的主要终点评估了依帕珠单抗在患有中度至重度sle的患者中的功效(alleviate 1和2)。观察到临床功效的趋势,并且与安慰剂相比,更多的使用依帕珠单抗治疗的患者满足了主要终点。依帕珠单抗治疗还导致了健康相关生活质量(hrqol)和均值糖皮质激素剂量的改善
18
。
35.在另一项iib期试验(emblem)中,将患有中度至重度sle的患者随机化为五种依帕珠单抗剂量中的一种或安慰剂。所有剂量的依帕珠单抗在12周时的bicla反应即主要终点均大于安慰剂,但该作用不是统计上显著的。
36.在随后的多中心iii期试验embody 1和embody 2中,患有中度至重度sle的患者未满足主要功效终点即48周时的bicla反应。未观察到次要终点(如总sledai-2k得分、pga或均值糖皮质激素剂量)的显著差异
19
。
37.pf-04236921
38.pf-04236921是结合可溶性il-6(一种在sle患者中升高的细胞因子)的单克隆抗体。在患有活动性sle的患者的ii期rct中评价了pf-0436921的功效(butterfly)(nct01405196)。将患者随机化为接受每8周一次皮下pf-0423692110mg、50mg或200mg或安慰剂;由于3例死亡,提前中止了200mg剂量组。主要功效终点为24周时的sri-4反应,且bicla为次要终点。未满足主要终点
20
。
39.i型ifn抑制和阿尼鲁单抗
40.i型干扰素(ifn)是在先天性与适应性免疫之间形成关键连接的细胞因子,并且依据在大多数sle患者中的遗传易感性数据和上调的干扰素刺激的基因表达而参与sle
21
。
41.先前对靶向i型ifn途径以治疗sle的尝试尚未成功。隆利珠单抗(rontalizumab)是人源化igg1抗干扰素α(抗ifn-α)单克隆抗体。进行了针对隆利珠单抗在患有中度至重度sle的患者中的功效和安全性的ii期研究(rose)(nct00962832)。将患有活动性sle的患者随机化(2∶1)为每4周一次750mg静脉内隆利珠单抗或安慰剂(第1部分)和每2周一次300mg皮下隆利珠单抗或安慰剂(第2部分)。并非所有患者均满足了该试验的主要终点和次要终点
22
。因此,中止了隆利珠单抗的开发。
42.西法木单抗(sifalimumab)是抗干扰素-α单克隆抗体。在患有中度至重度活动性系统性红斑狼疮(sle)的成年人的iib期随机双盲安慰剂对照研究(nct01283139)中评估了西法木单抗的功效和安全性,满足了主要终点和一些次要终点,但治疗效果不大。此外,西法木单抗对补体水平和抗dsdna水平没有显著影响。
43.阿尼鲁单抗(medi-546)是与ifnar结合的单克隆抗体。在ii期临床试验中,与安慰剂相比,阿尼鲁单抗在患有中度至重度sle的患者中降低了疾病活动性
23
。随后在两项iii期临床试验tulip i和tulip ii中评估了阿尼鲁单抗治疗sle的安全性和功效。然而,tulip i未能满足其主要终点
24,25
。
44.结论
45.对于相比于目前可用的疗法具有更好功效和安全性特征的sle疗法存在巨大的未满足的需求
26,27
。如上所述,已经提出了大量且范围广泛的不同生物制剂并进行了临床试验,但这些试验未能满足关键研究中的临床上有意义的终点。许多提出的治疗剂在ii期时的最初希望并未在随后的关键iii期临床试验中转化为显著且有意义的临床效果。
46.因此,仍然需要安全且有效的sle治疗,该治疗已经例如在iii期双盲随机安慰剂对照试验中被证明具有临床益处
28
。通过提供安全且有效的针对sle的治疗,本发明解决了一个或多个上述问题,其中已经证明了该治疗的安全性和功效。
技术实现要素:
47.本发明涉及一种治疗有需要的受试者的系统性红斑狼疮(sle)的方法,该方法包括向该受试者施用治疗有效量的i型干扰素(ifn)受体(ifnr)抑制剂,其中该ifnr抑制剂降低该受试者中的sle疾病活动性。该ifnr抑制剂降低受试者中的sle疾病活动性的能力可能已在iii期临床试验、特别是双盲随机安慰剂对照试验中得到证明。
48.本发明是基于阿尼鲁单抗的tulip ii iii期双盲随机安慰剂对照试验的令人惊讶的结果。tulip-2令人惊讶地满足了其主要终点和次要终点。与安慰剂相比,阿尼鲁单抗治疗导致跨广泛范围的综合和特定于器官的疾病活动性衡量指标显著更大的改善率,以及导致实现和维持低的疾病活动性、皮质类固醇逐渐减量以及发作率降低的趋势。自10多年前贝利单抗项目的试验以来,tulip ii是sle的首次成功的iii期试验。tulip ii不仅满足了其主要终点,而且证明特别是与唯一被批准用于治疗sle的生物制剂贝利单抗相比,阿尼鲁单抗在sle患者中具有出乎意料的早期且持续的作用。此外,施用阿尼鲁单抗允许在sle患者中逐渐减量ocs剂量,而不会恶化sle疾病活动性。使用贝利单抗的治疗不支持ocs逐渐减量
29
。
49.成功的tulip ii试验跟随在早期报告先前tulip i试验(nct02446912)的失败之后。tulip-1未能满足其主要终点((sri)4)。然而,对tulip i数据的分析证明了阿尼鲁单抗在包括bicla反应在内的预先指定的次要终点方面的功效。在对tulip-1数据进行仔细分析之后并且在对tulip-2试验数据揭盲之前,诸位发明人在方案修正案中将tulip-2的主要结局衡量指标由sri4改为bicla。与sri4形成对照,bicla反映与狼疮表现而不是表现的严重度有关的疾病活动性的存在。使用bicla允许评估增量反应,而不是要求疾病表现的更完全消退。
50.在本发明的方法中降低该受试者的sle疾病活动性可以包括以下中的一种或多种:
51.·
该受试者中的基于bilag的综合狼疮评估(bicla)反应,
52.·
与该受试者在治疗前的皮肤红斑狼疮病面积和严重度指数(cutaneous lupus erythematosus disease area and severity index,clasi)得分相比,降低该受试者的
clasi得分,
53.·
与该受试者在治疗前的压痛和肿胀关节计数相比,降低该受试者的压痛和肿胀关节计数,
54.·
该受试者在治疗后具有最高1个bilag-2004b得分,
55.·
该受试者在治疗后具有c或更好的bilag-2004得分,
56.·
该受试者具有与治疗前相比至少一个患者报告结局(pro)的改善,
57.·
与该受试者在治疗前的发作率相比,降低该受试者的sle发作率。
58.该方法可以包括在施用该ifnar抑制剂之前和之后测量该受试者的bilag得分。该bicla反应可以在该受试者中持续至少52周。该方法可以包括在施用该ifnar抑制剂之前和之后测量该受试者中的pro。这些pro可以包括该受试者的慢性病治疗功能评估-疲劳(functional assessment of chronic illness therapy-fatigue,facit-f)、36条简明健康状况调查表第2版(shorr form 36 health survey version 2,sf-36-v2)精神健康总评(mental component summary,mcs)和/或sf-36躯体健康总评(physical component summary,pcs)得分。
59.该bicla反应可以包括该受试者的bilag-2004a和b域得分分别降低至b/c/d和c/d。
60.与该受试者在治疗前的clasi得分相比降低该受试者的clasi得分可以包括该受试者的clasi-a得分与该受试者在治疗前的clasi-a得分相比的降低。降低该受试者中的sle疾病活动性可以包括降低该受试者中的抗dsdna水平。降低该受试者中的sle疾病活动性可以包括基于bilag的综合狼疮评估(bicla)反应。该方法可以包括与在治疗前向该受试者施用的ocs剂量相比,降低向该受试者施用的ocs剂量。
61.该ocs可以包括泼尼松、泼尼松龙和/或甲基泼尼松龙。
62.降低该受试者中的sle疾病活动性可以包括到治疗的至少第4周时基于bilag的综合狼疮评估(bicla)反应。
63.降低sle疾病活动性可以包括到治疗的至少第8周时基于bilag的综合狼疮评估(bicla)反应。
64.降低该受试者中的sle疾病活动性可以包括与该受试者在治疗前的值中的压痛关节和肿胀关节计数相比,该受试者中压痛关节计数和肿胀关节计数的至少50%改善。
65.降低该受试者中的sle疾病活动性可以不包括系统性红斑狼疮反应指数(sri)4得分的改善。
66.降低该受试者中的slr疾病活动性可以不包括在治疗52周后系统性红斑狼疮反应指数(sri)4得分的改善。
67.可以到治疗的至少第8周时实现该受试者的clasi得分的降低。
68.可以在治疗12周后实现该受试者的clasi得分的降低。
69.降低该受试者中的sle疾病活动性可以包括与该受试者在治疗前的clasi得分相比,该受试者的clasi得分的至少50%降低。
70.降低该受试者中的sle疾病活动性可以包括在治疗12周后该受试者的clasi-a得分的降低。
71.该受试者在治疗前的clasi-a得分可以≥10。
72.降低该受试者中的sle疾病活动性可以包括在治疗24周后该受试者的bilag-2004得分为c或更好。
73.降低该受试者中的sle疾病活动性可以包括在治疗24周后该受试者具有最高1个bilag-2004b得分。
74.降低该受试者中的sle疾病活动性可以包括与该受试者在治疗前的基于bilag的年化发作率相比,该受试者的基于bilag的年化发作率的降低。
75.降低该受试者中的sle疾病活动性可以包括预防该受试者中的发作。
76.发作可以被定义为与一个月前该受试者的得分相比≥1个新bilag-2004a或≥2个新(恶化的)bilag-2004b域得分。
77.降低该受试者中的sle疾病活动性可以包括与治疗前的发作率相比该受试者中降低的发作率,其中该方法包括与在治疗前向该受试者施用的ocs剂量相比,降低向该受试者施用的ocs剂量。
78.该方法可以包括选择用于治疗的受试者,其中针对患有活动性sle选择该受试者。该方法可以包括选择用于治疗的受试者,其中针对患有中度至重度sle选择该受试者。可以针对患有对ocs治疗无反应的sle选择该受试者。
79.该受试者可以是成体。该受试者可以是成年人。该受试者可以是患有中度至重度sle的成年人。该受试者可以是患有活动性sle的成年人。
80.本发明还涉及一种用于在患有自身免疫疾病的受试者中降低ocs剂量的方法,该方法包括向该受试者施用治疗有效量的i型ifn受体抑制剂,以及与在治疗前向该受试者施用的ocs剂量相比,降低向该受试者施用的ocs剂量,其中该ifnr抑制剂降低该受试者中的疾病活动性。
81.本发明还涉及一种用于在患有自身免疫疾病的受试者中预防ocs相关器官损害的方法,其中该受试者在治疗前正在接受ocs,该方法包括向该受试者施用治疗有效量的i型ifn受体抑制剂,以及与在治疗前向该受试者施用的ocs剂量相比,降低向该受试者施用的ocs剂量,其中该ifnr抑制剂降低该受试者中的疾病活动性。
82.在治疗开始时,该受试者可以正在接受约≥10mg/d的ocs剂量。该ocs可以降低至约≤7.5mg/d。该ocs可以降低至≤7.5mg/d。该ocs剂量可以降低至约0mg/d。该ocs剂量可以降低至0mg/d。该方法可以包括维持该降低的ocs剂量至少12周。
83.该受试者可以患有ocs相关器官损害。该ocs可以包括泼尼松、泼尼松龙和/或甲基泼尼松龙。该自身免疫疾病可以是sle或中度至重度sle。可以针对患有对ocs治疗无反应的sle选择该受试者。
84.可以将该i型ifn受体抑制剂静脉内施用。
85.i型ifn受体抑制剂可以是特异性结合ifnar1的抗i型干扰素受体抗体或其抗原结合片段。该抗体可以是单克隆抗体。该抗体可以是阿尼鲁单抗。
86.该方法可以包括施用300mg阿尼鲁单抗,任选地其中将阿尼鲁单抗经30分钟时间段以静脉内(iv)输注的方式施用。可以将阿尼鲁单抗经30分钟时间段以iv输注的方式每4周施用一次。可以将阿尼鲁单抗从单剂量小瓶施用。阿尼鲁单抗能以150mg/ml的浓度以溶液提供。可以将阿尼鲁单抗每四周施用一次。可以将阿尼鲁单抗施用至少52周。
87.本发明还涉及一种用于本发明的治疗方法的药物组合物,其中该药物组合物包含
该i型ifn受体抑制剂。
88.本发明还涉及药物组合物在制造用于治疗sle的药物中的用途,其中该药物组合物包含i型ifn受体抑制剂。
89.该药物组合物可以包含浓度为150mg/ml的阿尼鲁单抗。
90.该药物组合物可以包含
91.·
150mg/ml阿尼鲁单抗;
92.·
50mm赖氨酸盐酸盐:
93.·
130mm海藻糖二水合物;
94.·
0.05%聚山梨酯80;
95.·
25mm组氨酸/组氨酸盐酸盐,
96.其中该药物组合物的ph为5.9。
97.本发明还涉及一种用于本发明方法的单位剂量,其中该单位剂量包含300mg阿尼鲁单抗。
98.本发明还涉及一种用于本发明方法的试剂盒,其中该试剂盒包含:
99.·
本发明的单位剂量,和
100.·
含有该单位剂量的玻璃小瓶。
101.该试剂盒可以包含用于施用该单位剂量的说明书。该说明书可以指定每4周施用该单位剂量一次。该说明书可以指定该受试者患有中度至重度sle。
102.本发明还涉及一种用于在受试者中评估针对sle的治疗对治疗的患者报告结局(pro)的影响的改善方法,该改善方法包括测量该受试者的bicla反应,其中该bicla反应对应于该受试者中的治疗的患者报告结局(pro)的改善。这些pro可以包括该受试者的慢性病治疗功能评估-疲劳(facit-f)、36条简明健康状况调查表第2版(sf-36-v2)精神健康总评(mcs)和/或sf-36躯体健康总评(pcs)得分。
附图说明
103.图1:在tulip-1中随时间变化的主要和选择的次要功效结局
104.图1a-图1f示出了在tulip-1中随时间变化的主要和选择的次要功效结局。图1a和图1b显示了主要终点:具有sri(4)反应的患者的百分比。图1c和图1d显示了在基线时clasi得分≥10的患者中clasi活动性得分相对于基线降低≥50%的患者的百分比。图1e和图1f显示了具有bicla反应的患者的百分比。
105.图2:在tulip i中随时间变化的bicla反应和i型ifngs
106.图2a-图2b示出了在tulip-1中随时间变化的bicla反应和i型ifngs抑制。图2a显示了持续到第52周的bicla反应开始的时间的kaplan-meier图。在研究治疗中止日期或第52周(以较早发生者为准),对没有持续至第52周的bicla反应的患者进行检查。图2b显示了在基线时具有高i型ifngs(倍数变化>2)的患者中的每次访视时基线i型ifn药效动力学(21基因)标记的中值百分比。
107.图3:ocs降低
108.图3a和图3b显示在基线时皮质类固醇剂量≥10mg/d的患者中从第40周直到第52周持续口服皮质类固醇剂量降低至≤7.5mg/d的目标。图3a显示了使用预先指定的限制性
用药规则来确定无反应的结果,并且图3b显示了使用修正的限制性用药规则的分析。
109.图4:在tulip i中的抗dsdna抗体和c3浓度
110.图4a-图4b示出了在tulip-1中在基线时具有升高的抗dsdna抗体的患者中随时间变化的抗dsdna抗体相对于基线的变化(图4a),以及在基线时具有低c3的患者中随时间变化的c3浓度相对于基线的变化(图4b)。
111.图5:tulip-2的随时间变化的主要和关键次要功效结局
112.图5a-图5c示出了tulip-2的随时间变化的主要和关键次要功效结局。图5a显示了主要终点:具有bicla反应的患者的百分比(95%ci)。图5b显示了在使用基线剂量泼尼松≥10mg/d或等效物的患者中从第40周持续到第52周的ocs剂量降低至≤7.5mg/d的患者的百分比(95%ci)。图5c显示了在基线时clasi得分≥10的患者中clasi活动性得分相对于基线降低≥50%的患者的百分比(95%ci)。
113.图6:在tulip-2中持续bicla反应的时间过程和发作的时间
114.图6a-图6b示出了在tulip-2中持续bicla反应的时间过程和发作的时间。图6a显示了持续到第52周的bicla反应开始的时间。图6b显示了首次发作的时间,其中发作被定义为与先前的访视相比≥1个新bilag a或≥2个新bilag b项目。两种结局均使用cox比例风险模型进行评价。
115.图7:ifngs和抗dsdna抗体
116.在tulip-2中在基线时具有升高的抗dsdna抗体的患者中,ifngs(图7a)和抗dsdna抗体(图7b)随时间变化相对于基线的变化。图7c显示了在基线时具有低c3的患者中的c3浓度。
117.图8:在早期时间点的bicla反应
118.图8a-图8c示出了在tulip-1(图8a)、tulip-2(图8b)以及来自tulip-1和tulip-2的合并数据(图8c)中在早期时间点具有bicla反应的患者的百分比。
119.图9:在tulip-1、tulip-2以及来自tulip-1和tulip-2的合并数据中,具有从开始持续到第52周的bicla反应的患者的百分比。
120.bicla,基于大不列颠群岛狼疮评估组的综合狼疮评估;ci,置信区间;ifngs,干扰素基因标记;ocs,口服皮质类固醇;sledai-2k,系统性红斑狼疮疾病活动性指数2000。在tulip-1、tulip-2和合并的tulip数据中,限制性用药规则是根据tulip-2方案。使用采用治疗组和分层因子(筛选时的sledai-2k、第1天ocs剂量以及筛选时的i型ifngs测试结果)作为协变量的cox回归模型来估计风险比和95%ci。
121.图10:在所有时间点的bicla反应。
122.bicla,基于大不列颠群岛狼疮评估组的综合狼疮评估;ifngs,干扰素基因标记;ocs,口服皮质类固醇;sledai-2k,系统性红斑狼疮疾病活动性指数2000。在早期时间点,tulip-1和tulip-2中的p值分别为0.207和0.238(第4周)、0.020和0.004(第8周)以及0.054和0.029(第12周)。在tulip-1、tulip-2和合并的tulip数据中,限制性用药规则是根据tulip-2方案。使用采用分层因子第1天ocs剂量、sledai-2k和i型ifngs测试结果(均在筛选时)的分层cochran-mantel-haenszel方法计算反应者比率。在合并的分析中,添加了另外的分层因子以供研究。垂直条指示95%置信区间。
123.图11:具有bicla反应的患者的百分比
124.图11a-图11c示出了在tulip-1(图11a)、tulip-2(图11b)以及来自tulip-1和tulip-2的合并数据(图11c)中具有从开始持续到第52周的bicla反应的患者的百分比。
125.图12:bicla反应持续的时间
126.图12a-图12c示出了在tulip-1(图12a)、tulip-2(图12b)以及来自tulip-1和tulip-2的合并数据(图12c)中从开始持续到第52周的bicla反应的均值时间。
127.图13:mcp和pcr
128.图13a-图13c示出了在tulip-1(图13a)、tulip-2(图13b)以及来自tulip-1和tulip-2的合并数据(图12c)中在第24周实现持续到第52周的主要临床反应或部分临床反应的患者的百分比。ifngs,干扰素基因标记;mcr,主要临床反应;ocs,口服皮质类固醇;pcr,部分临床反应;sledai-2k,系统性红斑狼疮疾病活动性指数2000。在tulip-1、tulip-2和合并的tulip数据中,限制性用药规则是根据tulip-2方案。使用采用分层因子第1天ocs剂量、sledai-2k和i型ifngs测试结果(均在筛选时)的分层cochran-mantel-haenszel方法计算反应者比率。
129.图14:合并的tulip的依据人口统计学亚组的bicla反应。
130.bmi,身体质量指数;bicla,基于大不列颠群岛狼疮评估组的综合狼疮评估;ci,置信区间;cmh,cochran-mantel-haenszel。对tulip-1数据进行了分析,并入了预先指定的限制性用药规则。使用分层cmh方法对治疗估计值差异和相关95%ci进行加权和计算。
131.图15:依据人种的bicla反应。
132.bicla,基于大不列颠群岛狼疮评估组的综合狼疮评估;ci,置信区间;cmh,cochran-mantel-haenszel。
133.a来自安慰剂和阿尼鲁单抗300mg两个组的8名患者缺失tulip-1的数据。
134.对tulip-1数据进行了分析,并入了预先指定的限制性用药规则。使用分层cmh方法对治疗估计值差异和相关95%ci进行加权和计算。对合并的tulip数据进行最终确认。
135.图16:依据地理区域的bicla反应。
136.bicla,基于大不列颠群岛狼疮评估组的综合狼疮评估;ci,置信区间;cmh,cochran-mantel-haenszel。
137.a
在第7张幻灯片上定义了每个地理区域内的国家;b世界其他地区的治疗差异(95%ci):tulip-1,-6.7(-65.3,51.9);tulip-2,66.7(6.6,100.0);合并的,26.9(-15.1,69.0)。对tulip-1数据进行了分析,并入了预先指定的限制性用药规则。使用分层cmh方法对治疗估计值差异和相关95%ci进行加权和计算。
138.图17:依据筛选时的sledai-2k的bicla反应。
139.bicla,基于大不列颠群岛狼疮评估组的综合狼疮评估;ci,置信区间;cmh,cochran-mantel-haenszel;sledai-2k,系统性红斑狼疮疾病活动性指数2000。对tulip-1数据进行了分析,并入了预先指定的限制性用药规则。使用分层cmh方法对治疗估计值差异和相关95%ci进行加权和计算。
140.图18:依据基线口服皮质类固醇剂量的bicla反应。
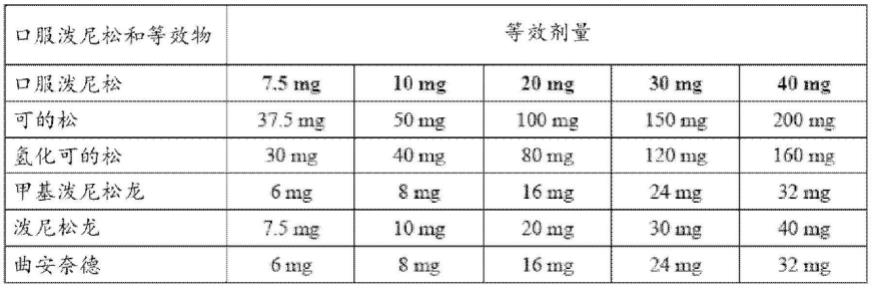
141.bicla,基于大不列颠群岛狼疮评估组的综合狼疮评估;ci,置信区间;cmh,cochran-mantel-haenszel;ocs,口服皮质类固醇。对tulip-1数据进行了分析,并入了预先指定的限制性用药规则。使用分层cmh方法对治疗估计值差异和相关95%ci进行加权和计
算。
142.图19:依据i型ifn基因标记状态(筛选)的bicla反应
143.bicla,基于大不列颠群岛狼疮评估组的综合狼疮评估;ci,置信区间;cmh,cochran-mantel-haenszel;ifngs,i型干扰素基因标记;qpcr,定量聚合酶链反应。a使用来自全血的基于4基因qpcr的测试,通过中心实验室筛选将i型ifngs分类为高或低。对tulip-1数据进行了分析,并入了预先指定的限制性用药规则。使用分层cmh方法对治疗估计值差异和相关95%ci进行加权和计算。
144.图20:在tulip-2和tulip-1中与安慰剂相比用阿尼鲁单抗治疗的患者中使用biliag-2004评估的发作。
145.bilag:大不列颠群岛狼疮评估组。注意:发作被定义为与上个月的访视相比的新bilag-2004a≥1个或新(恶化的)bilag-2004 b域得分≥2个。
146.图21:在tulip-2和tulip-1中最后发作的时间
147.bilag:大不列颠群岛狼疮评估组。注意:发作被定义为与上个月的访视相比的新bilag-2004a≥1个或新(恶化的)bilag-2004 b域得分≥2个。首次发作的时间是通过首次发作的日期减去首次施用研究产品的日期得出的。如果患者没有发作,则在暴露时间结束时对发作的时间进行检查。
148.图22:在tulip试验中直到第52周的年化发作率。
149.图23:在tulip试验中直到第52周具有1、2或3次或更多次sle发作的患者的百分比。
150.bilag:大不列颠群岛狼疮评估组;sle,系统性红斑狼疮。发作被定义为相比于先前访视的新bilag-2004 a≥1个或新bilag-2004 b器官域得分≥2个。
151.图24:在接受阿尼鲁单抗和安慰剂的患有sle的患者中依据时间的实现clasi-a反应的患者的百分比:tulip-1和tulip-2合并数据。
152.clasi,皮肤红斑狼疮病面积和严重度指数;clasi-a,clasi活动性得分;n,分析的患者数量;n,治疗组中的患者数量;na,不可用;ocs,口服皮质类固醇。反应被定义为对于基线clasi-a≥10的患者clasi活动性得分相对于基线降低≥50%。使用采用分层因子筛选时的sledai-2k得分、第1天ocs剂量、筛选时的i型ifn基因标记测试结果和研究(tulip-1和tulip-2)的分层cochran-mantel-haenszel方法计算反应者比率。呈现了标称p值,*p<0.05;**p<0.01;***p<0.001。
153.图25:接受阿尼鲁单抗和安慰剂的患有sle的患者中持续到第52周的clasi-a反应的时间:tulip-1和tulip-2。
154.clasi,皮肤红斑狼疮病面积和严重度指数;clasi-a,clasi活动性得分;n,分析的患者数量;n,治疗组中的患者数量;na,不可用;ocs,口服皮质类固醇。反应被定义为对于基线clasi-a≥10的患者clasi活动性得分相对于基线降低≥50%。使用采用治疗组与分层(筛选时的sledai-2k得分、第1天ocs剂量、研究和筛选时的i型ifn基因标记测试结果)作为协变量的cox回归模型来估计风险比和95%ci。
155.图26:在50%和75%反应阈值下依据基线clasi-a的在第12周时的clasi-a反应:tulip-1和tulip-2
156.图27:clasi-a皮肤反应:来自一名进行阿尼鲁单抗(300mg)治疗的患者的实例。
157.clasi-a,皮肤红斑狼疮病面积和严重度指数活动性得分。反应被定义为对于基线clasi-a≥10的患者clasi-a相对于基线降低≥50%。总共有来自5个地点的13名阿尼鲁单抗治疗的患者参加了皮肤照相;2名患者在第12周时具有clasi-a反应。
158.图28:在bicla反应者相比于无反应者中的发作和口服糖皮质激素使用。
159.图28a:直到第52周bilag-2004发作≥1次的患者。误差条表示95%ci。图28b:所有患者中从基线到第52周的口服糖皮质激素日剂量的ls均值变化,而无论基线口服糖皮质激素剂量如何。误差条表示95%ci。图28c:在基线时接受口服糖皮质激素≥10mg/d的患者中实现持续口服糖皮质激素剂量降低至≤7.5mg/d的患者。持续口服糖皮质激素剂量降低被定义为从第40周持续到第52周的口服糖皮质激素剂量≤7.5mg/d。误差条表示95%ci。图28d:对于所有患者直到第52周的口服糖皮质激素auc,而无论基线口服糖皮质激素剂量如何。误差条表示sd。a-d,使用分层cochran-mantel-haenszel方法计算比率差异、ci和标称p值。auc,曲线下面积;bicla,基于大不列颠群岛狼疮评估组的综合狼疮评估;bilag,大不列颠群岛狼疮评估组;ci,置信区间;ls,最小二乘;sd,标准偏差。
160.图29:在bicla反应者相比于无反应者中在第52周时的pro反应。
161.具有facit-f(图29a)中的反应的患者,该反应被定义为从基线到第52周的改善>3.4;具有sf-36pcs(图29b)中的反应的患者,该反应被定义为在pcs域中从基线到第52周的增加>3.4;以及具有sf-36mcs(图29c)中的反应的患者,该反应被定义为在mcs域中从基线到第52周的增加>4.2。图28a-图28c:误差条表示95%ci。使用分层cochran-mantel-haenszel方法计算反应率、ci和标称p值。图28d:ptga得分从基线到第52周的ls均值变化。误差条表示95%ci。ls均值差异、ci和标称p值-使用混合模型重复测量来计算。bicla,基于大不列颠群岛狼疮评估组的综合狼疮评估;facit-f,慢性病治疗功能评估-疲劳;mcs,精神健康总评;pcs,躯体健康总评;pro,患者报告结局;ptga,患者整体评估;sf-36,36条简明健康状况调查表。
162.图30:在bicla反应者相比于无反应者中sledai-2k和pga相对于基线的变化。
163.sledai-2k(图30a)和pga(图30b)从基线到第52周的变化。误差条表示95%ci。使用混合模型重复测量来计算ls均值差异、ci和标称p值。bicla,基于大不列颠群岛狼疮评估组的综合狼疮评估;bilag,大不列颠群岛狼疮评估组;ci,置信区间;ls,最小二乘;pga,医生整体评估;sledai-2k,系统性红斑狼疮疾病活动性指数2000。
164.图31:在基线时clasi-a得分≥10的患者中在第52周时具有clasi-a反应(定义为从基线到第52周降低≥50%)的患者。
165.使用分层cochran-mantel-haenszel方法计算反应率、ci和标称p值。图31b,对于活动性(定义为具有肿胀和压痛的关节)、压痛和肿胀关节从基线到第52周的ls均值关节计数的变化。误差条表示95%ci。使用混合模型重复测量来计算ls均值差异、ci和标称p值。bicla,基于bilag的综合狼疮评估;bilag-2004,大不列颠群岛狼疮评估组-2004;ci,置信区间;clasi-a,皮肤红斑狼疮病面积和严重度指数活动性;ls,最小二乘:bicla反应者与无反应者之间的clasi-a反应以及关节计数。a,
具体实施方式
166.本披露内容涉及用于治疗系统性红斑狼疮(sle)的方法和组合物。具体地,本披露
内容涉及包括向有需要的受试者施用阿尼鲁单抗的方法。
167.如根据本披露内容所利用的,除非另外指出,否则所有技术和科学术语应被理解为具有与本领域普通技术人员通常理解的相同含义。除非上下文另有要求,否则单数术语应包括复数形式,并且复数术语应包括单数形式。
168.在不限制本披露内容的情况下,本文出于说明目的描述了本披露内容的多个实施例。
169.受试者
170.术语“受试者”旨在包括人和非人动物、特别是哺乳动物。受试者可以是成年人患者。受试者可以是患有中度至重度sle的患者。
171.治疗
172.如本文所用的术语“治疗(treatment或treat)”是指治疗性治疗和预防性(prophylactic或preventative)措施两者。需要治疗的那些包括患有sle的受试者以及易于患上sle的那些或应预防sle的那些。在一些实施例中,本文披露的方法可以用于治疗sle。
173.施用
174.如本文所用的术语“施用(administration或administering)”是指通过任何适当的途径提供、接触和/或递送一种或多种化合物以实现所需效果。施用可以包括但不限于口服、舌下、肠胃外(例如,静脉内、皮下、皮内、肌内、关节内、动脉内、滑膜内、胸骨内、鞘内、病灶内或颅内注射)、透皮、局部、颊、直肠、阴道、鼻、眼、经由吸入以及植入物。
175.药物组合物
176.如本文所用的术语“药物组合物”是指当适当地向受试者施用时能够诱导所需治疗效果的化合物或组合物。在一些实施例中,本披露内容提供了药物组合物,其包含药学上可接受的载体和治疗有效量的至少一种本披露内容的抗体。
177.如本文所用的术语“药学上可接受的载体”或“生理上可接受的载体”是指适合于完成或增强本披露内容的一种或多种抗体的递送的一种或多种配制品材料。
178.抗原结合片段
179.术语“抗原结合片段”是指保留与抗原特异性结合的能力的一个或多个抗体片段。抗原结合片段的实例包括以下项:fab片段、f(ab
′
)2片段、fd片段、fv片段、dab片段以及scfv。
180.系统性红斑狼疮(sle)
181.系统性红斑狼疮(sle)是病因未明的慢性多系统性致残性自身免疫性风湿性疾病。系统性红斑狼疮主要影响育龄期女性,其中最近的综述报道育龄期女性与男性的比率为约12∶1。在很大程度上缺乏关于sle的当前发病率和患病率的准确数据,然而有许多迹象表明sle在非高加索人群中更为常见;例如,在美利坚合众国(美国),sle在非裔美国人、西班牙裔和亚洲人中的流行程度高于高加索人。因此,sle患病率因国家而异。此外,各国内sle患病率的可变性看起来取决于种族、遗传差异、复杂的社会经济因素和年龄;女性的疾病发病率通常在15-44岁之间最高。
182.sle的临床表现可以包括全身症状、脱发和皮疹、浆膜炎、炎性关节炎、肾脏疾病、系统性血管炎、淋巴结病、脾肿大、溶血性贫血、认知功能障碍和其他中枢神经系统(cns)受
累。这些疾病表现导致显著的疾病负担,并可能导致身体机能下降、失业、健康相关生活质量(hrqol)降低以及寿命缩短约10年。增加的住院治疗以及药物治疗(包括长期口服皮质类固醇(ocs)和其他免疫抑制治疗)的副作用增加了sle的疾病负担。此时,贝利单抗是自从羟氯喹被批准用于盘状狼疮和sle以来约50年中已得到美国食品药品管理局(fda)批准的唯一针对sle的新治疗。现有的针对sle的标准照护治疗(soc sle)原本由标签外药物组成。红斑狼疮。
183.已经鉴定出sle中疾病活动性的不同模式。petri和同事进行的群组研究中出现了三种sle活动性模式:慢性活动性、复发缓解型和长期无症状。慢性活动性模式是最常见的模式,其约占该sle群组研究中所追踪的总人年的一半。对于患有慢性活动性疾病的患者,平均疾病活动性是中重度的,这表明在该子集中发生了显著的发病。此外,大多数患有慢性活动性疾病的患者在随访期间都有中度或重度加重的叠加。在略微超过四分之一的患者中出现了疾病的第二种复发缓解型模式,并且在疾病缓解期期间平均疾病活动性趋于轻度。最不常见的模式是长期无症状,这发生在略微少于四分之一的患者中。
184.尽管近年来标签外疗法已得到改善,但长期预后仍然较差。与一般群体相比,sle的总死亡率增加,其中在追踪超过70,000患者年的9,457名患者的大国际群组中,标准化死亡比(smr;定义为观察到的死亡数与预期死亡数的比率)为2.4。在该研究中,死亡率因地理区域而异,并且在女性、年龄小于40岁的患者(smr=10.7,9.5-11.995%置信区间[ci])中、以及在病程小于1年的患者(smr=5.4,4.7-6.395%ci)中较高。死亡的主要原因是循环系统疾病(smr=1.7,1.5-1.995%ci)、感染(smr=5.0,3.7-6.795%ci)和肾脏原因(smr=7.9,5.5-11.095%ci)。其他前瞻性研究已报道在患有重度和/或活动性疾病的sle患者中死亡率上升。
[0185]
在治疗特别是患有中度至重度疾病的患者中的sle方面存在大量未满足的医学需求。贝利单抗是自从羟氯喹被批准用于盘状狼疮和sle以来约50年中已得到fda批准的唯一针对sle的新治疗。当前用于治疗sle的许多药剂(如硫唑嘌呤、环磷酰胺和霉酚酸酯/霉酚酸)尚未被批准用于该疾病。其他可用的治疗包括非甾体抗炎药(nsaid)和用于发热、关节痛和关节炎的镇痛药;和局部防晒霜以最小化光敏性。可以添加抗疟疾剂(例如,羟氯喹)和皮质类固醇以控制关节痛、关节炎和皮疹。通常难以使患有中度或重度疾病的患者逐渐完全停用皮质类固醇,这导致长期发病并且可能促成早期心血管病死亡。即使是低剂量的泼尼松,如果用作长期治疗,也会带来副作用增加的风险。
[0186]
临床试验
[0187]
2期/ii期/关键研究
[0188]
ii期研究收集了关于有效性的初步数据。在2期研究中,研究人员将该药物施用于一组患有该药物被开发所用于的疾病或病症的患者。这些研究通常涉及数百名患者,其规模还不足以显示该药物是否有益。作为替代,2期研究为研究人员提供了另外的安全性数据。研究人员使用这些数据来细化研究问题,开发研究方法并设计新的3期研究方案。
[0189]
3期/iii期/关键研究或试验
[0190]
研究人员设计了3期研究以证明产品是否可为特定群体提供治疗益处。这些研究有时称为关键研究,其涉及300至3,000名参与者。3期研究提供了大部分的安全性数据。在先前的研究中,不太常见的副作用可能也许未被检测到。由于这些研究规模更大且持续时
间更长,因此结果更有可能显示出长期或罕见的副作用。诸如ema和fda等监管机构通常要求进行iii期临床试验,从而证明该产品是安全的并且至少与在批准新的药物之前可用的药物一样有效(如果不是更好的话)。即使他们进行了成功的ii期临床试验,iii期临床试验通常也会失败。
[0191]
clasi(皮肤红斑狼疮病面积和严重度指数)
[0192]
clasi是用于测量疾病严重度和对治疗的反应的工具。clasi活动性得分减少4分或20%通常被视为将受试者分类为治疗的反应者的截断值。在特定实施例中,使用阿尼鲁单抗的治疗导致与受试者的基线得分相比,该受试者的clasi得分降低至少50%。
[0193]
clasi是用于评估sle的皮肤病变的经验证的指数,并且由2个单独的得分组成:第一个得分总结了该疾病的炎性活动性;第二个得分是该疾病造成的损害的衡量指标。活动性得分考虑了红斑、鳞屑/肥大、粘膜病变、近期脱发和非瘢痕性脱发。损害得分表示色素沉着异常、瘢痕化/萎缩/脂膜炎和头皮瘢痕化。询问受试者其色素沉着异常是否持续12个月或更长时间,在这种情况下色素沉着异常得分加倍。以上每个参数都是在特别包括在内的13个不同的解剖位置中测量的,因为这些解剖位置最常在皮肤红斑狼疮(cle)中受累。测量每个区域中最严重的病变。
[0194]
在特定实施例中,使用阿尼鲁单抗的治疗到治疗的至少第8周、第12周、第24周、第36周、第48周或第52周降低了受试者的clasi得分。在特定实施例中,使用阿尼鲁单抗的治疗到治疗的至少第8周降低了受试者的clasi得分。在特定实施例中,使用阿尼鲁单抗的治疗到治疗的至少第12周降低了受试者的clasi得分。
[0195]
在特定实施例中,本文提供了治疗有需要的受试者的系统性红斑狼疮的方法,该方法包括向该受试者施用治疗有效量的阿尼鲁单抗,其中该治疗导致与接受安慰剂的患者相比皮肤红斑狼疮病面积和严重度指数(clasi)得分的降低。
[0196]
口服皮质类固醇
[0197]
口服皮质类固醇包括泼尼松、可的松、氢化可的松、甲基泼尼松龙、泼尼松龙和曲安奈德。
[0198]
在特定实施例中,本文提供了治疗有需要的受试者的系统性红斑狼疮的方法,其中该受试者正在用口服皮质类固醇治疗,该方法包括向该受试者施用治疗有效量的阿尼鲁单抗,其中该治疗导致在该受试者中口服皮质类固醇剂量降低到至少≤5.5mg/d、≤6.5mg/d、≤7.5mg/d或≤8.5mg/d。在特定实施例中,在该受试者中口服皮质类固醇剂量的降低是降低到至少≤7.5mg/d。在特定实施例中,该治疗导致在该受试者中口服皮质类固醇剂量从≥10mg/d降低至≤7.5mg/d。
[0199]
在特定实施例中,本文提供了治疗有需要的受试者的系统性红斑狼疮的方法,其中该受试者正在用口服皮质类固醇治疗,该方法包括向该受试者施用治疗有效量的阿尼鲁单抗,其中该治疗导致在该受试者中口服皮质类固醇剂量降低到至少≤5.5mg/d、≤6.5mg/d的泼尼松或泼尼松等效剂量、≤7.5mg/d的泼尼松或泼尼松等效剂量或≤8.5mg/d的泼尼松或泼尼松等效剂量。在特定实施例中,在该受试者中口服皮质类固醇剂量的降低是降低到至少≤7.5mg/d。在特定实施例中,该治疗导致在该受试者中口服皮质类固醇剂量从≥10mg/d降低至≤7.5mg/d的泼尼松或泼尼松等效剂量。
[0200]
表2中显示了口服泼尼松的等效剂量的实例。
[0201]
表2:口服泼尼松的等效剂量的实例
[0202][0203]
压痛和肿胀关节
[0204]
肿胀和压痛关节计数是基于上肢的左肩和右肩、肘、腕,掌指(mcp)1、mcp2、mcp3、mcp4、mcp5,近端指间(pip)1、pip2、pip3、pip4、pip5关节,以及下肢的左膝和右膝。用于关节计数评估的活动性关节被定义为具有压痛和肿胀的关节。
[0205]
在特定实施例中,本文提供了治疗有需要的受试者的系统性红斑狼疮的方法,该方法包括向该受试者施用治疗有效量的阿尼鲁单抗,其中该治疗导致与接受安慰剂的患者相比相对于压痛关节计数和肿胀关节计数的基线值的至少50%改善。
[0206]
剂量方案
[0207]
要向受试者施用的阿尼鲁单抗的剂量将部分地根据受试者的体型(体重、体表或器官大小)和状况(年龄和总体健康)而变化。
[0208]
在特定实施例中,向受试者施用一种或多种固定剂量的阿尼鲁单抗,其中该剂量为150mg、200mg、250mg、300mg或350mg。在一些实施例中,向受试者施用一种或多种固定剂量的阿尼鲁单抗,其中该剂量为300mg。
[0209]
在特定实施例中,在两周治疗期内、在四周治疗期内、在六周治疗期内、在八周治疗期内、在十二周治疗期内、在二十四周治疗期内或在一年或更长时间的治疗期内施用阿尼鲁单抗。在特定实施例中,在三周治疗期内、在六周治疗期内、在九周治疗期内、在十二周治疗期内、在二十四周治疗期内或在一年或更长时间的治疗期内施用阿尼鲁单抗。在特定实施例中,将阿尼鲁单抗施用至少52周。
[0210]
在特定实施例中,将阿尼鲁单抗每周、每两周、每四周、每六周、每八周、每十周或每十二周施用一次。
[0211]
施用方法
[0212]
当用于体内施用时,本披露内容的配制品应是无菌的。本披露内容的配制品可以通过各种灭菌方法(包括例如无菌过滤或辐射)灭菌。在一个实施例中,将该配制品用预先杀菌的0.22微米过滤器进行过滤杀菌。注射用无菌组合物可以按照如在“remington:the science&practice of pharmacy[雷明顿:药学科学与实践],”第21版,lippincott williams&wilkins[利平科特
·
威廉斯
·
威尔金斯出版公司],(2005)中描述的常规制药实践来配制。
[0213]
在一些实施例中,可以将i型ifn抑制剂配制用于特定施用途径,如口服、鼻、肺、局部(包括颊和舌下)、直肠、阴道和/或肠胃外施用。如本文所用的术语“肠胃外施用”和“肠胃外施用的”是指除了肠道和局部施用以外的施用方式(通常通过注射),并且包括但不限于
静脉内、肌内、动脉内、鞘内、囊内、眼眶内、心脏内、皮内、腹膜内、经气管、皮下、表皮下、关节内、囊下、蛛网膜下、脊柱内、硬膜外和胸骨内注射和输注。
[0214]
在一些实施例中,可以将阿尼鲁单抗配制用于特定施用途径,如口服、鼻、肺、局部(包括颊和舌下)、直肠、阴道和/或肠胃外施用。如本文所用的术语“肠胃外施用”和“肠胃外施用的”是指除了肠道和局部施用以外的施用方式(通常通过注射),并且包括但不限于静脉内、肌内、动脉内、鞘内、囊内、眼眶内、心脏内、皮内、腹膜内、经气管、皮下、表皮下、关节内、囊下、蛛网膜下、脊柱内、硬膜外和胸骨内注射和输注。
[0215]
配制品
[0216]
这些配制品可以以单位剂型呈现,并且可以通过药学领域已知的任何方法制备。本披露内容的配制品中的活性成分的实际剂量水平可以变化以便于获得有效实现对于特定受试者、组合物和施用方式所需的治疗反应而对该受试者无毒的活性成分的量(例如,“治疗有效量”)。还可以将剂量经由连续输注(如通过泵)施用。施用的剂量还可能取决于施用途径。
[0217]
该药物组合物可以包含约150mg/ml阿尼鲁单抗。
[0218]
该药物组合物可以包含50mm赖氨酸盐酸盐。
[0219]
该药物组合物可以包含130mm海藻糖二水合物。
[0220]
该药物组合物可以包含0.05%聚山梨酯80。
[0221]
该药物组合物可以包含25mm组氨酸/组氨酸盐酸盐。
[0222]
该药物组合物的ph可以为5.9。
[0223]
干扰素测试
[0224]
i型ifn在sle疾病发病机制中被认为是重要的,并且该途径的抑制是由阿尼鲁单抗靶向的。为了了解i型ifn表达与对抗ifn疗法的反应之间的关系,有必要知道受试者的疾病是否由i型ifn激活所驱动。然而,直接测量靶蛋白仍然是挑战。因此,开发了基于转录物的标记物以评价靶蛋白过表达对一组特定的mrna标记物的影响。这些标记物的表达很容易在全血中检测到,并显示出与sle中患病组织(如皮肤)中的表达相关。sle受试者的转录物得分的双峰分布支持定义ifn测试的高和低亚群。i型ifn测试在wo 2011028933 a1中进行了描述,将其通过引用以其整体并入本文。
[0225]
阿尼鲁单抗
[0226]
阿尼鲁单抗是靶向ifnar1(α、β和ω干扰素的受体)的单克隆抗体。与阿尼鲁单抗有关的披露内容可以发现于美国专利号7,662,381和美国专利号9,988,459中,将其通过引用并入本文。
[0227]
阿尼鲁单抗是以高亲和力和特异性与ifnar结合的单克隆抗体。该抗体是ifnar阻断(拮抗)抗体,并且阻断该受体的配体即i型干扰素(如干扰素-α和干扰素-β)的活性。因此,阿尼鲁单抗提供ifnar信号传导的下调,并因此抑制ifn诱导型基因。
[0228]
表3:阿尼鲁单抗序列
[0229][0230]
因此,阿尼鲁单抗是如下抗体,其包含分别为seq id no:3、seq id no:4和seq id no:5的hcdr1、hcdr2和hcdr3(或其功能变体);以及分别为seq id no:6、seq id no:7和seq id no:8的lcdr1、lcdr2和lcdr3(或其功能变体)。更详细地,如本文所提及的阿尼鲁单抗是如下抗体,其包含seq id no:1的vh和seq id no:2的vl(或其功能变体)。
[0231]
本发明涵盖本文定义的具有所述cdr序列或可变重链和可变轻链序列的抗体(参考(阿尼鲁单抗)抗体)及其功能变体。“功能变体”与参考(阿尼鲁单抗)抗体结合相同的靶抗原。当与参考抗体相比时,这些功能变体对于靶抗原可以具有不同的亲和力,但基本上相同的亲和力是优选的。
[0232]
在一个实施例中,当与相应的参考cdr序列相比时,参考(阿尼鲁单抗)抗体的功能变体在一个或多个cdr处显示序列变异。因此,功能抗体变体可以包含cdr的功能变体。在cdr序列的上下文中使用术语“功能变体”时,这意味着当与相应的参考cdr序列相比时,该cdr具有最多2个、优选最多1个氨基酸差异,并且当与其余5个cdr(或其变体)组合时,使该变体抗体能够与参考(阿尼鲁单抗)抗体结合相同的靶抗原,并且优选地能够对靶抗原展现出与参考(阿尼鲁单抗)抗体相同的亲和力。
[0233]
不希望受到理论的束缚,由于阿尼鲁单抗靶向(例如阻断或拮抗)ifnar,因此认为阿尼鲁单抗通过阻断由i型干扰素(ifn)引发的信号传导来治疗疾病(如sle)。已知i型ifn是炎症的重要驱动物(例如通过协调i型干扰素反应),并因此在免疫系统中起关键作用。然而,i型ifn信号传导失调可能导致异常(例如异常高)的炎症水平和自身免疫。已经报道了在许多自身免疫疾病中的i型ifn干扰素的这种失调。
[0234]
例如,参考(阿尼鲁单抗)抗体的变体可以包含:
[0235]
·
当与seq id no:3相比时具有最多2个氨基酸差异的重链cdr1;
[0236]
·
当与seq id no:4相比时具有最多2个氨基酸差异的重链cdr2;
[0237]
·
当与seq id no:5相比时具有最多2个氨基酸差异的重链cdr3;
[0238]
·
当与seq id no:6相比时具有最多2个氨基酸差异的轻链cdr1;
[0239]
·
当与seq id no:7相比时具有最多2个氨基酸差异的轻链cdr2;以及
[0240]
·
当与seq id no:8相比时具有最多2个氨基酸差异的轻链cdr3;
[0241]
其中该变体抗体与阿尼鲁单抗的靶标(例如ifnar)结合,并且优选以相同亲和力
结合。
[0242]
优选地,参考(阿尼鲁单抗)抗体的变体可以包含:
[0243]
·
当与seq id no:3相比时具有最多1个氨基酸差异的重链cdr1;
[0244]
·
当与seq id no:4相比时具有最多1个氨基酸差异的重链cdr2;
[0245]
·
当与seq id no:5相比时具有最多1个氨基酸差异的重链cdr3;
[0246]
·
当与seq id no:6相比时具有最多1个氨基酸差异的轻链cdr1;
[0247]
·
当与seq id no:7相比时具有最多1个氨基酸差异的轻链cdr2:以及
[0248]
·
当与seq id no:8相比时具有最多1个氨基酸差异的轻链cdr3;
[0249]
其中该变体抗体与阿尼鲁单抗的靶标(例如ifnar)结合,并且优选以相同亲和力结合。
[0250]
在一个实施例中,当与相应的参考(阿尼鲁单抗)抗体相比时,变体抗体可以在其cdr中具有总计最多5、4或3个氨基酸差异,条件是每个cdr存在最多2个(优选最多1个)氨基酸差异。优选地,当与相应的参考(阿尼鲁单抗)抗体相比时,变体抗体在其cdr中具有总计最多2个(更优选最多1个)氨基酸差异,条件是每个cdr存在最多2个氨基酸差异。更优选地,当与相应的参考(阿尼鲁单抗)抗体相比时,变体抗体在其cdr中具有总计最多2个(更优选最多1个)氨基酸差异,条件是每个cdr存在最多1个氨基酸差异。
[0251]
该氨基酸差异可以是氨基酸取代、插入或缺失。在一个实施例中,该氨基酸差异是如本文所述的保守氨基酸取代。
[0252]
在一个实施例中,当与相应的参考(阿尼鲁单抗)抗体相比时,变体抗体可以在其框架区中具有总计最多5、4或3个氨基酸差异,条件是每个框架区存在最多2个(优选最多1个)氨基酸差异。优选地,当与相应的参考(阿尼鲁单抗)抗体相比时,变体抗体在其框架区中具有总计最多2个(更优选最多1个)氨基酸差异,条件是每个框架区存在最多2个氨基酸差异。更优选地,当与相应的参考(阿尼鲁单抗)抗体相比时,变体抗体在其框架区中具有总计最多2个(更优选最多1个)氨基酸差异,条件是每个框架区存在最多1个氨基酸差异。
[0253]
因此,变体抗体可以包含如本文所述的可变重链和可变轻链,其中:
[0254]
·
当与本文的重链序列相比时,该重链具有最多14个氨基酸差异(每个cdr中最多2个氨基酸差异,并且每个框架区中最多2个氨基酸差异);以及
[0255]
·
当与本文的轻链序列相比时,该轻链具有最多14个氨基酸差异(每个cdr中最多2个氨基酸差异,并且每个框架区中最多2个氨基酸差异);
[0256]
其中该变体抗体与参考(阿尼鲁单抗)抗体结合相同的靶抗原(例如ifnar),并且优选以相同亲和力结合。
[0257]
这些变体重链或轻链可以被称为参考重链或轻链的“功能等效物”。
[0258]
在一个实施例中,变体抗体可以包含如本文所述的可变重链和可变轻链,其中:
[0259]
·
当与本文的重链序列相比时,该重链具有最多7个氨基酸差异(每个cdr中最多1个氨基酸差异,并且每个框架区中最多1个氨基酸差异);以及
[0260]
·
当与本文的轻链序列相比时,该轻链具有最多7个氨基酸差异(每个cdr中最多1个氨基酸差异,并且每个框架区中最多1个氨基酸差异);
[0261]
其中该变体抗体与参考(阿尼鲁单抗)抗体结合相同的靶抗原(例如ifnar),并且优选以相同亲和力结合。
[0262]
因此,在一个实施例中,该i型干扰素受体抑制剂是阿尼鲁单抗或其功能变体。
[0263]
sri(系统性红斑狼疮反应指数≥4)
[0264]
如果满足以下所有标准,则受试者实现sri(4):
[0265]
·
sledai-2k相对于基线的降低≥4分;
[0266]
·
使用bilag-2004,与基线相比无新器官系统受累,如由1个或多个bilag-2004a或者2个或更多个
[0267]
·
bilag-2004b项目所定义的;
[0268]
·
根据3分pga vas,受试者的狼疮疾病活动性相对于基线无恶化,由增加≥0.30分所定义的。
[0269]
sri(x)(x=5、6、7或8)是由满足以下标准的受试者的比例定义的:
[0270]
·
sledai-2k相对于基线的降低≥x分;
[0271]
·
使用bilag-2004,与基线相比无新器官系统受累,如由1个或多个bilag-2004a或者2个或
[0272]
·
更多个bilag-2004b项目所定义的;
[0273]
·
根据3分pga vas,受试者的狼疮疾病活动性相对于基线无恶化,由
[0274]
·
增加≥0.30分所定义的。
[0275]
bilag-2004,大不列颠群岛狼疮评估组-2004
[0276]
bilag-2004是关于9个器官系统(一般状况、粘膜皮肤、神经精神系统、肌肉骨骼、心和肺、胃肠道、眼睛、肾脏和血液)的转化指数,其能够捕获临床表现的变化的严重度。根据设计它具有顺序级别,并且没有整体得分;准确地说,它通过比较最近的4周与其之前的4周,一目了然地记录了跨不同器官系统的疾病活动性。它是基于医生的意向治疗的原则并且将疾病活动性从a到e分为5种不同水平:
[0277]
·
a级表示疾病非常具活动性,需要免疫抑制药物和/或>20mg/d的泼尼松剂量或等效物
[0278]
·
b级表示中度疾病活动性,需要较低剂量的皮质类固醇、局部类固醇、局部免疫抑制剂、抗疟药或nsaid
[0279]
·
c级指示疾病轻度稳定
[0280]
·
d级意味着无疾病活动性,但系统先前已受累
[0281]
·
e级指示无当前或先前的疾病活动性
[0282]
尽管bilag-2004是基于意向治疗的原则开发的,但治疗与评分指数无关。只有活动性表现的存在会影响评分。
[0283]
bicla:基于bilag的综合狼疮评估(bicla)
[0284]
bicla是最初通过疾病活动性指数的专家共识得出的综合指数。bicla反应被定义为(1)在参加时具有中度或重度疾病活动性的所有身体系统中的基线bilag得分的至少一个等级改善(例如,所有a(重度疾病)得分降至b(中度)、c(轻度)或d(无活动性)和所有b得分降至c或d);(2)无新bilag a或多于一个新bilag b得分;(3)总sledai得分相对于基线无恶化;(4)在医生整体评估中无显著退化(≤10%);以及(5)无治疗失败(开始非方案治疗)。
[0285]
特别地,如果满足以下标准,则受试者是bicla反应者:
[0286]
·
所有基线bilag-2004 a降低至b/c/d和所有基线bilag-2004 b降低至c/d,并且
在其他器官系统中无bilag-2004恶化,如由1个新bilag-2004 a或多于1个新bilag-2004 b项目所定义的;
[0287]
·
sledai-2k相对于基线无恶化,如定义为sledai-2k相对于基线增加>0分;
[0288]
·
根据3分pga vas,受试者的狼疮疾病活动性相对于基线无恶化,由增加≥0.30分所定义的;
[0289]
·
在评估之前没有中止研究产品或使用方案允许的阈值以外的限制药物。
[0290]
在特定实施例中,使用阿尼鲁单抗的治疗到治疗的至少第8周、第12周、第24周、第36周、第48周或第52周改善了受试者的bicla反应率。在特定实施例中,使用阿尼鲁单抗的治疗到治疗的至少第8周改善了受试者的bicla反应率。
[0291]
在特定实施例中,尽管该受试者显示出bicla反应的改善,但该受试者并未显示出系统性红斑狼疮反应指数(sri)4得分的改善。
[0292]
在特定实施例中,本文提供了治疗有需要的受试者的系统性红斑狼疮的方法,该方法包括向该受试者施用治疗有效量的阿尼鲁单抗,其中该治疗导致与接受安慰剂的患者相比基于bilag的综合狼疮评估(bicla)反应率的改善。bilag反应率的改善可能是统计上显著的。在多重性调整后,bilag反应率的改善可能是统计上显著的。bilag反应率的改善可能是统计上显著的,其中统计显著性由p《0.05或p<0.005确定。
[0293]
患者报告结局(pro)
[0294]
在特定实施例中,使用阿尼鲁单抗的治疗产生mcr。在特定实施例中,使用阿尼鲁单抗的治疗产生pcr。
[0295]
sf-36-v2(快速)是多用途36项调查表,其测量8个健康领域:身体机能、由于躯体健康造成的角色限制、身体疼痛、一般健康感知、活力、社交功能、由于情绪问题造成的角色限制和精神健康。它产生针对这8个健康领域的每个领域的量表分数以及躯体和精神健康状况的概括性衡量指标:躯体健康总评和精神健康总评。
[0296]
facit-f是用于评估过去7天内疲劳的影响的由受试者完成的13项问卷。回答的范围为从0(完全不)到4(非常大)。最终得分是回答的总和,并且范围为从0到52;得分越高表明qol越好(yellen等人,1997)。得分变化>3分被认为是临床上有意义的。
[0297]
ptga是单项的问题,其考虑了此时疾病和健康状况可能影响患者的所有方式。回答此问题时,患者应考虑先前的一周。在100mm vas上,回答的范围从非常好到非常差。医生和受试者必须分别独立完成pga和ptga。
[0298]
主要临床反应(mcr)包括在第24周时bicla得分为c或更好,在第24-52周之间维持没有新a或b得分。部分临床反应(pcr)包括在第24周时最高1个bicla得分,直到第52周维持没有新a或>1个新b域得分。
[0299]
疾病活动性的医生整体评估(pga)是指其中医生通过视觉模拟量表(vas)评价受试者的银屑病性关节炎(psa)状况的评估。根据受试者当前的关节炎状况对其进行评估。vas是基于“非常好”到“非常差”的词语描述。
[0300]
该方法可以包括在施用阿尼鲁单抗之前和之后测量该受试者中的pro。这些pro可以包括该受试者的慢性病治疗功能评估-疲劳(facit-f)、36条简明健康状况调查表第2版(sf-36-v2)精神健康总评(mcs)和/或sf-36躯体健康总评(pcs)得分。
[0301]
实例
[0302]
以下实例说明了本披露内容的具体实施例及其各种用途。阐述它们仅出于解释目的并且不应以任何方式解释为限制本披露内容的范围。
[0303]
实例1:活动性系统性红斑狼疮中的i型干扰素抑制
[0304]
在tulip-1(nct02446912)即尽管进行了标准照护(soc)治疗仍患有中度至重度sle的成年人的一项3期双盲随机对照研究中,患者每4周一次静脉内接受(2:1:2)安慰剂或阿尼鲁单抗(150或300mg),持续48周。继续进行稳定的soc,但对于在基线时接受泼尼松/等效物≥10mg/d的患者,强制性尝试逐渐减量口服皮质类固醇(ocs)。主要终点是在第52周时阿尼鲁单抗300mg和安慰剂的sle反应指数(sri[4])反应率之间的差异。还评估了安全性。
[0305]
患者年龄为18-70岁并且符合美国风湿病学会(american college of rheumatology)sle分类标准(hochberg mc.arthritis rheum[关节炎与风湿病]1997;40(9):1725;tan em等人arthritis rheum[关节炎与风湿病]1982;25(11):1271-7)。要求包括sle疾病活动性指数2000(sledai-2k)(gladman dd等人j rheumatol[风湿病学杂志]2002;29(2):288-91)≥6(不包括来自发热、狼疮性头痛或器质性脑综合征的分数)、临床sledai-2k≥4(不包括来自实验室结果的分数);大不列颠群岛狼疮评估组(bilag)-2004(isenberg da等人rheumatology(oxford)[风湿病学(牛津)]2005;44(7):902-6)器官域得分≥1个a和/或≥2个b项目(yee cs,cresswell l等人rheumatology(oxford)[风湿病学(牛津)]2010;49(9):1665-9);并且疾病活动性的医生整体评估(pga)(petri m等人n engl j med[新英格兰医学杂志]2005;353(24):2550-8)得分≥1(0-3级别)。患者对抗核抗体或抗双链dna(抗dsdna)或抗史密斯抗体呈血清反应阳性,并正在接受使用以下至少一种的稳定治疗:泼尼松或等效物、抗疟药、硫唑嘌呤、咪唑立宾、霉酚酸酯/霉酚酸或甲氨蝶呤。
[0306]
为了使研究产品有足够的时间实现临床益处,研究人员被允许针对增加的sle疾病活动性/非sle活动性在第0周(第1天)与第12周之间施用1次皮质类固醇的激增(burst)和逐渐减量。从第0周(第1天)到第12周接受了多于1次类固醇激增和逐渐减量或者违反了任何上述标准的患者可以继续该研究,但无论是针对增加的sle活动性还是非sle病因施用了ocs激增,这些患者都被视为对于疾病活动性的后续评估的无反应者。在第12周与第40周之间,不允许针对增加的sle活性增加皮质类固醇剂量。接受高于他或她第0周(第1天)剂量的类固醇剂量的患者可以继续该研究,但被视为对于疾病活动性的后续评估的无反应者。在第40周后不允许增加ocs(但不良事件(ae)的管理或作为肾上腺功能不全的预防除外)。在第40周后其接受的ocs增加的患者被视为对于疾病活动性的后续评估的无反应者。
[0307]
从第8周开始并持续直到第40周,要求在基线时ocs剂量≥10.0mg/d的所有患者中尝试类固醇逐渐减量至ocs剂量≤7.5mg/d,除非满足至少一种以下标准:
[0308]
与主要器官系统(肾脏、中枢神经系统、心肺、血管炎、发热、血小板减少症或溶血性贫血或胃肠道活动)中的基线相比,sledai-2k活动性恶化
[0309]
基于系统性红斑狼疮疾病活动性指数2000(sledai-2k)的一个或多个新器官系统受累,不包括血清学异常(双链dna[dsdna]抗体、低补体血症)
[0310]
如由皮肤红斑狼疮病面积和严重度指数活动性得分≥10所反映的中度至重度皮肤疾病
[0311]
如由活动性关节计数≥8个压痛和/或肿胀关节所反映的中度至重度关节炎疾病
[0312]
筛选时的i型ifngs分类是通过中心实验室用来自全血的经分析验证的基于4基因
(ifi27、ifi44、ifi44l、rsad2)定量聚合酶链反应的测试来确定的(furie r,arthritis rheum[关节炎与风湿病]2017;69(2):376-86;yao y等人arthritis res ther[关节炎研究与治疗]2010;12增刊1:s6)。基于2期药代动力学/药效动力学建模和益处-风险概况,选择阿尼鲁单抗300mg作为治疗剂量;包括150mg剂量以阐明剂量-反应。每4周施用输注一次直到第48周,且在第52周时进行最终评估。
[0313]
主要功效评价是接受阿尼鲁单抗300mg或安慰剂的患者在第52周时实现sle反应指数(sri)(4)
30
反应的百分比差异。sri(4)反应是里程碑式的评估,其被定义为相对于基线sledai-2k降低≥4分、<1个新bilag-2004a或<2个新bilag-2004b器官域得分、pga增加<0
·
3分、没有使用方案允许的阈值以外的限制药物并且没有中止研究产品。
[0314]
关键次要终点针对多重性进行了调整,并且包括具有以下情况的患者的百分比:在ifngs测试高亚组中具有第52周sri(4)反应;在基线剂量≥10mg/d的患者中从第40周到第52周持续ocs剂量降低至≤7.5mg/d;在基线clasi≥10的患者中第12周皮肤红斑狼疮病面积和严重度指数(clasi)
31
活动性降低≥50%;和第24周sri(4)反应;以及直到第52周的年化发作率(相比于先前的访视,≥1个新bilag-2004 a或≥2个新bilag-2004 b器官域得分)
32
。
[0315]
未针对多重性进行调整的预先指定的次要终点包括以下项:第52周基于bilag的综合狼疮评估(bicla)反应、第52周sri(5-9)的更高阈值、从基线到第52周的医生整体评估(pga)的变化、从基线到第52周的sledai-2k的变化、bilag整体得分的变化、从基线到第52周的clasi活动性得分降低≥50%以及活动性关节计数的降低(从基线到第52周关节计数的降低和变化≥50%)。此外,评估了阿尼鲁单抗150mg组中的第52周sri(4)反应。
[0316]
安全性评估包括不良事件、实验室评估和生命体征。21基因测定评估了i型ifngs的药效动力学中和。测量了抗dsdna、c3、c4、ch50和抗药物抗体(ada)。
[0317]
功效分析包括被随机化并接受≥1个剂量的研究治疗的患者;根据随机化治疗(修改的意向治疗)对患者进行了分析。计划的功效分析将阿尼鲁单抗300mg与安慰剂进行了比较。使用采用与随机化时所用的相同分层因子的分层cochran-mantel-haenszel(cmh)测试,比较了阿尼鲁单抗300mg和安慰剂第52周sri(4)反应的主要终点。为了针对分层因子进行调整,cmh方法使用跨具有特定于层的比例差异的层的加权平均,其中这些层是基于3个因子的8种可能组合来定义的。类似地分析了关键次要终点,但发作率除外,其使用负二项回归模型进行了分析。使用具有预定权重的加权holm程序将跨主要和关键次要终点的i型族错误率(family-wise type i error rate)控制在0.05。该程序根据预定义的权重拆分0.05的α,并在初始零假设被拒绝后,将相应的α按比例再循环至这些权重。
[0318]
使用先前描述的cmh分析策略比较了阿尼鲁单抗150mg相比于安慰剂的sri(4)反应率。使用重复测量并针对基线值、治疗组、访视、治疗-访视相互作用和分层因子进行调整,对作为连续变量的结局进行了建模。
[0319]
前瞻性地定义了指定限制性用药的规则,并将其并入了功效终点中。用于基于非甾体抗炎药(nsaid)使用来对反应者进行分类的原始规则与该方案的意图相矛盾,并且将使用新nsaid或nsaid剂量增加的患者不适当地分类为对于所有二元反应终点的无反应者,即使nsaid使用是短暂的或在长达一年的试验初期使用。这些规则对研究进行没有任何影响(即,不影响医疗决策、患者的治疗或数据收集;它们只影响数据的分析)。在揭盲之后,一
组sle专家和申办者评价了所有限制性用药规则的临床适用性并对其进行了修订。使用修正的限制性用药规则重复进行关键分析(事后比较),并与原始分析一起呈现。使用cox比例风险模型进行了另外的事后分析,探索了持续直到第52周的首次bicla反应的时间。
[0320]
最初的限制性用药规则表明,在第1天之后抗疟药和/或免疫抑制剂的剂量的新开始或增加导致针对所有随后的功效评估的无反应(nr)分类。对于皮质类固醇,适用以下标准:
[0321]
在任何时候超过方案定义的最大值的剂量都会导致针对所有随后的功效评估分类为接收后的nr。
[0322]
在治疗的前12周期间接受多于一次类固醇激增或违反了定义激增和逐渐减量的任何标准的患者被分类为针对随后的功效评估的nr,而不论激增的原因是什么(sle或非sle活动性)。
[0323]
在第12周与第40周之间,仅允许一次类固醇激增来治疗非sle症状。违反该标准的患者被分类为针对随后的功效评估的nr。
[0324]
在第40周后剂量增加导致分类为针对随后的功效评估的nr。
[0325]
将患者分类为针对nsaid的所有随后的功效的nr。
[0326]
事后分析中使用的修订的用药规则的总体意图是在试验初期将用药规则与临床上的适当用途相匹配,且在更接近主要终点的情况下进行更严格的解释。该修订将防止在试验早期的临床上适当的药物使用导致在第52周时分类为无反应者(nr),与此同时确保如果患者服用可能混淆第52周的功效评估的药物,则他们将在第52周时被分类为nr。对于抗疟药和/或免疫抑制剂,在试验期间任何时候剂量增加(或新开始)导致nr归责。对于口服皮质类固醇,适用以下标准:
[0327]
在任何时候超过方案定义的最大剂量的剂量都会导致分类为接收后的nr
[0328]
在第12周前允许一次类固醇激增和逐渐减量;超过一次导致分类为针对随后的12周的nr
[0329]
通常,在第12周与第40周之间不允许使用高于基线的剂量;超过基线剂量导致分类为针对试验的剩余部分的nr
[0330]
在第40周后,大于第40周剂量的剂量或使用中等至高度有效的局部皮质类固醇导致分类为nr
[0331]
对于nsaid,在第52周的14天内开始使用新的nsaid并在第52周评估的前一天记录使用导致在第52周访视时分类为nr。第50周前使用nsaid不会导致分类为nr。
[0332]
将457名患者随机化(阿尼鲁单抗300mg,n=180;150mg,n=93;安慰剂,n=184)。阿尼鲁单抗300mg(36.2%,65/180)和安慰剂(40.4%,74/184;p=0.41)的第52周sri(4)达到率是相似的(图1a;表1)。类似地,对于在第24周时的sri(4)和在高ifngs患者中的sri(4),阿尼鲁单抗组和安慰剂组无差异。在基线ocs≥10mg/d的患者中,持续剂量降低至≤7.5mg/d对于阿尼鲁单抗300mg有41.0%(42/103)实现,并且对于安慰剂有32.1%(33/102)实现(差异8.9[95%ci:-4.1,21.9])。在基线时clasi活动性≥10的患者中,在第12周时clasi降低≥50%有41.9%(24/58)的阿尼鲁单抗300mg患者实现,并且有24.9%(14/54)的安慰剂患者实现(差异17.0[95%ci:-0.3,34.3])。年化发作率对于阿尼鲁单抗为0.60,并且对于安慰剂为0.72(率比0.83[95%ci:0.60,1.14])。基于大不列颠群岛狼疮评估组的综
合狼疮评估(bicla)反应有37.1%(67/180)的接受阿尼鲁单抗300mg的患者实现,相比于对于安慰剂有27.0%(49/184)实现(差异10.1[95%置信区间(ci):0.6,19.7])。
[0333]
[0334]
[0335][0336]
在ifngs测试高亚群(375/457,研究群体的82.1%)中,接受阿尼鲁单抗300mg(35.9%,53/148)和安慰剂(39.3%,59/151;差异-3.4[95%ci:-14.4,7.6])的患者在第52周时的sri(4)反应是相似的。
[0337]
在随机化时接受泼尼松或等效物≥10mg/d的患者中,阿尼鲁单抗300mg组
(41.0%,42/103)比安慰剂组(32.1%,33/102)以数值上更大的百分比实现了ocs剂量降低至目标(≤7.5mg/d),从第40周持续到第52周(差异8.9[95%ci:-4.1,21.9])(图3a和图3b)。在基线时clasi活动性得分≥10的患者中,在第12周时降低≥50%在阿尼鲁单抗组300mg中有41.9%(24/58)实现,相比于在安慰剂组中有24.9%(14/54)实现(差异17.0[95%ci:-0.3,34.3])(图1c,表1)。在第24周时的sri(4)结果与在第52周时的结果相似。阿尼鲁单抗的基于bilag的年化发作率在数值上低于安慰剂(分别为0.60相比于0.72;率比0.83[95%ci:0.60,1.14])。
[0338]
表1的下面部分中显示了疾病改善的辅助性次要衡量指标。在第52周时,在阿尼鲁单抗300mg组(37.1%,67/180)中比在安慰剂组(27.0%,49/184;差异10.1[95%ci:0.6,19.7];图1e,表1)中有数值上更多的患者实现了bicla反应(严格的综合整体疾病衡量指标)。尽管跨治疗组的sri(4)反应看起来相似,但较高的sri阈值略微支持阿尼鲁单抗(表1)。与安慰剂组相比,在阿尼鲁单抗组中sledai-2k和bilag整体得分两者从基线到第52周的数值变化均更大(表1)。同样地,与安慰剂组相比,在阿尼鲁单抗组中pga得分发生了数值上更大的改善(相对于基线的ls均值变化分别为-1.11[se=0.053]和-0.89[se=0.052],差异-0.22[95%ci:-0.36,-0.08])。对于clasi的辅助性衡量指标和2个其他的关节计数衡量指标,也观察到支持阿尼鲁单抗的数值差异(表1)。
[0339]
在阿尼鲁单抗150mg组中,第52周sri(4)反应与安慰剂相似(分别为37.6%[35/93]和40.4%[74/184];差异-2.6[95%ci:-14.7,9.6])。
[0340]
表2中呈现了阿尼鲁单抗150mg组的另外的功效结局。
[0341]
[0342][0343]
在预先指定的sri(4)分析中,由于使用了新的或增加的nsaid,最初的限制性用药规则将大约8%的研究群体分类为无反应者。应用事后修正的限制性用药规则在此基础上减少分类为无反应者的患者数量(表1,右图)。在这些规则下,主要终点sri(4)的实现在数值上更高,但阿尼鲁单抗与安慰剂之间的反应率差异仍然相似(阿尼鲁单抗300mg 46.9%;
安慰剂43.0%;差异3.9[95%ci:-6.3,14.1];图1b,表1)。在ifngs高亚组中,在第24周时的sri(4)反应和在第52周时的sri(4)以相似的模式发生了。
[0344]
在随机化时接受泼尼松或等效物≥10mg/d的患者中,实现持续ocs降低至≤7.5mg/d的用阿尼鲁单抗治疗的患者(48.8%,50/103)多于用安慰剂治疗的患者(32.1%,33/102;差异16.7[95%ci:3.5,29.8];表1;图3)。在预先定义的患者子集中的clasi反应在用阿尼鲁单抗治疗的患者(43.6%,25/58)中比在接受安慰剂的患者(24.9%,14/54;差异18.7[95%ci:1.4,36.0];图id,表1)中更为常见。
[0345]
尽管跨治疗组的sri(4)反应相似,但使用并入了更高的sledai-2k反应阈值的修改的sri观察到阿尼鲁单抗与安慰剂之间的更大差异(表1)。例如,sri(7)反应有29.0%的阿尼鲁单抗治疗的患者实现,相比于有17.6%的接受安慰剂的患者实现(差异11.5[95%ci:2.4,20.6])。用阿尼鲁单抗治疗的患者(46.1%)比用安慰剂治疗的患者(29.6%;差异16.4[95%ci:6.7,26.2];图1f,表1)有数值上更多的患者实现了bicla反应。达到持续bicla反应的时间差异表明,与接受安慰剂的患者相比,接受阿尼鲁单抗的患者实现持续到第52周的反应的可能性要高93%(风险比1.93;95%ci:1.38,2.73;图2a)。皮肤和关节反应的辅助性终点也在阿尼鲁单抗组中具有数值上更大的改善(表1)。例如,在预先定义的患者子集中关节计数改善≥50%在阿尼鲁单抗的情况下(53.0%,37/70)比在安慰剂的情况下(32.3%,22/68;差异20.7[95%ci:4.7,36.7])更为常见。
[0346]
在基线时具有高i型ifn药效动力学标记(倍数变化>2)的接受阿尼鲁单抗300mg的患者中,ifngs的中和在治疗早期被观察到(在第12周时基线标记的中值百分比,12.6%[中值绝对偏差=6.5],即ifngs的87.4%抑制)并维持直到第52周(图2b)。在安慰剂的情况下未观察到ifngs中和,并且在阿尼鲁单抗150mg的情况下观察到最小抑制。在阿尼鲁单抗300mg治疗的情况下抗dsdna和c3水平趋于正常(表3;图4a-图4b)。在基线时呈ada阴性和在基线后任何时候呈ada阳性的患者的百分比很小且跨治疗组相似(阿尼鲁单抗300mg,5/164的患者[3.0%];安慰剂,7/171的患者[4.1%])。呈持续ada阳性(定义为在基线时呈ada阴性且在第一次与最后一次阳性测试之间≥16周的情况下在≥2次评估时呈ada阳性)的患者数量在阿尼鲁单抗300mg组中为3/164(1.8%),并且在安慰剂组中为4/171(2.3%)。
[0347]
在阿尼鲁单抗300mg和150mg组(分别为161/180,89.4%和79/93,84.9%)中比在安慰剂组(144/184,78.3%)中有更大百分比的患者具有至少一例不良事件。严重不良事件的频率跨治疗组是相似的,其中没有事件占主导地位。
[0348]
[0349][0350]
选择sri(4)作为tulip-1的主要终点,这是因为其广泛使用并且是在阿尼鲁单抗2期muse试验中的积极结局。在tulip-1中,sri(4)反应率在安慰剂组与阿尼鲁单抗组之间没有差异;然而,其他终点(包括另一个综合终点bicla)的结果表明了阿尼鲁单抗的临床益处。尽管sri(4)和bicla包含相同的组成部分,但这些综合终点中的每一个在不同情况下可
能都是最佳的
33
。sri(4)是基于sledai-2k,它要求表现的完全消退然后该项目的得分才会改变。因此,即使这种改善是临床上有意义的,sri(4)也无法捕获器官域内的部分消退
34
。相比之下,bicla是基于bilag-2004的改善,它记录了器官域内的分级变化,并因此对检测到改善更敏感。例如,sledai-2k粘膜皮肤域中的皮疹具有2分权重,这使得即使患者经历了皮疹的完全消退,也无法仅基于这种表现实现sri(4)反应;相比之下,bicla捕获皮疹的部分或完全消退作为反应,clasi也是如此。bicla与sri之间的另一个区别在于bicla仅反映了临床改善,而sri(4)反应可以仅通过血清学改善来实现。使用更直接地靶向产生抗体的细胞的疗法更有可能观察到对血清学的影响。
[0351]
在阿尼鲁单抗治疗期间降低ocs使用的可能性是tulip-1的特别重要的结局。ocs通常用于sle管理,尽管伴随着其使用有一系列的严重不良作用随着持续时间延长和剂量升高而增加
35
。在当前的研究中,在基线时正在服用高剂量ocs(泼尼松或等效物≥10mg/d)的阿尼鲁单抗治疗的患者中,48.8%能够实现持续剂量降低至≤7.5mg/d的目标,相比之下,32.1%的接受安慰剂的患者能够实现上述目标(使用修正的限制性用药规则)。皮肤和关节疾病是最常见的sle表现之一,如在tulip-1群体中在基线时所反映的,并且数据表明用阿尼鲁单抗治疗可能改善这两种表现。在基线皮肤疾病活动性较高(clasi≥10)的患者中,与安慰剂治疗的患者相比,更多的阿尼鲁单抗治疗的患者实现了clasi活动性得分降低≥50%(分别为44%相比于25%,使用修正的用药规则)。类似地,在基线关节疾病活动性较高(≥8个肿胀和≥8个压痛关节)的患者中,与安慰剂治疗的患者相比,更多的阿尼鲁单抗治疗的患者实现了肿胀和压痛关节计数减少≥50%(分别为53%相比于33%,使用修正的用药规则)。
[0352]
尽管该试验未实现其主要终点sri(4),但阿尼鲁单抗300mg导致在达到多个其他整体和特定于器官的终点方面相对于安慰剂的数值改善,这些终点包括bicla、皮肤红斑狼疮病面积和严重度指数(clasi)、关节计数和皮质类固醇逐渐减量。
[0353]
实例2:阿尼鲁单抗在活动性系统性红斑狼疮中的功效和安全性
[0354]
tulip-2即一项3期随机双盲安慰剂对照试验评价了在尽管进行了标准照护(soc)治疗仍患有中度至重度sle的患者中为期48周每4周一次静脉内阿尼鲁单抗300mg相比于安慰剂(1:1)的功效和安全性。第52周的bicla反应是主要终点。soc是稳定的,但对于在参加时接受≥10mg/d的患者,强制性尝试口服皮质类固醇(ocs)逐渐减量至泼尼松等效物≤7.5mg/d。
[0355]
患者年龄为18-70岁并且符合美国风湿病学会sle分类标准
36
。患者患有中度至重度sle,如由sledai 2000(sledai-2k
37
得分≥6(不包括归因于发热、狼疮性头痛或器质性脑综合征的分数)并且临床sledai-2k得分≥4(不包括来自实验室结果的分数))所测量的。他们还具有在≥1个器官中的重度疾病活动性或在≥2个器官中的中度活动性(通过bilag-2004
38
测量)、器官域得分≥1个a项目或≥2个b项目
39
并且在从0(无)到3(重度疾病)的视觉模拟量表上的疾病活动性的医生整体评估(pga)≥1。在筛选时,患者对抗核抗体、抗双链dna(抗dsdna)抗体或抗史密斯抗体呈血清反应阳性,并已接受使用以下至少一种的针对sle的稳定标准照护(soc)治疗:泼尼松或等效物、抗疟药、硫唑嘌呤、咪唑立宾、霉酚酸酯/霉酚酸或甲氨蝶呤。筛选时的i型干扰素基因标记(ifngs)分类是通过中心实验室用来自全血的经分析验证的基于4基因(ifi27、ifi44、ifi44l、rsad2)定量聚合酶链反应的测试来确
定的
40
。患有活动性重度狼疮性肾炎或神经精神系统sle的患者被排除在外。
[0356]
为了使研究产品有足够的时间实现临床益处,研究人员被允许针对增加的sle疾病活动性/非sle活动性在第0周(第1天)与第12周之间施用1次皮质类固醇的激增(burst)和逐渐减量。从第0周(第1天)到第12周接受了多于1次类固醇激增和逐渐减量或者违反了任何上述标准的患者可以继续该研究,但无论是针对增加的sle活动性还是非sle病因施用了ocs激增,这些患者都被视为对于疾病活动性的后续评估的无反应者。在第12周与第40周之间,不允许针对增加的sle活性增加皮质类固醇剂量。接受高于他或她第0周(第1天)剂量的类固醇剂量的患者可以继续该研究,但被视为对于疾病活动性的后续评估的无反应者。在第40周后不允许增加ocs(但ae的管理或作为肾上腺功能不全的预防除外)。在第40周后其接受的ocs增加的患者被视为对于疾病活动性的后续评估的无反应者。
[0357]
从第8周开始并持续直到第40周,要求在基线时ocs剂量≥10.0mg/d的所有患者中尝试类固醇逐渐减量至ocs剂量≤7.5mg/d,除非满足至少一种以下标准:
[0358]
·
与主要器官系统(肾脏、中枢神经系统、心肺、血管炎、发热、血小板减少症或溶血性贫血或胃肠道活动)中的基线相比,sledai-2k活动性恶化
[0359]
·
基于系统性红斑狼疮疾病活动性指数2000(sledai-2k)的一个或多个新器官系统受累,不包括血清学异常(双链dna[dsdna]抗体、低补体血症)
[0360]
·
如由皮肤红斑狼疮病面积和严重度指数活动性得分≥10所反映的中度至重度皮肤疾病
[0361]
·
如由活动性关节计数≥8个压痛和/或肿胀关节所反映的中度至重度关节炎疾病
[0362]
主要功效评价是在阿尼鲁单抗300mg组与安慰剂组中在第52周时实现bicla反应的患者的百分比之间的差异。bicla反应被定义为所有以下项:(i)将所有重度或中重度基线疾病活动性(bilag-2004a或b)降低至较低水平(分别为b/c/d或c/d),并且在其他器官系统中无恶化(定义为≥1个新bilag-2004a或≥2个新bilag-2004b项目);(ii)确认通过sledai-2k测量的疾病活动性无恶化(相对于基线无增加);(iii)pga相对于基线的增加<0.3分;(iv)没有使用方案允许的阈值以外的限制药物;并且(v)没有中止研究产品。在揭盲之前,bicla反应而不是sri(4)反应被指定为方案修正的主要终点,这是因为其度量属性和在先前的阿尼鲁单抗试验中各治疗组之间的一致性区别。
[0363]
关键次要终点针对多重性进行了调整,并且包括:a)在基线时为ifngs测试高的患者中在第52周时实现bicla反应的患者的百分比;b)在基线剂量≥10mg/d的患者中实现从第40周持续到第52周ocs剂量降低至≤7.5mg/d的患者的百分比;c)在基线时具有中度至重度皮肤活动性(clasi≥10)的患者中在第12周时实现皮肤红斑狼疮病面积和严重度指数(clasi)
31
降低≥50%的患者的百分比;以及d)在基线时具有≥6个肿胀和≥6个压痛关节的患者中在第52周时实现肿胀和压痛关节计数两者均降低≥50%的患者的百分比。直到52周的年化发作率(与先前的访视相比,≥1个新bilag-2004a或≥2个新bilag-2004b得分)
32
也是关键次要终点。
[0364]
未针对多重性进行调整的探索性终点包括sri(4)至sri(8)反应、首次发作的时间以及持续bicla反应开始的时间。
[0365]
功效分析包括被随机化并接受≥1个剂量的研究治疗的所有患者。使用采用与用
于随机化的相同分层因子(sledai-2k、在基线时的ocs剂量和i型ifngs)的分层cochran-mantel-haenszel(cmh)测试,比较了阿尼鲁单抗组和安慰剂组在第52周时的bicla反应率的主要终点。报告了反应者的原始数量以及使用cmh调整的反应百分比和ci。类似地分析了关键次要终点和其他反应终点,但发作率除外,其使用负二项回归模型进行了分析。使用具有预定权重的加权holm程序将跨主要和关键次要终点的i型族错误率控制在0.05。基于估计的检力和相对临床重要性选择权重:在具有高基线ifngs的患者中的bicla(0.8)、ocs降低(0.06)、clasi反应(0.06)、关节计数降低(0.06)和发作率(0.02)。其他预先指定的探索性结局未针对多重性进行控制。使用cox比例风险模型评价了持续直到第52周的bicla反应开始的时间和发作时间。
[0366]
在阿尼鲁单抗300mg的情况下(47.8%,86/180)比在安慰剂的情况下(31.5%,57/182;差异16.3[95%置信区间[ci]:6.3,26.3;p=0.001])有更多的患者在第52周时实现了bicla反应(表4)。探索随时间变化的bicla反应,在所有评估的时间点,数值上更大比例的用阿尼鲁单抗治疗的患者实现了bicla(图5a),并且在阿尼鲁单抗治疗的患者中更早地实现了持续bicla反应(图5a)。
[0367]
[0368][0369]
在ifngs测试高亚群(301/362,总患者的83.1%)中,在第52周时的bicla反应率在阿尼鲁单抗组中大于在安慰剂组中(差异17.3[95%ci:6.5,28.2],调整的p=0.002])(表4)。在随机化时接受泼尼松或等效物≥10mg/d的患者(47.0%,170/362)中,观察到实现持
续降低至≤7.5mg/d的患者的比例的差异(阿尼鲁单抗51.5%,45/87;安慰剂30.2%,25/83;差异21.2[95%ci:6.8,35.7],调整的p=0.014)(表4;图5b)。在基线时患有至少中度活动性皮肤疾病(clasi≥10)的患者中,实现在第12周时clasi降低≥50%的阿尼鲁单抗治疗的患者(49.0%,24/49)多于安慰剂治疗的患者(25.0%,10/40;差异24.0[95%ci:4.3,43.6],调整的p=0.039)(图5c)。阿尼鲁单抗组(42.2%,30/71)和安慰剂组(37.5%,34/90)的在基线时具有≥6个肿胀和≥6个压痛关节的在52周时实现肿胀和压痛关节计数两者均减少≥50%的患者的百分比是相似的(差异4.7[95%ci:-10.6,20.0],调整的p=0.55)。阿尼鲁单抗的基于bilag的年化发作率在数值上低于安慰剂(分别为0.43相比于0.64;率比0.67[95%ci:0.48,0.94])(调整的p=0.081),并且首次发作的时间的探索性分析支持阿尼鲁单抗(风险比,0.65;95%ci:0.46,0.91)(图6b)。
[0370]
在阿尼鲁单抗组(55.5%,100/180)中的在第52周时的sri(4)反应在数值上大于安慰剂组(37.3%,68/182;差异18.2[95%ci:8.1,28.3])(表4)。对于sri(5-8)的每个较高阈值,观察到支持阿尼鲁单抗的数值差异。
[0371]
在基线时为i型ifngs测试高的接受阿尼鲁单抗的患者(150/180,83.3%)中,ifngs的中和在治疗的早期被实现(在第12周时的中值百分比中和=88.0%)并且被维持直到第52周(表5;图7)。在安慰剂治疗的情况下未观察到ifngs中和。在基线时具有异常抗dsdna的患者中,阿尼鲁单抗治疗使水平趋于正常化。在基线时具有异常(低)补体水平的患者中,在阿尼鲁单抗的情况下观察到数值上更大的增加。在基线时呈ada阴性的阿尼鲁单抗治疗的患者中,几乎没有患者在基线后的任何时候呈ada阳性(1/170的患者[0.6%])。
[0372]
159/180(88.3%)阿尼鲁单抗治疗的患者和153/182(84.1%)安慰剂治疗的患者报告了不良事件。
[0373]
表5.干扰素基因标记抑制、免疫生物标记物和免疫原性结果
[0374][0375]
*
除非另外指出,否则是在第52周时测量的。
[0376]
在2次或更多次评估(在第一次与最后一次阳性测试之间≥16周的情况下)时检测到或在最后一次评估(在基线时呈ada阴性的患者中)时检测到治疗诱导的ada。
[0377]
缩写:ada=抗药物抗体;bl=基线;c3=第三补体;c4=第四补体;ch50=总溶血补体水平;dsdna=双链dna;ifngs=干扰素基因标记;sd=标准偏差;wk=周。
[0378]
实例2.早期持续反应
[0379]
在2项3期试验中在患有活动性系统性红斑狼疮(sle)的患者中在阿尼鲁单抗治疗的情况下的早期和持续反应
[0380]
背景
[0381]
在sle的3期tulip-2和tulip-1试验中,相比于安慰剂,用i型干扰素受体抗体阿尼鲁单抗治疗导致在第52周时具有bicla反应的患者的比例更高,其中差异分别为16.3%(主
要终点;p=0.001,95%ci 6.3-26.3)和16.4%(次要终点;95%ci 6.7-26.2)。
[0382]
目的
[0383]
为了更好地了解对阿尼鲁单抗的bicla反应的时间过程,我们在tulip-2和tulip-1中检查了与安慰剂相比随时间变化的反应,包括从达到持续直到第52周的反应。还评估了主要临床反应(mcr)和部分临床反应(pcr)作为可替代结局衡量指标。特别地,为了比较在tulip-1、tulip-2和合并的tulip数据中在早期时间点随时间变化的对阿尼鲁单抗相比于安慰剂的bicla反应、持续到第52周的反应开始的时间以及主要和部分临床反应。主要临床反应被定义为在第24周时所有bilag-2004得分为c或更好,维持直到第52周,且在第24-52周之间没有新a或b得分。部分临床反应被定义为在第24周时最高1个bilag-2004b得分,维持直到第52周,且直到第52周没有新a或>1个新b域得分。
[0384]
方法
[0385]
tulip-2和tulip-1随机双盲安慰剂对照试验评价了阿尼鲁单抗(300mg q4w)历经52周在患有中度至重度活动性sle的正在接受标准照护治疗的患者中的功效和安全性。使用cox比例风险模型评价了从达到持续直到第52周的bicla反应开始的时间。mcr被定义为在第24周时所有bilag-2004得分为c或更好,在第24-52周之间维持没有新a或b得分。pcr被定义为在第24周时≤1个bilag-2004b得分,直到第52周时维持没有新a或>1个新b域得分。对于tulip-1,使用修正的限制性用药规则分析了bicla反应率和bicla反应开始的时间;使用预先指定的分析计划分析了mcr和pcr。
[0386]
结果
[0387]
从早期时间点开始,在阿尼鲁单抗的情况下相比于在安慰剂的情况下有更多的bicla反应者(图9、图11、图12)。持续bicla反应开始的时间支持阿尼鲁单抗(图11、图12)。在具有持续bicla反应的患者的百分比以及具有pcr和mcr的患者的百分比方面存在支持阿尼鲁单抗的数值差异(图13)。总体而言,在tulip-2和tulip-1中各有180名患者接受了阿尼鲁单抗,相比之下,在安慰剂组中分别为182名和184名患者。在tulip-2中的前3次评估(第4周、第8周和第12周)时,与安慰剂(21.3%、21.6%和31.8%)相比,数值上更大百分比的用阿尼鲁单抗治疗的患者(分别为26.8%、35.3%和42.9%)被分类为具有bicla反应。在阿尼鲁单抗的情况下(23.3%、34.2%和36.5%)相比于在安慰剂的情况下(18.3%、23.2%和27.5%)在tulip-1中观察到相似的趋势。从开始持续直到第52周的bicla反应开始的时间在tulip-2(hr 1.55,95%ci 1.11-2.18)和tulip-1(hr 1.93,95%ci 1.38-2.73)两者中均支持阿尼鲁单抗。在tulip-2中,86名(47.8%)用阿尼鲁单抗治疗的患者具有从开始时持续直到第52周的bicla反应,相比之下,在安慰剂组中有57名(31.3%)患者具有上述情况。在tulip-1中,在阿尼鲁单抗治疗组中有85名(47.2%)患者具有从开始时持续直到第52周的bicla反应,相比之下,在安慰剂组中有55名(29.9%)患者具有上述情况。在tulip-2和tulip-1中,分别在20.8%和22.1%的用阿尼鲁单抗治疗的患者中观察到mcr,相比之下,在10.9%和15.8%的接受安慰剂的患者中观察到。在46.8%和45.4%的阿尼鲁单抗治疗的患者中观察到pcr,相比之下,分别在安慰剂组中的38.4%和40.2%中观察到。
[0388]
结论
[0389]
快速且持久的bicla反应支持阿尼鲁单抗对于患有中度至重度活动性sle的患者的临床益处。在2项3期研究中,与安慰剂相比,在阿尼鲁单抗治疗的情况下更大比例的患者
实现了从开始持续直到第52周的bicla反应。跨这些tulip研究,阿尼鲁单抗导致在维持直到第52周的bicla反应开始的时间方面在数值上有利的差异。mcr和pcr也支持阿尼鲁单抗。这些数据支持源自对患有活动性sle的患者进行阿尼鲁单抗治疗的临床益处的可持续性。
[0390]
实例3:在患者亚组中的功效
[0391]
目的
[0392]
为了比较在tulip-1和tulip-2中以及跨合并的tulip-1和tulip-2数据在方案定义的患者亚组中直到第52周对阿尼鲁单抗相比于安慰剂的bicla反应。表6和表7中显示了基线特征。
[0393]
结果
[0394]
在第52周时,在tulip-1、tulip-2和合并的tulip数据中跨预先指定的亚组在阿尼鲁单抗的情况下观察到稳健的bicla反应率。对人口统计学(图14-图16)、基线疾病活动性(图17)、基线ocs剂量(图18)、基线i型ifngs测试状态(图19)的效应量没有实质性影响。在ifngs测试高和低患者中,对阿尼鲁单抗的反应率是相似的(图19)。
[0395]
表6:基线患者人口统计学
[0396][0397][0398]
bmi,身体质量指数;ifngs,i型干扰素基因标记;ocs,口服皮质类固醇;sd,标准偏差;sledai-2k,系统性红斑狼疮疾病活动性指数2000;qpcr,定量聚合酶链反应。
[0399]
表7:基线疾病特征
[0400][0401]
实例4:发作评估
[0402]
背景
[0403]
在3期tulip-2和tulip-1试验中,阿尼鲁单抗治疗导致在患有系统性红斑狼疮(sle)的患者中基于大不列颠群岛狼疮评估组(bilag)的综合狼疮评估(bicla)反应率的改善。此外,与安慰剂相比,在用阿尼鲁单抗治疗的组中年化发作率更低
[0404]
目的
[0405]
分析了tulip-2和tulip-1数据以评估在52周治疗期间阿尼鲁单抗对sle发作次数和首次发作的时间的影响。
[0406]
方法
[0407]
随机双盲安慰剂对照tulip-2和tulip-1试验评价了在尽管进行了标准照护治疗仍患有中度至重度sle的患者中为期48周每4周一次静脉内阿尼鲁单抗300mg相比于安慰剂的功效和安全性,且在第52周时评估主要终点。发作被定义为与上个月的访视相比的≥1个新bilag-2004a或≥2个新(恶化的)bilag-2004b域得分。使用cox比例风险模型评价了首次发作的时间。使用负二项回归模型分析了年化发作率。
[0408]
结果
[0409]
在tulip-2(阿尼鲁单抗,n=180;安慰剂,n=182)和tulip-1(阿尼鲁单抗,n=180;安慰剂,n=184)中,与安慰剂组(tulip-2:42.3%,n=77;tulip-1:43.5%,n=80;图20)相比,阿尼鲁单抗组中经历≥1次bilag-2004发作的患者更少(tulip-2:31.1%,n=56;tulip-1:36.1%,n=65)。跨两项试验,在首次发作的时间(tulip-2:风险比[hr]0.65,95%置信区间[ci]0.46-0.91和tulip-1:hr 0.76,95%ci 0.55-1.06;图21)以及基于bilag的年化发作率(tulip-2:调整的率比0.67,95%ci 0.48-0.94和tulip-1:率比0.83,95%ci 0.60-1.14)方面观察到支持阿尼鲁单抗的结果。在tulip-2中,与安慰剂组相比,阿尼鲁单抗组中的年化bilag发作率(相比于先前访视)显著更低(图22)。与安慰剂组(分别为43.5%、42.3%和42.9%;图23)相比,在tulip-1、tulip-2和合并的tulip中阿尼鲁单抗组(分别为36.1%、31.1%和33.6%)中更少的患者经历了相比于先前访视≥1次bilag发作
[0410]
结论
[0411]
跨2项3期试验,与安慰剂相比,在阿尼鲁单抗治疗的情况下我们观察到发作总次数和年化发作率降低并且首次发作的时间延长。这些结果支持阿尼鲁单抗降低疾病活动性
和降低发作从而使患有sle的患者受益的潜力。tulip试验的结果支持阿尼鲁单抗在存在ocs逐渐减量的情况下不仅具有降低疾病活动性的能力,还具有降低发作的能力,ocs逐渐减量是对于患有sle的患者的长期管理至关重要的属性。
[0412]
实例5:了解bicla
[0413]
背景
[0414]
基于bilag的综合狼疮评估(bicla)是经验证的sle疾病活动性综合衡量指标,其记录器官系统内的部分和完全两种改善。在阿尼鲁单抗的3期tulip-1和tulip-2试验中,bicla已被用作终点。该研究对在tulip-1和tulip-2中bicla反应与sle的临床/实验室评估之间的关系进行了研究,而不考虑治疗。
[0415]
方法
[0416]
这是对随机双盲tulip-1和tulip-2试验的事后分析。将尽管进行了标准照护仍患有中度至重度活动性sle的患者随机化为接受阿尼鲁单抗(150或300mg iv q4w)或安慰剂持续48周,且在第52周时评估主要终点。bicla反应由所有以下项定义:基线bilag-2004a和b域得分分别降低至b/c/d和c/d,并且在任何器官系统中无恶化;sle疾病活动性指数2000(sledai-2k)得分无恶化;医生整体评估(pga;范围0-3)无≥0.3分的恶化。维持口服皮质类固醇(ocs)剂量降低被定义为到第40周实现ocs剂量≤7.5mg/d并维持直到第52周。皮肤红斑狼疮病面积和严重度指数活动性(clasi-a)反应被定义为对于在基线时clasi-a≥10的患者clasi-a得分相对于基线降低≥50%。
[0417]
结果
[0418]
在bicla反应者(n=318)和无反应者(n=501)中,基线特征总体上是可比较的。总体而言,在bicla反应者相比于无反应者中观察到改善的结局,包括从基线到第52周sledai-2k在数值上更大的改善(-7.4[sd:3.64]相比于-4.2[4.28])。从基线到第52周,在bicla反应者相比于无反应者中观察到更大的均值ocs日剂量降低(-5.4[sd:6.84]相比于-1.7[8.08]),并且在第52周时,更多的bicla反应者相比于无反应者(79.2%相比于19.1%)实现了维持ocs剂量降低。在第52周时,更多的bicla反应者相比于无反应者(92.0%相比于23.2%)实现了clasi-a得分降低。从基线到第52周,在bicla反应者相比于无反应者中观察到均值抗dsdna水平的更大降低(-46.1[sd:335.69]相比于15.8[450.92]);对于补体蛋白c3和c4,也观察到数值改善。
[0419]
结论
[0420]
bicla反应与sle的多种临床和实验室衡量指标的改善相关,从而增强了其作为sle试验中具有临床上有意义的主要终点的价值。在两项iii期临床试验中,用i型ifn抑制剂阿尼鲁单抗治疗患有sle的患者导致患者中与sle的多种临床和实验室衡量指标的其他改善相关的bicla反应。
[0421]
实例5:如通过clasi测量的皮肤疾病严重度的早期和持续降低
[0422]
背景
[0423]
皮肤是在sle中受累的第二常见器官,其中多达85%的患者正在经历皮肤疾病。皮肤红斑狼疮病面积和严重度指数(clasi)是用范围从0(轻度)到70(重度)的活动性得分(clasi-a)测量皮肤疾病严重度的经验证的指数。clasi-a包括红斑、鳞屑/肥大、粘膜病变、近期脱发和非瘢痕性脱发的衡量指标。在患有sle的患者的3期tulip-1和-2期试验中,与安
慰剂相比,在阿尼鲁单抗的情况下更大比例的在基线时clasi-a≥10的患者在第12周时实现了clasi-a降低≥50%。我们使用从tulip-1和-2合并的数据进一步评价了阿尼鲁单抗对特定于皮肤的sle疾病活动性的影响。
[0424]
方法
[0425]
tulip-1和-2是52周随机双盲安慰剂对照试验,它们评价了阿尼鲁单抗(300mg iv,每4周一次持续48周)在尽管进行了标准照护治疗仍患有中度至重度活动性sle的患者中的功效和安全性。根据tulip-2方案,使用限制性用药规则分别分析了tulip-1和-2,并合并了来自两项试验的数据。我们比较了接受阿尼鲁单抗相比于安慰剂的患者中随时间变化的皮肤反应。clasi-a反应被定义为对于clasi-a≥10的患者clasi-a得分相对于基线降低≥50%。使用cox比例风险模型评价了clasi-a反应的时间。
[0426]
结果
[0427]
总共360名患者接受了阿尼鲁单抗,并且366名接受了安慰剂。在基线时,均值(sd)clasi-a得分为8.1(7.41);95.9%(696/726)的患者的基线clasi-a>0,并且27.7%(201/726)的基线clasi-a≥10。在基线clasi-a≥10的患者亚组中,到第8周,36.0%(38/107)的接受阿尼鲁单抗的患者相比于21.7%(21/94)的接受安慰剂的患者(差异14.3;95%ci 1.8%,26.9%)实现了clasi-a反应(降低≥50%)。(图24)。在tulip-1(风险比[hr]1.91;95%ci 1.14,3.27)和tulip-2(hr 1.55;95%ci 0.87,2.85)中,在持续到第52周的clasi-a反应的时间方面观察到支持阿尼鲁单抗的结果(图25)。在基线clasi-a>0的患者亚组中,在tulip-1和-2两者中,在阿尼鲁单抗组相比于安慰剂组中到第12周有更多数量的患者实现了clasi-a反应(降低≥50%)(标称p<0.05)(图26);在tulip-1和-2两者中,在基线clasi-a≥10的患者亚组中观察到相似的效果(标称p<0.05)(图26)。图27中显示了来自一名进行阿尼鲁单抗(300mg)治疗的患者的实例。
[0428]
结论
[0429]
在基线时具有轻度至重度皮肤活动性的患者亚组中,阿尼鲁单抗治疗与特定于皮肤的sle疾病活动性的快速且持久改善相关,如通过clasi所评估的。这些发现证明,阿尼鲁单抗具有降低患有中度至重度活动性sle的患者中皮肤疾病活动性的能力。
[0430]
实例6:bilca的临床相关性
[0431]
背景
[0432]
基于大不列颠群岛狼疮评估组的综合狼疮评估(bicla)是系统性红斑狼疮(sle)临床试验中经验证的治疗反应整体衡量指标。为了了解bicla与临床实践的相关性,研究了bicla反应和常规sle评估与患者报告结局(pro)之间的关系。
[0433]
bicla是在专家小组对sle临床试验中使用的疾病活动性指数进行审查后开发的。bicla反应要求通过bilag-2004评估的在基线时受累的所有域的改善、其他bilag-2004域无恶化、sledai-2k和pga两者相比于基线均无恶化、没有开始非方案治疗或方案允许的阈值以外的使用并且没有中止研究产品。因此,与sri形成对照,bicla中功效的驱动物是bilag-2004,而除bilag之外,还使用sledai-2k和pga评估恶化。基于bilag-2004的bicla对器官系统均等地加权,并区分非活动性疾病、部分和完全改善以及疾病活动性的退化,而基于sledai-2k的sri为器官系统分配权重并要求受累器官系统中疾病活动性完全消退以捕获改善。
[0434]
在临床实践中通常不使用综合sle评估。因此,临床医生可能并不喜欢以这种方式评估的治疗反应的相关性。因此,我们研究了bicla反应与其他sle疾病衡量指标之间的关系,这些sle疾病衡量指标在现实世界的临床实践中是有意义的,包括发作、口服糖皮质激素日剂量和持续口服糖皮质激素逐渐减量、pro、医疗资源利用以及整体和特定于器官的疾病的临床和实验室衡量指标。无论治疗组的分配如何,使用来自阿尼鲁单抗的3期tulip-1和tulip-2试验的合并数据评估了bicla反应者与无反应者之间的这些关系。
[0435]
方法
[0436]
患者和研究设计
[0437]
这是对来自3期随机安慰剂对照双盲52周tulip-1和tulip-2试验的合并数据的事后分析。简而言之,符合条件的患者年龄为18至70岁,符合美国风湿病学会修正的sle分类标准(13),并且尽管进行了标准照护治疗仍患有血清反应阳性的中度至重度sle。患有活动性重度狼疮性肾炎或神经精神系统sle的患者被排除在外。将患者随机化为接受每4周一次安慰剂或阿尼鲁单抗的静脉内输注持续48周以及标准照护治疗(tulip-1:安慰剂、阿尼鲁单抗150mg或阿尼鲁单抗300mg[2∶1∶2];tulip-2:安慰剂或阿尼鲁单抗300mg[1∶1])。在第52周时评估主要终点。在整个试验过程中,其他治疗均稳定,但由方案确定的意图逐渐减量的口服糖皮质激素产生的治疗除外。对于在基线时接受口服糖皮质激素≥10mg/d的患者,要求在第8周与第40周之间尝试将口服糖皮质激素逐渐减量至≤7.5mg/d;也允许在基线时接受口服糖皮质激素<10mg/d的患者逐渐减量。要求在第40周与第52周之间稳定口服糖皮质激素剂量。
[0438]
研究终点和评估
[0439]
bicla反应被定义为所有以下项:所有基线bilag-2004 a和b域得分分别降低至b/c/d和c/d,并且在其他bilag-2004器官系统中无恶化,如由≥1个新bilag-2004 a或≥2个新bilag-2004 b域得分所定义的;sledai-2k得分无增加(相对于基线);pga得分无增加(相对于基线≥0.3分);没有中止研究产品;并且没有使用方案允许的阈值以外的限制药物。根据tulip-2限制性用药分析规则对合并数据进行了分析,以对反应者/无反应者进行分类。
[0440]
在第52周时,无论治疗组的分配如何,比较了bicla反应者与无反应者之间的临床结局衡量指标,并且结果以临床相关性层次呈现,作者之间达成了共识。结局衡量指标包括直到第52周具有发作(定义为与先前访视相比≥1个新bilag-2004 a或≥2个新bilag-2004 b域得分)的患者的百分比、年化发作率、实现持续口服糖皮质激素逐渐减量(定义为在基线时接受≥10mg/d的患者中到第40周实现且持续直到第52周的口服糖皮质激素剂量降低至≤7.5mg/d泼尼松或等效物)的患者的百分比以及日口服糖皮质激素剂量从基线到第52周的变化。评估了从基线到第52周的pro的变化,这些pro包括慢性病治疗功能评估-疲劳[facit-f]中的反应(定义为>3分改善)、36条简明健康状况调查表第2版[sf-36-v2][快速]躯体健康总评[pcs]和精神健康总评[mcs]中的反应(定义为pcs中改善>3.4和mcs中改善>4.6)以及患者整体评估[ptga]相对于基线的变化。还评估了医疗资源利用(医疗保健就诊、急诊科[ed]使用和医院就诊)。在bicla反应者与无反应者之间比较的其他指数包括从基线到第52周的sledai-2k、pga、关节计数(活动性、肿胀、压痛)以及皮肤红斑狼疮病面积和严重度指数活动性(clasi-a)反应(定义为在基线时clasi-a得分≥10的患者中clasi-a得分降低≥50%)的变化。评价了血清学(抗双链dna[抗dsdna]抗体以及补体c3和c4);抗
dsdna抗体水平被分类为“阳性”(>15u/ml)或“阴性”(≤15u/ml),并且补体水平被分类为“异常”(c3,《0.9g/l;c4,《0.1g/l)或“正常”(c3,≥0.9g/l;c4,≥0.1g/l)。还评估了不良事件(ae)。
[0441]
统计学分析
[0442]
tulip-1和tulip-2研究的类似设计允许将结果合并。为tulip-1和tulip-2选择样本大小以获得足够的安全性数据库大小以及评估关键次要终点。在tulip-1和tulip-2中,使用0.05的双侧α,180名受试者/组分别产生>99%和88%的检力来拒绝假设(主要终点无差异)。使用分层cochran-mantel-haenszel方法计算反应者相比于无反应者比率,该方法包括筛选时sledai-2k得分(《10或≥10)、基线口服糖皮质激素剂量(<10mg/d或≥10mg/d)以及筛选时的i型ifngs测试状态(测试低或测试高)的分层因子。该模型中也包括研究。对于所有反应者分析,如果患者在评估前使用方案允许的阈值以外的限制药物或中止研究产品,则他们被视为无反应者。使用采用基线值、组、访视、研究和筛选时所用的分层因子的固定效应的混合重复测量模型评估了对bicla反应者与无反应者之间从基线到第52周的估计变化的比较;使用组-访视相互作用项,并且访视是该模型中的重复变量。对于数据缺失的首次访视,使用末次观测值结转法估算缺失数据;未估算数据缺失的后续访视。对于反应者分析,如果由于数据缺失而无法得出变量的任何组成部分,则将患者分类为对于该次访视的无反应者。
[0443]
结果
[0444]
试验群体
[0445]
合并了tulip-1中457名患者和tulip-2中362名患者的数据(n=819)。跨两项试验,360名患者接受了阿尼鲁单抗300mg,93名患者接受了阿尼鲁单抗150mg,并且366名患者接受了安慰剂。无论治疗组的分配如何,在第52周时有318名bicla反应者和501名bicla无反应者。患者的人口统计学和基线临床特征跨bicla反应者与无反应者总体上是平衡的(表8和表9)。大多数患者为女性(92.5%,反应者;93.0%,无反应者),并且反应者的均值(标准偏差[sd])年龄为41.5(11.67)岁且无反应者为41.7(12.13)岁。bicla反应者与无反应者的比例相似,白人(67.0%相比于65.9%)、黑人/非裔美国人(14.2%相比于12.6%)或亚洲人(9.1%相比于11.0%)。
[0446]
总体而言,在bicla反应者相比于无反应者中观察到改善的结局。
[0447]
表8.患者人口统计学和基线临床特征
[0448]
[0449]
[0450][0451]
bicla,基于bilag的综合狼疮评估;bilag-2004,大不列颠群岛狼疮评估组-2004;clasi,皮肤红斑狼疮病面积和严重度指数;dsdna,双链dna;ifngs,干扰素基因标记:max,最大值;min,最小值;pga,医生整体评估;sd,标准偏差;sdi,系统性红斑狼疮国际合作诊所/美国风湿病学会损伤指数(systemic lupus international collaborating clinics/american college of rheumatology damage index);sle,系统性红斑狼疮;sledai-2k,sle疾病活动性指数2000。
[0452]a口服糖皮质激素包括泼尼松或等效物;b活动性关节被定义为具有肿胀和压痛的关节;c抗dsdna抗体“阳性”被定义为结果>15u/ml。d只有具有抗dsdna抗体且在基线时补体水平异常的患者才被包括在各个变量的概要统计中。e补体c3水平“异常”被定义为结果<0.9g/l。f补体c4水平“异常”被定义为结果<0.1g/l。
[0453]
表9.bicla反应者与无反应者的患者人口统计学和基线sle药物
[0454][0455][0456]
bicla,基于大不列颠群岛狼疮评估组的综合狼疮评估;;sd,标准偏差;sle,系统性红斑狼疮。
[0457]a16名患者(反应者组与无反应者组中各8名)缺失人种数据;b口服糖皮质激素包括泼尼松或等效物;c免疫抑制剂包括硫唑嘌呤、甲氨蝶呤、霉酚酸酯、霉酚酸和咪唑立宾。
[0458]
发作
[0459]
在52周治疗期内无发作的bicla反应者多于无反应者(76.1%相比于52.2%),这意味着与无反应者相比,在52周时间段内更少的bicla反应者经历了≥1次发作(23.9%相比于47.8%;差异-23.9%;95%置信区间[ci]-30.4至-17.5;标称p<0.001)(图28a)。对于bicla反应者相比于无反应者,有更少的患者经历了1、2或≥3次发作,并且年化发作率更低(率比[rr]0.36,95%ci0.29至0.47;标称p<0.001)(表10)。
[0460]
表10.bicla反应者与无反应者中的sle发作
[0461][0462][0463]
bicla,基于bilag的综合狼疮评估;bilag-2004,大不列颠群岛狼疮评估组-2004;ci,置信区间;cmh,cochran-mantel-haenszel;pga,医生整体评估;sd,标准偏差;sle,系统性红斑狼疮;sledai-2k,sle疾病活动性指数2000。
[0464]
bilag-2004发作通过与先前访视相比≥1个新bilag-2004 a或≥2个新bilag-2004b域得分来定义。
[0465]a使用分层cmh方法对百分比、差异、ci和标称p值进行加权和计算。
[0466]b使用负二项回归模型计算发作率,该模型包括组和分层因子的协变量。随访时间(以e为基底)的对数用作该模型中的偏移变量,以针对不同的曝光时间进行调整。
[0467]
口服糖皮质激素使用和类固醇节制
[0468]
在基线时,相似百分比的bicla反应者与无反应者正在以任何剂量和以≥10mg/d接受口服糖皮质激素。从基线到第52周,bicla反应者相比于无反应者的日口服糖皮质激素剂量有更大降低(最小二乘[ls]均值差异-4.29mg/d,95%ci-5.37至-3.20,标称p<0.001)(图28b)。在基线时正在接受口服糖皮质激素≥10mg/d的患者中,与无反应者相比,更多的bicla反应者实现了持续口服糖皮质激素剂量降低至≤7.5mg/d的次要终点(79.2%相比于19.1%;差异60.1%,95%ci 52.1%至68.1%,标称p<0.001)(图28c)。在bicla反应者相比于无反应者中直到第52周的均值(sd)累积口服糖皮质激素剂量要低31.3%(2159.20[1661.39]mg相比于3140.81[3081.19]mg)(图28d)。
[0469]
pro
[0470]
在基线时bicla反应者与无反应者的facit-f、sf-36mcs和sf-36pcs得分是相似的(表11)。与无反应者相比,在更多的bicla反应者中报告了facit-f的改善(55.6%相比于15.7%;差异40.0%,95%ci 33.6%至46.3%,标称p<0.001)(图29a)。类似地,与无反应者相比,更多的bicla反应者在sf-36pcs(57.9%相比于12.8%;差异45.1%,95%ci 38.9%至51.3%,标称p<0.001)和sf-36mcs(42.6%相比于12.3%;差异30.3%,95%ci 24.1%至36.5%,标称p《0.001)方面具有高于预先定义的阈值的改善(图29a-图29c)。
[0471]
表11.bicla反应者与无反应者在基线时的pro得分
[0472][0473]
bicla,基于大不列颠群岛狼疮评估组的综合狼疮评估;facit-f,慢性病治疗功能评估-疲劳;mcs,精神健康得分;pcs,躯体健康得分;pro,患者报告结局;ptga,患者整体评估;sd,标准偏差;sf-36-v2,36条简明健康状况调查表第2版(快速回忆)。
[0474]
ptga
[0475]
bicla反应者与无反应者在基线时的ptga得分是相似的。与无反应者相比,bicla反应者报告了从基线到第52周的ptga得分的更大改善(ls均值差异-11.1,95%ci-14.9至-7.3,标称p<0.001)(图29d)。
[0476]
医疗资源利用
[0477]
在52周试验期间,与无反应者相比,更少的bicla反应者具有医疗保健就诊
(62.5%相比于70.7%;差异-8.3%,95%ci-14.9%至-1.6%,标称p=0.015)(表12)。与无反应者相比,更少的bicla反应者需要急诊科(ed)就诊(11.9%相比于21.8%;差异-9.9%,95%ci-15.2%至-4.5%,标称p=0.001),并且更少的ed就诊与增加的sle活动性有关(2.6%相比于24.0%;差异-21.4%,95%ci-35.3%至-7.5%,标称p=0.003)。类似地,与无反应者相比,更少的bicla反应者具有医院就诊(4.5%相比于14.4%;差异-10.0%,95%ci-14.3%至-5.7%,标称p<0.001),并且在bicla反应者中无医院就诊与增加的sle活动性有关,相比之下,在bicla无反应者中为38.5%(差异-38.5%,95%ci-58.8%至-18.2%,标称p<0.001)。
[0478]
表12.bicla反应者与无反应者的医疗资源利用
[0479]
[0480][0481]
bicla,基于大不列颠群岛狼疮评估组的综合狼疮评估;ci,置信区间;ed,急诊科;icu,重症监护病房;sd,标准偏差;sle,系统性红斑狼疮。
[0482]a使用分层cmh方法计算百分比、差异、ci和标称p值。b在bicla无反应者组中有8名患者缺失医院就诊和急诊科就诊的数据。
[0483]
sledai-2k和pga
[0484]
在基线时,反应者与无反应者之间的均值(sd)sledai-2k和pga得分是相似的(表1)。从基线到第52周,在总sledai-2k(ls均值差异-3.5,95%ci-4.1至-3.0,标称p<0.001)(图30a)和pga得分(ls均值差异-0.59,95%ci-0.67至-0.51,标称p<0.001)(图30b)方面,观察到bicla反应者相比于无反应者有更大的改善。
[0485]
clasi活动性
[0486]
总体而言,32.4%的bicla反应者和25.5%的无反应者的基线clasi-a≥10(表1)。在这些患者中,更多的bicla反应者相比于无反应者在第52周时实现了clasi-a降低≥50%(92.0%相比于23.2%;差异68.8%,95%ci 59.2%至78.3%,标称p<0.001)(图31a)。
[0487]
关节计数
[0488]
在基线时,在bicla反应者与无反应者中的均值(sd)活动性关节计数(定义为具有肿胀和压痛的关节)分别为6.1(5.22)和6.9(5.97)。均值(sd)肿胀关节计数分别为6.5(5.27)和7.4(6.08),并且压痛关节计数分别为9.8(6.94)和11.1(7.85)。从基线到第52周,对于活动性(ls均值差异-1.9,95%ci-2.4至-1.4,标称p<0.001)、压痛(ls均值差异-3.6,95%ci-4.4至-2.8,标称p<0.001)和肿胀(ls均值差异-2.1,95%ci-2.7至-1.6,标称p<0.001)关节,bicla反应者相比于无反应者的关节计数改善更多(图31b)。
[0489]
血清学
[0490]
在bicla反应者与无反应者之间,在基线时呈抗dsdna抗体阳性的患者的百分比是相等的。在相似比例的bicla反应者与无反应者(5.0%相比于4.4%)中观察到从阳性到阴性抗dsdna抗体状态的改善(表13)。
[0491]
表13.bicla反应者与无反应者的从基线到第52周的血清学变化
[0492][0493][0494]
bicla,基于大不列颠群岛狼疮评估组的综合狼疮评估;ci,置信区间;dsdna,双链dna;max,最大值;min,最小值;sd,标准偏差。
[0495]a抗dsdna抗体“阳性”或“阴性”被分别定义为结果>15u/ml或≤15u/ml。
[0496]b补体c3水平“异常”或“正常”被分别定义为结果<0.9g/l或c3<0.9g/l。
[0497]c补体c4水平“异常”或“正常”被分别定义为结果<0.1g/l或c3<0.1g/l。
[0498]
只有基线抗dsdna阳性或补体c3或c4异常的患者才被包括在该分析中。使用采用基线值、组、访视、研究和分层因子的固定效应的重复测量模型计算百分比变化、差异、ci和标称p值。访视-组相互作用项用于解释跨组的不同关系,并且访视是该模型中的重复变量。由于缺失数据,百分比不等于100%。
[0499]
在基线时,相似比例的bicla反应者与无反应者具有异常的c3和c4水平。对于c3(ls均值差异2.82,95%ci-4.185至9.819,标称p=0.429)或c4(ls均值差异-9.63,95%ci-25.174至5.910,标称p=0.223),补体水平从基线到第52周的百分比变化在bicla反应者相比于无反应者之间并无差异(表13)。与无反应者相比,更多的bicla反应者具有从异常到正常c3(10.4%相比于7.0%)和c4(7.5%相比于4.8%)的改善。
[0500]
安全性
[0501]
在bicla反应者与无反应者之间的ae频率是相似的(83.6%和85.2%)(表14)。相似百分比的bicla反应者与无反应者报告了轻度和中度ae,而与无反应者相比,更少的bicla反应者经历了重度ae(3.8%相比于9.4%)。在bicla反应者中没有导致中止的ae(dae),相比之下,在无反应者中有8.2%的dae。与无反应者相比,更少的bicla反应者经历了严重ae(5.0%相比于19.0%)。与无反应者相比,更少的bicla反应者具有非机会性严重感染(2.2%相比于6.8%)。在bicla反应者与无反应者中患有带状疱疹的患者的百分比是相似的(4.7%相比于3.6%),患有流感(1.9%相比于2.0%)或恶性肿瘤(0.6%相比于1.0%)的患者的百分比也是如此。
[0502]
表14.在bicla反应者与无反应者中在治疗期间的ae
[0503]
[0504][0505]
ae,不良事件;aesi,特别关注的不良事件;dae,导致中止的不良事件;sae,严重不良事件;sle,系统性红斑狼疮;tb,结核病。
[0506]
结论
[0507]
bicla是二分法sle结局衡量指标,其基于器官域活动性的变化将患者分类为反应者或无反应者。由于bicla主要用于临床试验环境中,因此该研究的目的是从与患者和医生相关的结局角度评估bicla反应的意义。在从招募进tulip-1和tulip-2试验中的819名患者获取的合并数据的该事后分析中,跨一系列sle评估、关键pro和医疗资源利用衡量指标,bicla反应与临床结局的改善显著相关。
[0508]
在增加或不增加糖皮质激素剂量的情况下,发作对患有sle的患者均构成重大风险。从长远来看,疾病发作和口服糖皮质激素使用两者均与器官损害相联系,器官损害本身会增加死亡风险。发作还与健康相关生活质量下降相关,并且发作严重度和口服糖皮质激素使用与医疗保健成本有关联。因此,关键的sle治疗目标是预防发作,同时最小化口服糖皮质激素暴露,这转而有望降低医疗资源利用。我们观察到bicla反应者具有更少的疾病发作以及更低的日口服糖皮质激素剂量。更大百分比的bicla反应者实现了持续口服糖皮质激素降低至目标剂量。他们与无反应者相比还具有更少的住院治疗和ed就诊,包括与增加的sle活动性有关的那些。如通过pga、sledai-2k、clasi-a和关节计数所测量的,在反应者相比于无反应者中还观察到整体和特定于组织的疾病活动性的更大改善。由于已证明在疾病活动性和口服糖皮质激素暴露方面改善的患者结局与降低的医疗保健成本相关,因此bicla反应者可能比无反应者承担更低的医疗保健成本。
[0509]
我们还评估了bicla反应者与无反应者中的不良事件。与和bicla反应相关的更低的发作率、降低的医疗资源利用以及更少的sle有关的ed就诊和住院治疗相一致,在bicla反应者相比于无反应者中有更少的sae。尽管由于任何原因中止研究产品导致按定义将患者分类为bicla无反应者,但值得注意的是,与bicla反应者相比,bicla无反应者因ae而中止的倾向更大。
[0510]
pro已被并入几乎所有sle临床试验中。然而,由于患者对疾病活动性和疾病的感知受疲劳和生活质量的严重影响且未被疾病活动性的正常衡量指标的结果所捕获,因此分析通常会在临床结局与pro之间产生不一致。在tulip试验中,bicla反应者在经验证的pro方面有改善,这些pro包括sf-36健康状况调查表的躯体和精神健康组分以及疲劳的facit评估。作为患有sle的患者的常见症状,疲劳干扰日常生活并且在tulip试验中超过一半的具有bicla反应的患者经历了疲劳的改善。ptga和pga得分在改善方面显示出一致性,并且与无反应者相比,bicla反应者的改善程度更高。我们的结果证明,bicla反应转化为患有sle的患者的躯体和精神健康的总体改善。
[0511]
在来自2项2b期试验(西法木单抗和阿尼鲁单抗)以及2项3期贝利单抗试验的合并数据中对sri(4)反应与临床结局的相关性进行研究还证明,与无反应者相比,在sri(4)反应者中临床结局得到改善。尽管在tulip试验中在bicla反应者与无反应者之间的血清学结局的变化无显著差异,但在贝利单抗3期试验中sri(4)反应与抗dsdna抗体和补体c3水平(而非c4水平)的显著改善相关。这种不一致可能反映了2种被评价的药物的不同作用机制,和/或是因为测量bicla的改善的bilag-2004在其评分系统中不包括血清学。
[0512]
数据证实了bicla作为临床试验终点的价值,并且bicla反应与一系列其他结局的改善有关联,这些结局与临床医生和患者两者在日常实践中的优先事项均产生共鸣。
[0513]
表8.bicla反应者与无反应者在基线时的pro得分
[0514][0515]
bicla,基于大不列颠群岛狼疮评估组的综合狼疮评估;facit-f,慢性病治疗功能评估-疲劳;mcs,精神健康得分;pcs,躯体健康得分;pro,患者报告结局;ptga,患者整体评估;sd,标准偏差;sf-36-v2,36条简明健康状况调查表第2版(快速回忆)。
[0516]
参考文献
[0517]
(1)bruce,i.n.;o’keeffe,a.g.;farewell,v.;hanly,j.g.;manzi,s.;su,l.;gladman,d.d.;bae,s.-c.;sanchez-guerrero,j.;romero-diaz,j.;gordon,c.;wallace,d.j.;clarke,a.e.;bernatsky,s.;ginzler,e.m.;isenberg,d.a.;rahman,a.;merrill,j.t.;alarc
ó
n,g.s.;fessler,b.j.;fortin,p.r.;petri,m.;steinsson,k.;dooley,m.a.;
khamashta,m.a.;ramsey-goldman,r.;zoma,a.a.;sturfelt,g.k.;nived,o.;aranow,c.;mackay,m.;ramos-casals,m.;van vollenhoven,r.f.;kalunian,k.c.;ruiz-irastorza,g.;lim,s.;kamen,d.l.;peschken,c.a.;inanc,m.;urowitz,m.b.factors associated with damage accrual in patients with systemic lupus erythematosus:results from the systemic lupus international collaborating clinics(slicc)inception cohort.ann.rheum.dis.2015,74(9),1706-1713.https://doi.org/10.1136/annrheumdis-2013-205171.
[0518]
(2)petri,m.long-term outcomes in lupus.am.j.manag.care 2001,7(16suppl),s480-485.
[0519]
(3)patel,d.d.;antoni,c.;freedman,s.j.;levesque,m.c.;sundy,j.s.phase 2 to phase 3 clinical trial transitions:reasons for success and failure in immunologic diseases.j.allergy clin.immunol.2017,140(3),685-687.https://doi.org/10.1016/jjaci.2017.04.029.
[0520]
(4)dowden,h.;munro,j.trends in clinical success rates and therapeutic focus.nat.rev.drug discov.2019,18(7),495-496.https://doi.org/10.1038/d41573-019-00074-z.
[0521]
(5)eisenberg,r.why can’t we find a new treatment for sle?j.autoimmun.2009,32(3-4),223-230.https://doi.org/10.1016/j.jaut.2009.02.006.
[0522]
(6)hahn,b.h.targeted therapies in systemic lupus erythematosus:successes,failures and future.ann.rheum.dis.2011,70 suppl 1,i64-i66.https://doi.org/10.1136/ard.2010.142208.
[0523]
(7)isenberg,d.a.;petri,m.;kalunian,k.;tanaka,y.;urowitz,m.b.;hoffman,r.w.;morgan-cox,m.;iikuni,n.;silk,m.;wallace,d.j.efficaey and safety of subcutaneous tabalumab in patients with systemic lupus erythematosus:results from illuminate-1,a 52-week,phase iii,multicentre,randomised,double-blind,placebo-controlled study.ann.rheum.dis.2016,75(2),323-331.https://doi.org/10.1136/annrheumdis-2015-207653.
[0524]
(8)isenberg,d.;merrill,j.;hoffman,r.;linnik,m.;morgan-cox,m.;veenhuizen,m.;iikuni,n.;dickson,c.;silk,m.;wallace,d.;t.op0184efficacy and safety of tabalumab in patients with systemic lupus erythematosus(sle):results from 2 phase 3,52-week,multicenter,randomized,placebo-controlled trials.ann.rheum.dis.2015,74(suppl 2),141-141.https://doi.org/10.1136/annrheumdis-2015-eular.1195.
[0525]
(9)furie,r.a.;leon,g.;thomas,m.;petri,m.a.;chu,a.d.;hislop,c.;martin,r.s.;scheinberg,m.a.;pearl-sc study.a phase 2,randomised,placebo-controlled clinical trial of blisibimod,an inhibitor of b cell activating factor,in patients with moderate-to-severe systemic lupus erythematosus,the pearl-sc study.ann.rheum.dis.2015,74(9),1667-1675.https://doi.org/10.1136/annrheumdis-2013-205144.
[0526]
(10)merrill,j.t.;shanahan,w.r.;scheinberg,m.;kalunian,k.c.;wofsy,d.;martin,r.s.phase iii trial results with blisibimod,a selective inhibitor of b-cell activating factor,in subjects with systemic lupus erythematosus(sle):results from a randomised,double-blind,placebo-controlled trial.ann.rheum.dis.2018,77(6),883-889.https://doi.org/10.1136/annrheumdis-2018-213032.
[0527]
(11)isenberg,d.;gordon,c.;licu,d.;copt,s.;rossi,c.p.;wofsy,d.efficacy and safetv of atacicept for prevention of flares in patients with moderate-to-severe systemic lupus erythematosus(sle):52-week data(april-sle randomised trial).ann.rheum.dis.2015,74(11),2006-2015.https://doi.org/10.1136/annrheumdis-2013-205067.
[0528]
(12)alarc
ó
n-segovia,d.;tumlin,j.a.;furie,r.a.;mckay,j.d.;cardiel,m.h.;strand,v.;bagin,r.g.;linnik,m.d.;hepburn,b.;ljp 394 investigator consortium.ljp 394 for the prevention of renal flare in patients with systemic lupus erythematosus:results from a randomized,double-blind,placebo-controlled study.arthritis rheum.2003,48(2),442-454.https://doi.org/10.1002/art.10763.
[0529]
(13)mahieu,m.a.;strand,v.;simon,l.s.;lipsky,p.e.;ramsey-goldman,r.a critical review of clinical trials in systemic lupus erythematosus.lupus 2016,25(10),1122-1140.https://doi.org/10.1177/0961203316652492.
[0530]
(14)rovin,b.h.;furie,r.;latinis,k.;looney,r.j.;fervenza,f.c.;sanchez-guerrero,j.;maciuca,r.;zhang,d.;garg,j.p.;brunetta,p.;appel,g.;lunar investigator group.efficacy and safety of rituximab in patients with active proliferative lupus nephritis:the lupus nephritis assessment with rituximab study.arthritis rheum.2012,64(4),1215-1226.https://doi.org/10.1002/art.34359.
[0531]
(15)merrill,j.t.;neuwelt,c.m.;wallace,d.j.;shanahan,j.c.;latinis,k.m.;oates,j.c.;utset,t.o.;gordon,c.;isenberg,d.a.;hsieh,h.-j.;zhang,d.;brunetta,p.g.efficacy and safety of rituximab in moderately-to-severely active systemic lupus erythematosus:the randomized,double-blind,phase ii/iii systemic lupus erythematosus evaluation of rituximab trial.arthritis rheum.2010,62(1),222-233.https://doi.org/10.1002/art.27233.
[0532]
(16)daikh,d.i.;wofsy,d.cutting edge:reversal of murine lupus nephritis with ctla4ig and cyclophosphamide.j.immunol.2001,166(5),2913-2916.https://doi.org/10.4049/jimmunol.166.5.2913.
[0533]
(17)merrill,j.t.;burgos-vargas,r.;westhovens,r.;chalmers,a.;d’cruz,d.;wallace,d.j.;bae,s.c.;sigal,l.;becker,j.-c.;kelly,s.;raghupathi,k.;li,t.;peng,y.;kinaszczuk,m.;nash,p.the efficaey and safety of abatacept in patients with non-life-threatening manifestations of systemic lupus erythematosus:results of a twelve-month,multicenter,exploratory,phase iib,randomized,
responsiveness to patient concerns in clinical research.arthritis res.ther.2015,17(1),183.https://doi.org/10.1186/s13075-015-0702-6.
[0551]
(35)rice,j.b.;white,a.g.;scarpati,l.m.;wan,g.;nelson,w.w.long-term systemic corticosteroid exposure:a systematic literature review.clin.ther.2017,39(11),2216-2229.https://doi.org/10.1016/j.clinthera.2017.09.011.
[0552]
(36)hochberg,m.c.updating the american college of rheumatology revised criteria for the classification of systemic lupus erythematosus.arthritis rheum.1997,40(9),1725.https://doi.org/10.1002/art.1780400928.
[0553]
(37)gladman,d.d.;d.;urowitz,m.b.systemic lupus erythematosus disease activity index 2000.j.rheumatol.2002,29(2),288-291
[0554]
(38)isenberg,d.a.;rahman,a.;allen,e.;farewell,v.;akil,m.;bruce,i.n.;d’cruz,d.;griffiths,b.;khamashta,m.;maddison,p.;mchugh,n.;snaith,m.;teh,l.s.;yee,c.s.;zoma,a.;gordon,c.bilag 2004.development and initial validation of an updated version of the british isles lupus assessment group’s disease activity index for patients with systemic lupus erythematosus.rheumatol.oxf.engl.2005,44(7),902-906.https://doi.org/10.1093/rheumatology/keh624.
[0555]
(39)yee,c.-s.;cresswell,l.;farewell,v.;rahman,a.;teh,l.-s.;griffiths,b.;bruce,i.n.;ahmad,y.;prabu,a.;akil,m.;mchugh,n.;d’cruz,d.;khamashta,m.a.;isenberg,d.a.;gordon,c.numerical scoring for the bilag-2004index.rheumatol.oxf.engl.2010,49(9),1665-1669.https://doi.org/10.1093/rheumatology/keq026.
[0556]
(40)yao,y.;higgs,b.w.;richman,l.;white,b.;jallal,b.use of type i interferon-inducible mrnas as pharmacodynamic markers and potential diagnostic markers in trials with sifalimumab,an anti-ifnαantibody,in systemic lupus erythematosus.arthritis res.ther.2010,12(suppl 1),s6.https://doi.org/10.1186/ar2887.
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。