1.本发明涉及外表面具有细胞外基质的细胞培养物、该细胞培养物的制造方法、及使用了该细胞培养物的外周动脉疾病的处置方法等。
背景技术:
2.近年来,伴随老龄化的发展、饮食的西化、运动不足等,动脉硬化症的患者正在增加,与其相关的外周动脉疾病的患者数量也在增加。作为上述疾病的治疗方法,在疾病为轻度时,选择改善生活习惯的指导、药物治疗,在转为重症下肢缺血等重度的疾病时,选择使用了导管的血管形成疗法、旁路移植术等治疗方法。但是,若进一步重症化,则这些治疗方法也无法治疗,需要截断缺血肢。因此,希望开发侵入性低、对重症化的患者也能够使用的新型治疗方法。
3.对此,以血管内皮前体细胞的发现为契机,正在进行针对上述疾病的利用了再生医学的治疗方法的开发。作为这样的治疗方法,可举出例如,将自身骨髓细胞的单核细胞级分移植到对象的缺血肢的方法(非专利文献1);将外周血单核细胞、间充质干细胞施与至外周动脉疾病的对象的方法(专利文献1、2);将用凝胶成形为片状的源自ips细胞的血管前体细胞移植到具有下肢缺血的对象的方法(专利文献3)等。
4.现有技术文献
5.专利文献
6.专利文献1:日本特表2012-512843号公报
7.专利文献2:日本特表2015-524437号公报
8.专利文献3:国际公开2013/069661号公报
9.非专利文献
10.非专利文献1:吉冈徹他,j jpn coll angiol,2005,45:161-165
技术实现要素:
11.发明所要解决的课题
12.本发明的目的在于提供外表面具有细胞外基质的细胞培养物、该细胞培养物的制造方法及使用了该细胞培养物的外周动脉疾病的处置方法等。
13.用于解决课题的手段
14.专利文献1、2中记载的将自身骨髓细胞的单核细胞级分、外周血单核细胞或间充质干细胞施与至具有外周动脉疾病的对象的方法中,存在分别以单细胞的状态进行施与,施与部位中的施与的细胞的植活不充分等课题。
15.本技术发明人发现,通过施与外表面具有细胞外基质的含有骨骼肌成肌细胞的细胞培养物,能够在生物体内确保高植活性,并促进血管生成,基于该见解进行进一步持续研究,结果完成了本发明。
16.即,本发明涉及以下内容。
17.[1]细胞培养物,其为用于处置下肢疾病的具有100~500μm大小的细胞培养物,该细胞培养物的外表面具有细胞外基质。
[0018]
[2]如[1]所述的细胞培养物,其用于促进血管生成。
[0019]
[3]如[1]或[2]所述的细胞培养物,其含有骨骼肌成肌细胞。
[0020]
[4]如[1]~[3]中任一项所述的细胞培养物,其中,细胞培养物为片状细胞培养物的碎片。
[0021]
[5]如[1]~[4]中任一项所述的细胞培养物,其中,下肢疾病为外周动脉疾病。
[0022]
[6]片状细胞培养物的碎片,其具有细胞外基质。
[0023]
[7]用于制作片状细胞培养物的碎片的方法,其包括以下步骤:
[0024]
将细胞接种于基材上的步骤;
[0025]
将接种的细胞进行片化的步骤;及
[0026]
将形成的片状细胞培养物进行破碎的步骤。
[0027]
[8]如[7]所述的方法,其中,片状细胞培养物的破碎为使用注射器进行4~6次悬浮。
[0028]
[9]医药组合物,其用于处置外周动脉疾病,上述医药组合物包含含有骨骼肌成肌细胞的细胞培养物和细胞外基质。
[0029]
[10]用于处置外周动脉疾病的方法,其包括施与含有骨骼肌成肌细胞且具有细胞外基质的片状细胞培养物的碎片。
[0030]
[11]用于处置外周动脉疾病的方法,其包括施与包含含有骨骼肌成肌细胞的细胞培养物和细胞外基质的医药组合物。
[0031]
[12]如[10]或[11]所述的方法,其中,施与为向肌肉内的施与。
[0032]
发明的效果
[0033]
通过施与本发明的细胞培养物,能够促进血管形成,处置外周动脉疾病。另外,本发明的细胞培养物能够在施与的部位长期植活。此外,本发明的细胞培养物可以通过例如注射而直接施与至对象的患部,因此即使对象的患部范围广,也能够分成多个位置简便地进行施与。更详细而言,通过将本发明的细胞培养物施与至患部,例如能够生成中心具有核的肌纤维、或者改善血流量等。
附图说明
[0034]
[图1]图1示出片状细胞培养物的制作中使用的细胞的使用了facs的细胞纯度的测定结果。
[0035]
[图2a]图2a为制作的片状细胞培养物的照片。
[0036]
[图2b]图2b为经苏木精-伊红染色的片状细胞培养物的截面的显微镜照片。
[0037]
[图2c]图2c为经免疫染色的片状细胞培养物的截面的显微镜照片。
[0038]
[图3a]图3示出片状细胞培养物的悬浮液的显微镜照片。图3a为反复进行5次作为悬浮的抽吸
·
排出的组合操作后的悬浮液的照片。
[0039]
[图3b]图3b为图3a的悬浮液的经放大的显微镜照片。
[0040]
[图3c]图3c为反复进行10次作为悬浮的抽吸
·
排出的组合操作后的悬浮液的经放大的显微镜照片。
[0041]
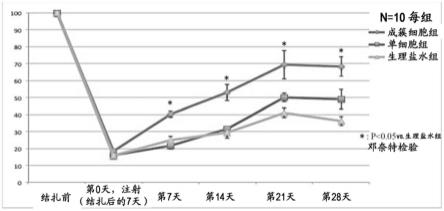
[图4]图4为示出通过激光多普勒血流灌注成像(ldpi)测定的、将小鼠缺血模型制作前的血流量设为100%时的第0天、第7天、第14天、第21天及第28天的各组小鼠的血流量%的结果的图表。图中的成簇细胞组表示碎片施与组的小鼠,单细胞组表示单细胞施与组的小鼠,生理盐水组表示生理盐水施与组的小鼠。另外,图中*表示对生理盐水施与组进行邓奈特检验(dunnett’s test),其中p《0.05。
[0042]
[图5]图5示出通过ldpi测定的第7天、第14天、第21天及第28天的各组的代表性的小鼠的成像结果。图中的成簇细胞组表示碎片施与组的小鼠,单细胞组表示单细胞施与组的小鼠,生理盐水组表示生理盐水施与组的小鼠。
[0043]
[图6a-f]图6示出对第3天、第5天、第7天及第28天的从碎片施与组、单细胞施与组、生理盐水施与组的各小鼠中采集的组织的rt-pcr的结果。图中的成簇细胞组表示碎片施与组的小鼠,单细胞组表示单细胞施与组的小鼠,生理盐水组表示生理盐水施与组的小鼠。另外,图中*表示对生理盐水施与组进行邓奈特检验,其中p《0.05,图中 表示对单细胞施与组进行邓奈特检验,其中p《0.05。图6a示出针对vegf的rt-pcr的结果,图6b示出针对hgf的rt-pcr的结果,图6c示出针对fgf的rt-pcr的结果,图6d示出针对ang-1的rt-pcr的结果,及图6e示出针对ang-2的rt-pcr的结果,图6f示出针对sdf-1的rt-pcr的结果。
[0044]
[图6gh]图6g示出针对pax7的rt-pcr的结果,图6h示出针对myod的rt-pcr的结果。
[0045]
[图7]图7示出第3天、第5天、第7天及第28天的从碎片施与组2、单细胞施与组2、生理盐水施与组2的各小鼠中采集的组织的经苏木精-伊红染色的显微镜照片。图中的成簇细胞组表示碎片施与组2的小鼠,单细胞组表示单细胞施与组2的小鼠,生理盐水组表示生理盐水施与组2的小鼠。
[0046]
[图8]图8a示出对经苏木精-伊红染色的各组织中的中心具有核的肌纤维(新生肌纤维)的数量进行计数的结果。图8b示出对经苏木精-伊红染色的各组织中的中心具有核的肌纤维(新生肌纤维)的数量与边缘具有核的成熟肌纤维的数量的比率进行计算的结果。图中的成簇细胞组表示碎片施与组2的小鼠,单细胞组表示单细胞施与组2的小鼠,生理盐水组表示生理盐水施与组2的小鼠。另外,图中*表示对生理盐水施与组2进行邓奈特检验,其中p《0.05,图中 表示对单细胞施与组2进行邓奈特检验,其中p《0.05。图8c示出对第3天的从碎片施与组2、单细胞施与组2、生理盐水施与组2的各小鼠中采集的组织中的初期(embryonic)的mhc阳性的细胞数进行计数的结果。mhc为骨骼肌的标志物,该标志物阳性则表示细胞为肌肉的细胞。
[0047]
[图9]图9示出第7天的从碎片施与组2及单细胞施与组2的各小鼠中采集的组织的冰冻标本的显微镜照片。图9(a)示出从碎片施与组2的小鼠中采集的标本的照片,图9(b)示出从单细胞施与组2的小鼠中采集的标本的照片。
具体实施方式
[0048]
以下,对本发明进行详细说明。
[0049]
本发明的一方面涉及用于处置下肢疾病的具有100~500μm大小的细胞培养物,该细胞培养物的外表面具有细胞外基质。
[0050]
本发明中,“细胞培养物”是指经过细胞培养步骤获得的组合物。本发明的细胞培养物介由由构成细胞培养物的细胞产生的细胞外基质,使至少一部分的细胞呈细胞彼此接
合。本发明中,对细胞培养物而言,不仅在细胞培养物的内部的细胞彼此之间、而且在细胞培养物的外表面也具有细胞外基质。一个方式中,本发明的细胞培养物在细胞培养物的整个外表面具有细胞外基质层。另一个方式中,本发明的细胞培养物为片状形态,此处,片状的形态是指具有第1面和与之几乎平行的第2面的形态,细胞培养物在其1个面具有细胞外基质层。又一个方式中,本发明的细胞培养物形成聚球体,聚球体与基材相接的部分、例如大致球状的聚球体的外表面部分的约一半具有细胞外基质层。
[0051]
本发明中,由构成细胞培养物的细胞产生的细胞外基质取决于各种条件,例如,可通过在细胞接种后培养24小时以上、例如培养24小时、30小时、36小时、42小时、48小时、54小时、60小时、66小时、72小时而产生。
[0052]
细胞外基质有助于细胞培养物粘附到施与部位,施与细胞培养物时,能够提高施与部位的细胞培养物的植活率。另外,细胞外基质为源自细胞的成分,因此与本发明的细胞培养物一同供于施与时不会有任何问题。本发明的细胞培养物优选外表面具有细胞外基质,但是例如在使用单细胞作为细胞培养物的情况等、不具有对细胞培养物粘附到施与部位而言充分的细胞外基质的情况下,可以与所需量的细胞外基质组合而进行施与。例如,由7~10
×
105个细胞制作的片状细胞培养物具有对粘附到施与部位而言充分的细胞外基质,可以将与其相当的量的细胞外基质与细胞培养物组合而进行施与。此处,单细胞是指互相不粘附的、以单个状态存在的细胞,其中包括将原本粘附的多个细胞分离为单个细胞的细胞及以单个细胞的状态制备的细胞。另外,本说明书中,单细胞包括与单细胞相近的形态的细胞。此处,与单细胞相近的形态是指至少一部分的细胞在少数的细胞间粘附,但表现出与单细胞同样的行为的形态。与单细胞相近的形态的细胞包含1~30%、优选1~20%、更优选1~10%的呈细胞彼此粘附的状态的细胞。
[0053]
本发明的细胞培养物中包含的细胞只要能够产生细胞外基质就没有特别限定,例如包含贴壁细胞(附着性细胞)。贴壁细胞例如包含粘附性的体细胞(例如,心肌细胞、成纤维细胞、上皮细胞、内皮细胞、肝细胞、胰细胞、肾细胞、肾上腺细胞、牙周膜细胞、牙龈细胞、骨膜细胞、皮肤细胞、滑膜细胞、软骨细胞等)及干细胞(例如,成肌细胞、心脏干细胞等的组织干细胞、胚胎干细胞、ips(induced pluripotent stem,诱导多潜能干细胞)细胞等多潜能干细胞、间充质干细胞等)等。体细胞可以是由干细胞、特别是ips细胞分化而来的细胞(源自ips细胞的贴壁细胞)。作为本发明的细胞培养物中包含的细胞的非限定例,可举出例如成肌细胞(例如,骨骼肌成肌细胞等)、间充质干细胞(例如,源自骨髓、脂肪组织、外周血、皮肤、毛根、肌肉组织、子宫内膜、胎盘、脐带血的细胞等)、心肌细胞、成纤维细胞、心脏干细胞、胚胎干细胞、ips细胞、滑膜细胞、软骨细胞、上皮细胞(例如,口腔粘膜上皮细胞、视网膜色素上皮细胞、鼻粘膜上皮细胞等)、内皮细胞(例如,血管内皮细胞等)、肝细胞(例如,肝实质细胞等)、胰细胞(例如,胰导细胞等)、肾细胞、肾上腺细胞、牙周膜细胞、牙龈细胞、骨膜细胞、皮肤细胞等。此处,ips细胞是通过导入基因而诱导的、具有万能分化性及自我复制能力的细胞。作为源自ips细胞的贴壁细胞的非限定例,可举出源自ips细胞的心肌细胞、成纤维细胞、上皮细胞、内皮细胞、肝细胞、胰细胞、肾细胞、肾上腺细胞、牙周膜细胞、牙龈细胞、骨膜细胞、皮肤细胞、滑膜细胞、软骨细胞等。
[0054]
另一个方式中,本发明的细胞培养物中包含的细胞为能够促进血管生成的细胞,例如特别优选能够分泌促进血管生成的因子、例如vegf等细胞因子的细胞。
[0055]
构成细胞培养物的细胞可以源自供于基于细胞培养物的处置的任意生物,这些生物包括人、灵长类、犬、猫、猪、马、山羊、绵羊、啮齿目动物(例如,小鼠、大鼠、仓鼠、豚鼠等)、兔等,但并不限于此。另外,构成细胞培养物的细胞可以仅使用1种、也可以使用2种以上的细胞。本发明的优选方式中,构成细胞培养物的细胞为2种以上的情况下,在细胞培养物制造结束时,最多的细胞的含有比率(纯度)为60%以上,优选为70%以上,更优选为75%以上。
[0056]
细胞可以是源自异种的细胞,也可以是源自同种的细胞。此处,关于“源自异种的细胞”,在细胞培养物被用于移植的情况下,是指来源于与其受体为不同的种的生物的细胞。例如,受体为人的情况下,来源于猴、猪的细胞等属于源自异种的细胞。另外,“源自同种的细胞”是指来源于与受体为相同的种的生物的细胞。例如,受体为人的情况下,人细胞属于源自同种的细胞。源自同种的细胞包括自源细胞(也称为自身细胞或自体细胞,即来源于受体的细胞)和同种非自源细胞(也称为异体细胞)。自源细胞由于在移植后不会发生排斥反应,因此在本公开中优选。但是,也可以利用源自异种的细胞或同种非自源细胞。利用源自异种的细胞或同种非自源细胞的情况下,为了抑制排斥反应,有时需要免疫抑制处置。需要说明的是,本说明书中有时也将自源细胞以外的细胞、即源自异种的细胞和同种非自源细胞统称为非自源细胞。本公开的一个方式中,细胞为自体细胞或异体细胞。本公开的一个方式中,细胞为自体细胞。本公开的另一个方式中,细胞为异体细胞。
[0057]
本发明中,将细胞培养物施与至对象的组织内、优选施与至具有下肢疾病的对象的病变部位。一个方式中,将细胞培养物施与至外周动脉疾病患者的血流量恶化的病变部位、例如下肢的股内收肌群。一个方式中,通过将细胞培养物施与到病变部位,例如施与7天后,与健康状态相比较,能够将血流量改善至例如35%、40%、45%。一个方式中,通过将细胞培养物施与到病变部位,与对照的生理盐水相比较,例如能够将血流量改善约1.5倍、约2倍、约2.5倍。优选将细胞培养物通过注射而施与至组织内。因此,本发明的细胞培养物具有通过施与中使用的注射针的内部、且施与后细胞培养物无法进入微血管的程度的大小。作为这样的大小,可举出例如,平均直径为30μm~1000μm、优选为100μm~500μm的细胞培养物。此处,100μm~500μm的细胞培养物是指:例如在显微镜下等平面地观察细胞培养物时观察到的形状为多边形的情况下,连接任意角的所有线段长度为100μm~500μm的细胞培养物;或观察到的形状为大致圆形的情况下,长径及短径各为100μm~500μm的细胞培养物。一个方式中,这样的大小的细胞培养物可举出具有约102~106个细胞的片状细胞培养物、片状细胞培养物的碎片、聚球体等。
[0058]
本发明中,“下肢疾病”包括具有下肢损伤的所有疾病。作为该疾病的例子,可举出外周动脉疾病、下肢静脉瘤、深静脉血栓症等,但不限定于此。优选本发明中的下肢疾病为下肢的血管狭窄或闭塞、其下肢血流量恶化的疾病,例如外周动脉疾病。本发明中,外周动脉疾病包含下肢闭塞性动脉硬化症、血栓闭塞性脉管炎(buerger’s disease)、胶原病等,但不限定于此,特别将重症化的下肢闭塞性动脉硬化症称为重症下肢缺血。
[0059]
本发明中,“处置”包含以疾病的治愈、暂时性缓解或预防等为目的的医学上允许的所有种类的预防性及/或治疗性介入。例如,“处置”包含进行各种目的的医学上允许的介入,上述各种目的包括组织异常相关的疾病进展的延迟或停止、病变的消退或消失、该疾病发病的预防或复发的防止等。
[0060]
本发明的细胞培养物对外周动脉疾病的作用虽然不受特定理论的限制,但是认为是通过由被施与的本发明的细胞培养物持续分泌的vegf等细胞因子直接地及/或间接地作用于缺血部位的细胞,从而促进血管生成而起效的。另外,认为本发明的细胞培养物包含细胞外基质,因此细胞培养物在缺血部位的植活率变高,有效地作用于缺血部位的细胞。如此,本发明的细胞培养物在缺血部位的植活率高,其作用于缺血部位的细胞并促进血管形成,因此认为能够在早期发生肌肉生成(日:筋新生)。例如,在小鼠中,发生缺血模型的肌肉恢复需要2个月(参见mohiuddin m et.al,scientific reports volume 9,article number:9551(2019)),但通过使用本发明的细胞培养物,例如能够3天产生肌纤维、1个月完成肌肉生成。
[0061]
通过将本发明的细胞培养物施与至缺血部位,作用于缺血部位的细胞,能够产生中心具有核的肌纤维(新生肌纤维),该肌纤维的产生能够通过下述方式来确认:例如对经苏木精-伊红染色的各组织中的边缘具有核的成熟肌纤维的数量及中心具有核的肌纤维(新生肌纤维)的数量进行计数;对组织中初期的mhc阳性的细胞数进行计数;或者对vegf、hgf、fgf、ang-1、ang-2及sdf-1等血管生成相关因子、pax7、myod等肌肉分化调控因子的基因表达进行分析。一个方式中,通过将本发明的细胞培养物施与至缺血部位,能够例如在2天以内、3天以内、4天以内产生中心具有核的肌纤维,能够以上述的方式确认肌肉的治愈。
[0062]
一个方式中,细胞培养物含有源自骨骼肌的细胞。本发明中,源自骨骼肌的细胞是指卫星细胞、骨骼肌成肌细胞、骨骼肌细胞、骨骼肌管及骨骼肌纤维。源自骨骼肌的细胞优选为骨骼肌成肌细胞。该方式中,构成本发明的细胞培养物的细胞含有50%以上、60%以上、65%以上、70%以上、75%以上、80%以上、85%以上或90%以上的源自骨骼肌的细胞,优选含有60%以上的源自骨骼肌的细胞。
[0063]
骨骼肌成肌细胞是该技术领域中熟知的,可以由骨骼肌通过任意的已知方法(例如,日本特开2007-89442号公报中记载的方法等)来制备,也可以商业获得(例如,lonza japan ltd.的商品目录编号:cc-2580,cosmo bio co.,ltd.的商品编号:3520等)。骨骼肌成肌细胞可以通过cd56、α7整联蛋白、肌球蛋白重链iia、肌球蛋白重链iib、肌球蛋白重链iid(iix)、myod、myf5、myf6、肌细胞生成蛋白、结蛋白、pax3等标志物进行鉴定,但并不限于此。一个方式中,骨骼肌成肌细胞为cd56阳性。一个方式中,骨骼肌成肌细胞为cd56阳性及结蛋白阳性。
[0064]
由横纹肌组织制备骨骼肌成肌细胞的情况下,制备的细胞群中含有成纤维细胞。制造本发明涉及的细胞培养物时,使用由横纹肌组织制备的含有骨骼肌成肌细胞的细胞群的情况下,该细胞群中含有一定量的成纤维细胞。成纤维细胞是该技术领域中熟知的,可以通过te-7(例如,参见rosendaal et al.,j cell sci.1994;107(pt1):29-37、goodpaster et al.j histochem cytochem.2008;56(4):347-358等)等标志物进行鉴定。
[0065]
一个方式中,构成本发明的细胞培养物的细胞含有由横纹肌组织制备的骨骼肌成肌细胞。因此,本发明的细胞培养物的制造中使用的细胞群中,可以含有骨骼肌成肌细胞及成纤维细胞。一个方式中,本发明的细胞培养物的制造中使用的细胞群的cd56阳性率可以为50%以上、60%以上、65%以上、70%以上、75%以上、80%以上、85%以上、90%以上,优选为60%以上。
[0066]
本发明的细胞培养物的制造中使用的细胞群可以含有成纤维细胞,但成纤维细胞
的含有率过高时,骨骼肌成肌细胞的含有率会降低,故而不优选。因此,一个方式中,本发明的细胞培养物的制造中使用的细胞群的te-7阳性率可以为50%以下、40%以下、35%以下、30%以下、25%以下、20%以下、15%以下、10%以下,优选为40%以下。
[0067]
本发明的细胞培养物的制造中使用的细胞群可以含有除骨骼肌成肌细胞及成纤维细胞以外的细胞,但这些细胞越少越优选。因此,cd56阳性率及te-7阳性率的合计值越高越优选,例如可以为80%以上、85%以上、90%以上、95%以上、96%以上、97%以上、98%以上、99%以上等,优选为90%以上。
[0068]
本发明中,从含有源自骨骼肌的细胞的细胞培养物中分泌细胞因子。
[0069]
本发明中,由含有源自骨骼肌的细胞的细胞培养物分泌的细胞因子可举出例如il-1b、il-1ra、il-2、il-4、il-5、il-6、il-7、il-8、il-9、il-10、il-12、il-13、il-15、il-17、嗜酸性粒细胞趋化因子、碱性成纤维细胞生长因子(fgf-basic)、g-csf、gm-csf、ifn-g、ip-10、mcp-1(mcaf)、mip-1a、pdgf-bb、mip-1b、rantes、tnf-a、hgf-1、sdf-1及vegf等,但并不限于此。
[0070]
一个方式中,本发明的细胞培养物为片状细胞培养物的碎片。本发明中,“片状细胞培养物的碎片”是指通过将片状细胞培养物进行破碎从而分割成多个碎片而得的碎片。对于碎片的大小,优选为碎片中的大部分无法进入微血管、且能够通过注射针的内部的大小,但并不限于此。对该大小而言,例如片形状的平面的对角线的长度的平均值为30μm~1000μm,优选为100μm~500μm。对本发明中的破碎而言,只要是能够获得片状细胞培养物的碎片的方法,则能够通过已知的任意方法进行,例如可以利用注射器及注射针或移液器等,通过对含有片状细胞培养物的液体进行悬浮而进行。
[0071]
本发明中,“片状细胞培养物”是指细胞相互连接成为片状的培养物。细胞彼此可以直接(包括经由粘附分子等细胞要素的方式)相互连接、及/或通过中间物相互连接。作为中间物,只要是至少能够将细胞彼此物理性(机械性)地连接的物质,则没有特别的限定,可举出例如,细胞外基质等。中间物优选为源自细胞的物质,特别是来源于构成细胞培养物的细胞的物质。细胞至少被物理性(机械性)地连接,也可以进一步被功能性地连接,例如化学性连接、电连接。片状细胞培养物可以是由一个细胞层构成的培养物(单层),也可以是由两个以上的细胞层构成的培养物(层叠(多层)体,例如2层、3层、4层、5层、6层等)。另外,片状细胞培养物可以具有:细胞不呈现明确的层结构而厚度超过单个细胞厚度的三维结构。例如,在片状细胞培养物的垂直截面中,细胞也可以以不均匀(例如镶嵌状)配置的状态存在,而非在水平方向上均匀地排列。
[0072]
片状细胞培养物优选不含有支架(支承体)。在该技术领域中,支架有时被用于使细胞附着在其表面上及/或其内部,从而维持片状细胞培养物的物理一体性,例如,已知有聚偏氟乙烯(pvdf)制的膜等,但本公开的片状细胞培养物即使没有上述支架也能够维持其物理一体性。另外,优选本公开的片状细胞培养物仅含有源自构成片状细胞培养物的细胞的物质,不含有除此以外的物质。
[0073]
本发明中,片状细胞培养物的厚度没有特别限定。使用单层的片作为片状细胞培养物时,其厚度通常具有1个细胞以上的厚度,根据形成片状细胞培养物的片的细胞种类的不同,其厚度也有所不同,一个方式中,本发明的片状细胞培养物具有30μm以上的厚度,优选的一个方式中,具有50μm以上的厚度。作为本发明的片状细胞物的值的范围,可举出例如
为30μm~200μm,优选为50μm~150μm,更优选为60μm~100μm。使用层叠的片作为片状细胞培养物时,其为不超过前述单层片的厚度
×
层叠枚数的厚度。因此,作为一个方式,例如使用叠合5枚单层片而得的片时,其厚度具有150μm以上的厚度,优选的一个方式中,具有250μm以上的厚度。在此情况下,作为片状细胞物的值的范围,可举出例如为150μm~1000μm,优选为250μm~750μm,更优选为300μm~500μm。
[0074]
本发明的另一方面涉及用于制作片状细胞培养物的碎片的方法,该方法包括:将细胞接种于基材上的步骤;将接种的细胞进行片化的步骤;及将形成的片状细胞培养物进行破碎的步骤。
[0075]
本发明的片状细胞培养物的碎片的制作方法中,片状细胞培养物可以通过本领域技术人员已知的任意方法(例如,参见专利文献1、日本特开2010-081829、日本特开2011-110368等)而制造。典型地,片状细胞培养物的制造方法包括将细胞接种于基材上的步骤;将接种的细胞进行片化的步骤;将形成的片状细胞培养物从基材剥离的步骤,但并不限定于此。此处,在将接种的细胞进行片化的步骤中,在片状细胞培养物的基材侧的一个面形成有细胞外基质层,在将随后形成的片状细胞培养物从基材剥离的步骤中,将片状细胞培养物以其一个面具有细胞外基质层的状态从基材剥离。可以在将细胞接种于基材上的步骤之前,进行冷冻细胞的步骤及解冻细胞的步骤。进一步,也可以在解冻细胞的步骤之后,进行洗涤细胞的步骤。上述各步骤可以通过适合制造片状细胞培养物的已知的任意方法进行。制造片状细胞培养物的步骤可以包括上述片状细胞培养物的制造方法涉及的步骤的1个或2个以上作为子步骤。某一个方式中,不包括在解冻细胞的步骤之后、将细胞接种于基材上的步骤之前使细胞增殖的步骤。
[0076]
本发明的片状细胞培养物的碎片的制作方法进一步包括在制造片状细胞培养物之后将形成的片状细胞培养物进行破碎的步骤。对于将片状细胞培养物进行破碎的步骤,只要是能够将片状细胞培养物分离成多个细胞培养物,从而制作上述的片状细胞培养物的碎片,则能够使用已知的任意方法进行。一个方式中,片状细胞培养物的破碎为使用注射器与注射针,反复进行2~8次片状细胞培养物的抽吸与排出的组合操作,使其悬浮,优选反复进行4~6次抽吸与排出的组合操作,使其悬浮。
[0077]
对于基材,只要细胞能在其上形成细胞培养物,则没有特别限定,例如,包括各种材质的容器、容器中的固态或半固态的表面等。容器优选为不允许培养液等液体透过的结构
·
材料。作为这种材料,没有限定,可举出例如聚乙烯、聚丙烯、teflon(注册商标)、聚对苯二甲酸乙二醇酯、聚甲基丙烯酸甲酯、尼龙6,6、聚乙烯醇、纤维素、硅、聚苯乙烯、玻璃、聚丙烯酰胺、聚二甲基丙烯酰胺、金属(例如,铁、不锈钢、铝、铜、黄铜)等。另外,优选容器具有至少1个平坦的面。作为这种容器的例子,没有限定,可举出例如具备由能够形成细胞培养物的基材构成的底面和非透液性的侧面的培养容器。作为这种培养容器的特定的例子,没有限定,可举出细胞培养皿、细胞培养瓶等。容器的底面可以为透明,也可以为不透明。若容器的底面为透明,则能够从容器的背侧进行细胞的观察、计数等。另外,容器可以在其内部具有固态或半固态的表面。作为固态的表面,可举出如上述的各种材料的培养板、容器等,作为半固态的表面,可举出凝胶、软质的聚合物基质等。基材可以使用上述材料制作,也可以利用市售的基材。作为优选的基材,没有限定,可举出例如适合片状细胞培养物形成的、具有粘附性的表面的基材。具体而言,可举出具有亲水性的表面的基材,例如,在该表面上
涂布有经电晕放电处理的聚苯乙烯、胶原凝胶(collagen gel)、亲水性聚合物等亲水性化合物的基材;进一步还可举出表面涂布有胶原蛋白、纤连蛋白、层粘连蛋白(laminin)、玻连蛋白(tronectin)、蛋白多糖(proteoglycan)、糖胺多糖(glycosaminoglycan)等细胞外基质、钙黏着蛋白家族(cadherin family)、选择素家族(seletin family)、整合素家族(integrin family)等细胞粘附因子等的基材等。另外,上述基材已有市售(例如,corning(注册商标)tc处理培养皿(tc-treated culture dish)、corning等)。基材可以整体或部分透明,也可以不透明。
[0078]
基材可以在表面被覆有响应刺激(例如,温度、光)而发生物性变化的材料。作为这种材料,没有限定,例如可以使用下述已知材料:由(甲基)丙烯酰胺化合物、n-烷基取代(甲基)丙烯酰胺衍生物(例如,n-乙基丙烯酰胺、n-正丙基丙烯酰胺、n-正丙基甲基丙烯酰胺、n-异丙基丙烯酰胺、n-异丙基甲基丙烯酰胺、n-环丙基丙烯酰胺、n-环丙基甲基丙烯酰胺、n-乙氧基乙基丙烯酰胺、n-乙氧基乙基甲基丙烯酰胺、n-四氢糠基丙烯酰胺、n-四氢糠基甲基丙烯酰胺等)、n,n-二烷基取代(甲基)丙烯酰胺衍生物(例如,n,n-二甲基(甲基)丙烯酰胺、n,n-乙基甲基丙烯酰胺、n,n-二乙基丙烯酰胺等)、具有环状基团的(甲基)丙烯酰胺衍生物(例如,1-(1-氧代-2-丙烯基)-吡咯烷、1-(1-氧代-2-丙烯基)-哌啶、4-(1-氧代-2-丙烯基)-吗啉、1-(1-氧代-2-甲基-2-丙烯基)-吡咯烷、1-(1-氧代-2-甲基-2-丙烯基)-哌啶、4-(1-氧代-2-甲基-2-丙烯基)-吗啉等)、或乙烯基醚衍生物(例如,甲基乙烯基醚)的均聚物或共聚物形成的温度响应性材料,具有偶氮苯基的光吸收性高分子、三苯甲烷无色氢氧化物(triphenylmethane leucohydroxide)的乙烯基衍生物与丙烯酰胺系单体的共聚物、及包含螺苯并吡喃的n-异丙基丙烯酰胺凝胶等光响应性材料等(例如,参见日本特开平2-211865、日本特开2003-33177)。通过对这些材料施加规定的刺激,可以使其物性(例如,亲水性、疏水性)变化,从而促进附着在同材料上的细胞培养物的剥离。被覆有温度响应性材料的培养皿已有市售(例如,例如,cellseed inc.的upcell(注册商标)和dic corporation的cepallet(注册商标)),可以将其用于本公开的制造方法中。
[0079]
基材可以为各种形状,但优选为平坦的。另外,其面积没有特别限定,例如可以为约1cm2~约200cm2、约2cm2~约100cm2、约3cm2~约50cm2等。例如,作为基材,可举出直径为10cm的圆形培养皿。这种情况下,其面积为56.7cm2。
[0080]
基材可以涂覆(被覆或涂布)有血清。通过使用涂覆有血清的基材,可以形成更高密度的片状细胞培养物。“涂覆有血清”是指在基材的表面附着有血清成分的状态。上述状态没有限定,例如,可以通过用血清对基材进行处理而获得。基于血清的处理包括使血清与基材接触、及根据需要孵育规定的时间。
[0081]
作为血清,可以使用异种血清及/或同种血清。关于异种血清,在将片状细胞培养物用于移植的情况下,其表示来源于与受体为不同的种的生物的血清。例如,受体为人的情况下,来源于牛、马的血清(例如,胎牛血清(fbs、fcs)、小牛血清(cs)、马血清(hs))等属于异种血清。另外,“同种血清”是指来源于与受体为相同的种的生物的血清。例如,受体为人的情况下,人血清属于同种血清。同种血清包括自身血清(也称为自体血清,即来源于受体的血清)、及来源于受体以外的同种个体的同种异体血清。需要说明的是,本说明书中,也有时也将自身血清以外的血清(即异种血清和同种异体血清)统称为非自身血清。
[0082]
用于涂覆基材的血清可以为市售的血清、或通过常规方法从所希望的生物中采集
血液并制备。具体而言,可举出例如,将采集的血液于室温下放置约20分钟~约60分钟左右,使其凝固,并将其在约1000
×
g~约1200
×
g左右的条件下离心分离,采集上清液的方法等。
[0083]
在基材上进行孵育时,血清可以使用原液,也可以稀释后使用。稀释可以使用任意介质进行,例如可以不受限制地使用水、生理盐水、各种缓冲液(例如,pbs、hbss等)、各种液体培养基(例如,dmem、mem、f12、dmem/f12、dme、rpmi1640、mcdb(mcdb102、104、107、120、131、153、199等)、l15、skbm、ritc80-7等)等。对于稀释浓度,只要血清成分能够附着在基材上则没有特别限定,例如,为约0.5%~约100%(v/v),优选为约1%~约60%(v/v),更优选为约5%~约40%(v/v)。
[0084]
孵育时间也是只要血清成分能够附着在基材上则没有特别限定,例如,为约1小时~约72小时,优选为约2小时~约48小时,更优选为约2小时~约24小时,进一步优选为约2小时~约12小时。孵育温度也是只要血清成分能够附着在基材上则没有特别限定,例如,为约0℃~约60℃,优选为约4℃~约45℃,更优选为室温~约40℃。
[0085]
孵育后可以将血清弃置。作为血清的弃置方法,可以使用基于移液器等的抽吸、倾析(decantation)等惯用的液体弃置方法。本公开的优选方式中,弃置血清后,可以使用无血清洗涤液洗涤基材。作为无血清洗涤液,只要是不含有血清、且不对已附着于基材的血清成分产生不良影响的液体介质,则没有特别限定,例如,可以不受限制地使用水、生理盐水、各种缓冲液(例如,pbs、hbss等)、各种液体培养基(例如,dmem、mem、f12、dmem/f12、dme、rpmi1640、mcdb(mcdb102、104、107、120、131、153、199等)、l15、skbm、ritc80-7等)等而进行。作为洗涤方法,可以是惯用的基材洗涤方法,例如,可以不受限制地使用在基材上添加无血清洗涤液、搅拌规定时间(例如,约5秒~约60秒)后弃置的方法等。
[0086]
本公开中,也可以用生长因子涂覆基材。此处,“生长因子”是指较之其不存在的情况而言能促进细胞的增殖的任意物质,例如,包括上皮细胞生长因子(egf)、血管内皮生长因子(vegf)、成纤维细胞生长因子(fgf)等。对于基于生长因子的基材的涂覆方法、弃置方法及洗涤方法,除了孵育时的稀释浓度例如为约0.0001μg/ml~约1μg/ml、优选为约0.0005μg/ml~约0.05μg/ml、更优选为约0.001μg/ml~约0.01μg/ml之外,基本与血清相同。
[0087]
本公开中,也可以用甾体药物涂覆基材。此处,“甾体药物”是指具有甾核的化合物中可能会对生物体造成肾上腺皮质功能障碍、库欣综合征等不良影响的化合物。作为上述化合物,没有限定,例如,包括皮质醇、泼尼松龙、去炎松(triamcinolone)、地塞米松、倍他米松等。对于基于甾体药物的基材的涂覆方法、弃置方法及洗涤方法,除了孵育时的稀释浓度以外基本与血清相同,对于该稀释浓度,对于地塞米松而言,例如为约0.1μg/ml~约100μg/ml,优选为约0.4μg/ml~约40μg/ml,更优选为约1μg/ml~约10μg/ml。
[0088]
基材可以用血清、生长因子及甾体药物中的任一种进行涂覆,也可以使用这些成分的任意组合,(即,血清和生长因子、血清和甾体药物、血清和生长因子和甾体药物,或生长因子和甾体药物的组合)进行涂覆。用多种成分进行涂覆时,可以将这些成分混合并同时进行涂覆,也可以通过各自分开的步骤进行涂覆。
[0089]
对于基材,可以在用血清等进行涂覆后立即接种细胞,也可以在涂覆后预先保存,然后接种细胞。经涂覆的基材可以通过保存于例如约4℃以下、优选约-20℃以下、更优选约-80℃以下来长期保存。
[0090]
向基材的细胞接种可以用已知的任意的方法及条件进行。向基材的细胞接种,例如也可以通过将培养液中悬浮有细胞的细胞悬浮液注入基材(培养容器)而进行。细胞悬浮液的注入可以使用滴液吸管、移液器等适合于细胞悬浮液的注入操作的器具。
[0091]
一个方式中,接种以约7.1
×
105个/cm2~约3.0
×
106个/cm2、约7.3
×
105个/cm2~约2.8
×
106个/cm2、约7.5
×
105个/cm2~约2.5
×
106个/cm2、约7.8
×
105个/cm2~约2.3
×
106个/cm2、约8.0
×
105个/cm2~约2.0
×
106个/cm2、约8.5
×
105个/cm2~约1.8
×
106个/cm2、约9.0
×
105个/cm2~约1.6
×
106个/cm2、约1.0
×
106个/cm2~约1.6
×
106个/cm2等密度进行。
[0092]
本发明的又一方面涉及医药组合物,其用于处置外周动脉疾病,该医药组合物包含含有骨骼肌成肌细胞的细胞培养物和细胞外基质。
[0093]
除本发明的细胞培养物之外,本发明的医药组合物也可以包含细胞外基质等各种追加成分,例如药学上允许的载体、提高细胞培养物的存活性、植活性及/或功能等的成分、用于处置对象疾病的其他有效成分等。作为上述追加成分,可以使用已知的任意成分,本领域技术人员精通这些附加成分。另外,本发明的医药组合物可以与提高细胞培养物的存活性、植活性及/或功能等的成分、用于处置对象疾病的其他有效成分等联用。一个方式中,本发明的医药组合物用于处置下肢疾病。对于成为处置对象的组织、疾病,为针对本发明的细胞培养物已在上文中叙述的组织、疾病。
[0094]
本发明的医药组合物中,可以分别制备细胞培养物和细胞外基质,同时进行施与。本发明的医药组合物中,细胞培养物可以使用上述的细胞培养物,但只要与对粘附到施与部位而言充分量的细胞外基质并用,则也可以使用单细胞。此处,施与片状细胞培养物的碎片的情况下,在制作片状细胞培养物时的与基材的粘附面上形成有对粘附到缺血部位而言充分量的细胞基质,因此不需要另外施与细胞外基质。施与作为聚球体的细胞培养物的情况下,只需施与相对于由同数量的细胞形成的片状细胞培养物中包含的细胞外基质的量而言不足的量即可,例如,聚球体细胞培养物具有片状细胞培养物的一半量的细胞外基质的情况下,只需施与与剩余一半相当的量。细胞外基质已有市售(例如,advanced biomatrix公司/vitrocol(商标)人源i型胶原蛋白等),可以将其用于本发明的医药组合物。
[0095]
本发明的另一方面涉及在对象中处置外周动脉疾病方法,其包括将本发明的细胞培养物或医药组合物以有效量施与至需要其的对象的步骤。对于成为本发明的处置方法的对象的组织、疾病,为针对本发明的细胞培养物已在上文中叙述的组织、疾病。另外,本发明的处置方法中,可以将提高细胞培养物的存活性、植活性及/或功能等的成分、用于处置对象疾病的其他有效成分等与本发明的细胞培养物或医药组合物联用。
[0096]
本发明中,用语“对象”是指任意的生物个体,优选为动物,更优选为哺乳动物,进一步优选为人的个体。
[0097]
另外,用语“处置”包含以疾病的治愈、暂时性缓解或预防等为目的的医学上允许的所有种类的预防性及/或治疗性介入。例如,“处置”的用语包含各种目的的医学上允许的介入,上述各种目的包括疾病进展的延迟或停止、病变的消退或消失、该疾病发病的预防或复发的防止等。
[0098]
本发明中,“有效量”是例如可抑制疾病的发病、复发、减轻症状、或者延迟或停止进展的量(例如,细胞培养物中包含的细胞数、细胞培养物的大小、重量等),优选为预防该疾病的发病及复发、或治愈该疾病的量。另外,优选为不产生超过施予所带来的利益的不良
影响的量。上述量例如可以通过小鼠、大鼠、犬或猪等实验动物、疾病模型动物的试验等来适当确定,这样的试验方法已为本领域技术人员所熟知。另外,成为处置对象的组织病变的大小可成为用于确定有效量的重要指标。一个方式中,对具有外周动脉疾病的小鼠疾病模型,可以将合计7~10
×
105个细胞、以每1个包含约102~106个细胞的细胞培养物的形态进行施与。另一个方式中,对具有外周动脉疾病的人,可以将合计7~10
×
106个细胞、以每1个包含约102~106个细胞的细胞培养物的形态进行施与。
[0099]
本发明的又一方面涉及用于处置外周动脉疾病的方法,其包括施与含有骨骼肌成肌细胞且具有细胞外基质的片状细胞培养物的碎片、或包含含有骨骼肌成肌细胞的细胞培养物和细胞外基质的医药组合物。
[0100]
根据本发明的制造方法,本发明的处置方法可以进一步包括制造本发明的片状细胞培养物的碎片的步骤。本发明的处置方法可以进一步包括:在制造片状细胞培养物的碎片的步骤之前,从对象中采集用于制造片状细胞培养物的碎片的细胞(使用ips细胞的情况下,例如皮肤细胞、血细胞等)或成为细胞的供给源的组织(使用ips细胞的情况下,例如皮肤组织、血液等)的步骤。一个方式中,采集细胞或成为细胞的供给源的组织的对象与接受片状细胞培养物的碎片或医药组合物等的施与的对象为同一个体。另一个方式中,采集细胞或成为细胞的供给源的组织的对象与接受片状细胞培养物的碎片或医药组合物等的施与的对象为同种的不同个体。另一个方式中,采集细胞或成为细胞的供给源的组织的对象与接受片状细胞培养物的碎片或医药组合物等的施与的对象为异种的个体。
[0101]
作为施与方法,典型地,可举出向组织的直接适用,优选为向施与对象的肌肉组织的直接适用。使用片状细胞培养物的片断时,本发明的细胞培养物及医药组合物可以通过能够利用注射而施与的各种途径、例如静脉内、肌肉内、皮下、局部、动脉内、门静脉内、心室内、腹腔内等途径进行施与。一个方式中,施与方法为向施与对象的肌肉内的注射。注射可以在1次的处置中分多个位置进行。
[0102]
对施与频率而言,典型地,为每1次的处置中施与1次,但未获得所期望的效果的情况下,也可以多次施与。例如,施与外表面具有细胞外基质的细胞培养物的情况下,可以分多个位置进行注射、也可以在同一位置进行多次注射。施与单细胞和细胞外基质的情况下,可以分别将单细胞与细胞外基质进行1次或多次注射,也可以将单细胞和细胞外基质混合而成的物质以1次或多次于同一位置或多个位置进行注射。
[0103]
实施例
[0104]
例1.源自小鼠的骨骼肌成肌细胞片的碎片的制作
[0105]
(1)源自小鼠的骨骼肌成肌细胞片的制作
[0106]
从4周龄的c57bl/6小鼠(clea japan inc.)的下肢中采集骨骼肌,并用含有胶原酶及胰蛋白酶的溶液进行处理,使其分散为单个细胞。将这些细胞在37℃、5%co2的条件下,使用含有20%fbs的mcdb131培养基培养至汇合,回收细胞。
[0107]
使用facs测定回收的细胞。将测定结果示于图1。回收的细胞中95%以上为骨骼肌成肌细胞。
[0108]
将回收的细胞以7~10
×
105/cm2的浓度接种于12孔的温度响应性培养容器(upcell(注册商标),12孔细胞培养板,cs3003,cellseed inc.),使用含有20%fbs的dmem/f12培养基培养6小时以上,进行片化。然后,将温度降低至20℃,从而使片状细胞培养物从
温度响应性培养容器剥离。
[0109]
对于剥离的片状细胞培养物,通过苏木精-伊红(he)染色,用苏木精将细胞核染成蓝紫色,用伊红将其他结构染成各种浓度的红色,用显微镜(20倍)对其截面进行观察。另外,对于另外的剥离的片状细胞培养物,通过免疫染色,将细胞核染成蓝色,将结蛋白染成绿色,用显微镜(20倍)对其截面进行观察。
[0110]
图2a示出片状细胞培养物的照片,图2b示出经苏木精-伊红染色的片状细胞培养物的截面的显微镜照片,图2c示出经免疫染色的片状细胞培养物的截面的显微镜照片。
[0111]
(2)碎片的制作
[0112]
对于(1)中未供于染色的片状细胞培养物,从温度响应性培养容器中除去培养基等,添加0.3ml的生理盐水。添加后,使用1.0ml注射器(泰尔茂公司制)及23g注射针(泰尔茂公司制)对生理盐水连同片状细胞培养物一起反复进行抽吸、排出,将片状细胞培养物进行破碎,使其悬浮于生理盐水。对于悬浮液,分别准备反复5次、反复10次进行抽吸
·
排出的组合操作而得的悬浮液。
[0113]
图3示出各悬浮液的显微镜照片。图3a为反复5次进行抽吸
·
排出的组合操作而得的悬浮液的照片,图3b为其经放大的显微镜照片。图3c为反复5次进行抽吸
·
排出的组合操作而得的悬浮液的经放大的显微镜照片。
[0114]
反复5次进行抽吸
·
排出的组合操作而得的悬浮液中,确认到约300~500μm的碎片。但是,反复10次的悬浮液中,几乎所有的细胞为与单细胞相近的形态。
[0115]
认为例1中获得的破碎物为在片状细胞培养物粘附于培养基材的面上存在大量细胞外基质(ecm)的破碎物。
[0116]
例2.小鼠缺血模型中的片状细胞培养物的碎片的施与
[0117]
(1)小鼠缺血模型的制作
[0118]
在开始施与试验的7天前,在8周龄的c57bl/6小鼠(clea japan inc.)的右后肢的股动脉远心端进行结扎及血管切除。在进行结扎及血管切除之前,通过激光多普勒血流灌注成像(ldpi)测定健康状态下的小鼠的血流量。
[0119]
(2)移植
[0120]
将(1)中制作的小鼠缺血模型随机分成3组,每组10只。对第1组的小鼠注入例1中制作的反复5次进行抽吸
·
排出的组合操作而得的悬浮液(以下称为碎片施与组)。作为对照,对第2组的小鼠注入使7~10
×
105个与片状细胞培养物中使用的细胞相同来源的细胞以未进行培养的单细胞状态悬浮于0.3ml的生理盐水而得的悬浮液(以下称为单细胞施与组)。对第3组的小鼠仅注入0.3ml的生理盐水(以下称为生理盐水施与组)。在任一组的小鼠中,注入是在小鼠缺血模型的缺血肢的去除了血管的部分的肌肉中分2处进行的。
[0121]
(3)试验计划
[0122]
试验是将注入日作为第0天计算试验开始后的天数,并实施至第28天。在第0天、第7天、第14天、第21天及第28天,通过ldpi对各小鼠测定血流量。另外,在第1天、第3天、第5天、第7天及第28天,采集施与的部位的组织以确认基因的表达。通过rt-pcr对从各组小鼠采集的组织中的基因的表达进行评价。
[0123]
(4)结果
[0124]
将小鼠缺血模型制作前的血流量设为100%时的第0天、第7天、第14天、第21天及
第28天的各组小鼠的血流量%的基于ldpi的结果在图4示出。另外,第7天、第14天、第21天及第28天的各组代表性的小鼠的基于ldpi的成像的结果在图5示出。图4、图5中,图中的成簇细胞组表示碎片施与组的小鼠,单细胞组表示单细胞施与组的小鼠,生理盐水组表示生理盐水施与组的小鼠。另外,图4中*表示对生理盐水施与组进行邓奈特检验,其中p《0.05。
[0125]
如图4所示,各组在第0天的血流量均下降至小于小鼠缺血模型制作时的20%,但在第7天、第14天、第21天及第28天,与生理盐水施与组的小鼠及单细胞施与组的小鼠相比,碎片施与组的小鼠中观察到血流量的显著的改善。
[0126]
如图5所示,在第7天、第14天、第21天及第28天的任一测定中,确认到与生理盐水施与组及单细胞施与组相比,碎片施与组的小鼠血流量进一步改善,并且为与处于健康状态的左肢相近的状态。
[0127]
如图6所示,确认到与从单细胞施与组的小鼠中采集的组织及从生理盐水施与组的小鼠中采集的组织相比,从碎片施与组的小鼠中采集的组织中vegf、hgf、fgf、ang-1、ang-2、sdf-1、pax7及myod以极高的水平表达。
[0128]
例3.施与细胞的植活确认
[0129]
(1)试验计划
[0130]
从4周龄的gfp导入c57bl/6小鼠(japan slc inc.)的下肢中采集骨骼肌,以与例1同样的方式(相同条件下)对生理盐水连同片状细胞培养物一起反复进行抽吸、排出,将片状细胞培养物进行破碎,使其悬浮于生理盐水而制作悬浮液。然后,以与例2(1)同样的方式制作小鼠缺血模型,并分为3组。对第1组的小鼠注入所制作的悬浮液(以下称为碎片施与组2)。作为对照,对第2组的小鼠注入使7~10
×
105个从gfp导入c57bl/6小鼠的下肢中采集的骨骼肌的细胞以未进行培养的单细胞状态悬浮于0.3ml的生理盐水而得的悬浮液(以下称为单细胞施与组2)。对第3组的小鼠仅注入0.3ml的生理盐水(以下称为生理盐水施与组2)。在任一组的小鼠中,注入是在小鼠缺血模型的缺血肢的去除了血管的部分的肌肉中分2处进行的。
[0131]
将注入日作为第0天计算试验开始后的天数,在第1天、第3天、第5天、第7天及第28天,处死各组小鼠并采集内收肌。对各小鼠的从采集的内收肌中获得的组织的一部分,用福尔马林溶液固定后进行苏木精-伊红染色,对另一部分用多聚甲醛溶液固定后制作冰冻标本。对经苏木精-伊红染色的各组织中的中心具有核的肌纤维(新生肌纤维)及边缘具有核的成熟肌纤维的数量进行计数。对冰冻标本确认gfp的区域。在第3天于从各组小鼠采集的组织中进一步对初期的mhc阳性的细胞的数量进行计数。
[0132]
(2)结果
[0133]
示出在第3天、第5天、第7天及第28天,从碎片施与组2、单细胞施与组2、生理盐水施与组2的各小鼠中采集的组织的经苏木精-伊红染色的显微镜照片。图7中,图中的成簇细胞组表示碎片施与组2的小鼠,单细胞组表示单细胞施与组2的小鼠,生理盐水组表示生理盐水施与组2的小鼠。另外,将对经苏木精-伊红染色的各组织中的中心具有核的肌纤维(新生肌纤维)的数量进行计数的结果示于图8a,将对经苏木精-伊红染色的各组织中的中心具有核的肌纤维(新生肌纤维)的数量与边缘具有核的成熟肌纤维的数量的比率进行计算的结果示于图8b。另外,图中*表示对生理盐水施与组2进行邓奈特检验,其中p《0.05,图中 表示对单细胞施与组2进行邓奈特检验,其中p《0.05。将在第3天对从碎片施与组2、单细胞施
与组2、生理盐水施与组2的各小鼠中采集的组织中的初期的mhc阳性的细胞数进行计数的结果示于图8c。
[0134]
如图8a及图8b所示,在第28天碎片施与组2的小鼠的肌肉生成几乎完成,相对于此,单细胞施与组2及生理盐水施与组2中肌肉生成仍在继续,因此确认碎片施与组2的小鼠在早期发生肌肉生成。如图8c所示,在第3天,确认到与从单细胞施与组2、生理盐水施与组2的小鼠中采集的组织中相比,从碎片施与组2的小鼠中采集的组织中显著存在大量的初期的mhc阳性的细胞数。
[0135]
将在第7天从碎片施与组2、单细胞施与组2的各小鼠中采集的组织的冰冻标本的显微镜照片示于图9。
[0136]
如图9所示,确认到与从单细胞施与组2的小鼠中采集的组织的标本相比,从碎片施与组2的小鼠中采集的组织的标本的gfp的区域更广。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。