降低病毒分子水平的方法
1.通过引用并入优先权申请
2.本技术要求于2019年11月7日提交的美国临时申请序列号62/931,962的优先权,其全文据此以引用方式并入本文。
3.背景
技术领域
4.本技术涉及通过使受感染的细胞与靶向细胞宿主因子的治疗剂接触来降低病毒分子水平和/或治疗病毒感染的方法,该细胞宿主因子是参与病毒复制的靶rna或靶蛋白。
背景技术:
5.乙型肝炎病毒(hbv)是一种dna病毒,是嗜肝病毒(hepadnaviridae)科的成员。hbv在世界范围内感染超过3亿,并且为肝癌和肝病诸如慢性肝炎、肝硬化和肝细胞癌的致病原。hbv感染可为急性的和/或慢性的。急性hbv感染可为无症状的或存在有症状的急性肝炎。慢性乙型肝炎的特征在于肝细胞被hbv持续感染,这可以持续数年甚至数十年。hbv分为a至j十种基因型。
6.hbv具有约3.2千碱基(kb)对的部分双链环状dna。已经对hbv复制途径进行了非常详细的研究(1)。一部分复制包括形成共价闭合环状dna(cccdna)形式。cccdna的存在引起病毒在宿主生物的整个寿命期间再度出现的风险。hbv携带者可传播疾病多年。据估计,全世界每年有超过750,000人死于乙型肝炎。此外,免疫抑制的个体或经历化学疗法的个体尤其具有hbv感染再激活的风险。
7.hbv可以通过血液、精液和/或其他含有病毒的体液传播。这可通过以下方式发生:直接的血液-血液接触、无保护的性交、共享针头以及在分娩过程期间从受感染的母亲到她的婴儿。hbv表面抗原(hbsag)最常用于筛查这种感染的存在,因为大多数hbsag存在于hbv病毒粒子中。目前可用的药物不能治愈hbv感染。相反,药物抑制病毒的复制。
8.冠状病毒疾病2019(covid-19)(也称为新型冠状病毒肺炎或2019-ncov急性呼吸道疾病)是由sars-cov2(严重急性呼吸综合征冠状病毒2,也称为新型冠状病毒2019或2019-ncov)感染引起的。该疾病于2019年12月首次发现并在全球蔓延,造成了大流行。covid-19的症状包括发烧、咳嗽、气短、疲劳、头痛、嗅觉丧失、鼻塞、喉咙痛、咳痰、肌肉或关节疼痛、寒颤、恶心、呕吐和腹泻。在严重的情况下,症状可能包括行走困难、精神错乱、脸色发青、咳血、白细胞计数减少和器官衰竭。并发症可能包括肺炎、病毒性败血症、急性呼吸窘迫综合征和肾衰竭。
9.sars-cov-2并不是唯一会引起疾病的冠状病毒。它是一种β冠状病毒(冠状病毒的一个属),包括其他人类病原体,包括sars-cov(严重急性呼吸综合征的病原体)、mers-cov(中东呼吸综合征的病原体)和hcov-oc43(普通感冒的一种病原体)。这些病毒的传染性以及它们引起的疾病的严重程度差异很大。β-冠状病毒还可以表现为人畜共患感染,在人和动物之间传播。此外,非人物种诸如骆驼、蝙蝠、老虎、非人灵长类动物和兔子也可能对β冠
状病毒易感。迫切需要治疗或治愈多种冠状病毒。
10.本公开提供了可用于抗病毒的分子,这些病毒利用细胞宿主因子进行病毒复制,包括hbv和呼吸道病毒,诸如冠状病毒。因此,本公开满足了本领域对可用于安全且有效地治疗或预防人的此类感染的化合物的需要。
技术实现要素:
11.多种细胞因子现已被确定为在被hbv和其他病毒用来复制它们的基因组和/或调节病毒感染结果的某些分子的产生中发挥作用。已开发寡核苷酸和sirna以靶向这些细胞因子,并因而减少由受感染细胞产生的相应病毒分子。
12.一个实施方案提供了一种降低由受感染细胞产生的病毒分子的水平的方法,该方法包括:
13.使受感染细胞与有效量的靶向细胞宿主因子的寡核苷酸抑制剂接触,从而抑制由受感染细胞产生细胞宿主因子并减少由受感染细胞产生的病毒分子的量;
14.其中受感染细胞产生(a)至少一种细胞宿主因子,该至少一种细胞宿主因子是选自grp78/bip rna、grp78/bip蛋白、srsf1 rna、srsf1蛋白、hnrnpa2b1 rna、hnrnpa2b1蛋白、rplp1 rna、rplp1蛋白、rplp2 rna和rplp2蛋白的靶rna或靶蛋白;以及(b)病毒用于复制的一定量的至少一种病毒分子,其中该病毒分子是病毒蛋白、病毒dna或病毒rna。在一个实施方案中,病毒是hbv。在另一个实施方案中,病毒是冠状病毒。在一个实施方案中,寡核苷酸抑制剂具有小于100nm的ec
50
值,如通过针对病毒分子的测定所确定的。
15.另一个实施方案提供了一种治疗病毒感染的方法,该方法包括:
16.向有需要的受试者施用治疗有效量的寡核苷酸抑制剂,其中该寡核苷酸抑制剂靶向细胞宿主因子,从而减少受试者的受感染细胞产生细胞宿主因子;
17.其中受感染细胞产生至少一种细胞宿主因子,该至少一种细胞宿主因子是选自grp78/bip rna、grp78/bip蛋白、srsf1 rna、srsf1蛋白、hnrnpa2b1 rna、hnrnpa2b1蛋白、rplp1 rna、rplp1蛋白、rplp2 rna和rplp2蛋白的靶rna或靶蛋白。在一个实施方案中,引起感染的病毒是hbv。在另一个实施方案中,引起感染的病毒是冠状病毒。在一个实施方案中,寡核苷酸抑制剂具有小于100nm的ec
50
值,如通过针对病毒分子的测定所确定的。
18.另一个实施方案提供了一种用于治疗受试者的病毒感染的药物组合物,该药物组合物包含:
19.药学上可接受的载体、稀释剂、赋形剂或它们的组合;以及
20.治疗有效量的寡核苷酸抑制剂,该寡核苷酸抑制剂靶向选自grp78/bip rna、grp78/bip蛋白、srsf1 rna、srsf1蛋白、hnrnpa2b1 rna、hnrnpa2b1蛋白、rplp1 rna、rplp1蛋白、rplp2 rna、rplp2蛋白以及任何前述物质的组合的靶rna或靶蛋白中的至少一种。在一个实施方案中,感染病毒是乙型肝炎病毒。在另一个实施方案中,病毒感染是covid-19。在一个实施方案中,寡核苷酸抑制剂具有小于100nm的ec
50
值,如通过对由受感染细胞产生的病毒分子的测定所确定的。
21.以下更详细地描述这些实施方案和其他实施方案。
附图说明
22.图1a示出了宿主因子mrna的示意图、它们在美国国家生物技术信息中心(ncbi)的登录号和在本技术中用于识别sirna的靶序列的核碱基的编号。编码蛋白的开放阅读框表示为矩形,起始密码子的第一个腺苷酸表示为核苷酸1。
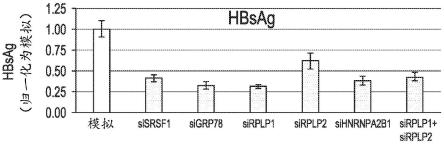
23.图1b示出了sirna敲低对细胞活力和hbsag水平的影响的总结。通过使用celltiter-glo试剂测定的atp水平评估细胞活力,并将结果归一化为模拟处理细胞中的水平。使用elisa对hbsag水平进行定量,并将数据归一化为模拟处理细胞中的水平。结果表明,靶向grp78、srsf1、hnrnpa2b1和rplp2的sirna可降低hepg2.2.15细胞产生的hbsag水平。
24.图1c示出了样品蛋白印迹图像,其示出sirna降低了它们靶向的细胞蛋白的水平。用对靶标特异的抗血清探测印迹。l.c.表示上样对照。
25.图2a是示出可敲低hepg2.2.15细胞中的细胞因子的sirna的细胞毒性(cc
50
)的样品分析的图。
26.图2b是示出可敲低hepg2.2.15细胞中的细胞因子的两种sirna的有效浓度(ec
50
)的样品分析的图,如可将hbsag水平降低至模拟处理样品的50%的sirna所证明的。
27.图2c是示出可敲低hepg2.2.15细胞中的细胞因子的sirna的细胞毒性(cc
50
)的样品分析的图。
28.图2d是示出可敲低hepg2.2.15细胞中的细胞因子的两种sirna的有效浓度(ec
50
)的样品分析的图,如可将hbsag水平降低至模拟处理样品的50%的sirna所证明的。
29.图2e是总结可单独或组合敲低hepg2.2.15细胞中的细胞因子的sirna的细胞毒性(cc
50
)和有效浓度(ec
50
)的表。
30.图3a是示出靶向hnrnpa2b1、grp78、rplp1、rplp2和srsf1的sirna对hepg2.2.15细胞活力的影响极小的图。使用celltiter-glo试剂定量对细胞活力的影响。将所有数据都归一化为由模拟处理细胞产生的蛋白的量。
31.图3b是示出靶向hnrnpa2b1、grp78、rplp1、rplp2和srsf1的sirna与模拟处理的hepg2.2.15细胞相比引起hbsag水平降低的图。使用elisa对用sirna处理后hepg2.2.15细胞产生的hbv蛋白进行定量。
32.图3c是示出靶向hnrnpa2b1、grp78、rplp1、rplp2和srsf1的sirna与模拟处理的hepg2.2.15细胞相比引起hbeag水平降低的图。结果示出了用sirna处理后hepg2.2.15细胞产生的hbv蛋白的定量。使用elisa评估细胞培养基中的hbeag。
33.图3d是示出靶向hnrnpa2b1、grp78和srsf1的sirna与模拟处理的hepg2.2.15细胞相比引起核心水平降低的图。结果示出了用sirna处理后hepg2.2.15细胞产生的hbv蛋白的定量。
34.图3e是示出当与模拟处理的hepg2.2.15细胞相比时,靶向hnrnpa2b1、rplp1、rplp2以及rplp1和rplp2的组合的sirna引起分泌的hbv dna水平降低的图。结果示出了在细胞培养基中发现的hbv dna的量的定量。使用qpcr确定dna的拷贝数。
35.图3a-e示出了靶向宿主因子的sirna可以降低hepg2.2.15细胞中多种hbv分子的水平。所有sirna均以10nm的终浓度引入细胞,但用rplp1和rplp2的sirna处理的细胞除外,它们用每组sirna的5nm终浓度处理。
36.图4a-c示出了靶向宿主因子的sirna可抑制冠状病毒产生。
37.图4a示出了用于评估靶向宿主因子的sirna是否可以影响由hcov-oc43感染hct8细胞产生的病毒粒子rna的实验示意图。
38.图4b示出了在oc43感染的hct 8细胞中测试的宿主因子sirna在以10nm或5nm测试时不影响细胞活力。使用celltiter-glo试剂获得细胞活力结果。
39.图4c示出了转染到hct8细胞中的宿主因子sirna和添加到培养细胞中的瑞德西韦可以减少hcov-oc43病毒粒子rna的产生。使用逆转录和定量聚合酶链反应对vrna进行定量。
40.图5a至图5c示出了几种靶向rplp1和rplp2的sirna的性质。
41.图5a示出了抑制hbsag和hbeag水平而不影响细胞活力的sirna的两个示例。这些图示出了多种性质:hbv s抗原(hbsag)和hbv e抗原(hbeag)的剂量依赖性减少以及对细胞活力的影响,如通过使用celltiter-glo(ctg)试剂测定的。示例性sirna编号为24和34,它们分别靶向rplp1和rplp2(参见表2)。
42.图5b.sirna靶向的rna减少的示例。通过qpcr定量靶mrna的量。
43.图5c.sirna靶向的蛋白减少的示例。凝胶图像来自用抗原特异性抗体探测的蛋白印迹。rplp1和rplp2作为异二聚体起作用,并且降低一种蛋白的丰度导致另一种蛋白的类似减少。p54nrb和gapdh的水平用作上样对照。
44.图6示出了靶向宿主因子的sirna可以减少冠状病毒病毒粒子rna的量。
45.图6a示出了靶向宿主因子的sirna可以减少感染细胞产生的hcov-oc43病毒粒子rna的示例。sirna以10nm的终浓度转染到hct8细胞中。以0.9μm使用用于抑制冠状病毒感染的阳性对照,瑞德西韦(rem)。使用对oc43 rna特异的分支dna测定对病毒粒子rna(vrna)进行定量。
46.图6b示出了用两种sirna处理的细胞产生的hcov-ov43病毒粒子rna的减少的实例,其中每种sirna的浓度为10nm。这两种sirna是在水平条中通过化合物编号(参见表2)提及的那些,以及靶向grp78、sigrp78的sirna。以0.9μm使用用于抑制冠状病毒感染的阳性对照,瑞德西韦(rem)。使用对oc43 rna特异的分支dna测定对vrna进行定量。
具体实施方式
47.定义
48.除非另有定义,否则本文所用的所有技术和科学术语均具有与本领域的普通技术人员通常所理解的含义相同的含义。除非另有说明,否则本文引用的所有专利、申请、公开申请和其他公开全文均以引用方式并入。在本文的术语存在多个定义的情况下,除非另有说明,否则以该部分中的定义为准。
49.如本文所用,术语“寡核苷酸”(或“低聚核苷酸”)具有本领域技术人员所理解的其通常含义,因此是指包括寡脱氧核苷酸、寡脱氧核糖核苷酸和寡核糖核苷酸的一类化合物。因此,“寡核苷酸”是指核糖核酸(rna)或脱氧核糖核酸(dna)或其模拟物的寡聚物或聚合物,包括提及由天然存在的核碱基、糖和磷酸二酯(po)核苷间(主链)键组成的寡核苷酸以及具有类似功能的非天然存在部分的“经修饰的”或经取代的寡核苷酸,和/或包括增加循环半衰期和/或减少寡核苷酸降解(例如,由核酸内切酶降解)和增加细胞摄取的修饰,诸如
galnac。“寡核苷酸抑制剂”是至少部分抑制细胞产生其所靶向的rna或蛋白的寡核苷酸。
[0050]“反义”寡核苷酸(aso)是以序列特异性方式识别靶rna或特异性退火到靶rna的合成寡核苷酸。由sirna或aso识别的靶rna的序列由mrna的蛋白编码序列的核苷酸编号定义,其中起始密码子(aug)的腺苷酸(aug)称为核苷酸1。本技术中使用的序列具有可以在细胞内以高特异性识别靶标的长度和序列。特异性可以通过sirna和靶rna序列组的双链体的1nm双链体在生理盐(155mm)中的计算解链温度并使用最近邻参数来表示。特异性还可以通过退火双链体的热力学常数、吉布斯自由能(δg)的变化来表示。计算sirna/靶双链体的tm和热力学常数的计算机程序可作为oligocalc获得(19)。
[0051]
如本文所用,术语“sirna”具有本领域技术人员所理解的其通常含义,因此是指一类称为小干扰rna、短干扰rna和/或沉默rna的寡核苷酸。这些化合物是长度通常为19-25个碱基对的非编码双链rna分子,其在rna干扰(rnai)途径中起作用并干扰含有与sirna反义链互补的核苷酸序列的特定基因的表达并介导mrna的降解。mrna水平降低会降低翻译和靶蛋白的量。本文提及的sirna应理解为包括由天然存在的核碱基、糖和磷酸二酯(po)核苷间(主链)键组成的sirna以及具有类似功能的非天然存在部分的“经修饰的”或经取代的sirna,和/或包括增加循环半衰期和/或减少寡核苷酸降解(例如,由核酸内切酶降解)和增加细胞摄取的修饰,诸如galnac。
[0052]
如本文所用,术语“靶”、“靶向”和类似术语,如在寡核苷酸抑制剂通过碱基配对识别靶rna的上下文中所用的,并且具有本领域技术人员所理解的它们的通常含义,是指寡核苷酸抑制剂与靶rna杂交并至少部分抑制其所靶向的rna或蛋白的产生的过程。例如,sirna可以通过减少mrna从而减少从靶rna合成的产物(包括蛋白)而引起编码mrna的基因的沉默。可以使用各种测定技术来确定寡核苷酸抑制剂至少部分地抑制其所靶向的rna或蛋白的产生的程度。这样的sirna和它们靶向的各种rna的非限制性示例在表1和表2中列出。
[0053]
如本文所用,术语“病毒分子”具有本领域技术人员所理解的其通常含义,因此是指由病毒基因组制备的一类分子。病毒分子通常是病毒蛋白、病毒dna或病毒rna。病毒可以利用或需要这些分子来复制它们的基因组或调节病毒感染的结果。例如,术语“hbv分子”是指由hbv基因组制备的一类分子。hbv分子的示例包括s-抗原、e-抗原、核心-抗原、hbv rna和hbv dna。在一个实施方案中,病毒分子是冠状病毒分子,诸如冠状病毒rna。
[0054]
如本文所用,术语“细胞宿主因子”、“细胞因子”、“宿主因子”和类似术语具有本领域技术人员所理解的它们通常的含义,因此是指由细胞产生并被病毒用来复制的rna或蛋白。如上所述,各种细胞因子现已被确定为在被hbv和其他病毒用来复制的某些病毒分子的产生中发挥作用。
[0055]
如本文所用,术语“病毒测定”具有本领域技术人员所理解的其通常含义,因此是指定量评估病毒分子的测定。例如,“hbv测定”是指定量评估hbv分子或hbv感染对受感染细胞的影响的测定。hbv测定的示例包括hbsag测定、hbeag测定、hbv核心测定、hbv rna测定和hbv dna测定。同样,“冠状病毒测定”是定量评估一种或多种呼吸道病毒分子或病毒感染对受感染细胞的影响的呼吸道病毒测定的示例。冠状病毒测定的示例包括定量聚合酶链反应(qpcr)测定和分支dna测定。可以使用合适的病毒测定来鉴定被病毒感染的细胞和/或受试者。
[0056]
如本文所用,“载体”是指促进化合物通过、递送和/或结合到细胞、组织和/或身体
器官的化合物或颗粒。例如但不限于可以将sirna递送至细胞的细胞质的sirna的脂质载体。另一个示例是纳米颗粒(lnp),一种这样的类型的载体,其可以包封寡核苷酸和/或sirna,从而保护寡核苷酸抑制剂在通过血流期间不被降解和/或促进递送至所需器官,诸如肝脏。
[0057]
如本文所用,“稀释剂”是指药物组合物中不具有药物活性但在药学上可能是必须的或期望的成分。例如,稀释剂可用于增大其质量太小而无法制造和/或施用的强效药品的体积。它也可为用于待通过注射、摄取或吸入施用的药品的溶解的液体。本领域中稀释剂的常见形式为缓冲水溶液,诸如但不限于模仿人类血液的组成的磷酸盐缓冲盐水。
[0058]
如本文所用,“赋形剂”是指添加到药物组合物中以向组合物提供但不限于体积、稠度、稳定性、结合能力、润滑、崩解能力等的惰性物质。“稀释剂”是一种类型的赋形剂。
[0059]
减少病毒分子和治疗病毒感染的方法
[0060]
如以下工作示例所示,细胞蛋白grp78/bip、srsf1、hnrnpa2b1、rplp1和rplp2现已被确定为在病毒复制和感染中发挥作用的细胞宿主因子。现在已经开发了多种方法来通过靶向这些宿主因子来降低病毒分子的水平。例如,一个实施方案提供了一种减少受感染细胞产生的病毒分子数量的方法,包括使受感染细胞与有效量的寡核苷酸抑制剂接触,该寡核苷酸抑制剂靶向靶rna中的至少一种或靶向如本文所述的蛋白的减少。这种接触可有效抑制受感染细胞产生细胞宿主因子并减少受感染细胞产生的病毒分子的量。本领域技术人员认识到,本文所述的方法还提供了寡核苷酸抑制剂的相应用途的描述。例如,各种实施方案提供了用于如本文所述的方法(例如降低病毒水平和/或治疗病毒感染的方法)中的寡核苷酸抑制剂。其他实施方案提供了用于制备药物的寡核苷酸抑制剂,该药物可通过本文所述的方法(例如减少产生的病毒的量和/或治疗病毒感染的方法)施用于受试者。
[0061]
一个实施方案提供了一种降低由受感染细胞产生的病毒分子的水平的方法,该方法包括:
[0062]
使受感染细胞与有效量的靶向细胞宿主因子的寡核苷酸抑制剂接触,从而抑制由受感染细胞产生细胞宿主因子并减少由受感染细胞产生的病毒分子的量;
[0063]
其中受感染细胞产生(a)至少一种细胞宿主因子,该至少一种细胞宿主因子是选自grp78/bip rna、grp78/bip蛋白、srsf1 rna、srsf1蛋白、hnrnpa2b1 rna、hnrnpa2b1蛋白、rplp1 rna、rplp1蛋白、rplp2 rna和rplp2蛋白的靶rna或靶蛋白;以及(b)病毒用于复制的一定量的至少一种病毒分子,其中该病毒分子是病毒蛋白、病毒dna或病毒rna。
[0064]
在一个实施方案中,被病毒感染的细胞是哺乳动物细胞。例如,在一个实施方案中,哺乳动物细胞是人细胞。对于hbv感染,受感染细胞通常是来自肝脏的细胞,例如肝细胞。
[0065]
在一个实施方案中,病毒是hbv并且病毒分子是hbv分子。例如,在各种实施方案中,hbv分子是s-抗原(hbsag)、e-抗原(hbeag)、核心抗原、hbv rna或hbv dna。在一个实施方案中,hbv分子是s-抗原(hbsag)。
[0066]
在另一个实施方案中,病毒是呼吸道病毒并且病毒分子是呼吸道病毒分子。在一个实施方案中,呼吸道病毒是冠状病毒,例如,诸如sars-cov、mers-cov、hcov-oc43(aka oc43)或sars-cov2(引起covid-19的病毒)的冠状病毒。在一个实施方案中,冠状病毒分子是冠状病毒rna或病毒基因组。
[0067]
还开发了各种治疗病毒感染的方法。例如,一个实施方案提供了一种治疗病毒感染的方法,该方法包括:
[0068]
向有需要的受试者施用治疗有效量的寡核苷酸抑制剂,其中该寡核苷酸抑制剂靶向细胞宿主因子,从而减少受试者的受感染细胞产生细胞宿主因子;
[0069]
其中受感染细胞产生至少一种细胞宿主因子,该至少一种细胞宿主因子是选自grp78/bip rna、grp78/bip蛋白、srsf1 rna、srsf1蛋白、hnrnpa2b1 rna、hnrnpa2b1蛋白、rplp1 rna、rplp1蛋白、rplp2 rna和rplp2蛋白的靶rna或靶蛋白。
[0070]
除非上下文另有说明,否则本文对各种发明特征或方面的描述应理解为适用于降低受感染细胞产生的病毒分子水平的方法和治疗病毒感染的方法的这两种实施方案。在一个实施方案中,被病毒感染的受试者是哺乳动物受试者,在这种情况下,受感染细胞是哺乳动物细胞。例如,在一个实施方案中,哺乳动物受试者是人受试者并且受感染细胞是人细胞。在各种实施方案中,该方法还包括在使受感染细胞与有效量的寡核苷酸抑制剂接触和/或向受试者施用治疗有效量的寡核苷酸抑制剂之前将细胞和/或受试者鉴定为被病毒感染。
[0071]
在各种实施方案中,由受试者的受感染细胞产生的细胞宿主因子是如本文所述的rna或蛋白。在各种实施方案中,通过确定受感染细胞产生的病毒分子的减少来确定受试者的受感染细胞对细胞宿主因子的减少。在一个实施方案中,寡核苷酸抑制剂降低受感染细胞产生的病毒分子的水平,并因而降低受试者的病毒载量。在一个实施方案中,感染受试者的病毒是hbv,并且细胞宿主因子产生的减少由hbv分子水平的降低指示。例如,在各种实施方案中,hbv分子是s-抗原(hbsag)、e-抗原(hbeag)、核心抗原、hbv rna或hbv dna。在一个实施方案中,hbv分子是s-抗原(hbsag)。因此,在一个实施方案中,细胞宿主因子产生的减少是由hbsag测定所确定的hbsag水平降低来指示的。
[0072]
在另一个实施方案中,感染受试者的病毒是呼吸道病毒并且病毒分子是呼吸道病毒分子。在一个实施方案中,呼吸道病毒是冠状病毒,例如人冠状病毒,并且呼吸道病毒分子是人冠状病毒分子。例如,在一个实施方案中,冠状病毒是β-冠状病毒,例如sars-cov、sars-cov2、mers-cov或hcov-oc43。
[0073]
在各种实施方案中,寡核苷酸抑制剂靶向选自grp78/bip rna、srsf1 rna、hnrnpa2b1 rna、rplp1 rna和rplp2 rna的靶rna中的至少一种。在其他实施方案中,寡核苷酸抑制剂靶向选自grp78/bip蛋白、srsf1蛋白、hnrnpa2b1蛋白、rplp1蛋白和rplp2蛋白的靶蛋白中的至少一种。在一个实施方案中,寡核苷酸抑制剂是识别靶rna的反义寡核苷酸(aso),其中靶rna包括mrna。在另一个实施方案中,寡核苷酸抑制剂是识别靶rna的沉默rna(sirna),其中靶rna包括mrna。在各种实施方案中,寡核苷酸抑制剂包含一个或多个化学修饰的核苷酸,其增强寡核苷酸抑制剂与靶rna或靶蛋白的结合。
[0074]
靶向靶rna或靶蛋白中的至少一种的寡核苷酸和sirna可以从商业来源获得,通过已知方法或其修饰制备,和/或如本文别处所述制备。靶向grp78/bip、hnrnpa2b1、rplp1、rplp2和srsf1的sirna的非限制性实例列于表1和表2中并描述于下文实施例中。在一个实施方案中,寡核苷酸抑制剂是如表1和表2中所述的sirna或其修饰形式。在各种实施方案中,修饰寡核苷酸抑制剂以减少核酸酶对寡核苷酸的降解。在另一个实施方案中,修饰寡核苷酸抑制剂以增强寡核苷酸抑制剂与靶rna或靶蛋白的结合。在另一个实施方案中,寡核苷
酸抑制剂与氨基糖或脂质缀合。
[0075]
在一个实施方案中,寡核苷酸抑制剂靶向grp78/bip rna和grp78/bip蛋白中的至少一种。在另一个实施方案中,寡核苷酸抑制剂靶向srsf1 rna和srsf1蛋白中的至少一种。在另一个实施方案中,寡核苷酸抑制剂靶向hnrnpa2b1 rna和hnrnpa2b1蛋白中的至少一种。在另一个实施方案中,寡核苷酸抑制剂靶向rplp1 rna和rplp1蛋白中的至少一种。在另一个实施方案中,寡核苷酸抑制剂靶向rplp2 rna和rplp2蛋白中的至少一种。
[0076]
在一个实施方案中,将如本文所述的寡核苷酸抑制剂以有效降低受感染细胞产生的病毒分子水平并因而降低受试者的病毒载量的量施用于受试者。靶向靶rna或靶蛋白中的至少一种的寡核苷酸抑制剂可以具有小于100nm、小于50nm、小于30nm或小于10nm的ec
50
值,如通过合适的病毒测定(例如,hbv测定或呼吸道病毒测定)所确定的。各种合适的病毒测定是本领域技术人员已知的并且可以基于选择用于减少的病毒分子来选择。例如,冠状病毒rna水平的降低可以通过测量受感染细胞产生的病毒粒子的减少来确定。hbv分子的示例包括s-抗原(hbsag)、e-抗原(hbeag)、核心-抗原、hbv rna和hbv dna。在一个实施方案中,hbv测定定量评估hbsag、hbeag、hbv核心、hbv rna或hbv dna。在一些情况下,hbv测定的选择不一定基于被选择用于减少的hbv分子进行,包括例如hbv分子未知、存在多个hbv分子和/或受试者正在接受hbv治疗的情况。在这种情况下,选择hbsag测定作为默认hbv测定。例如,在如本文所述的治疗hbv感染的方法的实施方案中,hbv测定是hbsag测定。
[0077]
在各种实施方案中,通过使病毒感染的细胞与有效量的如本文所述的寡核苷酸抑制剂接触,可以显著降低病毒分子的水平。例如,病毒感染的细胞与有效量的寡核苷酸抑制剂的接触可以将病毒分子的水平降低至少20%、至少30%、至少40%或至少50%。在一个实施方案中,细胞被hbv感染并且病毒分子是hbv分子。在另一个实施方案中,细胞被冠状病毒(例如β-冠状病毒)感染并且病毒分子是冠状病毒分子。病毒分子水平的降低可以使用如本文别处所述的合适的病毒测定来确定。这种测定可以基于确定水平降低的病毒分子来选择,同样hbsag测定是默认的hbv测定。
[0078]
本文描述的一些实施方案涉及一种治疗病毒感染(例如,hbv感染或呼吸道病毒感染,诸如冠状病毒感染)的方法,该方法可以包括向被鉴定为患有病毒感染的受试者施用有效量的如本文所述的寡核苷酸抑制剂,或包含有效量的如本文所述的寡核苷酸抑制剂的药物组合物。本文所述的其他实施方案涉及使用如本文所述的寡核苷酸抑制剂来制备用于治疗病毒感染(例如,hbv感染或呼吸道病毒感染,诸如冠状病毒感染)的药物。本文所述的其他实施方案涉及如本文所述的寡核苷酸抑制剂或包含如本文所述的寡核苷酸抑制剂的药物组合物用于治疗病毒感染(例如,hbv感染或呼吸道病毒感染,诸如冠状病毒感染)的用途。
[0079]
各种实施方案提供了通过向受试者施用有效量的如本文所述的寡核苷酸抑制剂来治疗病毒感染的方法。其他实施方案提供了如本文所述的寡核苷酸抑制剂,用于治疗此类病毒感染和/或用于制备用于此类病毒感染治疗的药物。在各种实施方案中,这样的方法和用途还包括将有效量的第二疗法与寡核苷酸抑制剂组合施用于受试者。第二疗法可以选自用于治疗病毒感染的各种治疗形式。在一个实施方案中,第二疗法包括将有效量的第二治疗分子与寡核苷酸抑制剂组合施用于受试者。例如,在各种实施方案中,第二治疗分子包括如本文所述的第二寡核苷酸抑制剂、核苷、核苷酸、核苷酸前药、干扰素、衣壳组装调节
剂、蛋白酶抑制剂或它们的组合。例如,在一个实施方案中,第二治疗分子是瑞德西韦。在一个实施方案中,第二治疗分子包括第二寡核苷酸抑制剂。在一个实施方案中,第二寡核苷酸抑制剂靶向至少一种细胞宿主因子。第二寡核苷酸抑制剂靶向的细胞宿主因子可以与第一寡核苷酸抑制剂靶向的细胞宿主因子相同或不同。在一个实施方案中,第一寡核苷酸抑制剂靶向rplp1并且第二寡核苷酸抑制剂靶向rplp2。在另一个实施方案中,第一寡核苷酸抑制剂靶向grp78并且第二寡核苷酸抑制剂靶向rplp1。在另一个实施方案中,第一寡核苷酸抑制剂靶向grp78并且第二寡核苷酸抑制剂靶向rplp2。
[0080]
如本文别处所述,可以使用多种途径将寡核苷酸抑制剂施用于有需要的受试者。在一个实施方案中,将有效量的寡核苷酸抑制剂或包含寡核苷酸抑制剂的药物组合物通过肠胃外途径施用于受试者。例如,在一个实施方案中,将有效量的寡核苷酸抑制剂或包含寡核苷酸抑制剂的药物组合物静脉内施用于受试者。在另一个实施方案中,将有效量的寡核苷酸抑制剂或包含寡核苷酸抑制剂的药物组合物皮下施用于受试者。在另一个实施方案中,将有效量的寡核苷酸抑制剂或包含寡核苷酸抑制剂的药物组合物通过吸入施用于受试者。
[0081]
分离的合成寡核苷酸抑制剂
[0082]
各种实施方案提供了分离的合成寡核苷酸抑制剂,其具有与如本文所述的靶rna以高特异性杂交的反义链。此类寡核苷酸抑制剂的示例描述于表2中。杂交的特异性可以通过至少约48℃、约49℃或约50℃的计算解链温度(tm)来表示。例如,在一个实施方案中,杂交的特异性由50℃或更高的计算tm表示。在一个实施方案中,杂交的特异性由大于或等于表2中所示的任何计算tm值的计算tm表示。
[0083]
一个实施方案提供了一种具有与靶rna杂交的反义链的分离的合成寡核苷酸抑制剂,其中:
[0084]
该靶rna选自grp78/bip rna、srsf1 rna、hnrnpa2b1 rna、rplp1 rna、rplp2 rna;并且
[0085]
该反义链是能够与选自以下的靶rna的15-21长度区段以高特异性杂交的任何15-21聚体反义链:
[0086]
该grp78/bip rna的核碱基1379至1397、
[0087]
该srsf1 rna的核碱基51至69、
[0088]
该srsf1 rna的核碱基523至541、
[0089]
该rplp1 rna的核碱基286至305、
[0090]
该rplp1 rna的核碱基81至101、
[0091]
该rplp1 rna的核碱基283至303、
[0092]
该rplp1 rna的核碱基331至351、
[0093]
该rplp1 rna的核碱基-1至20、
[0094]
该rplp1 rna的核碱基9至29、
[0095]
该rplp1 rna的核碱基74至94、
[0096]
该rplp1 rna的核碱基125至145、
[0097]
该rplp1 rna的核碱基272至292、
[0098]
该rplp1 rna的核碱基329至349、
[0099]
该rplp2 rna的核碱基135至155、
[0100]
该rplp2 rna的核碱基327至347、
[0101]
该rplp2 rna的核碱基336至356、
[0102]
该rplp2 rna的核碱基136至156、
[0103]
该rplp2 rna的核碱基190至210、
[0104]
该rplp2 rna的核碱基273至293、
[0105]
该rplp2 rna的核碱基302至322、
[0106]
该rplp2 rna的核碱基325至345、
[0107]
该rplp2 rna的核碱基52至72、
[0108]
该rplp2 rna的核碱基132至153、
[0109]
该rplp2 rna的核碱基142至162、
[0110]
该rplp2 rna的核碱基333至351、
[0111]
该rplp2 rna的核碱基56至74、
[0112]
该rplp2 rna的核碱基147至165、
[0113]
该rplp2 rna的核碱基108至126和
[0114]
该rplp2 rna的核碱基120至138。
[0115]
核碱基根据如图1a所示的相应靶rna所示的编号位置进行编号。在各种实施方案中,杂交的特异性由至少约48℃、约49℃或约50℃的计算tm表示。例如,在一个实施方案中,杂交的特异性由50℃或更高的计算tm表示,诸如大于或等于表2中所示的计算tm值中的任一个的计算tm。
[0116]
在各种实施方案中,分离的合成寡核苷酸抑制剂的反义链是seq id no.21-52中的任一个的反义链内的任何15-21聚体、16-21聚体、17-21聚体、18-21聚体、19-21聚体或20-21聚体反义链,条件是分离的合成寡核苷酸的反义链不是seq id no.1-20中的任一个。例如,在一个实施方案中,分离的合成寡核苷酸抑制剂的反义链是seq id no.21-42、44-45、47-50和52中的任一个的反义链内的任何15-21聚体反义链。在另一个实施方案中,分离的合成寡核苷酸抑制剂的反义链是seq id no.21-42、44-50和52中的任一个的反义链内的任何17-21聚体反义链。
[0117]
减少病毒分子和治疗病毒感染的方法的讨论
[0118]
病毒是细胞内寄生虫,依靠宿主细胞提供它们的复制和繁殖所需的许多代谢物和因子。细胞宿主因子是治疗干预的潜在靶标,只要它们对于细胞健康不是必需的。当与直接作用的抗病毒药进行比较时,靶向细胞蛋白以减少病毒感染不太可能选择抗性病毒,因为细胞分子的产生通常不经历病毒核酸合成典型的容易出错的合成(2)。
[0119]
hbv是最小的包膜病毒之一(1)。hbv攻击肝细胞并且其感染可以是急性的并且被宿主清除,也可以是慢性的。慢性感染和由此产生的炎症反应可导致患者发展为肝炎、肝硬化和肝细胞癌。全世界有超过1.8亿人慢性感染hbv。虽然可以抑制hbv聚合酶的现有药物是可获得的并且在降低病毒载量方面是有效的,但是它们并不能治愈病毒感染。
[0120]
hbv通过称为牛磺胆酸钠协同转运多肽(nctp)的肝特异性胆汁酸转运蛋白进入肝细胞(3)。释放到细胞中的核衣壳含有与病毒聚合酶共价连接的松弛的部分双链dna基因组,该病毒聚合酶可以将部分双链dna转化为共价闭合环,称为cccdna。cccdna是hbv rna巢
的转录模板,该hbv rna巢可以加工然后翻译形成几种蛋白,或者hbv前基因组rna可以复制形成hbv dna(1)。第一个被发现的hbv蛋白是hbv表面抗原(hbsag),它被分泌以影响免疫应答以及在核衣壳周围组装以形成感染性病毒。核心蛋白(也称为核心抗原)是在hbv基因组周围组装形成二十面体核衣壳的结构蛋白。e-抗原(hbeag)由rna剪接变体产生,该rna剪接变体含有与核心融合的前导肽,以使得能够从受感染细胞分泌e-抗原,可能的结果是干扰宿主免疫应答。hbv还产生其自身的dna聚合酶,这是一种可以从rna或dna模板合成dna的逆转录酶。称为hbx的hbv蛋白是一种多功能蛋白,可以调节细胞信号传导并有助于肝脏病理。
[0121]
hbv复制已在培养细胞中进行了广泛研究。人肝胚细胞瘤细胞系hepg2细胞可以感染hbv病毒粒子,特别是当它们过表达nctp受体时(4)。来源于含有整合的hbv基因组拷贝的hepg2细胞的hepg.2.2.15细胞也已用于产生hbv分子和形成感染性病毒粒子(5)。
[0122]
人们认为,细胞蛋白在整个hbv复制/感染过程中发挥着重要作用。这些宿主因子中的几种已被确定,包括在hbv蛋白的合成、折叠、修饰和运输中发挥作用的那些(6)。与hbv核酸的加工相互作用的宿主因子也已被确定,但是它们在hbv感染中的作用尚未得到充分研究和理解。已知宿主蛋白与ε元件相互作用,该ε元件是一种存在于hbv前基因组rna的两个末端和hbv mrna的3'末端的rna基序(7)。ε元件是hbv核酸合成和衣壳化所必需的(8)。
[0123]
被称为grp78/bip rna、grp78/bip蛋白、srsf1 rna、srsf1蛋白、hnrnpa2b1 rna、hnrnpa2b1蛋白、rplp1 rna、rplp1蛋白,rplp2 rna和rplp2蛋白的rna和蛋白是已知的,但寡核苷酸抑制剂先前尚未被确定为用于靶向降低hbv或呼吸道病毒分子水平和/或用于治疗hbv感染或呼吸道病毒感染的候选物。grp78/bip蛋白(可被称为grp78或bip)被认为是一种蛋白伴侣,可调节对错误折叠蛋白的识别,从而影响细胞存活、蛋白合成和蛋白降解(9)。grp78蛋白水平可能在hbv感染期间升高,并且可能与过表达的hbsag相关(10)。srsf1蛋白是一种rna结合蛋白,可影响rna剪接、rna转运和可翻译性,并且可调节无义介导的mrna衰变(11)。hnrnpa2b1蛋白识别rna,包括具有n6-甲基化腺苷酸的那些,以调节rna稳定性、加工和可翻译性(12)。hbv rna已显示在涉及hbv rna稳定性、复制和可翻译性的ε元件的碱基处具有n6-甲基腺苷酸(13)。hnrnpa2b1还可能涉及调节促炎细胞因子的产生,该促炎细胞因子的产生可激活宿主对病毒感染的先天免疫应答(14)。rplp2蛋白是一种被认为可调节翻译延伸效率的核糖体相关蛋白(15)。rplp2蛋白与另外两种蛋白rplp0和rplp1复合发挥作用,构成一种名为酸性核糖体茎的结构,该结构可以与翻译延伸因子相互作用以增强一些跨膜蛋白的翻译(16)。rplp1和rplp2都涉及从几种正链rna病毒产生野生型水平的包膜蛋白,并且都影响感染性(17,18)。
[0124]
药物组合物
[0125]
本文所述的一些实施方案涉及一种药物组合物,其可包含如本文所述的寡核苷酸抑制剂和药学上可接受的载体、稀释剂、赋形剂或它们的组合。例如,一个实施方案提供了一种用于治疗病毒感染(例如,hbv感染或呼吸道病毒感染,诸如冠状病毒感染)的药物组合物,该药物组合物包含:
[0126]
药学上可接受的载体、稀释剂、赋形剂或它们的组合;以及
[0127]
有效量的一种或多种寡核苷酸抑制剂,该寡核苷酸抑制剂靶向选自grp78/bip rna、grp78/bip蛋白、srsf1 rna、srsf1蛋白、hnrnpa2b1 rna、hnrnpa2b1蛋白、rplp1 rna、rplp1蛋白、rplp2 rna、rplp2蛋白以及任何前述物质的组合的靶rna或靶蛋白中的至少一
种。
[0128]
在一个实施方案中,寡核苷酸抑制剂具有小于100nm的ec
50
值,如通过合适的测定(例如,hbv测定或呼吸道病毒测定,诸如冠状病毒测定)所确定的。
[0129]
本领域技术人员应当理解,包含在药物组合物中的寡核苷酸抑制剂可以是靶向如本文别处描述的靶rna或靶蛋白中的至少一种的各种寡核苷酸抑制剂中的任何一种或多种。例如,在一个实施方案中,药物组合物中的sirna是如表1中所述的sirna或其修饰形式。在另一个实施方案中,药物组合物中的sirna是如表2中所述的sirna或其修饰形式。
[0130]
药物组合物的适当配方取决于所选择的施用途径。本文所述的寡核苷酸抑制剂的配制和施用技术是本领域技术人员已知的。本领域存在多种施用寡核苷酸抑制剂的技术,包括但不限于肠胃外递送,例如通过吸入、静脉内或皮下递送。药物组合物通常将根据特定的预期施用途径进行调制。例如,在一个实施方案中,药物组合物是适合通过肠胃外递送向受试者施用的形式。在各种实施方案中,这样的肠胃外递送形式包括增强递送的载体。例如,在一个实施方案中,将寡核苷酸抑制剂包封在脂质中,所述脂质保护寡核苷酸抑制剂在通过血流期间免于降解和/或促进递送至所需器官,诸如肝脏。
[0131]
实施例
[0132]
在以下示例中更详细地公开了附加的实施方案,其不旨在以任何方式限制权利要求的范围。
[0133]
实施例1-20
[0134]
从商业来源制备或获得靶向细胞宿主因子以降低hbv分子水平的一系列sirna。表1描述了每种sirna和相应靶rna的序列。
[0135]
表1
[0136][0137]
1靶mrna的起始密码子(aug)中的第一个腺苷酸命名为nt.1。
[0138]
2使用最近邻参数测定1nm双链rna在155mm盐(na )中的tm。
[0139]
3在热力学恒定条件下计算1nm退火dsrna的δg:1m nacl,25℃,ph 7.0。
[0140]
实施例21-52
[0141]
制备靶向细胞因子以降低病毒分子水平的一系列sirna。表2描述了每种sirna和相应靶rna的序列。
[0142]
表2
[0143]
[0144][0145]
1靶mrna的起始密码子(aug)中的第一个腺苷酸命名为nt.1。
[0146]
2使用最近邻参数测定1nm双链rna在155mm盐(na )中的tm。
[0147]
3在热力学恒定条件下计算1nm退火dsrna的δg:1m nacl,25℃,ph 7.0。
[0148]
实施例a1
[0149]
细胞蛋白grp78/bip、srsf1、hnrnpa2b1、rplp1和rplp2被确定为在hbv复制和感染中发挥作用。使靶向编码这些蛋白的rna的各种sirna及其组合以7.5nm的终浓度与hepg2.2.15细胞接触。sirna的引入对细胞活力的影响极小(参见图1b)。如图1b和图1c所示,这些sirna降低了hbv分子的水平,如通过hbsag测定所确定的,与模拟物相比,s-抗原(hbsag)降低了超过50%。敲低rplp1比敲低rplp2更多地降低hbsag水平。此外,当与用单独靶向rplp1或rplp2的sirna处理的细胞相比时,敲低hepg2.2.15细胞中的rplp1和rplp2两者的sirna导致hbsag水平的额外降低,这表明细胞因子可协同作用以实现最佳hbsag积累。同样地,靶向grp78和rplp2两者的sirna比敲低任一单独因子更多地降低hbsag水平。
[0150]
实施例a2
[0151]
就降低hepg2.2.15细胞中hbsag水平的能力而言,确定了靶向hnrnpa2b1、grp78、
rplp1、rplp2和/或srsf1的几种sirna和sirna组合的ec
50
值。参见图2a-e。发现靶向grp78的sirna降低了hbsag水平,ec
50
值为1nm,而对hepg2.2.15细胞的活力没有影响(图2a、图2b和图2e)。靶向rplp1的sirna对hbsag水平的影响同样非常有效,产生约0.9nm的ec
50
值,其中cc
50
超过100nm(图2c、图2d和图2e)。靶向rplp1和rplp2的sirna具有约0.3nm的ec
50
值和超过100nm的cc
50
值。靶向srsf1和rplp2的sirna还具有约1.5nm或更小的ec
50
值和超过100nm的cc
50
值(图2d和图2e)。
[0152]
实施例a3
[0153]
通过定量hepg2.2.15细胞在与10nm靶向hnrnpa2b1、grp78、rplp1、rplp2和srsf1的sirna接触后产生的hbsag、hbeag和核心蛋白的量评估了靶向宿主因子的sirna然后导致多种hbv分子产量减少的能力。我们还将细胞与5nm靶向rplp1和rplp2两者的每组sirna接触。hbsag、hbeag和核心的水平均使用elisa测定。sirna的引入对细胞活力或细胞毒性的影响极小(图3a)。当与模拟处理的细胞相比时,sirna导致hbsag水平降低,敲低grp78和rplp1导致最大的降低,而敲低hnrnpa2b1具有中等效果(图3b)。敲低grp78和rplp1再次导致hbeag水平的最大降低(图3c),与敲低hnrnpa2b1相关的hbeag的降低更适度(图3c)。对于核心抗原,敲低srsf1导致最显著的降低。敲低rplp1和rplp2两者的sirna产生了hbsag和hbeag的最大降低,但不显著影响核心蛋白的水平(图3c至图3d)。最后,敲低rplp1和rplp2导致分泌的hbv dna的量减少(图3e)。
[0154]
总之,这些结果表明,细胞因子可有助于hbv感染的肝细胞模型中多种hbv分子的水平,并且特定宿主因子可有助于hbv分子的积累。重要的是,靶向编码宿主因子的rna的sirna和寡核苷酸可降低成功感染所需的hbv分子的水平。
[0155]
实施例a4
[0156]
我们确定的影响hbv复制的宿主因子也在冠状病毒感染中发挥作用。人冠状病毒oc43是与高致病性sars-cov和sars-cov2相同的β-冠状病毒属的成员(20)。我们建立了oc43感染人结肠上皮细胞系hct8的程序,因为冠状病毒可感染人肠道并引起腹泻。hct8细胞表达grp78、rplp1/2、srsf1和hnrnpa2b1,靶向这些宿主因子的sirna的转染导致这些宿主因子的特异性敲低。为了检查sirna对oc43感染的影响,首先用病毒感染hct8细胞,然后用sirna转染,并使用具有oc43 n基因特异性引物的逆转录-定量聚合酶链反应(rt-qpcr)定量感染产生的病毒量(图4a)。该实验的阳性对照是评估瑞德西韦(一种可抑制冠状病毒复制的核苷酸前药)的作用(21)。最后,还使用celltiter-glo试剂评估了细胞活力。在这些实验中,0.5μm的瑞德西韦能够将oc43病毒粒子的产量减少至小于5%。此外,靶向rplp1和grp78的sirna减少了oc43 rna,而对hct8细胞的活力没有明显的不利影响(图4b和图4c)。在其他实验中,敲低rplp2和srsf1也相对于模拟处理的细胞减少了oc43 rna。这些结果表明,rplp1/2、grp78和srsf1对冠状病毒感染具有作用,并且靶向hbv感染所需的宿主因子的sirna也可以抑制冠状病毒感染。
[0157]
实施例a5
[0158]
设计并合成了靶向grp78、srsf1、rplp1和rplp2的sirna文库。该文库偏向于支持rplp1和rplp2,因为这些蛋白在体细胞中是非必需的,并且它们在grp78的上游起作用。也就是说,由于rplp1和rplp2蛋白缺乏而失败的病毒蛋白合成不能被伴侣蛋白grp78挽救。
[0159]
实施例a6
[0160]
测试了实施例a5的sirna文库对hepg2.2.15细胞和hbv病毒粒子中分泌的hbsag的减少。如表3中总结的,发现sirna中的1个靶向grp78、2个靶向srsf2、10个靶向rplp1和19个靶向rplp2和所有都可以降低hbsag水平,ec
50
值小于10nm。事实上,大多数sirna的ec
50
值小于1nm。此外,在最高测试浓度80nm处,没有sirna具有明显的细胞毒性(表3)。最后,有效的sirna降低了另一种关键hbv分子hbeag的水平。hbsag和hbeag减少的剂量反应和两种sirna(seq id no 24和34)的细胞毒性曲线的示例示出在图5a中。
[0161]
表3
[0162]
[0163][0164]
*10nm sirna转染到细胞中
[0165]
nd:未确定
[0166]
实施例a7
[0167]
如实施例a6中所述鉴定的sirna应当通过包括装载在risc复合物中以裂解同源mrna从而导致mrna降解的机制起作用。为了检查sirna是否有效减少靶mrna,我们使用逆转录偶联定量聚合酶链反应(rt-qpcr)来评估hepg2.2.15细胞中靶mrna的水平。表2中描述的所有32种sirna使mrna减少超过75%(表3)。图5b示出了由sirna引起的靶mrna减少百分比的取样。
[0168]
实施例a7
[0169]
宿主因子可能在病毒感染中作为蛋白起作用。因此,我们确定了sirna是否可以减少靶蛋白的量。将用10nm的每种sirna转染72小时的细胞裂解,并使用用靶特异性抗体探测的蛋白印迹鉴定靶蛋白。表3中描述的有效sirna将模拟处理样品的蛋白水平降低了28%至92%。蛋白的减少小于靶mrna的减少,这可能是由于蛋白具有延长的半衰期并且它们的降解需要更多的时间。使用蛋白印迹分析检测到的rplp1和rplp2减少的示例如图5d所示。值得注意的是,敲低rplp1不仅降低了rplp1的水平,而且导致了rplp2的降低,反之亦然。我们推断这是由于rplp1和rplp2作为异二聚体起作用,使得一种蛋白的减少增加了另一种蛋白对降解的脆弱性。campos等人报道了类似的蛋白伴随减少(17)。最后,未被sirna靶向的两种细胞蛋白p54nrb和gapdh的水平不受影响。结果表明sirna对它们的靶标具有特异性。
[0170]
实施例a8
[0171]
将表2中所列的sirna转染到人结肠上皮hct8细胞中,并对产生的oc43病毒粒子的量进行定量。在这些测定中,使用分支dna测定(quantigene基因表达测定:thermofisher)对oc43 vrna进行定量。作为阳性抑制对照,感染的细胞用瑞德西韦处理。用0.9μm的瑞德西韦处理导致oc43 vrna减少超过98%。此外,以10nm终浓度转染到hct8细胞中的sirna导致oc43 vrna减少36至94%(表3)。抑制oc43 vrna的示例示出于图5a中。这些结果证实了靶向宿主因子的sirna可以抑制人冠状病毒感染。
[0172]
实施例a9
[0173]
hbv复制的宿主因子协同作用和敲低多种宿主因子导致hbv复制和hbsag产生的更显著减少(图1b)。靶向宿主因子的sirna的组合应该更有力地减少oc43病毒粒子的产生。为了说明这一点,用10nm来自表2的sirna连同10nm靶向grp78的sirna转染hct8细胞。使用分支dna测定法对产生的病毒粒子rna进行定量。结果显示靶向grp78的sirna连同靶向srsf1、rplp1或rplp2的sirna导致oc43病毒粒子rna的显著减少(表3)。该活力的示例在图6b中示出。靶向宿主因子grp78、srsf1、rplp1和rplp2的sirna的组合可以导致受感染细胞产生的
b virus rna differentially regulates the viral life cycle.,proc.natl.acad.sci.usa 115:8829-34.
[0189]
14.wang,l.,wen,m.,and cao x.2019.nuclear hnrnpa2b1 initiates and amplifies the innate immune response to dna viruses.science:eaav0758.
[0190]
15.ballesta,j.p.,remacha,m.1996.the large ribosomal stalk as a regulatory element of the eukaryotic translational machinery.prog.nucleic acid res.mol biol.55:157-193.
[0191]
16.choi.a.k.h.et al.2015.structures of eukaryotic ribosomal stalk proteins and their complex with trichosanthin and their implications in recruiting ribosome-inactivating proteins to the ribosomes.toxins 7:638.
[0192]
17.campos,r.k.et al.2017.rplp1 and rplp2 are essential flavivirus host factors that promote early viral accumulation.j.virol.91:e01706-16.
[0193]
18.campos r.k.et al.,2019.ribosomal stalk proteins rplp1 and rplp2 promote biogenesis of flaviviral and cellular multi-pass transmembrane proteins.biorxiv.doi 10.110/713016.
[0194]
19.kibbe wa.2007 oligocalc:an online oligonucleotide properties calculator.nucl.acids res.35(webserver issue):may 25.
[0195]
20.coronaviridae study group of the international committee on taxonomy of viruses.2020.the species of severe acute respiratory syndrome-related coronavirus:classifying the 2019-ncov and naming it sars-cov2.nature microbiology 5,536-544.
[0196]
21.wang m.cao r.,zhang l.,yang x.,liu j.et al.2020.remdesivir and chloroquine effectively inhibits the recently emerged novel coronavirus(2019-ncov)in vitro.cell research 30,269-271.
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。