1.本发明涉及可用于治疗的包含水平升高的目标蛋白或多肽的红系细胞,具体涉及在网状细胞前体细胞中表达蛋白或多肽并通过分化保留高浓度的所述蛋白或多肽。本发明涉及制备方法、细胞产品、药物组合物和治疗用途。
背景技术:
2.许多疾病是由蛋白质或多肽缺陷或缺乏引起的,如酶缺陷或缺乏。治疗这些疾病的一种方法是使用蛋白质或多肽替代治疗。例如,酶替代治疗涉及向患者施用非缺陷的酶,以补偿酶的功能损失或表达损失。这种施用不仅可以用于恢复有缺陷或缺乏的蛋白质和多肽的功能,例如,还可以为受试者提供全新的功能。示例包括使用治疗与缺陷蛋白或多肽无关的疾病的外源性蛋白或多肽,例如使用中和内源性或外源性毒素的外源性酶(例如,用于消除某种代谢物的累积或中和神经毒剂或吸毒过量(drug overdose))。
3.施用蛋白质或多肽的一个主要挑战是如何递送蛋白质或多肽并在不引起破坏性免疫应答的前提下,确保良好的生物利用度。一种已知的施用方法是利用被红细胞封装的蛋白质或多肽,例如,其可通过低渗裂解将蛋白质或多肽插入红细胞来制备。使用红细胞载体可以使蛋白质或多肽周身分布,同时对酶提供一定水平的保护,以避开受试者免疫系统和身体自然降解途径。酶胸苷磷酸化酶(thymidine phosphorylase,tp)可作为进一步解释的示例。线粒体神经胃肠道脑肌病(mitochondrial neurogastrointestinal encephalomyo pathy,mngie)是一种常染色体隐性代谢疾病,由编码tp的tymp基因突变引起。红细胞通常不表达tp,但低渗溶血和等渗重封可用于将大肠杆菌(escherichia coli)tp封装在自体红血细胞中(ihler,g.m.et al.,proc natl acad sci u s a,1973,70(9),p.2663-2666;bourgeaux,v.,et al.,drug des devel ther,2016,10,p.665-676)。这已成功用于临床,提供了通过降低血浆核苷水平实现延长mngie临床表型停止(cessation)的概念验证(bax,b.e.,et al.,neurology,2013,81(14),p.1269-71)。虽然这种方法在一定程度上是有效的,但使用低渗裂解法在红血细胞内封装的方法通常会损害细胞膜的完整性和该红血细胞的寿命,这意味着需要频繁输血,而且患者还可能产生针对细菌酶的抗体(levene,m.,et al.,mol ther methods clin dev,2018,11,p.1-8)。
4.另一种方法是利用基因工程在细胞内表达所需的酶。成熟的红血细胞缺少细胞核,因此无法表达一种或多种酶,这意味着任何基因工程和蛋白质的表达都必须在该细胞的生命早期进行,因为此刻它仍然有细胞核。这种方法的优点包括保留细胞膜的完整性并使该红血细胞有全部寿命。
5.本发明涉及一种改进的方法,用于在整个红血细胞发育和成熟为网状细胞和/或红细胞的过程中保留目标蛋白或多肽,以在网状细胞或红细胞中提供高浓度的该目标蛋白或多肽。因此,本发明的方法可用于在网状细胞和/或红细胞中保留目标蛋白或多肽,而在此之前目标蛋白或多肽不会在细胞成熟过程中保留。同样,如果目标蛋白或多肽可以在成熟过程中保留在网状细胞和/或红细胞中,本发明的方法可以用来增加保留并提高后续目
标蛋白或多肽在去核红系细胞(网状细胞和/或红细胞)中的丰度,例如使得治疗剂的用量减少。
6.发明简述
7.根据第一方面,本发明提供了一种制备包含水平升高的目标蛋白或多肽的网状细胞的方法,所述方法包括:a)提供能够表达目标蛋白或多肽的红系祖细胞;b)表达目标蛋白或多肽;和c)红系祖细胞成熟为网状细胞;其中在红系祖细胞成熟为网状细胞期间,目标蛋白或多肽被改装和/或抑制,从而目标蛋白或多肽的泛素化受到阻碍或被阻止。因此,目标蛋白或多肽的泛素介导的降解被阻碍或阻止。
8.本发明人已经观察到,在红系细胞(erythroid cell)成熟和去核过程中,大量的特定蛋白质通过高度活跃的泛素化和泛素介导的降解途径被清除。本发明人还确定了可以利用对这种泛素化过程的破坏,使目标蛋白或多肽在去核过程中保留更高的浓度,并进入成熟的网状细胞(reticulocyte)和随后的红细胞(erythrocyte)中。具体而言,本发明人试图通过干扰目标蛋白或多肽(而不是干扰泛素连接酶)、通过改装(configuring)和/或抑制目标蛋白或多肽来阻碍(hinder)或阻止(prevent)泛素化。通过将所述干扰定位到目标蛋白或多肽,本发明人还可以克服与抑制泛素酶有关的问题。泛素化是红系细胞成熟过程的重要组成部分(nguyen,a.t.,et al.,science,2017,357(6350)),因此使用抑制剂如mg132对泛素化进行全面抑制,并不是提高网状细胞中tp水平所需的方案。在存在通用泛素连接酶抑制剂的情况下,许多非红系蛋白将被保留在发育中的网状细胞或红细胞中。因此,细胞功能的许多方面将被破坏,这可能对细胞的重要方面产生不利影响,如生命和免疫系统兼容性。在某些情况下,广泛的泛素化抑制可能完全阻止分化和/或导致细胞死亡。相反,在本发明中,任何改装或抑制都发生在目标蛋白或多肽上,而不是泛素连接酶上,因此对于非目标蛋白或多肽,泛素连接酶功能不会受到实质性损害。
9.我们所说的“目标蛋白或多肽”,一般是指通过本发明的方法在去核红系细胞(网状细胞和/或红细胞)中保留了水平升高的目标蛋白或目标多肽。对于所述目标蛋白或多肽,我们设想了三种场景:(1)所述目标蛋白或多肽包括泛素化位点;(2)所述目标蛋白或多肽是源蛋白或多肽的变体,其中所述源蛋白或多肽包括泛素化位点,且其中所述目标蛋白或多肽包括一个或多个有关源蛋白的突变,使泛素化受到阻碍或被阻止;和/或(3)所述目标蛋白或多肽没有泛素化位点。在场景(1)中,通过提供目标蛋白或多肽泛素化位点的抑制剂,泛素化可以而受到阻碍或被阻止;在场景(2)中,红系祖细胞中表达的蛋白质或多肽具有有干扰泛素化的突变;意识到泛素化的重要性后,还提供了场景(3),即选择没有泛素化位点的外源性蛋白或多肽进行表达。
10.我们所说的目标蛋白或多肽的“水平升高”,一般是指目标蛋白或多肽在网状细胞(或随后的红细胞)中的水平(或浓度),相对于泛素化没有受到阻碍或被阻止的网状细胞(或随后的红细胞)而言是升高的。在内源性蛋白或多肽(天然表达或过表达)或外源性蛋白或多肽具有泛素化位点的情况下,当泛素化位点在细胞成熟期间被抑制时,相对于该泛素化位点在细胞成熟期间未被抑制,网状细胞(或随后的红细胞)中的水平更高。在外源性蛋白或多肽包含关于源蛋白或多肽的突变,从而使源蛋白或多肽的泛素化受到阻碍或被阻止的情况下,关于所述源蛋白或多肽的保留水平的“水平”是升高的。在外源性蛋白没有泛素化位点的情况下,网状细胞(以及随后的红细胞)中的水平大于零。
11.我们所说的“阻碍”,一般是指与没有改装和/或抑制目标蛋白或多肽而使泛素化受阻的情况下红系祖细胞的成熟相比,在红系祖细胞成熟中泛素化和随后的蛋白或多肽的损失水平较低。换句话说,与预期的泛素化水平相比,每个蛋白或多肽分子泛素化的可能性降低。这可以通过干扰泛素化的任何方法来实现,例如通过提供抑制剂和/或通过提供经过遗传修饰以阻碍泛素化的红系祖细胞实现。我们所说的“阻止”,一般是指泛素化不可能发生。例如,这可能是通过泛素化位点的缺失或通过提供没有泛素化位点的蛋白质或多肽实现。比如说,所述目标蛋白或多肽的泛素化可以通过以下方式受到阻碍或被阻止:i)如果所述目标蛋白或多肽包括泛素化位点时,则在所述红系祖细胞成熟为网状细胞期间提供所述目标蛋白或多肽泛素化位点的抑制剂;ii)如果所述目标蛋白或多肽为具有泛素化位点的源蛋白或多肽的变体,则提供能够表达包含突变的目标蛋白或多肽的红系祖细胞,所述突变使关于源蛋白或多肽的泛素化受到阻碍或被阻止;和/或iii)提供能够表达没有泛素化位点的外源性蛋白或多肽的红系祖细胞。
12.优选地,所述红系祖细胞能够表达所述目标蛋白或多肽。这里,我们指的是所述红系祖细胞含有表达所述目标蛋白或多肽的遗传物质。因此,所述目标蛋白或多肽不需要去核后插入细胞,病可以避免诸如低渗裂解等技术。
13.所述红系细胞(如红系祖细胞、网状细胞和/或红细胞)可包括一种以上类型的目标蛋白或目标多肽。在这样的实施方案中,可以使用多种蛋白质组分,例如,提供酶链,以催化一系列的反应。
14.当蛋白质或多肽具有一个以上的泛素化位点时,至少有一个位点的泛素化受到阻碍或被阻止。在一优选的实施方案中,所有泛素化位点的泛素化都受到阻碍或被阻止。
15.如果使用抑制剂,则在红系祖细胞成熟为网状细胞和/或红细胞期间提供抑制剂。这里,我们指的是所述抑制剂至少在分化和成熟过程的部分时期、通常至少在成熟过程的后期提供。例如,可只在分化末期阶段加入抑制剂。优选地,在去核时存在所述抑制剂,优选是在去核的整个过程中存在。因此,所述抑制剂可以在去核前立即加入,如加入启动去核的培养基中,或在去核前的分化系谱阶段加入。在一个示例中,所述抑制剂在多色红细胞(polychromatic erythroblast)阶段加入。换句话说,抑制剂不一定要存在于整个红系细胞成熟过程中。例如,当提早添加抑制剂对细胞增殖或存活具有有害作用,所述抑制剂可以仅在成熟过程的后期加入,这是特别有益的。
16.所述目标蛋白或多肽可以为具有泛素化位点的源蛋白或多肽的变体,其中所述变体关于源蛋白或多肽有一个或多个突变,使源蛋白或多肽泛素化受到阻碍或被阻止。所述突变可以是单个氨基酸或多个氨基酸的突变。所述突变可包含点突变、插入或缺失。所述突变可为连续或不连续的氨基酸或一段氨基酸突变。在一个实施方案中,所述突变可以空间上阻断泛素连接酶将泛素递送至泛素化位点。可选地,所述突变可以破坏泛素化位点的构象,例如通过阻止泛素连接酶识别泛素化位点,从而使泛素酶不再能将泛素结合到泛素化位点。这种突变可以在泛素化位点内,特别是泛素化的氨基酸,或可能在仍能破坏泛素化位点的蛋白质或多肽内的另一个位置。这也可能涉及部分泛素化位点的缺失,特别是泛素化的氨基酸,或整个泛素化位点共有序列的缺失。无论如何,氨基酸序列的修改必须使其不破坏所述蛋白质或多肽的必要活性。
17.在某些蛋白质或多肽中,在所述蛋白质或多肽能够被泛素化之前,需要一个或多
个翻译后修饰。例如,在泛素化发生之前,可能需要乙酰化、甲基化、磷酸化、糖基化和/或脂化。在这些情况下,使泛素化受到阻碍或被阻止的突变可以是阻碍或阻止翻译后修饰的突变。例如,酶谷氨酰胺合成酶在泛素化之前需要乙酰化。因此,破坏乙酰化和/或泛素化位点可以用来破坏泛素化。一种去除谷氨酰胺合成酶乙酰化位点的技术为去除n末端,例如从n端至少去除5、10、15或20个氨基酸,且从n末端去除不多于30、40、50或60个氨基酸。如果在红系细胞成熟期存活的蛋白质或多肽的数量足以补偿,那么蛋白质或多肽活性的降低是可以接受的。
18.通常情况下,设想红系细胞将进入网状细胞阶段,并在网状细胞阶段储存。网状细胞为不完全成熟的红细胞,但是是去核的。设想所述网状细胞也将用于对受试者施用,并允许其在受试者体内成熟为红细胞,因为这能确保红细胞的完整生命可利用。一旦注射到体内,网状细胞大约需要1-2天成熟为红细胞,从这一点来看,红细胞仍有其完整的生命。然而,也有可能在施用于受试者之前,所述细胞就已经完全成熟为红细胞。
19.因此,在一实施方案中,本发明第一方面的方法包括所述网状细胞成熟为红细胞的进一步步骤。所述网状细胞成熟为红细胞涉及到在细胞从网状细胞变成双凹红细胞的过程中去除蛋白质(和其他物质)的进一步阶段。通过这进一步的成熟步骤,预期通过继续(或开始)对所述目标蛋白或多肽的泛素化的阻碍或阻止来改善蛋白或多肽的保留。
20.本发明的第二方面提供了一种制备包含目标蛋白或多肽的红细胞的方法,所述方法包括本发明第一方面的步骤(a)-(c),并包括以下进一步步骤:d)红系细胞发育,特别地是网状细胞成熟为红细胞;其中在成熟为红细胞期间,所述目标蛋白或多肽被改装和/或抑制以阻碍或阻止泛素化,优选地被本发明第一方面的(i)-(iii)中的任一个阻碍或阻止。
21.在一优选的实施方案中,制备网状细胞和/或红细胞的所述方法为体外方法。
22.所述目标蛋白可包括内源性蛋白和/或所述目标多肽可以包括内源性多肽。这里,我们通常是指未被人为过表达的内源性蛋白或多肽。换句话说,这是指在所述红系祖细胞成熟前处于内源性浓度的内源性蛋白或多肽。本发明允许通过阻碍或阻止所述蛋白质或多肽的泛素化来提高这种内源性蛋白和多肽在网状细胞或红细胞中的水平,通常其中所述蛋白质或多肽具有泛素化位点并且所述泛素化的阻碍或阻止是用抑制剂实现的。
23.所述目标蛋白可包括过表达的内源性蛋白或外源性蛋白和/或所述目标多肽可包括过表达的内源性多肽或外源性多肽。
24.我们所说的“过表达”一般是指在细胞成熟和/或去核之前,人为地将所述红系祖细胞中的内源性蛋白或多肽提高到更高的浓度。过表达技术在本领域是众所周知的,包括插入更多的基因拷贝和/或提供或表达适当的转录调节因子。例如,一种合适的技术为使用转录因子或其他增强子来增加蛋白质的表达(其中所述蛋白质可以由细胞自身的dna编码或由加入的dna编码),例如通过使用crispr增强子和特异性引导来增加表达水平。合适的基因操作技术在本领域是众所周知的,包括使用诸如crispr-cas9碱基编辑以及慢病毒载体基因插入等技术。
25.基因插入一般会在去核前的一个分化阶段进行。例如,图7显示了细胞分化谱系的示意图,分别从造血干细胞和bel-a原红细胞开始,举例说明可以在体外添加病毒载体(如用于慢病毒载体基因插入)的阶段。特别是在cd34 细胞的情况下,有可能在后面的步骤,即不晚于分化之前加入病毒。提早添加病毒的好处是,你需要更少的病毒和试剂。
26.我们所说的“外源性”一般是指在所述红系祖细胞中不天然表达的蛋白质或多肽。这包括相对于内源性蛋白质包含一个或多个氨基酸突变的蛋白质或多肽。这包括,例如,所述红系祖细胞表达有缺陷的蛋白质或多肽,而所述外源性酶是功能性蛋白或多肽的治疗。外源性还包括来自其他细胞或物种的异构体,或非天然发生的蛋白或多肽,如杂交蛋白、嵌合蛋白、融合蛋白或新的蛋白质或多肽序列。如上所述,可用于表达外源性蛋白或多肽的基因操作技术为本领域众所周知的。
27.所述红系祖细胞可以为自体的。例如,所述红系祖细胞可以从受试者身上去除,经过基因操作以表达所述目标蛋白或多肽,并最终回到受试者。优选地,所述红系祖细胞为异体的,但可被应用于具有匹配血型的合适受试者。
28.所述抑制剂可以为所述目标蛋白或多肽的天然底物或天然产物。这适用于所述泛素化位点位于所述蛋白质或多肽的活性位点内的情况。这是一种通过占据所述活性位点从而阻止降解来阻止所述蛋白质或多肽降解的机制。这有时被称为“底物遮蔽(substrate masking)”,因为底物掩盖了所述泛素化位点,并且可以用于通过提供高水平的合适的天然底物或产物,来阻止细胞成熟过程中的降解。通常情况下,这种情况下的所述蛋白质或多肽为酶。
29.同样地,所述抑制剂可以为所述目标蛋白或多肽的天然底物或天然产物的可逆抑制剂。这种可逆的抑制剂包括所述天然底物或产物的衍生物和类似物(即化学模拟物),通常不会被所述蛋白质或多肽反转。
30.所述红系祖细胞没有特别限制,可以是任何能够成熟为网状细胞并随后成为红细胞的细胞术语“红系祖细胞”可以用来指处于成熟/分化途径的不同阶段的细胞。术语“红系祖细胞”通常指有细胞核的细胞,即在去核开始之前。所述红系祖细胞可以是干细胞、造血干细胞、诱导多能细胞、红系永生化细胞系或成红细胞。优选地,所述红系祖细胞为cd34 细胞、cd34-细胞或bel-a细胞。
31.我们所说的“去核红细胞”,一般指源于红系祖细胞的已去核的细胞。这种细胞的典型示例包括网状细胞或红细胞。去核的红系细胞在所述红系细胞表面显示红系带3(阴离子交换蛋白1(ae1);溶质载体家族4成员1;slc4a1)蛋白。在根据本发明生产去核的红系细胞时,所述去核的红系细胞可能具有工程化其他的蛋白质(如血红蛋白或血型蛋白),但所述去核的红系细胞仍然可以通过红系带3/ae1的存在和通过不具有核而确定。例如,本发明的网状细胞或红细胞可以具有工程化的诸如血红蛋白或血型蛋白的蛋白,但仍然可以通过红系带3/ae1的存在和通过不具有核而确定。这样的细胞可以通过基于细胞骨架的红细胞谱系的存在来进一步确定。
32.优选地,所述目标蛋白或多肽为治疗蛋白或多肽。优选地,所述目标蛋白或多肽为酶。在一特定的实施方案中,所述目标蛋白为胸苷磷酸化酶(thymidine phosphorylase)、谷氨酰胺合成酶(glutamine synthase)、己糖激酶(hexokinase)、葡萄糖激酶(glucokinase)、苯丙氨酸羟化酶(phenylalanine hydroxylase)、醇脱氢酶(alcohol dehydrogenase)、过氧化氢酶(catalase)、葡萄糖-6-磷酸脱氢酶(glucose-6-phosphate dehydrogenase)、腺苷脱氨酶(adenosine deaminase)、天冬酰胺酶(asparaginase)、尿酸酶(uricase)、细菌l-苯丙氨酸氨解酶(bacterial l-phenylalanine ammonia lyase)、丙氨酸转氨酶(alanine aminotransferase)、谷氨酸脱氢酶(glutamate dehydrogenase)、精
氨酸脱亚胺酶(arginine deiminase)或精氨酸酶(arginase)。优选地,所述目标蛋白为胸苷磷酸化酶、谷氨酰胺合成酶、己糖激酶、葡萄糖激酶、苯丙氨酸羟化酶、醇脱氢酶、过氧化氢酶、葡萄糖-6-磷酸脱氢酶、腺苷脱氨酶、天冬酰胺酶、尿酸酶或细菌l-苯丙氨酸氨解酶。更优选地,所述目标蛋白是胸苷磷酸化酶。
33.使用胸苷磷酸化酶(tp)作为示例蛋白,最初的实验显示,用mg132抑制泛素化可保护tp在分化中免于降解(参见实施例3)。这表明,抑制泛素化可以成功地用于阻止tp降解。在这个具体的示例中,泛素化位点的突变对所需的酶活性产生不利影响。因此,在编辑泛素化位点时,应考虑对所需蛋白质活性的影响。例如,可以重新设计酶活性位点以保留活性,同时去除所述泛素化位点,或者使用另一种破坏tp泛素化的方法。比如,发明人确定tp泛素化位点为所述活性位点的一部分,因此底物胸苷实际上可以阻断泛素化位点。基于此,发明人展示了用添加到培养基中的胸苷阻断所述(未突变的)泛素化位点,导致网状细胞中活化tp的浓度大致加倍(见实施例5)。进一步的细节可以参见meinders et al.,molecular therapy-methods&clinical development,volume 17,page 822-830,june 12,2020(在本技术的优先权日之后公布),其全文通过引用并入本文。所述胸苷磷酸化酶泛素化位点可以被胸苷、脱氧尿苷、胸腺嘧啶、尿苷、2-脱氧核糖1-磷酸或其衍生物或类似物抑制。优选地,所述胸苷磷酸化酶泛素化位点被胸苷抑制。
34.这个概念验证也提供了通过其他方式破坏泛素化位点可以导致相同的结果的证据,例如通过适当工程化如上所述的蛋白质序列。例如,序列分析表明,谷氨酰胺合成酶的泛素化位点不在活性位点内。这意味着所述底物遮蔽技术不太可能适用于阻碍谷氨酰胺合成酶的泛素化。然而,泛素化位点与活性位点的这种分离定位意味着可以进行可能破坏泛素化而不影响活性的突变,这意味着这种修饰使所述酶能够在红系祖细胞的整个分化和去核中得以保留,并在去核的红系细胞中进一步提高水平。
35.通过这种方式,底物遮蔽技术和突变技术提供了可以根据泛素化位点在所述目标蛋白或多肽中的定位来选择的可选方案。
36.如果所述目标蛋白为没有泛素化位点的外源性蛋白或多肽,在一个实施方案中,其为非真核生物蛋白,优选细菌蛋白或多肽。来源为非真核生物如细菌的这种蛋白质和多肽,在其野生型的形式下,通常没有泛素化位点。当所述目标蛋白或多肽为细菌的蛋白或多肽时,包括野生型细菌氨基酸序列。正如本领域所知的,当在人类细胞中表达细菌蛋白时,在细菌表达系统中编码特定氨基酸的某些密码子应被转换为表达这些特定氨基酸的等效人类密码子。这很容易利用已知的分子生物学原理进行。对细菌氨基酸序列的改变也可能有助于实现某些效果,如在人类表达系统中优化表达。当所述细菌氨基酸序列被修饰时,所述序列仍应产生预期的功能,特别是没有重新引入泛素化位点的情况下。
37.本发明人已经确定,细菌尿酸酶(为在人类表达系统中表达而进行密码子优化)确实在去核过程中以高水平保留到去核的红系细胞中。本发明人已经确定天然缺乏泛素化位点的蛋白和多肽的池可以靶向以确定特别适合于本发明方法的蛋白质和多肽。特别地,本发明人已确定细菌蛋白质提供了蛋白质和多肽的可行的池,可用于本发明的方法中以提供用于治疗的具有高水平蛋白或多肽的去核的红系细胞。
38.在一个实施方案中,所述目标蛋白为胸苷磷酸化酶。当胸苷磷酸化酶被选为目标蛋白时,所述胸苷磷酸化酶的泛素化位点优选地被胸苷、脱氧尿苷、胸腺嘧啶、尿苷、2-脱氧
核糖1-磷酸或其衍生物或类似物抑制。优选地,所述胸苷磷酸化酶的泛素化位点被胸苷抑制。可选的方法可能涉及谨慎的蛋白质工程,以破坏泛素化位点而不阻止酶的活性,或利用细菌酶缺乏泛素化位点而催化相同的酶促反应而表达细菌的胸苷磷酸化酶,。当所述目标蛋白为胸苷磷酸化酶时,所述去核的红系细胞(网状细胞和/或红细胞)优选用于治疗线粒体神经胃肠道脑病。
39.在一个实施方案中,所述目标蛋白为谷氨酰胺合成酶。我们已经表明,人类谷氨酰胺合成酶可以用慢病毒过表达,应用泛素化抑制剂mg132增加网状细胞中谷氨酰胺合成酶的水平(实施例6,图8)。因此,本发明的策略是靶向谷氨酰胺合成酶而不是泛素化酶,期望在健康的去核细胞中产生改善的谷氨酰胺合成酶的表达和保留。如上所述,序列分析表明,谷氨酰胺合成酶的泛素化位点不在活性位点内。因此,包含使源蛋白或多肽的泛素化受到阻碍或被阻止的突变的谷氨酰胺合酶的表达应适合于通过成熟至所述去核的红系细胞来改善谷氨酰胺合酶的保留。谷氨酰胺合成酶在被泛素化之前可能需要乙酰化(van nguyenet al,molecular cell(2016)61(6):809-820)。因此,破坏乙酰化和/或泛素化位点可以作为破坏泛素化的进一步技术。一种去除谷氨酰胺合成酶乙酰化位点的技术是去除n末端,例如从n末端至少去除5、10、15或20个氨基酸,从n末端去除不多于30、40、50或60个氨基酸。可选地,可以过表达细菌谷氨酰胺合酶,其天然不含泛素化位点或可工程化为不含此类位点。当所述目标蛋白为谷氨酰胺合成酶时,所述去核的红系细胞(网状细胞和/或红细胞)优选用于治疗高氨血症。
40.在一个实施方案中,所述目标蛋白为己糖激酶,如葡萄糖激酶。葡萄糖激酶为一种肝脏和胰腺的酶,对葡萄糖的km值很高。葡萄糖激酶是一种己糖激酶的同工酶,并与其他三种己糖激酶同源。众所周知,葡萄糖激酶受泛素化调节(见hofmeister-brix等,biochem j(2013)456(2):173-184)。因此,葡萄糖激酶特别适合于通过突变使泛素化受到阻碍或被阻止,从而在去核过程中改善其保留。可选地,可以过表达细菌的己糖激酶或葡萄糖激酶,所述己糖激酶或葡萄糖激酶天然不含泛素化位点或可工程化为不含此类位点。当所述目标蛋白为己糖激酶和/或葡萄糖激酶时,所述去核的红系细胞(网状细胞和/或红细胞)优选用于治疗高血糖症。
41.在一个实施方案中,所述目标蛋白为苯丙氨酸羟化酶。众所周知,重组苯丙氨酸羟化酶是泛素化的(见例如doskeland和flatmark,biochem j.1996nov 1;319(pt 3):941-945)。具体地,重组蛋白在特定的赖氨酸上通过细胞裂解物泛素化。错误折叠的蛋白质增加了泛素化和降解。这证明苯丙氨酸羟化酶适合于通过突变使泛素化受到阻碍或被阻止,从而在去核过程中改善其保留。可选地,可以过表达细菌的苯丙氨酸羟化酶,所述苯丙氨酸羟化酶天然不含泛素化位点或可工程化为不含此类位点。当所述目标蛋白是苯丙氨酸羟化酶时,所述去核的红系细胞(网状细胞和/或红细胞)优选用于治疗苯丙氨酸羟化酶缺乏症。
42.在一个实施方案中,所述目标蛋白为醇脱氢酶。众所周知,醇脱氢酶是泛素化的(见例如mezey等人,biochem biophys res commun,第285卷,第3期,2001年7月20日,第644-648页)。因此,醇脱氢酶适用于通过突变使泛素化受到阻碍或被阻止,从而在去核过程中改善其保留。可选地,可以过表达另一种醇脱氢酶的异构体或细菌醇脱氢酶,其天然不含泛素化位点或可工程化为不含此类位点。当所述目标蛋白为醇脱氢酶时,所述去核的红系细胞(网状细胞和/或红细胞)优选用于治疗酒精中毒/解毒。
43.在一个实施方案中,所述目标蛋白为过氧化氢酶。众所周知,过氧化氢酶的降解受由酪氨酸磷酸化引起的泛素化的调控(参见例如cao et al,biochemistry,2003sep 9,42(35),10348-53)。因此,过氧化氢酶适用于通过突变使泛素化受到阻碍或被阻止,从而在去核过程中改善其保留。可选地,可以过表达细菌的过氧化氢酶,所述过氧化氢酶天然不含泛素化位点或可工程化为不含此类位点。当所述目标蛋白为过氧化氢酶时,所述去核的红系细胞(网状细胞和/或红细胞)优选用于治疗过氧化氢酶缺乏症和/或阻止活性氧自由基(reactive oxygen species)对细胞的损害。
44.在一个实施方案中,所述目标蛋白为葡萄糖-6-磷酸脱氢酶(g6pd)。有证据表明在人类足细胞(podocyte)中存在g6pd的泛素化和降解(见例如wang等人,the faseb journal,2019,33:5,6296-6310)。因此,g6pd可适合于通过突变使泛素化受到阻碍或被阻止,从而在去核过程中改善其保留。可选地,可以过表达细菌的g6pd,其天然不含泛素化位点或可工程化为不含此类位点。当所述目标蛋白为g6pd时,所述去核的红系细胞(网状细胞和/或红细胞)优选用于治疗g6pd缺乏症。
45.在一个实施方案中,所述目标蛋白为腺苷脱氨酶。如上所述,序列分析表明腺苷脱氨酶泛素化位点不在活性位点内。我们已经表明腺苷脱氨酶通过去核保留在网状细胞中(图9)。因此,表达包括使关于源蛋白或多肽的泛素化受到阻碍或被阻止的突变的腺苷脱氨酶,预期将通过去核改善腺苷脱氨酶的保留,并导致去核的红系细胞中腺苷脱氨酶的浓度增加。可选地,可以过表达细菌的腺苷脱氨酶,其天然不含泛素化位点或可以工程化为不含此类位点。当所述目标蛋白为腺苷脱氨酶时,所述去核的红系细胞(网状细胞和/或红细胞)优选用于治疗腺苷脱氨酶缺乏症。
46.在一个实施方案中,所述目标蛋白为天冬酰胺酶或l-天冬酰胺酶。序列分析表明,l-天冬酰胺酶泛素化位点是存在的,且不在活性位点内。我们已经表明,l-天冬酰胺酶通过去核保留在网状细胞中(图10)。因此,表达包括使关于源蛋白或多肽泛素化受到阻碍或被阻止的突变的l-天冬酰胺酶,预期将通过去核改善l-天冬酰胺酶的保留,并导致去核的红系细胞中l-天冬酰胺酶的浓度增加。可选地,可以过表达细菌的l-天冬酰胺酶,其天然不含泛素化位点或可工程化为不含此类位点。当所述目标蛋白为天冬酰胺酶或l-天冬酰胺酶时,所述去核的红系细胞(网状细胞和/或红细胞)优选用于治疗急性淋巴细胞白血病癌症。
47.在一个实施方案中,所述目标蛋白是尿酸酶,优选细菌尿酸酶。众所周知,人类的尿酸酶是无功能的。因此,优选地,所述尿酸酶为无可检测到的泛素化位点的细菌尿酸酶,或为加入突变以重新激活酶活性并去除泛素化的人类尿酸酶,或是已移除泛素化位点的来自另一物种的尿酸酶。我们已经确定,细菌尿酸酶(针对人类表达进行密码子优化的)在红系祖细胞中表达良好,并通过去核良好保留到网状细胞中(图11)。当所述目标蛋白是尿酸酶时,所述去核的红系细胞(网状细胞和/或红细胞)优选用于治疗高尿酸血症。
48.在一个实施方案中,所述目标蛋白为细菌l-苯丙氨酸氨解酶(pal)。细菌pal已知用于治疗(见sarkissian等人,pnas march 2,1999 96(5)2339-2344),且天然没有泛素化位点。当所述目标蛋白为细菌pal时,去核的红系细胞(网状细胞和/或红细胞)优选用于治疗苯丙酮尿症/苯丙氨酸羟化酶缺乏症。
49.在一个实施方案中,丙氨酸氨基转移酶和谷氨酸脱氢酶均在红系前体细胞中表达,并保留到去核红细胞中。在本实施方案中,所述目标蛋白可以为丙氨酸氨基转移酶或谷
氨酸脱氢酶。在本实施方案中,一种蛋白用于本发明所述的方法,另一种蛋白则在不影响泛素化的情况下通过去核携带。在一优选的实施方案中,所述目标蛋白为丙氨酸氨基转移酶,另一个目标蛋白为谷氨酸脱氢酶。这里,我们指的是这两种蛋白均在红系前体细胞中表达,并且这两种蛋白均以本发明的方法改善保留直至去核的红系细胞。关于丙氨酸氨基转移酶,发明人进行了泛素共同序列(consensus sequence)的位点扫描,并在两种人类异构体上确定了泛素位点。因此,表达包括使关于源蛋白或多肽的泛素化受到阻碍或被阻止的突变的丙氨酸氨基转移酶,预期将通过去核改善丙氨酸氨基转移酶的保留,并导致去核的红系细胞中丙氨酸氨基转移酶的浓度增加。可选地,可以过表达细菌的丙氨酸氨基转移酶,其天然不含泛素化位点或可以工程化为不含此类位点。关于谷氨酸脱氢酶,本发明人进行了泛素共同序列的位点扫描,并在两种异构体中的一种上确定了泛素位点。因此,表达包括使关于源蛋白或多肽的泛素化受到阻碍或被阻止的突变的泛素标记的谷氨酸脱氢酶,预期将通过去核改善谷氨酸脱氢酶的保留,并导致去核的红系细胞中谷氨酸脱氢酶的浓度增加。可选地,可以过表达缺乏泛素位点的异构体或细菌的谷氨酸脱氢酶,其天然不包含泛素位点或可工程化为不含此类位点。当所述目标蛋白为丙氨酸氨基转移酶和/或所述另一目标蛋白为谷氨酸脱氢酶时,去核的红系细胞(网状细胞和/或红细胞)优选用于治疗高氨血症。
50.在一个实施方案中,所述目标蛋白为精氨酸脱亚胺酶。发明人进行了泛素共同序列的位点扫描,并在六个异构体中的三个上确定了泛素位点。因此,表达包含使关于源蛋白或多肽泛素化受到阻碍或被阻止的突变的泛素标记的精氨酸脱氨酶,预期将通过去核改善精氨酸脱氨酶的保留,并导致去核的系红细胞中精氨酸脱氨酶的浓度增加。可选地,可以过表达缺乏泛素位点的异构体或细菌的精氨酸脱氨酶,其天然不含泛素位点或可工程化为不含此类位点。当所述目标蛋白为精氨酸脱亚氨酸酶时,去核的红系细胞(网状细胞和/或红细胞)优选用于治疗癌症。
51.在一个实施方案中,所述目标蛋白为精氨酸酶。发明人进行了泛素共同序列的位点扫描,并在一个异构体上确定了泛素位点。因此,表达包含使关于源蛋白或多肽的泛素化受到阻碍或被阻止的突变的泛素标记的精氨酸酶异构体,预期将通过去核改善精氨酸酶的保留,并导致去核的红系细胞中精氨酸酶的浓度增加。可选地,可以过表达缺乏泛素位点的异构体或细菌的精氨酸酶,它天然不含泛素位点或可被设计为不含此类位点。当所述目标蛋白为精氨酸酶时,去核的红系细胞(网状细胞和/或红细胞)优选用于治疗高精氨酸血症。
52.在一个实施方案中,所述网状细胞或红细胞为分离的网状细胞或分离的红细胞。我们所说的“分离的”一般指网状细胞或红细胞从受试者或患者的身体中分离出来。换言之,所述网状细胞或红细胞是在体外产生的。因此,所述分离的网状细胞或分离的红细胞可以为分离的网状细胞群或分离的红细胞群,并且可以存在于其他细胞或生物材料中,特别是促进细胞成熟和/或促进细胞储存所需的生物材料和化学因子。
53.根据第三方面,本发明提供了一种包含目标蛋白或多肽的红系细胞,其中:i)如果所述目标蛋白或多肽包括泛素化位点,则所述红系细胞进一步包括所述目标蛋白或多肽的泛素化位点的抑制剂;和/或ii)如果所述目标蛋白或多肽为具有泛素化位点的源蛋白或多肽的变体,则所述目标蛋白或多肽包括突变,所述突变使关于源蛋白或多肽的泛素化受到阻碍或被阻止;和/或iii)所述目标蛋白或多肽包括没有泛素化位点的外源性蛋白或多肽。
54.我们所说的“红系细胞(erythroid cell)”,一般指红系祖细胞、网状细胞前体、网
状细胞或红细胞,优选网状细胞或红细胞,更优选网状细胞。在一个实施方案中,所述红系细胞为红系祖细胞。在另一个实施方案中,所述红系细胞为去核的红系细胞(如网状细胞或红细胞)。
55.根据本发明的方法通过阻碍或阻止所述目标蛋白或多肽的泛素化产生的去核的红系细胞,与通过除所述目标蛋白或多肽的泛素化未受阻碍外其他方面都相同的方法产生的去核的红系细胞相比,该红系细胞将含有升高水平的目标蛋白或多肽。
56.当抑制剂为一种内源性物质时,指抑制剂的水平升高。
57.在一个实施方案中,所述目标蛋白可以包括内源性蛋白和/或所述目标多肽可以包括内源性多肽。在另一个实施方案中,所述目标蛋白可以包括过表达的内源性蛋白或外源性蛋白和/或所述目标多肽可以包括过表达的内源性多肽或外源性多肽。
58.所述抑制剂可以为所述目标蛋白或多肽的天然底物或天然产物,或者可以为所述目标蛋白或多肽的天然底物或天然产物的可逆抑制剂。
59.在一个实施方案中,所述目标蛋白为酶。在一个具体的实施方案中,所述目标蛋白为胸苷磷酸化酶、谷氨酰胺合成酶、己糖激酶/葡萄糖激酶、苯丙氨酸羟化酶、醇脱氢酶、过氧化氢酶、葡萄糖-6-磷酸脱氢酶、腺苷脱氨酶、l-天冬氨酸酶、尿酸酶、细菌l-苯丙氨酸氨解酶、丙氨酸转氨酶、谷氨酸脱氢酶、精氨酸脱亚胺酶或精氨酸酶。优选地,所述目标蛋白为胸苷磷酸化酶、谷氨酰胺合成酶、己糖激酶/葡萄糖激酶、苯丙氨酸羟化酶、醇脱氢酶、过氧化氢酶、葡萄糖-6-磷酸脱氢酶、腺苷脱氨酶、l-天冬氨酸酶、尿酸酶或细菌l-苯丙氨酸氨解酶。更优选地,所述目标蛋白为胸苷磷酸化酶。
60.当所述目标蛋白为胸苷磷酸化酶时,所述胸苷磷酸化酶的泛素化位点可被胸苷、脱氧尿苷、胸腺嘧啶、尿苷和/或2-脱氧核糖1-磷酸或这些的衍生物或类似物抑制,优选为胸苷。
61.所述红系细胞可以为分离的红系细胞。
62.在一个实施方案中,没有泛素化位点的所述目标蛋白或多肽可以为非真核生物蛋白,优选为细菌蛋白。
63.根据第四方面,本发明提供了一种通过本发明第一方面或第二方面的方法获得的红系细胞。
64.根据第五方面,本发明提供一种药物组合物,所述药物组合物包括根据本发明第三或第四方面所述的红系细胞和药学上可接受的载体、赋形剂和/或佐剂。优选地,所述药物组合物包括储存在红系细胞储存缓冲液中的红系细胞,所述红系细胞缓冲液包括所述目标蛋白或多肽泛素化位点的抑制剂。这适用于所述目标蛋白或多肽包括泛素化位点和所述红系细胞进一步包括所述目标蛋白或多肽泛素化位点的抑制剂的情况。储存可以是短期储存、长期储存、低温储存、临床储存、运输期间储存或直至对受试者施用的任何其他储存。
65.根据第六个方面,本发明提供了一种包括红系细胞新的药物组合物,所述药物组合物包括红系细胞和药学上可接受的载体、赋形剂和/或佐剂,所述红系细胞包括具有泛素化位点的目标蛋白或多肽和所述目标蛋白或多肽泛素化位点的抑制剂。通常地,所述抑制剂为外源性抑制剂,即添加到红系细胞中的抑制剂。当所述抑制剂天然存在于红系细胞中时,我们一般指人工提升水平的抑制剂。在一个优选的实施方案中,根据本发明第六方面的药物组合物包括储存在红系细胞储存缓冲液中的红系细胞,所述红系细胞储存缓冲液包括
所述目标蛋白或多肽泛素化位点的抑制剂。红系细胞储存缓冲液中的红系细胞通常将用于短期储存、长期储存、低温储存、临床储存、运输期间储存或直至对受试者施用的任何其他储存。
66.根据第七个方面,本发明提供了一种药物组合物,所述药物组合物包括含有目标蛋白或多肽的红系细胞以及药学上可接受的载体、赋形剂和/或佐剂,其中所述目标蛋白或多肽为具有泛素化位点的源蛋白的变体,且其中所述目标蛋白或多肽包括使关于源蛋白或多肽的泛素化受到阻碍或被阻止的突变。
67.本发明的组合物可包括如本领域所理解的赋形剂或药学上可接受的佐剂、载体或填料,以及试剂,如稳定剂、抗菌剂、冷冻保护剂、抗氧化剂、自由基清除剂、增溶剂、滋补剂(tonicifying agent)和表面活性剂。在一个优选的实施方案中,所述药物组合物与处于网状细胞阶段的细胞一起储存在合适的网状细胞储存培养基中。合适的培养基是本领域已知的,包括sagm、paggm、as1、as3、人类血浆或人工血浆溶液,以及生理上可施用的缓冲剂,如磷酸盐缓冲盐水,或任何这些培养基的混合物。
68.根据第八方面,本发明提供了一种根据本发明的第三方面或第四方面的红系细胞,或用于治疗的用途的根据本发明的第五方面、第六方面或第七方面的药物组合物。优选地,用于治疗的任何红系细胞为去核细胞。在治疗中使用去核细胞优点之一为,在去核过程中已排出任何遗传修饰的材料,因此不存在将遗传修饰材料施用于受试者的问题。
69.在一个实施方案中,所述用途是用于酶替代治疗(enzyme replacement therapy)、器官修复(organ reconditioning)或解毒(detoxification),优选治疗线粒体神经胃肠道脑肌病(mitochondrial neurogastrointestinal encephalomyopathy)、高氨血症(hyperammonemia)、高血糖症(hyperglycaemia)、苯丙氨酸羟化酶缺乏症(phenylalanine hydroxylase enzyme deficiency)、酒精中毒/解毒(alcohol toxicity/detoxification)、过氧化氢酶缺乏症(catalase deficiency)和/或预防由活性氧自由基引起的细胞损伤(cell damage by reactive oxygen species)、g6pd缺乏症(g6pd deficiency)、腺苷脱氨酶缺乏症(adenosine deaminase deficiency)、急性淋巴细胞白血病癌症(acute lymphoblastic leukemia cancer)、高尿酸血症(hyperuricemia)、苯丙酮尿症(phenylketonuria)/苯丙氨酸羟化酶缺乏症(phenylalanine hydroxylase enzyme deficiency)或高精氨酸血症(hyperargininaemia)。优选用于治疗线粒体神经胃肠脑病、高氨血症、高血糖症、苯丙氨酸羟化酶缺乏症、酒精中毒/解毒、过氧化氢酶缺乏症和/或防止细胞被活性氧自由基损伤、g6pd缺乏症或高尿酸血症。
70.根据第九方面,本发明提供了一种用于治疗用途的根据本发明第三或第四方面所述的红系细胞,或根据本发明第五、第六或第七方面所述的药物组合物。
71.根据第十方面,本发明提供了一种治疗有需要的受试者的方法,该方法包括施用药学有效量的根据本发明的第三或第四方面所述的红系细胞,或药学有效量的根据本发明的第五、第六或第七方面所述的药物组合物。
72.根据第十一方面,本发明提供了一种筛选在红系祖细胞成熟期间通过泛素化降解的蛋白质或多肽的方法,所述方法包括在红系祖细胞中表达待测蛋白,并:a)确定与红系祖细胞在泛素酶活性没有受阻碍或阻止时的待测蛋白的量相比,当红系祖细胞在泛素酶活性受到阻碍或被阻止的情况下成熟时,所述待测蛋白的量是否升高;b)当在所述红系祖细胞
成熟期间提供标记的泛素构建体时,确定待测蛋白是否被标记;或(c)通过抗泛素抗体标记或通过质谱法确定待测蛋白是否泛素化。
73.在本说明书的整个描述和权利要求书中,“包括”和“包含(contain)”以及这些词的变体,例如“包括(comprising)”和“包含(comprises)”,意味着“包括但不限于”,并且不排除其他组分、整数或步骤。此外,除非上下文另有要求,否则单数形式包括复数:具体地,在使用不定冠词情况下,除非上下文另有要求,否则本说明书应被理解为考虑复数和单数。
74.本发明各方面的优选特征可与其他任何方面的描述相一致。在本技术的范围内,明确表示前面各段、权利要求书和/或以下描述和附图中列出的各方面、实施方案、示例和可选方案,特别是其个别特征,可以独立或以任何方式组合。也就是说,所有的实施方案和/或任何实施方案的特征可以以任何方式和/或组合进行组合,除非这些特征是不相容的。
附图说明
75.现在将参照附图,仅以举例的方式描述本发明的一个或多个实施方案,其中:
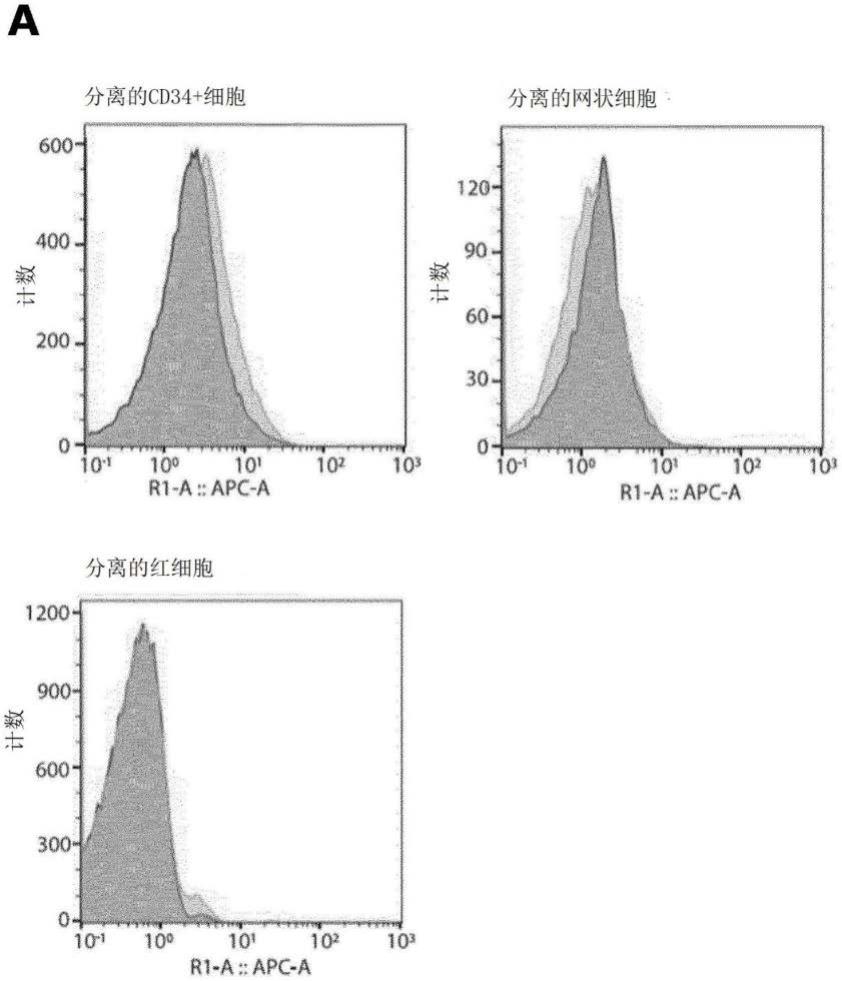
76.图1a显示了通过流式细胞仪测定来自捐献血液中的分离的cd34 干细胞、分离的网状细胞和分离的红血细胞中的内源性胸苷磷酸化酶(tp)表达的示例,其中深灰色描绘igg同型对照,浅灰色描绘tp表达。图1b显示了流式细胞图的量化(n=3)。图1c显示了通过分光光度计测定来自捐献血液的分离的cd34 干细胞、分离的网状细胞、分离的红细胞和作为对照的分离的血小板中检测的tp活性。图1d显示了在体外培养的第8天(原红细胞)、第12天(嗜碱性红细胞)和网状细胞阶段中通过流式细胞仪测定的内源性胸苷磷酸化酶(tp)表达的示例,其中深灰色描绘igg同型对照,浅灰色描绘tp表达。图1e显示了流式细胞图的量化(n=3)。图1f显示了在体外培养的第8天(原红细胞)、第12天(嗜碱性红细胞)和网状细胞中测定的tp活性。图1g显示了在增殖的bel-a、第6天分化的(多色红细胞)和bel-a衍生的网状细胞中通过流式细胞仪测定的内源性胸苷磷酸化酶(tp)表达的示例,其中深灰色描绘igg同型对照,浅灰色描绘tp表达。图1h显示了流式细胞图的量化(n=3)。
77.图2显示了通过在培养的cd34 衍生的红系祖细胞(表达tp的细胞)(ctp;图2a)和增殖的bel-a(表达tp的细胞)(btp;图2b)中外源性过表达tp而增加的tp表达,以每ctp细胞为单位表示tp活性(图2c)和ctp衍生的网状细胞的变形性(图2d)。
78.图3显示了在ctp细胞中降解抑制剂对tp表达的影响(图3a)和显示人类tp建模结果和需要突变的泛素化位点定位的3d模型(图3b)。
79.图4显示了ctp细胞(图4a;ctp-mut)和btp细胞(图4b;btp-mut)中突变tp的表达水平,以及ctp细胞(图4c;ctp-mut)和btp细胞(图4d;btp-mut)中突变tp的活性水平。
80.图5显示了在ctp细胞(图5a)和btp细胞(图5b)中存在胸苷补充时tp的表达水平。
81.图6显示了从造血干细胞向红血细胞分化的示意图。
82.图7显示了细胞分化谱系的示意图,分别从造血干细胞和bel-a原红细胞开始,举例说明了可添加病毒载体的体外阶段。
83.图8显示了通过使用慢病毒在分化过程中过表达谷氨酰胺合成酶的柱状图,通过流式细胞仪在两种不同的培养物中进行评估,以及显示了存在和不存在mg132时谷氨酰胺合成酶表达水平的柱状图。
84.图9显示了通过使用慢病毒在分化过程中过表达腺苷脱氨酶(用c-myc标记)的柱
状图,通过流式细胞仪在两种不同的培养物中进行评估,以及显示了在体外衍生网状细胞中的表达的western blot。
85.图10显示了通过使用慢病毒在分化过程中过表达l-天冬氨酸酶(用c-myc标记)的柱状图,通过流式细胞仪在两种不同的培养物中进行评估,以及显示了在体外衍生的网状细胞中的表达的western blot。
86.图11显示了通过使用慢病毒在分化过程中表达尿酸酶(用c-myc标记)的柱状图,通过流式细胞仪在两种不同的培养物中进行评估,以及显示了在体外衍生的网状细胞中的表达的western blot。
具体实施方式
87.实施例1—红系祖细胞、网状细胞和红细胞中的内源性tp表达
88.我们首先确认了在分离的造血cd34 干细胞(即从血液中分离出来的)、标准供体衍生的网状细胞和红细胞中的基线内源性表达和胸苷磷酸酶(tp)的活性水平。通过流式细胞仪评估固定和透化细胞中的表达,并使用基于分光光度计的分析确定tp的活性,通过在37℃下30分钟后,存在tp时,测定胸腺嘧啶的吸光度水平差异。如预期,两种分析均确认了在cd34 造血干细胞和网状细胞中tp的内源性表达和活性较低,因此在红血细胞中没有tp的表达或活性(图1a、1b和1c)。外周血中新鲜分离的血小板作为活性分析的阳性对照(1c),因为这些血细胞含有tp。接下来,我们检测了从cd34 造血干细胞体外分化的红系细胞中的内源性tp表达和活性。之前,我们曾报道过体外培养系统中红系细胞成熟的不同阶段(griffiths,r.e.,et al.,blood,2012,119(26),p.6296-306)。在此,我们基于这一知识,提到了培养的天数并在括号中注明它们的大致分化阶段。图1d、1e和1f显示,在第8天(原红细胞)和第12天(多色红细胞)的内源性tp的表达和活性较低。这也表明,未经修饰过滤的体外培养的网状细胞的表达和活性与供体分离的内源性网状细胞相当。我们接下来测试了内源性tp在红细胞系bel-a(具有分化成网状细胞的能力的红细胞系)中的表达,与体外培养的网状细胞相当(trakarnsanga,k.,et al.,nat commun,2017.8:p.14750)。使用bel-a细胞的优点是这些细胞提供了一个可持续的细胞来源,可以进行遗传修饰和冷冻储存,且修饰可无限期地保持(hawksworth,j.,et al.,embo mol med,2018.10(6);trakarnsanga,k.,et al.,nat commun,2017.8:p.14750)。而cd34 衍生的培养物是有限期的,且每次都需要重新启动。增殖的bel-a细胞(与原红细胞成红细胞相当)内源性tp表达低(图1g和1h),且bel-a衍生的网状细胞没有表现出可测定的tp表达(图1h),与cd34 衍生培养的网状细胞(图1e)和体内分离的网状细胞(图1b)相当。
89.实施例2—使用慢病毒在体外cd34 细胞和bel-a衍生细胞中外源性过表达胸苷磷酸化酶
90.通过将表达人类tp cdna的慢病毒稳定地转导至细胞,创建了培养的红系祖细胞(表达tp的细胞)(ctp)和增殖的bel-a(表达tp的细胞)(btp)。通过使用facs进行盲单细胞分选,从多克隆btp群中创建亚克隆。与内源性表达相比,第6天的ctp(原红细胞)和增殖的btp细胞(原红细胞)流式细胞仪分别显示了25倍和45倍增长(图2a和2b)的tp酶表达。活性分析确认了激活的酶的存在(在每个多色ctp细胞中浓度约为8.6
×
10-9
单位),相当于约10个新鲜分离的血小板的天然内源性表达相当。
91.在第10天(嗜碱性红细胞)、第14天(多色红细胞)、第16天(正色红细胞(orthochromatic erythrocyte))和过滤的网状细胞中测定ctp细胞的分化和tp的表达(见图2a)。在第4天(嗜碱性红细胞)、第6天(多色红细胞)、第10天(正色红细胞)和网状细胞测定分化过程中btp的表达(见图2b)。虽然在ctp和btp网状细胞中观察到的表达与内源性水平相比有6倍和12倍的增长,但在终末分化过程中观察到表达明显下降。在过滤的ctp网状细胞中测得的tp活性为4.4
×
10-9
u/cell(见图2c)。使用自动流变仪细胞分析仪(arca)测定了ctp衍生的网状细胞的变形性。这表明,ctp网状细胞在尺寸和变形性方面都与未修饰的ctp对照网状细胞相当(图2d)。
92.实施例3—胸苷磷酸化酶在成红细胞中通过泛素降解途径降解
93.分化过程中tp酶表达的大量损失意味着在终末分化过程中tp降解活跃。为了测试在分化过程中外源性tp的降解是由于泛素化还是溶酶体降解,我们将第14天(正色红细胞)的ctp细胞置于泛素化抑制剂mg132或溶酶体降解抑制剂亮抑酶肽(leupeptin)中(tsubuki,s.,et al.,j biochem,1996,119(3),p.572-6;hershko,a.and a.ciechanover,annu rev biochem,1982,51,p.335-64)。首先在第14天测定tp的表达,然后在用抑制剂或载体对照孵育24小时后测定。虽然亮抑酶肽(leupeptin)没有破坏降解,但加入mg132后观察到降解的抑制(图3a)。这表明,分化过程中的泛素化是人类tp蛋白降解的重要原因。
94.实施例4—人类tp和泛素化位点的诱变的建模
95.对人类tp二聚体晶体结构(2j0f.pdb)的研究表明,该蛋白由两个同源二聚体组成,每个二聚体由6个α螺旋的α结构域域和由α螺旋包围的反平行β折叠组成的α/β结构域组成(norman,r.a.,et al.,structure,2004,12(1),p.75-84)。这些结构域在与底物结合后可以相对旋转8
°
。在没有底物存在的情况下,tp处于开放的构象,而与胸苷和磷酸盐的结合则导致酶的关闭。对大肠杆菌和兔tp蛋白进行的动力学研究表明,有一个连续的结合机制,即底物胸苷首先结合,2-dr-1-p最后释放(krenitsky,t.a.,j biol chem,1968,243(11),p.2871-5)。
96.人类和小鼠的tp蛋白有81.2%的同一性,序列比对证实在小鼠tp酶中位于残基115和221的两个已知泛素化位点在人类tp结构中是保守的。对结构的研究表明,这两个保守的赖氨酸为胸苷结合位点的一个组成部分,因此这些重要残基的改变可能会影响tp的活性或稳定性,因为活性位点被改变了(图3b)。将人类tp中的两个赖氨酸残基替换为精氨酸残基以保留活性位点结构,但去除了泛素化位点,成为tp-mut。在第3天体外培养的红细胞(ctp-mut)和增殖的bel-a细胞(btp-mut)中均表达这种酶,细胞随后分化。tp-mut表达水平达到与第6天的ctp和增殖的btp细胞相当(见图4a和4b),但在ctp-mut网状细胞中没有检测到tp活性(图4c)。这些突变损害了酶的活性和稳定性。这提供了泛素化位点的突变可用于阻止蛋白质在去核过程中降解的概念验证,但必须注意确保任何突变不会破坏所需的蛋白质活性。因此,要么需要重新设计酶活性位点以保留活性但去除泛素位点,要么需要破坏tp泛素的替代方法。
97.实施例5—通过胸苷补充减少胸苷磷酸化酶的降解
98.在进一步研究人类tp的分子结构后,我们观察到与小鼠tp相对应的2个泛素化位点,只有在缺乏底物的情况下才可以进行泛素化。因此我们假设,在培养基中补充tp酶底物胸苷可能会导致tp结构关闭,通过掩盖活性位点中赖氨酸泛素化位点而减少降解。然而之
naoh终止。用分光光度计在299nm处测定吸光度,并与tp酶的标准浓度曲线进行比较(mart
í
,r.,l.c.l
ó
pez,and m.hirano,methods in molecular biology(clifton,n.j.),2012.837:p.121-133)。
116.使用arca测定网状细胞的变形性
117.将1
×
106个网状细胞重悬于200μl聚乙烯吡咯烷酮溶液中(pvp viscosity 28.1;mechatronics instruments,the netherlands)。样品在arca中进行检测(dobbe,j.g.g.,et al.,measurement of the distribution of red blood cell deformability using an automated rheoscope.2002.50(6),p.313-325),该arca包括一个安装在linkam成像站组件上的平板式光学剪切台(型号css450),并使用linksys32软件(linkam scientific instruments,surrey,uk)进行温度控制。显微镜配备了一个lmplanfl 50
×
的10.6毫米工作距离的物镜(olympus,essex,uk),由x-1500频闪仪(perkinelmer,the netherlands)通过一个带通干涉滤镜(cwl 420nm,fwhm 10nm;edmund optics,poppleton,uk)进行照明。使用ueye相机(ui-2140se-m-gl;ids gmbh,obersulm,germany)获取图像。每个样品至少获取1,000张细胞图像,并使用定制的arca软件进行分析。
118.tp建模
119.从哺乳动物蛋白泛素化位点数据库mubisida(http://202.195.183.4:8000/brogo3_data.php?name=0016154)中预测泛素化位点。它提供了wagner等人(mol cell proteomics,2012,11(12),p.1578-85)中分析的小鼠泛素化位点的详细信息。clustal omega(doi:10.1093/nar/gkz268)用来比对人类和小鼠的序列。用ucsf chimera软件(doi:10.1002/jcc.20084)使蛋白质结构可视化,并生成图像。
120.泛素位点共同序列确定。使用两个序列搜索程序对完整的蛋白质序列进行了泛素共同序列的搜索。第一个为ubpred(radivojac,p.,vacic,v.,haynes,c.,cocklin,r.r.,mohan,a.,heyen,j.w.,goebl,m.g.,and iakoucheva,l.m.identification,analysis and prediction of protein ubiquitination sites.proteins:structure,function,and bioinformatics.78(2):365-380.(2010)),可以在线访问http://www.ubpred.org/;第二个为phosphosite(“hornbeck pv,zhang b,murray b,kornhauser jm,latham v,skrzypek e phosphositeplus,2014:mutations,ptms and recalibrations.nucleic acids res.2015 43:d512-20.”),可在线访问https://www.phosphosite.org/(后者提供所有潜在的翻译后位点—包括乙酰化和泛素化)。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。