1.本发明涉及:以血液中的生长分化因子15(growth and differentiation factor 15、以下也记为“gdf15”)蛋白的前肽及其降解产物作为指标,检测成为测定对象的癌(其中,不包括去势抵抗性前列腺癌(castration resistant prostate cancer。以下记为“crpc”))的骨转移的方法和检测试剂。
背景技术:
2.随着癌的进展,癌细胞变得具有转移能力,从癌组织中游离出的癌细胞可通过血管被输送至体内的各个部位。血流量较大的肺、肝脏、富含生长因子的淋巴结和骨基质被认为容易成为癌转移的目的地。若癌转移到骨中,则称为转移性骨肿瘤,会发生骨痛、脊髓压迫、病理性骨折、针对骨转移灶的手术、放射线疗法、高钙血症之类的骨骼相关事件(skeletal related event),已知会对生活质量、预后造成不良影响。
3.怀疑发生骨转移时,首先,通过基于简单x射线、计算机断层扫描的检查进行骨折风险评价、治疗法的选择。骨闪烁显像、
18
f-氟脱氧葡萄糖-正电子发射断层扫描、正电子发射断层扫描-计算机断层扫描、核磁共振成像(以下也记为“mri”)在诊断骨转移中的有用性高且在骨转移诊疗准则(2015年)中也被推荐。任何方法都存在优点和缺点,根据癌类型、骨转移的性质来区分利用这些影像诊断,并对骨转移灶进行检测。
4.作为体外诊断标记物,报道了表1所示的骨代谢标记物能用于骨转移治疗的监测。然而,骨代谢标记物为治疗效果的直接预测因子这一点尚未得到验证,在国内外的指南中也未推荐在日常的诊疗中使用。
5.影像诊断在骨转移的诊断中的有用性虽高,但也存在解读者之间存在差异、伴随暴露、装置(全身mri)未得到普及之类的课题。因此,期望发现能够简便且以高精度检测骨转移的标记物并开发出检测法。
6.[表1]
[0007]
表1
[0008][0009]
gdf15是与巨噬细胞抑制因子1(macropharge inhibitory cytokine 1:mic-1)、非甾体类抗炎药活化基因1(nonsteroidal anti-inflammatory drug-activated gene 1:nag-1)为同一种蛋白质,属于tgf-β家族。gdf15表达为包含分泌信号和前肽的前原gdf15后,分泌信号被切断,成为前gdf15并分泌到细胞外。前gdf15通过前肽储存在细胞外基质中,在通过弗林样蛋白酶由前肽形成二聚体的状态下gdf15被切断并释放到血液中(非专利文献1)。报道了全长前gdf15的分子量为40000左右,gdf15成熟体在分子量15000左右被分级出来(非专利文献2)。
[0010]
已确认了在胰腺癌、大肠癌等各种癌的情况下gdf15的血液中的成熟体量增加(非专利文献3~8),还报道了在前列腺癌中可以成为伴随转移、恶性度的预后判定指标(非专利文献9~12)。
[0011]
报道了在crpc、胰腺癌、大肠癌、肺癌、乳腺癌、食道癌、胃癌、肺小细胞癌的情况下gdf15前肽的血中含量增加(专利文献1~2)。专利文献1中记载了:在完整的gdf15前肽与骨转移的指标eod、bsi之间未观察到高度相关性。然而,另一方面,也记载了:完整的gdf15前肽为高值时观察到骨转移等恶性进展,启示出可能成为crpc的恶性进展的标记物。如此专利文献1中发现了相互矛盾的记载,gdf15前肽与骨转移的关系不明。
[0012]
需要说明的是,gdf15前肽(以下也记为“gdpp”)是位于前gdf15的n末端侧的165残基的多肽。更具体而言,本说明书中的gdf15前肽为:在基于序列号1所示的人gdf15的cdna(genebank accession no.:nm_004864)的氨基酸序列(序列号2)中,继起始蛋氨酸到第29位残基的丙氨酸的信号肽之后,至少包含第30位残基的亮氨酸到第194位残基的精氨酸的序列者;或者包含与前述序列具有80%以上的一致性的氨基酸序列者。
[0013]
现有技术文献
[0014]
专利文献
[0015]
专利文献1:国际公开第2017/150314号小册子
[0016]
专利文献2:日本特开2019-045486号公报
[0017]
非专利文献
[0018]
非专利文献1:prostate cancer prostatic dis.2012;15(4):320-328
[0019]
非专利文献2:cancer res.2005;65(6):2330-2336
[0020]
非专利文献3:bmc cancer.2014;14:578-588
[0021]
非专利文献4:biochemical pharmacology.2013;85:597-606
[0022]
非专利文献5:clin cancer res.2009;15(21):6658-6664
[0023]
非专利文献6:clin cancer res.2011;17:4825-4833
[0024]
非专利文献7:clin cancer res.2003;9:2642-2650
[0025]
非专利文献8:clin cancer res.2006;12:442-446
[0026]
非专利文献9:cancer epidemiol biomarders prev.2007;16(3):532-537
[0027]
非专利文献10:anticancer research.2016;36:1973-1978
[0028]
非专利文献11:anticancer research.2017;37(3):1501-1505
[0029]
非专利文献12:technology in cancer research&treatment.17:1-7
技术实现要素:
[0030]
发明要解决的问题
[0031]
本发明的课题在于,提供简便且以高精度检测癌的骨转移的方法、和能用于前述方法的试剂。
[0032]
用于解决问题的方案
[0033]
为了解决上述课题,本发明人等进行了深入研究,结果得到了如下发现:在前列腺癌(其中,不包括crpc)、肾癌、肺癌、乳腺癌、甲状腺癌、胰腺癌、膀胱癌、大肠癌、黑色素瘤、骨髓瘤或淋巴瘤的骨转移病例中,根据使用了识别gdf15前肽的抗体的免疫分析法,与健康待检体和各种癌的非骨转移病例待检体相比,这些癌的骨转移病例待检体中血液中的gdf15前肽显示出增加,gdf15前肽可以成为检测癌(其中,不包括crpc)的骨转移的标记物,并完成了本发明。
[0034]
即,本发明如下所述。
[0035]
[1]一种检测癌的骨转移的方法,其包括测定待检体中完整的生长分化因子15(gdf15)前肽量,其中,所述癌不包括去势抵抗性前列腺癌。
[0036]
[2]一种检测癌的骨转移的方法,其包括测定待检体中gdf15前肽片段量,其中,所述癌不包括去势抵抗性前列腺癌。
[0037]
[3]一种检测癌的骨转移的方法,其包括测定待检体中完整的gdf15前肽量与gdf15前肽片段量的总计量,其中,所述癌不包括去势抵抗性前列腺癌。
[0038]
[4]根据[2]或[3]所述的方法,其中,前述gdf15前肽片段包含以下的(a)和/或(b)所述的gdf15前肽片段,
[0039]
(a)具有以下特征的gdf15前肽片段。
[0040]
包含序列号2所示的gdf15氨基酸序列的第58位残基的赖氨酸到至少第167位残基的天冬氨酸的氨基酸序列、或与其具有80%以上的一致性的序列。
[0041]
(b)具有以下特征的gdf15前肽片段。
[0042]
包含序列号2所示的gdf15氨基酸序列的第74位残基的谷氨酸到至少第167位残基的天冬氨酸的氨基酸序列、或与其具有80%以上的一致性的序列。
[0043]
[5]根据[1]~[4]中任一项所述的方法,其检测非去势抵抗性前列腺癌的前列腺癌、肾癌、肺癌、乳腺癌、甲状腺癌、胰腺癌、膀胱癌、大肠癌、黑色素瘤、骨髓瘤或淋巴瘤的骨
转移。
[0044]
[6]根据[1]~[5]中任一项所述的方法,其中,利用使用了识别gdf15前肽的抗体的抗原抗体反应进行前述测定。
[0045]
[7]根据[1]~[5]中任一项所述的方法,其中,利用质谱分析法来进行前述测定。
[0046]
[8]一种用于检测癌的骨转移的试剂,其包含特异性识别gdf15前肽的抗体,其中,所述癌不包括去势抵抗性前列腺癌。
[0047]
发明的效果
[0048]
根据本发明,提供简便且以高精度检测癌(其中,不包括crpc)的骨转移的方法、和能用于前述方法的试剂。
[0049]
另外,本发明的试剂用于检测gdf15前肽,gdf15是tfg-β家族成员之一,可能发映出从癌细胞释放出的细胞因子对破骨细胞的激活程度。推测该情况能反映现有的骨修饰剂(bone modifying agents)的治疗效果。因此,本发明的试剂还可以是癌(其中,不包括crpc)的骨转移治疗中的伴随诊断剂。
附图说明
[0050]
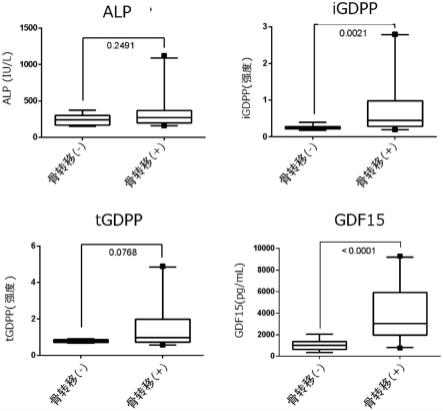
图1是示出良性(活检阴性)、前列腺癌(无骨转移)和前列腺癌转移性骨肿瘤的血清中的各种标记物测定值的箱形图的图。
[0051]
图2是示出前列腺癌(无骨转移)和前列腺癌转移性骨肿瘤、或者良性(活检阴性)和前列腺癌转移性骨肿瘤的血清中的各种标记物的受试者工作特征(roc)曲线解析的结果的图。
[0052]
图3是示出使用前列腺癌(无骨转移)和前列腺癌转移性骨肿瘤的血清血浆同时采血品的各种标记物的roc曲线解析的结果的图。
[0053]
图4是示出肾癌(无骨转移)和肾癌转移性骨肿瘤的血清中的各种标记物的箱形图的图。
[0054]
图5是示出肾癌(无骨转移)和肾癌转移性骨肿瘤的血清中的各种标记物的roc曲线解析的结果的图。
[0055]
图6是示出健康、肺癌转移性骨肿瘤或乳腺癌转移性骨肿瘤的血浆中的各种标记物的箱形图的图。
[0056]
图7是示出健康、肺癌转移性骨肿瘤或乳腺癌转移性骨肿瘤的血浆中的各种标记物的roc曲线解析的结果的图。
[0057]
图8是示出crpc中的无骨转移病例和转移性骨肿瘤病例的血清中的各种标记物的箱形图的图。
[0058]
图9是示出不是crpc的前列腺癌中的无骨转移病例和转移性骨肿瘤病例的血清中的各种标记物的箱形图的图。
[0059]
图10是示出不是crpc的前列腺癌中的无骨转移病例和转移性骨肿瘤病例的血清中的各种标记物的roc曲线解析的结果的图。
[0060]
图11是示出肺癌(无转移)、肺癌(向骨以外转移)和肺癌转移性骨肿瘤的按照待检体分类的各种标记物的箱形图的图。
[0061]
图12是示出肺癌中的无骨转移病例和转移性骨肿瘤病例的按照待检体分类的各
种标记物的roc曲线解析的结果的图。
[0062]
图13是示出乳腺癌(无转移)、乳腺癌(向骨以外转移)和乳腺癌转移性骨肿瘤的按照待检体分类的各种标记物的箱形图的图。
[0063]
图14是示出乳腺癌中的无骨转移病例和转移性骨肿瘤病例的按照待检体分类的各种标记物的roc曲线解析的结果的图。
[0064]
图15是示出健康、甲状腺癌、胰腺癌、膀胱癌、大肠癌、黑色素瘤、骨髓瘤和淋巴瘤的转移性骨肿瘤的血浆中的各种标记物的箱形图的图。
具体实施方式
[0065]
《1》本发明的检测癌(其中,不包括crpc)的骨转移的方法
[0066]
本发明的第一方式是检测癌(其中,不包括crpc)的骨转移的方法,其包括测定待检体中gdf15前肽量。其是基于与健康人和非骨转移癌患者的待检体相比在具有癌(其中,不包括crpc)的骨转移的患者的血液等生物试样中特征性地存在gdf15前肽的方法。待检体中的gdf15前肽量的测定通常在体外(in vitro)进行。
[0067]
如后述的实施例所示,与测定现有已知的骨代谢标记物(alp)的情况相比,利用该方法检测癌(其中,不包括crpc)的骨转移时,能够以高的灵敏度和特异性进行检测。
[0068]
需要说明的是,本发明的方法包括至检测癌(其中,不包括crpc)的骨转移的阶段为止的方法,不包括与骨转移的诊断相关的最终的判断行为。医生参考基于本发明的方法的检测结果等来诊断骨转移或制定治疗方针。
[0069]
通常,检测骨转移的对象(被检动物)为人。
[0070]
本方式中作为测定对象的gdf15前肽包括:包含序列号2所示的gdf15氨基酸序列的第30位残基的亮氨酸到第194位残基的精氨酸的氨基酸序列、或与前述序列具有80%以上的一致性的氨基酸序列的完整的gdf15前肽(以下也记为“igdpp”);和,gdf15前肽片段。完整的gdf15前肽是指未进行加工的(未分解的)gdf15前肽。gdf15前肽片段包含:dnt57-gdpp(包含序列号2的氨基酸序列的第58位残基到第167位残基的氨基酸序列、或与前述序列具有80%以上的一致性的氨基酸序列的肽)、dnt73-gdpp(包含序列号2的氨基酸序列的第74位残基到第167位残基的氨基酸序列、或与前述序列具有80%以上的一致性的氨基酸序列的肽)、及其它肽片段。其它肽片段只要是gdf15前肽经加工后的肽片段就没有特别限定,优选包含序列号2的氨基酸序列的一部分序列、或与前述序列具有80%以上的一致性的氨基酸序列的肽。
[0071]
本发明的检测方法中,测定gdf15前肽量的方法没有特别限制。例如可以示例出利用使用特异性识别gdf15前肽的抗体的抗原抗体反应的方法、利用了质谱分析法的方法。
[0072]
作为利用使用特异性识别gdf15前肽的抗体的抗原抗体反应的测定方法的具体例,可列举出以下的方法。
[0073]
(a)使用特异性识别经标记的测定对象和测定对象的抗体,利用经标记的测定对象和待检体中包含的测定对象与前述抗体竞争性地结合的竞争法。
[0074]
(b)使待检体与固定化有特异性识别测定对象的抗体的芯片接触,使用检测依赖于该抗体与测定对象的结合的信号的表面等离子共振的方法。
[0075]
(c)使用经荧光标记的特异性识别测定对象的抗体,利用由于该抗体与测定对象
结合而荧光偏振度上升的荧光偏振免疫测定法。
[0076]
(d)使用表位不同的2种特异性识别测定对象的抗体(其中1个为经标记的抗体),形成该2个抗体与测定对象的3者的复合体的夹心法。
[0077]
(e)作为预处理,利用特异性识别测定对象的抗体将待检体中的测定对象浓缩后,通过质谱分析装置等检测该结合蛋白的多肽的方法。
[0078]
(d)、(e)的方法简便且通用性高,但在处理大量待检体方面更优选(d)的方法,因为与试剂和装置相关的技术已充分确立起来。
[0079]
作为特异性识别gdf15前肽的抗体,特异性识别gdf15前肽的n末端区域、例如与序列号2的第30位残基的亮氨酸到第57位残基的精氨酸的区域内的抗原决定簇结合的抗体可以优选用于igdpp量的测定。另外,特异性识别gdf前肽的c末端区域、例如与序列号2的第74位残基的谷氨酸到第196位残基的精氨酸的区域内的抗原决定簇结合的抗体可以优选用于igdpp量和gdpp片段量的总计量(总gdpp、以下也记为“tgdpp”)的测定。
[0080]
特异性识别gdf15前肽的抗体可以通过将gdf15前肽本身、由gdf15前肽的部分区域组成的寡肽、编码前gdf15蛋白的完整蛋白或部分区域的多核苷酸等作为免疫原使动物免疫而得到。
[0081]
免疫中使用的动物只要是具有抗体产生能力者就没有特别限定,可以是小鼠、大鼠、兔子等通常免疫中使用的哺乳动物,也可以使用鸡等禽类。
[0082]
需要说明的是,使用gdf15前肽本身或由gdf15前肽的部分区域组成的寡肽作为免疫原时,在制备前述蛋白质或前述寡肽的过程中其结构有可能发生变化。因此,得到的抗体有可能对期望的抗原不具有高的特异性、结合力,作为结果有可能变得无法准确定量待检体中包含的gdf15前肽量。另一方面,使用包含编码前gdf15蛋白的完整蛋白或部分区域的多核苷酸的表达载体作为免疫原时,在被免疫的动物的体内不发生结构变化地表达与导入相符合的gdf15前肽蛋白的完整蛋白或部分区域,因此可以得到对待检体中的gdf15前肽具有高的特异性和结合力(即,高亲和性)的抗体,故而优选。
[0083]
特异性识别gdf15前肽的抗体可以是单克隆抗体,也可以是多克隆抗体,但优选为单克隆抗体。
[0084]
关于产生特异性识别gdf15前肽的抗体的杂交瘤细胞的建立,从已确立了技术的方法中适宜选择来进行即可。作为一例,从利用前述的方法免疫的动物中采集b细胞,使前述b细胞与骨髓瘤细胞电融合或在聚乙二醇的存在下融合,利用hat培养基进行产生期望的抗体的杂交瘤细胞的选择,利用有限稀释法对所选择的杂交瘤细胞进行单克隆化,由此能够建立产生特异性识别gdf15前肽的单克隆抗体的杂交瘤细胞。
[0085]
对于本发明的检测癌(其中,不包括crpc)的骨转移的方法中使用的特异性识别gdf15前肽的抗体、例如特异性识别gdf15前肽的单克隆抗体的选择可以基于源自宿主表达系统的针对gpi(glycosyl phosphatidyl inositol,糖基磷脂酰肌醇)锚定型gdf15前肽或分泌型gdf15前肽的亲和性来进行。
[0086]
需要说明的是,作为前述宿主,没有特别限定,本领域技术人员从通常用于蛋白质的表达的大肠杆菌、酵母等微生物细胞、昆虫细胞、动物细胞中适宜选择即可,优选使用能够通过二硫键或糖链添加之类的翻译后修饰而表达具有接近天然型的gdf15前肽的结构的蛋白质的哺乳细胞作为宿主。作为哺乳细胞的一例,可列举出一直以来使用的人胎肾来源
细胞(hek)293t细胞株、猴肾细胞cos-7细胞株、中国仓鼠卵巢(cho)细胞株或从人体分离出的癌细胞等。
[0087]
关于本发明的癌(其中,不包括crpc)的骨转移的检测方法中使用的抗体的纯化,从已确立了技术的方法中适宜选择来进行即可。作为一例,培养利用前述的方法确立的产生抗体的杂交瘤细胞后,回收该培养上清液,根据需要通过硫酸铵沉淀进行抗体浓缩后,使用固定化有蛋白a、蛋白g或蛋白l等的载体通过亲和色谱和/或离子交换色谱而能够进行抗体的纯化。
[0088]
需要说明的是,利用前述的夹层法进行抗原抗体反应时使用的经标记的抗体可以用过氧化物酶、碱性磷酸酶等酶来标记利用前述方法纯化后的抗体,该标记也可以使用已确立了技术的方法来进行。
[0089]
以下具体地说明在本发明的检测方法中利用质谱分析法检测gdf15前肽的方法。
[0090]
待检体为血液的情况下,作为预处理工序,优选:利用agilent human 14等去除血液中大量包含的白蛋白、免疫球蛋白、运铁蛋白等蛋白质后,通过离子交换、凝胶过滤或反相hplc等进行进一步分级。
[0091]
测定可以通过串联质谱分析(ms/ms)、液相色谱/串联质谱分析(lc/ms/ms)、基质辅助激光解吸电离飞行时间质谱分析(matrix assisted laser desorption ionization time-of-flight mass spectrometry、maldi-tof/ms)、表面增强激光解吸电离质谱分析(surface enhanced laser desorption ionization mass spectrometry、seldi-ms)等来进行。
[0092]
在本发明的检测方法中,优选:在通过测定而得到的gdf15前肽量超过由对照计算出的基准值(截止值)的情况下,判定为检测到癌(其中,不包括crpc)的骨转移。
[0093]
判定时使用的gdf15前肽量可以是测定值或换算浓度值的任意者。需要说明的是,换算浓度值是指:基于以gdf15前肽作为标准试样制得的标准曲线由测定值换算而得的值。关于标准试样的浓度确定,可以设为基于使用质谱分析的标准肽的标准曲线由测定值换算的值。
[0094]
对于基准值(截止值),可以分别测定非骨转移癌患者待检体和具有骨转移的癌(其中,不包括crpc)患者待检体,通过受试者工作特征(roc)曲线解析适宜设定显示出最佳的灵敏度和特异性的测定值。
[0095]
本发明的检测骨转移的方法可以用于治疗转移性骨肿瘤的方法。即,根据本发明,提供治疗患者中的转移性骨肿瘤的方法,所述方法包括如下工序:
[0096]
(i)将gdf15前肽量的测定值超过预先设定的基准值的人鉴定为患者的工序;及
[0097]
(ii)对前述鉴定出的患者实施治疗的工序。
[0098]
在前述工序(i)的鉴定中,gdf15前肽量的测定可以使用特异性识别gdf15前肽的抗体进行,也可以使用质谱分析法进行。
[0099]
作为前述工序(ii)的治疗,可列举出外科治疗、药物疗法、放射线疗法等,但没有特别限定。
[0100]
《2》本发明的用于检测癌(其中,不包括crpc)的骨转移的试剂
[0101]
本发明的第二方式是用于检测癌(其中,不包括crpc)的骨转移的试剂,所述试剂包含识别gdf15前肽的抗体。前述抗体通常是与序列号2所示的前gdf15的第30位残基的亮
氨酸到第196位残基的精氨酸的区域内的抗原决定簇结合的抗体。
[0102]
本方式中作为抗体的识别对象的gdf15前肽包含完整的gdf15前肽和/或gdf15前肽片段,gdf15前肽片段包含dnt57-gdpp、dnt73-gdpp、和其它肽片段。这些前肽和前肽片段的说明依据前述的第一方式。
[0103]
将本发明的试剂用于前述的夹层法时,作为前述抗体,需要包含表位不同的2种抗体。
[0104]
本发明的检测试剂进而还可以包含含有特异性识别骨代谢标记物的抗体的骨代谢标记物的检测试剂。作为骨代谢标记物,例如可列举出表1所示的标记物。
[0105]
本发明的试剂中包含的抗体可以是抗体本身,也可以经标记或固定化于固相。
[0106]
本发明的试剂中,以下具体说明用于作为前述夹层法的一个方式的两步夹层法的情况。但是,本发明不限定于此。
[0107]
首先,本发明的试剂可以利用以下的(i)至(iii)所示的方法来制作。
[0108]
(i)首先,使夹层法中使用的特异性识别gdf15前肽且表位不同的2种抗体(以下记为“抗体1”和“抗体2”)中的抗体1结合于免疫板、磁性颗粒等能进行b/f(结合/游离)分离的载体上。结合方法可以是利用了疏水键的物理结合,也可以是使用能使两种物质之间交联的连接试剂等的化学结合。
[0109]
(ii)使前述抗体1结合于载体后,为了避免非特异性结合,用牛血清白蛋白、脱脂乳、市售的免疫法用封闭剂等对载体表面进行封闭处理,作为1次试剂。
[0110]
(iii)标记另一者、即抗体2,从而准备包含得到的标记抗体的溶液作为2次试剂。作为对抗体2进行标记的物质,优选:过氧化物酶、碱性磷酸酶之类的酶、荧光物质、化学发光物质、放射性同位素等能用检测装置检测的物质;或者亲合素与生物素等存在特异性结合的另一者的物质等。另外,作为2次试剂的溶液,优选能良好地进行抗原抗体反应的缓冲液、例如磷酸盐缓冲液、tris-hcl缓冲液等。
[0111]
如此制作的本发明的试剂可以根据需要进行冷冻干燥。
[0112]
需要说明的是,一步夹层法的情况,与前述的(i)~(ii)同样地制作抗体1与载体结合并进行封闭处理者,在前述抗体固定化载体中进一步添加包含经标记的抗体2的缓冲液来制作试剂即可。
[0113]
接着,使用前述的方法中得到的试剂,利用两步夹层法检测、测定gdf15前肽时,利用以下的(iv)至(vi)所示的方法进行即可。
[0114]
(iv)使(ii)中制作的1次试剂与待检体在一定温度下接触一定时间。反应条件在温度4℃至40℃的范围内使其反应5分钟到180分钟即可。
[0115]
(v)通过b/f分离去除未反应物质,接着与(iii)中制作的2次试剂在一定温度下接触一定时间,形成夹心复合体。关于反应条件,在温度4℃至40℃的范围内使其反应5分钟到180分钟即可。
[0116]
(vi)通过b/f分离去除未反应物质,对标记抗体的标记物进行定量,利用以已知浓度的gdf15前肽溶液作为标准而制作的标准曲线对待检体中的人gdf15前肽浓度进行定量。
[0117]
检测试剂中包含的抗体等试剂成分的量根据待检体量、待检体的种类、试剂的种类、检测的方法等各种条件进行适宜设定即可。具体而言,例如,如后所述,作为待检体使用经2.5倍稀释的血清、血浆50μl,利用夹层法进行gdf15前肽量的测定时,相对于使该待检体
50μl与抗体反应的反应体系,与载体结合的抗体量可以为100ng至1000μg,标记抗体量可以为2ng至20μg。
[0118]
本发明的癌(其中,不包括crpc)的骨转移检测试剂也可以用于手动方法的检测,也可以用于使用了自动免疫诊断装置的检测。特别是使用了自动免疫诊断装置的检测能够在不受待检体中包含的内源性的测定阻碍因素、竞争酶的影响的情况下进行检测,且能够在短时间内对待检体中的gdf15前肽以及骨代谢标记物的浓度进行定量,故而优选。
[0119]
本发明的第二方式的另一方案是特异性识别gdf15前肽的抗体在制造用于检测癌(其中,不包括crpc)的骨转移的试剂中的应用。
[0120]
另外,本发明的第二方式的另一方案是特异性识别gdf15前肽的抗体在检测癌(其中,不包括crpc)的骨转移中的应用。
[0121]
成为本发明的检测癌(其中,不包括crpc)的骨转移的方法和本发明的检测试剂的对象的待检体(被检试样)通常由癌症患者进行采集。更具体而言,可列举出由非去势抵抗性前列腺癌的前列腺癌、肾癌、肺癌、乳腺癌、甲状腺癌、胰腺癌、膀胱癌、大肠癌、黑色素瘤、骨髓瘤或淋巴瘤的患者采集者,但不限定于此。这些当中,优选由非去势抵抗性前列腺癌的前列腺癌、肾癌、肺癌、乳腺癌的患者采集者,进一步优选由肾癌、肺癌、乳腺癌的患者采集者。
[0122]
即,本发明的方法中优选被检测的骨转移为非去势抵抗性前列腺癌的前列腺癌、肾癌、肺癌、乳腺癌、甲状腺癌、胰腺癌、膀胱癌、大肠癌、黑色素瘤、骨髓瘤或淋巴瘤的骨转移。
[0123]
作为本发明的待检体,可列举出全血、血细胞、血清、血浆等血液成分、细胞或组织的提取液、尿液、脑脊髓液等。使用血液成分、尿等体液作为待检体时,能够简便且非侵入式地检测癌(其中,不包括crpc)的骨转移,因此优选,若考虑到待检体采集的容易性、在其它检测项目中的通用性,则特别优选使用血液成分作为待检体。
[0124]
本发明中将待检体供于检测时,可以直接使用由患者采集的上述血液等试样,或者也可以是实施了稀释、抗凝固剂的添加等适宜处理的试样。将待检体稀释时,根据所使用的待检体的种类、状态从无稀释到100倍稀释中适宜选择其稀释倍率即可,例如,血清、血浆的情况,使用进行了2.5倍稀释的待检体50μl即可。
[0125]
另外,本发明的待检体的采集时期可以是诊断为癌症后的任意时期,没有特别限定,可以是癌症的初期或进展期,另外可以在实施了手术疗法、药物疗法、放射线疗法等任意治疗后,可以是某种治疗后的经过观察期,在任意阶段采集的待检体均可以供于本发明的方法。
[0126]
实施例
[0127]
以下为了对本发明进行具体地说明而示出实施例,但这些实施例用于示出本发明的一例,本发明不限定于实施例。
[0128]
《实施例1》gdf15前肽测定试剂的制备
[0129]
基于专利文献2的记载制作2种gdpp测定试剂,用于测定。1种通过识别gdpp的n末端区域的抗体(ts-gdpp02)和识别c末端区域的抗体(ts-gdpp04)的组合来检测完整的gdpp(igdpp)。另一种通过识别c末端区域的抗体的组合(ts-gdpp04和ts-gdpp08)检测igdpp及n末端区域缺失的gdf15前肽片段(包含dnt57-gdpp和dnt73-gdpp)这两者。将利用后者检测
的值作为总gdpp(tgdpp)。
[0130]
《实施例2》前列腺癌血清待检体中的转移性骨肿瘤的判断性能
[0131]
将本实施例中使用的血清待检体组(共计54个病例)的详细情况示于表2。均为在大阪大学泌尿器科学讲座以相同规程收集的待检体,得到知情同意的许可和大阪大学内的临床研究审查委员会批准而提供。
[0132]
[表2]
[0133]
表2
[0134] 病例数良性(活检阴性)14前列腺癌(无骨转移)22前列腺癌转移性骨肿瘤18
[0135]
该研究中,测定碱性磷酸酶(alp)、前列腺特异性抗原(prostate specific anigen,psa)、igdpp、tgdpp和gdf15,对前列腺癌中的转移性骨肿瘤的判断性能进行了比较。对于psa、igdpp和tgdpp,利用专用测定试剂和全自动酶免疫分析装置aia-600ii(东曹株式会社制),gdf15使用市售elisa试剂盒(r&d公司)计算出测定值。alp参照最接近采血的保险诊疗时的测定值。将各种测定值的箱形图示于图1,将基于曼-惠特尼u检验的差异显著性检验结果示于表3。
[0136]
[表3]
[0137]
表3
[0138][0139]
前列腺癌中的转移性骨肿瘤的判断性能在除alp外的4种标记物中观察到显著性差异,igdpp和tgdpp显示出最大的p值。作为良性的活检阴性例和前列腺癌转移性骨肿瘤的判断性能在igdpp、tgdpp和gdf15中观察到显著性差异,tgdpp显示出最大的p值。
[0140]
接着,通过受试者工作特征(roc)曲线解析实施前列腺癌中的转移性骨肿瘤的判断性能。将解析结果示于图2,将auc(area under the curve、roc曲线下面积)示于表4。
[0141]
[表4]
[0142]
表4
[0143][0144]
对于前列腺癌中的转移性骨肿瘤的判断性能和作为良性的活检阴性例与前列腺癌转移性骨肿瘤的判断性能而言,均显示出igdpp和tgdpp与包括alp在内的其它标记物相比更优异。
[0145]
《实施例3》前列腺癌血清/血浆同时采血待检体中的转移性骨肿瘤的判断性能
[0146]
使用实施例2中解析的前列腺癌血清待检体中的、进行了血清血浆同时采血的病例(前列腺癌(无骨转移)9例、前列腺癌转移性骨肿瘤16例),通过曼-惠特尼u检验或roc解析比较了血清血浆之间的各种标记物的诊断性能。将u检验的p值和auc示于表5,将roc解析示于图3。
[0147]
[表5]
[0148]
表5
[0149][0150]
gdf15和psa的诊断性能在血清血浆之间未观察到较大差异。另一方面,证实了与血清相比,igdpp的诊断性能在血浆中得到大幅改善。现有研究显示出gdpp有易被蛋白酶等降解的倾向,启示出igdpp的检测优选使用血浆。
[0151]
《实施例4》肾癌血清待检体中的转移性骨肿瘤的判断性能
[0152]
将本实施例中使用的血清待检体组(共计29个病例)的详细情况示于表6。均为在大阪大学泌尿器科学讲座以相同规程收集的待检体,得到知情同意的许可和大阪大学内的临床研究审查委员会批准而提供。
[0153]
[表6]
[0154]
表6
[0155] 病例数肾癌(无骨转移)9肾癌转移性骨肿瘤20
[0156]
该研究中,测定alp、igdpp、tgdpp和gdf15,对肾癌血清待检体中的转移性骨肿瘤的判断性能进行了比较。对于igdpp和tgdpp,利用专用测定试剂和全自动酶免疫分析装置aia-600ii(东曹株式会社制),gdf15使用市售elisa试剂盒(r&d公司)计算出测定值。alp参照最接近采血的保险诊疗时的测定值。将各种测定值的箱形图示于图4,将roc解析示于图5,将基于曼-惠特尼u检验的差异显著性检验结果和基于roc解析的auc示于表7。
[0157]
[表7]
[0158]
表7
[0159][0160]
显示出alp在肾癌中也与前列腺癌同样地转移性骨肿瘤的判断性能低。另一方面,显示出igdpp和gdf15在肾癌血清待检体中具有良好的判断性能。
[0161]
《实施例5》肺癌和乳腺癌血浆待检体中的转移性骨肿瘤的判断性能
[0162]
将本实施例中使用的血浆待检体组(共计29个病例)的详细情况示于表8。健康人血清待检体从bioreclamationivt公司购入,各种癌血清待检体从promeddx公司购入,各公司的产品随附资料中明确记载了利用伦理委员会批准的方案进行收集。
[0163]
[表8]
[0164]
表8
[0165] 病例数健康人16肺癌转移性骨肿瘤8乳腺癌转移性骨肿瘤5
[0166]
该研究中,测定igdpp、tgdpp和gdf15,对健康和肺癌转移性骨肿瘤或乳腺癌转移性骨肿瘤的判断性能进行了比较。对于igdpp和tgdpp,利用专用测定试剂和全自动酶免疫分析装置aia-600ii(东曹株式会社制),gdf15使用市售elisa试剂盒(r&d公司)计算出测定值。将各种测定值的箱形图示于图6,将基于曼-惠特尼u检验的差异显著性检验结果示于表9。
[0167]
[表9]
[0168]
表9
[0169][0170]
肺癌转移性骨肿瘤或乳腺癌转移性骨肿瘤的判断性能显示出igdpp最优异。gdf15也观察到相对良好的判断性能,但认为在一部分健康人中血中浓度上升而导致判断性能降低。
[0171]
接着,通过roc曲线解析实施了肺癌转移性骨肿瘤或乳腺癌转移性骨肿瘤的判断性能。将解析结果示于图7,将auc示于表10。
[0172]
[表10]
[0173]
表10
[0174][0175]
肺癌转移性骨肿瘤或乳腺癌转移性骨肿瘤的判断性能均显示出igdpp最优异。
[0176]
根据本发明的上述实施例,显示出:与作为骨转移指标的alp相比,gdpp前肽的转移性骨肿瘤的判断性能显著高。进而,使用血浆待检体的情况,igdpp显示出比gdf15更优异的转移性骨肿瘤的判断性能。
[0177]
《实施例6》非去势抵抗性前列腺癌(crpc)的前列腺癌(非crpc)的血清待检体中的转移性骨肿瘤的判断性能
[0178]
将依据crpc/非crpc、无/有转移性骨肿瘤对实施例2中使用的前列腺癌血清待检体组(共计40个病例)进行分类的详细情况示于表11。
[0179]
[表11]
[0180]
表11
[0181][0182]
该研究中,测定igdpp、tgdpp、gdf15和碱性磷酸酶(alp),对crpc组和非crpc组中的转移性骨肿瘤的判断性能进行了比较。对于igdpp和tgdpp,利用专用测定试剂和全自动酶免疫分析装置aia-600ii(东曹株式会社制),gdf15使用市售elisa试剂盒(r&d公司)计算出测定值。alp参照最接近采血的保险诊疗时的测定值。将crpc组的各种测定值的箱形图示于图8,将非crpc组的各种测定值的箱形图示于图9,将基于曼-惠特尼u检验的差异显著性检验结果示于表12。
[0183]
[表12]
[0184]
表12
[0185][0186]
在crpc组中任意标记物均未观察到显著性差异,但在非crpc组中igdpp和tgdpp观察到显著性差异。
[0187]
接着,通过受试者工作特征(roc)曲线解析实施了非crpc组中的转移性骨肿瘤的判断性能。将解析结果示于图10,将auc(area under the curve、roc曲线下面积)示于表13。
[0188]
[表13]
[0189]
表13
[0190][0191]
关于非crpc组中的转移性骨肿瘤的判断性能,igdpp和tgdpp与包括alp在内的其它标记物相比显示出优异。
[0192]
《实施例7》肺癌的血清和血浆待检体中的转移性骨肿瘤的判断性能
[0193]
将本实施例中使用的血清和血浆待检体组(共计27个病例)的详细情况示于表14(转移性骨肿瘤的血浆待检体为与实施例5相同的病例)。使用的待检体从bioreclamationivt公司/promeddx公司购入,产品随附资料中明确记载了利用伦理委员会批准的方案进行收集。
[0194]
[表14]
[0195]
表14
[0196][0197]
该研究中,测定igdpp、tgdpp,对肺癌中的转移性骨肿瘤的判断性能进行了比较。igdpp和tgdpp使用专用测定试剂和全自动酶免疫分析装置aia-600ii(东曹株式会社制)计算出测定值。将各种测定值的箱形图示于图11,将基于曼-惠特尼u检验的差异显著性检验结果示于表15。
[0198]
[表15]
[0199]
表15
[0200][0201]
在血清待检体中未观察到显著性差异,但在血浆待检体中igdpp和tgdpp均观察到显著性差异。由于评价不是基于同一病例的血清/血浆对待检体,因此不能一概而论,但作为血清和血浆之间的判断性能不同的原因,可认为是基于蛋白酶的降解等待检体中的稳定性所引起的影响。
[0202]
接着,通过受试者工作特征(roc)曲线解析实施了肺癌中的转移性骨肿瘤的判断性能。将解析结果示于图12,将auc(area under the curve、roc曲线下面积)示于表16。
[0203]
[表16]
[0204]
表16
[0205][0206]
显示出血浆待检体的igdpp或者tgdpp的测定具有优异的肺癌转移性骨肿瘤的判断性能。
[0207]
《实施例8》乳腺癌的血清和血浆待检体中的转移性骨肿瘤的判断性能
[0208]
将本实施例中使用的血清和血浆待检体组(共计28个病例)的详细情况示于表17(转移性骨肿瘤的血浆待检体为与实施例5相同的病例)。使用的待检体从bioreclamationivt公司/promeddx公司购入,产品随附资料中明确记载了利用伦理委员会批准的方案进行收集。
[0209]
[表17]
[0210]
表17
[0211][0212]
该研究中,测定igdpp、tgdpp,对乳腺癌中的转移性骨肿瘤的判断性能进行了比较。igdpp和tgdpp使用专用测定试剂和全自动酶免疫分析装置aia-600ii(东曹株式会社制)计算出测定值。将各种测定值的箱形图示于图13,将基于曼-惠特尼u检验的差异显著性检验结果示于表18。
[0213]
[表18]
[0214]
表18
[0215][0216]
关于乳腺癌的转移性骨肿瘤,虽然存在一部分gdpp浓度上升的病例,但病例数较少,未观察到统计学的差异显著性。
[0217]
接着,通过受试者工作特征(roc)曲线解析实施了乳腺癌中的转移性骨肿瘤的判断性能。将解析结果示于图14,将auc(area under the curve、roc曲线下面积)示于表19。
[0218]
[表19]
[0219]
表19
[0220][0221]
关于乳腺癌中的转移性骨肿瘤判断,血浆待检体的tgdpp测定中显示出稍稍良好的性能。
[0222]
《实施例9》各种癌血浆待检体中的转移性骨肿瘤的判断性能
[0223]
将本实施例中使用的血浆待检体组(共计34个病例)的详细情况示于表20。使用的待检体从bioreclamationivt公司/promeddx公司购入,产品随附资料中明确记载了利用伦理委员会批准的方案进行收集。
[0224]
[表20]
[0225]
表20
[0226] 病例数健康5甲状腺癌转移性骨肿瘤2胰腺癌转移性骨肿瘤1膀胱癌转移性骨肿瘤1大肠癌转移性骨肿瘤6黑色素瘤转移性骨肿瘤4骨髓瘤转移性骨肿瘤10淋巴瘤转移性骨肿瘤5
[0227]
该研究中,测定igdpp和tgdpp,对各种癌中的转移性骨肿瘤的判断性能进行了比较。igdpp和tgdpp使用专用测定试剂和全自动酶免疫分析装置aia-600ii(东曹株式会社制)计算出测定值。将各种测定值的箱形图示于图15。
[0228]
虽然存在病例数少的癌症种类、无法进行满意的差异显著性检验的评价,但与健康人相比,igdpp和tgdpp的血中浓度显著上升,显示出能够判断各种癌症的转移性骨肿瘤。
[0229]
产业上的可利用性
[0230]
根据本发明,提供能够检测癌(其中,不包括crpc)的骨转移的方法和试剂。由此,利用血液诊断等能够简便且高精度地检测难以通过现有的骨代谢标记物判断的癌(其中,不包括crpc)是否发生骨转移。其结果,简化了癌(其中,不包括crpc)的骨转移的检测,使得治疗法的选择以及治疗效果判定成为可能,因此在产业上是非常有用的。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。