基于丝素蛋白的微针及其用途
1.相关申请
2.本技术要求2019年10月9日提交的美国序列号62/912,832的优先权。前述申请的内容通过引用整体并入本文。
技术领域
3.本公开总体上涉及基于丝素蛋白的微针,其配置为释放治疗剂,如抗癌剂、免疫调节剂或其组合,以治疗患有疾病或病症例如癌症的受试者。
背景技术:
4.由于皮肤最外层——角质层的高效屏障性质,故将药物递送到皮肤中以产生局部或全身作用是极其困难的。微针装置包括亚毫米针,其设计为微创的并绕过角质层进入皮肤的微循环以通过透皮途径实现治疗剂的局部和/或全身递送。然而,传统的微针设计和材料伴随着各种限制,这些限制会连累其生产并限制其性能(参见例如donnelly等人,drug deliv.17(4):187-207,2010)。具体而言,难以设计一种既具有足够的机械强度以刺穿角质层又具有引入并随后释放有效量的治疗剂的能力的微针。需要改进的微针设计和制造方法。
技术实现要素:
5.本公开至少部分地基于以下认识:丝素蛋白具有适用于微针制造中的性质,包括全水处理(all-aqueous processing)、机械强度、生物相容性以及稳定和控制各种治疗剂从基于丝的基质的释放的能力。另外,本公开至少部分地基于以下认识:向肿瘤部位局部施用治疗剂如抗癌剂和/或免疫调节剂可导致施用部位处或施用部位附近肿瘤生长的抑制并还可导致全身免疫应答而消融远处部位处的肿瘤。此外,某些疾病如癌症与肿瘤特异性抗原(例如,新抗原)相关,这些抗原通过抗原呈递细胞(apc)不良和/或低效地呈递给受试者的免疫系统,例如由于免疫抑制肿瘤微环境(tme)。不希望受理论束缚,本公开提供了基于丝素蛋白的微针和基于丝素蛋白的微针装置,其可用于例如通过施用有效量的抗癌剂、免疫调节剂或其组合来改变肿瘤微环境,从而促进肿瘤特异性抗原(例如,新抗原)向受试者体内的apc的呈递并产生对肿瘤特异性抗原稳健且持久的免疫(例如,癌症免疫)。在一些实施方案中,基于丝素蛋白的微针和基于丝素蛋白的微针装置可用于递送患者特异性新抗原(例如,癌症疫苗)以经由治疗剂如抗癌剂和/或免疫调节剂在受试者中的持续释放来实现增强的免疫。
6.本公开提供了基于丝素蛋白的微针和基于丝素蛋白的微针装置,其配置为向受试者(例如,人类受试者)引入并随后释放(例如,施用)有效量的治疗剂或治疗剂的组合。在一些实施方案中,基于丝素蛋白的微针和基于丝素蛋白的微针装置包含抗癌剂、免疫调节剂或其组合。在一些实施方案中,本文公开的微针可与第二治疗剂或过程如癌症疗法(例如,抗癌剂、免疫疗法、光动力疗法(pdt)、手术和/或放射中的一种或多种)组合使用。
7.所公开的基于丝素蛋白的微针可配置为根据各种释放动力学如突然释放(例如,在施用于生物屏障如皮肤、粘液表面、肿瘤、口腔或颊腔后立即或快速溶解,通常在数分钟内发生)和/或持续释放来释放治疗剂或治疗剂的组合(例如,抗癌剂、免疫调节剂或其组合)。持续释放的实例包括但不限于零级释放(例如,释放速率与剂型中的治疗剂浓度无关,例如,释放速率在一段时间内大致恒定,例如,每单位时间消除恒定量的治疗剂)、一级释放(例如,释放速率为剂型中剩余的治疗剂的量的函数,例如,每单位时间消除恒定比例如百分数的药物)和二级释放(例如,其中将剂量中的治疗剂浓度加倍,释放速率将增至四倍)。在一些实施方案中,微针的一部分配置为用于第一类型的释放,例如突然释放,而微针的另一部分配置为用于第二类型的释放,例如持续释放。此外,治疗剂(例如,抗癌剂、免疫调节剂或其组合)从本文所述的基于丝素蛋白的微针的释放(例如,施用)可通过以下来促进:所述治疗剂从所述微针或其一部分的扩散;所述微针或其一部分的降解(例如,蛋白酶介导的降解);和/或所述微针或其一部分的溶解。
8.所公开的基于丝素蛋白的微针可配置为具有足够的机械性质(例如,强度)和合适的几何形状(例如,尖端锐度、尖端夹角、长度、针间间距)以刺穿生物屏障(例如,皮肤、肿瘤、组织、细胞膜、粘液表面、口腔、或颊腔),从而实现治疗剂或治疗剂的组合(例如,抗癌剂、免疫调节剂或其组合)向受试者的局部和/或全身递送。在一些实施方案中,本文描述的微针或装置配置为将治疗剂(例如,抗癌剂、免疫调节剂或其组合)施用至肿瘤部位(例如,肿瘤内和/或肿瘤周围)。在一些实施方案中,本文描述的微针或装置配置为将治疗剂(例如,抗癌剂、免疫调节剂或其组合)施用至皮肤病变部位。
9.在一些实施方案中,通过本文描述的基于丝素蛋白的微针或基于丝素蛋白的微针装置将治疗剂(例如,抗癌剂、免疫调节剂或其组合)局部施用至肿瘤和/或皮肤病变的部位可在施用部位处或施用部位附近引起抗癌作用(例如,抑制肿瘤生长),并任选地可引起全身性抗癌作用(例如,免疫应答)而消融远处部位的肿瘤。
10.在一些实施方案中,基于丝素蛋白的微针和基于丝素蛋白的微针装置与护理标准治疗(例如,针对癌症或皮肤病况的护理标准治疗)组合施用,所述护理标准治疗任选地选自手术、化学疗法、免疫疗法、靶向疗法、激素疗法和/或放射疗法。
11.还公开了制造和使用这样的微针来在受试者中治疗疾病例如癌症的方法。
12.本领域技术人员应认识或者能够使用不超过常规的实验确定本文描述的本公开的具体实施方案的许多等同物。这样的等同物旨在为以下实施方案(e)所涵盖。
13.e1.一种微针装置(例如,微针贴剂),其包含多根基于丝素蛋白的微针,其中所述多根微针包含:
14.包含抗癌剂的第一微针;和
15.包含免疫调节剂的第二微针,
16.任选地,包含抗癌剂和/或免疫调节剂的第三微针,
17.其中所述第一和/或第二微针包含丝素蛋白(例如,再生丝素蛋白和/或重组丝素蛋白),并且所述微针装置配置为向受试者递送所述抗癌剂和所述免疫调节剂。
18.e2.一种微针装置(例如,微针贴剂),其包含多根基于丝素蛋白的微针,其中所述多根微针包含:
19.两根或更多根包含抗癌剂的微针,
20.其中所述两根或更多根微针包含丝素蛋白(例如,再生丝素蛋白和/或重组丝素蛋白),并且所述微针装置配置为向受试者递送所述抗癌剂。
21.e3.一种微针装置(例如,微针贴剂),其包含多根基于丝素蛋白的微针,其中所述多根微针包含:
22.两根或更多根包含免疫调节剂的微针,
23.其中所述两根或更多根微针包含丝素蛋白(例如,再生丝素蛋白和/或重组丝素蛋白),并且所述微针装置配置为向受试者递送所述免疫调节剂,任选地,其中所述免疫调节剂增强对癌症的免疫应答。
24.e4.根据前述实施方案中任一项所述的微针装置,其中所述多根微针中的第一和/或第二微针包含:
25.(i)基底(例如,可溶解基底),
26.(ii)丝素蛋白尖端(例如,可植入的丝素蛋白尖端),其包含施加于基底的丝素蛋白,和
27.(iii)(任选的)施加于基底的背衬。
28.e5.多根微针,其中所述多根微针包含:
29.包含抗癌剂的第一微针;和
30.包含免疫调节剂的第二微针,
31.任选地,包含抗癌剂和/或免疫调节剂的第三微针,
32.其中所述第一和/或第二微针包含丝素蛋白,例如,再生丝素蛋白和/或重组丝素蛋白。
33.e6.多根微针,其中所述多根微针包含:
34.包含抗癌剂的第一微针;和
35.包含抗癌剂的第二微针,
36.其中所述第一和/或第二微针包含丝素蛋白,例如,再生丝素蛋白和/或重组丝素蛋白。
37.e7.多根微针,其中所述多根微针包含:
38.包含免疫调节剂的第一微针;和
39.包含免疫调节剂的第二微针,
40.其中所述第一和/或第二微针包含丝素蛋白,例如,再生丝素蛋白和/或重组丝素蛋白。
41.e8.根据实施方案e4所述的微针装置,其中所述丝素蛋白尖端包含抗癌剂和/或免疫调节剂。
42.e9.根据实施方案e4所述的微针装置,其中所述基底包含抗癌剂和/或免疫调节剂。
43.e10.根据前述实施方案中任一项所述的微针装置或多根微针,其中所述微针配置为刺穿生物屏障(例如,皮肤)。
44.e11.根据实施方案e4或e8所述的微针装置,其中微针配置为将丝素蛋白尖端植入到受试者的生物屏障(例如,皮肤)中。
45.e12.根据实施方案e1-e4或e8-e11中任一项所述的微针装置,其中所述微针装置
配置为实现抗癌剂和/或免疫调节剂向受试者的局部和/或全身递送(例如,释放)。
46.e13.根据实施方案e1-e4或e8-e12中任一项所述的微针装置,其中所述微针装置配置为向受试者递送有效量的抗癌剂和/或免疫调节剂。
47.e14.根据实施方案e4或e8所述的微针装置,其中所述丝素蛋白尖端包含再生丝素蛋白和/或重组丝素蛋白。
48.e15.根据前述实施方案中任一项所述的微针装置或多根微针,其配置为递送(例如,释放)两种或更多种抗癌剂(例如,三种或更多种、四种或更多种、或者五种或更多种抗癌剂)。
49.e16.根据前述实施方案中任一项所述的微针装置或多根微针,其配置为递送(例如,释放)两种或更多种免疫调节剂(例如,三种或更多种、四种或更多种、或者五种或更多种免疫调节剂)。
50.e17.根据前述实施方案中任一项所述的微针装置或多根微针,其中所述多根微针包含至少一根另外的微针,其中所述另外的微针包含相同的第一抗癌剂。
51.e18.根据前述实施方案中任一项所述的微针装置或多根微针,其中所述多根微针包含至少一根另外的微针,其中所述另外的微针包含与第一抗癌剂不同的抗癌剂(“第二抗癌剂”)。
52.e19.根据前述实施方案中任一项所述的微针装置或多根微针,其中所述多根微针包含至少一根另外的微针,其中所述另外的微针包含相同的第一免疫调节剂。
53.e20.根据前述实施方案中任一项所述的微针装置或多根微针,其中所述多根微针包含至少一根另外的微针,其中所述另外的微针包含与第一免疫调节剂不同的免疫调节剂(“第二免疫调节剂”)。
54.e21.根据前述实施方案中任一项所述的微针装置或多根微针,其中所述多根微针包含另外的基于丝素蛋白的微针,所述另外的基于丝素蛋白的微针包含第二抗癌剂。
55.e22.根据前述实施方案中任一项所述的微针装置或多根微针,其中所述多根微针包含另外的基于丝素蛋白的微针,所述另外的基于丝素蛋白的微针包含第二免疫调节剂。
56.e23.根据前述实施方案中任一项所述的微针装置或多根微针,其包含多根所述第一、第二和/或另外的微针。
57.e24.根据实施方案e1、e2、e4-e6或e8-e23中任一项所述的微针装置或多根微针,其中所述抗癌剂选自小分子(例如,化疗药物)、生物制剂(例如,抗体)、病毒癌症治疗剂、纳米药物和核酸分子(例如,dna和/或rna)中的一种或多种。
58.e25.根据实施方案e1、e2、e4-e6或e8-e24中任一项所述的微针装置或多根微针,其中所述抗癌剂不为化疗核苷酸。
59.e26.根据实施方案e1、e2、e4-e6或e8-e25中任一项所述的微针装置或多根微针,其中所述抗癌剂为mrna,任选地其中所述mrna编码抗癌剂和/或免疫调节剂,任选地其中所述mrna编码检查点抑制剂、tlr激动剂、sting激动剂、rig激动剂、癌症疫苗、靶向疗法和/或细胞因子。
60.e27.根据实施方案e1、e2、e4-e6或e8-e26中任一项所述的微针装置或多根微针,其中所述抗癌剂选自以下中的一种或多种:吉西他滨维莫非尼
达拉非尼曲美替尼多柔比星康奈非尼考比替尼比美替尼达卡巴嗪(dtic)、替莫唑胺伊匹单抗派姆单抗纳武单抗阿地白介素重组干扰素alfa-2b(内含子a)、聚乙二醇干扰素alfa-2b(peg-内含子/sylatron)、奥沙利铂和拉他莫基(talimogene laherparepvec)
61.e28.根据实施方案e1、e3-e5或e7-e27中任一项所述的微针装置或多根微针,其中所述免疫调节剂选自检查点抑制剂、toll样受体(tlr)激动剂、sting激动剂、rig激动剂、癌症疫苗和细胞因子。
62.e29.根据实施方案e28所述的微针装置或多根微针,其中所述检查点抑制剂抑制选自以下的检查点分子:ctla4、pd1、pd-l1、pd-l2、tim3、lag3、cd160、2b4、cd80、cd86、b7-h3(cd276)、b7-h4(vtcn1)、hvem(tnfrsf14或cd270)、btla、kir、mhc i类、mhc ii类、gal9、vista、btla、tigit、lair1和a2ar。
63.e30.根据实施方案e28或e29所述的微针装置或多根微针,其中所述检查点抑制剂为pd-1抑制剂。
64.e31.根据实施方案e28或e29所述的微针装置或多根微针,其中所述检查点抑制剂为ctla4抑制剂。
65.e32.根据实施方案e28所述的微针装置或多根微针,其中所述tlr激动剂选自tlr-1激动剂、tlr-2激动剂、tlr-3激动剂、tlr-4激动剂、tlr-5激动剂、tlr-6激动剂、tlr-7激动剂、tlr-8激动剂、tlr-9激动剂、tlr-10激动剂、tlr-1/2激动剂、tlr-2/6激动剂或tlr-7/8激动剂。
66.e33.根据实施方案e28或e32所述的微针装置或多根微针,其中所述tlr激动剂为tlr-7激动剂。
67.e34.根据实施方案e28或e32所述的微针装置或多根微针,其中所述tlr激动剂为tlr-9激动剂(例如,未甲基化的cg二核苷酸(cpg odn))。
68.e35.根据实施方案e28所述的微针装置或多根微针,其中所述sting激动剂为环状二核苷酸,例如包含嘌呤或嘧啶核碱基(例如,腺苷、鸟嘌呤、尿嘧啶、胸腺嘧啶或胞嘧啶核碱基)的环状二核苷酸,任选地双-(3'-5')-环状二聚鸟苷单磷酸(c-di-gmp)。
69.e36.根据实施方案e28所述的微针装置或多根微针,其中所述细胞因子为gm-csf、il-1α、il-1β、il-2、il-3、il-4、il-5、il-6、il-7、il-8、il-10、il-12、il-15、il-21、ifn-α、ifn-β、ifn-γ、mip-1α、mip-1β、tgf-β、tnf-α和tnfβ。
70.e37.根据实施方案e28所述的微针装置或多根微针,其中所述细胞因子为gm-csf、il-1α、il-1β、il-2、il-3、il-4、il-5、il-6、il-7、il-8、il-10、il-12、il-15、il-18、il-21、ifn-α、ifn-β、ifn-γ、mip-1α、mip-1β、tgf-β、tnf-α或tnfβ。
71.e38.根据实施方案e28或e36所述的微针装置或多根微针,其中所述细胞因子为il-2。
72.e39.根据实施方案e28或e36所述的微针装置或多根微针,其中所述细胞因子为
il-12。
73.e40.根据实施方案e28或e36所述的微针装置或多根微针,其中所述细胞因子为il-15。
74.e41.根据实施方案e28或e37所述的微针装置或多根微针,其中所述细胞因子为il-18。
75.e42.根据实施方案e28、e36或e37中任一项所述的微针装置或多根微针,其中所述细胞因子为工程化细胞因子。
76.e43.根据实施方案e28、e36或e37中任一项所述的微针装置或多根微针,其中所述细胞因子为工程化白介素(例如,工程化il-2或il-18)。
77.e44.根据实施方案e28、e36或e37中任一项所述的微针装置或多根微针,其中所述细胞因子为工程化白介素-2。
78.e45.根据实施方案e28或e37所述的微针装置或多根微针,其中所述细胞因子为工程化白介素18。
79.e46.根据实施方案e28、e36或e37中任一项所述的微针装置或多根微针,其中所述细胞因子为抗诱饵白介素。
80.e47.根据实施方案e28或e37所述的微针装置或多根微针,其中所述细胞因子为抗诱饵白介素18。
81.e48.根据实施方案e28或e36所述的微针装置或多根微针,其中所述细胞因子为gm-csf。
82.e49.根据前述实施方案中任一项的微针装置或多根微针,其配置为与以下中的一种或多种组合地施用抗pd1抗体和/或抗ctla4抗体:
83.(i)il-2;
84.(ii)il-12;
85.(iii)il-15;
86.(iv)吉西他滨
87.(v)维莫非尼
88.(vi)达拉非尼
89.(vii)曲美替尼
90.(viii)多柔比星
91.(ix)c-di-gmp;
92.(x)mrna;
93.(xi)tlr-9激动剂(例如,未甲基化的cg二核苷酸(cpg odn));
94.(xii)奥沙利铂;和
95.(xiii)gm-csf。
96.e50.根据前述实施方案中任一项所述的微针装置或多根微针,其配置为与以下中的一种或多种组合地施用抗pd1抗体和/或抗ctla4抗体:
97.(i)il-2;
98.(ii)il-12;
99.(iii)il-15;
100.(iv)il-18
101.(v)吉西他滨
102.(vi)维莫非尼
103.(vii)达拉非尼
104.(viii)曲美替尼
105.(ix)多柔比星
106.(x)c-di-gmp;
107.(xi)mrna;
108.(xii)tlr-9激动剂(例如,未甲基化的cg二核苷酸(cpg odn));
109.(xiii)奥沙利铂;和
110.(xiv)gm-csf。
111.e51.根据实施方案e28或e37所述的微针装置或多根微针,其配置为与il-2、il-12或il-18中的一种或多种组合地施用抗pd1抗体和/或抗ctla4抗体。
112.e52.根据前述实施方案中任一项所述的微针装置或多根微针,其配置为与il-2和il-12组合地施用抗pd1抗体和/或抗ctla4抗体。
113.e53.根据前述实施方案中任一项所述的微针装置或多根微针,其配置为与il-2和tlr-9激动剂(例如,未甲基化的cg二核苷酸(cpg odn))组合地施用抗pd1抗体和/或抗ctla4抗体。
114.e54.根据前述实施方案中任一项所述的微针装置或多根微针,其配置为施用il-2和c-di-gmp、任选地il-12。
115.e55.根据前述实施方案中任一项所述的微针装置或多根微针,其配置为施用il-12和c-di-gmp、任选地il-2。
116.e56.根据前述实施方案中任一项所述的微针装置或多根微针,其配置为施用癌症疫苗,任选地其中所述癌症疫苗包含肿瘤抗原,例如新抗原。
117.e57.一种微针,所述微针包含:
118.(i)基底(例如,可溶解基底),
119.(ii)可植入的丝素蛋白尖端,其包含施加或附接于基底的丝素蛋白,和
120.(iii)(任选的)施加于基底的背衬,
121.其中所述微针配置为将丝素蛋白尖端植入到受试者例如人类受试者的生物屏障(例如,皮肤)中,
122.其中所述丝素蛋白尖端包含丝素蛋白,例如,再生丝素蛋白和/或重组丝素蛋白,
123.其中所述丝素蛋白尖端还包含足以诱导抗癌应答的量的抗癌剂。
124.e58.包含根据实施方案e57所述的微针的微针装置或多根微针,任选地,其中所述多根微针中的至少两根微针包含相同的抗癌剂或不同的抗癌剂。
125.e59.一种微针,所述微针包含:
126.(i)基底(例如,可溶解基底),
127.(ii)可植入的丝素蛋白尖端,其包含施加于基底的丝素蛋白,和
128.(iii)(任选的)施加于基底的背衬,
129.其中所述微针配置为将丝素蛋白尖端植入到受试者例如人类受试者的生物屏障(例如,皮肤)中,
130.其中所述丝素蛋白尖端包含丝素蛋白,例如,再生丝素蛋白和/或重组丝素蛋白,
131.其中所述丝素蛋白尖端还包含足以刺激和/或抑制免疫系统的量的免疫调节剂。
132.e60.根据实施方案e1、e3-e5、e7-e56或e59中任一项所述的微针装置或多根微针,任选地,其中所述多根微针中的至少两根微针包含相同的免疫调节剂或不同的免疫调节剂。
133.e61.包含多根基于丝素蛋白的微针的微针装置,其中所述多根微针包含一根或多根根据前述实施方案中任一项所述的微针。
134.e62.根据前述实施方案中任一项所述的微针装置、多根微针或微针,其中所述装置、多根微针或微针配置为持续释放抗癌剂和/或免疫调节剂。
135.e63.根据实施方案e62所述的微针装置、多根微针或微针,其中所述持续释放包括基本上连续低剂量施用所述抗癌剂和/或所述免疫调节剂。
136.e64.根据实施方案e62或e63所述的微针装置、多根微针或微针,其中所述持续释放包括连续施用丝素蛋白尖端中存在的抗癌剂的总量和/或免疫调节剂的总量的约大于0%份至约100%份。
137.e65.根据实施方案e62-e64中任一项所述的微针装置、多根微针或微针,其中所述持续释放是在包括至少约3天(例如,约3、4、5、6、7天或更多天,例如,约5天至约10天,例如,约7天至约15天,例如,约1周至约2周、约1周至约3周、或约2周至约4周,例如,约1个月至约3个月,例如,约2个月至约4个月,例如,约3个月至约6个月)的时间段内。
138.e66.根据实施方案e62-e65中任一项所述的微针装置、多根微针或微针,其中所述持续释放是在约2天至约28天的时间段内。
139.e67.根据实施方案e62-e66中任一项所述的微针装置、多根微针或微针,其中所述持续释放是在约5天至约21天的时间段内。
140.e68.根据前述实施方案中任一项所述的微针装置、多根微针或微针,其配置为释放有效量的抗癌剂和/或免疫调节剂以增强受试者的免疫系统的暴露于与癌症相关的新抗原(例如,肿瘤细胞裂解后释放的新抗原),从而诱导和/或扩增对该新抗原特异性的免疫效应细胞,例如t细胞。
141.e69.根据前述实施方案中任一项所述的微针装置、多根微针或微针,其配置为释放有效量的抗癌剂和/或免疫调节剂以诱导t细胞激活和/或克服肿瘤微环境中的免疫抑制。
142.e70.根据前述实施方案中任一项所述的微针装置、多根微针或微针,其中所述装置、多根微针或微针配置为突然释放所述抗癌剂和/或所述免疫调节剂。
143.e71.根据实施方案e70所述的微针装置、多根微针或微针,其中所述突然释放包括快速施用所述抗癌剂和/或所述免疫调节剂。
144.e72.根据实施方案e70或e71所述的微针装置、多根微针或微针,其中所述突然释
放包括快速施用丝素蛋白尖端中存在的抗癌剂的总量和/或免疫调节剂的总量的大于0%份至约100%份。
145.e73.根据实施方案e70-e72中任一项所述的微针装置、多根微针或微针,其中所述突然释放是在包括至少约1小时(例如,约1至约30分钟,例如,约1、2、3、4、5、6、7、8、9、10、15、20或24小时)的时间段内。
146.e74.根据实施方案e12、e15、e16或e62-e73中任一项所述的微针装置、多根微针或微针,其中所述抗癌剂的释放以与所述免疫调节剂的释放基本上相同的速率(例如,同时地)发生。
147.e75.根据实施方案e12、e15、e16或e62-e74中任一项所述的微针装置、多根微针或微针,其中所述抗癌剂的释放以与所述免疫调节剂的释放不同的速率发生,使得抗癌剂基本上在免疫调节剂的释放之前或基本上在免疫调节剂的释放之后释放。
148.e76.根据前述实施方案中任一项所述的微针装置、多根微针或微针,其配置为施加(例如,施用)到选自皮肤层、细胞膜、粘液表面、口腔或颊腔的生物屏障。
149.e77.根据前述实施方案中任一项所述的微针装置、多根微针或微针,其配置为施加(例如,施用)到肿瘤(例如,转移性肿瘤)。
150.e78.根据前述实施方案中任一项所述的微针装置、多根微针或微针,其配置为在肿瘤切除之后施加(例如,施用)到肿瘤部位,例如以诱导对肿瘤的免疫应答和/或消融切除之后留下的任何癌细胞。
151.e79.根据前述实施方案中任一项所述的微针装置、多根微针或微针,其配置为在肿瘤切除之前施加(例如,施用)到肿瘤部位,例如以诱导对肿瘤的免疫应答和/或消融切除之后留下的任何癌细胞。
152.e80.根据前述实施方案中任一项所述的微针装置、多根微针或微针,其配置为施加(例如,施用)到皮肤。
153.e81.根据前述实施方案中任一项所述的微针装置、多根微针或微针,其配置为施加(例如,施用)到眼睛。
154.e82.根据前述实施方案中任一项所述的微针装置、多根微针或微针,其配置为施加(例如,施用)到口腔。
155.e83.根据前述实施方案中任一项所述的微针装置、多根微针或微针,其配置为在肿瘤内施加(例如,施用)。
156.e84.根据前述实施方案中任一项所述的微针装置、多根微针或微针,其配置为在肿瘤周围施加(例如,施用)。
157.e85.根据前述实施方案中任一项所述的微针装置、多根微针或微针,其配置为施加(例如,施用)到皮肤病变或邻近皮肤病变(例如,与癌症或癌前病况相关的皮肤病变)。
158.e86.根据实施方案e12所述的微针装置,其中所述局部和/或全身递送(例如,释放)导致:
159.(i)施用部位处或附近肿瘤生长的抑制;
160.(ii)局部免疫应答的诱导以消融施用部位处或附近的肿瘤;
161.(iii)肿瘤微环境中激活的免疫效应细胞(例如,t细胞)的增加;
162.(iv)局部免疫抑制细胞(例如,调节性t细胞(treg))的减少;
163.(v)全身免疫应答的诱导以消融远处部位处的肿瘤;
164.(vi)对癌症或癌前病况的免疫记忆;和/或
165.(vii)对肿瘤抗原如新抗原的免疫应答;和/或
166.(viii)癌症再发(例如,癌症复发)的预防和/或抑制。
167.e87.根据实施方案e4或e57-e59中任一项所述的微针装置、多根微针或微针,其中所述背衬选自固体支撑物,例如基于纸的材料、塑料材料、聚合物材料或基于聚酯的材料(例如,whatman 903纸、聚合物胶带、塑料胶带、粘合剂背衬聚酯胶带或其他医用胶带)。
168.e88.根据实施方案e4、e9、e57-e59或e87中任一项所述的微针装置、多根微针或微针,其中所述基底(例如,可溶解基底)包含以下中的两种或更多种:
169.(i)多糖(例如,右旋糖酐);
170.(ii)二糖(例如,蔗糖、麦芽糖和海藻糖);
171.(iii)聚合物(例如,甲基纤维素、聚乙二醇(peg)、羧甲基纤维素(cmc)、聚乙烯基吡咯烷酮(pvp)、聚乙烯醇(pva)和透明质酸盐);
172.(iv)蛋白质(例如,明胶);
173.(v)增塑剂(例如,甘油、丙二醇);和
174.(vi)表面活性剂(例如,辛基酚乙氧基化物(例如,triton-x)、聚山梨酯、泊洛沙姆和/或聚乙氧基化醇)。
175.e89.根据实施方案e4、e9、e57-e59、e87或e88中任一项所述的微针装置、多根微针或微针,其中所述基底包含以下中的一种或多种:明胶、右旋糖酐、甘油、聚乙二醇(peg)(例如,包括低分子量peg)、蔗糖、海藻糖、麦芽糖、羧甲基纤维素(cmc)、聚乙烯基吡咯烷酮(pvp)、聚乙烯醇(pva)、透明质酸盐、甲基纤维素和/或表面活性剂(例如,辛基酚乙氧基化物(例如,triton-x)、聚山梨酯、泊洛沙姆如p188、和/或聚乙氧基化醇),任选地其中所述微针配置用于持续释放和/或突然释放。
176.e90.根据实施方案e4、e9、e57-e59或e87-e89中任一项所述的微针装置、多根微针或微针,其中所述基底包含右旋糖酐、蔗糖、甘油和表面活性剂,任选地配置用于持续释放。
177.e91.根据实施方案e62-e67、e89或e90中任一项所述的配置用于持续释放的微针装置、多根微针或微针,其包含(任选地,其中这是用于浇铸的溶液和/或经干燥、凝固的基底的组合物):
178.(i)约20%至约40%、例如30%的70kda右旋糖酐;
179.(ii)约5%至约15%、例如约10%的蔗糖;
180.(iii)约0.5%至约2.5%、例如约1%的甘油;和
181.(iv)约0.001%至约1%、例如约0.01%的triton-x。
182.e92.根据实施方案e88-e91中任一项所述的微针装置、多根微针或微针,其中所述右旋糖酐具有约30kd至约600kda的分子量。
183.e93.根据实施方案e88-e92中任一项所述的微针装置、多根微针或微针,其中所述右旋糖酐衍生自肠膜明串珠菌(leuconostoc mesenteroides)。
184.e94.所述实施方案e4、e8、e9、e57-e59、e87或e88-e93中任一项所述的微针装置、多根微针或微针,其中所述基底包含聚乙烯醇(pva)和蔗糖,任选地配置用于突然释放。
185.e95.根据实施方案e70-e72、e89或e94中任一项所述的配置用于突然释放的微针
装置、多根微针或微针,其包含(任选地,其中这是用于浇铸的溶液和/或经干燥、凝固的基底的组合物):
186.(i)约15%至约20%、例如约18%的pva;
187.(ii)约25%至约75%的蔗糖,例如约50%的蔗糖;
188.(iii)约25%至约75%的pva,例如约50%的pva;和
189.(iv)约15%至约20%、例如约18%的蔗糖。
190.e96.根据实施方案e4、e8、e9、e57-e59、e87或e88-e95中任一项所述的微针装置、多根微针或微针,其中所述基底不包含聚(丙烯酸)(paa)。
191.e97.根据实施方案e4、e8、e9-e96中任一项所述的微针装置、多根微针或微针,其中所述丝素蛋白尖端包含以下中的两种或更多种:
192.(i)二糖(例如,蔗糖、麦芽糖和海藻糖);
193.(ii)聚合物(例如,甲基纤维素、聚乙二醇(peg)、羧甲基纤维素(cmc)、聚乙烯基吡咯烷酮(pvp)、聚乙烯醇(pva)、透明质酸盐);
194.(iii)氨基酸(例如,苏氨酸);
195.(iv)增塑剂(例如,甘油、丙二醇);和
196.(v)缓冲剂(例如,pbs)。
197.e98.根据实施方案e4、e8、e9-e97中任一项所述的微针装置、多根微针或微针,其中所述丝素蛋白尖端包含赋形剂。
198.e99.根据实施方案e4、e8、e9-e98中任一项所述的微针装置、多根微针或微针,其中所述丝素蛋白尖端包含羧甲基纤维素(cmc)、蔗糖和苏氨酸中的一种或多种。
199.e100.根据实施方案e4、e8、e9-e99中任一项所述的微针装置、多根微针或微针,其中所述丝素蛋白尖端包含缓冲剂,任选地磷酸盐缓冲盐水(pbs)。
200.e101.根据实施方案e70-e72、e89、e94或e95中任一项所述的微针装置、多根微针或微针,其中配置用于突然释放的丝素蛋白尖端包含约2%至约8%的蔗糖(例如,约5%的蔗糖)。
201.e102.根据实施方案e70-e72、e89、e94、e95或e101中任一项所述的微针装置、多根微针或微针,其中配置用于突然释放的丝素蛋白尖端包含约0.5%至约3%w/v的cmc(例如,约1%的cmc)。
202.e103.根据实施方案e70-e72、e89、e94、e95、e101或e102中任一项所述的微针装置、多根微针或微针,其中配置用于突然释放的丝素蛋白尖端包含约50mm至约100mm的氨基酸,如苏氨酸(例如,约75mm的苏氨酸)。
203.e104.根据实施方案e4、e8或e9-e103中任一项所述的微针装置、多根微针或微针,其中所述丝素蛋白尖端包含约1%w/v至约10%w/v(例如,约1、2、3、4、5、6、7、8、9或10%w/v)的丝素蛋白、或具有根据图5的分子量分布的丝素蛋白、或包含例如每121根微针阵列约20μg至约245μg的量的丝素蛋白)。
204.e105.根据实施方案e4、e8或e9-e103中任一项所述的微针装置、多根微针或微针,其中所述丝素蛋白尖端包含约1%w/v至约10%w/v(例如,约1、2、3、4、5、6、7、8、9或10%w/v)的10mb丝素蛋白溶液、或根据图5的丝素蛋白溶液。
205.e106.根据实施方案e4、e8或e9-e103中任一项所述的微针装置、多根微针或微针,
其中所述丝素蛋白尖端包含约1%w/v至约10%w/v(例如,约1、2、3、4、5、6、7、8、9或10%w/v)的60mb丝素蛋白溶液、或根据图5的丝素蛋白溶液,例如,100kda至200kda(例如,约153kda)丝素蛋白溶液。
206.e107.根据实施方案e4、e8或e9-e103中任一项所述的微针装置、多根微针或微针,其中所述丝素蛋白尖端包含约1%w/v至约10%w/v(例如,约1、2、3、4、5、6、7、8、9或10%w/v)的120mb丝素蛋白溶液、或根据图5的丝素蛋白溶液,例如,70kda至150kda(例如,约100kda)丝素蛋白溶液。
207.e108.根据实施方案e4、e8或e9-e103中任一项所述的微针装置、多根微针或微针,其中所述丝素蛋白尖端包含约1%w/v至约10%w/v(例如,约1、2、3、4、5、6、7、8、9或10%w/v)的180mb丝素蛋白溶液、或根据图5的丝素蛋白溶液,例如,36kda至100kda(例如,约71kda)丝素蛋白溶液。
208.e109.根据实施方案e4、e8或e9-e103中任一项所述的微针装置、多根微针或微针,其中所述丝素蛋白尖端包含约1%w/v至约10%w/v(例如,约1、2、3、4、5、6、7、8、9或10%w/v)的480mb丝素蛋白溶液、或根据图5的丝素蛋白溶液,例如,1kda至60kda(例如,约16kda)丝素蛋白溶液。
209.e110.根据实施方案e62-e67、e89、e90或e91中任一项所述的微针装置、多根微针或微针,其中配置用于持续释放的丝素蛋白尖端包含约1%至约10%w/v的60mb丝素蛋白溶液。
210.e111.根据实施方案e62-e67、e89、e90或e91中任一项所述的微针装置、多根微针或微针,其中配置用于持续释放的丝素蛋白尖端包含约1%至约10%w/v的60mb丝素蛋白溶液。
211.e112.根据实施方案e62-e67、e89、e90或e91中任一项所述的微针装置、多根微针或微针,其中配置用于持续释放的丝素蛋白尖端包含约1%至约10%w/v的120mb丝素蛋白溶液。
212.e113.根据实施方案e62-e67、e89、e90或e91中任一项所述的微针装置、多根微针或微针,其中配置用于持续释放的丝素蛋白尖端包含约1%至约10%w/v的180mb丝素蛋白溶液。
213.e114.根据实施方案e62-e67、e89、e90或e91中任一项所述的微针装置、多根微针或微针,其中配置用于持续释放的丝素蛋白尖端包含约1%至约10%w/v的480mb丝素蛋白溶液。
214.e115.根据前述实施方案中任一项所述的微针装置、多根微针或微针,其基本上仅包含可溶解的材料,例如基本上仅包含基于聚合物和/或基于糖的材料。
215.e116.根据前述实施方案中任一项所述的微针装置、多根微针或微针,其配置为施加到肿瘤部位,例如切除后,并留在原处以完全溶解。
216.e117.根据实施方案e4、e8或e9-e114中任一项所述的微针装置、多根微针或微针,其中所述微针配置为将所述丝素蛋白尖端以约100μm至约1mm的深度(例如,尖端的远部的最大穿透深度)植入到受试者的生物屏障中。
217.e118.根据前述实施方案中任一项所述的微针装置、多根微针或微针,其中所述微针的长度介于约350μm至约1500μm之间。
218.e119.根据实施方案e4、e8、e9-e114或e117中任一项所述的微针装置、多根微针或微针,其中所述丝素蛋白尖端的高度可延伸至所述微针的整个高度的大约一半。
219.e120.根据实施方案e4、e8、e9-e114或e117中任一项所述的微针装置、多根微针或微针,其中所述丝素蛋白尖端的高度在约75μm至约475μm之间。
220.e121.根据实施方案e4、e8、e9-e114或e117中任一项所述的微针装置、多根微针或微针,其中所述丝素蛋白尖端包含约0.5μm至约100μm的尖端半径。
221.e122.根据实施方案e4、e8、e9-e114或e117中任一项所述的微针装置、多根微针或微针,其中所述丝素蛋白尖端包含约5μm至约10μm的尖端半径。
222.e123.根据实施方案e4、e8、e9-e114或e117中任一项所述的微针装置、多根微针或微针,其中所述丝素蛋白尖端包含约5度至约45度的角。
223.e124.一种治疗癌症(例如,转移性癌症)和/或诱导对癌症(例如,转移性癌症)的免疫应答的方法,其包括使根据实施方案e1-e56、e58或e60-e123中任一项所述的微针装置或多根微针与受试者的癌症(例如,转移性肿瘤)部位接触(例如,施用),从而产生以下中的一种或多种:
224.(i)裂解癌细胞,例如肿瘤细胞,以释放癌症相关抗原(例如,新抗原)和/或暴露癌症相关抗原(例如,新抗原)于受试者的免疫系统;
225.(ii)由抗原呈递细胞(apc)向免疫系统细胞(例如,辅助细胞,如b-细胞、树突状细胞等)展示在其表面上与主要组织相容性复合体(mhc)复合的癌症相关抗原(例如,新抗原);
226.(iii)由免疫效应细胞(例如,t细胞和/或nk细胞)识别所展示的癌症相关抗原(例如,新抗原);
227.(iv)激活和/或扩增免疫效应细胞,例如t细胞和/或nk细胞,其对受试者中展示的癌症相关抗原(例如,新抗原)具有特异性;和
228.(v)增强(例如,刺激或上调)免疫效应细胞例如t细胞和/或nk细胞的免疫应答,其促进受试者中表达癌症相关抗原(例如,新抗原)的靶细胞的杀伤和/或抑制所述靶细胞的生长或增殖。
229.e125.根据实施方案e124所述的方法,其中所述癌症表达多种抗原(例如,新抗原),但其中所述肿瘤微环境阻碍识别它们的免疫效应细胞(例如,t细胞)的激活。
230.e126.根据实施方案e124或e125所述的方法,其中对表达癌症相关抗原(例如,新抗原)的靶细胞增强的(例如,刺激的或上调的)免疫应答发生在施用部位处或附近。
231.e127.根据实施方案e124-e126中任一项所述的方法,其中对表达癌症相关抗原(例如,新抗原)的靶细胞增强的(例如,刺激的或上调的)免疫应答为全身性免疫应答(例如,广谱应答)以消融远处部位处的肿瘤。
232.e128.一种治疗癌症(例如,转移性癌症)和/或诱导对癌症(例如,转移性癌症)的免疫应答的方法,其包括使根据实施方案e1-e56、e58或e60-e123中任一项所述的微针装置或多根微针与受试者的癌症(例如,转移性肿瘤)部位接触(例如,施用)。
233.e129.一种治疗癌症(例如,转移性癌症)或癌前病况(例如,癌前皮肤病况)的方法,其包括使根据实施方案e1-e56、e58或e60-e123中任一项所述的微针装置或多根微针与受试者的肿瘤(例如,转移性肿瘤)或病变(例如,皮肤病变)接触(例如,施用)。
234.e130.一种预防癌症复发的方法,其包括使根据实施方案e1-e56、e58或e60-e123中任一项所述的微针装置或多根微针与受试者的肿瘤(例如,转移性肿瘤,例如皮肤上)接触(例如,施用)。
235.e131.一种治疗癌症(例如,转移性癌症)的方法,其包括使根据实施方案e1-e56、e58或e60-e123中任一项所述的微针装置或多根微针与受试者的手术切除位置或其近侧位置接触(例如,施用)。
236.e132.一种治疗癌症(例如,转移性癌症)的方法,其包括使根据实施方案e1-e56、e58或e60-e123中任一项所述的微针装置或多根微针与受试者的肿瘤(例如,转移性肿瘤)位置接触(例如,施用),从而诱导:
237.(i)对癌症的局部免疫应答和/或局部细胞毒性(例如,如由施加微针装置的位置处或邻近施加微针装置的位置癌细胞的死亡所证实,例如,局部肿瘤尺寸和/或局部肿瘤负荷的减小);和/或
238.(ii)对癌症的远端免疫应答和/或远端细胞毒性(例如,如由施加微针贴剂的位置远端的位置处癌细胞的死亡所证实,例如,远端肿瘤尺寸和/或总体肿瘤负荷的减小)。
239.e133.根据实施方案e124-e132中任一项所述的方法,其中所述接触(例如,施用)导致以下中的一种或多种:
240.(i)施用部位处或附近肿瘤生长的抑制;
241.(ii)局部免疫应答的诱导以消融施用部位处或附近的肿瘤;
242.(iii)肿瘤微环境中激活的免疫效应细胞(例如,t细胞)的增加;
243.(iv)局部免疫抑制细胞(例如,调节性t细胞(treg))的减少;
244.(v)全身免疫应答的诱导以消融远处部位处的肿瘤;
245.(vi)对癌症或癌前病况的免疫记忆;
246.(vii)对肿瘤抗原如新抗原的免疫应答;和/或
247.(viii)癌症再发(例如,癌症复发)的预防和/或抑制。
248.e134.根据实施方案e133所述的方法,其中所述免疫记忆导致施用部位处或附近再发性肿瘤的消融和/或远处部位处再发性肿瘤的消融,任选地当再发性肿瘤在施用后约1至约6个月内出现时,任选地当再发性肿瘤在施用后约1至约5年内出现时。
249.e135.根据实施方案e133或e134所述的方法,其中所述免疫记忆防止肿瘤再发。
250.e136.根据实施方案e133-e135中任一项所述的方法,其中所述免疫记忆防止癌症在最初施用微针后的前5年内再发。
251.e137.根据实施方案e124-e136中任一项所述的方法,其中所述癌症为转移性癌症。
252.e138.根据实施方案e124-e137中任一项所述的方法,其中所述癌症为复发性癌症。
253.e139.根据实施方案e124-e138中任一项所述的方法,其中所述癌症为难治性癌症。
254.e140.根据实施方案e124-e139中任一项所述的方法,其中所述癌症选自肛门癌;基底细胞癌;膀胱癌;骨癌;脑肿瘤;乳腺癌;子宫颈癌;结肠和直肠癌;子宫内膜癌;食管癌;胃肠道间质瘤;妊娠滋养细胞疾病;头颈癌;霍奇金淋巴瘤;卡波西肉瘤;肾(肾细胞)癌;白
血病;肝癌;肺癌;恶性间皮瘤;黑色素瘤;merkel细胞癌;多中心型castleman病;多发性骨髓瘤和其他浆细胞肿瘤;骨髓增生性肿瘤;神经母细胞瘤;非霍奇金淋巴瘤;卵巢癌、输卵管癌或原发性腹膜癌;胰腺癌;阴茎癌;嗜铬细胞瘤和副神经节瘤;前列腺癌;成视网膜细胞瘤;横纹肌肉瘤;皮肤癌;鳞状细胞癌;软组织肉瘤;体内任何地方的实体瘤;胃(胃部)癌;睾丸癌;甲状腺癌;阴道癌;外阴癌;以及wilms肿瘤和其他儿童肾癌。
255.e141.根据实施方案e124-e140中任一项所述的方法,其中所述癌症为黑色素瘤。
256.e142.根据实施方案e124-e140中任一项所述的方法,其中所述癌症为基底细胞癌。
257.e143.根据实施方案e124-e140中任一项所述的方法,其中所述癌症为鳞状细胞癌。
258.e144.根据实施方案e124-e140中任一项所述的方法,其中所述癌症为merkel细胞癌。
259.e145.根据实施方案e124-e140中任一项所述的方法,其中所述癌症为乳腺癌。
260.e146.根据实施方案e124-e140中任一项所述的方法,其中所述癌症与皮肤病变和/或肿瘤相关。
261.e147.根据实施方案e124-e140中任一项所述的方法,其中所述肿瘤为转移性肿瘤。
262.e148.根据实施方案e124-e140中任一项所述的方法,其中所述肿瘤是无需手术即可触及的。
263.e149.根据实施方案e124-e140中任一项所述的方法,其中所述肿瘤是通过手术可触及的。
264.e150.根据实施方案e124-e140中任一项所述的方法,其中所述肿瘤在皮肤上。
265.e151.根据实施方案e124-e140中任一项所述的方法,其中所述肿瘤在眼睛上。
266.e152.根据实施方案e129或e133-e151中任一项所述的方法,其中所述癌前病况为癌前皮肤病况,任选地选自光化性角化病(ak)、恶性雀斑样痣、粘膜白斑病和bowen’s病。
267.e153.根据实施方案e124-e152中任一项所述的方法,其中所述接触(例如,施用)在肿瘤内进行。
268.e154.根据实施方案e124-e152中任一项所述的方法,其中所述接触(例如,施用)在肿瘤周围进行。
269.e155.根据实施方案e124-e152中任一项所述的方法,其中所述接触(例如,施用)在手术切除之前进行。
270.e156.根据实施方案e124-e152中任一项所述的方法,其中所述接触(例如,施用)在手术切除之后进行。
271.e157.根据实施方案e124-e152中任一项所述的方法,其中所述接触(例如,施用)与手术和/或活检的收集同时进行。
272.e158.根据实施方案e124-e152中任一项所述的方法,其中所述接触(例如,施用)与护理标准治疗(例如,针对癌症或癌前病况的护理标准治疗)组合进行,所述护理标准治疗任选地选自手术、化学疗法、免疫疗法、靶向疗法、激素疗法和/或放射疗法。
273.e159.根据实施方案e158所述的方法,其中所述护理标准治疗在微针装置之前、之
后或同时进行。
274.e160.根据实施方案e124-e159中任一项所述的方法,其中所述受试者为人类受试者。
275.e161.一种制造微针装置的方法,所述方法包括:
276.提供包括模体的模具,所述模体有着形成在其中的具有预定形状的针腔的阵列,例如,金字塔形状和/或圆锥形状针腔;
277.用包含丝素蛋白、抗癌剂和/或免疫调节剂溶液的组合物填充所述针腔的尖端;
278.干燥所述针腔的填充尖端以产生丝素蛋白尖端,并任选地对所述针尖端退火;
279.用基底(例如,可溶解基底)溶液填充模具的针腔;
280.干燥所述基底溶液以产生用于所述丝素蛋白尖端的基底层;和
281.(任选地)向所述基底层施加背衬以制造微针装置。
282.e162.一种制造微针装置的方法,所述方法包括:
283.提供包括模体的模具,所述模体有着形成在其中的具有预定形状的针腔的阵列,例如,金字塔形状和/或圆锥形状针腔;
284.用包含丝素蛋白和治疗剂(例如,抗癌剂、免疫调节剂或两者)溶液的组合物填充所述针腔的尖端;
285.干燥所述针腔的填充尖端以产生丝素蛋白尖端,并任选地对所述丝素蛋白尖端退火;
286.用第一基底(例如,可溶解基底)溶液进一步填充模具的针腔;
287.干燥所述第一基底溶液以形成第一基底层;
288.(任选地)通过向第一基底层添加一种或多种另外的基底溶液并干燥所述另外的基底溶液来形成一个或多个另外的基底层,任选地,其中所述另外的基底溶液不同于所述第一基底溶液,和
289.(任选地)向基底层(例如,第一基底层、或所述一个或多个另外的基底层)施加背衬,从而制造微针装置。
290.e163.根据实施方案e161或e162所述的方法,其中所述基底溶液(例如,第一基底溶液、所述一种或多种另外的基底溶液、或两者)包含熔融液体。
291.e164.根据实施方案e161或e162所述的方法,其中所述基底溶液(例如,第一基底溶液、所述一种或多种另外的基底溶液、或两者)包含浆料。
292.e165.根据实施方案e161-e163中任一项所述的方法,其中填充(例如,模具或针腔)包括用包含熔融液体的基底溶液填充。
293.e166.根据实施方案e161-e165中任一项所述的方法,其中填充(例如,模具或针腔)包括用包含浆料的基底溶液填充。
294.e167.根据实施方案e161-e166中任一项所述的方法,其还包括使用化学反应(例如,在填充之后)使基底层(例如,第一基底层、所述一个或多个另外的基底层、或两者)凝固。
295.e168.根据实施方案e161-e167中任一项所述的方法,其还包括从模具取出微针装置,任选地在施加背衬之前。
296.e169.根据实施方案e161-e168中任一项所述的方法,其中通过将模具弯离微针装
置来取出微针装置。
297.e170.根据实施方案e161-e169中任一项所述的方法,其还包括将微针装置包装在具有低的水气透过率的容器中,该容器具有干燥剂以维持包装内约0%至约50%(例如,约0%至10%、约10%至约20%、约20%至约30%、约30%至约40%、或约40%至50%,例如约25%)的相对湿度。
298.e171.根据实施方案e161-e170中任一项所述的方法,其中经由纳升印刷将丝素蛋白、抗癌剂和/或免疫调节剂溶液分配到模具中的每个针腔中。
299.e172.根据实施方案e161-e171中任一项所述的方法,其中填充所述针腔的尖端包括将溶液例如丝素蛋白、抗癌剂和/或免疫调节剂溶液分配到每个针腔中。
300.e173.根据实施方案e161-e172中任一项所述的方法,其中干燥所述针腔的填充尖端包括初级干燥步骤和次级干燥步骤。
301.e174.根据实施方案e161-e173中任一项所述的方法,其中干燥所述基底(例如,可溶解基底)溶液包括使模具经受3900rpm的离心2分钟并用50μl基底溶液填满(topping off)所述针腔。
302.e175.根据实施方案e161-e174中任一项所述的方法,其中所述基底填充通过纳升(nl)分配(例如,纳升印刷)进行。
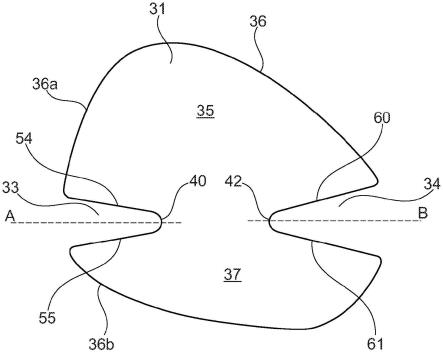
303.e176.根据实施方案e161-e175中任一项所述的方法,其还在填充针腔的尖端之后(例如,在填充所述基底之前)包括退火步骤。
304.e177.根据实施方案e161-e176中任一项所述的方法,其还在填充针腔的尖端之后(例如,在填充基底之前)包括水退火步骤。
305.e178.根据实施方案e161-e177中任一项所述的方法,其中所述背衬层包括纸背衬层和粘性塑料胶带中之一。
306.e179.根据实施方案e161-e178中任一项所述的方法,其中所述背衬层包含粘合剂涂覆塑料胶带。
307.e180.根据实施方案e161-e179中任一项所述的方法,其中所述背衬层包含多孔层。
308.e181.根据实施方案e161-e180中任一项所述的方法,其中所述背衬层包含一种或多种选自以下的粘合剂:丙烯酸、丙烯酸酯、氰基丙烯酸酯、有机硅、聚氨酯和合成橡胶。
309.e182.根据实施方案e161-e181中任一项所述的方法,其中所述背衬层包含能够通过光照射固化的粘合剂。
310.e183.根据实施方案e1-e182中任一项所述的微针装置、多根微针、微针或方法,其中所述微针装置、多根微针、微针或其部件以约0.5μg至约500μg丝素蛋白的量包含丝素蛋白(例如,约0.5μg至约5μg、或约1μg至约10μg、或约5μg至约15μg、或约10μg至约20μg、或约15μg至约25μg、或约20μg至约30μg、或约25μg至约35μg、或约30μg至约40μg、或约35μg至约45μg、或约40μg至约50μg、或约45μg至约55μg、或约50μg至约60μg、或约55μg至约65μg、或约60μg至约70μg、或约65μg至约75μg、或约70μg至约80μg、或约75μg至约85μg、或约80μg至约90μg、或约85μg至约95μg、或约90μg至约100μg、或约95μg至约150μg、或约125μg至约175μg、或约150μg至约200μg、或约225μg至约275μg、或约250μg至约300μg、或约325μg至约375μg、或约350μg至约400μg、或约425μg至约475μg、或约450μg至约500μg丝素蛋白)。
311.e184.根据实施方案e1-e183中任一项所述的微针装置、多根微针、微针或方法,其中所述微针装置、多根微针、微针或其部件以按重量计约1%至约75%的丝素蛋白的量包含丝素蛋白(例如,按重量计约1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%或75%的丝素蛋白)。
附图说明
312.图1为根据本公开的一个实例的微针制造过程的示意图。
313.图2为根据本公开的一个实例的配置为通过持续释放或通过突然(称为“推注(bolus)”)释放来释放不同治疗剂的一系列微针。最左边的微针配置为在两周时间内释放抗癌剂,如化疗剂。中间的微针配置为在两周时间内释放免疫调节剂,如检查点抑制剂(例如,抗pd1抗体)。最右边的微针配置为在短时间内、例如几分钟内快速释放免疫调节剂,如细胞因子(例如,il-2)。
314.图3示意了根据本公开的一个实例的具有施加到背衬或“把手”层的微针阵列的完整微针装置。
315.图4示意了根据本公开的一个实例的微针装置。该微针装置包含多根微针,这些微针具有足够的机械性质(例如,强度)和合适的几何形状(例如,尖端锐度、尖端夹角、长度和针间间距)以刺穿生物屏障(例如,皮肤)从而实现治疗剂或治疗剂的组合(例如,抗癌剂、免疫调节剂或其组合)向受试者的局部和/或全身递送。
316.图5示意了可用于制造本文所述的微针的丝素蛋白溶液的各种分子量分布。
317.图6a示意了用于在示例性小鼠模型中比较il-2或吉西他滨的肿瘤内(it)推注给药与it每日给药的给药方案;图6b为曲线图,描绘了在用推注il-2(it)或每日il-2(it)治疗的小鼠中肿瘤体积随时间的变化;图6c为曲线图,比较了在用推注(it)或每日il-2(it)治疗的小鼠中的存活情况;图6d为曲线图,描绘了在用推注吉西他滨(it)或每日吉西他滨(it)治疗的小鼠中肿瘤体积随时间的变化;图6e为曲线图,描述了在用推注(it)或每日吉西他滨(it)治疗的小鼠中的存活情况。
318.图7a-7b示意了用于在示例性小鼠模型中比较肿瘤内推注(it)吉西他滨(图7a)与每日it吉西他滨(图7b)的给药方案;图7c为曲线图,描绘了在用推注(it)或每日(it)吉西他滨治疗的小鼠中肿瘤体积随时间的变化;图7d为曲线图,描绘了在用推注(it)或每日(it)吉西他滨治疗的小鼠中的存活情况。
319.图8为曲线图,描绘了示例性丝制剂中il-2在4℃、室温(rt)或37℃下14天的时间段内的稳定性,如通过il-2回收(%)所确定。
具体实施方式
320.定义
321.除非另有定义,否则本文使用的所有技术和科学术语具有与本公开所属领域普通技术人员通常所理解的相同的含义。
322.冠词“一个(a/an)”和“一种(a/an)”在本文中用于指一个或不止一个(即,指至少一个)该冠词的语法对象。举例来说,“一个要素”指的是一个要素或不止一个要素。
323.在提及可测量值如量、持续时间等时,术语“约”意在涵盖在指定值的基础上
±
20%或在一些情况下
±
10%、或在一些情况下
±
5%、或在一些情况下
±
1%、或在一些情况下
±
0.1%的变化,因为这样的变化对于例如实现所公开的方法是适宜的。
[0324]“组合”或“与
……
组合”不旨在暗示疗法或治疗剂可同时施用和/或配制用于一起递送,但这些递送方法在本文所述的范围内。组合中的治疗剂可与一种或多种其他另外的疗法或治疗剂同时施用、在其之前施用或在其之后施用。治疗剂或治疗方案可以任何顺序施用。通常,每种药剂将以针对该药剂确定的剂量和/或时间表施用。还应理解,在此组合中使用的另外的治疗剂可在单个组合物中一起施用或在不同的组合物中分开施用。通常,预期组合使用的另外的治疗剂以不超过它们单独使用的水平的水平使用。在一些实施方案中,组合使用的水平将低于单独使用的水平。
[0325]
术语“抑制”、“抑制剂”或“拮抗剂”包括给定分子(例如,免疫检查点抑制剂)的某一参数(例如,活性)的降低。例如,该术语包括活性(例如,pd-1或pd-l1活性)至少5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或更多的抑制。因此,抑制不必为100%。
[0326]
术语“激活”、“激活剂”或“激动剂”包括给定分子(例如,共刺激分子)的某一参数(例如,活性)的增加。例如,该术语包括活性(例如,共刺激活性)至少5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或更多的增加。
[0327]
术语“抗肿瘤作用”和“抗癌作用”可互换使用并且是指可表现为各种手段的生物作用,包括但不限于例如肿瘤体积或癌体积的减小、肿瘤细胞或癌细胞的数目的减少、转移的数目的减少、预期寿命的增加、肿瘤细胞增殖或癌细胞增殖的减少、肿瘤细胞存活或癌细胞存活的减少、复发的预防、或与癌症病况相关的各种生理症状的改善。“抗肿瘤作用”或“抗癌作用”也可表现为本公开的微针预防肿瘤或癌症首次发生和/或癌症再发或复发的能力。“抗肿瘤作用”或“抗癌作用”还可表现为本公开的微针形成对癌症的免疫应答的能力,例如,形成对癌症相关抗原(例如,新抗原)的免疫应答的能力。
[0328]
如本文所用,“肿瘤抗原”或可互换的“癌症抗原”包括存在于癌上或与癌症相关的任何分子,例如,可激发免疫应答的癌细胞或肿瘤微环境。如本文所用,“免疫细胞抗原”包括存在于可激发免疫应答的免疫细胞上或与可激发免疫应答的免疫细胞相关的任何分子。在一些实施方案中,肿瘤抗原是指新抗原(例如,由肿瘤中的体细胞突变产生的不同于野生型抗原并且可对每种肿瘤和/或受试者特异性的抗原,如肽)。
[0329]
如本文所用,术语“抗癌剂”是指可诱导抗肿瘤和/或抗癌作用的疗法和/或药物。在一些实施方案中,抗癌作用包括但不限于肿瘤体积或癌体积的减小、肿瘤细胞或癌细胞的数目的减少、转移的数目的减少、预期寿命的增加、肿瘤细胞增殖或癌细胞增殖的减少、肿瘤细胞存活或癌细胞存活的减少、复发的预防、或与癌症病况相关的各种生理症状的改善。
[0330]
如本文所用,测量值的“增大”或“减小”通常是与基线值相比较,另有说明除外。例如,测量值的增大或减小可与健康受试者预期的测量值的基线水平相比较。或者,测量值的增大或减小可与相同的受试者的先前时间点相比较,例如,治疗之前。在一些情况下,测量值的增大或减小可与相同的受试者的先前时间点相比较,例如,在治疗的过程中。
[0331]
如本文所用,术语“免疫调节剂”是指可调节(例如,增大和/或减小)、增强、诱导、
刺激、抑制、减少或上调例如患有癌症的受试者中的免疫应答的一个或多个方面的疗法和/或药物。例如,免疫调节剂可增强或促进靶细胞如癌细胞的免疫攻击和/或可促进免疫效应细胞杀伤或抑制靶细胞如癌细胞的生长或增殖。在一些实施方案中,如本文所述例如通过本文所述的微针或装置施用的免疫调节剂可增强受试者对癌症的免疫应答。
[0332]
如本文所用,术语“癌症”意在包括所有类型的癌性生长或致癌过程、转移性组织或恶性转化的细胞、组织或器官,而与组织病理学类型或侵袭阶段无关。癌细胞可局部扩散或通过血流和淋巴系统扩散到身体的其他部分。癌性病症的实例包括但不限于实体瘤、血液癌、软组织肿瘤和转移性病变。实体瘤的实例包括各种器官系统的恶性肿瘤,例如肉瘤和癌(包括腺癌和鳞状细胞癌),如影响肝、肺、乳腺、淋巴、胃肠(例如,结肠)、泌尿生殖道(例如,肾、尿道上皮细胞)、前列腺和咽的那些。腺癌包括恶性肿瘤如大多数结肠癌、直肠癌、肾细胞癌、肝癌、非小细胞肺癌、小肠癌和食道癌。鳞状细胞癌包括恶性肿瘤如影响肺、食道、皮肤、头颈区域、口腔、肛门和子宫颈的那些。也可使用本公开的方法和微针治疗或预防前述癌症的转移性病变。
[0333]
术语“肿瘤”和“癌症”在本文中可互换使用,例如,这两个术语均涵盖实体肿瘤和液体肿瘤,例如,弥散性或循环性肿瘤。如本文所用,术语“癌症”或“肿瘤”包括恶化前的以及恶性的癌症和肿瘤。
[0334]
术语“抗原呈递细胞”或“apc”是指在其表面上展示与主要组织相容性复合体(mhc)复合的外源抗原的免疫系统细胞如辅助细胞(例如,b-细胞、树突状细胞等)。t-细胞可使用其t-细胞受体(tcr)识别这些复合体。apc加工抗原并将其呈递给t-细胞。
[0335]
如本文所用,“免疫细胞”是指在免疫系统中起作用以例如免受感染剂和外来物质影响的各种细胞中的任一种。在实施方案中,该术语包括白细胞,例如嗜中性粒细胞、嗜酸性粒细胞、嗜碱性粒细胞、淋巴细胞和单核细胞。先天白细胞包括吞噬细胞(例如,巨噬细胞、嗜中性粒细胞和树突状细胞)、肥大细胞、嗜酸性粒细胞、嗜碱性粒细胞和自然杀伤细胞。先天白细胞通过接触攻击较大的病原体或通过吞噬并然后杀伤微生物来识别和消除病原体,并且是适应性免疫应答的激活中的介质。适应性免疫系统的细胞为特殊类型的白细胞,称为淋巴细胞。b细胞和t细胞是重要的淋巴细胞类型并来源于骨髓中的造血干细胞。b细胞参与体液免疫应答,而t细胞参与细胞介导的免疫应答。术语“免疫细胞”包括免疫效应细胞。
[0336]
如本文所用,术语“免疫效应细胞”或“效应细胞”是指参与免疫应答、例如促进免疫效应应答的细胞。免疫效应细胞的实例包括t细胞,例如,α/βt细胞和γ/δt细胞、b细胞、自然杀伤(nk)细胞、自然杀伤t(nkt)细胞、肥大细胞和骨髓来源的吞噬细胞。
[0337]
如本文所用,术语“免疫效应”或“效应”、“功能”或“应答”是指增强或促进靶细胞的免疫攻击的功能或反应,例如免疫效应细胞的功能或反应。例如,免疫效应功能或反应是指t或nk细胞促进杀伤靶细胞或抑制靶细胞生长或增殖的性质。在t细胞的情况下,初级刺激和共刺激为免疫效应功能或应答的实例。
[0338]
术语“效应功能”是指细胞的一种特化功能。t细胞的效应功能可例如为溶细胞活性或辅助细胞活性,包括细胞因子的分泌。
[0339]
如本文所用,术语“治疗(treat/treatment/treating)”是指由施用一种或多种疗法引起病症(例如,增殖性病症)的进展、严重性和/或持续时间的减少或改善或者病症的一
种或多种症状(优选地,一种或多种可辨别的症状)的改善。在具体的实施方案中,术语“治疗(treat/treatment/treating)”是指改善增殖性病症的至少一种可测量的物理参数,如肿瘤的生长,其不一定是患者可辨别的。在其他实施方案中,术语“治疗(treat/treatment/treating)”是指在身体上通过例如稳定可辨别的症状、在生理上通过例如稳定物理参数或两者来抑制增殖性病症的进展。在其他实施方案中,术语“治疗(treat/treatment/treating)”是指减小或稳定肿瘤尺寸或癌细胞计数。
[0340]
术语“多肽”、“肽”和“蛋白质”(如果是单链)在本文中可互换使用,是指任何长度的氨基酸的聚合物。所述聚合物可以是线形的或支化的,其可包含经修饰的氨基酸,并且其可被非氨基酸打断。该术语还涵盖已被修饰的氨基酸聚合物;例如,二硫键形成、糖基化、脂化、乙酰化、磷酸化或任何其他操作,如与标记组分缀合。多肽可自天然来源分离,可通过重组技术从真核或原核宿主产生,或可为合成过程的产物。
[0341]
术语“核酸”、“核酸序列”、“核苷酸序列”或“多核苷酸序列”和“多核苷酸”可互换使用。它们是指任何长度的核苷酸的聚合物形式,所述核苷酸为脱氧核糖核苷酸或核糖核苷酸或其类似物。多核苷酸可以是单链或双链的,并且如果是单链,可为编码链或非编码(反义)链。多核苷酸可包含经修饰的核苷酸,如甲基化的核苷酸和核苷酸类似物。核苷酸的序列可被非核苷酸组分打断。聚合后可进一步修饰多核苷酸,如通过与标记组分缀合。核酸可为重组多核苷酸,或者基因组、cdna、半合成或合成来源的多核苷酸,其在自然界中不存在或以非天然排列与另一多核苷酸连接。
[0342]
在核苷酸序列的上下文中,术语“基本上相同”在本文中用于指含有足够或最小数目的与第二核酸序列中的比对核苷酸相同的核苷酸的第一核酸序列,使得第一和第二核苷酸序列编码具有共同功能活性的多肽,或编码共同的结构多肽结构域或共同的功能多肽活性,例如,与对照序列(例如,本文提供的序列)具有至少约75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的核苷酸序列。
[0343]
术语“变体”是指具有与对照氨基酸序列基本上相同的氨基酸序列或由基本上相同的核苷酸序列编码的多肽。在一些实施方案中,变体为功能性变体。
[0344]
术语“功能性变体”是指具有与对照氨基酸序列基本上相同的氨基酸序列或由基本上相同的核苷酸序列编码并且能够具有对照氨基酸序列的一种或多种活性的多肽。
[0345]
术语“细胞因子”(例如,gm-csf、il-1α、il-1β、il-2、il-3、il-4、il-5、il-6、il-7、il-8、il-10、il-12、il-15、il-18、il-21、ifn-α、ifn-β、ifn-γ、mip-1α、mip-1β、tgf-β、tnf-α和tnfβ)包括天然存在的细胞因子的全长、片段或变体,例如功能性变体(包括其具有天然存在的细胞因子的至少10%、30%、50%或80%的活性(例如,免疫调节活性)的片段和功能性变体)。在一些实施方案中,细胞因子具有与天然存在的细胞因子基本上相同(例如,至少约85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性)的氨基酸序列,或由与编码细胞因子的天然存在的核苷酸序列基本上相同(例如,至少约75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性)的核苷酸序列编码。在一些实施方案中,如上下文中所理解,细胞因子还包含受体结构域,例如,细胞因子受体结构域(例如,il-15/il-15r)。
[0346]
术语“有效量”或“治疗有效量”在本文中可互换使用,并且是指如本文所述的有效于实现特定生物学结果的化合物、制剂、材料或组合物的量。
[0347]
如本文所用,术语“治疗(therapeutic)”是指治疗(treatment)。治疗作用通过减轻、抑制、缓解或根除疾病状态(例如,癌症)获得。
[0348]
如本文所用,术语“预防”指的是疾病或疾病状态(例如,癌症)的预防或防护性治疗。
[0349]
如本文所用,“难治性”是指对治疗无反应的疾病,例如癌症。在实施方案中,难治性癌症可对治疗之前或治疗开始时的治疗耐药。在其他实施方案中,难治性癌症可在治疗期间变得耐药。难治性癌症也称为耐药性癌症。
[0350]
如本文所用,“复发的”或“复发”是指疾病(例如,癌症)或疾病如癌症的体征和症状在改善或反应期之后、例如在疗法(例如,癌症疗法)的既往治疗之后的恢复或重现。初始反应期可包括癌细胞的水平下降至某一阈值以下,例如20%、15%、10%、5%、4%、3%、2%或1%以下。重现可包括癌细胞的水平升高至某一阈值以上,例如20%、15%、10%、5%、4%、3%、2%或1%以上。例如,在一些癌症的情况下,重现可包括例如反应后肿瘤的重现。在一些实施方案中,反应(例如,完全反应或部分反应)可包括不存在可检测的肿瘤或可检测的mrd(微小残留病)。在一些实施方案中,初始反应期持续至少1、2、3、4、5或6天;至少1、2、3或4周;至少1、2、3、4、6、8、10或12个月;或至少1、2、3、4或5年。
[0351]
范围:贯穿本公开内容,本发明的各个实施方案可以范围格式呈现。应理解,以范围格式的描述仅是为了方便和简洁,而不应解释为对本公开的范围的僵硬限制。相应地,范围的描述应视为已具体公开了所有可能的子范围以及该范围内的各个数值。例如,范围如1至6的描述应视为已具体公开了子范围如1至3、1至4、1至5、2至4、2至6、3至6等,以及该范围内的各个数,例如1、2、2.7、3、4、5、5.3和6。作为另一个实例,范围如95-99%同一性包括具有95%、96%、97%、98%或99%同一性的事物,并包括子范围如96-99%、96-98%、96-97%、97-99%、97-98%和98-99%同一性。无论范围的广度如何,这都适用。
[0352]
如本文所用“辅助(adjuvant)”,在涉及癌症治疗的一些实施方案中,辅助为在初期治疗之后给予以降低癌症重返的风险的另外的癌症治疗。辅助疗法可包括例如化学疗法、放射疗法、激素疗法、靶向疗法或生物疗法。
[0353]
如本文所用“佐剂(adjuvant)”,在涉及疫苗递送的一些实施方案中,佐剂为能够有利于或放大免疫事件的级联的物质,最终导致增加的免疫应答,例如对抗原的综合身体反应,包括细胞和/或体液免疫应答。佐剂的非限制性实例包括:铝(例如,铝凝胶和/或铝盐,如氢氧化铝、磷酸铝和硫酸铝钾)、脂质(例如,角鲨烯、单磷酰脂质a(mpl))、as03(例如,包含d,l-α-生育酚(维生素e)、角鲨烯和聚山梨酯80的佐剂)、as04(例如,包含氢氧化铝和mpl的组合的佐剂)和(例如,包含角鲨烯的佐剂)。
[0354]
如本文所用,术语“背衬”是指适于粘结到和/或粘附到微针的部件的材料。在一些实施方案中,背衬材料适于粘结到和/或粘附到本文描述的微针的可溶解基底。
[0355]
如本文所用,术语“基底”是指形成微针的基底的层(例如,用作加载有抗癌剂、免疫调节剂或其组合的远端丝尖端的支撑物),和/或也可用作连接相邻微针以形成连续微针阵列或微针贴剂的层。在一些实施方案中,至少10%、20%、30%、40%、50%、60%、70%、80%、90%或更多的基底在施用到生物屏障例如皮肤、肿瘤、组织、细胞膜、粘液表面、口腔或颊腔后溶解。
[0356]
如本文所用,术语“剂量”指的是施用(例如,在本文所述的微针中)以在生物体中
引发抗癌反应和/或免疫应答(例如,体液和/或细胞免疫应答)的抗癌剂和/或免疫调节剂的量。
[0357]
如本文所用,“标准剂量”指的是以典型人剂量施用的抗癌剂和/或免疫调节剂的量,例如,如由国家或国际监管机构(例如,美国fda、emea)批准上市的。
[0358]
如本文所用,“分剂量”是指包含抗癌剂和/或免疫调节剂的总剂量(例如,标准剂量)的部分量的剂量,其被施用(例如,在微针中)以在生物体中引发抗癌反应和/或免疫应答。在一些实施方案中,以分剂量施用的抗癌剂和/或免疫调节剂的量不超过1/x,其中x为任何数字,例如,其中x为所施用的抗癌剂和/或免疫调节剂的总剂量(例如,标准剂量)的0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1、2、3、4、5、6、7、8、9、10、15、20、30、40、50、60、70、80、90或100或更多倍。
[0359]
如本文所用,术语“明胶”是指衍生自胶原的水溶性蛋白质。在一些实施方案中,术语“明胶”是指通过动物胶原的部分酸水解(a型明胶)或部分碱水解(b型明胶)产生的无菌无热原蛋白质配制剂(例如,级分),所述动物胶原最通常源自牛、猪和鱼来源。可获得不同分子量范围的明胶。也可使用重组来源的明胶。
[0360]
如本文所用,术语“聚乙二醇(peg)”是指环氧乙烷的低聚物或聚合物。peg也称为聚环氧乙烷(peo)或聚氧乙烯(poe)。peg的结构通常表示为h-(o-ch
2-ch2)
n-oh。
[0361]
如本文可互换使用的,术语“持续释放的丝素蛋白尖端”是指能够刺穿受试者的生物屏障例如皮肤、粘液表面、肿瘤、口腔或颊腔并沉积在生物屏障、皮肤层(例如,真皮)内的微针的远端,例如,尖端。在实施方案中,尖端包含丝素蛋白,其量足以将治疗剂如抗癌剂和/或免疫调节剂的释放维持长时间,例如,至少约1天(例如,约1、2、3、4、5、6、7、8、9、10、11、12、13或14天或更多天,例如,约4天至约30天,例如,约1-2周、约1-3周或约1-4周,例如,约2-12个月)。
[0362]
如本文所用,术语“微针”是指具有至少两个、更通常三个部件(例如,层)的结构,用于跨生物屏障如皮肤、组织、肿瘤或细胞膜输运或递送治疗剂,如抗癌剂、免疫调节剂或其组合。在一些实施方案中,微针包含基底(例如,如本文所述的可溶解基底)、尖端(例如,如本文所述的可植入尖端)和任选地背衬材料。在实施方案中,微针具有高度为约350μm至约1500μm(例如,约350μm至约1500μm,例如,约350μm、约400μm、约450μm、约500μm、约550μm、约600μm、约650μm、约700μm、约750μm、约800μm、约850μm、约900μm、约950μm、约1000μm、约1050μm、约1100μm、约1150μm、约1200μm、约1250μm、约1300μm、约1350μm、约1400μm、约1450μm、约1500μm))的尺寸。在一些实施方案中,微针制造为具有任何尺寸和/或几何形状以使得能够将丝素蛋白尖端(例如,可植入的持续释放尖端)以约100μm至约900μm的深度(例如,以约800μm的深度)部署到皮肤的真皮层中以释放(例如,受控释放或持续释放)抗癌剂、免疫调节剂或其组合。
[0363]
如本文所用,术语“微针贴剂”和“微针阵列”是指包含例如以随机或预定图案如阵列排列的多根微针(例如,基于丝素蛋白的微针)的装置。在一些实施方案中,本公开的微针贴剂或微针阵列可包含约0.5μg至约500μg丝素蛋白的量的丝素蛋白。在一些实施方案中,本公开的微针贴剂或微针阵列可以约0.5μg至约5μg、或约1μg至约10μg、或约5μg至约15μg、或约10μg至约20μg、或约15μg至约25μg、或约20μg至约30μg、或约25μg至约35μg、或约30μg至约40μg、或约35μg至约45μg、或约40μg至约50μg、或约45μg至约55μg、或约50μg至约60μg、
或约55μg至约65μg、或约60μg至约70μg、或约65μg至约75μg、或约70μg至约80μg、或约75μg至约85μg、或约80μg至约90μg、或约85μg至约95μg、或约90μg至约100μg、或约95μg至约150μg、或约125μg至约175μg、或约150μg至约200μg、或约225μg至约275μg、或约250μg至约300μg、或约325μg至约375μg、或约350μg至约400μg、或约425μg至约475μg、或约450μg至约500μg的量包含丝素蛋白。在一些实施方案中,本公开的微针贴剂或微针阵列可包含至少约0.5、0.6、0.7、0.8、0.9、1、2、3、4、5、6、7、8、9、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、150、200、250、300、350、400、450或500μg丝素蛋白的量的丝素蛋白。在一些实施方案中,本公开的微针贴剂或微针阵列可包含至多约0.5、0.6、0.7、0.8、0.9、1、2、3、4、5、6、7、8、9、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、150、200、250、300、350、400、450或500μg丝素蛋白的量的丝素蛋白。在一些实施方案中,本公开的微针贴剂或微针阵列可包含约0.5、0.6、0.7、0.8、0.9、1、2、3、4、5、6、7、8、9、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、150、200、250、300、350、400、450或500μg丝素蛋白的量的丝素蛋白。
[0364]
在一些实施方案中,本公开的微针贴剂或微针阵列包含按重量计约1%至约75%、约1%至约5%、约10%至约60%、约15%至约50%、或约20%至约40%的丝素蛋白。在一些实施方案中,本公开的微针贴剂或微针阵列包含按重量计至少约1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%或75%的丝素蛋白。在一些实施方案中,本公开的微针贴剂或微针阵列包含按重量计至多约1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%或75%的丝素蛋白。在一些实施方案中,本公开的微针贴剂或微针阵列包含按重量计约1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%或75%的丝素蛋白。
[0365]
如本文所用,术语“丝素蛋白”包括蚕丝蛋白和昆虫或蜘蛛丝蛋白。根据本文描述的各个方面,可使用任何类型的丝素蛋白。由蚕如家蚕(bombyx mori)产生的丝素蛋白是最常见的并且是地球友好的可再生资源。例如,微针(例如,丝素蛋白尖端,例如微针的可植入受控或持续释放尖端)中使用的丝素蛋白可通过从家蚕的茧除去丝胶而获得。在一些实施方案中,丝素蛋白为再生丝素蛋白,例如从家蚕的茧提取丝胶和例如经由煮沸步骤的另外的处理后获得的丝素蛋白。有机蚕茧也可商购获得。然而,存在许多不同的丝,包括蜘蛛丝(例如,从金丝蜘蛛(nephila clavipes)获得)、转基因丝、重组和/或基因工程丝,如可使用来自细菌、酵母、哺乳动物细胞、转基因动物或转基因植物的丝(参见例如wo 97/08315;us 5,245,012)及其变体。
[0366]
如本文所用,“受试者”是指人或动物。通常,动物为脊椎动物如灵长类动物、啮齿动物、家养动物或狩猎动物。灵长类动物包括黑猩猩、食蟹猴、蜘蛛猴和猕猴(例如,恒河猴)。啮齿动物包括小鼠、大鼠、旱獭、雪貂、兔和仓鼠。家养动物和狩猎动物包括牛、马、猪、鹿、野牛、水牛、猫科动物(例如,家猫)、犬科动物(例如,狗、狐狸、狼)、禽类(例如,鸡、鸸鹋、鸵鸟)和鱼类(例如,鳟鱼、鲶鱼和鲑鱼)。在本文描述的方面的某些实施方案中,受试者为哺乳动物(例如,灵长类动物,例如人)。受试者可为雄性或雌性。在某些实施方案中,受试者为哺乳动物。哺乳动物可以是人、非人灵长类动物、小鼠、大鼠、狗、猫、马或牛,但不限于这些实例。另外,本文描述的方法和制剂可用于治疗家养动物和/或宠物。在一些实施方案中,术
语“受试者”旨在包括其中可引发免疫应答的活生物体(例如,哺乳动物,例如人)。
[0367]
如本文所用,术语“释放”和“受控释放或持续释放”是指治疗剂如抗癌剂、免疫调节剂或其组合在一段时间内(例如,从本文所述的微针、微针装置、制剂、组合物、制品、装置或配制剂,例如,从如本文所述的基于丝素蛋白的微针尖端)的释放,例如达至少约1天至约28天(例如,约1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27或28天或更多天,例如,约4天至约14天,例如,约1-2周、约1-3周或约1-4周,例如,约1个月至约3个月)。在一些实施方案中,治疗剂如抗癌剂、免疫调节剂或其组合由如本文所述的微针、微针装置、制剂、组合物、制品、装置或配制剂在约1天至约14天、例如约1、2、3、4、5、6、7、8、9、10、11、12、13或14天的时间段内的受控释放或持续释放可例如在受试者中导致抗癌反应和/或免疫应答。在一些实施方案中,治疗剂如抗癌剂、免疫调节剂或其组合由如本文所述的微针、微针装置、制剂、组合物、制品、装置或配制剂在约1周至约4周、例如约1、2、3或4周的时间段内的受控释放或持续释放可例如在受试者中导致抗癌反应和/或免疫应答。在一些实施方案中,包含丝素蛋白和治疗剂如抗癌剂、免疫调节剂或其组合的制剂和配制剂具有受控释放或持续释放性质(例如,配制和/或配置为在1、5、10、15、30、45分钟或至少1、5、10、15、30、45分钟的时间段内;在1、2、3、4、5、10、24小时或至少1、2、3、4、5、10、24小时的时间段内;在1、2、3、4、5、6、7、8、9、10、11、12、13、14天或至少1、2、3、4、5、6、7、8、9、10、11、12、13、14天的时间段内;在1、2、3、4、5、6、7、8周或至少1、2、3、4、5、6、7、8周的时间段内;在1、2、3、4、5、6、7、8、9、10、11个月或至少1、2、3、4、5、6、7、8、9、10、11个月的时间段内;在1、2、3、4、5年或更长或至少1、2、3、4、5年或更长的时间段内向例如受试者的皮肤中释放治疗剂)。在一些实施方案中,受控释放或持续释放是通过突然释放。在一些实施方案中,本文描述的微针和微针装置可配置用于治疗剂如化疗剂约28天或更长时间的持续释放。
[0368]
如本文所用,术语“治疗剂”和“活性剂”是本领域认可的术语并且是指在受试者中局部或全身性地起作用的生物学、生理学或药理学活性物质的任何化学部分。可使用在施用给受试者后能够从本文所述的微针释放到邻近组织或流体中的各种形式的治疗剂。
[0369]
下文将更详细地描述本文的组合物和方法的各种实施方案。另外的定义在整个说明书中阐述。
[0370]
具体实施方式
[0371]
本文提供了基于丝素蛋白的微针和基于丝素蛋白的微针装置(例如,微针贴剂),其配置为将有效量的治疗剂(例如,抗癌剂、免疫调节剂或其组合)引入并随后释放(例如,施用)到受试者中(例如,释放到受试者的生物屏障如皮肤中和/或跨受试者的生物屏障如皮肤释放)。使用基于丝素蛋白的微针和基于丝素蛋白的微针装置(例如,微针贴剂)可在患者中产生抗癌作用和/或对癌症的免疫(例如,对癌症相关抗原(例如,新抗原)长时间的广谱免疫)。
[0372]
不希望受理论束缚,本文公开的微针或微针装置向受试者的施加部位(例如,异常细胞的部位,例如肿瘤或病变)的施用导致有效量的治疗剂(例如,抗癌剂、免疫调节剂或其组合)释放到受试者中,从而在施用部位处或附近诱导局部治疗作用(例如,局部抗癌作用)。除了这种局部治疗作用之外,本文公开的微针或微针装置的施用还可在具有与施加部位类似特征的远处部位(例如,异常细胞的远处部位,例如,远处肿瘤或远处病变)处产生全身治疗作用(例如,全身抗癌作用)。
[0373]
在一些实施方案中,本文公开的微针或微针装置可施用于受试者以实现有效量的治疗剂(例如,抗癌剂、免疫调节剂或其组合)在预定时间段(例如,4-15天)内持续释放到受试者中。在一些实施方案中,本文公开的微针或微针装置可施用于受试者以实现有效量的治疗剂(例如,抗癌剂、免疫调节剂或其组合)在预定时间段内持续释放到受试者中,例如在至少1、5、10、15、30、45分钟的时间段内;在1、2、3、4、5、10、24小时或至少1、2、3、4、5、10、24小时的时间段内;在1、2、3、4、5、6、7、8、9、10、11、12、13、14天或至少1、2、3、4、5、6、7、8、9、10、11、12、13、14天的时间段内;在1、2、3、4、5、6、7、8周或至少1、2、3、4、5、6、7、8周的时间段内;在1、2、3、4、5、6、7、8、9、10、11个月或至少1、2、3、4、5、6、7、8、9、10、11个月的时间段内;在1、2、3、4、5年或更长或至少1、2、3、4、5年或更长的时间段内。
[0374]
在一些实施方案中,本文公开的微针或微针装置可施用于受试者以实现有效量的治疗剂(例如,抗癌剂、免疫调节剂或其组合)在预定时间段(例如,约24小时或更短)内突然释放到受试者中。在一些实施方案中,本文公开的微针或微针装置可施用于受试者以实现有效量的治疗剂(例如,抗癌剂、免疫调节剂或其组合)在预定时间段内突然释放到受试者中,例如在至少1、5、10、15、30、45分钟的时间段内;或在1、2、3、4、5、10、24小时或至少1、2、3、4、5、10、24小时的时间段内。
[0375]
在一些实施方案中,本文公开的微针或微针装置可与第二治疗剂或过程组合施用。
[0376]
因此,本文公开了制备用于在受试者中治疗疾病的改进的基于丝素蛋白的微针和包含其的装置的制造方法。
[0377]
基于丝素蛋白的微针
[0378]
在一些实施方案中,本公开提供了基于丝素蛋白的微针和微针装置(例如,微针贴剂)以将有效量的治疗剂如抗癌剂、免疫调节剂或其组合输运和释放到生物屏障(例如,皮肤、肿瘤、粘膜、组织如器官组织和肌肉组织、颊腔、口腔或细胞膜)中和/或跨生物屏障输运和释放。
[0379]
因此,本文公开的基于丝素蛋白的微针和微针装置可配置为具有各种机械性质(例如,强度)、设计和几何形状(例如,针形状和锐度)及释放动力学(例如,持续释放和/或突然释放)以使得能够向受试者施用有效量的治疗剂如抗癌剂、免疫调节剂或其组合来例如治疗疾病或病症如癌症和/或皮肤病况。
[0380]
机械性能
[0381]
微针,包括本文公开的基于丝素蛋白的微针,可设计为插入到皮肤中而不破裂。在一些实施方案中,通过使用具有尖锐尖端和足够长度的针来克服在插入之前发生的生物屏障(例如,皮肤)表面的偏转而实现微针插入。在一些实施方案中,插入过程中微针的完整性可通过使所需的插入力最小化来实现,例如,通过使用尖锐尖端的针,通过使机械强度最大化,和/或通过优化针直径(参见例如park等人,j.korean phys.soc.56(4):1223-1227,2010)。因此,在一些实施方案中,对基于丝素蛋白的微针的机械性能进行优化(例如,通过调节各种制剂组分的浓度,包括本文公开的丝素蛋白结晶度)以避免微针因压弯(buckling)而突然破坏,并使得微针能够成功地穿透和插入到生物屏障(例如,皮肤、肿瘤、组织、细胞膜、粘液表面、口腔、或颊腔)中。在一些实施方案中,本文公开的微针可配置为具有长度与等效直径的纵横比低于4:1的几何形状和/或具有以杨氏模量大于500mpa和破坏
应力大于10mpa为特征的机械强度。在一些实施方案中,微针具有15度的夹角和/或约4:1的纵横比。在一些实施方案中,基底配方具有约1000至约1500mpa的挠曲模量和约15至约30mpa的破坏应力。在一些实施方案中,本文公开的微针可配置为具有长度与等效直径的纵横比低于2:1的几何形状。在一些实施方案中,微针具有约5度至约50度的夹角。例如,微针可具有约5、10、15、20、25、30、35、40、45或50度的夹角。在一些实施方案中,微针具有30度的夹角。在一些实施方案中,微针具有30度的夹角和/或约1.87:1的纵横比。在一些实施方案中,基底配方具有约50至约1500mpa(例如,约50、60、70、80、90、100、150、200、250、300、350、400、450、500、550、560、750、800、850、900、950、1000、1100、1200、1300、1400或1500mpa)的挠曲模量和/或约1至约30mpa(例如,约1、2、3、4、5、6、7、8、9、10、15、20、25、30mpa)的挠曲破坏应力。
[0382]
微针设计
[0383]
在一些实施方案中,本公开提供了具有各种设计配置的基于丝素蛋白的微针和包含其的装置。本文公开的基于丝素蛋白的微针可呈适用于刺穿生物屏障(例如,皮肤、肿瘤、组织、细胞膜、粘液表面、口腔、或颊腔)的任何形状和/或几何形状以使得治疗剂(例如,抗癌剂、免疫调节剂或其组合)能够在受试者内释放,例如持续释放和/或突然释放。微针的形状和/或几何形状的非限制性实例包括:圆柱体形状、楔形、圆锥体形状、金字塔形状、和/或不规则形状、或其任何组合。
[0384]
在一些实施方案中,基于丝素蛋白的微针包含溶解性和/或可降解的微针。在一些实施方案中,本公开的可溶解和/或可降解(例如,可再吸收)的微针将治疗剂(例如,抗癌剂、免疫调节剂或其组合)包封在制剂如基于丝素蛋白的制剂中,其一旦在受试者(例如,皮肤)内就溶解和/或降解。在一些实施方案中,治疗剂(例如,抗癌剂、免疫调节剂或其组合)从可降解微针的释放是通过蛋白酶介导的降解。在一些实施方案中,基于丝素蛋白的微针的仅一部分(例如,尖端,例如丝素蛋白尖端)配置为可溶解和/或可降解的。在一些实施方案中,基本上所有的基于丝素蛋白的微针都是可溶解和/或可降解的。在一些实施方案中,治疗剂(例如,抗癌剂、免疫调节剂或其组合)从可溶解和/或可降解(例如,可再吸收)的微针的释放是通过扩散控制的释放通过微针材料。
[0385]
在一些实施方案中,基于丝素蛋白的微针为实心微针。在一些实施方案中,本公开的实心微针设计为两部分系统。在一些实施方案中,首先将包含基于丝素蛋白的实心微针的微针装置施加到皮肤以产生刚好深到足以穿透生物屏障(例如,皮肤)的最外层的显微孔,然后经由透皮贴剂施加治疗剂(例如,抗癌剂、免疫调节剂或其组合)。在一些实施方案中,治疗剂(例如,抗癌剂、免疫调节剂或其组合)从实心微针的释放是通过扩散通过微针材料和/或微针材料的降解,例如,蛋白酶介导的降解。在其中实心微针降解的一些实施方案中,实心微针通常被称为溶解性或可再吸收的微针。
[0386]
在一些实施方案中,基于丝素蛋白的微针为中空微针。在一些实施方案中,本公开的中空微针包含贮存器,其将治疗剂(例如,抗癌剂、免疫调节剂或其组合)直接递送到施加部位(例如,生物屏障,例如皮肤)中。
[0387]
在一些实施方案中,基于丝素蛋白的微针为包衣微针。在一些实施方案中,将治疗剂(例如,抗癌剂、免疫调节剂或其组合)直接施加到微针的一部分(例如,表面)。在一些实施方案中,包衣微针还包被有表面活性剂(例如,辛基酚乙氧基化物(例如,triton-x)、聚山
梨酯、泊洛沙姆如p188和/或聚乙氧基化醇)和/或增稠剂以确保治疗剂被适当地递送。
[0388]
在一些实施方案中,本公开的基于丝素蛋白的微针可包含以下层:(1)背衬材料(任选);(2)基底(例如,可溶解基底);和(3)丝素蛋白尖端。例如,本文所述的微针可包括施加到可溶解基底层的背衬材料(任选),所述可溶解基底层支撑包含丝素蛋白和治疗剂(例如,抗癌剂、免疫调节剂或其组合)的远端丝素蛋白尖端。
[0389]
在一些实施方案中,本公开的基于丝素蛋白的微针可包含约0.5μg至约500μg丝素蛋白的量的丝素蛋白。在一些实施方案中,本公开的基于丝素蛋白的微针可以约0.5μg至约5μg、或约1μg至约10μg、或约5μg至约15μg、或约10μg至约20μg、或约15μg至约25μg、或约20μg至约30μg、或约25μg至约35μg、或约30μg至约40μg、或约35μg至约45μg、或约40μg至约50μg、或约45μg至约55μg、或约50μg至约60μg、或约55μg至约65μg、或约60μg至约70μg、或约65μg至约75μg、或约70μg至约80μg、或约75μg至约85μg、或约80μg至约90μg、或约85μg至约95μg、或约90μg至约100μg、或约95μg至约150μg、或约125μg至约175μg、或约150μg至约200μg、或约225μg至约275μg、或约250μg至约300μg、或约325μg至约375μg、或约350μg至约400μg、或约425μg至约475μg、或约450μg至约500μg的量包含丝素蛋白。在一些实施方案中,本公开的基于丝素蛋白的微针可包含至少约0.5、0.6、0.7、0.8、0.9、1、2、3、4、5、6、7、8、9、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、150、200、250、300、350、400、450或500μg丝素蛋白的量的丝素蛋白。在一些实施方案中,本公开的基于丝素蛋白的微针可包含至多约0.5、0.6、0.7、0.8、0.9、1、2、3、4、5、6、7、8、9、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、150、200、250、300、350、400、450或500μg丝素蛋白的量的丝素蛋白。在一些实施方案中,本公开的基于丝素蛋白的微针可包含约0.5、0.6、0.7、0.8、0.9、1、2、3、4、5、6、7、8、9、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、150、200、250、300、350、400、450或500μg丝素蛋白的量的丝素蛋白。
[0390]
在一些实施方案中,本公开的基于丝素蛋白的微针包含按重量计约1%至约75%、约1%至约5%、约10%至约60%、约15%至约50%、或约20%至约40%的丝素蛋白。在一些实施方案中,本公开的基于丝素蛋白的微针包含按重量计至少约1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%或75%的丝素蛋白。在一些实施方案中,本公开的基于丝素蛋白的微针包含按重量计至多约1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%或75%的丝素蛋白。在一些实施方案中,本公开的基于丝素蛋白的微针包含按重量计约1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%或75%的丝素蛋白。
[0391]
背衬
[0392]
可用于制造本公开的微针的示例性背衬材料包括但不限于固体支撑物,例如基于纸的材料、塑料材料、聚合物材料或基于聚酯的材料(例如,whatman 903纸、聚合物胶带、塑料胶带、粘合剂背衬聚酯胶带或其他合适的胶带)。在一些实施方案中,背衬包括whatman 903纸。在一些实施方案中,背衬包括聚酯胶带。在一些实施方案中,聚酯胶带包括粘合剂背衬聚酯胶带。在一些实施方案中,背衬材料可用适于粘结和/或粘附到本文所述微针的可溶解基底的粘合剂涂覆(例如,至少在一侧上)。在一些实施方案中,背衬可延伸超出微针阵列。在一些实施方案中,涂覆在背衬上的粘合剂可适于粘附到受试者的皮肤以将阵列保持
在适当位置。
[0393]
本公开的微针中使用的背衬材料可具有各种性质,包括但不限于粘结和/或粘附到溶解性基底层以允许脱模的能力。背衬材料可足够强以便背衬保持贴剂完整性,例如,如果溶解性基底层具有裂缝或不连续的话。背衬材料可以是足够柔性的以便适形于例如非平坦表面,如皮肤表面。特别地,背衬在佩戴期间可以是足够柔性的,如在将贴剂施加(例如,压入)到皮肤之后。背衬可包含非溶解性材料和/或由非溶解性材料组成,使得背衬在贴剂施加到皮肤表面之后和在从皮肤表面移除贴剂期间保持其完整性。
[0394]
在一些实施方案中,背衬层包括粘合剂涂覆塑料胶带、多孔材料和/或粘合剂。在一些实施方案中,粘合剂选自丙烯酸、丙烯酸酯、氰基丙烯酸酯、有机硅、聚氨酯和合成橡胶。在一些实施方案中,粘合剂包括可通过光照射固化的材料。
[0395]
背衬可具有适于施加到目标生物屏障(例如,皮肤表面)的任何形体(dimension)。在一些实施方案中,背衬的形体包括圆形。在一些实施方案中,背衬的形体包括矩形(例如,正方形或矩形条带)。背衬可具有圆角(例如,具有圆角的正方形或矩形)。背衬还可包括例如待用作“把手”的延伸(参见例如图3)。
[0396]
背衬可具有任何合适的尺寸,例如以容纳微针阵列和/或更好地适合于预期的施加部位。例如,背衬可具有约5mm至约50mm的直径,例如,约6mm至约40mm、约8mm至约35mm、约10mm至约30mm、约11mm至约25mm、约12mm至约24mm、约10mm至约20mm、或约10mm至约15mm。在一些实施方案中,背衬具有约5mm或更大的直径,例如,约6mm、7mm、8mm、9mm、10mm、11mm、12mm、13mm、14mm、15mm、16mm、17mm、18mm、19mm、20mm、21mm、22mm、23mm、24mm、25mm或更大。
[0397]
在一些实施方案中,背衬为圆形,具有约8mm至约16mm的直径,例如,约8mm、9mm、10mm、11mm、12mm、13mm、14mm、15mm或16mm。在一些实施方案中,背衬为正方形,具有约8mm x 8mm、约9mm x 9mm、约10mm x 10mm、约11mm x 11mm、约12mm x 12mm、约13mm x 13mm、约14mm x 14mm、约15mm x 15mm、或约16mm x 16mm的尺寸。在一些实施方案中,背衬为矩形(例如,矩形条带),具有约8mm或更大的宽度(例如,约9mm、约10mm、约11mm、约12mm、约13mm或更大的宽度)和大于宽度的长度,例如,约10mm或更大的长度(例如,约11mm、约12mm、约13mm、约14mm、约15mm、约16mm、约17mm、约18mm、约19mm、约20mm、约21mm、约22mm、约23mm、约24mm、约25mm或更大的长度)。
[0398]
在一些实施方案中,背衬的形体可为12mm直径的圆。在一些实施方案中,背衬的形体可为12mm宽的条带,具有超出12mm x 12mm贴剂的边缘至多12mm长的“把手”部分(参见例如图3)。在一些实施方案中,可使用具有大约12mm见方的延伸“把手”的12mm见方聚酯胶带(参见例如图3)。在一些实施方案中,背衬可更大,例如约25mm见方,任选地具有圆角。在一些实施方案中,背衬可为约25mm直径的圆。在一些实施方案中,延伸超出阵列的背衬区域可用于用生物相容性皮肤粘合剂将贴剂保持在皮肤上。
[0399]
可溶解基底
[0400]
基底层(例如,溶解性基底层)形成针的基底(例如,用作可加载有治疗剂(例如,抗癌剂、免疫调节剂或其组合)的远端丝素蛋白尖端的支撑物)。基底层(例如,可溶解基底层)也可用作连接相邻微针以形成微针阵列或微针贴剂的层。
[0401]
在一些实施方案中,基底层(例如,溶解性基底层)包含可例如在预期的佩戴时间(例如,约五分钟)内溶解到受试者中的材料。在一些实施方案中,至少约10%、20%、30%、
40%、50%、60%、70%、80%、90%或100%的可溶解基底层在施加到受试者的生物屏障(例如,皮肤)后在预期的佩戴时间(例如,约1分钟、约2分钟、约3分钟、约4分钟、约5分钟、约6分钟、约7分钟、约8分钟、约9分钟、或约10分钟或更长)内溶解。
[0402]
在可溶解基底的制造中使用的材料可足够坚固以使得微针能够穿透皮肤,并且足够坚韧(例如,不过度脆)以还使得微针在制造期间能够脱模。可溶解基底材料可经受常规的处理而无灾难性失效,并且可在脱模与施加之间保持其机械性质(例如,不会如此吸湿以至于因环境湿度而消散)。可溶解基底层材料在贴剂中使用的剂量下可以是无毒且无反应原性的。在一些实施方案中,可溶解基底层包含水溶性组分。
[0403]
可用于制造基底层(例如,可溶解基底层)的材料的非限制性实例包括多糖、二糖、聚合物、蛋白质、增塑剂和/或表面活性剂。在一些实施方案中,基底层(例如,溶解性基底层)包含以下中的一种或多种(例如,两种或更多种、三种或更多种、四种或更多种、五种或更多种、或全部):多糖(例如,右旋糖酐);二糖(例如,蔗糖、麦芽糖和海藻糖);聚合物(例如,甲基纤维素、聚乙二醇(peg)、羧甲基纤维素(cmc)、聚乙烯基吡咯烷酮(pvp)、聚乙烯醇(pva)、透明质酸盐);蛋白质(例如,明胶、丝素);增塑剂(例如,甘油、丙二醇);和表面活性剂(例如,辛基酚乙氧基化物(例如,triton-x)、聚山梨酯、泊洛沙姆和/或聚乙氧基化醇)。
[0404]
本文公开的基底层可以约0.001%至约75%(例如,约0.001%至约1%,例如,约1%、约2%、约3%、约4%、约5%、约6%、约7%、约8%、约9%、约10%、约15%、约20%、约25%、约30%、或约35%、约40%、约45%、约50%、约55%、约60%、约65%、约70%、或约75%)的浓度包含多糖、二糖、聚合物、蛋白质、增塑剂和/或表面活性剂。在一些情况下,干燥的固体基底可包含浓度至多约100%的多糖、二糖、聚合物、蛋白质、增塑剂和/或表面活性剂。在一些情况下,干燥的固体基底可包含浓度为约0.001%的表面活性剂。
[0405]
在一些实施方案中,基底层(例如,溶解性基底层)配置用于治疗剂(例如,抗癌剂、免疫调节剂或其组合)的突然释放和/或持续释放。在一些实施方案中,基底层(例如,溶解性基底层)包含以下中的一种或多种(例如,两种或更多种、三种或更多种、四种或更多种、五种或更多种、或六种或更多种):明胶、右旋糖酐、甘油、聚乙二醇(peg)、蔗糖、海藻糖、麦芽糖、羧甲基纤维素(cmc)、聚乙烯基吡咯烷酮(pvp)、聚乙烯醇(pva)、透明质酸盐、甲基纤维素和/或表面活性剂(例如,辛基酚乙氧基化物(例如,triton-x)、聚山梨酯、泊洛沙姆和/或聚乙氧基化醇),任选地其中所述微针配置用于持续释放和/或突然释放。
[0406]
在一些实施方案中,基底层(例如,溶解性基底层)包含以下中的一种或多种(例如,两种或更多种、三种或更多种、或四种或更多种):右旋糖酐、蔗糖、甘油和表面活性剂(例如,辛基酚乙氧基化物(例如,triton-x)、聚山梨酯、泊洛沙姆和/或聚乙氧基化醇),任选地配置用于持续释放。
[0407]
在一些实施方案中,基底层(例如,溶解性基底层)包含聚乙烯醇(pva)和蔗糖,任选地配置用于突然释放。
[0408]
在一些实施方案中,基底层(例如,溶解性基底层)包含右旋糖酐。在一些实施方案中,右旋糖酐可具有约30kda至约600kda的分子量。在一些实施方案中,右旋糖酐具有约40kda、约50kda、约60kda、约70kda、约80kda、约90kda、约100kda、约200kda、约300kda、约400kda、约500kda或约600kda的分子量。在一些实施方案中,可使用不同的右旋糖酐的混合物,例如具有各种分子量的右旋糖酐的混合物。在一些实施方案中,右旋糖酐可获得自和/
或源自多种细菌来源,包括但不限于肠膜明串珠菌(leuconostoc mesenteroides)。
[0409]
在一些实施方案中,基底层(例如,溶解性基底层)不包含聚(丙烯酸)(paa)。在一些实施方案中,如本文所述的可溶解基底层具有改善的生物相容性,例如,如与包含聚(丙烯酸)(paa)的可溶解基底层相比。在一些实施方案中,可溶解基底层材料引起减少的炎症应答和/或减少的组织坏死。在一些实施方案中,可溶解基底层材料不为paa,并与paa相比诱导减少的炎症应答和/或减少的组织坏死。在一些实施方案中,可溶解基底层材料具有与其将溶解于其中的生物屏障相似的ph,例如,约4.0至约8.0的ph,例如,约4.0、约4.5、约5.0、约5.5、约6.0、约6.5、约7.0、约7.5、或约8.0。
[0410]
在其他实施方案中,基底层包含丝素蛋白和/或治疗剂。基底层(例如,可溶解基底层)可包含加载到微针和/或微针装置中的治疗剂的总量(例如,剂量)的小于98%(例如,小于约98%、小于约90%、小于约80%、小于约70%、小于约60%、小于约50%、小于约40%、小于约30%、小于约20%、小于约10%、小于约9%、小于约8%、小于约7%、小于约6%、小于约5%、小于约4%、小于约3%、小于约2%、或小于约1%)的治疗剂。
[0411]
在一些实施方案中,基底层不包含例如可检测的量的丝素蛋白和/或治疗剂。在一些实施方案中,基底层配制为限制和/或减少治疗剂从丝素蛋白尖端渗漏(例如,扩散)到基底层中的量,例如如与本领域已知的基底层制剂(例如,包含paa的基底层制剂)相比。在一些实施方案中,可在制造和存放(例如,在约4℃(例如,冷藏)下、在约25℃(例如,室温)下、在约37℃(例如,体温)下、在约45℃下和/或在约50℃下存放)后约1天、约2天、约3天、约4天、约5天、或约6天;约1周、约2周、或约3周;约1个月、约2个月、约3个月、约4个月、约5个月、约6个月、约7个月、约8个月、约9个月、约10个月、或约11个月;或约1年或更长时间测得从丝素蛋白尖端有限和/或减少的量的治疗剂渗漏(例如,扩散),例如如与包含paa的基底层制剂相比。
[0412]
在一些实施方案中,可溶解基质包含约10%至约70%的明胶(例如,水解明胶)(例如,约10%、约20%、约30%、约40%、约50%、约60%、或约70%的明胶)。
[0413]
在一些实施方案中,可溶解基质包含约10%至约70%的增塑剂如甘油(例如,约10%、约20%、约30%、约40%、约50%、约60%、或约70%的甘油)。在一些实施方案中,加入增塑剂以降低脆性。例如,相对于基本上不含增塑剂的可溶解基底层,包含增塑剂的可溶解基底层的脆性可降低约1%、约2%、约4%、约6%、约8%、约10%、约15%、约20%、约30%、约40%、约50%、约60%、约70%、约80%、约90%、约100%、约125%、约150%、约200%、约300%或更多。
[0414]
在一些实施方案中,可溶解基底包含约0.001%至约5%的本文所述的表面活性剂,如聚山梨酯(例如,约0.001%至约1%、或约1%至约5%的表面活性剂)。在一些实施方案中,加入表面活性剂以帮助加工。在一些实施方案中,加入表面活性剂作为增塑剂。
[0415]
在一些实施方案中,可溶解基底包含约1%至约70%的聚乙二醇(peg)(例如,约1%、约2%、约3%、约4%、约5%、约6%、约7%、约8%、约9%、约10%、约20%、约30%、约40%、约50%、约60%、或约70%的peg)。
[0416]
在一些实施方案中,可溶解基底包含约1%至约35%的蔗糖(例如,约1%、约2%、约3%、约4%、约5%、约6%、约7%、约8%、约9%、约10%、约15%、约20%、约25%、约30%、或约35%的蔗糖)。
[0417]
在一些实施方案中,可溶解基底包含约1%至约35%的cmc(例如,约1%、约2%、约3%、约4%、约5%、约6%、约7%、约8%、约9%、约10%、约15%、约20%、约25%、约30%、或约35%的cmc)。
[0418]
在一些实施方案中,可溶解基质包含约10%至约70%的pvp(例如,约10%、约20%、约30%、约40%、约50%、约60%、或约70%的pvp)。
[0419]
在一些实施方案中,可溶解基底包含约1%至约35%的pva(例如,约1%、约2%、约3%、约4%、约5%、约6%、约7%、约8%、约9%、约10%、约15%、约20%、约25%、约30%、或约35%的pva)。
[0420]
在一些实施方案中,可溶解基底包含约1%至约75%的透明质酸盐(例如,约1%、约2%、约3%、约4%、约5%、约6%、约7%、约8%、约9%、约10%、约15%、约20%、约25%、约30%、或约35%、约40%、约45%、约50%、约55%、约60%、约65%、约70%、或约75%的透明质酸盐)。
[0421]
在一些实施方案中,可溶解基底包含约1%至约75%的麦芽糖(例如,约1%、约2%、约3%、约4%、约5%、约6%、约7%、约8%、约9%、约10%、约15%、约20%、约25%、约30%、或约35%、约40%、约45%、约50%、约55%、约60%、约65%、约70%、或约75%的麦芽糖)。
[0422]
在一些实施方案中,可溶解基底包含约1%至约75%的甲基纤维素(例如,约1%、约2%、约3%、约4%、约5%、约6%、约7%、约8%、约9%、约10%、约15%、约20%、约25%、约30%、或约35%、约40%、约45%、约50%、约55%、约60%、约65%、约70%、或约75%的甲基纤维素)。
[0423]
在一些实施方案中,可溶解基底层可包含在去离子(di)水中40%w/v的水解明胶、10%w/v的蔗糖。任选地,基底层可包含1%的低粘度羧甲基纤维素(cmc),其可降低脆性。在一些实施方案中,可溶解基底层可包含在di水中至多50%w/v的10kd mw聚乙烯基吡咯烷酮(pvp);在di水中至多20%的87%水解的13kd mw聚乙烯醇(pva);或在di水中至多10%的cmc。以下组合也可能适合于制造可溶解基底层:30%pvp和10%pva;37%pvp、5%pva和15%蔗糖;或各种其他比例的pvp、pva和蔗糖。
[0424]
可溶解基底层可以是任何合适的形体、大小或形状。例如,可溶解基底层可具有适合容纳微针阵列和/或更好地适合于预期的施加部位的形体、大小或形状。在一些实施方案中,可溶解基底层的形状包括圆形。在一些实施方案中,可溶解基底层的形状包括矩形(例如,正方形或矩形条带)。可溶解基底层可具有圆角(例如,具有圆角的正方形或矩形)或尖角(例如,具有尖角的正方形或矩形)。
[0425]
在一些实施方案中,可溶解基底层具有约5mm至约50mm的直径,例如,约6mm至约40mm、约8mm至约35mm、约10mm至约30mm、约11mm至约25mm、约12mm至约24mm、约10mm至约20mm、或约10mm至约15mm。在一些实施方案中,可溶解基底层具有约5mm或更大的直径,例如,约6mm、7mm、8mm、9mm、10mm、11mm、12mm、13mm、14mm、15mm、16mm、17mm、18mm、19mm、20mm、21mm、22mm、23mm、24mm、25mm或更大。
[0426]
在一些实施方案中,可溶解基底层为圆形,具有约8mm至约16mm的直径,例如,约8mm、9mm、10mm、11mm、12mm、13mm、14mm、15mm或16mm。在一些实施方案中,可溶解基底层为正方形,具有约8mm x 8mm、约9mm x 9mm、约10mm x 10mm、约11mm x 11mm、约12mm x 12mm、约
13mm x 13mm、约14mm x 14mm、约15mm x 15mm、或约16mm x 16mm的尺寸。在一些实施方案中,可溶解基底层为矩形(例如,矩形条带),具有约8mm或更大的宽度(例如,约9mm、约10mm、约11mm、约12mm、约13mm或更大的宽度)和大于宽度的长度,例如,约10mm或更大的长度(例如,约11mm、约12mm、约13mm、约14mm、约15mm、约16mm、约17mm、约18mm、约19mm、约20mm、约21mm、约22mm、约23mm、约24mm、约25mm或更大的长度)。
[0427]
可溶解基底层的厚度可根据具体的微针装置和/或微针装置的预期应用来调节。在一些实施方案中,可溶解基底层的厚度在约0.5mm至1mm之间,例如,约0.55mm至0.95mm之间、约0.60mm至0.90mm之间、约0.65mm至0.85mm之间、或约0.70mm至0.80mm之间。在一些实施方案中,可溶解基底层的厚度为约0.50mm或更大,例如,约0.55mm、约0.60mm、约0.65mm、约0.70mm、约0.75mm、约0.80mm、约0.85mm、约0.90mm、约0.95mm或更大。
[0428]
可溶解基底层可包含一个或多个层,例如通过使用本文所述的方法在微针装置的制备中使用不止一种基底层溶液。在一些实施方案中,可溶解基底层包含单个层。在一些实施方案中,可溶解基底层包含两个层。在一些实施方案中,可溶解基底层包含三个层。在一些实施方案中,可溶解基底层包含四个或更多个层。在一些实施方案中,可溶解基底层包含不止一个层,其中所述层中的一个或多个是不同的,例如,当使用一种或多种不同的基底层溶液组合物形成每个基底层时。在一些实施方案中,可溶解基底层包含不止一个层,其中所述层中的每一个都是不同的。
[0429]
在一些实施方案中,可溶解基底层为大约12mm见方和0.75mm厚。在一些实施方案中,可溶解基底层可覆盖整个贴剂(例如,微针贴剂)。在一些实施方案中,基底层的形体可为12mm直径的圆或12
×
12mm的正方形。
[0430]
丝素蛋白尖端
[0431]
本文提供的方法可用于制造任何形体的丝素蛋白尖端,例如基于丝素蛋白的可植入持续释放和/或突然释放尖端。丝素蛋白尖端可配置为包含和释放有效量的治疗剂(例如,抗癌剂、免疫调节剂或其组合)。
[0432]
在一些实施方案中,所述丝素蛋白尖端具有高度/长度为约75μm至约800μm(例如,约75、约100μm、约125μm、约150μm、约250μm至约300μm、约300μm至约350μm、约350μm至约400μm、约400μm至约450μm、约450μm至约500μm、约500μm至约550μm、约550μm至约600μm、约600μm至约650μm、约650μm至约700μm、约700μm至约750μm、约750μm至约800μm)的尺寸。
[0433]
在一些实施方案中,丝素蛋白尖端(例如,可植入尖端)可具有任何大小的直径,例如基于旨在被尖端刺穿的生物屏障(例如,皮肤层、肿瘤、组织、细胞膜、粘液表面、口腔、或颊腔)的类型。在一些实施方案中,丝素蛋白尖端具有约10μm或更小(例如,约1μm至约10μm,例如,约1μm或更小、约2μm或更小、约3μm或更小、约4μm或更小、约5μm或更小、约6μm或更小、约7μm或更小、约8μm或更小、约9μm或更小、或约10μm或更小)的尖端半径。在实施方案中,尖端可具有约50nm至约50μm(例如,约50nm至约250nm、约250nm至约500nm、约500至约750nm、约750nm至约1μm、约1μm至约5μm、约5μm至约10μm、约10μm至约15μm、约15μm至约20μm、约20μm至约25μm、约25μm至约30μm、约30μm至约35μm、约35μm至约40μm、约40μm至约45μm、或约45μm至约50μm)的尺寸(例如,直径)。可以理解的是,不存在阻止尖端具有甚至更小直径的基本限制(例如,已经证明丝复制品浇铸(silk replica casting)的极限是数十nm的分辨率,参见例如perry等人,20adv.mat.3070(2008))。
same;wo 2008/127403,biopolymer optofluidic device&method of manufacturing the same;wo 2008/127401,biopolymer optical wave guide&method of manufacturing same;wo 2008/140562,biopolymer sensor&method of manufacturing same;wo 2008/127405,microfluidic device with cylindrical microchannel&method for fabricating same;wo 2008/106485,tissue-engineered silk organs;wo 2008/140562,electroactive biopolymer optical&electro-optical devices&method of manufacturing same;wo 2008/150861,method for silk fibroin gelation using sonication;wo 2007/103442,biocompatible scaffolds&adipose-derived stem cells;wo 2009/155397,edible holographic silk products;wo 2009/100280,3-dimensional silk hydroxyapatite compositions;wo 2009/061823,fabrication of silk fibroin photonic structures by nanocontact imprinting;wo 2009/126689,system&method for making biomaterial structures。
[0437]
在各种实施方案中,基于丝素蛋白的微针尖端可还包含至少一种另外的治疗剂,其中所述另外的治疗剂可分散在整个微针中或形成微针尖端的至少一部分。在一些实施方案中,所述另外的治疗剂可用于治疗本文所述的疾病和/或病症,如癌症。任选地,基于丝素蛋白的微针尖端可还包含如本文所述的赋形剂和/或佐剂。
[0438]
在实施方案中,微针尖端可由丝素蛋白制成并可包含本文所述的治疗剂(例如,抗癌剂、免疫调节剂或其组合)。在一些实施方案中,由于真皮中的专职抗原呈递细胞群体远高于皮下空间中,故可将尖端设计成部署到皮肤的真皮层中(例如,不部署到皮下空间中)。在人类中,基于位置及患者年龄和健康,真皮的厚度为约1000-2000μm(例如,约1-2mm)。在啮齿动物中,真皮薄得多(例如,小鼠~100-300μm,大鼠~800-1200μm)。不希望受理论的束缚,使用650μm高的微针,尖端(例如,可植入的持续释放尖端)可部署在约100μm至约600μm的深度处以实现如本文所述的治疗剂的受控释放或持续释放。
[0439]
不受理论的束缚,本文所述微针的制造中使用的丝素蛋白溶液的分子量可充当调节治疗剂(例如,抗癌剂、免疫调节剂或其组合)从尖端的释放的控制因子。在一些实施方案中,较高分子量的丝素蛋白溶液可有利于较慢的受控释放或持续释放(例如,将初始突释的量(例如,第0天释放的量)减少至少约10%并然后在至少约接下来的4天内释放另外的抗原)。在一些实施方案中,抗癌剂、免疫调节剂或其组合从尖端的受控释放或持续释放可在至少约4天(例如,约4、5、6、7、8、9、10、11、12、13或14天或更多天,例如约4天至约15天,例如约1-2周、约1-3周或约1-4周)内。在一些实施方案中,释放发生在约1周至约2周内。
[0440]
在实施方案中,本文所述微针的制造中使用的丝素蛋白溶液可为包含具有一定范围的分子量的丝素蛋白片段的群体的低分子量丝素蛋白组合物,其特征在于:所述群体中丝素蛋白片段总数的不超过15%具有超过200kda的分子量,并且所述群体中丝素蛋白片段总数的至少50%具有在指定范围内的分子量,其中所述指定范围为约3.5kda至约120kda、或约5kda至约125kda。换言之,本文所述微针的制造中使用的丝素蛋白溶液可包含具有一定范围的分子量的丝素蛋白片段的群体,其特征在于:所述群体中丝素蛋白片段总摩尔数的不超过15%具有超过200kda的分子量,并且所述群体中丝素蛋白片段总摩尔数的至少50%具有在指定范围内的分子量,其中所述指定范围为约3.5kda至约120kda、或约5kda至约125kda(参见例如wo2014/145002,其通过引用并入本文)。
[0441]
示例性的丝素蛋白(例如,再生丝素蛋白)溶液可具有不同的分子量分布,例如,如通过尺寸排阻色谱法(sec)所测定(参见例如图5)。在一些实施方案中,丝素蛋白溶液可例如根据已建立的方法制备。在一些实施方案中,在通过sec分析之前,首先将来自家蚕的茧在0.02m na2co3中煮沸以除去存在于未加工的天然丝中的丝胶蛋白。在一些实施方案中,丝素蛋白组合物可为通过在常压沸腾温度下将来自家蚕(bombyx mori)的茧脱胶约480分钟或更少、例如小于480分钟、小于400分钟、小于300分钟、小于200分钟、小于180分钟、小于120分钟、小于100分钟、小于60分钟、小于50分钟、小于40分钟、小于30分钟、小于20分钟、小于10分钟或更短时间而产生的组合物或混合物。在一个实施方案中,丝素蛋白组合物可为通过在常压沸腾温度下在碳酸钠水溶液中将丝茧脱胶约480分钟或更少,例如小于480分钟、小于400分钟、小于300分钟、小于200分钟、小于180分钟、小于120分钟、小于100分钟、小于60分钟、小于50分钟、小于40分钟、小于30分钟、小于20分钟、小于10分钟或更短时间而产生的组合物或混合物。
[0442]
在一些实施方案中,丝素蛋白溶液可为煮沸10分钟(10mb)、煮沸60分钟(60mb)、煮沸120分钟(120mb)、煮沸180分钟(180mb)或煮沸480分钟(480mb)的丝素蛋白溶液(参见例如图5)。在一些实施方案中,治疗剂如抗癌剂、免疫调节剂或其组合可配制在1%w/v至约10%w/v(例如,约1、2、3、4、5、6、7、8、9或10%w/v)的10mb丝素蛋白溶液中。在一些实施方案中,治疗剂如抗癌剂、免疫调节剂或其组合可配制在1%w/v至约10%w/v(例如,约1、2、3、4、5、6、7、8、9或10%w/v)的60mb丝素蛋白溶液中。在一些实施方案中,治疗剂如抗癌剂、免疫调节剂或其组合可配制在1%w/v至约10%w/v(例如,约1、2、3、4、5、6、7、8、9或10%w/v)的120mb丝素蛋白溶液中。在一些实施方案中,治疗剂如抗癌剂、免疫调节剂或其组合可配制在1%w/v至约10%w/v(例如,约1、2、3、4、5、6、7、8、9或10%w/v)的180mb丝素蛋白溶液中。在一些实施方案中,治疗剂如抗癌剂、免疫调节剂或其组合可配制在1%w/v至约10%w/v(例如,约1、2、3、4、5、6、7、8、9或10%w/v)的480mb丝素蛋白溶液中。
[0443]
在一些实施方案中,丝素蛋白尖端(例如,可植入的持续释放尖端)可包含约0.5μg至约500μg丝素蛋白的量的丝素蛋白。在一些实施方案中,丝素蛋白尖端(例如,可植入的持续释放尖端)可以约0.5μg至约5μg、或约1μg至约10μg、或约5μg至约15μg、或约10μg至约20μg、或约15μg至约25μg、或约20μg至约30μg、或约25μg至约35μg、或约30μg至约40μg、或约35μg至约45μg、或约40μg至约50μg、或约45μg至约55μg、或约50μg至约60μg、或约55μg至约65μg、或约60μg至约70μg、或约65μg至约75μg、或约70μg至约80μg、或约75μg至约85μg、或约80μg至约90μg、或约85μg至约95μg、或约90μg至约100μg、或约95μg至约150μg、或约125μg至约175μg、或约150μg至约200μg、或约225μg至约275μg、或约250μg至约300μg、或约325μg至约375μg、或约350μg至约400μg、或约425μg至约475μg、或约450μg至约500μg的量包含丝素蛋白。在一些实施方案中,丝素蛋白尖端(例如,可植入的持续释放尖端)可包含至少约0.5、0.6、0.7、0.8、0.9、1、2、3、4、5、6、7、8、9、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、150、200、250、300、350、400、450或500μg丝素蛋白的量的丝素蛋白。在一些实施方案中,丝素蛋白尖端(例如,可植入的持续释放尖端)可包含至多约0.5、0.6、0.7、0.8、0.9、1、2、3、4、5、6、7、8、9、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、150、200、250、300、350、400、450或500μg丝素蛋白的量的丝素蛋白。在一些实施方案中,丝素蛋白尖端(例如,可植入的持续释放尖端)可包含约0.5、0.6、0.7、0.8、0.9、1、2、
3、4、5、6、7、8、9、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、150、200、250、300、350、400、450或500μg丝素蛋白的量的丝素蛋白。
[0444]
在一些实施方案中,丝素蛋白尖端(例如,可植入的持续释放尖端)包含按重量计约1%至约75%、约1%至约5%、约10%至约60%、约15%至约50%、或约20%至约40%的丝素蛋白。在一些实施方案中,丝素蛋白尖端(例如,可植入的持续释放尖端)包含按重量计至少约1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%或75%的丝素蛋白。在一些实施方案中,丝素蛋白尖端(例如,可植入的持续释放尖端)包含按重量计至多约1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、或75%的丝素蛋白。在一些实施方案中,丝素蛋白尖端(例如,可植入的持续释放尖端)包含按重量计约1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%或75%的丝素蛋白。
[0445]
不受理论的束缚,丝素蛋白尖端(例如,可植入的持续释放尖端)的主要可调性在于其结晶度,结晶度经由β-折叠含量(分子间和分子内β-折叠)测量。这影响丝尖端基质的溶解性和保留抗原的能力。随着β-折叠含量的增加,尖端的机械强度也变得更强。特定的治疗剂(例如,抗癌剂和/或免疫调节剂)释放曲线通过调节丝基质的结晶度和扩散性来实现。这通过丝输入材料和制剂两者以及增加结晶度的后处理(例如,水退火、甲醇/溶剂退火)来完成。在一些实施方案中,丝素蛋白尖端(例如,可植入的受控释放或持续释放微针尖端)包含约10%至约60%(例如,约10%、约20%、约30%、约40%、约50%、约60%)的β-折叠含量,例如,如基于“结晶度指数”,例如本领域已知的“结晶度指数”。在一些实施方案中,丝素蛋白尖端(例如,可植入的受控释放或持续释放微针尖端)可配制为颗粒(例如,微米颗粒和/或纳米颗粒)。
[0446]
在另一方面,本公开的特征在于微针(例如,基于丝素蛋白的微针),其可稳定设置在微针中的治疗剂(例如,抗癌剂、免疫调节剂或两者),例如部分由于微针组合物的热稳定性质(例如,丝素蛋白组合物的热稳定性质)。在一些实施方案中,通过本文所述的微针或微针装置稳定抗癌剂、免疫调节剂或两者(例如,本文所述的抗癌剂或免疫调节剂)。不希望受理论束缚,本公开的微针或微针装置稳定治疗剂的能力可便于微针装置的存放,例如以防止存放期间治疗剂生物活性的损失。此外,可在施用微针或微针装置之后保持治疗剂的生物活性。例如,治疗剂可稳定在丝素蛋白尖端内,例如,以防止在施用微针或微针装置后在体温下释放(例如,受控释放)期间生物活性的损失。
[0447]
在一些实施方案中,抗癌剂和/或免疫调节剂在例如室温(例如,约25℃)下存放2周或更多周的时间段后保留其原始生物活性的至少50%(例如,约50%、60%、70%、80%、90%、92%、94%、96%、98%、99%、99.5%或更多)。在一些实施方案中,抗癌剂和/或免疫调节剂在约25℃下存放至少约2周(例如,约2周、约3周、约4周、约5周、约6周、约7周、约8周、约9周、约10周、约11周、或约12周)的时间段后保留其原始生物活性的至少70%、80%或90%。在一些实施方案中,抗癌剂和/或免疫调节剂在约37℃下存放至少约2周(达约2周、约3周、约4周、约5周、约6周、约7周、约8周、约9周、约10周、约11周、或约12周)的时间段后保留其原始生物活性的至少60%、70%或80%。在一些实施方案中,抗癌剂和/或免疫调节剂在约45℃下存放至少约2周(达约2周、约3周、约4周、约5周、约6周、约7周、约8周、约9周、约10
周、约11周、或约12周)的时间段后保留其原始生物活性的至少50%、60%或70%。
[0448]
在一些实施方案中,本公开的基于丝素蛋白的微针将稳定细胞因子。例如,丝素蛋白可在一定范围的温度下存放(例如,在4℃、室温(例如,25℃)或37℃下存放)期间,包括长时间(例如,1、2、3、4、5、6、7、8、9、10、11、12、13或14天或更多天,1、2、3或4周或更多周,1、2、3、4、5、6、7、8、9、10、11或12个月或更多个月,或1、2、3或4年或更多年)存放期间,稳定细胞因子(例如,白介素,如il-2)。在一些实施方案中,基于丝素蛋白的微针将稳定白介素。在一些实施方案中,基于丝素蛋白的微针将稳定白介素-2(il-2)。在一些实施方案中,基于丝素蛋白的微针将在4℃下至少14天的时间段内稳定il-2。在一些实施方案中,基于丝素蛋白的微针将在室温(约25℃)下至少14天的时间段内稳定il-2。在一些实施方案中,基于丝素蛋白的微针将在体温(约37℃)下至少14天的时间段内稳定il-2。
[0449]
微针尺寸
[0450]
在一些实施方案中,本公开提供了具有各种尺寸和几何形状的基于丝素蛋白的微针和包含其的装置。
[0451]
在实施方案中,可将基于丝素蛋白的微针的长度制造得足够长以使得能够将包含治疗剂(例如,抗癌剂、免疫调节剂或其组合)的丝素蛋白尖端递送(例如,植入)到生物屏障(例如,皮肤)内的期望深度,例如以诱导抗癌反应,例如以诱导免疫应答。
[0452]
在一些实施方案中,生物屏障为肿瘤和/或皮肤病变。
[0453]
在一些实施方案中,基于丝素蛋白的微针的长度可为约350μm至约1500μm(例如,约350μm、约400μm、约450μm、约500μm、约550μm、约600μm、约650μm、约700μm、约750μm、约800μm、约850μm、约900μm、约950μm、约1000μm、约1050μm、约1100μm、约1150μm、约1200μm、约1250μm、约1300μm、约1350μm、约1400μm、约1450μm、约1500μm)。
[0454]
在一些实施方案中,基于丝素蛋白的微针长度足以使得能够递送至表皮(例如,皮肤表面下约10μm至120μm)。
[0455]
在一些实施方案中,基于丝素蛋白的微针长度足以使得能够递送至真皮(例如,皮肤表面下约60μm至约2.1mm)。
[0456]
在一些实施方案中,基于丝素蛋白的微针长度足以使得能够递送至眼睛(例如,眼睛表面下约10μm至120μm)。
[0457]
在一些实施方案中,基于丝素蛋白的微针长度足以使得能够递送至肿瘤(例如,肿瘤表面下约10μm至120μm)。
[0458]
在一些实施方案中,微针配置为将丝素蛋白尖端以约100μm至约600μm的深度(例如,尖端的远部的最大穿透深度)植入到受试者的生物屏障中。在一些实施方案中,微针的长度为约350μm至约1500μm。在一些实施方案中,丝素蛋白尖端的高度可延伸至微针的整个高度的大约一半。在一些实施方案中,丝素蛋白尖端的高度为约75μm至约475μm。在一些实施方案中,丝素蛋白尖端包含约0.5μm至约25μm的尖端半径。在一些实施方案中,丝素蛋白尖端包含约5μm至约10μm的尖端半径。在一些实施方案中,丝素蛋白尖端包含约5度至约45度的角度。
[0459]
在一些实施方案中,丝素蛋白尖端(例如,可植入尖端)可具有任何大小的直径,例如基于旨在被尖端刺穿的生物屏障(例如,皮肤层)的类型。在一些实施方案中,丝素蛋白尖端具有约10μm或更小(例如,约1μm至约10μm,例如,约1μm或更小、约2μm或更小、约3μm或更
小、约4μm或更小、约5μm或更小、约6μm或更小、约7μm或更小、约8μm或更小、约9μm或更小、或约10μm或更小)的尖端半径。在实施方案中,尖端可具有约50nm至约50μm(例如,约50nm至约250nm、约250nm至约500nm、约500至约750nm、约750nm至约1μm、约1μm至约5μm、约5μm至约10μm、约10μm至约15μm、约15μm至约20μm、约20μm至约25μm、约25μm至约30μm、约30μm至约35μm、约35μm至约40μm、约40μm至约45μm、或约45μm至约50μm)的尺寸(例如,直径)。可以理解的是,不存在阻止尖端具有甚至更小直径的基本限制(例如,已经证明丝复制品浇铸(silk replica casting)的极限是数十nm的分辨率,参见例如perry等人,20adv.mat.3070(2008))。
[0460]
在一些实施方案中,丝素蛋白尖端点(例如,可植入的持续释放尖端点)的锐度在本文中以尖端半径描述。本文所述微针的制造中使用的模具设计为具有约0.5μm至约10μm(例如,约0.5μm、0.6μm、0.7μm、0.8μm、0.9μm、1μm、2μm、3μm、4μm、5μm、6μm、7μm、8μm、9μm、或10μm)的尖端半径。在一些实施方案中,尖端半径在约20μm至约25μm之间(例如,约20μm、21μm、22μm、23μm、24μm或25μm)。不受理论的束缚,可以理解较钝的针可能需要更大的力来穿透表皮。在实施方案中,丝素蛋白尖端(例如,可植入的持续释放尖端)的其他尺寸可通过模具的形状和填充体积来控制。在一些实施方案中,丝素蛋白尖端(例如,可植入的持续释放尖端)可具有约5度至约45度的夹角(例如,约5、6、7、8、9、10、15、20、25、30、35、40或45度)。在一些实施方案中,尖端可具有约15度至45度的夹角(例如,约15度、约16度、约17度、约18度、约19度、约20度、约21度、约22度、约23度、约24度、约25度、约26度、约27度、约28度、约29度、约30度、约31度、约32度、约33度、约34度、约35度、约36度、约37度、约38度、约39度、约40度、约41度、约42度、约43度、约44度或约45度)。
[0461]
不希望受理论的束缚,本领域技术人员可针对多种因素调节基于丝素蛋白的微针长度,所述因素包括但不限于组织厚度,例如皮肤厚度(例如,随年龄、性别、身体上的位置、受试者物种(例如,人)而变化),药物递送特性,治疗剂的扩散性质(例如,治疗剂的离子电荷和/或分子量、和/或形状),或其任何组合。
[0462]
然而,不希望受理论的束缚,使用大约650μm高的微针可将丝素蛋白尖端以约100μm至约600μm的深度部署(例如,植入)到受试者的皮肤的真皮层内以实现治疗剂(例如,抗癌剂、免疫调节剂或其组合)从丝素蛋白尖端的释放(例如,突然释放或持续释放)。在一些实施方案中,微针可为约800μm高(例如,约500μm至1200μm高)。
[0463]
用于组合疗法的基于丝素蛋白的微针装置
[0464]
在一些实施方案中,本公开的基于丝素蛋白的微针装置(例如,微针贴剂)可包含多根本文公开的微针。基于丝素蛋白的微针装置(例如,微针贴剂)可包含多根相同类型的微针。替代地,微针装置可包含多根不同类型的微针。
[0465]
例如,基于丝素蛋白的微针装置可包含多根包含抗癌剂的微针。在一些实施方案中,基于丝素蛋白的微针装置可包含多根包含抗癌剂的组合(例如,两种、三种、四种、五种、六种或更多种抗癌剂)的微针。对于配置为递送抗癌剂的组合(例如,两种、三种、四种、五种、六种或更多种抗癌剂)的微针,微针装置可包含例如多根相同的微针,所述微针包含(例如,所有)抗癌剂的相同组合;或包含多根不同的微针,所述微针包含不同的抗癌剂或抗癌剂的不同组合。在一些实施方案中,多根微针包含一种抗癌剂。在一些实施方案中,多根微针包含两种或更多种抗癌剂(例如,两种、三种、四种、五种、六种或更多种抗癌剂)。
[0466]
在一些实施方案中,基于丝素蛋白的微针装置可包含多根包含免疫调节剂的微针。在一些实施方案中,基于丝素蛋白的微针装置可包含多根包含免疫调节剂的组合(例如,两种、三种、四种、五种、六种或更多种抗癌剂)的微针。对于配置为递送免疫调节剂的组合(例如,两种、三种、四种、五种、六种或更多种免疫调节剂)的微针,微针装置可包含例如多根相同的微针,所述微针包含(例如,所有)免疫调节剂的相同组合;或包含多根不同的微针,所述微针包含不同的免疫调节剂或免疫调节剂的不同组合。在一些实施方案中,多根微针包含一种免疫调节剂。在一些实施方案中,多根微针包含两种或更多种免疫调节剂(例如,两种、三种、四种、五种、六种或更多种免疫调节剂)。
[0467]
在一些实施方案中,基于丝素蛋白的微针装置可包含多根包含抗癌剂和免疫调节剂的组合的微针。对于配置为递送抗癌剂和免疫调节剂的组合的微针,微针装置可包含例如多根包含抗癌剂和免疫调节剂的相同组合的相同微针;或多根包含抗癌剂和免疫调节剂的不同组合的不同微针。
[0468]
在一些实施方案中,对于配置为递送抗癌剂和免疫调节剂的组合的微针,微针装置可包含:多根包含一种抗癌剂的微针;多根包含两种或更多种抗癌剂(例如,两种、三种、四种、五种、六种或更多种抗癌剂)的微针;多根包含一种免疫调节剂的微针;多根包含两种或更多种免疫调节剂(例如,两种、三种、四种、五种、六种或更多种免疫调节剂)的微针;和/或多根既包含抗癌剂(例如,一种、两种、三种、四种、五种、六种或更多种抗癌剂)又包含免疫调节剂(例如,一种、两种、三种、四种、五种、六种或更多种免疫调节剂)的微针。
[0469]
在一些实施方案中,多根微针可以随机或预定图案布置以形成微针或贴剂,如本文所述。贴剂可包含粘附到基底背面的载体、背衬或“把手”层(参见例如图3)。该层可提供结构支撑和区域,通过该区域可在不干扰针阵列的情况下抓握和操作贴剂。
[0470]
本文所述的微针装置(例如,微针贴剂)可设计成容纳不同数量的微针。在一些实施方案中,微针装置包含至少50根微针,例如至少约60根、约64根、约70根、约80根、约81根、约90根、约100根、约110根、约121根、约144根、约150根、约169根、约175根、约196根、约200根、约225根、约250根、约256根、约289根、约300根或更多根微针。在一些实施方案中,微针装置(例如,微针贴剂)包含约50根微针至500根微针,例如约50根至400根微针、约75根至约300根微针、约100根至200根微针、或约100根至150根微针。微针可排列成网格,例如正方形网格。在一些实施方案中,微针排列成8
×
8网格、9
×
9网格、10
×
10网格、11
×
11网格、12
×
12网格、13
×
13网格、14
×
14网格、15
×
15网格、16
×
16网格或17
×
17网格。在一些实施方案中,微针排列成11
×
11网格。在一些实施方案中,微针装置具有约0.5mm至1.0mm的间距,例如,约0.55mm、0.60mm、0.65mm、0.70mm、0.75mm、0.80mm、0.85mm、0.95mm或1mm。在一些实施方案中,微针装置具有约0.75mm的间距。
[0471]
在一些实施方案中,微针装置包含成11
×
11正方形网格的约121根针,间距为大约0.75mm。在一些实施方案中,微针装置(例如,微针贴剂)可包含成11
×
11正方形网格的约121根针,间距为大约0.75mm。在一些实施方案中,微针装置包含一根一根单独的针,所述单独的针为具有大约0.35mm的基底直径和大约30
°
的夹角的大约0.65mm长的圆锥体。在一些实施方案中,微针装置包含一根一根单独的针,所述单独的针具有丝素蛋白尖端,其中所述针的丝素蛋白尖端足够尖锐以穿透生物屏障(例如,皮肤)。在一些实施方案中,微针装置包含一根一根单独的针,所述单独的针具有丝素蛋白尖端,其中所述丝素蛋白尖端的曲率半
径理想地应不大于0.01mm。
[0472]
本公开的示例性微针和装置在图2-4中描绘。
[0473]
释放动力学
[0474]
所公开的基于丝素蛋白的微针可配置为根据各种释放动力学来释放治疗剂或治疗剂的组合(例如,抗癌剂、免疫调节剂或其组合)。
[0475]
在一些实施方案中,基于丝素蛋白的微针可配置为释放有效量的抗癌剂和/或免疫调节剂以在受试者中诱导抗癌反应。在某些实施方案中,抗癌剂和/或免疫调节剂的释放将增强受试者免疫系统对与癌症相关的新抗原的暴露,从而诱导对受试者中待激活和/或扩增的新抗原特异性的免疫效应细胞,例如,t细胞。抗癌剂和/或免疫调节剂的释放可促进受试者中对癌症的长时间免疫的发生。
[0476]
在一些实施方案中,基于丝素蛋白的微针可配置为通过突然释放来释放治疗剂或治疗剂的组合(例如,抗癌剂、免疫调节剂或其组合)。在一些实施方案中,突然释放包括向受试者快速施用抗癌剂和/或免疫调节剂。突然释放可包括快速施用存在于丝素蛋白尖端中的抗癌剂总量和/或免疫调节剂总量的大于0%部分至约100%部分(例如,约1%至约25%、约25%至约50%、约50%至约75%、约75%至约100%)。在一些实施方案中,突然释放是在包括至少约1小时(例如,约1至约30分钟,例如,约1、2、3、4、5、6、7、8、9、10、15、20或24小时)的时间段内。
[0477]
在一些实施方案中,基于丝素蛋白的微针可配置为通过持续释放来释放治疗剂或治疗剂的组合(例如,抗癌剂、免疫调节剂或其组合)。持续释放的实例包括但不限于零级释放、一级释放和二级释放。在一些实施方案中,零级释放为与剂型(例如,微针)中的治疗剂浓度无关的释放速率。在一些实施方案中,零级释放为在一段时间内大致恒定的治疗剂释放(例如,每单位时间释放恒定量的治疗剂)。在一些实施方案中,一级释放为是剂型(例如,微针)中剩余的治疗剂的量的函数的释放速率。在一些实施方案中,一级释放为每单位时间从剂型(例如,微针)释放恒定比例如百分数的治疗剂。在一些实施方案中,二级释放为当将剂型中的治疗剂浓度加倍时释放速率增至四倍。在一些实施方案中,持续释放包括基本上连续地低剂量施用抗癌剂和/或免疫调节剂。持续释放可包括连续施用存在于丝素蛋白尖端中的抗癌剂总量和/或免疫调节剂总量的约大于0%部分至约100%部分(例如,约1%至约25%、约25%至约50%、约50%至约75%、约75%至约100%)。在一些实施方案中,持续释放是在包括至少约3天(例如,约3、4、5、6、7天或更多天,例如,约5天至约10天,例如,约7天至约15天,例如,约1周至约2周、约1周至约3周、或约2周至约4周,例如,约1个月至约3个月,例如,约2个月至约4个月,例如,约3个月至约6个月)的时间段内。在某些实施方案中,持续释放是在约7天至约15天的时间段内。
[0478]
在一些实施方案中,治疗剂(例如,抗癌剂、免疫调节剂或其组合)从本文所述的基于丝素蛋白的微针的释放(例如,施用)可通过治疗剂从微针或其部分的扩散来促进。
[0479]
在一些实施方案中,治疗剂(例如,抗癌剂、免疫调节剂或其组合)从本文所述的基于丝素蛋白的微针的释放(例如,施用)可通过微针或其部分的降解(例如,蛋白酶介导的降解)来促进。
[0480]
在一些实施方案中,治疗剂(例如,抗癌剂、免疫调节剂或其组合)从本文所述的基于丝素蛋白的微针的释放(例如,施用)可通过微针或其部分的溶解来促进。
[0481]
不希望受理论的束缚,抗癌剂的释放可与免疫调节剂的释放以基本上相同的速率(例如,同时地)发生。在其他实施方案中,抗癌剂的释放可以与免疫调节剂的释放速率不同的速率发生,使得抗癌剂基本上在免疫调节剂的释放之前或基本上在免疫调节剂的释放之后释放。
[0482]
治疗剂
[0483]
在一些实施方案中,本公开提供了包含治疗剂(例如,抗癌剂、免疫调节剂或其组合)的基于丝素蛋白的微针。本公开还提供了用于施用本文公开的微针与另外的疗法的组合治疗方法。可引入到本公开的基于丝素蛋白的微针中和/或可以与本公开的基于丝素的微针的组合疗法施用的治疗剂的非限制性实例在下文公开。
[0484]
抗癌剂
[0485]
在一些实施方案中,本公开的基于丝素蛋白的微针可包含低分子量或小分子量化疗剂和/或可与低分子量或小分子量化疗剂组合施用。示例性的低分子量或小分子量化疗剂包括但不限于13-顺式-视黄酸(异维甲酸,)、2-cda(2-氯脱氧腺苷,克拉屈滨,leustatin
tm
)、5-氮胞苷(阿扎胞苷,)、5-氟尿嘧啶(5-fu,氟尿嘧啶,)、6-巯基嘌呤(6-mp,巯基嘌呤,)、6tg(6-硫代鸟嘌呤,硫鸟嘌呤,thioguanine)、abraxane(白蛋白结合型紫杉醇)、放线菌素-d(更生霉素,)、阿利维a酸全反式维a酸(atra,维a酸,)、六甲蜜胺(六甲基密胺,hmm,)、氨甲蝶呤(甲氨蝶呤,甲氨蝶呤钠,mtx,trexall
tm
,)、氨磷汀阿糖胞嘧啶(ara-c,阿糖胞苷,)、三氧化二砷天冬酰胺酶(欧文氏菌l-天冬酰胺酶,l-天冬酰胺酶,)、bcnu(卡氯芥,)、苯达莫司汀贝沙罗汀博来霉素白消安甲酰四氢乙酸钙(嗜橙菌因子,甲酰四氢乙酸,亚叶酸)、喜树碱-11(cpt-11,伊立替康,)、卡培他滨卡波铂卡莫司汀晶片(具有卡莫司汀植入物的prolifeprospan 20,晶片)、cci-779(替西罗莫司,)、ccnu(洛莫司汀,ceenu)、cddp(顺铂,)、苯丁酸氮芥(瘤可宁)、环磷酰胺达卡巴嗪(dic,dtic,咪唑羧酰胺,)、柔红霉素(柔红比星,盐酸柔红比星,盐酸柔红霉素,)、地西他滨右丙亚胺dhad(米托蒽醌,)、多西他赛阿霉素表柔比星(ellence
tm
)、艾瑞布林雌氮芥依托泊苷(vp-16,磷酸依托泊苷,)、氟尿苷氟达拉滨
氟尿嘧啶(乳膏)(carac
tm
,)、吉西他滨羟基脲(droxia
tm
,mylocel
tm
)、伊达比星异环磷酰胺伊沙匹隆(ixempra
tm
)、lcr(醛基长春碱,长春新碱,vcr,vincasar)、l-pam(l-溶肉瘤素,美法仑,苯丙氨酸氮芥,)、双氯乙基甲胺(双氯乙基甲胺盐酸盐,氮芥(mustine/nitrogen mustard)、)、巯乙磺酸钠(mesnex
tm
)、丝裂霉素(丝裂霉素-c,mtc,)、奈拉滨奥沙利铂(eloxatin
tm
)、紫杉醇(onxal
tm
)、培门冬酶(peg-l-天冬酰胺酶,)、培美曲塞喷司他丁丙卡巴肼链佐星替莫唑胺替尼泊苷(vm-26,)、tespa(硫代磷酰胺,噻替派,tspa,)、拓扑替康长春碱(硫酸长春碱(vinblastine sulfate/vincaleukoblastine),vlb,)、长春瑞滨(酒石酸长春瑞滨,)和伏立诺他
[0486]
在一些实施方案中,本公开的基于丝素蛋白的微针可包含fda批准的靶向疗法和/或可与fda批准的靶向疗法组合施用。例如,为了治疗黑色素瘤,本公开的基于丝素蛋白的微针可包含比美替尼考比替尼达拉非尼康奈非尼曲美替尼和/或维莫非尼和/或可与比美替尼考比替尼达拉非尼康奈非尼曲美替尼和/或维莫非尼组合施用。
[0487]
在一些实施方案中,为了治疗基底细胞癌,本公开的基于丝素蛋白的微针可包含索尼德吉和/或维莫德吉和/或可与索尼德吉和/或维莫德吉组合施用。
[0488]
在一些实施方案中,为了治疗乳腺癌,本公开的基于丝素蛋白的微针可包含玻玛西尼阿培利西奥拉帕利帕博西尼瑞博西尼和/或他拉唑帕利和/或可与玻玛西尼阿培利西奥拉帕利帕博西尼瑞博西尼和/或他拉唑帕利组合施用。
[0489]
在一些实施方案中,本公开的基于丝素蛋白的微针可包含生物制剂和/或可与生物制剂组合施用。可用于癌症治疗中的生物制剂是本领域已知的,并且如本文所述的基于丝素蛋白的微针可例如与此类已知的生物制剂结合施用。例如,fda已批准以下生物制剂用
于治疗乳腺癌:(曲妥珠单抗,genentech inc.(加利福尼亚州南旧金山);在her2-阳性乳腺癌中具有抗肿瘤活性的人源化单克隆抗体);(氟维司群,astrazeneca pharmaceuticals,lp(特拉华州威尔明顿);用于治疗乳腺癌的雌激素受体拮抗剂);(阿那曲唑,astrazeneca pharmaceuticals,lp;阻断芳香酶的非甾体芳香酶抑制剂,芳香酶是产生雌激素所需的酶);(依西美坦,pfizer inc.(纽约州纽约市);用于乳腺癌治疗中的不可逆甾体芳香酶灭活剂);(来曲唑,novartis pharmaceuticals(新泽西州东汉诺威);经fda批准用于治疗乳腺癌的非甾体芳香酶抑制剂);和(他莫昔芬,astrazeneca pharmaceuticals,lp;fda批准用于治疗乳腺癌的非甾体抗雌激素)。可与本公开的基于丝素蛋白的微针组合的其他生物制剂包括:(贝伐珠单抗,genentech inc.;设计用于抑制血管生成的第一种fda批准疗法);和(替伊莫单抗,biogen idec(马萨诸塞州剑桥);目前批准用于治疗b-细胞淋巴瘤的放射性标记单克隆抗体)。
[0490]
另外,fda已批准以下生物制剂用于治疗结肠直肠癌:另外,fda已批准以下生物制剂用于治疗结肠直肠癌:(西妥昔单抗,imclone systems inc.(纽约州纽约市)和bristol-myers squibb(纽约州纽约市);为针对表皮生长因子受体(egfr)的单克隆抗体);(甲磺酸伊马替尼;蛋白激酶抑制剂);和(盐酸左旋咪唑,janssen pharmaceutica products,lp(新泽西州泰特斯维尔);1990年fda批准在dukes分期c期结肠癌患者中手术切除后与5-氟尿嘧啶组合作为辅助治疗的免疫调节剂)。
[0491]
对于肺癌的治疗,示例性的生物制剂包括(厄洛替尼hcl,osi pharmaceuticals inc.(纽约州梅尔维尔);设计用于靶向人表皮生长因子受体1(her1)通路的小分子)。
[0492]
对于多发性骨髓瘤的治疗,示例性的生物制剂包括velcade(硼替佐米,millennium pharmaceuticals(马萨诸塞州剑桥);蛋白酶体抑制剂)。另外的生物制剂包括(沙利度胺,clegene corporation(新泽西州沃伦县);一种免疫调节剂并且似乎具有多种作用,包括抑制骨髓瘤细胞生长和存活以及抗血管生成的能力)。
[0493]
另外的示例性癌症治疗性抗体包括但不限于3f8、阿巴伏单抗(abagovomab)、阿德木单抗(adecatumumab)、恩美曲妥珠单抗(ado-trastuzumab emtansine)阿托珠单抗(afutuzumab)、培化阿珠单抗(alacizumab pegol)、阿仑单抗(alemtuzumab)喷替酸阿妥莫单抗(altumomab pentetate)麻安莫单抗(anatumomab mafenatox)、安芦珠单抗(anrukinzumab)(ima-638)、阿泊珠单抗(apolizumab)、阿西莫单抗(arcitumomab)阿替利珠单抗(atezolizumab)阿维鲁单抗(avelumab)巴土昔单抗(bavituximab)、贝妥莫单抗(bectumomab)贝利木单抗(belimumab)
贝索单抗(besilesomab)贝伐珠单抗(bevacizumab)比伐单抗-bmi(bivatuzumab mertansine)、兰妥莫单抗(blinatumomab)、brentuximab vedotin、美坎珠单抗(cantuzumab mertansine)、卡罗单抗喷地肽(capromab pendetide)卡妥索单抗(catumaxomab)cc49、西米普利单抗-rwlc(cemiplimab-rwlc)西妥昔单抗(cetuximab)(c225,)、泊西他珠单抗(citatuzumab bogatox)、西妥木单抗(cixutumumab)、clivatuzumab tetraxetan、可那木单抗(conatumumab)、达西珠单抗(dacetuzumab)、地舒单抗(denosumab)地莫单抗(detumomab)、依美昔单抗(ecromeximab)、依决洛单抗(edrecolomab)埃罗妥珠单抗(elotuzumab)、西依匹莫单抗(epitumomab cituxetan)、依帕珠单抗(epratuzumab)、厄马索单抗(ertumaxomab)埃达珠单抗(etaracizumab)、法勒珠单抗(farletuzumab)、芬妥木单抗(figitumumab)、夫苏木单抗(fresolimumab)、加利昔单抗(galiximab)、吉妥珠单抗奥佐米星(gemtuzumab ozogamicin)吉瑞昔单抗(girentuximab)、格莱木单抗维多汀(glembatumumab vedotin)、替伊莫单抗(ibritumomab)(ibritumomab tiuxetan,)、伊戈伏单抗(igovomab)英妥木单抗(intetumumab)、伊珠单抗奥佐米星(inotuzumab ozogamicin)、伊匹单抗(ipilimumab)、伊妥木单抗(iratumumab)、拉贝珠单抗(labetuzumab)来沙木单抗(lexatumumab)、林妥珠单抗(lintuzumab)、鲁卡木单抗(lucatumumab)、鲁昔单抗(lumiliximab)、马帕木单抗(mapatumumab)、马妥珠单抗(matuzumab)、米拉珠单抗(milatuzumab)、明瑞莫单抗(minretumomab)、米妥莫单抗(mitumomab)、他那可单抗(nacolomab tafenatox)、他那莫单抗(naptumomab estafenatox)、耐昔妥珠单抗(necitumumab)、尼妥珠单抗(nimotuzumab)巯诺莫单抗(nofetumomab merpentan)奥法木单抗(ofatumumab)olaratumab、莫奥珠单抗(oportuzumab monatox)、奥戈伏单抗(oregovomab)帕木单抗(panitumumab)帕尼单抗(pemtumomab)培妥珠单抗(pertuzumab)平妥莫单抗(pintumomab)、普立木单抗(pritumumab)、雷莫芦单抗(ramucirumab)、兰尼单抗()利妥木单抗(rilotumumab)、利妥昔单抗(rituximab)利妥木单抗(rilotumumab)、利妥昔单抗(rituximab)罗妥木单抗(robatumumab)、沙妥莫单抗喷地肽(satumomab pendetide)、西罗珠单抗(sibrotuzumab)、siltuximab、松妥珠单抗(sontuzumab)、他珠单抗(tacatuzumab tetraxetan)帕他莫单抗(taplitumomab paptox)、替妥莫单抗(tenatumomab)、tgn1412、替西木单抗(ticilimumab)(曲美木单抗(tremelimumab))、替加珠单抗(tigatuzumab)、tnx-650、托西莫单抗(tositumomab)曲妥珠单抗(trastuzumab)曲妥珠
单抗和透明质酸酶-oysk(trastuzumab and hyaluronidase-oysk)(herceptin )、曲美木单抗(tremelimumab)、西莫白介素单抗(tucotuzumab celmoleukin)、维妥珠单抗(veltuzumab)、伏洛昔单抗(volociximab)、伏妥昔单抗(votumumab)扎芦木单抗(zalutumumab)和扎木单抗(zanolimumab)
[0494]
在其他实施方案中,本公开的基于丝素蛋白的微针可包含病毒癌症治疗剂和/或可与病毒癌症治疗剂组合施用。示例性的病毒癌症治疗剂包括但不限于痘苗病毒(vvdd-cdsr)、表达癌胚抗原的麻疹病毒、重组痘苗病毒(tk-缺失加gm-csf)、塞内卡谷病毒-001、新城疫病毒、表达柯萨奇病毒a21、gl-onc1、ebna1 c-末端/lmp2嵌合蛋白的重组修饰痘苗安卡拉疫苗、表达癌胚抗原的麻疹病毒、g207溶瘤病毒、表达p53的修饰痘苗病毒安卡拉疫苗、oncovex gm-csf修饰的1型单纯疱疹病毒、禽痘病毒疫苗载体、重组痘苗前列腺特异性抗原疫苗、人乳头瘤病毒16/18l1病毒样颗粒/as04疫苗、mva-ebna1/lmp2 inj.疫苗、四价hpv疫苗、四价人乳头瘤病毒(6、11、16、18型)重组疫苗重组禽痘-cea(6d)/tricom疫苗;重组痘苗-cea(6d)-tricom疫苗、重组修饰痘苗安卡拉-5t4疫苗、重组禽痘-tricom疫苗、溶瘤疱疹病毒nv1020、hpv l1 vlp疫苗v504、人乳头瘤病毒双价(16和18型)疫苗单纯疱疹病毒hf10、ad5cmv-p53基因、重组痘苗df3/muc1疫苗、重组痘苗-muc-1疫苗、重组痘苗-tricom疫苗、alvac mart-1疫苗、表达人前脑啡肽原(np2)的复制缺陷型单纯疱疹病毒i型(hsv-1)载体、野生型呼肠孤病毒、呼肠孤病毒3型dearing溶瘤病毒hsv1716、编码爱泼斯坦-巴尔病毒靶标抗原的基于重组修饰痘苗安卡拉(mva)的疫苗、重组禽痘-前列腺特异性抗原疫苗、重组痘苗前列腺-特异性抗原疫苗、重组痘苗-b7.1疫苗、rad-p53基因、ad5-δ24rgd、hpv疫苗580299、jx-594(胸苷激酶缺失痘苗病毒加gm-csf)、hpv-16/18l1/as04、禽痘病毒疫苗载体、痘苗-酪氨酸酶疫苗、medi-517hpv-16/18vlp as04疫苗、含有单纯疱疹病毒的胸苷激酶的腺病毒载体tk99un、hspe7、fp253/氟达拉滨、alvac(2)黑色素瘤多抗原治疗疫苗、alvac-hb7.1、金丝雀痘-hil-12黑色素瘤疫苗、ad-reic/dkk-3、rad-ifn sch 721015、til-ad-infg、ad-isf35和柯萨奇病毒a21(cva21、)。在其他实施方案中,本公开的基于丝素蛋白的微针可包含拉他莫基(一种fda批准的黑色素瘤治疗)和/或可与拉他莫基组合施用。
[0495]
在其他实施方案中,本公开的基于丝素蛋白的微针可包含新抗原疫苗和/或可与新抗原疫苗组合施用。在某些实施方案中,新抗原疫苗可如例如schumacher等人,science.348(6230):69-74,2015中所述制备,其通过引用整体并入本文。在一些实施方案中,本文公开的微针可用于鉴定新抗原的方法中,和/或用于制备新抗原疫苗的方法中。不希望受理论的束缚,源自肿瘤组织中随机体细胞突变的癌症新抗原是包括癌症疫苗在内的癌症免疫疗法的有吸引力的靶标类型。针对肿瘤特异性新抗原的疫苗接种使中枢和外周耐受的潜在诱导以及自身免疫的风险最小化。(参见例如guo等人,frontiers in immunology.vol.9article 1499,2018,其通过引用整体并入本文)。在某些实施方案中,将本公开的微针施用于肿瘤可导致受试者的免疫系统暴露于肿瘤特异性新抗原,并导致对具
有相同或相似肿瘤特异性新抗原的癌症的疫苗接种和免疫的发生。
[0496]
在其他实施方案中,本公开的基于丝素蛋白的微针可包含纳米药物和/或可与纳米药物组合施用。示例性的癌症纳米药物包括但不限于(紫杉醇结合白蛋白纳米颗粒)、crlx101(与基于线形环糊精的聚合物缀合的喜树碱(cpt))、crlx288(多西他赛与可生物降解的聚合物聚(乳酸-共-乙醇酸)缀合)、阿糖胞苷脂质体(脂质体ara-c,depocyt
tm
)、柔红比星脂质体多柔比星脂质体包囊柠檬酸多柔比星脂质体和peg抗-vegf适体
[0497]
在一些实施方案中,本公开的基于丝素蛋白的微针可包含紫杉醇或紫杉醇制剂(例如,)、蛋白质结合的紫杉醇(例如,)和/或可与紫杉醇或紫杉醇制剂(例如,)、蛋白质结合的紫杉醇(例如,)组合施用。示例性的紫杉醇制剂包括但不限于纳米颗粒白蛋白结合紫杉醇(abraxis bioscience出售)、二十二碳六烯酸结合紫杉醇(dha-紫杉醇,二十二碳六烯酸紫杉醇,protarga出售)、聚谷氨酸盐结合紫杉醇(pg-紫杉醇,聚谷氨酸紫杉醇,ct-2103,xyotax,cell therapeutic出售)、肿瘤激活前药(tap)、ang105(angiopep-2与三分子紫杉醇结合,immunogen出售)、紫杉醇-ec-1(紫杉醇与erbb2-识别肽ec-1结合;参见li等人,biopolymers(2007)87:225-230)和葡萄糖缀合紫杉醇(例如,2-吡喃葡萄糖基琥珀酸2'-紫杉醇甲酯(参见例如liu等人,bioorganic&medicinal chemistry letters(2007)17:617-620)。
[0498]
用于治疗癌症的示例性rnai和反义rna药剂包括但不限于calaa-01、sig12d loder(local drug eluter)和aln-vsp02。
[0499]
其他癌症治疗剂包括但不限于细胞因子(例如,阿地白介素(il-2、白介素-2、)、α干扰素(ifn-α、干扰素α、a(干扰素α-2b)、(干扰素α-2a))、阿法依泊汀非格司亭(g-csf、粒细胞集落刺激因子、)、gm-csf(粒细胞巨噬细胞集落刺激因子、沙莫司亭、leukine
tm
)、il-11(白介素-11、奥普瑞白介素、)、干扰素α-2b(peg缀合物)(peg干扰素、peg-intron
tm
)、和聚乙二醇非格司亭(neulasta
tm
))、激素治疗剂(例如,氨鲁米特阿那曲唑比卡鲁胺依西美坦氟甲睾酮氟他胺氟维司群戈舍瑞林来曲唑亮脯利特(eligard
tm
、lupronviadur
tm
)、甲地孕酮(醋酸甲地孕酮、)、尼鲁米特奥曲肽(醋酸奥曲肽、sandostatin)、雷洛昔芬罗米司亭他莫昔芬和托瑞米芬)、磷脂酶a2
抑制剂(例如,阿那格雷)、生物反应调节剂(例如,bcg和达依泊汀α)、靶向疗法药剂(例如,硼替佐米达沙替尼(sprycel
tm
)、地尼白介素-毒素连接物厄洛替尼依维莫司吉非替尼甲磺酸伊马替尼(sti-571、gleevec
tm
)、拉帕替尼索拉非尼和su11248(舒尼替尼、))、免疫调节和抗血管生成剂(例如,cc-5013(来那度胺、)和沙利度胺)、糖皮质激素(例如,可的松(氢化可的松、氢化可的松磷酸酯钠、氢化可的松琥珀酸钠、hydrocort氢化可的松磷酸盐)、地卡特隆(地塞米松、醋酸地塞米松、地塞米松磷酸钠、隆(地塞米松、醋酸地塞米松、地塞米松磷酸钠、)、甲基泼尼松龙(6-甲基泼尼松龙、醋酸甲基泼尼松龙、甲基泼尼松龙琥珀酸钠、醋酸甲基泼尼松龙、甲基泼尼松龙琥珀酸钠、)、泼尼松龙和泼尼松尼松和双膦酸盐(例如,帕米磷酸盐和唑来膦酸
[0500]
在一些实施方案中,本公开的基于丝素蛋白的微针可包含酪氨酸激酶抑制剂(例如,受体酪氨酸激酶(rtk)抑制剂)和/或可与酪氨酸激酶抑制剂(例如,受体酪氨酸激酶(rtk)抑制剂)组合施用。示例性的酪氨酸激酶抑制剂包括但不限于表皮生长因子(egf)通路抑制剂(例如,表皮生长因子受体(egfr)抑制剂)、血管内皮生长因子(vegf)通路抑制剂(例如,抗vegf抗体、vegf捕获剂、血管内皮生长因子受体(vegfr)抑制剂(例如,vegfr-1抑制剂、vegfr-2抑制剂、vegfr-3抑制剂))、血小板来源生长因子(pdgf)通路抑制剂(例如,血小板来源生长因子受体(pdgfr)抑制剂(例如,pdgfr-β抑制剂))、raf-1抑制剂、kit抑制剂和ret抑制剂。在一些实施方案中,与ahcm药剂组合使用的抗癌剂选自:阿昔替尼(ag013736)、博舒替尼(ski-606)、西地尼布(recentintm、azd2171)、达沙替尼(bms-354825)、厄洛替尼吉非替尼伊马替尼(cgp57148b、sti-571)、拉帕替尼来他替尼(cep-701)、来那替尼(hki-272)、尼洛替尼semaxanib(semaxinib、su5416)、舒尼替尼(su11248)、托西尼布凡德他尼(zd6474)、瓦他拉尼(ptk787、ptk/zk)、曲妥珠单抗贝伐珠单抗利妥昔单抗西妥昔单抗帕尼单抗兰尼单抗尼洛替尼索拉非
尼阿仑单抗吉妥珠单抗奥佐米星enmd-2076、pci-32765、ac220、乳酸多维替尼(tki258、chir-258)、bibw 2992(tovoktm)、sgx523、pf-04217903、pf-02341066、pf-299804、bms-777607、abt-869、mp470、bibf 1120ap24534、jnj-26483327、mgcd265、dcc-2036、bms-690154、cep-11981、替沃扎尼(av-951)、osi-930、mm-121、xl-184、xl-647、xl228、aee788、ag-490、ast-6、bms-599626、cudc-101、pd153035、培利替尼(ekb-569)、凡德他尼(zactima)、wz3146、wz4002、wz8040、abt-869(利尼伐尼)、aee788、ap24534(普纳替尼)、av-951(替沃扎尼)、阿昔替尼、bay 73-4506(瑞戈非尼)、丙氨酸布立尼布(bms-582664)、布立尼布(bms-540215)、西地尼布(azd2171)、chir-258(多维替尼)、cp 673451、cyc116、e7080、ki8751、马赛替尼(ab1010)、mgcd-265、二磷酸莫替沙尼(amg-706)、mp-470、osi-930、盐酸帕唑帕尼、pd173074、甲苯磺酸索拉非尼(bay 43-9006)、su 5402、tsu-68(su6668)、瓦他拉尼、xl880(gsk1363089、exel-2880)。所选择的酪氨酸激酶抑制剂选自舒尼替尼、厄洛替尼、吉非替尼或索拉非尼。在一个实施方案中,酪氨酸激酶抑制剂为舒尼替尼。
[0501]
在一些实施方案中,本公开的基于丝素蛋白的微针可包含以下中的一种或多种和/或可与以下中的一种或多种组合施用:抗血管生成剂、或血管靶向剂或血管破坏剂。示例性的抗血管生成剂包括但不限于血管内皮生长因子(vegf)抑制剂(例如,抗vegf抗体(例如,贝伐珠单抗);vegf受体抑制剂(例如,伊曲康唑);细胞增殖和/或内皮细胞迁移的抑制剂(例如,羧胺三唑、tnp-470);血管生成刺激剂的抑制剂(例如,苏拉明),等。血管靶向剂(vta)或血管破坏剂(vda)设计为损伤导致中心性坏死的癌症肿瘤的脉管系统(血管)(在例如thorpe,p.e.(2004)clin.cancer res.vol.10:415-427中综述)。vta可以是小分子。示例性的小分子vta包括但不限于微管去稳定药物(例如,考布他汀a-4磷酸二钠盐(ca4p)、zd6126、ave8062、oxi 4503);和瓦迪梅赞(vadimezan)(asa404)。
[0502]
在某些实施方案中,本文所述的抗癌剂可配制在持续释放颗粒中。
[0503]
免疫调节剂
[0504]
检查点抑制剂
[0505]
在一些实施方案中,本公开的基于丝素蛋白的微针可包含免疫检查点抑制剂和/或可与免疫检查点抑制剂组合施用。例如,在某些实施方案中,基于丝素蛋白的微针可用于与检查点抑制剂(例如,抗pd1抗体)的全身施用(例如,通过注射)组合地向受试者的肿瘤局部施用治疗剂(例如,抗癌剂和/或免疫调节剂)。
[0506]
在实施方案中,免疫检查点抑制剂抑制检查点分子。示例性的检查点分子包括但不限于ctla4、pd1、pd-l1、pd-l2、tim3、lag3、cd160、2b4、cd80、cd86、b7-h3(cd276)、b7-h4(vtcn1)、hvem(tnfrsf14或cd270)、btla、kir、mhc i类、mhc ii类、gal9、vista、btla、tigit、lair1和a2ar。参见例如pardoll.nat.rev.cancer 12.4(2012):252-64,其通过引用并入本文。
[0507]
在一些实施方案中,免疫检查点抑制剂为pd-1抑制剂,例如抗pd-1抗体如纳武单抗、派姆单抗或匹地利珠单抗。纳武单抗(也称为mdx-1106、mdx-1106-04、ono-4538或bms-936558)是将特异性抑制pd1的全人igg4单克隆抗体。参见例如us 8,008,449和wo2006/121168。派姆单抗(也称为兰博单抗、mk-3475、mk03475、sch-900475或
merck)是将与pd-1结合的人源化igg4单克隆抗体。(参见例如hamid,o.等人,(2013)new england journal of medicine 369(2):134
–
44;us 8,354,509和wo2009/114335)。匹地利珠单抗(也称为ct-011或cure tech)是将与pd1结合的人源化igg1k单克隆抗体。(参见例如wo2009/101611)。在一个实施方案中,pd-1的抑制剂为具有与纳武单抗、派姆单抗或匹地利珠单抗的序列基本上相同或相似的序列、例如与纳武单抗、派姆单抗或匹地利珠单抗的序列至少85%、90%、95%相同或更高的序列的抗体分子。另外的抗pd1抗体,例如amp514(amplimmune),见述于例如us 8,609,089、us 2010028330和/或us 20120114649中。
[0508]
在一些实施方案中,pd-1抑制剂为免疫粘附素,例如,包含融合到恒定区(例如,免疫球蛋白的fc区)的pd-1配体(例如,pd-l1或pd-l2)的细胞外/pd-1结合部分的免疫粘附素。在实施方案中,pd-1抑制剂为amp-224(b7-dcig,例如见述于wo2011/066342和wo2010/027827中),其为将阻断b7-h1与pd-1之间的相互作用的pd-l2 fc融合可溶性受体。
[0509]
在一些实施方案中,免疫检查点抑制剂为pd-l1抑制剂,例如,抗体分子。在一些实施方案中,pd-l1抑制剂为yw243.55.s70、mpdl3280a、medi-4736、msb-0010718c或mdx-1105。在一些实施方案中,抗pd-l1抗体为msb0010718c(也称为a09-246-2;merck serono),其为将与pd-l1结合的单克隆抗体。示例性的人源化抗pd-l1抗体见述于例如wo2013/079174中。在一个实施方案中,pd-l1抑制剂为抗pd-l1抗体,例如,yw243.55.s70。yw243.55.s70抗体见述于例如wo 2010/077634中。在一个实施方案中,pd-l1抑制剂为mdx-1105(也称为bms-936559),其见述于例如wo2007/005874中。在一个实施方案中,pd-l1抑制剂为mdpl3280a(genentech/roche),其为针对pd-l1的人fc-优化igg1单克隆抗体。参见例如美国专利号:7,943,743和美国公开号:20120039906。在一个实施方案中,pd-l1的抑制剂为具有与yw243.55.s70、mpdl3280a、medi-4736、msb-0010718c或mdx-1105的序列基本上相同或相似的序列、例如与yw243.55.s70、mpdl3280a、medi-4736、msb-0010718c或mdx-1105的序列至少85%、90%、95%相同或更高的序列的抗体分子。
[0510]
在实施方案中,免疫检查点抑制剂为pd-l2抑制剂,例如amp-224(其为将阻断pd1与b7-h1之间的相互作用的pd-l2 fc融合可溶性受体)。参见例如wo2010/027827和wo2011/066342。
[0511]
在一个实施方案中,免疫检查点抑制剂为lag-3抑制剂,例如,抗lag-3抗体分子。在实施方案中,抗lag-3抗体为bms-986016(也称为bms986016;bristol-myers squibb)。bms-986016和其他人源化抗lag-3抗体见述于例如us 2011/0150892、wo2010/019570和wo2014/008218中。
[0512]
在实施方案中,免疫检查点抑制剂为tim-3抑制剂,例如,抗tim3抗体分子,例如见述于美国专利号8,552,156、wo 2011/155607、ep 2581113和美国公开号2014/044728中。
[0513]
在实施方案中,免疫检查点抑制剂为ctla-4抑制剂,例如,抗ctla-4抗体分子。示例性的抗ctla4抗体包括曲美木单抗(来自pfizer的igg2单克隆抗体,原先称为替西木单抗,cp-675,206);和伊匹单抗(也称为mdx-010,cas no.477202-00-9)。其他示例性的抗ctla-4抗体见述于例如美国专利号5,811,097中。
[0514]
tlr激动剂
[0515]
在一些实施方案中,本公开的基于丝素蛋白的微针可包含toll样受体(tlr)激动剂和/或可与toll样受体(tlr)激动剂组合施用。
[0516]
tlr为模式识别受体的家族,其最初被鉴定为是识别微生物病原体的先天免疫系统的传感器。在人类中,tlr包括tlr-1、tlr-2、tlr-3、tlr-4、tlr-5、tlr-6、tlr-7、tlr-8、tlr-9和tlr-10。tlr-1、tlr-2、tlr-4、tlr-5和tlr-6在细胞的表面上表达,而tlr-3、tlr-7/8和tlr-9在er区室中表达。可基于不同的tlr表达模式来鉴定人树突状细胞亚群。人树突状细胞的骨髓或“常规”亚群表达tlr 1-8,而树突状细胞的浆细胞样亚群仅表达tlr-7和tlr-9。与tlr结合的配体会引起细胞内信号传导通路的级联,其诱导参与炎症和免疫的因子的产生。在刺激后,人树突状细胞的骨髓亚群和浆细胞样亚群分别导致nk细胞和t-细胞的抗原特异性cd4 和cd8 t细胞引发和激活。
[0517]
在一些实施方案中,tlr激动剂选自tlr-1激动剂、tlr-2激动剂、tlr-3激动剂、tlr-4激动剂、tlr-5激动剂、tlr-6激动剂、tlr-7激动剂、tlr-8激动剂、tlr-9激动剂、tlr-10激动剂、tlr-1/2激动剂、tlr-2/6激动剂、或tlr-7/8激动剂中的一种或多种。在一个实施方案中,tlr激动剂为tlr7激动剂。
[0518]
在一些实施方案中,tlr激动剂为咪喹莫特或3-(2-甲基丙基)-3,5,8-三氮杂三环[7.4.0.02,6]十三-1(9),2(6),4,7,10,12-己烯-7-胺。咪喹莫特或3-(2-甲基丙基)-3,5,8-三氮杂三环[7.4.0.02,6]十三-1(9),2(6),4,7,10,12-己烯-7-胺可结合并激活tlr-7和/或tlr-8。
[0519]
在一些实施方案中,tlr激动剂为852a。852a在例如inglefield等人,j interferon cytokine res.2008;28(4):253-63中有公开。852a可结合并激活tlr-7和/或tlr-8。
[0520]
在一些实施方案中,tlr激动剂为卡介苗(bcg)。bcg可结合并激活tlr-9。
[0521]
在一些实施方案中,tlr激动剂为emd 120108。emd 120108为含有硫代磷酸酯寡聚脱氧核苷酸的合成寡核苷酸。emd 1201081可结合并激活tlr-9,例如,在单核细胞/巨噬细胞、浆细胞样树突状细胞(dc)和b细胞中,从而启动免疫信号传导通路、激活b细胞并诱导辅助性t细胞细胞因子的产生。
[0522]
在一些实施方案中,tlr激动剂为imo-2055。imo-2055为含有未甲基化的cpg二核苷酸的合成寡核苷酸。在细菌dna中模拟未甲基化的cpg序列,imo-2055可结合并激活tlr-9,例如,在单核细胞/巨噬细胞、浆细胞样树突状细胞(dc)和b细胞中,从而启动免疫信号传导通路、激活b细胞和dc并诱导辅助性t细胞细胞因子的产生。
[0523]
可在组合中使用的其他示例性tlr激动剂包括例如tlr-1/2激动剂(例如,pam3cys)、tlr-2激动剂(例如,cfa、malp2、pam2cys、fsl-1或hib-ompc)、tlr-3激动剂(例如,聚肌胞苷酸(poly i:c)、聚腺苷-聚尿苷酸(poly au)、用聚-l-赖氨酸和羧甲基纤维素稳定的聚肌苷酸-聚胞苷酸)、tlr-4激动剂(例如,单磷酰脂质a(mpl)、lps、唾液酰-tn(stn))、tlr-5激动剂(例如,细菌鞭毛蛋白)、tlr-7激动剂(例如,咪喹莫特)、tlr-7/8激动剂(例如,瑞喹莫德或洛索立宾)和tlr-9激动剂(例如,未甲基化的cpg二核苷酸(cpg-odn))。
[0524]
在另一个实施方案中,tlr激动剂与gitr激动剂组合使用,例如如wo2004/060319和国际公开号wo2014/012479中所述。
[0525]
sting激动剂
[0526]
在一些实施方案中,本公开的基于丝素蛋白的微针可包含sting激动剂和/或可与
sting激动剂组合施用。
[0527]
在一些实施方案中,sting激动剂为环状二核苷酸,例如包含嘌呤或嘧啶核碱基(例如,腺苷、鸟嘌呤、尿嘧啶、胸腺嘧啶或胞嘧啶核碱基)的环状二核苷酸。在一些实施方案中,环状二核苷酸的核碱基包含相同的核碱基或不同的核碱基。
[0528]
在一些实施方案中,sting激动剂包含腺苷或鸟苷核碱基。在一些实施方案中,sting激动剂包含一种腺苷核碱基和一种鸟苷核碱基。在一些实施方案中,sting激动剂包含两种腺苷核碱基或两种鸟苷核碱基。
[0529]
在一些实施方案中,sting激动剂包含经修饰的环状二核苷酸,例如,包含经修饰的核碱基、经修饰的核糖或经修饰的磷酸键。在一些实施方案中,经修饰的环状二核苷酸包含经修饰的磷酸键,例如,硫代磷酸酯。
[0530]
在一些实施方案中,sting激动剂包含具有2’,5’或3’,5’磷酸键的环状二核苷酸(例如,经修饰的环状二核苷酸)。在一些实施方案中,sting激动剂包含在磷酸键周围具有rp或sp立体化学的环状二核苷酸(例如,经修饰的环状二核苷酸)。
[0531]
在一些实施方案中,sting激动剂为rp,rp二硫代2',3'c-二-amp(例如,rp,rp-二硫代c-[a(2',5')pa(3',5')p])或其环状二核苷酸类似物。在一些实施方案中,sting激动剂为美国专利公开号us2015/0056224中描述的化合物(例如,图2c中的化合物,例如,化合物21或化合物22)。在一些实施方案中,sting激动剂为c-[g(2',5')pg(3',5')p]、其二硫代核糖o-取代的衍生物或在pct公开号wo 2014/189805和wo 2014/189806的图4中描绘的化合物。在一些实施方案中,sting激动剂为c-[a(2',5')pa(3',5')p]或其二硫代核糖o-取代的衍生物,或为在pct公开号wo 2014/189805和wo 2014/189806的图5中描绘的化合物。在一些实施方案中,sting激动剂为c-[g(2',5')pa(3',5')p]或其二硫代核糖o-取代的衍生物,或为在pct公开号wo 2014/189805和wo 2014/189806的图5中描绘的化合物。在一些实施方案中,sting激动剂为2'-0-炔丙基-环状-[a(2',5')pa(3',5')p](2'-0-炔丙基-ml-cda)或pct公开号wo 2014/189806的图7中描绘的化合物。
[0532]
其他示例性的sting激动剂在例如pct公开号wo 2014/189805和wo 2014/189806及美国公开号2015/0056225中有公开。
[0533]
rig激动剂
[0534]
在一些实施方案中,本公开的基于丝素蛋白的微针可包含rig激动剂(即,由基因ddx58编码的视黄酸诱导基因i(rig-i)的激动剂)和/或可与所述rig激动剂组合施用。示例性的rig激动剂见述于elion等人,oncotarget.9(48):29007
–
29017,2018中,其通过引用整体并入本文。
[0535]
细胞因子
[0536]
在一些实施方案中,本公开的基于丝素蛋白的微针可包含细胞因子和/或可与细胞因子组合施用。
[0537]
细胞因子通常为例如通过信号转导途径影响细胞活性的多肽。因此,细胞因子是有用的并可与受体介导的信号传导相关,该信号传导从细胞膜外部传递信号以调节细胞内的反应。细胞因子为蛋白质信号传导化合物,是免疫应答的介质。它们控制许多不同的细胞功能,包括增殖、分化和细胞存活/凋亡;细胞因子还参与若干病理生理学过程,包括病毒感染和自身免疫性疾病。细胞因子在各种刺激下由先天免疫系统(单核细胞、巨噬细胞、树突
状细胞)和适应性免疫系统(t-细胞和b-细胞)的各种细胞合成。细胞因子可分为两组:促炎性和抗炎性。促炎性细胞因子,包括ifnγ、il-1、il-6和tnf-α,主要来源于先天免疫细胞和th1细胞。抗炎性细胞因子,包括il-10、il-4、il-13和il-5,由th2免疫细胞合成。
[0538]
因此,在一些实施方案中,细胞因子分子为白介素或其变体,例如其功能变体。在一些实施方案中,白介素为促炎性白介素。在一些实施方案中,白介素选自白介素-2(il-2)、白介素-12(il-12)、白介素-15(il-15)、白介素-18(il-18)、白介素-21(il-21)、白介素-7(il-7)或干扰素γ。在一些实施方案中,细胞因子分子为促炎性细胞因子。在一个实施方案中,细胞因子分子为il-18。
[0539]
细胞因子可以是野生型(例如,野生型重组体)或基因工程化的(例如,以引入一个或多个突变)。在一些实施方案中,细胞因子为工程化细胞因子,例如工程化白介素。在一些实施方案中,工程化细胞因子包含一个或多个突变,例如以提供相对于野生型变体不同的生物学性质。例如,细胞因子分子可以是工程化的“抗诱饵”白介素(例如,抗诱饵il-18),如zhou等人(nature(2020)583:609-614,其通过引用整体并入本文)所描述。在一些实施方案中,细胞因子为工程化白介素(例如,工程化的il-2或工程化的il-18)。
[0540]
在一些实施方案中,细胞因子被工程化以改善一种或多种药代动力学性质。在一些实施方案中,工程化细胞因子包含与另一分子(例如,抗体)融合的细胞因子,例如以增加细胞因子的血清半衰期。在一些实施方案中,细胞因子与长半衰期蛋白质或蛋白质结构域融合(例如,fc融合、转铁蛋白[tf]融合或白蛋白融合)。在一些实施方案中,细胞因子与惰性多肽(例如,xten或重组peg(rpeg);均氨基酸聚合物(hap;例如,通过hap化);脯氨酸-丙氨酸-丝氨酸聚合物(pas;例如,通过pas化);或弹性蛋白样肽(elp;例如,通过elp化))融合。在一些实施方案中,细胞因子与重复化学部分(例如,聚合物,例如通过peg化的peg;或透明质酸)缀合,例如以增加细胞因子的流体动力学半径。在一些实施方案中,增加细胞因子的负电荷,例如通过细胞因子的多聚唾液酸化,或通过融合带负电荷的高度唾液酸化的肽(例如,羧基末端肽[ctp;绒毛膜促性腺激素(cg)β-链的])到细胞因子。在一些实施方案中,细胞因子与长半衰期蛋白质例如hsa、人igg或转铁蛋白非共价结合。在一些实施方案中,细胞因子化学缀合至长半衰期蛋白质,例如人igg、fc部分或hsa。制备和使用融合蛋白及类似修饰的蛋白(例如,为了延长半衰期)的方法已见描述(参见例如strohl等人,biodrugs(2015)29:215-239;及其中引用的参考文献)。
[0541]
工程化细胞因子(例如,工程化白介素)可通过已知的方法产生,例如通过定向进化技术(参见例如zhou等人,见上文)。工程化细胞因子(例如,工程化白介素)的实例已见描述(参见例如wo 2012/107417;wo 2009/061853;美国专利号:9,580,486;minsahwi等人,front immunol.2020(11);1794;tang等人,cytokine x(2019)100001;mitra等人,immunity(2015)42:826-838;casades
ú
s等人,oncoimmunology(2020)9:1770565;zhou等人,见上文;其各自通过引用整体并入本文)。
[0542]
不希望受理论的束缚,工程化细胞因子(例如,“抗诱饵”白介素,例如抗诱饵的il-18)可具有与其野生型对应物相比有利的性质。举例来说,抗诱饵的il-18可保持信号传导潜能但保持不受il-18结合蛋白(il-18bp)抑制的影响。在一些实施方案中,与野生型细胞因子相比,工程化细胞因子具有改善的稳定性(例如,改善的温度依赖性稳定性、ph依赖性稳定性或两者)。在一些实施方案中,相对于野生型细胞因子,工程化细胞因子具有改善的
血清半衰期。在一些实施方案中,不同于野生型细胞因子,工程化细胞因子对受体具有改变的亲和力(例如,增强的亲和力)。在一些实施方案中,相对于野生型细胞因子,工程化细胞因子具有较低的毒性。
[0543]
在某些实施方案中,细胞因子为单链细胞因子。在某些实施方案中,细胞因子为多链细胞因子(例如,细胞因子包含2条或更多条(例如,2条)多肽链)。一种示例性的多链细胞因子为il-12。
[0544]
有用的细胞因子的实例包括但不限于gm-csf、il-1α、il-1β、il-2、il-3、il-4、il-5、il-6、il-7、il-8、il-10、il-12、il-18、il-21、ifn-α、ifn-β、ifn-γ、mip-1α、mip-1β、tgf-β、tnf-α和tnfβ。在一个实施方案中,多特异性或多功能多肽的细胞因子为选自gm-csf、il-2、il-7、il-8、il-10、il-12、il-15、il-18、il-21、ifn-α、ifn-γ、mip-1α、mip-1β和tgf-β的细胞因子。在一个实施方案中,多特异性或多功能多肽的细胞因子为选自gm-csf、il-2、il-7、il-8、il-10、il-12、il-15、il-21、ifn-α、ifn-γ、mip-1α、mip-1β和tgf-β的细胞因子。在一个实施方案中,多特异性或多功能多肽的细胞因子为选自il-2、il-7、il-10、il-12、il-15、il-18、ifn-α和ifn-γ的细胞因子。在一个实施方案中,多特异性或多功能多肽的细胞因子为选自il-2、il-7、il-10、il-12、il-15、ifn-α和ifn-γ的细胞因子。在某些实施方案中,使细胞因子突变以除去n-和/或o-糖基化位点。糖基化的消除可增加重组生产中可获得的产物的均一性。
[0545]
在一个实施方案中,细胞因子为il-2。在一个具体的实施方案中,il-2细胞因子可引起一种或多种选自以下的细胞反应:激活的t淋巴细胞中的增殖,激活的t淋巴细胞中的分化,细胞毒性t细胞(ctl)活性,激活的b细胞中的增殖,激活的b细胞中的分化,自然杀伤(nk)细胞中的增殖,nk细胞中的分化,激活的t细胞或nk细胞的细胞因子分泌,和nk/淋巴细胞激活的杀伤细胞(lak)抗肿瘤细胞毒性。
[0546]
在另一个实施方案中,细胞因子为il-12。在一个具体的实施方案中,所述il-12细胞因子为单链il-12细胞因子。在一个实施方案中,il-12细胞因子可引起一种或多种选自以下的细胞反应:nk细胞中的增殖、nk细胞中的分化、t细胞中的增殖和t细胞中的分化。
[0547]
在另一个实施方案中,细胞因子为il-10。在另一个具体的实施方案中,il-10细胞因子为单体il-10细胞因子。在一个实施方案中,il-10细胞因子可引起一种或多种选自以下的细胞反应:细胞因子分泌的抑制、抗原呈递细胞抗原呈递的抑制、氧自由基释放的减少和t细胞增殖的抑制。
[0548]
在一个具体的实施方案中,所述il-15细胞因子为对il-15受体的α-亚基具有降低的结合亲和力的突变体il-15细胞因子。不希望受理论的束缚,与il-15受体的α-亚基结合减少的突变体il-15多肽与全身成纤维细胞结合的能力降低,导致与野生型il-15多肽相比改善的药代动力学和毒性特征。在一个实施方案中,il-15细胞因子可引起一种或多种选自以下的细胞反应:激活的t淋巴细胞中的增殖,激活的t淋巴细胞中的分化,细胞毒性t细胞(ctl)活性,激活的b细胞中的增殖,激活的b细胞中的分化,自然杀伤(nk)细胞中的增殖,nk细胞中的分化,激活的t细胞或nk细胞的细胞因子分泌,和nk/淋巴细胞激活的杀伤细胞(lak)抗肿瘤细胞毒性。
[0549]
在另一个实施方案中,细胞因子为白介素-18(il-18)。在一个实施方案中,细胞因子为il-18变体多肽。在一个实施方案中,所述il-18细胞因子为抗诱饵的il-18(参见例如
美国专利公开号:2019/0070262;和zhou等人,见上文,其各自通过引用整体并入本文)。在一个实施方案中,il-18细胞因子可引起一种或多种选自以下的细胞反应:nk细胞中的增殖、nk细胞中的分化、t细胞中的增殖、t细胞中的分化和淋巴细胞(例如,先天淋巴细胞)的模拟。不希望受理论的束缚,il-18可用作有效的免疫治疗剂,并且在人类中具有良好的耐受性(参见例如robertson等人,clin.cancer res.(2006)12:4265-4273)。在一些实施方案中,il-18(例如,抗诱饵的il-18)增加表达具有抗肿瘤功能的转录因子(例如,tcf1)的前体t细胞(例如,cd8 t细胞)的群体。在一些实施方案中,il-18(例如,抗诱饵的il-18)促进t细胞向高活性多功能效应表型的分化。在一些实施方案中,il-18(例如,抗诱饵的il-18)降低耗竭的cd8 t细胞(例如,表达耗竭tox的转录调控因子的那些)的发生率。在一些实施方案中,il-18(例如,抗诱饵的il-18)增强nk细胞的活性和/或成熟。
[0550]
在一些实施方案中,细胞因子为抗诱饵的白介素il-18。在一些实施方案中,细胞因子为il-18变体多肽,其中所述il-18变体多肽与il-18受体(il-18r)特异性结合,并且与野生型(wt)il-18相比,其中所述il-18变体多肽包含至少一个突变并表现出与il-18结合蛋白(il-18bp)大大降低的结合。在一些实施方案中,细胞因子为il-18变体多肽,相对于野生型il-18序列,例如us2019/0070262的seq id no:30,其包含至少一个选自以下的突变:y1x、l5x、k8x、m51x、k53x、s55x、q56x、p57x、g59x、m60x、e77x、q103x、s105x、d110x、n111x、m113x、v153x和n155x。在一些实施方案中,细胞因子为il-18突变多肽,相对于野生型il-18序列,例如us2019/0070262的seq id no:30,其包含至少一个选自以下的突变:y1h、y1r、l5h、l5i、l5y、k8q、k8r、m51t、m51k、m51d、m51n、m51e、m51r、k53r、k53g、k53s、k53t、s55k、s55r、q56e、q56a、q56r、q56v、q56g、q56k、q56l、p57l、p57g、p57a、p57k、g59t、g59a、m60k、m60q、m60r、m60l、e77d、q103e、q103k、q103p、q103a、q103r、s105r、s105d、s105k、s105n、s105a、d110h、d110k、d110n、d110q、d110e、d110s、d110g、n111h、n111y、n111d、n111r、n111s、n111g、m113v、m113r、m113t、m113k、v153i、v153t、v153a、n155k和n155h。在一些实施方案中,细胞因子为il-18变体多肽,相对于野生型il-18序列,例如us2019/0070262的seq id no:30,其包含至少6个选自以下的突变:y1x、l5x、k8x、m51x、k53x、555x、q56x、p57x、g59x、m60x、e77x、q103x、s105x、d110x、n111x、m113x、v153x和n155x。在一些实施方案中,细胞因子为il-18变体多肽,相对于野生型il-18序列,例如us2019/0070262的seq id no:30,其在位置m51、k53、q56、d110和n111处包含突变。在一些实施方案中,细胞因子为il-18变体多肽序列,相对于野生型il-18序列,例如us2019/0070262的seq id no:30,其包含以下五个突变:(i)m51e、m51r、m51k、m51t、m51d或m51n;(ii)k53g、k53s、k53t或k53r;(iii)q56g、q56r、q56l、q56e、q56a、q56v或q56k;(iv)d110s、d110n、d110g、d110k、d110h、d110q或d110e;和(v)n111g、n111r、n111s、n111d、n111h或n111y。在一些实施方案中,细胞因子为il-18变体多肽,相对于野生型il-18序列,例如us2019/0070262的seq id no:30,其还在位置p57和m60处包含突变。在一些实施方案中,细胞因子为il-18变体多肽,相对于野生型il-18序列,例如us2019/0070262的seq id no:30,其包含以下七个突变:(i)m51e、m51r、m51k、m51t、m51d或m51n;(ii)k53g、k53s、k53t或k53r;(iii)q56g、q56r、q56l、q56e、q56a、q56v或q56k;(iv)d110s、d110n、d110g、d110k、d110h、d110q或d110e;(v)n111g、n111r、n111s、n111d、n111h或n111y;(vi)p57a、p57l、p57g或p57k;和(vii)m60l、m60r、m60k或m600。在一些实施方案中,细胞因子为il-18变体多肽序列,其包含us2019/0070262中描述的多肽序列
(例如,seq id no.:34-59、60-72、73-91、191-193或其片段中之一)。
[0551]
不希望受理论的束缚,il-18变体蛋白(例如,抗诱饵的il-18)可避免由于il-18结合蛋白如il-18bp的存在而可能的活性减弱。不希望受理论的束缚,il-18变体蛋白(例如,抗诱饵的il-18)可逃避il-18bp,并可通过刺激nk细胞活性和/或增强nk细胞成熟来进一步促进先天抗肿瘤免疫,并且可对由于mhc i类表面表达的丧失而对规范的免疫检查点阻断疗法(例如,抗pd-1加抗clta-4)具有抗性的肿瘤发挥抗肿瘤免疫。
[0552]
可用作效应部分的突变体细胞因子分子可通过使用本领域公知的遗传或化学方法进行删除、置换、插入或修饰来制备。遗传方法可包括编码dna序列的位点特异性诱变、pcr、基因合成等。可例如通过测序验证正确的核苷酸变化。置换或插入可涉及天然氨基酸残基以及非天然氨基酸残基。氨基酸修饰包括公知的化学修饰方法如添加或移除糖基化位点或碳水化合物附着等。
[0553]
在一个实施方案中,细胞因子为gm-csf。在一个具体的实施方案中,gm-csf细胞因子可引起粒细胞、单核细胞或树突状细胞的增殖和/或分化。
[0554]
在一个实施方案中,细胞因子为ifn-α。在一个具体的实施方案中,ifn-α细胞因子可引起一种或多种选自以下的细胞反应:抑制病毒感染细胞中的病毒复制和上调主要组织相容性复合体i(mhc i)的表达。在另一个具体的实施方案中,ifn-α细胞因子可抑制肿瘤细胞中的增殖。在一个实施方案中,细胞因子、特别是单链细胞因子为ifnγ。在一个具体的实施方案中,ifn-γ细胞因子可引起一种或多种选自以下的细胞反应:巨噬细胞活性增加、mhc分子的表达增加和nk细胞活性增加。
[0555]
在一个实施方案中,细胞因子、特别是单链细胞因子为il-7。在一个具体的实施方案中,il-7细胞因子可引起t和/或b淋巴细胞的增殖。
[0556]
在一个实施方案中,细胞因子为il-8。在一个具体的实施方案中,il-8细胞因子可在嗜中性粒细胞中引起趋化性。在一个实施方案中,细胞因子、特别是单链细胞因子为mip-1α。在一个具体的实施方案中,mip-1α细胞因子可在单核细胞和t淋巴细胞中引起趋化性。在一个实施方案中,细胞因子为mip-1β。在一个具体的实施方案中,mip-1β细胞因子可在单核细胞和t淋巴细胞中引起趋化性。在一个实施方案中,细胞因子为tgf-β。在一个具体的实施方案中,tgf-β细胞因子可引起一种或多种选自以下的细胞应答:单核细胞中的趋化性、巨噬细胞中的趋化性、激活的巨噬细胞中il-1表达的上调和激活的b细胞中iga表达的上调。
[0557]
在一些实施方案中,本文公开的微针或组合治疗包括细胞因子。在实施方案中,细胞因子包括细胞因子的全长、片段或变体;细胞因子受体结构域,例如,细胞因子受体二聚化结构域;或细胞因子受体的激动剂,例如,针对细胞因子受体的抗体分子(例如,激动性抗体)。
[0558]
在一些实施方案中,细胞因子选自il-2、il-12、il-15、il-18、il-7、il-21或干扰素γ,或其片段或变体,或任何前述细胞因子的组合。细胞因子分子可为单体或二聚体。在实施方案中,细胞因子分子还可包括细胞因子受体二聚化结构域。
[0559]
在其他实施方案中,细胞因子分子为细胞因子受体的激动剂,例如针对选自il-15ra或il-21r的细胞因子受体的抗体分子(例如,激动性抗体)。
[0560]
其他免疫调节剂包括但不限于癌症疫苗,如病毒癌症治疗剂和/或包含肿瘤抗原
如新抗原的癌症疫苗。
[0561]
活性剂制剂
[0562]
可将本文公开的至少一种治疗剂引入到多种制剂、组合物、制品、装置和/或配制剂中以便施用以例如实现受控释放和/或持续释放。更具体地,至少一种治疗剂可通过与适宜的药学上可接受的载体或稀释剂组合而配制成制剂、组合物、制品、装置和/或配制剂,并可配制成半固体、固体或液体形式的配制剂。在一些实施方案中,本文描述的制剂、组合物、制品、装置和/或配制剂包含丝素蛋白。示例性的制剂、组合物、制品、装置和/或配制剂包括:微针(例如,微针装置,例如,微针贴剂,例如如本文所述)、可植入装置(例如,泵,例如皮下泵)、可注射制剂、储库(depot)、凝胶(例如,水凝胶)、植入物和颗粒(例如,微米颗粒和/或纳米颗粒)。因此,组合物的施用可以各种方式实现,包括皮内、肌肉内、透皮、皮下或静脉内施用。此外,制剂、组合物、制品、装置和/或配制剂可配制和/或施用为实现治疗剂的受控释放和/或持续释放。
[0563]
在一些实施方案中,治疗剂施用例如基本上持续1、5、10、15、30、45分钟或至少1、5、10、15、30、45分钟的时间段;1、2、3、4、5、10、24小时或至少1、2、3、4、5、10、24小时的时间段;1、2、3、4、5、6、7、8、9、10、11、12、13、14天或至少1、2、3、4、5、6、7、8、9、10、11、12、13、14天的时间段;1、2、3、4、5、6、7、8周或至少1、2、3、4、5、6、7、8周的时间段;1、2、3、4、5、6、7、8、9、10、11个月或至少1、2、3、4、5、6、7、8、9、10、11个月的时间段;1、2、3、4、5年或更长或至少1、2、3、4、5年或更长的时间段。在一个实施方案中,治疗剂如抗癌剂、免疫调节剂或其组合作为受控释放或持续释放制剂、剂型或装置施用。在一个实施方案中,治疗剂如抗癌剂、免疫调节剂或其组合作为突然释放制剂、剂型或装置施用。在某些实施方案中,将治疗剂配制用于连续递送,例如皮内、肌肉内和/或静脉内连续递送。在一些实施方案中,用于治疗剂的受控释放或持续释放的组合物或装置选自:微针(例如,微针装置,例如微针贴剂)、可植入装置(例如,泵,例如皮下泵)、可注射制剂、储库、凝胶(例如,水凝胶)、植入物或颗粒(例如,微米颗粒和/或纳米颗粒)。在一个实施方案中,治疗剂呈基于丝素蛋白的微针受控释放或延长释放剂型或制剂(例如,本文描述的微针)。在一个实施方案中,治疗剂经由可植入装置例如泵(例如,皮下泵)、植入物、微针的可植入尖端或储库施用。可优化递送方法使得如本文所述的治疗剂剂量(例如,标准剂量)在受试者中施用和/或维持预定的时间段(例如,以下时间段或至少以下时间段:1、5、10、15、30、45分钟;1、2、3、4、5、10、24小时;1、2、3、4、5、6、7、8、9、10、11、12、13、14天;1、2、3、4、5、6、7、8周;1、2、3、4、5、6、7、8、9、10、11个月;1、2、3、4、5年或更长)。治疗剂的基本上持续或延长释放可用于持续数小时、数天、数周、数月或数年的时间地预防或治疗疾病和/或病症如癌症。
[0564]
在一些实施方案中,本公开提供了制剂、组合物、制品、装置和/或配制剂,其可配制和/或配置用于以足以在受试者中引起针对抗原(例如,肿瘤特异性抗原,如新抗原)的免疫应答(例如,细胞免疫应答和/或体液免疫应答)的量(例如,剂量)和/或时间段受控释放或持续释放治疗剂。
[0565]
在一些实施方案中,本公开的制剂、组合物、制品、装置和/或配制剂可配制和/或配置用于以足以在受试者中引起免疫(例如,癌症免疫)的量(例如,剂量)和/或时间段受控释放或持续释放至少一种治疗剂。
[0566]
治疗剂的基本上连续或延长释放递送或制剂可用于持续数小时、数天、数周、数月
或数年的时间地预防或治疗疾病或病症如癌症。
[0567]
在一些实施方案中,可将本文所述的治疗剂加到丝素蛋白溶液中,例如在形成本文所述的丝素蛋白微针或微针装置之前。在实施方案中,丝素蛋白溶液可与治疗剂混合,并然后用于可植入微针尖端的制造中,例如通过填充和/或浇铸、干燥、和/或退火的过程以产生具有任何如本文所述的期望材料性质的微针。
[0568]
不受理论的束缚,微针的丝素蛋白尖端(例如,可植入尖端)中丝素蛋白与治疗剂的比率将影响其释放。在一些实施方案中,尖端中增加的丝浓度有利于更慢的释放和/或尖端内更多的治疗剂保留。可使用任何浓度的丝,只要该浓度允许印刷并具有足以刺穿皮肤的机械强度即可。
[0569]
在一些实施方案中,在如本文所述的微针或其部件的制造中,丝素蛋白可以约1%w/v至约10%w/v(例如,约1、2、3、4、5、6、7、8、9或10%w/v)的浓度使用。在一些实施方案中,在如本文所述的微针或其部件的制造中,丝素蛋白可以约1%w/v至约30%w/v(例如,约1、2、3、4、5、6、7、8、9、10、15、20、25或30%w/v)的浓度使用。
[0570]
在一些实施方案中,在如本文所述的微针或其部件的制造中,丝素蛋白可以约0.5μg至约500μg丝素蛋白的量使用。在一些实施方案中,在如本文所述的微针或其部件的制造中,丝素蛋白可以约0.5μg至约5μg、或约1μg至约10μg、或约5μg至约15μg、或约10μg至约20μg、或约15μg至约25μg、或约20μg至约30μg、或约25μg至约35μg、或约30μg至约40μg、或约35μg至约45μg、或约40μg至约50μg、或约45μg至约55μg、或约50μg至约60μg、或约55μg至约65μg、或约60μg至约70μg、或约65μg至约75μg、或约70μg至约80μg、或约75μg至约85μg、或约80μg至约90μg、或约85μg至约95μg、或约90μg至约100μg、或约95μg至约150μg、或约125μg至约175μg、或约150μg至约200μg、或约225μg至约275μg、或约250μg至约300μg、或约325μg至约375μg、或约350μg至约400μg、或约425μg至约475μg或约450μg至约500μg丝素蛋白的量使用。在一些实施方案中,在如本文所述的微针或其部件的制造中,丝素蛋白可以至少约0.5、0.6、0.7、0.8、0.9、1、2、3、4、5、6、7、8、9、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、150、200、250、300、350、400、450或500μg丝素蛋白的量使用。在一些实施方案中,在如本文所述的微针或其部件的制造中,丝素蛋白可以至多约0.5、0.6、0.7、0.8、0.9、1、2、3、4、5、6、7、8、9、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、150、200、250、300、350、400、450或500μg丝素蛋白的量使用。在一些实施方案中,在如本文所述的微针或其部件的制造中,丝素蛋白可以约0.5、0.6、0.7、0.8、0.9、1、2、3、4、5、6、7、8、9、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、150、200、250、300、350、400、450或500μg丝素蛋白的量使用。在一些实施方案中,在如本文所述的微针或其部件的制造中,丝素蛋白可以约2.42ug至242ug的量使用。
[0571]
在一些实施方案中,在如本文所述的微针或其部件的制造中,丝素蛋白可以按重量计约1%至约75%、约1%至约5%、约10%至约60%、约15%至约50%、或约20%至约40%的丝素蛋白的量使用。在一些实施方案中,在如本文所述的微针或其部件的制造中,丝素蛋白可以按重量计至少约1、2、3、4、5、6、7、8、9、10、15、20、25、30、35、40、45、50、55、60、65、70或75%的丝素蛋白的量使用。在一些实施方案中,在如本文所述的微针或其部件的制造中,丝素蛋白可以按重量计至多约1、2、3、4、5、6、7、8、9、10、15、20、25、30、35、40、45、50、55、60、65、70或75%的丝素蛋白的量使用。在一些实施方案中,在如本文所述的微针或其部件的制
造中,丝素蛋白可以按重量计约1、2、3、4、5、6、7、8、9、10、15、20、25、30、35、40、45、50、55、60、65、70或75%的丝素蛋白的量使用。
[0572]
示例性赋形剂
[0573]
另外,所述制剂、组合物、制品、装置和/或配制剂可用常用的赋形剂、稀释剂或载体配制用于通过皮内、肌肉内、透皮、皮下或静脉内途径施用。在一些实施方案中,所述制剂、组合物、制品、装置和/或配制剂可例如透皮施用,并且可配制为受控释放或持续释放剂型等。本文描述的制剂、组合物、制品、装置和/或配制剂可单独施用、彼此组合施用、或它们可与其他已知的治疗剂组合使用。
[0574]
适用于本公开的制剂可见于remington的pharmaceutical sciences(1985)中。此外,关于药物递送方法的综述,参见langer(1990)science 249:1527-1533。本文描述的制剂、组合物、制品、装置和/或配制剂可以本领域技术人员已知的方式制造,例如通过混合、溶解、制粒、制糖衣丸、捻成细粉、乳化、包封、包埋或冻干过程。以下方法和赋形剂仅是示例性的而绝非限制。
[0575]
在本文描述的微针的制造中使用的丝素蛋白制剂可包含赋形剂。在实施方案中,可出于以下目的包含赋形剂:改善所引入的治疗剂如抗癌剂、免疫调节剂或其组合的稳定性;增加丝基质孔隙率和治疗剂如抗癌剂、免疫调节剂或其组合从制剂、组合物、制品、装置、配制剂和/或微针(例如,微针尖端)的扩散性;和/或增加丝基质的结晶度/β-折叠含量以使丝材料不溶。
[0576]
示例性的赋形剂包括但不限于糖或糖醇(例如,蔗糖、海藻糖、山梨糖醇、甘露糖醇或其组合)、二价阳离子(例如,ca
2
、mg
2
、mn
2
和cu
2
)、表面活性剂(例如,辛基酚乙氧基化物(例如,triton-x)、聚山梨酯、泊洛沙姆和/或聚乙氧基化醇)、多元醇(例如,甘油)、二醇(例如,丙二醇、peg)和/或缓冲剂。在一些实施方案中,可使用赋形剂的浓度来改变基质的孔隙率,例如,使用蔗糖作为针对此目的的最常用赋形剂。也可添加赋形剂来促进丝自组装成有序的β-折叠二级结构,并且这样的赋形剂通常可参与与丝的氢键结合或电荷相互作用而实现此作用。可用于促进丝自组装成有序的β-折叠二级结构的赋形剂的非限制性实例包括谷氨酸单钠(例如,l-谷氨酸)、赖氨酸、糖醇(例如,山梨糖醇和/或甘油)和溶剂(例如,dmso、甲醇和/或乙醇)。
[0577]
在一些实施方案中,糖或糖醇为蔗糖,以小于70%(w/v)、小于60%(w/v)、小于50%(w/v)、小于40%(w/v)、小于30%(w/v)、小于20%(w/v)、小于10%(w/v)、小于9%(w/v)、小于8%(w/v)、小于7%(w/v)、小于6%(w/v)、或5%(w/v)或更小的量存在,例如在临干燥前。
[0578]
在一些实施方案中,糖或糖醇为蔗糖,以约1%(w/v)至约10%(w/v)、约2%(w/v)至约8%(w/v)、约2.2%(w/v)至约6%(w/v)、约2.4%(w/v)至约5.5%(w/v)、约2.5%至约5%、或约2.4%(w/v)、约2.5%、或约5%(w/v)的量存在,例如在临干燥前。
[0579]
在一些实施方案中,糖或糖醇为海藻糖,以约1%(w/v)至约10%(w/v)、约2%(w/v)至约8%(w/v)、约2.2%(w/v)至约6%(w/v)、约2.4%(w/v)至约5.5%(w/v)、约2.5%至约5%、或约2.4%(w/v)、约2.5%、或约5%(w/v)的量存在,例如在临干燥前。
[0580]
在一些实施方案中,糖或糖醇为山梨糖醇,以约1%(w/v)至约10%(w/v)、约2%(w/v)至约8%(w/v)、约2.2%(w/v)至约6%(w/v)、约2.4%(w/v)至约5.5%(w/v)、约2.5%
至约5%、或约2.4%(w/v)、约2.5%、或约5%(w/v)的量存在,例如在临干燥前。
[0581]
在一些实施方案中,糖或糖醇为甘油,以约1%(w/v)至约10%(w/v)、约2%(w/v)至约8%(w/v)、约2.2%(w/v)至约6%(w/v)、约2.4%(w/v)至约5.5%(w/v)、约2.5%至约5%、或约2.4%(w/v)、约2.5%、或约5%(w/v)的量存在,例如在临干燥前。
[0582]
在一些实施方案中,表面活性剂(例如,辛基酚乙氧基化物(例如,triton-x)、聚山梨酯、泊洛沙姆和/或聚乙氧基化醇)以约0.005%(w/v)至约1%(w/v)、约1%(w/v)至约10%(w/v)、约2%(w/v)至约8%(w/v)、约2.2%(w/v)至约6%(w/v)、约2.4%(w/v)至约5.5%(w/v)、约2.5%至约5%、或约2.4%(w/v)、约2.5%、或约5%(w/v)的量存在,例如在临干燥前。
[0583]
在一些实施方案中,多元醇(例如,甘油)以约1%(w/v)至约10%(w/v)、约2%(w/v)至约8%(w/v)、约2.2%(w/v)至约6%(w/v)、约2.4%(w/v)至约5.5%(w/v)、约2.5%至约5%、或约2.4%(w/v)、约2.5%、或约5%(w/v)的量存在,例如在临干燥前。
[0584]
在一些实施方案中,二醇(例如,丙二醇,例如peg)以约1%(w/v)至约10%(w/v)、约2%(w/v)至约8%(w/v)、约2.2%(w/v)至约6%(w/v)、约2.4%(w/v)至约5.5%(w/v)、约2.5%至约5%、或约2.4%(w/v)、约2.5%、或约5%(w/v)的量存在,例如在临干燥前。
[0585]
在一些实施方案中,治疗剂配制剂还包含二价阳离子。在一些实施方案中,二价阳离子选自ca
2
、mg
2
、mn
2
和cu
2
。在一些实施方案中,例如在临干燥前,二价阳离子以0.1mm至100mm的量存在于配制剂中。在一些实施方案中,例如在临干燥前,二价阳离子以每标准剂量的治疗剂(例如,抗癌剂、免疫调节剂、病毒免疫原或其组合)10-7
至10-4
摩尔的量存在于配制剂中。在一些实施方案中,在临干燥前,二价阳离子以10-10
至2
×
10-3
摩尔的量存在于配制剂中。
[0586]
在一些实施方案中,治疗剂还包含聚(乳酸-共-乙醇酸)(pgla)。
[0587]
在一些实施方案中,例如在临干燥前,治疗剂配制剂还包含缓冲剂。在一些实施方案中,缓冲剂具有ph 3至ph 8、ph 4至ph 7.5、或ph 5至ph 7的缓冲能力。在一些实施方案中,缓冲剂选自pbs、hepes和cp缓冲剂。在一些实施方案中,例如在临干燥前,缓冲剂以0.1mm至100mm的量存在于配制剂中。在一些实施方案中,缓冲剂以每标准剂量的治疗剂(例如,抗癌剂、免疫调节剂、病毒免疫原或其组合)10-7
至10-4
摩尔的量存在。在一些实施方案中,缓冲剂以10-10
至2
×
10-3
摩尔的量存在。
[0588]
另外,治疗剂还可配制为储库、凝胶或水凝胶配制剂。这样的长效制剂可通过植入(例如,皮下或肌肉内)或通过肌肉内注射施用。因此,例如,治疗剂可与合适的聚合物或疏水材料一起配制(例如配制为在可接受的油中的乳液)或与离子交换树脂一起配制,或配制为略溶的衍生物,例如配制为略溶的盐。
[0589]
在一个实施方案中,治疗剂经由可植入输注装置例如泵(例如,皮下泵)、植入物或储库施用。可植入输注装置通常包含容纳液体贮存器的壳体,该液体储存器可由皮下注射针穿透填充端口隔膜透皮填充。药物贮存器通常经由内部流动路径连接到装置出口端口以通过导管将液体递送到患者身体部位。典型的输注装置还包含控制器和流体传送机构,如泵或阀,以将液体从贮存器通过内部流动路径移动到装置的出口端口。
[0590]
在一些实施方案中,治疗剂可包装和/或配制为颗粒,例如微米颗粒和/或纳米颗粒。通常,纳米颗粒的直径为10、15、20、25、30、35、45、50、75、100、150或200nm,或200nm至1,
000nm,例如10、15、20、25、30、35、45、50、75、100、150或200、或20或30或50-400nm。较小的颗粒往往更快地从系统中清除。治疗剂(包括本文所述的治疗剂)可被包埋在纳米颗粒内或与纳米颗粒偶联(例如,共价偶联)或以其他方式粘附到纳米颗粒。
[0591]
可使用基于脂质或油的纳米颗粒如脂质体和固体脂质纳米颗粒来递送治疗剂如抗癌剂、免疫调节剂或其组合,如本文所述。描述了用于递送治疗剂的固体脂质纳米颗粒(参见例如serpe等人,(2004)eur.j.pharm.bioparm.58:673-680,和lu等人(2006eur.j.pharm.sci.28:86-95)。可使用基于聚合物的纳米颗粒(例如,基于plga的纳米颗粒)来递送本文描述的药剂。这些往往依赖于可生物降解的骨架,其中治疗剂插层(具有或不具有与聚合物的共价键)在聚合物基质中。plga被广泛用于聚合物纳米颗粒中(参见例如hu等人,(2009)j.control.release 134:55-61;cheng等人,(2007)biomaterials 28:869-876;和chan等人,(2009)biomaterials 30:1627-1634)。也可使用基于peg化的plga的纳米颗粒来递送治疗剂(参见例如danhhier等人,(2009)j.control.release 133:11-17;gryparis等人,(2007)eur.j.pharm.biopharm.67:1-8)。也可使用基于金属的纳米颗粒(例如,基于金的纳米颗粒)来递送治疗剂。可使用基于蛋白质的纳米颗粒(例如,基于白蛋白的纳米颗粒)来递送本文描述的治疗剂。在一些实施方案中,治疗剂可与人白蛋白的纳米颗粒结合。
[0592]
广泛的纳米颗粒是本领域已知的。示例性的方法包括wo2010/005726、wo2010/005723、wo2010/005721、wo2008/121949、wo2010/075072、wo2010/068866、wo2010/005740、wo2006/014626、u.s.7,820,788和u.s.7,780,984中描述的那些,其内容通过整体引用并入本文。
[0593]
剂量
[0594]
根据本文所述的方法可使用当通过本公开的微针施用时能够在受试者中引起治疗反应(例如,抗癌反应,例如免疫应答)的治疗剂的任何剂量量(例如,标准剂量和/或分剂量)。
[0595]
不希望受理论的束缚,待通过本文描述的微针施用的治疗剂的总剂量量(例如,标准剂量)可在多根微针之间分配(例如,在贴剂内),使得一根微针尖端可包含总剂量量的小于约1%(例如,在包含约121根微针的阵列中),或总剂量量的至少约1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、21%、22%、23%、24%、或25%或更多。
[0596]
在一些实施方案中,加载到微针贴剂中的治疗剂剂量可经由形成针尖端的配制溶液中的治疗剂浓度、分配到每根针尖端中的溶液体积和针的总数来控制。在一些实施方案中,前两者是改变剂量的更方便的手段。释放到受试者中的剂量与部署效率(在移除贴剂后留在生物屏障如皮肤中的针尖端部分)以及随时间的释放曲线和尖端在受试者中的停留时间有关。由于皮肤从表皮不断脱落,故皮肤内更深的部署与更长的停留时间有关。因此,期望使针尖端的穿透深度最大化(达到皮肤内由疼痛受体的深度所限定的极限,例如约100μm至约600μm的深度处),并还期望使抗原在空间上朝向针的尖端集中。
[0597]
本文所述的制剂、组合物、制品、装置和/或配制剂(包括丝素蛋白尖端制剂)设计为不仅在尖端保留在真皮中的持续时间内释放(例如,持续释放)治疗剂,而且在这段时间期间(例如,至少约1-2周)维持治疗剂的稳定性。在一些实施方案中,可预期例如引入到本
文描述的制剂、组合物、制品、装置、配制剂和/或微针中的总剂量量的大约95-100%可利用以递送至例如受试者中,例如递送至受试者的组织如皮肤、肿瘤、粘膜、器官组织、颊腔、组织或细胞膜中。不受理论的束缚,微针成功地部署到皮肤中为阵列的至少约50%并可高达100%(例如,施加后阵列的微针总数的至少约50%、60%、70%、80%、90%或更多(例如,100%))成功部署在例如皮肤内以受控释放或持续释放治疗剂如抗癌剂、免疫调节剂或其组合。在一些实施方案中,在部署的持续时间期间一部分抗原可能不从丝尖端释放。
[0598]
制造微针的方法
[0599]
图1中示出了描绘制造本公开的微针的示例性方法的示意图。精确纳升(nl)体积的丝素蛋白溶液向一个一个单独的针腔中的机器视觉引导分配使得不同的剂量和制剂能够引入到微针装置(例如,微针阵列或贴剂)的可释放尖端内。一种示例性的微针装置(例如,微针阵列或贴剂)包含11
×
11圆锥体阵列。应理解,微针装置可包括以不同数目的腔和取向的阵列产生的针腔以实现期望的结果。
[0600]
模具生产
[0601]
在一些实施方案中,在微针装置的制造中使用模具。如将在下文更详细地讨论的,使用无菌模具来生产具有体现治疗剂-丝制剂(例如,抗癌剂-丝制剂、免疫调节剂-丝制剂、抗原-丝制剂或其组合)的可释放尖端阵列的微针装置。
[0602]
例如,可贴靠具有预期几何形状的微针阵列的阳母模浇铸有机硅(dow corning184)树脂。一旦有机硅已固化,就可将其从母模中取出。然后该母模可重新用于大量的有机硅浇铸。在整个制造过程中,可检查有机硅模具的缺陷(例如,在浇铸之间)。如果需要,可例如通过高压灭菌法对有机硅模具灭菌。在一个实施方案中,模具包括模体,所述模体具有形成在模体内的针腔阵列。
[0603]
在一些实施方案中,可使用其他类型的有机硅和/或其他材料和过程来制造模具。例如,可使用液体有机硅注射成型和热塑性弹性体注射成型。不希望受理论的束缚,可理解的是,关键要求在于模具材料是柔软且柔性的(例如,具有约50a的肖氏硬度)并具有与贴剂的构造中使用的丝和其他材料低的粘附性。
[0604]
尖端填充
[0605]
将由丝素蛋白、治疗剂(例如,抗癌剂、免疫调节剂、抗原或其组合)和可能地其他的赋形剂在水溶液中组成的尖端制剂经由纳升印刷分配到模具中的每个针腔中。目前,这在实验室规模使用机器视觉引导的自动分配系统来完成,如由biodot生产的biojet elite
tm
ad3400分配系统,但也可采用由其他供应商制造的具有类似能力的系统。在一些实施方案中,用于尖端填充的分配器(例如,biodot
tm
分配器)的工作体积被封闭并保持在升高的相对湿度(rh)下,例如60%或更高的rh,以例如减慢制剂的干燥和/或避免干燥的固体在分配喷嘴上积聚。在一个实施方案中,biodot
tm
分配器的工作体积被封闭并保持在60%的相对湿度(rh)下以减慢制剂的干燥和/或避免干燥的固体在分配喷嘴上的积聚。
[0606]
将模具置于夹具内,该夹具将模具的位置约束在biodot
tm
分配器的处理平台上。机器使用照相机对每个模具成像并且机器视觉算法确定每个模具中针腔阵列的精确位置和取向。该位置用于引导随后的分配步骤。使用立体显微镜检查填充的模具是否存在填充缺陷,如未对准的分配或液体中的大气泡。
[0607]
初级干燥
[0608]
在一些实施方案中,将填充的模具放在一边以干燥,例如在保持所需环境湿度的外壳内。在一个实施方案中,将填充的模具放在一边以在机器外壳内干燥约7分钟。在一些实施方案中,丝素蛋白溶解性可通过控制干燥时间来调节。不希望受理论的束缚,在干燥过程中,丝结构可转变为更多的β-折叠并变得较不可溶(例如,不溶),并且此效果可通过更缓慢地干燥和/或通过在升高的湿度(例如,从约10%升至约100%rh)下温育来增加。
[0609]
在干燥之后,可重复上述分配过程。在一些实施方案中,将模具移至具有大致饱和的湿度的腔室中并温育过夜以缓慢干燥尖端。在这段时间内,丝结构可转变为更多的β-折叠并变得较不可溶(例如,不溶)(退火)。
[0610]
次级干燥
[0611]
在一些实施方案中,将模具移至其中湿度被控制到约10%至约25%相对湿度(rh)和环境室温的腔室中并保持过夜(约14小时)以完成干燥。此为“次级”干燥步骤。
[0612]
水退火
[0613]
在一些实施方案中,将模具(例如,含有经干燥的丝素蛋白尖端的模具)转移至还含有约500ml去离子水(diw)的真空干燥器中。关闭干燥器并在实验室中使用主真空管线抽真空约5分钟。5分钟后,关闭干燥器的出口阀并将其置于保持在37℃的培养箱内达四小时。四小时后,对干燥器排气并将模具转移回环境室温下的25%rh腔室中。
[0614]
退火后干燥
[0615]
在随后的步骤之前,可将模具保持在约10%至约25%rh下达至少四小时或至多过夜。
[0616]
基底层填充
[0617]
可通过用本文描述的基底溶液填充模具来形成可溶解基底层。在一些实施方案中,基底溶液在diw中包含40%w/v的水解明胶和10%w/v的蔗糖。在一些实施方案中,基底溶液包含30%的右旋糖酐70kda、10%的蔗糖、1%的甘油和0.01%的triton-x100。基底层可以任何合适的方式填充。例如,首先,可用移液管将适合于模具的体积(例如,150μl)的基底溶液均匀地铺展在模具上方。接着,可将模具离心(例如,以3900rpm离心至多约2分钟)。可检查模具,如果任何针腔保持未填充,则可重复填充和离心过程。模具可进一步用合适的量的基底溶液(例如,50μl基底溶液)“填满”。在一些实施方案中,可使用离心填充。在一些实施方案中,以与尖端相同的方式通过使用向模腔中的视觉引导液滴分配来填充基底。
[0618]
在一些实施方案中,可施加不止一个基底层。例如,可根据上文阐述的方法形成第一基底层。然后,例如在干燥第一基底层之后,可重复该过程以添加一个或多个另外的基底层。可使用与第一基底层所用相同的基底层溶液施加所述一个或多个另外的基底层,或者可根据需要使用一种或多种不同的基底层溶液(例如,本文描述的一种或多种基底层溶液)。在一些实施方案中,基底溶液为熔融液体或浆料。在一些实施方案中,使用化学反应(例如,在填充之后)使基底层凝固。
[0619]
基底干燥
[0620]
可将填充的模具转移回在约10%至约25%rh下的腔室中并干燥至少过夜和至多3天。
[0621]
背衬施加
[0622]
用于生成治疗剂的释放(例如,受控释放或持续释放)和/或改善免疫原性(参见例
如实施例)的贴剂具有纸背衬层;然而,后续发展已表明,粘性塑料胶带可具有作为背衬层的优异性能。
[0623]
在一些实施方案中,纸背衬过程为如下:用移液管在表面上铺展10-30μl diw,使经干燥的基底层部分再润湿。将whatman 903纸冲压成直径12mm的圆。将纸圆轻轻压入到基底层的湿表面中。湿基底层部分地浸入到纸中。将具有背衬的模具转移回25%rh的腔室中干燥至少4小时直至使用。在一些实施方案中,背衬(例如,含有粘合剂的背衬)通过光照射固化。
[0624]
粘性胶带过程
[0625]
将粘合剂背衬聚酯胶带(例如,magic
tm
带)切割成约12mm宽和约25mm长的片。将胶带的一端与贴剂对齐并轻轻地压到基底层的表面上。将胶带的自由端折叠在其自身上以形成非粘性“把手”。
[0626]
脱模
[0627]
使用前从模具中取出贴剂。将柔性模具轻轻地弯离较硬的贴剂,并将贴剂从模具中取出。检查贴剂是否有缺陷如针的缺失或断裂。
[0628]
包装
[0629]
在上面的研究中,贴剂在脱模后不久使用并且不包装。如果需要长期存放,则可将组装的贴剂与干燥剂一起包装在具有低的水气透过率的容器(例如,由低mvtr材料制成的玻璃小瓶或热成型塑料托盘和箔背衬热密封盖)中以在包装内保持约0%至约50%(例如,约0%至10%、约10%至约20%、约20%至约30%、约30%至约40%、或约40%至50%,例如约25%)的相对湿度。
[0630]
治疗应用
[0631]
在一个方面,本公开提供了用于跨生物屏障(例如,皮肤层、细胞膜、粘液表面、口腔、皮肤病变、肿瘤或颊腔)递送(例如,施用)有效量的治疗剂如抗癌剂、免疫调节剂或其组合的方法。
[0632]
在一个方面,本公开提供了用于治疗、预防和/或改善受试者的疾病和/或病症例如受试者的癌症和/或皮肤病况的方法。在一些实施方案中,递送为通过肿瘤内递送。然而,在一些实施方案中,可将微针施加到邻近肿瘤的部位(例如,肿瘤周围递送)。在一些实施方案中,微针施用作为一线疗法,例如用于不可切除的肿瘤。在一些实施方案中,微针施用作为新辅助疗法(例如,在主要治疗例如切除肿瘤的手术之前)以缩小肿瘤。在一些实施方案中,微针施用作为辅助疗法(例如,在肿瘤切除后)以降低癌症再发的风险。
[0633]
在一个方面,本公开涉及一种治疗受试者的癌症的方法。该方法包括向受试者施用本公开的微针使得受试者的癌症得到治疗。可通过本公开的微针治疗的示例性癌症是本领域已知的并在本文中有公开。
[0634]
在一个方面,本公开涉及一种治疗受试者的皮肤病况的方法。该方法包括向受试者施用本公开的微针使得受试者的癌症得到治疗。可通过本公开的微针治疗的示例性皮肤病况是本领域已知的并在本文中有公开。
[0635]
在一个方面,本公开涉及在有此需要的受试者中诱导抗癌应答和/或免疫应答(例如,局部和/或全身免疫应答)的方法。在一些实施方案中,受试者中的抗癌应答和/或免疫应答(例如,局部和/或全身免疫应答)包括:肿瘤体积或癌体积的减小、肿瘤细胞或癌细胞
的数目的减少、转移的数目的减少、预期寿命的增加、肿瘤细胞增殖或癌细胞增殖的减少、肿瘤细胞存活或癌细胞存活的减少、复发的预防、和/或与癌症病况相关的各种生理症状的改善。
[0636]
在一些实施方案中,本公开涉及在有此需要的受试者中诱导抗癌应答和/或免疫应答(例如,局部和/或全身免疫应答)的方法,其导致受试者中肿瘤体积或癌体积例如与基线值相比至少约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或99%或更多的减小。
[0637]
在一些实施方案中,本公开涉及在有此需要的受试者中诱导抗癌应答和/或免疫应答(例如,局部和/或全身免疫应答)的方法,其导致受试者中肿瘤细胞或癌细胞的数目例如与基线值相比至少约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或99%或更多的减少。
[0638]
在一些实施方案中,本公开涉及在有此需要的受试者中诱导抗癌应答和/或免疫应答(例如,局部和/或全身免疫应答)的方法,其导致受试者中转移的数目例如与基线值相比至少约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或99%或更多的减少。
[0639]
在一些实施方案中,本公开涉及在有此需要的受试者中诱导抗癌应答和/或免疫应答(例如,局部和/或全身免疫应答)的方法,其将受试者的寿命延长至少约15、30、60、90、120、180或360天。
[0640]
在一些实施方案中,本公开涉及在有此需要的受试者中诱导抗癌应答和/或免疫应答(例如,局部和/或全身免疫应答)的方法,其导致肿瘤细胞增殖或癌细胞增殖例如与基线值相比至少约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或99%或更多的减少。
[0641]
在一些实施方案中,本公开涉及在有此需要的受试者中诱导抗癌应答和/或免疫应答(例如,局部和/或全身免疫应答)的方法,其导致肿瘤细胞存活或癌细胞存活例如与基线值相比至少约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或99%或更多的减少。
[0642]
在一个方面,本公开提供了用于治疗与肿瘤特异性抗原(例如,新抗原)的表达相关的疾病的方法。
[0643]
在一个方面,本公开涉及抑制肿瘤和/或皮肤病变(例如,表达肿瘤特异性抗原(例如,新抗原)的肿瘤和/或皮肤病变)的生长的方法。在某些实施方案中,待治疗的肿瘤可与正常细胞中可能不存在的癌症特异性或肿瘤特异性抗原相关。然而,不希望受理论的束缚,例如由于免疫抑制肿瘤微环境(tme),新抗原可能不良或低效地呈递给受试者的免疫系统。在一些实施方案中,本文描述的方法可改善新抗原向受试者的免疫系统的呈递并促进受试者中稳健且长时间的免疫应答(例如,抗癌应答,例如癌症免疫)的发生。在某些实施方案中,本文描述的方法可导致在初始微针施加部位处或附近的肿瘤消融,并还导致受试者体内远处部位处的肿瘤消融,例如在存在表达新抗原的癌细胞的任何地方。
[0644]
本公开提供了基于丝素蛋白的微针和基于丝素蛋白的微针装置,其用于治疗癌症(例如,转移性癌症)和/或皮肤病况(例如,皮肤病况)和/或诱导对癌症(例如,转移性癌症)和/或皮肤病况(例如,皮肤病况)的免疫应答。在一些实施方案中,本文公开的方法包括使
包含抗癌剂、免疫调节剂或其组合的微针装置或多根微针与受试者的癌症(例如,转移性肿瘤)或病变(例如,皮肤病变)的部位接触(例如,施用),从而产生以下中的一种或多种:(i)裂解癌细胞,例如肿瘤细胞,以释放癌症相关抗原(例如,新抗原)和/或暴露癌症相关抗原(例如,新抗原)于受试者的免疫系统;(ii)由抗原呈递细胞(apc)向免疫系统细胞(例如,辅助细胞,如b-细胞、树突状细胞等)展示在其表面上与主要组织相容性复合体(mhc)复合的癌症相关抗原(例如,新抗原);(iii)由免疫效应细胞(例如,t细胞和/或nk细胞)识别所展示的癌症相关抗原(例如,新抗原);(iv)激活和/或扩增免疫效应细胞,例如t细胞和/或nk细胞,其对受试者中展示的癌症相关抗原(例如,新抗原)具有特异性;和(v)增强(例如,刺激或上调)免疫效应细胞例如t细胞和/或nk细胞的免疫应答,其促进受试者中表达癌症相关抗原(例如,新抗原)的靶细胞的杀伤和/或抑制所述靶细胞的生长或增殖。
[0645]
在一个方面,本公开涉及释放肿瘤特异性抗原(例如,新抗原)和/或暴露肿瘤特异性抗原(例如,新抗原)于受试者的免疫系统以引起抗癌应答和/或免疫应答的方法。
[0646]
在一个方面,本公开涉及在受试者中诱导癌症免疫的方法,任选地其中所述癌症免疫针对肿瘤特异性抗原(例如,新抗原)。
[0647]
在本文描述的任何方法的一些实施方案中,微针的施用导致免疫细胞响应于肿瘤特异性抗原(例如,新抗原)而激活,所述肿瘤特异性抗原(例如,新抗原)因用微针(例如,包含抗癌剂和免疫调节剂和/或其组合的微针)治疗而暴露和/或从肿瘤释放。此外,其中激活的免疫细胞靶向表达肿瘤特异性抗原(例如,新抗原)的癌细胞,并从而抑制癌症的生长和/或增殖。任选地,其中所靶向的癌细胞在微针施用的部位处或附近。任选地,其中所靶向的癌细胞位于远处部位处。
[0648]
在一个方面,本公开涉及一种在受试者中诱导抗癌应答的方法。在一些实施方案中,所述方法包括向受试者施用本公开的微针使得诱导例如对与肿瘤特异性抗原(例如,新抗原)表达相关的疾病的免疫应答。在本文描述的任何方法的各个方面,免疫(例如,癌症免疫)在施用微针后在受试者中持续存在一段时间。例如,免疫(例如,癌症免疫)可在向受试者施用微针后在受试者中持续存在约一周、约两周、约三周、约一个月、约两个月、约三个月、约四个月、约五个月、约六个月、约七个月、约八个月、约九个月、约十个月、约十一个月、约十二个月、约十三个月、约十四个月、约十五个月、约十六个月、约十七个月、约十八个月、约十九个月、约二十个月、约二十一个月、约二十二个月、约二十三个月、约两年、约三年、约四年或约五年。
[0649]
在一个方面,本文提供了用于在肿瘤切除之后将有效量的治疗剂如抗癌剂、免疫调节剂或其组合递送(例如,施用)至肿瘤部位以例如诱导对肿瘤的免疫应答和/或消融切除后留下的任何癌细胞的方法。
[0650]
在一个方面,本文提供了用于在肿瘤切除之前将有效量的治疗剂如抗癌剂、免疫调节剂或其组合递送(例如,施用)至肿瘤部位以例如诱导对肿瘤的免疫应答和/或消融切除后留下的任何癌细胞的方法。
[0651]
这样的方法可包括提供包含治疗剂如本文所述的抗癌剂、免疫调节剂或其组合的微针。例如,这样的方法可包括提供至少一根本文描述的微针或至少一个本文描述的微针装置,其中所述微针或微针装置包含具有治疗剂如抗癌剂、免疫调节剂或其组合的基于丝素蛋白的尖端;使所述微针或微针装置穿透进入生物屏障(例如,皮肤,例如,肿瘤);和让有
效量的治疗剂在一段时间内从丝素蛋白尖端释放,例如至少约1天(例如,约1、2、3、4、5、6、7、8、9、10、11、12、13或14天或更多天,例如约4天至约14天,例如约1-2周、约1-3周或约1-4周,例如1、2、3、4、5、6、7、8、9、10、11个月,例如1、2、3、4、5年或更长时间)。
[0652]
组合疗法
[0653]
本文公开的微针可与第二治疗剂或过程组合使用。
[0654]
在实施方案中,本文公开的微针和第二治疗剂或过程在受试者已被诊断患有癌症之后、例如在已从受试者消除癌症之前施用/进行。在实施方案中,微针与第二治疗剂或过程同时或同期施用/进行。例如,在第二治疗的递送开始时,一种治疗的递送仍在进行,例如,在治疗的施用中存在交叠。在其他实施方案中,微针与第二治疗剂或过程按顺序施用/进行。例如,一种治疗的递送在另一种治疗的递送开始之前停止。
[0655]
在实施方案中,组合疗法可产生比单独地使用任一药剂的单一疗法更有效的治疗。在实施方案中,第一和第二治疗的组合比单独的第一或第二治疗更有效(例如,导致症状的更大减轻和/或癌细胞的更大减少)。在实施方案中,与作为单一疗法施用时实现类似作用通常所需的第一或第二治疗的剂量相比,组合疗法允许使用较低剂量的第一或第二治疗。在实施方案中,组合疗法具有部分累加效应、完全累加效应或大于累加效应。
[0656]
在一个实施方案中,微针分子与疗法例如癌症疗法(例如,抗癌剂、免疫疗法、光动力疗法(pdt)、手术和/或放射中的一种或多种)组合施用。术语“化疗剂”、“化学治疗剂”和“抗癌剂”在本文中可互换使用。微针的施用与所述疗法例如癌症疗法可以是按顺序的(有或没有交叠)或同时的。在疗法(例如,癌症疗法)过程期间,微针的施用可以是连续的或间歇的。可使用本文描述的某些疗法来治疗癌症和非癌性疾病。例如,使用本文描述的方法和组合物可增强治疗剂在癌性和非癌性病况中的功效。
[0657]
患者选择
[0658]
在治疗受试者的任何方法或用于本文公开的用途的组合物的一些实施方案中,受试者患有病症,例如癌症。
[0659]
如本文所用,“癌症”可涵盖所有类型的致癌过程和/或癌性生长。在实施方案中,癌症包括原发肿瘤以及转移性组织或恶性转化的细胞、组织或器官。在实施方案中,癌症涵盖癌症的所有组织病理学和阶段,例如侵袭性/严重性阶段。在实施方案中,癌症包括复发性和/或耐药性癌症。术语“癌症”和“肿瘤”可互换使用。例如,两个术语均涵盖实体肿瘤和液体肿瘤。如本文所用,术语“癌症”或“肿瘤”包括恶化前的以及恶性的癌症和肿瘤。本文描述了各种癌症的实例并包括但不限于:肛门癌;基底细胞癌;膀胱癌;骨癌;脑肿瘤;乳腺癌;子宫颈癌;结肠和直肠癌;子宫内膜癌;食管癌;胃肠癌(例如,胃肠道间质瘤);妊娠滋养细胞疾病;头颈癌;霍奇金淋巴瘤;卡波西肉瘤;肾(肾细胞)癌;白血病;肝癌;肺癌;恶性间皮瘤;黑色素瘤;merkel细胞癌;多中心型castleman病;多发性骨髓瘤和其他浆细胞肿瘤;骨髓增生性肿瘤;神经母细胞瘤;非霍奇金淋巴瘤;卵巢癌、输卵管癌或原发性腹膜癌;胰腺癌;阴茎癌;嗜铬细胞瘤和副神经节瘤;前列腺癌;成视网膜细胞瘤;横纹肌肉瘤;皮肤癌;鳞状细胞癌;软组织肉瘤;体内任何地方的实体瘤;胃(胃部)癌;睾丸癌;甲状腺癌;阴道癌;外阴癌;以及wilms肿瘤和其他儿童肾癌等。
[0660]
在一些实施方案中,癌症为黑色素瘤。在一些实施方案中,癌症为基底细胞癌。在一些实施方案中,癌症为鳞状细胞癌。在一些实施方案中,癌症为merkel细胞癌。在一些实
施方案中,癌症为乳腺癌。
[0661]
在治疗受试者的任何方法或用于本文公开的用途的组合物的一些实施方案中,受试者患有皮肤病况。本文描述了各种皮肤病况的实例并包括但不限于:光化性角化病(ak)、恶性雀斑样痣、粘膜白斑病和bowen’s病。
[0662]
示例性套件
[0663]
在某些实施方案中,本公开涉及包含本文描述的微针的包装或套件。在一些实施方案中,本公开涉及包含本文描述的治疗剂的包装或套件。在一些实施方案中,套件还可包含用于与微针的组合疗法的另外的治疗剂。在一些实施方案中,套件还可包含消毒剂(例如,酒精拭子)。在一些实施方案中,套件还可包含说明书(例如,可用于施加或施用本文描述的微针装置的说明书)。在一些实施方案中,本文描述的此类包装和套件可用于疫苗接种目的,例如以如本文所述在受试者中实现广谱免疫。在一些实施方案中,本文描述的此类包装和套件可用于癌症治疗或预防目的,例如以如本文所述在受试者中治疗或预防癌症。
[0664]
疫苗
[0665]
本文描述的微针和方法也可用于向有此需要的受试者递送疫苗。关于疫苗递送,本公开至少部分地基于以下发现:例如与疫苗的单剂量施用或推注施用相比,经由例如包含如本文所述的疫苗、例如病毒疫苗如流感疫苗的受控释放和/或持续释放组合物和装置(例如,微针,例如基于丝的微针,和微针装置)调节抗原呈递的动力学可在受试者中驱动更强效和/或持久的免疫应答(例如,更强效和/或持久的细胞免疫应答和/或体液免疫应答)。在一些实施方案中,可使用如本文所述的疫苗的受控释放或持续释放来在受试者中实现广谱免疫。
[0666]
在一些实施方案中,本文描述的微针和微针装置表现出疫苗(例如,流感疫苗)达至少约1-2周(例如,达至少约1、2、3、4、5、6、7、8、9、10、11、12、13或14天)的受控释放或持续释放,这导致免疫原性提高、免疫应答增强和/或广谱免疫中的一种或多种。
[0667]
在某些实施方案中,本公开的微针可配置为实现如本文所述的疫苗、抗原和/或免疫原(例如,流感疫苗)的受控释放或持续释放。不希望受理论的束缚,施用本文公开的包含疫苗的微针可在受试者中诱导对病毒的广谱免疫的发生。
[0668]
用于本文描述的微针和微针装置(例如,微针贴剂)中的疫苗的非限制性实例可包括商业疫苗,如季节性疫苗、大流行疫苗和/或通用疫苗;基于蛋的疫苗、基于细胞培养的疫苗;重组疫苗;减毒活病毒、灭活全病毒、裂解病毒体和/或蛋白质亚基疫苗;和佐剂疫苗。
[0669]
如本文所用,术语“病毒”是指由用壳体包裹在蛋白质中的核酸组成的传染剂。这些传染剂不能够自主复制(即,复制需要使用宿主细胞的运转部分)。病毒基因组学可为单链(ss)或双链(ds)rna或dna,并且可或不可使用逆转录酶(rt)。另外,ssrna病毒可以是正义的( )或反义的(-)。示例性的病毒包括但不限于dsdna病毒(例如,腺病毒、疱疹病毒、痘病毒)、ssdna病毒(例如,细小病毒)、dsrna病毒(例如,reo病毒)、( )ssrna病毒(例如,微小核糖核酸病毒、toga病毒)、(-)ssrna病毒(例如,正粘病毒,弹状病毒)、ssrna-rt病毒(即,在生命周期中具有dna中间体的( )正义rna(例如,逆转录病毒))和dsdna-rt病毒(例如,嗜肝dna病毒)。在一些实施方案中,病毒还可包括野生型(天然)病毒、被杀死的病毒、减毒活病毒、经修饰的病毒、重组病毒或其任何组合。示例性的逆转录病毒包括人类免疫缺陷病毒(hiv)。病毒的其他实例包括但不限于包膜病毒、呼吸道合胞病毒、无包膜病毒(例如,人乳
头状瘤病毒(hpv))、噬菌体、重组病毒和病毒载体。如本文所用,术语“噬菌体”是指感染细菌的病毒。
[0670]
作为实例,下面列出了可引入到本公开的微针中的各种商业流感疫苗。另外,包含mrna、dna、病毒载体和/或病毒样颗粒(vlp)的流感疫苗也适合用于本文描述的微针和微针装置(例如,微针贴剂)中。在一些实施方案中,流感疫苗可靶向流感病毒的基质蛋白1、基质蛋白2(m2e)和/或核蛋白(np)。
[0671][0672]
实施例
[0673]
通过参考以下实验实施例进一步详细描述本公开。提供这些实施例仅出于示意的目的,而非旨在限制,另有说明除外。因此,本公开绝不应解释为限于以下实施例,而是应解释为涵盖由于本文提供的教导而变得明显的任何和所有变化。
[0674]
实施例1.抗癌剂和免疫调节剂的基于丝的微针施用对于治疗实体瘤/癌症的功效的体内评价
[0675]
可使用小鼠黑色素瘤的体内模型来评估多种治疗剂(例如,细胞因子、检查点抑制剂、化疗剂、编码抗癌剂的mrna或者两者、三者或所有四者的组合)的持续释放在其控制肿瘤微环境的能力方面的功效。虽然在这些实验中使用的模型为黑色素瘤,但预期该平台在其他癌症(包括实体癌)中具有更广泛的用途。
[0676]
将小鼠黑色素瘤细胞(b16-f10)注射到小鼠(c57bl/6)的侧腹(右侧)中并让形成肿瘤。药剂将通过以下方式在肿瘤内或肿瘤周围(即,皮内或皮下)施用:
[0677]
1.单次推注,
[0678]
2.一系列分次注射,其中在时间框架内给予的总剂量与单次推注相等。这些注射可每天一次或隔天一次给予。
[0679]
3.用一种或多种治疗剂配制的丝微针贴剂。
[0680]
待在这些实验中研究的治疗剂(即,作为单一药剂和组合)可包括但不限于:
[0681]
抗癌剂,如:
[0682]
化学治疗剂:吉西他滨、多柔比星、奥沙利铂、达卡巴嗪、替莫唑胺
[0683]
靶向疗法:维莫非尼、达拉非尼、曲美替尼
[0684]
其他:编码抗癌剂的mrna
[0685]
免疫调节剂,如:
[0686]
细胞因子:il-2、il-12、il-15、gm-csf
[0687]
免疫调节剂:cpg、c-di-gmp
[0688]
检查点抑制剂:抗pd1、抗pd-l1、抗ctla4
[0689]
其他:编码细胞因子和其他免疫调节分子的mrna
[0690]
将探索和优化持续释放的持续时间(每日注射或丝微针)(~2-28天)。另外,多个周期的持续释放对于肿瘤清除可能是最佳的。为了测试这一点,将在约~2-28天内经由单次推注或持续释放(每日注射或丝微针)施用药剂。在一段时间内(~5-14天),不给予动物治疗,然后给予第二轮药剂,第二轮与第一轮相同。
[0691]
每周两到三次测量肿瘤生长。当达到人道终点时,对动物实施安乐死。这些终点包括体重减轻》15%、身体状况评分《1、肿瘤体积》1cm3、肿瘤长度(定义为最长维度)》1.5cm、或肿瘤溃疡/坏死。这些人道终点适用于所有使用黑色素瘤模型的体内实验。
[0692]
治疗剂的持续释放可导致肿瘤生长的抑制(与常规的单次推注相比)或肿瘤的完全清除。这些实验将找出最佳给药动力学、给药时间和施用途径。重要的是,目的在于减选和找出对肿瘤生长具有作用的药剂或药剂组合。然后测试这些药剂增强异位效应和记忆反应的能力(实验在下文详述)。
[0693]
在b16-f10小鼠中肿瘤内施用il-2或吉西他滨
[0694]
根据上文阐述的方法,用il-2或吉西他滨,使用b16-f10小鼠黑色素瘤肿瘤模型,将每日肿瘤内施用与单次肿瘤内推注给药进行比较。对于本研究,进行两个周期的治疗,包括在第7天和第21天推注施用以及在第7-11天和第21-25天每日施用。(参见图6a)。在第0天,通过皮下施用b16-f10细胞对小鼠接种。在第4天和第9天,通过腹膜内注射给小鼠施用一剂抗pd1 mab(每剂100ug)。收集来自两个实验的数据,每组15只小鼠。
[0695]
第一周期:在第7天,
‘
单次推注给药’组中的小鼠接受il-2(5μg)或吉西他滨(475μg)的单次推注给药。
‘
每日给药’组中的小鼠在第7-11天内接受il-2(1μg)或吉西他滨(95μg)的每日给药(肿瘤内)(总共5剂)。每次每日给药为相当于单次推注给药的大约1/5的分剂量。
[0696]
第二周期:在第21天,
‘
单次推注给药’组中的小鼠接受il-2(5μg)或吉西他滨(475μg)的单次推注给药。
‘
每日给药’组中的小鼠在第21-25天内接受il-2(1μg)或吉西他滨(95μg)的每日给药(肿瘤内)(总共5剂)。每次每日给药为相当于单次推注给药的大约1/5的分剂量。
[0697]
与接受推注给药的对应小鼠相比,接受il-2的每日给药的b16-f10小鼠具有较低的肿瘤负荷,如通过肿瘤体积随时间的变化所确定(参见图6b;平均值 sem)。接受il-2的每日给药的小鼠也比接受il-2的推注给药的小鼠具有更好的存活,如由图6c中示出的kaplan-meier曲线所证实。
[0698]
类似地,与接受推注吉西他滨的对应小鼠相比,用吉西他滨的每日肿瘤内给药治疗的b16-f10小鼠表现出较低的肿瘤负荷,如通过肿瘤体积随时间的变化所确定(参见图6d;平均值 sem)。接受每日肿瘤内吉西他滨的小鼠比推注组具有更高的存活,如由图6e中提供的kaplan-meier曲线所示。
[0699]
在ct26小鼠中肿瘤内施用吉西他滨
[0700]
在鼠ct26结肠癌模型中使用吉西他滨进一步研究每日肿瘤内施用,与单次肿瘤内推注给药相比较(参见图7a-7b)。在第0天,通过皮下施用ct26细胞对小鼠接种。在第4天和第9天,通过腹膜内注射给小鼠施用一剂抗pd1 mab(每剂100μg)。收集来自两个实验的数据,每组10只小鼠。
[0701]
‘
单次推注给药’组中的ct26小鼠在第7天接受吉西他滨(475μg)的单次推注给药(肿瘤内),并在接下来的四天接受四剂盐水(肿瘤内)(图7a)。
‘
每日给药’组中的ct26小鼠在第7-11天内接受吉西他滨(95μg)的每日给药(肿瘤内)(总共5剂)(图7b)。每次每日给药为相当于单次推注给药的大约1/5的分剂量。对肿瘤体积随时间的变化的分析揭示,与单次推注组相比,每日给药组中的小鼠具有较低的肿瘤负荷(参见图7c)。每日给药组中小鼠的总体存活能力也大于推注给药组,如图7d中提供的kaplan-meier存活曲线所证明。
[0702]
实施例2.远端肿瘤中的异位效应的体内评估
[0703]
为了确定持续释放是否产生异位效应——肿瘤的局部治疗可抑制远端肿瘤的进一步生长或促进远端肿瘤的清除的现象,使用b16-f10黑色素瘤细胞在小鼠的两个侧腹(右侧和左侧)中诱导肿瘤。当肿瘤已出现时,如下向右侧肿瘤中(施用)药剂:
[0704]
1.单次推注
[0705]
2.一系列分剂量注射
[0706]
3.用药剂配制的丝微针贴剂。
[0707]
随时间测量两个肿瘤的生长,每周两到三次。当达到人道终点时,对动物实施安乐死。如果药剂的持续释放促进了异位效应,则左侧(未经治疗的)肿瘤应显著小于经单次推注治疗的动物的那些。
[0708]
实施例3.建立将导致未来肿瘤排斥的记忆应答的能力的体内评估
[0709]
为了确定在原发肿瘤治疗后是否建立优异的免疫记忆应答,使用b16-f10黑色素
瘤细胞在小鼠的单个侧腹(右侧)中诱导肿瘤。如下施用药剂:
[0710]
1.单次推注
[0711]
2.一系列分剂量注射
[0712]
3.用药剂配制的丝微针贴剂。
[0713]
随时间测量肿瘤大小。在经过一段长时间(~60-90天)后,向与初始肿瘤相对的侧腹(左)中注射细胞。随时间跟踪新肿瘤的大小。如果药剂的持续释放增强抗癌记忆应答,则新肿瘤将不能生长或体积显著小于常规治疗的动物的那些。
[0714]
实施例4.细胞因子/化学治疗剂/检查点抑制剂的持续释放的体内评价
[0715]
对于基于蛋白质的药剂(例如,细胞因子、抗检查点抗体),用荧光团标记药剂。如果使用药剂的组合,则用不同的荧光团标记药剂。如前所述使用b16-f10模型在小鼠中诱导肿瘤。经由以下方式肿瘤内或肿瘤周围施用治疗:
[0716]
1.单次推注
[0717]
2.用药剂配制的丝微针贴剂。
[0718]
使用体内成像系统(ivis)可视化药剂释放的持续时间。经由推注施用的药剂从肿瘤快速清除,而来自丝微针的药剂应在肿瘤内存在延长的持续时间(数天至数周)。
[0719]
化疗剂通常为不能用大荧光团标记的小分子。为了使用ivis测定这些制剂的持续释放,如前所述向肿瘤施用在溶解度、大小和电荷方面与可以可视化的一种或多种药剂(例如,罗丹明b、香豆素6)相似的替代物分子。
[0720]
实施例5.细胞因子的基于丝的微针施用对于治疗黑色素瘤的功效的体外评价
[0721]
为了确定基于丝的微针的细胞因子“货物”的释放和生物功能,使用一系列体外测定。
[0722]
对于所有细胞因子(例如,il-2、il-12、il-15、gm-csf),使用可商购获得的酶联免疫吸附测定(elisa)来测定从微针释放的细胞因子的量。
[0723]
为了评价生物功能是否保全,采用基于细胞系的测定。对于选定的细胞因子,可获得其生长依赖于这些细胞因子的细胞系(例如,ctll-2、ht-2)。使用四唑盐(例如,wst-1、mtt或mts)在数天(2-5天)内测量细胞的增殖。
[0724]
il-12功能可通过小鼠脾细胞产生的ifnγ来量度。然后使用elisa测量ifnγ。
[0725]
大多数细胞因子的生物功能可使用可商购获得的报告细胞系来测定,这些细胞系经基因工程化而以剂量依赖性方式产生可测量的蛋白质(比色法、发光法或荧光法)。
[0726]
在所有这些实验中,通过将细胞读数与标准曲线进行比较来计算从微针释放的功能性细胞因子的浓度。通过使用和不使用经纯化的丝(以在配制微针的范围内的浓度)进行这些测定来评估丝本身对这些测定中的每一个的影响。
[0727]
il-2在干丝组合物中的稳定性
[0728]
为了研究丝形式的白介素2(il-2)随时间的稳定性,使用2%的丝和10ng/ml的il-2生成丝膜,并在pdms上空气干燥。然后将膜在4℃、室温或37℃下保持14天的时间。然后将膜在完全细胞培养基中重构,之后加入hek-blue il-12(invivogen)细胞,该细胞仅在生物功能性il-2的存在下分泌碱性磷酸酶。然后在24小时后测量碱性磷酸酶的释放,其结果提供在图8中。图8描绘了基于细胞的测定,其可具有一定量的变化。用于计算回收率的标准曲线纳入了丝以排除测定变化作为较高回收率值的一个因素。总之,这些结果证实在干丝组
合物中il-2的稳定性和活性随时间保持。
[0729]
实施例6.丝配制的小分子化疗对于治疗黑色素瘤的功效的体外评价
[0730]
在5天的时间内测量肿瘤细胞活力以评估体外化疗小分子的单次给药的有效持续时间。通过将小分子化疗(例如,吉西他滨、多柔比星、奥沙利铂)与或不与制剂一起浇铸到聚二甲基硅氧烷(pdms)盘上来制备治疗物。将治疗物在10%的相对湿度下干燥4小时,然后转移到微管中。将黑色素瘤细胞(例如,b16-f10)以10,000个细胞/孔的密度接种到24孔板中并温育。24小时后,使用新鲜培养基来重构治疗膜并用于更换24孔板中的培养基。每天通过四唑盐测定测量细胞活力。为了评估制剂对细胞活力的影响,治疗组包括未经处理的对照组(盐水)、仅制剂组(无小分子)、无制剂的小分子和在制剂的存在下干燥的小分子。预计细胞活力测定的结果将表明配制在丝中的化学治疗剂保持细胞毒性功能。
[0731]
等同物
[0732]
虽然已结合其优选的实施方案特别地示出和描述了本公开,但本领域技术人员应理解,可在不脱离如所附权利要求书所限定的本公开的精神和范围的情况下对形式和细节作各种改变。本领域技术人员应认识或者能够使用不超过常规的实验确定本文具体描述的本公开的具体实施方案的许多等同物。这样的等同物旨在涵盖在所附权利要求书的范围中。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。