本发明涉及一种辅助诊断大肠癌的方法、试剂盒(kit)及生物标志物。
背景技术:
糖链为葡萄糖、半乳糖、甘露糖、岩藻糖、木糖、n-乙酰葡糖胺、n-乙酰半乳糖胺等单糖及它们的衍生物通过糖苷键链状键合的分子的总称。糖链在活体内以与蛋白质或脂质键合的复合糖的形态主要存在于细胞表面上,并且与细胞的增殖、细菌或病毒感染、神经的伸长、炎症、免疫等的生理作用有关。另一方面,还已知糖链随着大肠癌等疾病而其结构发生变化。近年来,为了将糖链用作大肠癌等疾病的生物标志物,正在积极进行研究。作为上述生物标志物,例如已知有癌胚抗原(cea:carcinoembryonic anti gen)、富含亮氨酸的α2糖蛋白等(专利文献1)。现有技术文献专利文献专利文献1:日本特开2015-184168号公报
技术实现要素:
发明要解决的技术课题但是,在准确度的观点而言,上述公知的生物标志物不够充分。本发明的课题在于提供一种新的大肠癌的生物标志物、盒及诊断辅助方法。尤其,本发明的课题在于提供一种准确度高的大肠癌的生物标志物。用于解决技术课题的手段本发明是为了解决上述课题而完成的,并且由以下结构构成。
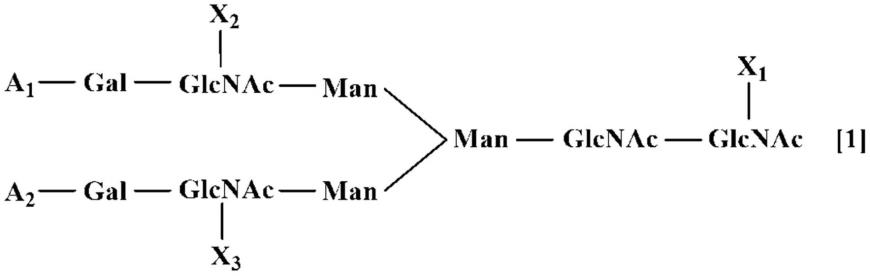
1.一种用于辅助诊断大肠癌的生物标志物,其包含选自下述(1)~(4)的糖链:(1)存在于α1抗胰蛋白酶中的下述式1或式2所表示的至少1个糖链;(2)存在于富含亮氨酸的α2糖蛋白中的下述式1所表示的糖链;(3)存在于α1抗胰凝乳蛋白酶中的下述式1或式2所表示的至少1个糖链;及(4)存在于补体成分9中的下述式1所表示的糖链。
(式1中,x1、x2及x3分别独立地表示fuc或h,a1及a2分别独立地表示neu5ac、neu5ac-neu5ac或h)(式2中,x4、x5、x6及x7分别独立地表示fuc或h,a3、a4及a5分别独立地表示neu5ac、neu5ac-neu5ac或h)
2.根据[1]所述的生物标志物,其中,所述糖链为下述(1-1)~(4-1)中的任一个所表示的糖链:(1-1)与α1抗胰蛋白酶的氨基酸序列的从n末端计第70个天冬酰胺残基键合的所述式1或式2所表示的至少1个糖链;(2-1)与富含亮氨酸的α2糖蛋白的氨基酸序列的从n末端计第79个天冬酰胺残基、第186个天冬酰胺残基或第269个天冬酰胺残基键合的所述式1所表示的糖链;(3-1)与α1抗胰凝乳蛋白酶的氨基酸序列的从n末端计第93个天冬酰胺残基键合的所述式1或式2所表示的至少1个糖链;及(4-1)与补体成分9的氨基酸序列的从n末端计第415个天冬酰胺残基键合的所述式1所表示的糖链。
[0003]
根据[1]或[2]所述的生物标志物,其中,所述糖链为与α1抗胰蛋白酶的氨基酸序列的从n末端计第70个天冬酰胺残基键合的所述式1或式2所表示的至少1个糖链。
[0004]
一种辅助诊断大肠癌的方法,其测定来源于被检动物的试样中的选自下述(1)~(4)的糖链,并根据所获得的测定结果来判定被检动物是否患有大肠癌:(1)存在于α1抗胰蛋白酶中的下述式1或式2所表示的至少1个糖链;(2)存在于富含亮氨酸的α2糖蛋白中的下述式1所表示的糖链;(3)存在于α1抗胰凝乳蛋白酶中的下述式1或式2所表示的至少1个糖链;及(4)存在于补体成分9中的下述式1所表示的糖链。
(式1中,x1、x2及x3分别独立地表示fuc或h,a1及a2分别独立地表示neu5ac、neu5ac-neu5ac或h)(式2中,x4、x5、x6及x7分别独立地表示fuc或h,a3、a4及a5分别独立地表示neu5ac、neu5ac-neu5ac或h)
[0005]
根据[4]所述的方法,其中,所述糖链为下述(1-1)~(4-1)中的任一个所表示的糖链:(1-1)与α1抗胰蛋白酶的氨基酸序列的从n末端计第70个天冬酰胺残基键合的所述式1或式2所表示的至少1个糖链;(2-1)与富含亮氨酸的α2糖蛋白的氨基酸序列的从n末端计第79个天冬酰胺残基、第186个天冬酰胺残基或第269个天冬酰胺残基键合的所述式1所表示的糖链;(3-1)与α1抗胰凝乳蛋白酶的氨基酸序列的从n末端计第93个天冬酰胺残基键合的所述式1或式2所表示的至少1个糖链;及(4-1)与补体成分9的氨基酸序列的从n末端计第415个天冬酰胺残基键合的所述式1所表示的糖链。
[0006]
根据[4]或[5]所述的方法,其中,所述糖链为与α1抗胰蛋白酶的氨基酸序列的从n末端计第70个天冬酰胺残基键合的所述式1或式2所表示的至少1个糖链。
[0007]
根据[4]至[6]中任一项所述的方法,其中,所述试样为全血、血清或血浆。
[0008]
一种用于辅助诊断大肠癌的试剂盒,其包含对选自下述(1)~(4)的糖链具有亲和性的物质:(1)存在于α1抗胰蛋白酶中的下述式1或式2所表示的至少1个糖链;(2)存在于富含亮氨酸的α2糖蛋白中的下述式1所表示的糖链;
(3)存在于α1抗胰凝乳蛋白酶中的下述式1或式2所表示的至少1个糖链;及(4)存在于补体成分9中的下述式1所表示的糖链。(式1中,x1、x2及x3分别独立地表示fuc或h,a1及a2分别独立地表示neu5ac、neu5ac-neu5ac或h)(式2中,x4、x5、x6及x7分别独立地表示fuc或h,a3、a4及a5分别独立地表示neu5ac、neu5ac-neu5ac或h)
[0009]
根据[8]所述的试剂盒,其中,所述糖链为下述(1-1)~(4-1)中的任一个所表示的糖链:(1-1)与α1抗胰蛋白酶的氨基酸序列的从n末端计第70个天冬酰胺残基键合的所述式1或式2所表示的至少1个糖链;(2-1)与富含亮氨酸的α2糖蛋白的氨基酸序列的从n末端计第79个天冬酰胺残基、第186个天冬酰胺残基或第269个天冬酰胺残基键合的所述式1所表示的糖链;(3-1)与α1抗胰凝乳蛋白酶的氨基酸序列的从n末端计第93个天冬酰胺残基键合的所述式1或式2所表示的至少1个糖链;及(4-1)与补体成分9的氨基酸序列的从n末端计第415个天冬酰胺残基键合的所述式1所表示的糖链。发明效果根据本发明的用于辅助诊断大肠癌的生物标志物及方法以及用于其的试剂盒,能够以高准确度辅助诊断大肠癌。
附图说明
图1是表示针对糖肽a、b、c及d的峰面积值,大肠癌患者(n=18)的平均值及健康者(n=20)的平均值的图。图2是表示针对糖肽e,f、g及h的峰面积值,大肠癌患者(n=18)的平均值及健康者(n=20)的平均值的图。图3是表示针对糖肽i、j、k及l的峰面积值,大肠癌患者(n=18)的平均值及健康者(n=20)的平均值的图。图4是表示针对糖肽m的峰面积值,大肠癌患者(n=18)的平均值及健康者(n=20)的平均值的图。
具体实施方式
<本发明的用于辅助诊断大肠癌的生物标志物>本发明的用于辅助诊断大肠癌的生物标志物(以下,有时简称为本发明的生物标志物。)包含选自下述(1)~(4)的糖链。(1)存在于α1抗胰蛋白酶中的下述式1或式2所表示的至少1个糖链(以下,有时简称为本发明的生物标志物(1)。);(2)存在于富含亮氨酸的α2糖蛋白中的下述式1所表示的糖链(以下,有时简称为本发明的生物标志物(2)。);(3)存在于α1抗胰凝乳蛋白酶中的下述式1或式2所表示的至少1个糖链(以下,有时简称为本发明的生物标志物(3)。);及(4)存在于补体成分9中的下述式1所表示的糖链(以下,有时简称为本发明的生物标志物(4)。)。另外,本发明的生物标志物可以单独包含本发明的生物标志物(1)~(4)中的任一个,或者也可以包含多种。以下,分别对本发明的生物标志物(1)~(4)进行说明。[本发明的生物标志物(1)]本发明的生物标志物(1)包含存在于α1抗胰蛋白酶中的下述式1或式2所表示的至少1个糖链。(式1中,x1、x2及x3分别独立地表示fuc或h,a1及a2分别独立地表示neu5ac、neu5ac-neu5ac或h)
(式2中,x4、x5、x6及x7分别独立地表示fuc或h,a3、a4及a5分别独立地表示neu5ac、neu5ac-neu5ac或h)上述式1及式2中的neu5ac表示n-乙酰神经氨酸,gal表示半乳糖,glcnac表示n-乙酰葡糖胺,man表示甘露糖,fuc表示岩藻糖,h表示氢原子。在上述式1及式2中的x1为h的情况下(x2、x3、x4、x5、x6或/和x7为h的情况也相同),x
1-glcnac表示glcnac。并且,在上述式1及式2中的末端的a1为h的情况下(a2、a3、a4或/和a5为h的情况也相同)、a
1-gal-表示gal-。以下,在本说明书中表示相同的含义。另外,作为本发明的生物标志物(1),可以为上述式1所表示的糖链及上述式2所表示的糖链中仅具有式1所表示的糖链的生物标志物,也可以为仅具有式2所表示的糖链的生物标志物,也可以为具有式1所表示的糖链和式2所表示的糖链这两个的生物标志物。并且,可以为仅具有式1中所包含的单个糖链的生物标志物,也可以为具有式1中所包含的多个糖链的生物标志物,并且可以为仅具有式2中所包含的单个糖链的生物标志物,也可以为具有式2中所包含的多个糖链的生物标志物。本发明的生物标志物(1)所涉及的α1抗胰蛋白酶为由394个氨基酸构成的糖蛋白质,主要由肝细胞生成,并且为在各种炎症时在血中增加的急性期反应物之一。并且,也已知作为血中的最主要的蛋白酶抑制剂而发挥作用。并且,上述α1抗胰蛋白酶的氨基酸序列例如登录在uniprot(登录号:p01009)等数据库中。本发明的生物标志物(1)所涉及的α1抗胰蛋白酶不仅包含登录在上述数据库中的物质,还包含在活体内能够产生的变异体等。例如为在该α1抗胰蛋白酶中缺失、取代或/和加成1~5个(优选为1或2个)氨基酸而获得的物质,并且为通过多态性或突变等而产生的物质。但是,即使为变异体,也优选为保存作为本发明的生物标志物(1)中的式1或式2所表示的至少1个糖链与α1抗胰蛋白酶的键合部位的、该α1抗胰蛋白酶的氨基酸序列的从n末端计第70个氨基酸残基(天冬酰胺残基)的变异体。本发明的生物标志物(1)中的式1或式2所表示的至少1个糖链(末端的n-乙酰葡糖胺)优选与α1抗胰蛋白酶的氨基酸序列的从n末端计第70个氨基酸残基(天冬酰胺残基)键合(n-糖苷键)。以下,分别对本发明的生物标志物(1)中的式1或式2所表示的糖链进行说明。
[存在于α1抗胰蛋白酶中的式1所表示的糖链](式1中,x1、x2及x3分别独立地表示fuc或h,a1及a2分别独立地表示neu5ac、neu5ac-neu5ac或h)上述式1中的x1、x2及x3优选为下述表1所示的组合,更优选为组合4~7。[表1]no.x1x2x3组合1fucfuch组合2fuchfuc组合3hfucfuc组合4fuchh组合5hfuch组合6hhfuc组合7hhh上述式1中的a1及a2优选为下述表2所示的组合,更优选为组合1、2及4。[表2]no.a1a2组合1neu5ac-neu5ach组合2neu5acneu5ac组合3neu5ach组合4hneu5ac-neu5ac组合5hneu5ac作为上述式1中的x1、x2及x3以及a1及a2的组合,优选为下述表3所示的组合,更优选为组合16、17、19、21、22、24、26、27、29、31、32及34。[表3]no.x1x2x3a1a2组合1fucfuchneu5ac-neu5ach组合2fucfuchneu5acneu5ac组合3fucfuchneu5ach组合4fucfuchhneu5ac-neu5ac组合5fucfuchhneu5ac组合6fuchfucneu5ac-neu5ach
组合7fuchfucneu5acneu5ac组合8fuchfucneu5ach组合9fuchfuchneu5ac―neu5ac组合10fuchfuchneu5ac组合11hfucfucneu5ac-neu5ach组合12hfucfucneu5acneu5ac组合13hfucfucneu5ach组合14hfucfuchneu5ac-neu5ac组合15hfucfuchneu5ac组合16fuchhneu5ac-neu5ach组合17fuchhneu5acneu5ac组合18fuchhneu5ach组合19fuchhhneu5ac-neu5ac组合20fuchhhneu5ac组合21hfuchneu5ac-neu5ach组合22hfuchneu5acneu5ac组合23hfuchneu5ach组合24hfuchhneu5ac-neu5ac组合25hfuchhneu5ac组合26hhfucneu5ac-neu5ach组合27hhfucneu5acneu5ac组合28hhfucneu5ach组合29hhfuchneu5ac-neu5ac组合30hhfuchneu5ac组合31hhhneu5ac-neu5ach组合32hhhneu5acneu5ac组合33hhhneu5ach组合34hhhhneu5ac-neu5ac组合35hhhhneu5ac根据glcnac、man、gal、neu5ac、fuc等各单糖彼此的键合方式,上述式1所表示的糖链例如优选为下述式1’所表示的糖链。(式1’中,x1、x2及x3以及a1及a2与上述相同)而且,上述式1’优选由下述式1”或式1
”’
表示。
(式1”中,x1、x2及x3以及a1及a2与上述相同(其中,x1、x2及x3中的任一个为fuc,其余的2个分别为h,a1及a2中的neu5ac的总数为2))(式1
”’
中,a1及a2与上述相同(其中,a1及a2中的neu5ac的总数为2))在上述式1’、式1”及式1
”’
中的x1、x2或x3为fuc的情况下,fuc例如优选通过α1-6糖苷键与glcnac键合。在a1或/和a2为neu5ac的情况下,neu5ac例如优选通过α2-3糖苷键或α2-6糖苷键与gal键合。并且,在a1或a2为neu5ac-neu5ac的情况下,neu5ac例如优选通过α2-8糖苷键与neu5ac键合。式1’、式1”及式1
”’
中的x1、x2及x3以及a1及a2的具体例、组合与上述式1相同。[存在于α1抗胰蛋白酶中的式2所表示的糖链](式2中,x4、x5、x6及x7分别独立地表示fuc或h,a3、a4及a5分别独立地表示neu5ac、neu5ac-neu5ac或h)上述式2中的x4、x5、x6及x7例如优选为下述表4所示的组合。[表4]no.x4x5x6x7组合1fuchhh组合2hfuchh组合3hhfuch组合4hhhfuc组合5hhhh
上述式2中的a3、a4及a5优选为下述表5所示的组合。[表5]no.a3a4a5组合1neu5ac-neu5achh组合2hneu5ac-neu5ach组合3hhneu5ac-neu5ac组合4neu5acneu5ach组合5neu5achneu5ac组合6hneu5acneu5ac作为上述式2中的x4、x5、x6及x7以及a3、a4及a5的组合,优选为下述表6所示的组合。[表6]no.x4x5x6x7a3a4a5组合1fuchhhneu5ac-neu5achh组合2fuchhhhneu5ac-neu5ach组合3fuchhhhhneu5ac-neu5ac组合4fuchhhneu5acneu5ach组合5fuchhhneu5achneu5ac组合6fuchhhhneu5acneu5ac组合7hfuchhneu5ac-neu5achh组合8hfuchhhneu5ac-neu5ach组合9hfuchhhhneu5ac-neu5ac组合10hfuchhneu5acneu5ach组合11hfuchhneu5achneu5ac组合12hfuchhhneu5acneu5ac组合13hhfuchneu5ac-neu5achh组合14hhfuchhneu5ac-neu5ach组合15hhfuchhhneu5ac-neu5ac组合16hhfuchneu5acneu5ach组合17hhfuchneu5achneu5ac组合18hhfuchhneu5acneu5ac组合19hhhfucneu5ac-neu5achh组合20hhhfuchneu5ac-neu5ach组合21hhhfuchhneu5ac-neu5ac组合22hhhfucneu5acneu5ach组合23hhhfucneu5achneu5ac组合24hhhfuchneu5acneu5ac组合25hhhhneu5ac-neu5achh组合26hhhhhneu5ac-neu5ach组合27hhhhhhneu5ac-neu5ac
组合28hhhhneu5acneu5ach组合29hhhhneu5achneu5ac组合30hhhhhneu5acneu5ac根据glcnac、man、gal、neu5ac、fuc等各单糖彼此的键合方式,上述式2所表示的糖链例如优选为下述式2’所表示的糖链。(式2’中,x4、x5、x6及x7以及a3、a4及a5与上述相同)而且,上述式2’优选由下述式2”或式2
”’
表示。(式2”中,x4、x5、x6及x7以及a3、a4及a5与上述相同(其中,x4、x5、x6及x7中的任一个为fuc,其余的3个分别为h,a3、a4及a5中的neu5ac的总数为2))(式2
”’
中,a3、a4及a5与上述相同(其中,a3、a4及a5中的neu5ac的总数为2))在上述式2’、式2”及式2
”’
中的x4、x5、x6或x7为fuc的情况下,fuc例如优选通过α1-6糖苷键与glcnac键合。在a3、a4或/和a5为neu5ac的情况下,neu5ac例如优选通过α2-3糖苷键或α2-6糖苷键与gal键合。并且,在a3、a4或a5为neu5ac-neu5ac的情况下,neu5ac例如优选通过α2-8糖苷键与neu5ac键合。式2’、式2”及式2
”’
中的x4、x5、x6及x7以及a3、a4及a5的具体例、组合与上述式2相同。
作为本发明的生物标志物(1)、即包含存在于α1抗胰蛋白酶中的式1或式2所表示的至少1个糖链的生物标志物,可以举出(i)存在于α1抗胰蛋白酶中的式1或式2所表示的至少1个糖链其本身、(ii)式1或式2所表示的至少1个糖链所键合的α1抗胰蛋白酶、(iii)为α1抗胰蛋白酶的一部分且式1或式2所表示的至少1个糖链所键合的肽片段等,优选为(ii)或(iii)。另外,上述肽片段为至少具有作为式1或式2所表示的至少1个糖链与α1抗胰蛋白酶的键合部位的、α1抗胰蛋白酶的氨基酸序列的从n末端计第70个氨基酸残基(天冬酰胺残基)的任意片段。具体而言,例如可以举出在活体内产生的物质或将α1抗胰蛋白酶添加到胰蛋白酶、赖氨酰肽链内切酶、aspn等的蛋白酶处理中的结果所产生的物质,更具体而言,可以举出由2~50个氨基酸残基构成的物质等,优选为序列号1所表示的物质。[本发明的生物标志物(2)]本发明的生物标志物(2)包含存在于富含亮氨酸的α2糖蛋白中的下述式1所表示的至少1个糖链。(式1中,x1、x2及x3分别独立地表示fuc或h,a1及a2分别独立地表示neu5ac、neu5ac-neu5ac或h)另外,作为本发明的生物标志物(2),可以为仅具有上述式1中所包含的单个糖链的生物标志物,也可以为具有式1中所包含的多个糖链的生物标志物。本发明的生物标志物(2)所涉及的富含亮氨酸的α2糖蛋白为血液中所包含的蛋白质,其特征在于具有富含亮氨酸重复序列结构。据报道,富含亮氨酸的α2糖蛋白与类风湿性关节炎、炎症性肠病等各种疾病有关。并且,上述富含亮氨酸的α2糖蛋白的氨基酸序列例如登录在uniprot(登录号:p02750)等数据库中。本发明的生物标志物(2)所涉及的富含亮氨酸的α2糖蛋白不仅包含登录在上述数据库中的物质,还包含在活体内能够产生的变异体等。例如为在该富含亮氨酸的α2糖蛋白中缺失、取代或/和加成1~5个(优选为1或2个)氨基酸而获得的物质,并且为通过多态性或突变等而产生的物质。但是,即使为变异体,也优选为保存作为本发明的生物标志物(2)中的式1所表示的糖链与富含亮氨酸的α2糖蛋白的键合部位的、该富含亮氨酸的α2糖蛋白的氨基酸序列的从n末端计第79个氨基酸残基(天冬酰胺残基)、第186个氨基酸残基(天冬酰胺残基)或第269个氨基酸残基(天冬酰胺残基)的变异体。本发明的生物标志物(2)中的式1所表示的糖链(末端的n-乙酰葡糖胺)优选与富
含亮氨酸的α2糖蛋白的氨基酸序列的从n末端计第79个氨基酸残基(天冬酰胺残基)、第186个氨基酸残基(天冬酰胺残基)或第269个氨基酸残基(天冬酰胺残基)键合(n-糖苷键)。以下,对本发明的生物标志物(2)中的式1所表示的糖链进行说明。[存在于富含亮氨酸的α2糖蛋白中的式1所表示的糖链](式1中,x1、x2及x3分别独立地表示fuc或h,a1及a2分别独立地表示neu5ac、neu5ac-neu5ac或h)上述式1中的x1、x2及x3优选为上述表1所示的组合。上述式1中的a1及a2优选为上述表2所示的组合。作为上述式1中的x1、x2及x3以及a1及a2的组合,优选为上述表3所示的组合。根据glcnac、man、gal、neu5ac、fuc等各单糖彼此的键合方式,上述式1所表示的糖链例如优选为下述式1’所表示的糖链。(式1’中,x1、x2及x3以及a1及a2与上述相同)而且,上述式1’优选由下述式1”、式1
”’
或式1
””
表示。(式1”中,x1、x2及x3以及a1及a2与上述相同(其中,x1、x2及x3中的任一个为fuc,其余的2个分别为h,a1及a2中的neu5ac的总数为2))
(式1
”’
中,a1及a2与上述相同(其中,a1及a2中的neu5ac的总数为2))(式1”中,x1、x2及x3以及a1及a2与上述相同(其中,x1、x2及x3中的任意2个分别为fuc,其余的1个为h,a1及a2中的neu5ac的总数为1))在上述式1’、式1”、式1
”’
及式1
””
中的x1、x2或x3为fuc的情况下,fuc例如优选通过α1-6糖苷键与glcnac键合。在a1或/和a2为neu5ac的情况下,neu5ac例如优选通过α2-3糖苷键或α2-6糖苷键与gal键合。并且,在a1或a2为neu5ac-neu5ac的情况下,neu5ac例如优选通过α2-8糖苷键与neu5ac键合。式1’、式1”及式1
”’
中的x1、x2及x3以及a1及a2的具体例、组合与上述式1相同。作为本发明的生物标志物(2)、即包含存在于富含亮氨酸的α2糖蛋白中的式1所表示的糖链的生物标志物,可以举出(i)存在于富含亮氨酸的α2糖蛋白中的式1所表示的糖链其本身、(ii)式1所表示的糖链所键合的富含亮氨酸的α2糖蛋白、(iii)为富含亮氨酸的α2糖蛋白的一部分且式1所表示的糖链所键合的肽片段等,优选为(ii)或(iii)。另外,上述肽片段为至少具有作为式1所表示的糖链与富含亮氨酸的α2糖蛋白的键合部位的、富含亮氨酸的α2糖蛋白的氨基酸序列的从n末端计第70个氨基酸残基(天冬酰胺残基)、第186个氨基酸残基(天冬酰胺残基)或第269个氨基酸残基(天冬酰胺残基)的任意片段。具体而言,例如可以举出在活体内产生的物质或将α1抗胰蛋白酶添加到胰蛋白酶、赖氨酰肽链内切酶、aspn等的蛋白酶处理中的结果所产生的物质,更具体而言,可以举出由2~50个氨基酸残基构成的物质等,优选为序列号2、序列号3或序列号4所表示的物质。[本发明的生物标志物(3)]本发明的生物标志物(3)包含存在于α1抗胰凝乳蛋白酶中的下述式1或式2所表示的至少1个糖链。(式1中,x1、x2及x3分别独立地表示fuc或h,a1及a2分别独立地表示neu5ac、neu5ac-neu5ac或h)
(式2中,x4、x5、x6及x7分别独立地表示fuc或h,a3、a4及a5分别独立地表示neu5ac、neu5ac-neu5ac或h)另外,作为本发明的生物标志物(3),可以为上述式1所表示的糖链及上述式2所表示的糖链中仅具有式1所表示的糖链的生物标志物,也可以为仅具有式2所表示的糖链的生物标志物,也可以为具有式1所表示的糖链和式2所表示的糖链这两个的生物标志物。并且,可以为仅具有式1中所包含的单个糖链的生物标志物,也可以为具有式1中所包含的多个糖链的生物标志物,并且可以为仅具有式2中所包含的单个糖链的生物标志物,也可以为具有式2中所包含的多个糖链的生物标志物。本发明的生物标志物(3)所涉及的α1抗胰凝乳蛋白酶为由433个氨基酸构成的糖蛋白质,并且为存在于血清中的丝氨酸蛋白酶抑制剂家族之一。并且,已知作为血中的最主要的蛋白酶抑制剂而发挥作用。并且,上述α1抗胰凝乳蛋白酶的氨基酸序列例如登录在uniprot(登录号:p01011)等数据库中。本发明的生物标志物(3)所涉及的α1抗胰凝乳蛋白酶不仅包含登录在上述数据库中的物质,还包含在活体内能够产生的变异体等。例如为在该α1抗胰凝乳蛋白酶中缺失、取代或/和加成1~5个(优选为1或2个)氨基酸而获得的物质,并且为通过多态性或突变等而产生的物质。但是,即使为变异体,也优选为保存作为本发明的生物标志物(3)中的式1或式2所表示的至少1个糖链与α1抗胰凝乳蛋白酶的键合部位的、该α1抗胰凝乳蛋白酶的氨基酸序列的从n末端计第93个氨基酸残基(天冬酰胺残基)的变异体。本发明的生物标志物(3)中的式1或式2所表示的至少1个糖链(末端的n-乙酰葡糖胺)优选与α1抗胰凝乳蛋白酶的氨基酸序列的从n末端计第93个氨基酸残基(天冬酰胺残基)键合(n-糖苷键)。以下,分别对本发明的生物标志物(3)中的式1或式2所表示的糖链进行说明。[存在于α1抗胰凝乳蛋白酶中的式1所表示的糖链]
6糖苷键与gal键合。并且,在a1或a2为neu5ac-neu5ac的情况下,neu5ac例如优选通过α2-8糖苷键与neu5ac键合。式1’、式1”及式1
”’
中的x1、x2及x3以及a1及a2的具体例、组合与上述式1相同。[存在于α1抗胰凝乳蛋白酶中的式2所表示的糖链](式2中,x4、x5、x6及x7分别独立地表示fuc或h,a3、a4及a5分别独立地表示neu5ac、neu5ac-neu5ac或h)上述式2中的x4、x5、x6及x7例如优选为上述表4所示的组合。上述式2中的a3、a4及a5优选为上述表5所示的组合。作为上述式2中的x4、x5、x6及x7以及a3、a4及a5的组合,优选为上述表6所示的组合。根据glcnac、man、gal、neu5ac、fuc等各单糖彼此的键合方式,上述式2所表示的糖链例如优选为下述式2’所表示的糖链。(式2’中,x4、x5、x6及x7以及a3、a4及a5与上述相同)而且,上述式2’优选由下述式2”或式2
”’
表示。
(式2”中,x4、x5、x6及x7以及a3、a4及a5与上述相同(其中,x4、x5、x6及x7中的任一个为fuc,其余的3个分别为h,a3、a4及a5中的neu5ac的总数为2))(式2
”’
中,a3、a4及a5与上述相同(其中,a3、a4及a5中的neu5ac的总数为2))在上述式2’、式2”及式2
”’
中的x4、x5、x6或x7为fuc的情况下,fuc例如优选通过α1-6糖苷键与glcnac键合。在a3、a4或a5为neu5ac的情况下,neu5ac例如优选通过α2-3糖苷键或α2-6糖苷键与gal键合。并且,在a1或a2为neu5ac-neu5ac的情况下,neu5ac例如优选通过α2-8糖苷键与neu5ac键合。式2’、式2”及式2
”’
中的x4、x5、x6及x7以及a3、a4及a5的具体例、组合与上述式1相同。作为本发明的生物标志物(3)、即包含存在于α1抗胰凝乳蛋白酶中的式1或式2所表示的至少1个糖链的生物标志物,可以举出(i)存在于α1抗胰凝乳蛋白酶中的式1或式2所表示的至少1个糖链其本身、(ii)式1或式2所表示的至少1个糖链所键合的α1抗胰凝乳蛋白酶、(iii)为α1抗胰凝乳蛋白酶的一部分且式1或式2所表示的至少1个糖链所键合的肽片段等,优选为(ii)或(iii)。另外,上述肽片段为至少具有作为式1或式2所表示的至少1个糖链与α1抗胰凝乳蛋白酶的键合部位的、α1抗胰凝乳蛋白酶的氨基酸序列的从n末端计第93个氨基酸残基(天冬酰胺残基)的任意片段。具体而言,例如可以举出在活体内产生的物质或将α1抗胰凝乳蛋白酶添加到胰蛋白酶、赖氨酰肽链内切酶、aspn等的蛋白酶处理中的结果所产生的物质,更具体而言,可以举出由2~50个氨基酸残基构成的物质等,优选为序列号5所表示的物质。[本发明的生物标志物(4)]本发明的生物标志物(4)包含存在于补体成分9中的下述式1所表示的糖链。
(式1中,x1、x2及x3分别独立地表示fuc或h,a1及a2分别独立地表示neu5ac、neu5ac-neu5ac或h)本发明的生物标志物(4)所涉及的补体成分9为辅助免疫反应(抗原抗体反应)的蛋白质之一。作为生理功能,已知有抗原的调理作用、基于膜攻击复合物的细菌的破坏、巨噬细胞等吞噬细胞的激活等。并且,上述补体成分9的氨基酸序列例如登录在uniprot(登录号:p02748)等数据库中。本发明的生物标志物(4)所涉及的补体成分9不仅包含登录在上述数据库中的物质,还包含在活体内能够产生的变异体等。例如为在该补体成分9中缺失、取代或/和加成1~5个(优选为1或2个)氨基酸而获得的物质,并且为通过多态性或突变等而产生的物质。但是,即使为变异体,也优选为保存作为本发明的生物标志物(4)中的式1所表示的糖链与补体成分9的键合部位的、该补体成分9的氨基酸序列的从n末端计第415个氨基酸残基(天冬酰胺残基)的变异体。本发明的生物标志物(4)中的式1所表示的糖链(末端的n-乙酰葡糖胺)优选与补体成分9的氨基酸序列的从n末端计第415个氨基酸残基(天冬酰胺残基)键合(n-糖苷键)。以下,分别对本发明的生物标志物(4)中的式1所表示的糖链进行说明。[存在于补体成分9中的式1所表示的糖链](式1中,x1、x2及x3分别独立地表示fuc或h,a1及a2分别独立地表示neu5ac、neu5ac-neu5ac或h)上述式1中的x1、x2及x3优选为上述表1所示的组合,更优选为组合7。上述式1中的a1及a2优选为上述表2所示的组合,更优选为组合1、2及4。作为上述式1中的x1、x2及x3以及a1及a2的组合,优选为上述表3所示的组合,更优选为组合31、32及34。
根据glcnac、man、gal、neu5ac、fuc等各单糖彼此的键合方式,上述式1所表示的糖链例如优选为下述式1’所表示的糖链。(式1’中,x1、x2及x3以及a1及a2与上述相同)而且,上述式1’优选由下述式1
”’
表示。(式1
”’
中,a1及a2与上述相同(其中,a1及a2中的neu5ac的总数为2))在上述式1’中的x1、x2或x3为fuc的情况下,fuc例如优选通过α1-6糖苷键与glcnac键合。在上述式1’及式1
”’
中的a1或/和a2为neu5ac的情况下,neu5ac例如优选通过α2-3糖苷键或α2-6糖苷键与gal键合。并且,在a1或a2为neu5ac-neu5ac的情况下,neu5ac例如优选通过α2-8糖苷键与neu5ac键合。式1’及式1
”’
中的x1、x2及x3以及a1及a2的具体例、组合与上述式1相同。作为本发明的生物标志物(4)、即包含存在于补体成分9中的式1所表示的糖链的生物标志物,可以举出(i)存在于补体成分9中的式1所表示的糖链其本身、(ii)式1所表示的糖链所键合的补体成分9、(iii)为补体成分9的一部分且式1所表示的糖链所键合的肽片段等,优选为(ii)或(iii)。另外,上述肽片段为至少具有作为式1所表示的糖链与补体成分9的键合部位的、补体成分9的氨基酸序列的从n末端计第415个氨基酸残基(天冬酰胺残基)的任意片段。具体而言,例如可以举出在活体内产生的物质或将补体成分9添加到胰蛋白酶、赖氨酰肽链内切酶、aspn等的蛋白酶处理中的结果所产生的物质,更具体而言,可以举出由2~50个氨基酸残基构成的物质等,优选为序列号6所表示的物质。作为本发明的生物标志物,优选为(i)包含存在于α1抗胰蛋白酶中的式1或式2所表示的至少1个糖链的生物标志物或(ii)包含存在于富含亮氨酸的α2糖蛋白中的式1所表示的糖链的生物标志物,更优选为(i)包含存在于α1抗胰蛋白酶中的式1或式2所表示的至少1个糖链的生物标志物,尤其优选为(iii)与α1抗胰蛋白酶的氨基酸序列的从n末端计第70个氨基酸残基(天冬酰胺残基)键合的式1或式2所表示的至少1个糖链。[本发明所涉及的大肠癌]本发明所涉及的大肠癌为从大肠产生的癌(恶性肿瘤)。关于本发明所涉及的大肠癌,例如包含结肠癌、直肠癌等。<本发明的辅助诊断大肠癌的方法>本发明的辅助诊断大肠癌的方法(以下,有时简称为本发明的辅助方法)通过如下
进行:测定来源于被检动物的试样中的选自下述(1)~(4)的糖链(以下,有时简称为本发明所涉及的测定工序),并根据所获得的测定结果来判定被检动物是否患有大肠癌(以下,有时简称为本发明所涉及的判定工序)。(1)存在于α1抗胰蛋白酶中的上述式1或式2所表示的至少1个糖链(本发明的生物标志物(1));(2)存在于富含亮氨酸的α2糖蛋白中的上述式1所表示的糖链(本发明的生物标志物(2));(3)存在于α1抗胰凝乳蛋白酶中的上述式1或式2所表示的至少1个糖链(本发明的生物标志物(3));及(4)存在于补体成分9中的上述式1所表示的糖链(本发明的生物标志物(4))另外,本发明的辅助方法可以单独使用本发明的生物标志物(1)~(4)中的任一个来进行,或者也可以使用多种。[本发明所涉及的被检动物]作为本发明所涉及的被检动物,可以举出人、猴、小鼠、大鼠、狗、猫、猪、兔、黑猩猩等哺乳动物,优选为人、猴、小鼠或大鼠,更优选为人。[本发明所涉及的试样]作为本发明所涉及的试样,只要为来源于上述被检动物的试样即可,例如可以举出血清、血浆、全血、尿、唾液、脑脊髓液、组织液、汗、泪、羊水、骨髓液、胸腔积液、腹水、滑液(synovial fluid)、眼房水、玻璃体液等来源于活体的试样,优选为血清、血浆、全血等来源于血液的试样,更优选为血清。从上述被检动物获得(采集)本发明所涉及的试样的方法并无特别限定,例如只要根据本身公知的方法从该被检动物获得(采集)该试样来进行即可,如果需要,则可以按照本身公知的方法进行分离、浓缩、纯化等。另外,上述试样可以为刚从上述被检动物获得的(采集的)的试样,也可以为保存了该试样的试样。作为保存试样的方法,只要为通常在该领域中进行的方法,则可以为任一个。[本发明所涉及的测定工序]关于本发明所涉及的测定工序,通过测定选自下述(1)~(4)的糖链来进行。(1)存在于α1抗胰蛋白酶中的上述式1或式2所表示的至少1个糖链;(2)存在于富含亮氨酸的α2糖蛋白中的上述式1所表示的糖链;(3)存在于α1抗胰凝乳蛋白酶中的上述式1或式2所表示的至少1个糖链;及(4)存在于补体成分9中的下述式1所表示的糖链另外,作为本发明所涉及的测定工序,可以通过单独测定本发明的生物标志物(1)~(4)中的任一个来进行,或者也可以通过测定多种来进行。本发明所涉及的测定工序中的选自上述(1)~(4)的糖链的测定为测定选自本发明的生物标志物(1)~(4)中的1个的测定,具体而言,例如可以举出(i)与本发明的生物标志物中的核心蛋白键合(来源于)的糖链其本身的量的测定、(ii)本发明的生物标志物中的糖链所键合的核心蛋白的量的测定、(iii)为本发明的生物标志物中的核心蛋白的一部分且糖链所键合的肽片段的量的测定等,优选为(ii)或(iii)。
上述本发明的生物标志物中的核心蛋白表示本发明的生物标志物中的除了糖链以外的部分,若为本发明的生物标志物(1),则表示α1抗胰蛋白酶,若为本发明的生物标志物(2),则表示富含亮氨酸的α2糖蛋白,若为本发明的生物标志物(3),则表示α1抗胰凝乳蛋白酶,若为本发明的生物标志物(4),则表示补体成分9。另外,上述“量”可以为容量、质量等绝对值或从浓度、离子强度、吸光度、荧光强度、浊度、峰面积等计算出的值等的相对值中的任一个。作为本发明所涉及的测定工序中的测定方法,只要为通常在该领域中进行的方法,则可以为任一个,具体而言,例如可以举出(a)使用对本发明的生物标志物具有亲和性的物质(例如,抗体、凝集素等)的方法、(b)利用质量分析法的方法等,优选为(a)。以下,分别对上述(a)及(b)进行具体说明。(a)使用对本发明的生物标志物具有亲和性的物质的方法作为上述对本发明的生物标志物具有亲和性的物质,可以举出与本发明的生物标志物中的核心蛋白(或肽片段)特异性键合的抗体或与本发明的生物标志物中的糖链特异性键合的凝集素或抗体等。作为对本发明的生物标志物具有亲和性的物质,在仅使用抗体的情况下,只要通过免疫学的测定方法来测定本发明的生物标志物即可,在使用除了抗体以外的物质(例如凝集素等)或除了抗体以外的物质及抗体的情况下,只要通过基于免疫学的测定方法的方法来测定本发明的生物标志物即可。作为这些测定方法的原理,例如可以举出夹心法或竞争法,并且可以为均质测定系统,也可以为异质测定系统。作为使用上述对本发明的生物标志物具有亲和性的物质的方法,具体而言,例如只要通过如下进行即可:使对本发明的生物标志物具有亲和性的物质与本发明的生物标志物接触而形成对本发明的生物标志物具有亲和性的物质与本发明的生物标志物的复合物,并测定本发明的生物标志物的量。作为使用对本发明的生物标志物具有亲和性的物质的方法,具体而言,例如可以举出酶联免疫吸附测定法(elisa法)、酶免疫测定法(eia法)、放射免疫测定法(ria法)、荧光免疫测定法(fia法)、化学发光酶免疫测定法(cleia法)、胶乳凝集比浊法等免疫比浊法、免疫散射比浊法(immunonephelometry)、免疫层析法(immunochromato)、蛋白质印迹法、luminescent oxygen channelingimmunoassay(发光氧通道免疫分析法)(loci法)、liquid-phase binding assay-electrokinetic analyte transport assay(配体结合分析-采用电驱动转运分析法)(lba-eata法)、凝集素电泳法等毛细管电泳法、表面等离子体激元共振法、凝集素柱法等,更优选为elisa法、eia法、ria法、fia法、cleia法、lba-eata法、凝集素电泳法等毛细管电泳法。作为上述与本发明的生物标志物中的核心蛋白(或肽片段)特异性键合的抗体,具体而言,例如若为本发明的生物标志物(1),则可以举出抗α1抗胰蛋白酶抗体,若为本发明的生物标志物(2),则可以举出抗富含亮氨酸的α2糖蛋白抗体,若为本发明的生物标志物(3),则可以举出抗α1抗胰凝乳蛋白酶抗体,若为本发明的生物标志物(4),则可以举出抗补体成分9抗体等。上述抗体可以为多克隆抗体、单克隆抗体中的任一个,这些可以单独使用也可以组合使用。
上述抗体也可以为fab、f(ab’2)、fv、sfv等的抗体片段或双链抗体、三链抗体、四链抗体等合成抗体等。并且,上述抗体可以使用市售的抗体,也可以使用按照本身公知的方法制备的抗体。另外,在按照本身公知的方法制备上述抗体的情况下,例如只要按照“免疫测定法”(生物化学测定研究会编辑、kodansha ltd.、2014年)等中所记载的方法进行即可。并且,上述抗体也可以为用标记物质标记的抗体。作为该标记物质,具体而言,例如可以举出辣根过氧化物酶(hrp)、牛小肠碱性磷酸酶、β-半乳糖酶等酶、
99m
tc、
131
i、
125
i、
14
c、3h、
32
p、
35
s等放射性同位素、荧光素(fluore scein)、异硫氰酸荧光素(fitc)、4-甲基伞形酮、若丹明或它们的衍生物等荧光性物质、萤光素(luciferin)、鲁米诺(luminol)、钌络合物等发光性物质、苯酚、萘酚、蒽或它们的衍生物等在紫外部具有吸收的物质、具有作为以4-氨基-2,2,6,6-四甲基哌啶-1-氧等具有氧基的化合物为代表的自旋标记试剂的性质的物质、hilyte系色素、alexa系色素、cydye系色素等色素、胶体金、量子点等纳米粒子等。另外,作为使上述标记物质与抗体键合的方法,只要按照本身公知的方法进行即可。作为上述与本发明的生物标志物中的糖链特异性键合的凝集素,具体而言,例如如下所述。即,若为本发明的生物标志物(1),则可以举出与上述式1所表示的糖链的fuc(岩藻糖)键合的aleuria aurantia lectin(橙黄网胞盘菌凝集素)(aal)或lotus tetragolonobus lectin(莲藕凝集素)(ltl)等、与neu5ac(n-乙酰神经氨酸)键合的elderberry balk lectin(接骨木凝集素)(ebl),maackia amurensis lectin(山楂凝集素)(maa)等、与上述式2所表示的糖链的fuc(岩藻糖)键合的aal或ltl等、与neu5ac(n-乙酰神经氨酸)键合的ebl、maa等。若为本发明的生物标志物(2),则可以举出与上述式1所表示的糖链的fuc(岩藻糖)键合的aal或ltl等、与neu5ac(n-乙酰神经氨酸)键合的ebl、maa等。若为本发明的生物标志物(3),则可以举出与上述式1所表示的糖链的fuc(岩藻糖)键合的aal或ltl等、与neu5ac(n-乙酰神经氨酸)键合的ebl、maa等。并且,若为本发明的生物标志物(4),则可以举出与上述式1所表示的糖链的fuc(岩藻糖)键合的aal或ltl等、与neu5ac(n-乙酰神经氨酸)键合的ebl、maa等。上述凝集素也可以为用标记物质标记的凝集素,作为该标记物质,如上述与本发明的生物标志物中的核心蛋白(或肽片段)特异性键合的抗体中所说明,具体例等也相同。并且,作为使上述标记物质与凝集素键合的方法,只要按照本身公知的方法进行即可。作为上述与本发明的生物标志物中的糖链特异性键合的抗体,具体而言,例如如下所述。即,若为本发明的生物标志物(1),则可以举出与上述式1所表示的糖链特异性键合的抗体、与上述式2所表示的糖链特异性键合的抗体等。若为本发明的生物标志物(2),则可以举出与上述式1所表示的糖链特异性键合的抗体等。若为本发明的生物标志物(3),则可以举出与上述式1所表示的糖链特异性键合的
抗体、与上述式2所表示的糖链特异性键合的抗体等。若为本发明的生物标志物(4),则可以举出与上述式1所表示的糖链特异性键合的抗体等。上述抗体也可以为用标记物质标记的抗体,作为该标记物质,如上述与本发明的生物标志物中的蛋白质(或肽片段)特异性键合的抗体中所说明,具体例等也相同。并且,作为使上述标记物质与凝集素键合的方法,只要按照本身公知的方法进行即可。作为测定上述对本发明的生物标志物具有亲和性的物质与本发明的生物标志物的复合物的量的方法,只要为能够测定该复合物的量的方法,则可以为任一个,具体而言,例如可以举出检测来源于与对本发明的生物标志物具有亲和性的物质键合的标记物质的信号的方法、利用来源于对本发明的生物标志物具有亲和性的物质与本发明的生物标志物的复合物的性质的方法等,优选为检测来源于与对本发明的生物标志物具有亲和性的物质键合的标记物质的信号的方法。作为上述检测来源于与对本发明的生物标志物具有亲和性的物质键合的标记物质的信号的方法,具体而言,例如只要通过如下进行即可:通过本身公知的方法来检测来源于与对本发明的生物标志物具有亲和性的物质键合的标记物质的信号。例如,在标记物质为酶的情况下,只要基于免疫测定法的常规方法、例如“酶免疫测定法”(蛋白质核酸酶分册no.31、北川常广
·
南原利夫
·
辻章夫
·
石川荣治编辑、51~63,共立出版、1987)等中所记载的方法进行测定即可,在标记物质为放射性物质的情况下,例如只要按照在ria中进行的常规方法,根据该放射性物质发出的放射线的种类及强度,适当选择使用液浸型gm计数器、液体闪烁计数器、井型闪烁计数器、hplc用计数器等测定机器来进行测定即可(例如参考医学化学实验课堂、第8卷、山村雄一主编、第1版、中山书店、1971等)。并且,在标记物质为荧光物质的情况下,例如只要基于在使用荧光计等测定机器的fia中进行的常规方法、例如“图说荧光抗体、川生明著、第1版、soft science公司、1983”等中所记载的方法进行测定即可,在标记物质为发光物质的情况下,只要基于使用光计数器等测定机器的常规方法、例如“酶免疫测定法”(蛋白质核酸酶分册no.31、北川常广
·
南原利夫
·
辻章夫
·
石川荣治编辑、252~263、共立出版、1987)等中所记载的方法进行测定即可。而且,在标记物质为在紫外部具有吸收的物质的情况下,只要通过使用分光光度计等测定机器的常规方法进行测定即可,在标记物质具有自旋的性质的情况下,只要基于使用电子自旋共振装置的常规方法、例如“酶免疫测定法”(蛋白质核酸酶分册no.31、北川常广
·
南原利夫
·
辻章夫
·
石川荣治编辑、264~271、共立出版、1987)等中所记载的方法分别进行测定即可。作为上述利用来源于对本发明的生物标志物具有亲和性的物质与本发明的生物标志物的复合物的性质的方法,具体而言,例如可以举出表面等离子体激元共振法等的均质免疫测定系统等的方法等。另外,关于上述方法的具体的手法,只要按照本身公知的手法进行即可。以下,对(a)使用对本发明的生物标志物具有亲和性的物质的方法进行更具体的说明。另外,在下述说明中,将本发明的生物标志物中的核心蛋白(或肽片段)表述为“目标核心蛋白(或目标肽片段)”,将本发明的生物标志物中的糖链表述为“目标糖链”。
例如,在测定本发明的生物标志物(1)的情况下,α1抗胰蛋白酶表示“目标核心蛋白(或目标肽片段)”,式1或式2所表示的至少1个糖链表示“目标糖链”。在测定本发明的生物标志物(2)的情况下,富含亮氨酸的α2糖蛋白表示“目标核心蛋白(或目标肽片段)”,式1所表示的糖链表示“目标糖链”。在测定本发明的生物标志物(3)的情况下,α1抗胰凝乳蛋白酶表示“目标核心蛋白(或目标肽片段)”,式1或式2所表示的至少1个糖链表示“目标糖链”。在测定本发明的生物标志物(4)的情况下,补体成分9表示“目标核心蛋白(或目标肽片段)”,式1所表示的糖链表示“目标糖链”。作为上述(a)使用对本发明的生物标志物具有亲和性的物质的方法,具体而言,例如可以举出包括下述工序1及工序2的方法。(工序1)从试样中分离目标糖链所键合的目标核心蛋白(本发明的生物标志物)的工序、(工序2)测定在所述工序1中分离的目标糖链所键合的目标核心蛋白的量的工序作为工序1,只要为能够从试样中分离目标糖链所键合的目标核心蛋白的方法,则可以为任一个,具体而言,例如可以举出分离存在于试样中的目标糖链所键合的目标核心蛋白与其他成分的方法。作为这种方法,具体而言,例如只要使用2种以上的具有亲和性的物质、即与目标糖链特异性键合的物质及与目标核心蛋白特异性键合的物质来形成目标糖链所键合的目标核心蛋白与具有亲和性的物质的复合物(与目标核心蛋白特异性键合的物质-与本发明的生物标志物的目标糖链特异性键合的物质),并通过本身公知的方法来分离目标糖链所键合的目标核心蛋白即可。并且,可以通过如下方法,从试样中分离目标糖链所键合的目标核心蛋白(本发明的生物标志物):例如利用与目标糖链特异性键合的物质(例如,上述与本发明的生物标志物中的糖链特异性键合的凝集素)和本发明的生物标志物的相互作用来分离与本发明的生物标志物等的目标糖链相互作用的成分和其他成分,进一步使用与目标核心蛋白特异性键合的物质来分离本发明的生物标志物和其他成分的方法、例如使用与目标核心蛋白特异性键合的物质来分离本发明的生物标志物和其他成分,进一步利用与目标糖链特异性键合的物质(例如,上述与本发明的生物标志物中的糖链特异性键合的凝集素)和本发明的生物标志物的相互作用来分离与本发明的生物标志物等的目标糖链相互作用的成分和其他成分的方法。关于该本发明的生物标志物的分离,例如能够通过凝集素电泳法或凝集素柱法来进行。另外,在使用用标记物质标记的具有亲和性的物质的情况下,目标糖链所键合的目标蛋白质的分离可以说是用标记物质标记的具有亲和性的物质与本发明的生物标志物的复合物的分离,此时,只要分离用标记物质标记的具有亲和性的物质与本发明的除了生物标志物以外的成分的复合物或/和用游离的标记物质标记的具有亲和性的物质即可。不需要进行与作为构成成分不包含用标记物质标记的具有亲和性的物质的成分的分离。并且,关于上述与糖链特异性键合的具有亲和性的物质及与核心蛋白特异性键合的具有亲和性的物质,如上所述,具体例等也相同。作为工序2,只要为能够测定在所述工序1中分离的目标糖链所键合的目标核心蛋白的方法,则可以为任一个,具体例等如上所述。
在上述方法中,可以在进行工序1之前,预先使试样中的所有蛋白质(包含目标蛋白质)肽片段化,在工序1中分离目标糖链所键合的目标肽片段,并在工序2中测定该目标糖链所键合的目标肽片段。作为该片段化处理,具体而言,例如只要通过在进行工序1之前,在试样中加入胰蛋白酶、赖氨酰肽链内切酶、aspn等蛋白酶来进行即可,只要在工序1中分别使用与目标糖链键合的物质及与目标肽片段键合的物质来形成目标糖链所键合的目标肽片段与具有亲和性的物质的复合物(与目标肽片段特异性键合的物质-与本发明的生物标志物的目标糖链特异性键合的物质),在如上所述分离该复合物之后,测定该复合物的量即可。并且,在进行了上述所有蛋白质的片段化的情况下,可以在继该片段化之后,进行基于凝集素柱等柱的浓缩。关于该浓缩,只要按照本身公知的方法进行即可,只要使用市售的凝集素柱等柱即可。而且,在上述方法中,可以代替工序2,从在工序1中分离的目标糖链所键合的目标蛋白质中分离目标糖链,并仅测定该目标糖链。具体而言,例如只要通过用聚糖酶、肼等对在工序1中分离的目标糖链所键合的目标蛋白质进行处理来分离目标糖链之后,如上所述仅测定该糖链的量即可。(b)利用质量分析法的方法作为利用质量分析法的方法,具体而言,例如可以举出利用液相色谱质谱仪(lc/ms)、毛细管电泳质谱仪(ce/ms)、气相色谱质谱仪(gc/ms)、液相色谱-串联质谱仪(lc/ms/ms)等的方法。作为上述方法,具体而言,例如只要通过如下进行即可:用具有液相色谱仪等色谱仪的分离部分离试样中的成分,并用质量分析部使被分离的各种成分离子化,进一步按每个质荷比(m/z)进行分离。另外,关于上述利用质量分析法的方法中的具体的手法,只要按照本身公知的手法或wo2014/038524、wo2017/19588、wo2018/034346等中所记载的手法进行即可。在上述利用质量分析法的方法中,可以预先从试样中提取所有蛋白质,作为其方法,具体而言,例如只要通过如下进行即可:在试样中加入丙酮、甲醇、乙醇、三氯乙酸、盐酸水溶液等的溶剂以使所有蛋白质沉淀。并且,根据需要,可以在从试样中提取所有蛋白质之前或从试样中提取所有蛋白质之后,使所有蛋白质片段化,在进行了片段化的情况下,也可以继该片段化之后,进行基于凝集素柱等柱的浓缩。关于该片段化及浓缩,如上所述。[优选的测定工序]在本发明所涉及的测定工序中,优选测定(i)存在于α1抗胰蛋白酶中的式1或式2所表示的至少1个糖链或(ii)存在于富含亮氨酸的α2糖蛋白中的式1所表示的糖链,更优选测定(i)存在于α1抗胰蛋白酶中的式1或式2所表示的至少1个糖链,进一步优选测定(iii)与α1抗胰蛋白酶的氨基酸序列的从n末端计第70个氨基酸残基(天冬酰胺残基)键合的式1或式2所表示的至少1个糖链。并且,在进行上述测定的情况下,优选为使用对本发明的生物标志物具有亲和性的物质的方法,更优选为elisa法、eia法、ria法、fia法、cleia法、胶乳凝集比浊法等免疫比浊法、免疫散射比浊法、免疫层析法、蛋白质印迹法、loci法、lba-eata法、凝集素电泳法等
毛细管电泳法、表面等离子体激元共振法、凝集素柱法,进一步优选为elisa法、eia法、ria法、fia法、cleia法、lba-eata法、凝集素电泳法等毛细管电泳法。更优选为使对本发明的生物标志物具有亲和性的物质与本发明的生物标志物接触来分离本发明的生物标志物,并形成对本发明的生物标志物具有亲和性的物质与本发明的生物标志物的复合物,并测定该复合物的量的方法,进一步优选为使对本发明的生物标志物具有亲和性的物质与本发明的生物标志物接触而形成对本发明的生物标志物具有亲和性的物质与本发明的生物标志物的复合物,并检测来源于与该复合物键合的标记物质的信号的方法。并且,更优选为如下方法:利用与目标糖链特异性键合的物质(例如,上述与本发明的生物标志物中的糖链特异性键合的凝集素)和本发明的生物标志物的相互作用来分离与本发明的生物标志物等的目标糖链相互作用的成分和其他成分,进一步使用与目标核心蛋白特异性键合的物质来分离本发明的生物标志物和其他成分,并测定本发明的生物标志物的量,进一步优选为如下方法:利用与目标糖链特异性键合的物质和本发明的生物标志物的相互作用来分离与本发明的生物标志物等的目标糖链相互作用的成分和其他成分,进一步使用与目标核心蛋白特异性键合的物质来分离本发明的生物标志物和其他成分,并检测来源于与复合物键合的标记物质的信号的方法,所述复合物为与目标核心蛋白特异性键合的物质与本发明的生物标志物的复合物。[本发明所涉及的判定工序]本发明所涉及的判定工序为根据通过本发明所涉及的测定工序而获得的测定结果来判定被检动物是否患有大肠癌的工序。关于本发明所涉及的判定工序,具体而言,例如利用使用来源于被检动物的试样并通过本发明所涉及的测定工序而获得的值(以下,有时简称为来源于被检动物的值)和预先设定的基准值(截止值等)来进行。即,(i)在来源于被检动物的值为预先设定的基准值(截止值等)以上的情况下,能够做出“被检动物有可能患有大肠癌或被检动物患有大肠癌的可能性高”等的判定,(ii)在来源于被检动物的值小于预先设定的基准值(截止值等)的情况下,能够做出“被检动物没有患有大肠癌的可能性或患有大肠癌的可能性低”等的判定。并且,作为另一方式,(i)在来源于被检动物的值为预先设定的基准值(截止值等)以下的情况下,能够做出“被检动物有可能患有大肠癌或被检动物患有大肠癌的可能性高”等的判定,(ii)在来源于被检动物的值超过预先设定的基准值(截止值等)的情况下,能够做出“被检动物没有患有大肠癌的可能性或患有大肠癌的可能性低”等的判定。另外,关于上述基准值(截止值等),能够利用使用来源于患有大肠癌的动物的试样并通过本发明所涉及的测定工序而获得的测定值和使用来源于健康动物的试样并通过本发明所涉及的测定工序而获得的值(以下,有时简称为来源于健康动物的值),并根据roc(receiver operating characteristic:感受者运作特性)曲线分析等统计分析来确定。并且,上述基准值(截止值等)的灵敏度或/和特异度例如为60%以上、优选为70%以上、更优选为80%以上、进一步优选为90%以上。作为另一方式,比较来源于被检动物的值与来源于健康动物的值,(i)在来源于被
检动物的值多于来源于健康动物的值的情况下,能够做出“被检动物有可能患有大肠癌或被检动物患有大肠癌的可能性高”等的判定,(ii)在来源于被检动物的值与来源于健康动物的值之间没有确认到显著的差异的情况下,能够做出“被检动物没有患有大肠癌的可能性或患有大肠癌的可能性低”等的判定。作为又一方式,在同一被检动物中,比较某一时刻的来源于被检动物的值与不同时刻的来源于被检动物的值,并评价该值的有无或/和增减的程度,从而能够进行大肠癌的发展程度、恶性程度的诊断、手术后的预后诊断等。即,(i)在确认到值的增加的情况下,能够做出病情发展到大肠癌(或者,大肠癌的恶性程度增加)或确认到病情向大肠癌发展的征兆(或者,确认到大肠癌的恶性程度增加的征兆)等的判定,(ii)在确认到值的减少的情况下,能够做出大肠癌的病情得到改善或确认到大肠癌的病情得到改善的征兆等的判定。另外,在本发明所涉及的测定工序中测定了多种本发明的生物标志物的情况下,只要使用所获得的多个值如上所述进行本发明所涉及的判定工序即可,能够进行准确度更高的判定。<本发明的用于辅助诊断大肠癌的试剂盒>本发明的用于进行大肠癌的诊断的试剂盒(以下,有时简称为本发明的盒)包含对选自下述(1)~(4)的糖链具有亲和性的物质。(1)存在于α1抗胰蛋白酶中的上述式1或式2所表示的至少1个糖链;(2)存在于富含亮氨酸的α2糖蛋白中的上述式1所表示的糖链;(3)存在于α1抗胰凝乳蛋白酶中的上述式1或式2所表示的至少1个糖链;及(4)存在于补体成分9中的上述式1所表示的糖链。本发明的盒包含对本发明的生物标志物具有亲和性的物质,换言之,本发明的盒包含对本发明的生物标志物(1)~(4)分别具有亲和性的物质。另外,关于本发明的盒中的本发明的生物标志物及大肠癌,如<本发明的生物标志物>及<本发明的辅助方法>中所说明,具体例、优选例等也相同。上述具有亲和性的物质为与本发明的生物标志物中的糖链或蛋白质(或肽片段)特异性键合的物质,可以举出凝集素、抗体等。关于上述具有亲和性的物质,如<本发明的辅助方法>中所说明,具体例、优选例等也相同。在本发明的盒中可以进一步包含通常在该领域中所使用的试剂类、例如为胰蛋白酶、赖氨酰肽链内切酶、aspn等肽片段化用试剂、凝集素柱等浓缩用柱、蛋白质提取用溶剂、缓冲剂、清洗剂、反应促进剂、糖类、蛋白质、盐类、表面活性剂等稳定化剂、防腐剂、用于稀释试样的溶液、凝集素固定化固相、抗体固定化固相、抗原固定化固相等固定化固相、用标记物质标记的第二抗体或该第二抗体的片段、标记物质检测用试剂等且共存的试剂等不阻碍稳定性的试剂。并且,其浓度、ph也只要在通常在该领域中所使用的范围内即可。作为上述凝集素固定化固相、抗体固定化固相、抗原固定化固相等固定化固相,只要为在磁性二氧化硅粒子等磁性粒子、聚苯乙烯、聚碳酸酯、聚乙烯基甲苯、聚丙烯、聚乙烯、聚氯乙烯、尼龙、聚甲基丙烯酸酯、明胶、琼脂糖、纤维素、聚对苯二甲酸乙二醇酯、玻璃、陶瓷等素材上使与本发明的生物标志物中的蛋白质(或肽片段)或糖链特异性键合的具有亲和性的物质(凝集素、抗体或该抗体的片段等)固相化而成的固相,则可以为任一个。
另外,关于上述凝集素固定化固相、抗体固定化固相、抗原固定化固相等固定化固相中的素材,可以使用通过本身公知的方法来制造的素材,也可以使用市售的素材。例如,在通过本身公知的方法来制造上述磁性二氧化硅粒子等磁性粒子的情况下,能够通过wo2012/173002中所记载的方法来制造。上述用标记物质标记的第二抗体或其抗体片段为与上述被固相化的具有亲和性的物质(凝集素、抗体或该抗体的片段等)分别键合的抗体或其抗体片段。另外,关于上述用标记物质标记的第二抗体或其抗体片段中的标记物质及使标记物质键合的方法,如<本发明的辅助方法>中所说明,优选例、具体例等也相同。在用标记物质标记凝集素、抗体或该抗体的片段等具有亲和性的物质的情况下,上述标记物质检测用试剂为检测用标记物质标记的凝集素、抗体或该抗体的片段等具有亲和性的物质中的标记或/和上述被标记的第二抗体或该第二抗体的片段中的标记的试剂,可以举出四甲基联苯胺、邻苯二胺等的吸光度测定用基质、羟苯基丙酸、羟苯基乙酸等的荧光基质、鲁米诺等的发光物质,并且可以举出4-硝基苯磷酸盐等的吸光度测定用试剂、4-甲基伞形酮磷酸酯等的荧光基质等。而且,在本发明的盒中可以包含用于进行本发明的辅助方法的说明书等。该“说明书”表示通过文章或/和图表实质上记载本发明的辅助方法的特征、原理、操作步骤、判定步骤等的本发明所涉及的试剂的处理说明书、附件、小册子(传单)等。具体而言,例如可以举出(i)记载有本发明所涉及的测定工序的原理、操作步骤等的说明书、(ii)记载有本发明所涉及的测定工序及判定工序的原理、操作步骤等的说明书等。如此,根据本发明的盒,能够简便、短时间且高精确度地进行本发明的辅助方法。<本发明所涉及的用于辅助诊断大肠癌的装置>本发明所涉及的用于辅助诊断大肠癌的装置(以下,有时简称为本发明所涉及的辅助装置)至少具备(1)测定部。而且,也可以具备(2)判定部、(3)输出部及(4)输入部。本发明所涉及的辅助装置中的(1)测定部构成为测定试样中的选自上述本发明的生物标志物(1)~(4)的糖链的量。具体而言,例如可以举出本发明所涉及的测定工序中所使用的各种质谱仪、基于免疫学的测定法的方法中所使用的装置等测定装置。另外,如果需要,则(1)测定部也可以构成为根据所测定的测定值来计算出上述本发明的生物标志物(1)~(4)的量。本发明所涉及的辅助装置中的(2)判定部构成为根据通过(1)测定部而获得的结果来判定被检动物是否患有大肠癌。本发明所涉及的辅助装置中的(3)输出部构成为输出通过(1)测定部而获得的结果或/和通过(2)判定部而获得的结果。本发明所涉及的辅助装置中的(4)输入部构成为接收操作者的操作,并向(1)测定部发送用于使该(1)测定部动作的信号。另外,关于通过上述本发明所涉及的辅助装置的(1)测定部及(2)判定部来进行的测定、判定等,如<本发明的辅助方法>中所说明,优选例、具体例等也相同。根据上述本发明所涉及的辅助装置,能够简便、短时间且高精确度地进行本发明的辅助方法。<本发明所涉及的治疗大肠癌的方法>
本发明所涉及的治疗大肠癌的方法(以下,有时简称为本发明所涉及的治疗方法)通过如下进行:测定来源于被检动物的试样中的选自本发明的生物标志物(1)~(4)的糖链的量,根据所获得的测定结果来判定被检动物是否患有大肠癌,并根据其判定结果对判定为有可能患有大肠癌或患有大肠癌的可能性高的患者实施适当的治疗。另外,关于本发明所涉及的治疗方法中的试样、标记、测定、判定等,如<本发明的辅助方法>中所说明,优选例、具体例等也相同。作为本发明所涉及的治疗方法中的适当的治疗,具体而言,例如可以举出内窥镜治疗、剖腹手术、腹腔镜手术等外科疗法、放化疗法等放射线治疗、通过给药草酸铂(通用名称)、伊立替康(通用名称)、氟尿嘧啶(通用名称)、贝伐珠单抗(通用名称)、雷莫芦单抗(通用名称)、阿柏西普(通用名称)、西妥昔单抗(通用名称)、帕尼单抗(通用名称)等药剂来进行的药物疗法等。以下,根据实施例对本发明进行更具体的说明,但是本发明并不受实施例的任何限定。实施例实施例1.大肠癌标记的分选[(1)被检体(样品)]将由横滨市立大学附属医院(yokohama city university medical center医院)及横滨市立大学先端医科学研究中心生物样本库(advanced medical research center,yokohama city university生物样本库)提供的来源于大肠癌患者的血清(18个被检体)及来源于健康者的血清(20个被检体)用作被检体(样品)。[(2)糖肽的制备]制备由包含12mm sodiumn deoxycholate(脱氧胆酸钠)(sdc)、12mm n-lauroylsarcosine(n-月桂酰肌氨酸)(ls)的100mm tris-hcl(三羟甲基氨基甲烷盐酸盐)(ph9.0)构成的消化缓冲液,并分别混合了该消化缓冲液90μl与上述(1)的来源于大肠癌患者的血清及来源于健康者的血清10μl。接着,分别添加巯基乙醇溶液以使最终浓度成为10mm,并在95℃下孵化5分钟,从而使蛋白质改性。接着,分别添加acrylamide(丙烯酰胺)(aa)溶液以使最终浓度成为20mm,并在25℃下,在暗处孵化30分钟,从而使半胱氨酸烷基化。接着,使用5μg的lys-c,在37℃下孵化1小时,从而使蛋白质消化。接着,用包含1.5mm cacl2的400μl的50mm tris-hcl(ph8.0)分别稀释之后,使用5μg的胰蛋白酶,在37℃下孵化12小时,从而使蛋白质进一步消化。接着,分别加入500μl的乙酸乙酯和10μl的甲酸之后,进行30秒钟的涡流,并以14000
×
g离心分离了5分钟。之后,去除包含sdc和lc的上层(乙酸乙酯层),并用离心蒸发器蒸发至约30μl,从而分别制备了糖肽。[(3)糖肽的浓缩]通过下述步骤,分别浓缩了在上述(2)中所制备的38个被检体量(大肠癌患者:18个被检体、健康者:20个被检体)的各糖肽。即,首先,在15ml离心管内,使用10ml的0.1%trifluoroacetic acid(三氟乙酸)(tfa)/90%acetonitrile(乙腈)(acn)清洗了纤维素微晶树脂300μl。接着,分别混合清洗后的300μl纤维素微晶树脂、10ml的0.1%tfa/90%acn及8μl的在(2)中所制备的各糖肽,并以1rpm孵化了6分钟。接着,用10ml的0.1%tfa/80%acn将吸附各糖肽的纤维素微晶树脂分
别清洗了4次。接着,用600μl的30%acn将各糖肽分别清洗2次,使各糖肽从上述纤维素微晶性树脂分别溶出,从而分别浓缩了糖肽。另外,浓缩后,为了去除微细的纤维素粒子,以14000
×
g进行离心分离,用离心蒸发器使其蒸发,并用50μl的0.1%甲酸/3%acn分别进行了再溶解。[(4)脱糖链肽的制备]为了鉴定糖链修饰部位,将在上述(3)中所制备的浓缩糖肽试样25μl分别附加到pngase f处理中。即,通过在上述试样中分别添加20μl的1m tris-hcl(ph8.0)来进行中和,并与1单元的pngase f分别进行了混合。接着,在37℃下孵化1小时之后,分别加载到用5μl的acn和0.1%甲酸预先清洗的脱盐柱中。用5μl的0.1%甲酸分别清洗2次之后,用5μl的50%acn分别进行溶出,从而分别制备了脱糖链肽。另外,制备后,用20μl的0.1%甲酸分别进行稀释,并在-30℃下保存直至使用为止。[(5)基于纳升级液相色谱质谱(nanolc/ms/ms)的解析]用orbitrap质谱仪q-exactive(thermo fisher scientific制),分别解析(分离/分析)了在上述(3)中所制备的各浓缩糖肽。具体而言,在与q-exactive连接的nanolc、easy-nlc1000(thermo fisher scientific制)中用200bar将各糖肽1.6μl分别注入到纳米孔捕获柱中,并用20μl的0.1%甲酸分别进行了清洗。接着,用0.1%甲酸(溶剂a)及0.1%甲酸/acn的二元线性梯度以流量300nl/分钟分别进行溶出,从而测定了糖肽的量(0-150分钟:0%溶剂b-35%溶剂b、150-155分钟:100%溶剂b)。另外,关于纳米孔捕获柱和分析柱,在各分析之前,分别用12μl及5μl的0.1%fa进行了初始化。关于全ms,从m/z350至m/z2000为止以分辨率(resolution)70000进行监测,关于产物离子扫描,通过数据依赖性采集(data dependent acquisition)来获取。关于上述测定中的离子化参数及q-exactive的数据依赖性采集参数,分别如下所述。<离子化参数>电喷雾电压(spray voltage):1800v毛细管温度(capillary temperature):250℃s-lens rf水平(level):50(没有单位)另外,没有使用辅助气体及鞘气。并且,关于来源于健康者和大肠癌患者的血清样品的测定顺序,为了避免混杂因素的影响而随机化。<q-exactive的数据依赖性采集参数>分辨率:17500自动增益控制目标(agc target):1000000最大注射时间(maximum injection time):350毫秒碎裂窗口(isolation width):3.0m/z阶梯归一化碰撞能量(stepped normalized collision energy):25及35并且,在与上述相同的条件下分别解析(分离/分析)了在(4)中所制备的各脱糖链肽1.6μl。之后,使用proteome discoverer 1.4(thermo fisher scientific制)分别鉴定了脱糖链肽中的糖链键合部位。而且,以上述鉴定信息为基础,分别确认了糖肽的结构。[(6)结果]
通过上述(1)~(5),如下述表7所示,鉴定了分别来源于α1抗胰蛋白酶、富含亮氨酸的α2糖蛋白、α1抗胰凝乳蛋白酶及补体成分9的糖肽a~m。并且,关于上述糖肽a~m的峰面积值,将大肠癌患者(18个被检体)的平均值及健康者(20个被检体)的平均值分别示于表8及图1~图4中。[表7][表8]
根据上述表7及表8以及图1,可知来源于α1抗胰蛋白酶的(i)具有式1”所表示的糖链的糖肽a(大肠癌患者平均峰面积值:1939358186.22222、健康者平均峰面积值:306335029.7)、(ii)具有式1
”’
所表示的糖链的糖肽b(大肠癌患者平均峰面积值:1099675503.77778、健康者平均峰面积值:245395191.4)、(iii)具有式2”所表示的糖链的糖肽c(大肠癌患者平均峰面积值:132975907.444444、健康者平均峰面积值;14027932.45)及(iv)具有式2
”’
所表示的糖链的糖肽d(大肠癌患者平均峰面积值:138263873.055556、健康者平均峰面积值:25985005.75)的表达量与健康者相比,在大肠癌患者中显著增加。并且,确认到上述糖肽a中的式1”所表示的糖链、糖肽b中的式1
”’
所表示的糖链、糖肽c中的式2”所表示的糖链及糖肽d中的式2
”’
所表示的糖链与α1抗胰蛋白酶的氨基酸序列的从n末端计第70个天冬酰胺残基键合。根据上述表7及表8以及图2,可知来源于富含亮氨酸的α2糖蛋白的(i)具有式1”所表示的糖链的糖肽e(大肠癌患者平均峰面积值:36204545.5555556、健康者平均峰面积值:2037297.6)、(ii)具有式1
””
所表示的糖链的糖肽f(大肠癌患者平均峰面积值:
53995609.7777778、健康者平均峰面积值:3415333.55)、(iii)具有式1
””
所表示的糖链的糖肽g(大肠癌患者平均峰面积值:53995609.7777778、健康者平均峰面积值:3415333.55)及(iv)具有式1
”’
所表示的糖链的糖肽h(大肠癌患者平均峰面积值:387390364.555556、健康者平均峰面积值:92357205.6)的表达量与健康者相比,在大肠癌患者中显著增加。并且,确认到上述糖肽e中的式1”所表示的糖链及糖肽f中的式1
””
所表示的糖链与富含亮氨酸的α2糖蛋白的氨基酸序列的从n末端计第79个天冬酰胺残基键合。确认到上述糖肽g中的式1
””
所表示的糖链与富含亮氨酸的α2糖蛋白的氨基酸序列的从n末端计第186个天冬酰胺残基键合。确认到上述糖肽h中的式1
”’
所表示的糖链与富含亮氨酸的α2糖蛋白的氨基酸序列的从n末端计第269个天冬酰胺残基键合。根据上述表7及表8以及图3,可知来源于α1抗胰凝乳蛋白酶的(i)具有式2”所表示的糖链的糖肽i(大肠癌患者平均峰面积值:162903669.944444、健康者平均峰面积值:8899040.75)、(ii)具有式2
”’
所表示的糖链的糖肽j(大肠癌患者平均峰面积值:206514550.444444、健康者平均峰面积值:18952737.35)、(iii)具有式1”所表示的糖链的糖肽k(大肠癌患者平均峰面积值:13321110.3333333、健康者平均峰面积值:913077)及(iv)具有式1
”’
所表示的糖链的糖肽l(大肠癌患者平均峰面积值:14098497.3333333、健康者平均峰面积值:2290770.7)的表达量与健康者相比,在大肠癌患者中显著增加。并且,确认到上述糖肽i中的式2”所表示的糖链、糖肽j中的式2
”’
所表示的糖链、糖肽k中的式1”所表示的糖链及糖肽l中的式1
”’
所表示的糖链与α1抗胰凝乳蛋白酶的氨基酸序列的从n末端计第93个天冬酰胺残基键合。根据上述表7及表8以及图1,可知来源于补体成分9的(i)具有式1
”’
所表示的糖链的糖肽m(大肠癌患者平均峰面积值:733351267.666667、健康者平均峰面积值:202557121.85)的表达量与健康者相比,在大肠癌患者中显著增加。而且,关于上述糖肽a~m的表达量,通过roc(receiver operating characteristic)曲线分析计算出auc值(area under the curve:曲线面积值)。将其结果示于下述表9中。另外,关于auc值,被设为越接近1,有越高的判定能力。[表9]
根据上述表9,上述糖肽a~m均显示出良好的auc值。根据以上,可知通过将上述糖肽a~m用作大肠癌的生物标志物,能够判定被测试者是否患有大肠癌。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。