1.本发明涉及纳米悬臂梁制作技术领域,特别涉及一种形变可恢复的纳米悬臂梁制作方法。
背景技术:
2.纳米悬臂梁是一种一端为固定支座,另一端为自由端的新型纳米结构,当纳米悬臂梁表层吸附分子或原子,以及在光照、热应力或机械应力的作用下,其悬臂梁结构将发生弯曲形变或谐振频率的变化,可用于高灵敏的生物、化学、力学、光学等信息检测。基于纳米悬臂梁的新型传感器件,在单细胞力学测量、痕量气体监测识别、单分子表征、光学与机械超材料等技术领域具有巨大的应用需求。将纳米悬臂梁技术与材料科学、化学、电子学、生物学、医学、计算机科学等交叉,各种不同应用场景的特殊需求对纳米悬臂梁的材料性质、加工精度、功能效应等提出了许多新的挑战。
3.20世纪90年代以来,硅微加工技术以及mems(微机电系统)技术的发展使得微悬臂梁的制造得以实现。当前微悬臂梁的材质主要为硅、氮化硅、金属等,在生物医学应用中,这些材料的生物相容性欠佳,容易造成炎症或者免疫反应,往往限制了其实际使用。当前常用的加工工艺包含光刻、刻蚀、薄膜工艺等,整个制备流程周期较长,涉及到的各个环节对加工工艺要求较高,顺序加工不易获得高成品率和确保不同批次间器件性能的一致性,一直是制约微悬臂梁制造的痛点问题。当前微悬臂梁的特征尺寸在微米级别,虽然通过深刻蚀、湿法刻蚀等可以获得诸如硅纳米等纳米结构,但复杂的加工工艺和专业的设备要求困难重重。受当前加工技术精度的限制,无法满足单原子或单分子高灵敏检测时对纳米尺寸悬臂梁敏感结构的加工需求。
4.因此,亟需提供一种形变可恢复的纳米悬臂梁制作方法,能够解决当前缺少有效加工蛋白质纳米悬臂梁的制备方法。
技术实现要素:
5.为解决上述技术问题,本发明公开了一种形变可恢复的纳米悬臂梁制作方法,包括以下步骤:
6.提供基底;
7.在所述基底上设置光刻材料形成与悬臂梁尺寸对应的薄膜,所述悬臂梁包括相互连接的悬臂梁体和支撑立柱;
8.基于预先输入的悬臂梁结构图使用电子束依次对所述薄膜中设定的悬臂梁体区域和支撑立柱区域进行电子束三维直写曝光得到待显影悬臂梁结构;
9.对所述待显影悬臂梁结构显影定影得到与所述悬臂梁结构图对应的悬臂梁结构,所述悬臂梁结构中的悬臂梁体受电子辐照形变可恢复。
10.进一步地、所述基于预先输入的悬臂梁结构图使用电子束依次对所述薄膜中设定的悬臂梁体区域和支撑立柱区域进行电子束三维直写曝光得到待显影悬臂梁结构,包括:
11.依照所述悬臂梁结构图的加工线宽、结构力学性质、结构高度要求设置不同曝光层的曝光剂量;
12.通过控制加速电压,结合工作距离,动态调节电子束的曝光焦点,实现在所述薄膜内部进行电子束三维直写曝光得到所述待显影悬臂梁结构。
13.进一步地、所述在所述基底上设置光刻材料形成与悬臂梁尺寸对应的薄膜,包括:
14.在所述基底上设置光刻材料,前烘焙,形成单层薄膜;
15.重复执行:在所述单层薄膜上设置光刻材料,前烘焙,直至形成所述与悬臂梁尺寸对应的薄膜。
16.进一步地、每层单层薄膜的厚度为0.1nm-1000μm。
17.进一步地、所述基于预先输入的悬臂梁结构图使用电子束依次对所述薄膜中设定的悬臂梁体区域和支撑立柱区域进行电子束三维直写曝光得到待显影悬臂梁结构,之后还包括:
18.对所述待显影悬臂梁结构后烘焙得到烘焙后待显影三维纳米结构;
19.所述对所述待显影悬臂梁结构显影定影得到与所述悬臂梁结构图对应的悬臂梁结构,包括:
20.对所述烘焙后待显影三维纳米结构显影定影得到与所述悬臂梁结构图对应的悬臂梁结构。
21.进一步地、所述对所述烘焙后待显影三维纳米结构显影定影得到与所述悬臂梁结构图对应的悬臂梁结构,包括:
22.将包括所述烘焙后待显影三维纳米结构的基底置于显影液中,在温度-100至300℃,保持1s-1000h,取出后在温度-100至300℃,保持1s-1000h,获得与所述悬臂梁结构图对应的悬臂梁结构结构。
23.进一步地、所述光刻材料包括:现有聚合物光刻材料、新型蛋白生物光刻材料、以及负载有金纳米粒子、石墨烯、碳纳米管、量子点、药物分子、荧光分子、染料分子、生物酶、血液、dna中一种或多种的复合功能化光刻材料,所述光刻材料的浓度:0.001-100g/ml。
24.进一步地、所述基底包括:硅基、金属、陶瓷、氧化物半导体、导电玻璃、导电高分子、塑料中一种或多种。
25.进一步地、所述在所述基底上设置光刻材料形成多层薄膜,包括:
26.使用滴涂法、旋涂法、提拉成膜法、刮涂法、喷涂法、夹缝挤压式涂布法中的一种或多种在所述基底上设置光刻材料形成所述多层薄膜。
27.进一步地、所述薄膜由至少一种所述光刻材料形成。
28.采用上述技术方案,本技术所述的形变可恢复的纳米悬臂梁制作方法具有如下有益效果:
29.为了解决当前缺少有效加工蛋白质纳米悬臂梁的制备方法,本发明提出一种特征尺寸优于50nm的蛋白质纳米悬臂梁加工技术。该蛋白质纳米悬臂梁通过电子束直写制备而成,不会引入杂质离子的污染问题;通过改变加速电压和工作距离,动态调控电子束在蛋白质薄膜中的曝光焦点和作用路径,实现纳米精度三维直写;通过改变曝光剂量、次数和速率,来定义支撑立柱和悬臂梁的交联程度(结晶化程度)和机械性能;通过改变不同加速电压和曝光剂量,来改变电子束入射悬臂梁的深度,实现蛋白质悬臂梁结晶化程度的由均匀
分布
→
非均匀分布
→
均匀分布的演变,从而导致悬臂梁应力失衡后的平衡和再平衡过程,在能量最小化驱动下实现悬臂梁弯曲-恢复行为。该蛋白质纳米悬臂梁的形变可恢复特性与电子辐照能量具有良好的对应关系,可作为一种高灵敏的电子辐照传感器件。
附图说明
30.为了更清楚地说明本发明实施例中的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
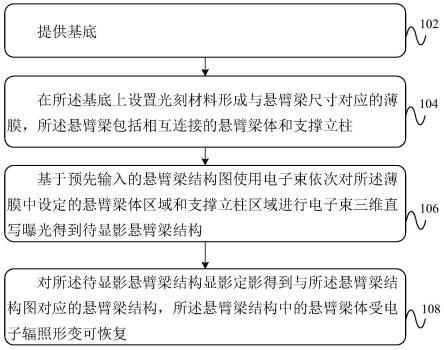
31.图1为本技术实施例一种可选的形变可恢复的纳米悬臂梁制作方法的流程图;
32.图2为本技术实施例一种不同加速电压对应在光刻材料中发生胶聚反应的对照示意图;
33.图3为本说明书实施例提供的一种蛋白质分子结构与光刻性能之间的关系示意图;
34.图4为本实施例提供的一种电子束曝光剂量对基因重组蜘蛛丝蛋白结晶化程度的示意图;
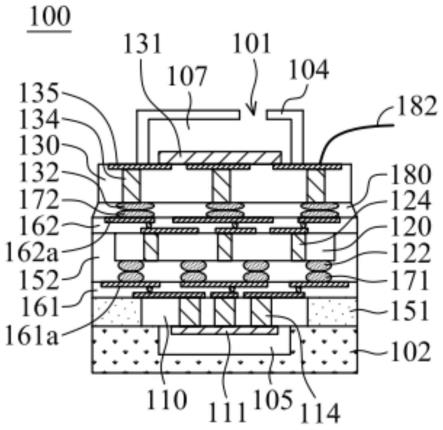
35.图5为本实施例提供的一种纳米悬臂梁制作示意图;
36.图6为本实施例提供的一种纳米悬臂梁形变恢复示意图;
37.图7为本实施例提供的又一种纳米悬臂梁形变恢复示意图;
具体实施方式
38.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述。显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动的前提下所获得的所有其他实施例,都属于本发明保护的范围。
39.此处所称的“一个实施例”或“实施例”是指可包含于本发明至少一个实现方式中的特定特征、结构或特性。在本发明的描述中,需要理解的是,术语“上”、“下”、“顶”、“底”等指示的方位或位置关系为基于附图所示的方位或位置关系,仅是为了便于描述本发明和简化描述,而不是指示或暗示所指的装置或元件必须具有特定的方位、以特定的方位构造和操作,因此不能理解为对本发明的限制。此外,术语“第一”、“第二”仅用于描述目的,而不能理解为指示或暗示相对重要性或者隐含指明所指示的技术特征的数量。由此,限定有“第一”、“第二”的特征可以明示或者隐含的包括一个或者更多个该特征。而且,术语“第一”、“第二”等是用于区别类似的对象,而不必用于描述特定的顺序或先后次序。应该理解这样使用的数据在适当情况下可以互换,以便这里描述的本发明的实施例能够以除了在这里图示或描述的那些以外的顺序实施。
40.电子束光刻常用于光刻胶二维微纳图案的直写,通过蒸镀、沉积、刻蚀、lift-off(剥离)等加工工艺,来实现悬臂梁结构的制备。所使用的技术流程复杂,加工过程容错率比较低,在保证各个加工环节成功的前提下,才能获得最终所需的纳米结构,无法通过单一电子束光刻实现悬臂梁结构的直写加工。
41.传统电子束光刻中因为背散射效应的影响,需要基底具有良好的导电性,首先要在衬底上布置一层数纳米厚的金属层(金属化),否则曝光图案会发生畸变,甚至远离曝光区域上千微米乃至厘米,从而无法保证在具有不同导电性质的硅基、陶瓷、金属、塑料、氧化物等各种基底上进行纳米结构精细加工。
42.当前电子束光刻过程中,采用的曝光焦点是一定的,即电子束在光刻材料中的穿透深度和作用位置是一定的,无法在三维空间内定义电子束的作用路径,局限于二维平面结构加工。采用现有的常规电子束光刻方法无法实现悬浮、镂空、大深宽比等复杂三微纳米结构在平面、乃至曲面上的直写加工。
43.并且,目前通过改造双光子曝光系统,调节双光子效应作用的区域范围,实现纳米尺度的加工,一方面需要花费大量的金钱和时间;另一方面需要开发配套的光刻材料,对材料的光敏感性、分子结构、光引发剂的使用有极高的要求。所加工的三维结构是在极端条件下得到的简单的纳米线条,无法作为通用、普适的技术推广使用。
44.蛋白质是组成生物体一切细胞、组织的重要成分。生物体所有重要的组成部分都需要蛋白质的参与,蛋白质与生命现象密切相关。一般认为,蛋白质约占人体全部质量的16%-20%。蚕丝蛋白、蜘蛛丝蛋白、鹿角蛋白、胶原蛋白、节肢弹性蛋白等因其优异的生物相容性、机械性能、可控降解性等在生物医学领域被广泛使用。开发基于蛋白质的纳米悬臂梁技术,在单细胞多模态表征、单分子或单原子识别、光敏与热敏测量、肿瘤治疗新机制探索等高精度、高灵敏传感领域具有明确的科学和应用价值。
45.为解决上述技术问题,本发明提供一种形变可恢复的纳米悬臂梁制作方法,请参见图1,图1为本技术实施例一种可选的形变可恢复的纳米悬臂梁制作方法的流程图,该图1中包括:
46.s102、提供基底;
47.在具体的实施过程中,为了增加纳米悬臂梁支撑结构与基底的粘附性,以达到稳固的效果,在薄膜涂覆前可对基底进行表面化处理,来改善基底的亲疏水性,例如对于亲水性蛋白光刻材料,可以用氧等离子体清洗基底表面;对于疏水性蛋白光刻胶材料,可以用硅烷化试剂处理基底表面。当需要得到可自由活动的三维纳米悬臂梁时(纳米悬臂梁支撑立柱在曝光过程中与基底无接触),无需进行基底表面处理操作。
48.s104、在所述基底上设置光刻材料形成与悬臂梁尺寸对应的薄膜,所述悬臂梁包括相互连接的悬臂梁体和支撑立柱。
49.在具体的实施过程中,与悬臂梁结构尺寸对应的薄膜可以根据悬臂梁结构图形的长度、宽度和高度设定。如,悬臂梁结构图形的的高度过高时,薄膜可采用多层薄膜叠加的方式形成。
50.悬臂梁体与支撑立柱的一端连接,交联程度可以根据需要进行设置,悬臂梁体用于抓取待测量物体,支撑立柱用于支持悬臂梁体。悬臂梁体与支撑立柱的具体结构在本说明书实施例中,不做具体限定。悬臂梁体可以是轻薄的长方体结构,悬臂梁体的一端与中心位置的预设位置处可以与圆柱形的支撑立柱的一端连接。
51.s106、基于预先输入的悬臂梁结构图使用电子束依次对所述薄膜中设定的悬臂梁体区域和支撑立柱区域进行电子束三维直写曝光得到待显影悬臂梁结构;
52.s108、对所述待显影悬臂梁结构显影定影得到与所述悬臂梁结构图对应的悬臂梁
结构,所述悬臂梁结构中的悬臂梁体受电子辐照形变可恢复。
53.在具体的实施过程中,由于制作出的悬臂梁结构是结晶态,在低能电子辐照悬臂梁体的上平面的情况下,通过控制电子在悬臂梁总的作用深度,诱导非均匀性的蛋白质晶体结构转变成无定型态(即解交联),从而产生应力和形变,悬臂梁体的下平面仍为结晶态,因此,悬臂梁体能够向上弯曲。在高能电子辐照悬臂梁体的上平面的情况下,被照射的悬臂梁体的上平面在无定型态转恢复到结晶态(即再次交联),重新达到应力平衡,因此,悬臂梁体能够形变可恢复。
54.在上述实施例基础上,本说明书一个实施例中,所述所述基于预先输入的悬臂梁结构图使用电子束依次对所述薄膜中设定的悬臂梁体区域和支撑立柱区域进行电子束三维直写曝光得到待显影悬臂梁结构,包括:
55.依照所述悬臂梁结构图的加工线宽、结构力学性质、结构高度要求设置不同曝光层的曝光剂量;
56.通过控制加速电压,结合工作距离,动态调节电子束的曝光焦点,实现在所述薄膜内部进行电子束三维直写曝光得到所述待显影悬臂梁结构。
57.具体的,将纳米悬臂梁的纳米数字图形文件导入到电子束曝光系统中,依照加工线宽(0.001nm-10μm)、结构力学性质(支撑立柱:坚实稳固、悬臂梁:薄且挺)或交联程度(结晶化程度:无定型态、部分结晶态、结晶态、降解态等)、结构厚度或高度(0.1nm-1000μm)等要求定义不同曝光层的曝光剂量:0.001-1000000μc/cm2。
58.图2为本技术实施例一种不同加速电压对应在光刻材料中发生胶聚反应的对照示意图,如图2所示,通过改变不同加速电压(0.001kv-1000kv)和曝光剂量(0.001-1000000μc/cm2),来改变电子束入射悬臂梁的深度(0.1nm-1000μm),实现蛋白质悬臂梁结晶化程度的由均匀分布
→
非均匀分布
→
均匀分布的演变,从而导致悬臂梁应力失衡后的平衡和再平衡过程,在能量最小化驱动下实现悬臂梁弯曲-恢复行为。其中,电子停留概率以归一化。
59.曝光次数和速率根据结构线宽、复杂程度(单层、多层、堆叠、嵌套、悬空、上大下小等)的不同来确定,多次曝光之间无需增加复杂的对准操作。
60.本发明提出的形变可恢复的纳米悬臂梁制作方法,通过调控电子束曝光的加速电压,可改变电子束曝光焦点在光刻材料薄膜内的位置(1-10000nm),从而实现真悬臂梁结构加工。通过蒙特卡洛模拟,结合真实实验结果,获得了电子束曝光焦点位置随电子束加速电压改变的对应关系。其典型历程包括:从薄膜上表面入射以后,高能电子快速穿透一定深度的光刻材料(以弹性碰撞为主,电子能量无明显损耗),不会引起材料的交联反应,称之为透明层;当深入到光刻材料内部以后,发生密集的电子停留(以非弹性碰撞为主,电子能量大量损耗),即电子与光刻材料进行有效的交联反应,形成材料聚合(光刻效应),称之为交联层。如图2所示。
61.在上述实施例基础上,本说明书一个实施例中,所述在所述基底上设置光刻材料形成与悬臂梁尺寸对应的薄膜,包括:
62.在所述基底上设置光刻材料,前烘焙,形成单层薄膜;
63.重复执行:在所述单层薄膜上设置光刻材料,前烘焙,直至形成所述与悬臂梁尺寸对应的薄膜。
64.具体的,为了排除薄膜中残余溶剂的干扰,保留生物活性物质的活性,将涂覆有光
刻材料的基底置于热板、真空烘箱、冰箱或真空冷冻干燥箱等装置,在温度-100至300℃,压力1-200kpa,保持1s-1000h。
65.在上述实施例基础上,本说明书一个实施例中,在上述实施例基础上,本说明书一个实施例中,每个单层薄膜的厚度为0.1nm-1000μm。
66.在上述实施例基础上,本说明书一个实施例中,所述基于预先输入的悬臂梁结构图使用电子束依次对所述薄膜中设定的悬臂梁体区域和支撑立柱区域进行电子束三维直写曝光得到待显影悬臂梁结构,之后还包括:
67.对所述待显影悬臂梁结构后烘焙得到烘焙后待显影三维纳米结构;
68.所述对所述待显影悬臂梁结构显影定影得到与所述悬臂梁结构图对应的悬臂梁结构,包括:
69.对所述烘焙后待显影三维纳米结构显影定影得到与所述悬臂梁结构图对应的悬臂梁结构。
70.具体的,为了保证悬臂梁结构的稳定性,保留生物活性物质的活性,将曝光后的涂覆有光刻材料的基底置于热板、真空烘箱、冰箱或真空冷冻干燥箱等装置,在温度-100至300℃,压力1-200kpa,保持1s-1000h。
71.在上述实施例基础上,本说明书一个实施例中,所述对所述烘焙后待显影三维纳米结构显影定影得到与所述悬臂梁结构图对应的悬臂梁结构,包括:
72.将包括所述烘焙后待显影三维纳米结构的基底置于显影液中,在温度-100至300℃,保持1s-1000h,取出后在温度-100至300℃,保持1s-1000h,获得与所述悬臂梁结构图对应的悬臂梁结构结构。
73.具体的,将曝光后的涂覆有光刻材料的基底置于纯水、甲醇、异丙醇、丙酮、甲苯或苯甲醚等显影液中,在温度-100至300℃,保持1s-1000h。取出后在温度-100至300℃,保持1s-1000h,获得所需悬臂梁结构。
74.在上述实施例基础上,本说明书一个实施例中,所述光刻材料包括:现有聚合物光刻材料、新型蛋白生物光刻材料、以及负载有金纳米粒子、石墨烯、碳纳米管、量子点、药物分子、荧光分子、染料分子、生物酶、血液、dna中一种或多种的复合功能化光刻材料,所述光刻材料的浓度:0.001-100g/ml。
75.具体的,现有聚合物光刻材料可以包括:pmma(聚甲基丙烯酸甲酯)、ebr-9(聚alfa-氯代丙烯酸三氟乙酯)、pbs(聚丁砜)、zep(alfa-氯代丙烯酸甲酯和alfa-甲基苯乙烯的交替共聚物)、hsq-聚氢倍半硅氧烷);新型蛋白生物光刻材料可以包括:纯的天然蚕丝蛋白、鹿角蛋白、胶原蛋白、基因重组蜘蛛丝蛋白、节肢弹性蛋白等;以及上述负载了金纳米粒子、石墨烯、碳纳米管、量子点、药物分子、荧光分子、染料分子、生物酶、血液、dna等的复合功能化光刻材料。其中,光刻材料的浓度:0.001-100g/ml。
76.在上述实施例基础上,本说明书一个实施例中,所述基底包括:硅基、金属、陶瓷、氧化物半导体、导电玻璃、导电高分子、塑料中一种或多种。
77.具体的,硅基可以包括:硅、氮化硅、氧化硅、石英、玻璃等;金属材质可以包括:金、银、铜、铝、铂、铁、锡、不锈钢等;陶瓷可以包括:氧化铝、氧化锆、氧化钛、碳化硼等;氧化物半导体可以包括:氧化锌、氧化锡、氧化铁、氧化铬、氧化铝等;导电玻璃可以包括:氧化铟锡等;导电高分子可以包括:聚乙炔、聚吡咯、聚噻吩、聚亚苯基、聚苯乙炔、聚苯胺、聚乙烯、聚
丙烯、聚苯乙烯、环氧树脂、酚醛树脂等;塑料可以包括:聚乙烯、聚丙烯、高密度聚乙烯、低密度聚乙烯、线性低密度聚乙烯、聚氯乙烯、通用级聚苯乙烯、聚苯乙烯泡沫、耐冲击性聚苯乙烯、苯乙烯-丙烯腈共聚物、丙烯腈-丁二烯-苯乙烯共聚合物、聚甲基丙烯酸酯、亚克力、有机玻璃、乙烯-醋酸乙烯酯共聚合物、聚对苯二甲酸乙二醇酯、聚对苯二甲酸丁酯、聚酰胺尼龙、聚碳酸树酯、聚甲醛树酯、聚苯醚、聚亚苯基硫醚、聚苯硫醚、聚氨基甲酸乙酯、聚氨酯、聚苯乙烯、聚四氟乙烯等。
78.在上述实施例基础上,本说明书一个实施例中,所述在所述基底上设置光刻材料形成与悬臂梁结构尺寸对应的薄膜,包括:
79.使用滴涂法、旋涂法、提拉成膜法、刮涂法、喷涂法、夹缝挤压式涂布法中的一种或多种在所述基底上设置光刻材料形成所述薄膜。
80.具体的,滴涂法drop-casting:把溶液滴到基片上,溶剂挥发,然后成膜;
81.旋涂法spin-coating:分两种,先滴溶液后旋涂和先旋涂后滴溶液,旋转后溶剂挥发成膜;
82.提拉成膜法dip-coating:把基底dip到溶液中,通过提拉成膜;
83.刮涂法blade-coating:即doctor-blade方法;
84.喷涂法spray-coating;
85.夹缝挤压式涂布法slot-die-coating:类似于roll-to-roll卷对卷的方法。
86.在上述实施例基础上,本说明书一个实施例中,所述薄膜由至少一种所述光刻材料形成。
87.上述同一蛋白质纳米悬臂梁可以是同一材质,也可以是不同材质,从而增加了纳米结构的功能性。重复上述操作,即可以实现异质异构蛋白质纳米悬臂梁的可控制备。
88.本发明提供的一种形变可恢复的纳米悬臂梁的制备方法,适用于纯的天然蚕丝蛋白、鹿角蛋白、胶原蛋白、基因重组蜘蛛丝蛋白、节肢弹性蛋白等,以及负载了金纳米粒子、石墨烯、碳纳米管、量子点、药物分子、荧光分子、染料分子、生物酶、血液、dna等的复合功能化蛋白光刻材料。能够实现在优于50nm的分辨率下利用电子束方便、快速直写蛋白质悬臂梁结构。所选用的基底包含硅基、陶瓷、金属、塑料、氧化物半导体、导电高分子等多种材质。
89.为了更好的解释发明,下述为本发明具体的实施例:
90.实例一:形变可恢复基因重组蜘蛛丝蛋白纳米悬臂梁,图3为本说明书实施例提供的一种蛋白质分子结构与光刻性能之间的关系示意图,图4为本实施例提供的一种电子束曝光剂量对基因重组蜘蛛丝蛋白结晶化程度的示意图(近场红外图谱),图5为本实施例提供的一种纳米悬臂梁制作示意图,如图3-5所示:
91.(1)薄膜制备:将基因重组蜘蛛丝蛋白光刻材料涂覆在基底上。
92.为了增加纳米悬臂梁支撑结构与基底的粘附性,达到稳固的效果,在薄膜涂覆前用氧等离子体清洗硅基底表面900s,以保证基因重组蜘蛛丝蛋白纳米悬臂梁立柱与基底紧密粘附。
93.选用基因重组蜘蛛丝蛋白,尤其增加了蛋白分子结构中负责机械强度的(ga)n、an氨基酸序列(a:甘氨酸、g:丙氨酸)的比重,以增强三维纳米悬臂梁的力学性能和稳定性。基因重组蜘蛛丝蛋白光刻材料的浓度:0.01-1g/ml。在硅基底上以1000-8000转/分钟,旋涂90s,以获取厚度为1000nm的基因重组蜘蛛丝蛋白薄膜。
94.(2)前烘焙:为了排除薄膜中残余溶剂的干扰,将涂覆有基因重组蜘蛛丝蛋白光刻材料的基底置于真空烘箱中,在温度60
–
150℃,压力1-100kpa,保持300s-3h。
95.(3)电子束直写:
96.将纳米悬臂梁的纳米数字图形文件导入到电子束曝光系统中,选用电子束曝光剂量为500-30000μc/cm2,加速电压为0.1-5kv,工作距离为1-5mm,实现纳米悬臂梁的梁体厚度为20-80nm,宽度为50-300nm,长度为100-5000nm,交联程度为完全结晶态;选用电子束曝光剂量为2000-200000μc/cm2,加速电压为3-50kv,工作距离为2-20mm,实现纳米悬臂梁的支撑立柱高度为50-50000nm,直径为50-1000nm,交联程度为完全结晶态。
97.通过改变不同加速电压(0.001kv-1000kv)和曝光剂量(0.001-1000000μc/cm2),来改变电子束入射悬臂梁的深度(0.1nm-1000μm),实现蛋白质悬臂梁结晶化程度的由均匀分布
→
非均匀分布
→
均匀分布的演变,从而导致悬臂梁应力失衡后的平衡和再平衡过程,在能量最小化驱动下实现悬臂梁弯曲-恢复行为。
98.(4)后烘焙:为了保证基因重组蜘蛛丝蛋白纳米悬臂梁结构的稳定性,将曝光后的涂覆有基因重组蜘蛛丝蛋白光刻材料的基底置于真空烘箱中,在温度20
–
120℃,压力1-100kpa,保持30-1200s。
99.(5)显影:将曝光后的涂覆有基因重组蜘蛛丝蛋白光刻材料的基底置于纯水中显影,在温度10
–
100℃,保持10-900s。取出后在温度20
–
120℃,保持300s-12h,获得所需基因重组蜘蛛丝蛋白纳米悬臂梁。
100.上述同一蛋白质纳米悬臂梁可以是同一材质,也可以是不同材质,从而增加了纳米结构的功能性。重复(1)-(5)的相关操作,即可以实现异质异构蛋白质纳米悬臂梁的可控制备。
101.(6)对电子辐照敏感的基因重组蜘蛛丝蛋白纳米悬臂梁形变可恢复操作:
102.选用低能电子辐照加速电压为0.1-3kv,剂量为100-10000μc/cm2,照射在基因重组蜘蛛丝蛋白纳米悬臂梁的自由端,即可实现纳米悬臂梁向上弯曲0-60
°
;选用高能电子辐照加速电压为2-30kv,剂量为500-100000μc/cm2,继续照射在基因重组蜘蛛丝蛋白纳米悬臂梁的自由端,即可实现纳米悬臂梁由向上弯曲状态向下恢复到初始状态。
103.图6为本实施例提供的一种纳米悬臂梁形变恢复示意图,图7为本实施例提供的又一种纳米悬臂梁形变恢复示意图,如图6-7所示,基因重组蜘蛛丝蛋白纳米悬臂梁的形变可恢复历程为:通过电子束直写得到的基因重组蜘蛛丝蛋白纳米悬臂梁整体为结晶态;(1)当选用低能电子辐照照射基因重组蜘蛛丝蛋白纳米悬臂梁的自由端时,由于电子只能穿透到悬臂梁部分梁体中,引起了该区域的结晶态转变为无定型态,而其余区域仍然为结晶态,此时由于两个区域的力学稳态被打破,产生沿着梁体向固定端的拉力,导致纳米悬臂梁向上弯曲;(2)当选用高能电子辐照照射已经向上弯曲的纳米悬臂梁的自由端时,由于此时电子可以完整进入到整个梁体中,使得梁体由部分无定型态、部分结晶态转变为均匀结晶态,形成新的力学平衡,导致纳米悬臂梁重新恢复到初始状态。
104.需要说明的是,能够在分子层面精准编辑蛋白质的组成氨基酸序列,根据实际应用需要,可以主动调控负责力学强度或抗刻蚀性等氨基酸的比例,灵活定制蛋白质分子链的长短,最终表达制备出的蛋白质分子结构高度可控,通过凝胶电泳(sds-page)分析可知,基因重组蜘蛛丝蛋白的分子量均一分布,呈现出单一条带。一般而言,光刻胶的性能与其分
子结构密切相关。分子量分布越窄、分子结构越均一,所形成的光刻图案精度越高;分子量越小,越容易制备出高分辨率的纳米图形,但蚕丝蛋白的力学性能较弱,不利于制作大深宽比图形。基因重组蜘蛛丝蛋白与蚕丝蛋白用于光刻时,其分子结构特征与光刻性能之间的关系如图3所示。
105.上述说明已经充分揭露了本发明的具体实施方式。需要指出的是,熟悉该领域的技术人员对本发明的具体实施方式所做的任何改动均不脱离本发明的权利要求书的范围。相应地,本发明的权利要求的范围也并不仅仅局限于前述具体实施方式。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。