hnf-1
α
基因修饰的间充质干细胞在防治肝癌中的用途
技术领域
1.本发明属生物技术领域;更具体地,本发明涉及hnf-1α基因修饰的间充质干细胞在防治肝癌等肝病中的用途,尤其是提供一种预防肝癌早期术后复发转移的干细胞治疗方案。
背景技术:
2.癌症仍然是一种人类难以攻克的疾病。随着医药学的进步,虽然已经利用手术、化学疗法和放射来治愈(cure)癌症取得了一些成功,但是仍需要新的策略。
3.原发性肝癌(primary hepatocellular carcinoma,phc)是全球第5位常见的恶性肿瘤和第3位癌症死因,全球每年新增肝癌病例的数量大约是55万人,近年来其发病率有上升的趋势。而中国是肝癌发病的“重灾区”,每年因肝癌死亡人数约20万。目前早期肝癌的最佳治疗手段为根治性手术切除。但肝癌患者术后极易出现复发和转移,术后三年的复发率约为40%-50%,术后五年的复发率则在60%-70%。
4.一旦发生肝癌的复发,临床上采用多种后续手段。包括:再次手术切除,手术可以处理复发肿瘤,但复发的肝癌病灶通常不止一个,肝癌会在多部位、多肝段复发;再次手术很难大面积切除肝脏,也很难切除干净;第二种方案是微创治疗,例如肝动脉化疗栓塞术,在肝动脉栓塞的基础上,利用碘油将化疗药物灌注到肿瘤处,特异性杀死肿瘤细胞;化学消融,通常是在b超或ct的引导下,向肿瘤里注射无水酒精,使细胞迅速脱水、蛋白质变性凝固,从而杀死肿瘤细胞,但这种方法目前应用比较少了;物理消融,包括射频消融和微波消融,也是在b超或ct引导下,通过穿刺针的产热作用,将肿瘤细胞杀死;以及比较常用但疗效不一而同的放化疗等。
5.上述传统的治疗方案,尽管可能一定程度地提高了患者的生存率和生活质量,但都不可避免的会对病人造成二次创伤和损害;因此,本领域还需要开发新的治疗手段或辅助治疗手段,以期能够在手术后直接抑制肝癌的复发。
技术实现要素:
6.本发明的目的在于提供hnf-1α基因修饰的间充质干细胞在防治肝癌等肝病中的用途。
7.在本发明的第一方面,提供一种重组间充质干细胞或其培养物在制备组合物中的用途,所述组合物用于:抑制肝癌,抑制肝纤维化,修复肝损伤和/或抑制炎症,所述的抑制包括预防或治疗;其中,所述重组间充质干细胞是表达外源的肝细胞核因子1α(hnf-1α)的间充质干细胞。
8.在一个优选例中,所述的表达为高表达或过表达。
9.在另一优选例中,将包含有肝细胞核因子1α的表达盒的表达构建体引入到所述间充质干细胞中。
10.在另一优选例中,所述表达构建体(表达载体)包括:病毒载体,非病毒载体。
11.在另一优选例中,所述的表达载体包括选自:腺病毒载体,慢病毒载体或腺相关病毒载体。
12.在另一优选例中,所述的表达载体为腺病毒载体。
13.在另一优选例中,所述间充质干细胞包括(但不限于)选自下组来源的间充质干细胞:骨髓、脐带、脂肪、脐血、胎盘、牙髓、子宫内膜。
14.在另一优选例中,所述肝癌包括:原发性肝癌,肝癌术后复发的肝癌,具有炎症环境的肝癌。
15.在另一优选例中,所述组合物还用于:减少肝星状细胞活化。
16.在另一优选例中,所述组合物还用于:减少肝脏组织中炎症细胞的浸润。
17.在另一优选例中,所述组合物还用于:降低血清中促炎因子的水平。
18.在另一优选例中,所述促炎因子包括tnf-α、ifn-γ、il-4或il-6。
19.在另一优选例中,所述组合物还用于:降低血清中的肝功能指标,所述指标包括:谷丙转氨酶(alt)、谷草转氨酶(ast)、总胆红素(tbil)以及结合胆红素(dbil)含量。
20.在本发明的另一方面,提供一种重组间充质干细胞或细胞培养物,所述细胞中包含外源的肝细胞核因子1α。
21.在一个优选例中,将包含有肝细胞核因子1α的表达盒的表达构建体引入到所述间充质干细胞中,获得所述重组间充质干细胞;较佳地,所述表达构建体(表达载体)包括:病毒载体,非病毒载体;更佳地,所述的表达载体包括选自:腺病毒载体,慢病毒载体或腺相关病毒载体;更佳地,所述的表达载体为腺病毒载体。
22.在本发明的另一方面,提供一种制备重组间充质干细胞的方法,包括在间充质干细胞中表达外源的肝细胞核因子1α;所述重组间充质干细胞为抑制肝癌,抑制肝纤维化,修复肝损伤和/或抑制炎症的细胞,所述的抑制包括预防或治疗。
23.在本发明的另一方面,提供一种用于抑制肝癌、抑制肝纤维化、修复肝损伤和/或抑制炎症的组合物,其中包含前面所述的重组间充质干细胞或细胞培养物,以及药学上可接受的载体,所述的抑制包括预防或治疗。
24.在本发明的另一方面,提供肝细胞核因子1α的用途,用于制备重组间充质干细胞,所述重组间充质干细胞具有抑制肝癌、抑制肝纤维化、修复肝损伤和/或抑制炎症的作用,所述的抑制包括预防或治疗。
25.在本发明的另一方面,提供一种用于抑制肝癌、抑制肝纤维化、修复肝损伤和/或抑制炎症的药盒,所述的抑制包括预防或治疗,所述药盒中包含所述的重组间充质干细胞或细胞培养物,或包含所述的组合物。
26.本发明的其它方面由于本文的公开内容,对本领域的技术人员而言是显而易见的。
附图说明
27.图1为大鼠骨髓原代间充质干细胞的分离鉴定以及成功制备hnf-1α过表达间充质干细胞的检测结果;
28.a:原代大鼠mscs分离培养及成脂成骨分化鉴定;
29.b-c:hnf-1α过表达腺病毒在mscs中的转染效率及转染效果鉴定。
30.图2为hnf-1α基因修饰mscs对den诱导的大鼠原发性肝癌发生发展的作用研究;
31.a:den诱癌大鼠经过不同mscs干预后的生存曲线;
32.b:大鼠肝脏的肿瘤形成情况和he染色结果;
33.c:不同处理组大鼠肝脏肿瘤的数目。
34.图3为hnf-1α基因修饰的间充质干细胞对den诱导的肝损伤修复的作用;
35.a:肝癌发生以前的组织异变期不同处理组大鼠血清转氨酶及胆红素检测;
36.b:肝癌发生以前的组织异变期不同处理组大鼠肝脏天狼星红及α-sma表达检测。
37.图4为hnf-1α基因修饰的间充质干细胞对肝癌发生过程中肝脏炎症反应的影响;
38.a:肝癌发生以前的组织异变期不同处理组大鼠肝脏切片he染色结果;
39.b:肝癌发生以前的组织异变期不同处理组大鼠血清中炎症因子的检测。
40.图5为在den诱癌的早期阶段输注hnf-1a基因修饰的人脐带来源mscs对于抑制den诱导的肝癌发生发展的作用;
41.a:大鼠肝脏的肿瘤形成情况和he染色结果;
42.b:不同处理组大鼠肝脏的最大肿瘤体积。
具体实施方式
43.本发明人经过深入的研究,揭示了一种经肝细胞核因子1α(hepatocyte nuclear factor,hnf-1α)修饰的间充质干细胞(mesenchymal stem cells,mscs),所述经修饰的细胞具有抑制肝癌,抑制肝纤维化,修复肝损伤和/或抑制炎症的作用,所述的抑制包括预防或治疗。本发明为肝癌等疾病的防治提供了新的临床治疗途径,有望用于防治肝癌病人的术后复发,具有良好的开发前景。
44.术语
45.如本文所用,所述的“外源”或“异源”是指来自不同来源的两条或多条核酸或蛋白质(多肽)序列之间的关系,或者来自不同来源的核酸或蛋白质与宿主细胞之间的关系。例如,如果核酸/蛋白质与宿主细胞的组合通常不是天然存在的,则核酸对于该宿主细胞来说是外源的。特定序列对于其所插入的细胞或生物体来说是“外源的”。
46.如本文所用,所述的“表达盒”是指包含有表达目的基因所需的所有必要元件的基因表达系统,通常其包括以下元件:启动子、目的基因序列,终止子;此外还可选择性包括信号肽编码序列等。这些元件是操作性相连的。
47.如本文所用,所述的“表达构建物”或“表达构建体”是指重组dna分子,它包含预期的核酸编码序列,其可以包含一个或多个基因表达盒。所述的“构建物”通常被包含在表达载体中。
48.如本文所用,所述的“可操作地连接(相连)”或“操作性连接(相连)”是指两个或多个核酸区域或核酸序列的功能性的空间排列。例如:启动子区被置于相对于目的基因核酸序列的特定位置,使得核酸序列的转录受到该启动子区域的引导,从而,启动子区域被“可操作地连接”到该核酸序列上。
49.如本文所用,术语“含有”表示各种成分可一起应用于本发明的混合物或组合物中。因此,术语“主要由...组成”和“由...组成”包含在术语“含有”中。如本文所用,术语“有效量”或“有效剂量”是指可对人和/或动物产生功能或活性的且可被人和/或动物所接受的
量。
50.如本文所用,“药学上可接受的”的成分是适用于人和/或哺乳动物而无过度不良副反应(如毒性、刺激和变态反应)的,即具有合理的效益/风险比的物质。术语“药学上可接受的载体”指用于治疗剂给药的载体,包括各种赋形剂和稀释剂。
51.间充质干细胞
52.炎症是导致肿瘤发生或促进肿瘤发展的最主要因素之一,约20%的恶性肿瘤由炎症诱发或促进。中国乙肝病毒携带者将近一个亿,而多数的肝癌患者正是由肝炎发展而来。根据“种子与土壤”理论,复发转移靶器官的局部微环境是影响复发转移是否发生的决定性因素之一。
53.本发明人的分析证实,在肝癌早期进行手术切除后,如果造成肝脏损伤的诱因不去除,肝脏仍处于慢性炎症损伤状态,肝癌则极易发生复发转移。如能削弱有利于转移形成的靶器官炎症状态,当可降低转移的发生。而肝癌术后的转移复发多发生于术后残余肝脏,故肝脏的炎症免疫微环境状态是影响肝癌术后病人的预后的关键因素。肝癌术后复发是由于术后残余肝脏选择性地扩增播散的瘤细胞,形成复发灶,或者是选择性地扩增新变异的细胞,形成新的肝癌病灶。肝癌术后残余肝脏的炎症状态和它的再生能力成负相关,炎症反应越重,其再生能力越差,就越容易形成肿瘤复发病灶。因此,本发明人认为,针对肝脏炎症的治疗有助于抑制肿瘤复发转移。
54.mscs是一群源于中胚层的具有高度自我更新能力和多分化潜能的成体干细胞。其相对容易获得,体外扩增培养技术成熟,目前在临床上有一定的研究,例如用于治疗gvhd、自身免疫性疾病以及炎症相关肝肾损伤等疾病。
55.与传统的化学药物不同,mscs是一种与环境相互作用的活细胞。在某些条件下,mscs可能作为促炎细胞,并交叉呈现可溶性外源抗原作为其抗原呈递细胞特性的一部分。干扰素-γ刺激骨髓mscs上调mhc-ii分子的表达,并将外源性抗原呈递给t细胞。急性肝功能衰竭的猪实验发现,严重的炎症环境限制了mscs的效果,因为mscs在严重炎症的肝脏环境中存活率低。mscs未能提高伴有全身性炎症的慢加急性肝功能衰竭患者的存活率,但是减轻炎症明显有利于提高mscs的治疗效果。在一项mscs治疗儿童激素难治性gvhd的多中心临床研究中,mscs在疾病早期介入治疗比晚期治疗更有效。这些研究数据提示炎症微环境特征对于mscs的治疗效果有重要的影响。更为重要的是有研究发现当机体存在地塞米松激素时,mscs的免疫抑制特性会受到严重抑制;在上述这种情况下mscs治疗的效果也大打折扣。体内环境复杂,mscs的功能在不同的环境下呈现不同的效果。正因于此,尽管mscs在临床上的应用越来越受到重视,然而目前临床试验的绝大多数结果都不能满足医疗需求。
56.本发明人针对mscs的体内实验发现,在癌症发生早期输注mscs可减轻肝组织的炎症反应,在一定程度上具有抑制肿瘤发生发展的作用,但效果仍不十分显著。
57.为了改善间充质细胞对于肿瘤的抑制作用,本发明人进行了大量的分析研究,分析了多种多样的基因,最终确定了以hnf-1α修饰mscs。mscs具有向损伤部位趋化的特性,同时在损伤炎症微环境的刺激下,mscs可发挥免疫抑制功能,抑制机体过激的炎症反应,而hnf-1α修饰mscs后,其可非常显著地提高mscs对于肿瘤的抑制作用。
58.本发明中,所述的mscs包括但不限于来源于骨髓、脂肪、脐带、脐血、胎盘、牙髓、子宫内膜等的mscs。在本发明的优选的实施例中,所述的mscs为骨髓来源的mscs。
59.肝细胞核因子1α
60.肝细胞核因子1α(hepatocyte nuclear factor,hnf-1α)是hnfs家族的成员之一,为调控许多肝功能基因表达的转录因子,对促进肝脏发育和维护肝细胞生物学功能发挥重要作用,包括调控肝脏功能相关基因表达以及参与糖脂代谢和胆汁酸代谢。最近研究表明hnf-1α在人肝癌组织中呈现低表达,但其表达下调的原因仍不明确。在hnfs家族成员中还有一类成员,就是hnf-4α。虽然hnf-1α与hnf-4α属于同一大家族,但在结构和功能上确有很大不同:hnf-4α是一种锌指结构蛋白,同时具有脂溶性激素受体的特性;有报道证实hnf-4α与病毒性肝炎的发生、发展密切相关;也有研究发现hnf-4α表达上调是胃肿瘤的一个重要信号事件,且拮抗hnf-4α具有抗肿瘤效应(hnf4αis a therapeutic target that links ampk to wnt signalling in early-stage gastric cancer.gut,2014)。
61.本发明所述hnf-1α可以是天然存在的,比如其可被分离或纯化自哺乳动物。此外,所述的hnf-1α也可以是人工制备的,比如可以根据常规的基因工程重组技术来生产重组hnf-1α,以应用于实验或临床。在应用时,可采用重组的hnf-1α。所述的hnf-1α包括全长的hnf-1α或其生物活性片段。
62.在优选的方式中,所述的hnf-1α的氨基酸序列可以与nm_012669(大鼠)以及nm_001530(人)所示的序列基本上相同。根据hnf-1α的氨基酸序列可以方便地得出其相应的核苷酸编码序列。
63.经过一个或多个氨基酸残基的取代、缺失或添加而形成的hnf-1α的氨基酸序列也包括在本发明中。hnf-1α或其生物活性片段包括一部分保守氨基酸的替代序列,所述经氨基酸替换的序列并不影响其活性或保留了其部分的活性。适当替换氨基酸是本领域公知的技术,所述技术可以很容易地被实施并且确保不改变所得分子的生物活性。这些技术使本领域人员认识到,一般来说,在一种多肽的非必要区域改变单个氨基酸基本上不会改变生物活性。见watson等,molecular biology of the gene,第四版,1987,the benjamin/cummings pub.co.p224。
64.hnf-1α的生物活性片段也可以应用到本发明中。在这里,hnf-1α的生物活性片段的含义是指作为一种多肽,其仍然能保持全长的hnf-1α的全部或部分功能。通常情况下,所述的生物活性片段至少保持50%的全长hnf-1α的活性。在更优选的条件下,所述活性片段能够保持全长hnf-1α的60%、70%、80%、90%、95%、99%、或100%的活性。
65.本发明也可采用经修饰或改良的hnf-1α,比如,可采用为了促进其半衰期、有效性、代谢、和/或蛋白的效力而加以修饰或改良的hnf-1α。所述经过修饰或改良的hnf-1α可以是一种hnf-1α的共轭物,或其可包含被取代的或人工的氨基酸。所述经过修饰或改良的hnf-1α可以是与天然存在的hnf-1α具有较小的共同点,但也具有抑制(包括预防或治疗)肝癌,抑制肝纤维化,修复肝损伤和/或抑制炎症的作用。也就是说,一些不影响hnf-1α的生物活性的变化形式都可用于本发明中。
66.hnf-1α修饰间充质干细胞及其用途
67.基于本发明人的新发现,本发明提供了一种mscs,其是hnf-1α修饰的mscs,或是过表达hnf-1α的mscs。优选的是hnf-1α过表达的mscs。
68.本发明中,可将编码过表达hnf-1α的多核苷酸序列插入到重组表达载体中,转化mscs。只要能在mscs内复制和稳定,多种质粒和载体都可以用于本发明。表达载体的一个重
要特征是通常含有复制起点、启动子、标记基因和翻译控制元件。例如,所述的表达载体可以包括:病毒载体,非病毒载体。
69.本领域的技术人员熟知的方法能用于构建含hnf-1α的多核苷酸序列和合适的转录/翻译控制信号的表达载体。这些方法包括体外重组dna技术、dna合成技术、体内重组技术等。所述的dna序列可有效连接到表达载体中的适当启动子上,以指导mrna合成。转化载体还包括翻译起始用的核糖体结合位点和转录终止子。
70.在一些优选的方式中,所述的表达载体包括(但不限于):腺相关病毒,慢病毒载体,腺病毒载体等。在更为优选的方式中,所述的hnf-1α基因修饰的mscs是通过hnf-1α过表达腺病毒转染mscs获得的。例如,实施例中,所述的过表达腺病毒载体名称为padeno-mcmv-目的基因-ha-p2a-egfp。本发明采用腺病毒载体进行目的基因的过表达,腺病毒转染mscs后在mscs中高表达hnf-1α基因,具有很高的感染率。相对于其它病毒载体,腺病毒转导效率较高,可以高效感染分裂期和非分裂期的干细胞,且其不整合入染色体,安全性较高。
71.基于本发明的新发现,还提供了一种hnf-1α基因修饰的mscs的用途,用于抑制肝癌,抑制肝纤维化,修复肝损伤和/或抑制炎症,或用于制备抑制肝癌,抑制肝纤维化,修复肝损伤和/或抑制炎症的药物组合物;所述的抑制包括预防和治疗。所述肝癌包括:原发性肝癌,肝癌术后复发的肝癌,具有炎症环境的肝癌等;尤其优选地,所述肝癌包括早期肝癌术后复发的肝癌。不同于种植瘤,den诱癌模型可模拟原发性肝癌,而早期肝癌术后复发的肝癌从发病机制上较为接近原发性肝癌,因此本发明中运用了适当的动物模型模拟了早期肝癌术后复发的肝癌,并论证了本发明的hnf-1α修饰间充质干细胞的技术效果。
72.基于本发明的新发现,还提供了hnf-1α的用途,用于制备重组间充质干细胞,所述重组间充质干细胞具有抑制肝癌、抑制肝纤维化、修复肝损伤和/或抑制炎症的作用。
73.组合物
74.本发明还提供了一种组合物,它含有有效量(如10
4-109个细胞/ml;较佳的10
5-108个细胞/ml;更佳的,10
6-107个细胞/ml)的所述的hnf-1α修饰的mscs,以及药学上可接受的载体。
75.通常,可将所述细胞配制于无毒的、惰性的和药学上可接受的水性载体介质中,其中ph通常约为5-8,较佳地,ph约为6-8。
76.药学上可接受的载体可包括(但并不限于):盐水、缓冲液、葡萄糖、水、甘油、乙醇、及其组合。通常药物制剂应与给药方式相匹配,本发明的药物组合物可以被制成针剂形式,例如用生理盐水或含有葡萄糖和其他辅剂的水溶液通过常规方法进行制备。所述的药物组合物宜在无菌条件下制造。活性成分的给药量是治疗有效量。本发明的药物制剂还可制成缓释制剂。
77.本发明所述的hnf-1α修饰的mscs的有效量可随给药的模式和待治疗的疾病的严重程度等而变化。优选的有效量的选择可以由本领域普通技术人员根据各种因素来确定(例如通过临床试验)。所述的因素包括但不限于:所述的hnf-1α修饰的mscs的药代动力学参数例如生物利用率、代谢、半衰期等;患者所要治疗的疾病的严重程度、患者的体重、患者的免疫状况、给药的途径等。通常,根据治疗状况的要求,可每天给予若干次分开的剂量,或将剂量按比例地减少。
78.作为本发明的一种优选方式,本发明的具体实施例中,给出了一些针对动物如鼠
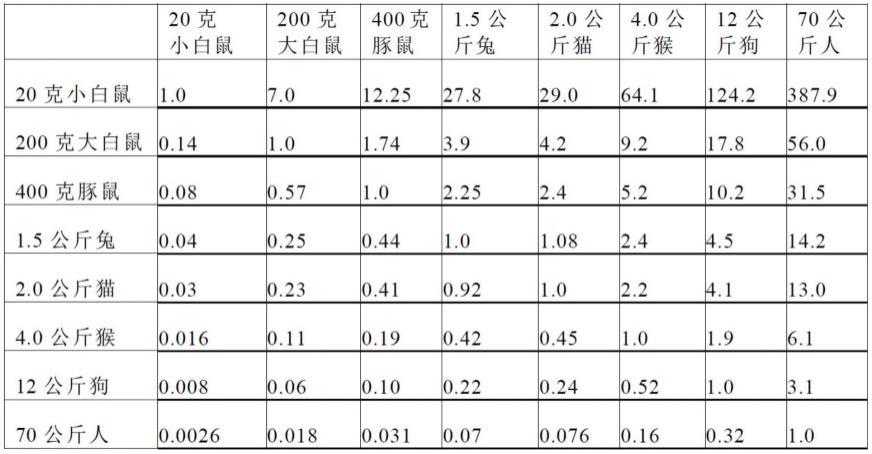
的给药方案。从动物(如鼠)的给药剂量换算为适用于人类的给药剂量是本领域技术人员易于作出的。本领域中,已经存在一些常用于剂量换算的实验动物及人的体表面积比例关系的示例,例如以下表1中所列举的。
79.表1
[0080][0081]
作为表1的查表方法的一种示例,例如:狗剂量为10毫克/公斤,12公斤的狗总剂量为12
×
10毫克=120毫克;查上表70公斤人与12公斤狗相交处为3.1,所以人(70公斤)的剂量=120毫克
×
3.1=372毫克。应理解,其它物种与人之间的换算方式可以依此类推。
[0082]
本发明还提供了用于抑制肝癌、抑制肝纤维化、修复肝损伤和/或抑制炎症的药盒/试剂盒,含有:容器,以及置于容器中的重组间充质干细胞或细胞培养物。
[0083]
此外,所述的药盒/试剂盒中还可以含有一些辅助用药的材料,例如注射用针管等。
[0084]
此外,所述的药盒/试剂盒中还可含有使用说明书,说明基于本发明的化合物组合抑制肝癌、抑制肝纤维化、修复肝损伤和/或抑制炎症的方法。
[0085]
本发明的有益效果在于:
[0086]
根据动物实验已经发现,在den诱癌的异变期以前输注本发明中涉及的基因修饰mscs可通过显著减轻肝脏组织的炎症反应从而达到抑制肝癌发生发展的作用,对于预防早期肝癌术后复发具有一定疗效。因此,hnf-1α基因修饰的mscs用于预防早期肝癌术后复发的用途,具有良好的开发前景。
[0087]
本发明的实施例中,利用过表达腺病毒转染使得mscs高表达hnf-1α基因,对mscs进行修饰改造。hnf-1α基因修饰的mscs保留有良好免疫豁免性,异体mscs在体内可以逃避自身免疫系统的清除,因此同种异体的mscs可以取代自身的干细胞用于肿瘤治疗;hnf-1α基因修饰的mscs保留有良好的肿瘤靶向性,可以迁移归巢至肿瘤组织,靶向传递抗肿瘤药物或治疗基因至肿瘤细胞以及它们的微转移瘤,从而对肿瘤的生长增殖发挥抑制作用。本发明解决了肿瘤基因治疗一直以来存在的无法高效靶向传递及安全问题。
[0088]
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条
件如j.萨姆布鲁克等编著,分子克隆实验指南,第三版,科学出版社,2002中所述的条件,或按照制造厂商所建议的条件。
[0089]
实施例1、大鼠骨髓原代间充质干细胞的分离鉴定以及hnf-1α过表达间充质干细胞的制备
[0090]
本实施例中,以大鼠骨髓来源的间充质干细胞(rbmscs)为例进行研究。
[0091]
(1)大鼠骨髓间充质干细胞的分离及体外培养
[0092]
应用贴壁培养法对sd大鼠进行骨髓mscs的分离、体外培养。取雄性sd大鼠200-250g,10%水合氯醛麻醉,常规消毒后取出股骨置于l-dmem培养基内。超净台内,用l-dmem培养基冲洗骨髓腔,收集骨髓悬液,离心5分钟(1500转/分),弃去上清,收集细胞沉淀,加入l-dmem 10%胎牛血清 100u/ml青霉素 100u/ml链霉素,血细胞计数板计数,以1
×
105/cm2接种于10cm培养皿中,于l-dmem 10%胎牛血清 l00u/ml青霉素 l00u/ml链霉素、37℃、5%co2孵箱静置培养。接种72h后,全量换液去除悬浮细胞,根据细胞生长情况,每2-3天换液一次。
[0093]
(2)大鼠骨髓间充质干细胞的传代培养
[0094]
待细胞长满培养瓶底面积85~90%,吸管移除培养液后,pbs清洗2遍。加入约1ml 0.25%胰蛋白酶溶液,37℃消化2分钟,镜下观察,见细胞回缩成短圆形后加入含10%胎牛血清的培养液终止消化。用吸管轻轻吹打细胞,直至贴壁细胞脱落,吸取细胞悬液1000rpm,5分钟离心后;将细胞沉淀用含10%胎牛血清完全培养基制成单细胞悬液,按1:2进行传代培养,此时的细胞称为第1代传代细胞(p1)。
[0095]
同法,对第2-4代细胞按1:2进行传代培养。
[0096]
(3)大鼠骨髓间充质干细胞向成骨细胞和成脂细胞分化
[0097]
将mscs按2
×
104个/cm2的密度接种到24孔板中,待细胞达到80%融合后;分别利用成骨诱导液和成脂诱导液对上述细胞进行诱导。对于成脂诱导,诱导液处理20天后,对上述细胞进行油红o(oil red o)染色鉴定;对于成骨诱导,在诱导液处理2-3周后,对上述细胞进行茜素红染色,显微镜下拍照。
[0098]
显微镜下观察染色结果显示,原代分离的间充质干细胞可以成功向成脂细胞分化以及成骨细胞分化,具有多向分化潜能,如图1a。
[0099]
(4)hnf-1α过表达腺病毒转染大鼠间充质干细胞
[0100]
过表达腺病毒ad-hnf-1α的建立:本发明人将大鼠hnf-1α(genbank id:nm_012669)的全基因组序列插入到质粒padeno-mcmv-ha-p2a-egfp(获自和元生物技术(上海)股份有限公司)表达质粒的ecorⅰ和bamhⅰ酶切位点中间,构建hnf-1α过表达腺病毒质粒,继而转染hek293细胞,制备hnf-1α过表达腺病毒。后续用引物mcmv-f和egfp-n-3进行扩增验证。
[0101]
mcmv-f:ggtataagaggcgcgaccag(seq id no:1);
[0102]
egfp-n-3:cgtcgccgtccagctcgaccag(seq id no:2)。
[0103]
按照上述(1)~(2)中的方法制备得到第三代mscs,以12000/cm2个细胞将mscs接种于24孔板中;接种24小时后,用含6μg/ml polybrene的0.5ml不含血清培养基替换原有培养基,再按moi=20加入过表达腺病毒ad-hnf-1α(ad-gfp作为对照病毒),对mscs进行转染。12h后弃去病毒液,清洗2遍,加入新鲜的完全培养基进行培养。转染后48小时,利用荧光显
微镜观察mscs的绿色荧光表达情况。
[0104]
荧光显微镜结果显示,对照病毒ad-gfp和ad-hnf-1α转染效率均可达到80%以上,见图1b。
[0105]
(5)hnf-1α表达水平检测
[0106]
ad-hnf-1α转染mscs后,收集细胞进行蛋白提取实验。采用western blot的方法分别从蛋白水平检测ad-hnf-1α转染mscs后,mscs中hnf-1α的表达情况。
[0107]
实验结果显示,ad-hnf-1α转染mscs后,细胞中hnf-1α的蛋白表达水平均显著上调,见图1c。
[0108]
实施例2、hnf-1α基因修饰mscs对den诱导的大鼠原发性肝癌发生发展的作用研究
[0109]
将20只sd大鼠适应性喂养一周后,随机分成4组,每组5只,即pbs输注组(ctrl),ad-gfp-mscs输注组(ad-gfp-mscs)、ad-hnf-1α-mscs输注组(ad-hnf-1α-mscs)以及ad-hnf-1α输注组,所有处理组实验动物均喂养den水(0.1%二乙基亚硝胺),各实验组动物分别从den诱癌第4周时(诱癌早期,或称为异变期)开始进行尾静脉注射,1.5
×
106个细胞/只/800μl;对照组(ctrl)输注800μlpbs;每两周尾静脉注射一次,共三次。然后继续喂养den水至14周时结束,更换为普通饮水。记录不同处理组大鼠的生存情况。den诱癌16周时,处死实验动物,收集肝脏组织进行大体观察以及he染色。
[0110]
实验结果显示,相比对照mscs组,早期输注ad-hnf-1α-mscs可非常显著地提高对肝癌发生发展的抑制效果:从实验动物的生存期可以看出早期输注ad-hnf-1α-mscs的大鼠的生存时间远超过空白对照组,与ad-gfp-mscs组以及ad-hnf-1α相比也有显著差异,见图2a。
[0111]
大体解剖获取肝组织标本看到,对照组den给药16周大鼠肝脏肉眼可见明显的多个肿瘤块,而早期输注ad-hnf-1α以及ad-gfp-mscs的大鼠肝脏仍有可见的肿瘤结节,但其数量和大小均小于den组,而输注ad-hnf-1α-mscs的大鼠肝脏几乎无肉眼可见的肿瘤块,肝脏整体状态良好;表明在den诱癌的早期阶段输注ad-hnf-1α-mscs可显著抑制肿瘤发生发展,如图2b~c。
[0112]
实施例3、hnf-1α基因修饰的间充质干细胞对den诱导的肝损伤修复的作用
[0113]
将15只sd大鼠适应性喂养一周后,随机分成3组,每组5只,即pbs输注组(ctrl),ad-gfp-mscs输注组(ad-gfp-mscs)及ad-hnf-1α-mscs输注组(ad-hnf-1α-mscs),所有处理组实验动物均喂养den水(0.1%二乙基亚硝胺),各实验组动物分别从den诱癌3周时开始进行尾静脉注射,1.5
×
106个细胞/只/800μl;对照组输注800μl pbs;每两周尾静脉注射一次,共三次。den处理第8周时处死实验动物,收集动物血清及肝脏组织进行相关检测。
[0114]
生化分析结果显示,相比ctrl对照组,ad-gfp-mscs和ad-hnf-1α-mscs输注组动物的血清中的肝功能指标如alt、ast、tbil以及dbil等含量均有所下降,但ad-hnf-1α-mscs输注组的肝功能情况更良好,如图3a。该结果说明,相比ad-gfp-mscs,ad-hnf-1α-mscs对于损伤的肝脏具有更强的保护作用。
[0115]
天狼星红染色和免疫组化染色结果显示相比ctrl对照组和ad-gfp-mscs,ad-hnf-1α-mscs输注组的纤维组织以及肝星状细胞活化显著减少,如图3b。该结果说明,ad-hnf-1α-mscs输注可显著减缓den导致的肝纤维化。
[0116]
实施例4、hnf-1α基因修饰的间充质干细胞对肝癌发生过程中肝脏炎症反应的影
响
[0117]
利用实施例3中收集的den诱癌第8周的动物血清及肝脏组织标本对肝脏组织的炎症反应状态进行检测。
[0118]
首先通过h&e染色图片观察发现相比ctrl对照组和ad-gfp-mscs,ad-hnf-1α-mscs输注组肝脏组织中炎症细胞的浸润更少,如图4a。
[0119]
同时利用悬液芯片系统(bioplex试剂盒,biorad)对动物血清进行炎症因子检测。研究结果显示,相比ctrl对照组和ad-gfp-mscs,ad-hnf-1α-mscs输注组动物血清中促炎因子,如tnf-α、ifn-γ、il-4和il-6等的含量显著降低(如图4b),提示相比ad-gfp-mscs,ad-hnf-1α-mscs抑制炎症反应的能力更强。
[0120]
实施例5、人源hnf-1a基因修饰的人脐带来源间充质干细胞对den诱导的大鼠原发性肝癌发生发展的作用研究
[0121]
参照实施例2构建den诱导肝癌发生的模型。将实验动物分成3组,每组5只。den给药的第四周开始进行输注实验,其中对照组(ctrl)输注800μl pbs;而ad-gfp-hmscs组以及ad-hnf-1a-hmscs组分别输注相应的细胞1.5
×
106个细胞/只/800μl,每两周尾静脉注射一次,共三次。然后继续喂养den水至14周时结束,更换为普通饮水。den处理第16周,处死实验动物,收集肝脏组织进行大体观察以及he染色。
[0122]
结果如图5所示,与大鼠mscs情况类似,相比对照组,在den诱癌的早期阶段输注hnf-1a基因修饰的人脐带来源mscs也具有显著抑制den诱导的肝癌发生发展的作用。
[0123]
在本发明提及的所有文献都在本技术中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本技术所附权利要求书所限定的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。