1.本发明涉及一种微针、微针贴片及其制备方法和应用。
背景技术:
2.可溶性微针给药作为一种新型无痛感经皮给药的技术,药物通过其在皮肤上无痛感地实现递送,增强皮肤对活性物质或药物,尤其是大分子药物的渗透吸收。因可溶性微针给药技术具有的无痛、安全、方便操作等优势,是药物经皮向体内递送的发展方向之一。
3.微针给药技术使用的微针的长度一般介于50~1000微米之间,可穿透具有天然保护作用的皮肤角质层(一般为20微米以内),由于没有达到神经末梢分布丰富的皮肤深层,所以不会产生痛觉,主要适合于低剂量活性物质、药物、基因、蛋白质或疫苗等制剂的经皮注射,将目标活性成分释放到血液或细胞中。
4.可溶性微针的组成材料是以生物可降解材料为基质的,除具有一般微针的优点,还具有生物可降解特性,从而解决了金属微针一旦断裂于皮肤内的医疗事故难题,并且比金属微针在一定程度上提高了载药剂量,扩大了微针的应用范围,因此,可溶性微针有望成为经皮给药系统的理想载体,具有非常好的应用科研及商业价值。
5.可溶性微针贴片是可溶性微针最主要的应用方式之一,在可溶性微针工艺的制作过程中,制作方法和工艺多种多样,美国专利us2009/0182306a1和国际专利wo2012/023044a1中公开了以羟甲基纤维素(carboxymethylcellulose,cmc)作为可溶性微针制作的基质,还公开了一些其它可制作可溶性微针的材料,并使用离心和真空的方法使溶液进入模具的针孔制作可溶性微针。另外,美国乔治亚大学的研究人员在《biodegradable polymer microneedles:fabrication,mechanics and transdermal drug delivery》文中提出了可溶性微针制作方法,即模具法(micro molding method),用该方法制作可溶性微针。该方法先利用微电机系统(micro electro mechanical systems)技术制作可用于微针模具,然后将含有目标活性物质可生物降解的高分子物质溶解(透明质酸、羟甲基化纤维素、聚乙烯毗咯烷酮等)或熔融(聚乙醇酸、聚乳酸或聚乳酸-聚乙醇酸共聚物)浇筑填充到微针模具(硅或聚二甲基硅氧烷模具)中,将模具放置在真空条件下,使高分子溶液干燥固化成微针,最后将干燥好的微针与模具分离,制成微针贴片。
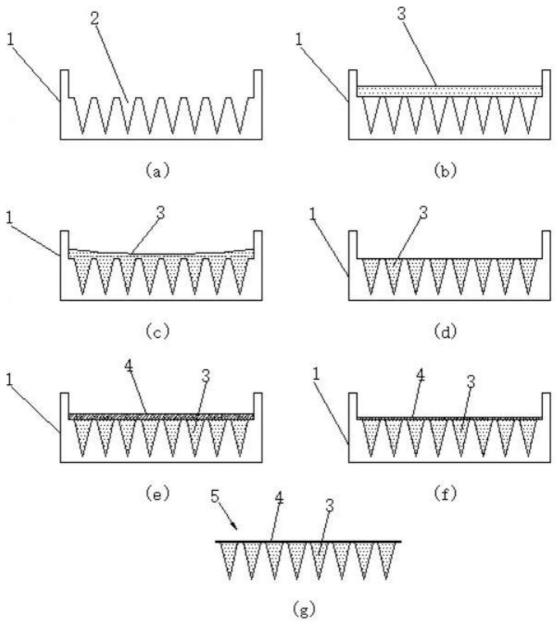
6.目前,浇筑填充方法主要有针尖和背贴基底分开浇筑法(参见图1)和一体浇筑法(参见图2)。
7.参见图1,针尖和背贴基底分开浇筑制作可溶性微针贴片5。首先,需要将制成可溶性微针针体的可溶性高分子材料和需要递送的目标药物制成高分子溶液3,然后将混合均匀的高分子溶液3注入到微针模具1内,通过使用离心或抽真空的方法,将高分子溶液3填充到微针模具1的微针腔体2内,然后刮除高于微针腔体2表面上多余的高分子溶液,然后通过真空高温干燥等手段,使微针腔体2内的高分子溶液固化,然后再将制作可溶性微针背贴的高分子材料溶液4注入含有固化后的针体的微针模具1中,通过真空高温干燥等方法使微针模具1中的高分子溶液固化,最后将固态成型的微针贴片5脱模(与微针模具1分开),形成可
溶性微针5。
8.参见图2,同时浇筑成微针和基底背贴制作可溶性微针贴片9。首先,需要将制作微针针体的可溶性高分子材料和需要递送的目标药物制成高分子溶液8,然后将混合均匀的高分子溶液8注入到微针模具6内,通过使用离心或者抽真空的方法,将高分子溶液8填充到微针模具6的微针腔体7内,通过真空高温干燥等方法使微针模具6中的高分子溶液固化,最后将固态成型的微针贴片9脱模(与微针模具6分开),形成可溶性微针9。
9.但已有的可溶性微针贴片在进行制备时,还具有以下问题:
10.关于图1的方案,浇筑针体后,干燥后高分子溶液中的大量溶剂挥发后,剩余的高分子溶质体积无法填充整个针体腔体(如图3和图4所示),导致针体空心或者针体缩小变型成为不是模具规则形态的针体(如图5所示)。关于图2的方案,同时浇注形成针体和基底背贴,则存在两种递送系统,针尖属于皮内或者皮下注射,基底背贴贴在皮肤上,属于外用制剂。
11.其他现有技术中也报道过可能能够形成微针模具的技术方案,例如中国专利文献cn106902453a公开了一种针体可溶而基底不可溶的微针的制备方法。该专利中先制备含药高分子水溶液,经干燥后,再将预设低熔点的材料加热至融化后,再加入至微针模具中,反复按压多次至基底层凝固。该方法制得的微针中含有大量不可溶材料;而且,在制备过程中,是将融化后的低熔点材料加入至微针模具中,可想而知,熔融的材料粘稠性较大直接加入至微针模具中难度较大,其还需反复按压多次,在按压的过程中会有多余的材料逸出微针成型孔中,在形成基底背贴的过程中也较为困难。同时,具有低熔点且干燥后可固化成型的材料种类较少,可选择性较少,实施难度大。
12.目前,亟需一种能够形成模具规则的可溶性微针,微针不会因溶剂蒸发而产生中空或空隙,使用范围广,容易制得的微针的制备方法。
技术实现要素:
13.本发明主要是为了克服现有技术中存在的微针产生中空或空隙的现象,以致于无法形成模具规则的缺陷,而提供了一种微针、微针贴片及其制备方法和应用。采用本发明中微针的制备方法制得的微针具有模具规则,微针的底部为平整的表面、微针可溶于皮肤中,且制备工艺简单容易实现。
14.本发明主要是通过以下技术方案解决上述技术问题的。
15.本发明提供了一种微针的制备方法,其包括将固体微针原料填充于微针模具的微针成型孔中,于潮湿环境中湿化溶解后,再干燥至固化成型即得;
16.其中:
17.所述固体微针原料的上表面与所述微针成型孔的孔口位于同一平面上;
18.所述固体微针原料包括药物层和载体材料层。
19.本发明中,发明人经过多次失败的实验,偶尔间发现,在所述微针成型孔中填充药物层,而微针成型孔的剩余腔体中填充所述载体材料层,然后将该微针成型孔在潮湿环境中放置一定时间即可。在所述潮湿环境中放置通过所述潮湿环境中的水分使得所述载体材料层吸收水分进而形成浆料状,由于所述微针的体积较小,浆料状的载体材料层一般会渗透入所述药物层,若所述药物层为松散的颗粒状,则浆料的载体材料层会与所述药物层混
合,进而通过干燥也使得所述药物层能够固化成型。
20.采用本发明的制备方法,不仅制得了可溶性的微针,制得的微针不会产生空针,能够形成模具规则,同样重要的是,本发明的制备方法简单,在制备过程中均是容易实现的操作。此外,考虑到实际使用所述微针时,需要药物集中在针尖区域,则先填充所述的药物层再填充所述的载体材料层即可。可见,本发明的微针制备方法,对于微针领域而言,取得了极大的进步。
21.本发明中,所述药物层较佳地填充于所述微针成型孔的针尖腔体中,同时,所述载体材料层则填充于所述微针成型孔的剩余腔体区域。
22.本发明中,所述药物层较佳地位于所述载体材料层的上方。
23.本发明中,所述药物层为松散的颗粒状和/或整体式块状。
24.本发明中,所述固体微针原料的填充顺序较佳地依次填充所述的药物层和所述的载体材料层。
25.本发明中,所述填充可为本领域内常规理解的含义,一般是指将所述药物层和/或所述载体材料层充实相应的区域。
26.本发明中,所述微针中所述药物层和所述载体材料层的体积比可根据所述微针中所需的药物活性成分的剂量合理选择即可,当所需的药物剂量确定之后,所述微针成型孔的剩余腔体中则填充载体材料。且本领域技术人员知晓,填充所述载体材料层的作用仅仅是作为填充除所述药物层的区域,同时能够与所述药物层粘结为一体,因此,其用量无需特别限制。
27.本发明中,所述药物层的药物较佳地能够溶于水。
28.本发明中,所述药物层中药物的种类可为本领域常规的可采用微针给药的药物,例如秋水仙碱。
29.本发明中,所述药物层较佳地包含药物,或者,包含药物和生物可降解材料,所述生物可降解材料能够溶于水,且较佳地所述生物可降解材料在干燥后能够形成固定的形状。
30.其中,所述生物可降解材料的种类较佳地为聚乙烯吡咯烷酮、聚乳酸-羟基乙酸共聚物、透明质酸、聚乳酸、聚乙烯醇、海藻糖、硫酸软骨素、聚酯、phbv(羟基丁酸-羟基戊酸共聚物)、php(水解聚丙烯酰胺)、phh(聚(3-羟基己酸酯))、pha-peg(聚羟基脂肪酸酯-聚乙二醇共聚物)、聚(4-羟基酸)、聚(α-羟基酸)、聚(β-羟基酸)、plga(聚乳酸-羟基乙酸共聚物)、15-聚二噁烷酮、聚酸酐、聚(氨基酸)、聚磷酸肌酸、壳聚糖、右旋糖苷、纤维素、羧甲基纤维素钠、肝素、海藻酸、菊糖、淀粉和糖原中的一种或多种。
31.所述聚酯可为本领域常规,例如包括pha(聚羟基脂肪酸酯)、聚(4-羟基丁酸酯)、聚(4-羟基戊酸酯)、聚(4-羟基己酸酯)、聚(酯酰胺)、聚已内酯、聚丙交酯、聚乙醇酸交酯、聚原酸酯、聚醚酯、聚(乙醇酸-共-三亚甲基碳酸酯)、聚磷酸酯、聚磷酸酯氨基甲酸酯、聚氰基丙烯酸酯、聚(三亚甲基碳酸酯)、聚(亚氨基碳酸酯)、聚(酪氨酸碳酸酯)、聚碳酸酯、聚(酪氨酸芳基酯)和聚亚烷基草酸酯一种或多种。
32.在本发明一具体实施例中,所述生物可降解材料为透明质酸。
33.本发明中,所述药物层的制备方法较佳地包括以下步骤:将药物溶液注入所述微针成型孔后,再干燥除去溶剂即得。
34.其中,所述药物溶液较佳地以压电喷射的方式注入所述微针成型孔中。采用压电喷射的方式能够使得微针给药时的药物剂量精准化。
35.其中,所述药物溶液中的溶剂可为本领域常规,例如为水和/或醇类溶剂。所述醇类溶剂例如为乙醇和/或甲醇。
36.其中,所述药物溶液的粘度可为本领域常规,不会过于粘稠使得难以填充入所述微针成型孔中即可,其粘度较佳地在15000mpa
·
s以下即可,以使得所述药物溶液易填充于所述微针成型孔的针尖腔体区,不会因为粘度较大而难以填充尖端区域。当所述药物溶液的粘度为0时,所述药物溶液干燥之后,一般为所述的颗粒状(无固定形状的粉末)。
37.其中,所述药物溶液的配制可根据所述药物层中的原料种类进行合理选择,当所述药物层中的物质为药物时,将所述药物溶于溶剂即得所述的药物溶液;当所述药物层中的物质为药物和生物可降解材料时,将所述药物溶于所述生物可降解材料的水溶液即得或者将所述药物和所述生物可降解材料溶于溶剂中即得。
38.其中,在向所述微针成型孔注入所述药物溶液之后、所述干燥之前,较佳地还包括振动,所述振动能够使得药物溶液充实所述微针成型孔的尖端处。所述振动的操作可为本领域常规,一般将微针模具置于振动机上。所述振动的振幅和频率一般无需特别限制,不会使得所述药物溶液洒出所述微针成型孔即可。
39.其中,所述干燥的工艺可为本领域常规,所述干燥一般在干燥箱进行,所述干燥时的相对湿度较佳地在30%rh以下,例如15%rh。所述干燥的温度较佳地在30℃以下。所述干燥的时间较佳地为3~12小时,例如5小时。
40.本发明中,本领域技术人员根据所述微针的制备方法可知,所述载体材料层中的载体材料一般为能够溶于水、且能够以固体的状态填充于所述微针成型孔中,且溶于水后再进行干燥能够固化为与所述的微针成型孔一致的形状即可得到所述的微针。
41.本发明中,所述载体材料层中的载体材料较佳地为颗粒状,所述载体材料的粒径一般小于所述微针成型孔的孔口且粒径越小越容易填充入所述的微针成型孔中,较佳地低于100μm。
42.本发明中,所述载体材料层中的载体材料较佳地为生物可降解材料,所述生物可降解材料可包括聚乙烯吡咯烷酮、聚乳酸-羟基乙酸共聚物、透明质酸、聚乳酸、聚乙烯醇、海藻糖、硫酸软骨素、聚酯、phbv、php、phh、pha-peg、聚(4-羟基酸)、聚(α-羟基酸)、聚(β-羟基酸)、plga(聚乳酸-羟基乙酸共聚物)、15-聚二噁烷酮、聚酸酐、聚(氨基酸)、聚磷酸肌酸、壳聚糖、右旋糖苷、纤维素、羧甲基纤维素钠、肝素、海藻酸、菊糖、淀粉和糖原中的一种或多种。
43.所述聚酯可为本领域常规,例如包括pha、聚(4-羟基丁酸酯)、聚(4-羟基戊酸酯)、聚(4-羟基己酸酯)、聚(酯酰胺)、聚已内酯、聚丙交酯、聚乙醇酸交酯、聚原酸酯、聚醚酯、聚(乙醇酸-共-三亚甲基碳酸酯)、聚磷酸酯、聚磷酸酯氨基甲酸酯、聚氰基丙烯酸酯、聚(三亚甲基碳酸酯)、聚(亚氨基碳酸酯)、聚(酪氨酸碳酸酯)、聚碳酸酯、聚(酪氨酸芳基酯)和聚亚烷基草酸酯一种或多种。
44.本发明中,所述载体材料层中的载体材料较佳地为聚乙烯吡咯烷酮、羧甲基纤维素钠和透明质酸中的一种或多种。例如质量比为2:1:3聚乙烯吡咯烷酮、羧甲基纤维素钠和透明质酸的混合物。
45.本发明中,所述微针模具可为本领域常规,一般还包括连接模块,所述连接模块用于连接若干个所述微针成型孔。
46.本发明中,所述微针模具中一般设有50~500个所述微针成型孔,例如396个。
47.本发明中,所述微针成型孔的形状可为本领域常规。
48.其中,所述微针成型孔的高可为50~1000μm,例如900μm。
49.其中,所述微针成型孔的底面的直径或边长可为100~600μm,例如400μm。
50.其中,所述微针成型孔的形状可为圆锥体或多棱椎体,例如四棱锥。
51.本发明中,本领域技术人员根据所述的制备方法可知,所述固体微针原料的上表面一般是指在所述微针成型孔的孔口处形成的表面。
52.本发明中,所述潮湿环境的温度较佳地2~8℃。
53.本发明中,所述潮湿环境的相对湿度较佳地为60~100%rh,例如80%rh、90%rh或97%rh。
54.本发明中,所述潮湿环境较佳地由一密闭空间提供,所述密闭空间设有置物区1和置物区2,所述置物区1用于放置所述的微针模具,所述置物区2用于放置装有水的开口容器,所述置物区1和所述置物区2之间为连通的空间。
55.其中,所述置物区1较佳地位于所述置物区2的上方。
56.其中,在密闭空间中较佳地应当避免所述置物区1上方空间中形成的水珠滴落至所述微针模具上。
57.本发明中,对于所述的潮湿环境,发明人曾尝试过采用加湿器或加热水使其形成水蒸汽的条件下形成潮湿环境,但是由于水分过多且水珠过大,使得微针成型孔中的药物和载体材料以浆料的形式溢出,直接形成了基底背贴,而且若干个所述微针成型孔中的原料浆料相互混合,使得基底背贴部分也含有药物,同时由于较多的水分进入微针成型孔,在干燥后仍然会形成中空或空隙现象。
58.本发明中,置于所述潮湿环境中的时间可根据实际情况合理选择即可,一般为6~24小时,例如15小时。
59.本发明中,所述湿化溶解可为本领域常规理解的含义,是使得所述载体材料层中的载体材料和/或所述药物层中的药物被所述潮湿环境中的水分溶解。
60.本发明中,所述湿化溶解之后、所述干燥之前,较佳地还包括振动的操作,所述振动使得所述湿化溶解后的载体材料的浆料能够充实于针体腔体区。所述振动一般是指将所述微针模具置于振动机上进行振动即可。所述振动的频率和振幅无需特别的限制,在振动时不会使得溶解后载体材料洒出微针成型孔即可。
61.本发明中,在向所述微针成型孔注入药物溶液和已所述湿化溶解的载体材料后,采用振动的方式,可以实现工艺放大,较离心而言更容易自动化产线,提高了微针的生产效率和降低了可溶性微针制造成本。
62.本发明中,所述干燥的相对湿度较佳地在30%rh以下,例如15%rh。
63.本发明中,所述干燥的温度较佳地在30℃以下。
64.本发明中,所述干燥的时间较佳地为5~24小时。
65.本发明中,所述的固化成型可为本领域常规理解的含义,一般是指通过所述的干燥形成与所述微针成型孔相匹配的形状。
66.本发明还提供了一种微针,其采用所述的制备方法制得。
67.本发明还提供了一种微针贴片,其包括所述的微针和基底背贴,所述微针固定于所述基底背贴的一侧面。
68.本发明中,所述基底背贴较佳地为粘性贴片。
69.本发明中,所述基底背贴中较佳地不含药物活性成分。
70.本发明的可溶性微针贴片是由含有所述药物的可溶性微针针体部分和不含目标药物的可溶性微针背贴基底部分所组成,药物活性成分分布在可溶性微针针体部分,实现可溶性微针贴片单一注射给药方式。
71.本发明中,所述微针贴片的制备方法可为本领域常规,将所述基底背贴与所述微针的底面相贴合后,进行脱模即得所述的微针贴片。
72.本发明还提供了一种所述微针或所述的微针贴片作为经皮给药制剂的应用。
73.本发明中,所述的能够溶于水可为本领域常规理解的含义,例如在20℃时,1l水中溶解1g以上的溶质。
74.在符合本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
75.本发明所用试剂和原料均市售可得。
76.本发明的积极进步效果在于:采用本发明的制备方法,不仅能够制得可溶性微针、且药物可位于针尖区域,而且制得的微针中的微针底部会不产生中空或空隙的缺陷,能够形成模具规则,同样重要的是,本发明的制备方法简单,在制备过程中均是容易实现的操作。
附图说明
77.图1是现有针体和基底背贴分开制作可溶性微针制造过程的示意图。
78.图2是现有可溶性微针制造过程的示意图。
79.图3是现有可溶性微针制造出空壳针体的放大图。
80.图4是现有可溶性微针制造出空壳针体的放大图。
81.图5是现有可溶性微针制造出针体缩小变型的放大图。
82.图6是实施例1~3中使用的微针模具的图片。
83.图7是实施例1中微针贴片的制造过程示意图。
84.图8是实施例2中微针贴片的制造过程示意图。
85.图9是实施例3中微针贴片的制造过程示意图。
86.图10是实施例1中制得的可溶性的微针的图片。
87.图11为实施例1中步骤5)中向微针成型孔中填充高分子粉末后的微针模具的俯视图。
88.图12为实施例1中步骤6)中高分子粉末湿化溶解后的微针模具的俯视显微图。
具体实施方式
89.下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商
品说明书选择。
90.下述实施例1~3中所使用的微针模具如下图6所示,该微针模具中共有396个微针成型孔,每一微针成型孔的底面的边长为400μm,每一微针成型孔为四棱椎体,每一微针成型孔的高为900μm,每一微针成型孔中腔体的体积为50nl。
91.下述实施例1~3中的潮湿环境由存放在2~8℃冰箱中的密闭空间,密闭空间的相对湿度为97%rh,该密闭空间的腔体中水平放置一网状置物架,该网状置物架上用于放置待湿化溶解的微针模具,网状置物架的下方腔体中放置装有水的开口容器。
92.实施例1
93.如图7所示为本实施例中微针贴片的制备流程示意图。图7中(a)表示微针模具,(b)表示采用压电喷射设备向微针模具的微针成型孔中注入药物溶液,(c)采用振动机振动之后的微针模具,使得药物溶液充实所述微针成型孔,尤其是充实了针尖区域,(d)药物溶液干燥固化成型为药物层,(e)在微针成型孔的药物层的上方腔体中填充粉末状的载体材料,湿化溶解后再振动、固化成型,(f)和(g)将基底背贴粘贴在微针的针体底面,(h)从微针模具中取出微针贴片。
94.可溶性微针贴片的具体制备工艺如下所示:
95.1)将秋水仙碱药物溶于1g/l的透明质酸水溶液中,根据药物的溶解度和所需要的载药剂量配置成10mg/ml的浓度,粘度不高于15000mpa
·
s;
96.2)调节压电喷射设备,将配制得到的药物溶液喷射到微针模具的微针成型孔的腔体中至腔体装满药物溶液;
97.3)调节振动平台至药物溶液不洒出微针成型孔即可,将微针模具放置在高频振动平台上进行振动,使药物溶液填充微针成型孔的尖端;
98.4)将微针模具在相对湿度为不高于15%rh、温度不高于30℃的条件下干燥5小时,使得药物溶液固化,形成药物层,该药物层为整体式块状;
99.5)将经过研磨粉碎后的水溶性的高分子粉末(聚乙烯吡咯烷酮、羧甲基纤维素钠和透明质酸的混合物,质量比为2:1:3)填充到微针成型孔的药物层的上方腔体中,直至高分子粉末填平微针成型孔,形成载体材料层;将微针模具表面(针体以外)的高分子粉末刮除干净,如图11所示。
100.6)将微针模具置于上述潮湿环境中15小时,让高分子粉末湿化溶解为胶黏状,如图12所示,此时微针成型孔的腔体中湿化后的高分子与药物层粘结为一体;
101.7)待高分子粉末完全湿化溶解后,将微针模具放置在高频振动平台上进行振动,让湿化后的高分子充实微针成型孔;
102.8)将振实后的微针模具放置在密闭干燥箱中(相对湿度为不高于15%rh、温度不高于30℃)干燥24小时,使得湿化溶解后的高分子固化成型;若高分子固化成型后,微针成型孔的孔口处未填平,再重复第5)至8)步的操作。
103.9)将粘性贴片粘贴到微针针体底部表面上,采用按压的方式将粘性贴片与可溶性微针针体底部表面接触并贴合,最后将其从微针模具中取出即可。
104.实施例2
105.如图8所示为本实施例中微针贴片的制备流程示意图。图6中(a)表示微针模具,(b)表示采用压电喷射设备向微针模具的微针成型孔中注入药物溶液并进行振动,(c)干燥
药物溶液形成药物层,(d)在微针成型孔的药物层的上方腔体中填充水溶性的高分子粉末形成载体材料层,湿化溶解后再振动、固化成型,(e)和(f)将基底背贴粘贴在微针的针体底面,(g)从微针模具中取出微针贴片。
106.可溶性微针贴片的制备工艺如下所示:
107.1)将秋水仙碱溶于50%v/v的乙醇水溶液中,根据药物的溶解度和所需要的载药剂量配置成10mg/ml的浓度;
108.2)调节压电喷射设备,将配制的药物溶液喷射到微针成型孔中至腔体装满药物溶液;
109.3)调节振动平台至药物溶液不洒出微针成型孔即可,将微针模具放置在高频振动平台上进行振动,让药物溶液填充到微针成型孔的尖端;
110.4)将微针模具在湿度为不高于15%rh、温度不高于30℃的条件下干燥5小时,形成药物层;
111.5)将经研磨粉碎后的水溶性的高分子粉末(聚乙烯吡咯烷酮、羧甲基纤维素钠和透明质酸的混合物,质量比为2:1:3)填充到微针成型孔中,直至高分子粉末填平微针成型孔;将模具表面(针体以外)的高分子粉末刮除干净。
112.6)将微针模具置于上述潮湿环境中15小时,使高分子粉末湿化溶解为胶黏状并与药物层粘结为一体;
113.7)待高分子粉末完全湿化溶解后,将模具放置在高频振动平台上进行振动,让湿化后的高分子充实微针成型孔;
114.8)将振实后的微针模具放置在密闭干燥箱中(相对湿度为不高于15%rh、温度不高于30℃)干燥24小时,使得湿化溶解后的高分子固化成型;
115.9)将粘性贴片粘贴到微针的针体底部表面上,采用按压的方式将粘性贴片与可溶性微针的针体底部表面接触并贴合,最后将其从微针模具中取出即可。
116.实施例3
117.如图9所示为本实施例中微针贴片的制备流程示意图。图9中(a)表示微针模具,(b)表示采用压电喷射设备向微针模具的微针成型孔中注入药物溶液,(c)干燥药物溶液除去溶剂形成药物层,(d)在微针成型孔的药物层的上方腔体中填充高分子水溶液,(e)振动微针模具,使得高分子溶液充实微针成型孔,(f)干燥使得微针成型孔中的原料固化成型,(g)填充水溶性的高分子粉末,湿化溶解后再振动、固化成型,(h)和(i)将基底背贴粘贴在微针的针体底面,(j)从微针模具中取出微针贴片。
118.可溶性微针贴片的制备步骤如下所示:
119.1)将秋水仙碱溶于50%v/v的乙醇水溶液中,根据药物的溶解度和所需要的载药剂量配置成适宜的浓度;
120.2)调节压电喷射设备,将配制的药物溶液喷射到微针成型孔中至腔体装满药物溶液;
121.3)调节振动平台至药物溶液不洒出微针成型孔即可,将模具放置在高频振动平台上进行振动,让药物溶液填充到微针成型孔的尖端;
122.4)将微针模具在湿度为5-30%、温度为15-30℃的条件下干燥5小时,形成药物层;
123.5)配制浓度适宜的1g/l的透明质酸水溶液,粘度不高于15000mpa
·
s;
124.6)调节压电喷射设备,将透明质酸水溶液定量喷射到微针成型孔;
125.7)调节振动平台至透明质酸水溶液不洒出微针成型孔即可,将微针模具放置在高频振动平台上进行振动,让透明质酸水溶液填充到微针成型孔的尖端;
126.8)将微针模具在相对湿度为不高于15%rh、温度不高于30℃的条件下干燥5小时,使得微针成型孔中的原料浆料固化成型;
127.9)将经过研磨粉碎后的水溶性的高分子粉末(聚乙烯吡咯烷酮、羧甲基纤维素钠和透明质酸的混合物,质量比为2:1:3)填充到微针成型孔的剩余腔体中,直至高分子粉末填平微针成型孔;将模具表面(针体以外)的高分子粉末刮除干净。
128.10)将微针模具置于上述潮湿环境中15小时,让高分子粉末湿化溶解;
129.11)待高分子粉末完全湿化溶解后,将模具放置在高频振动平台上进行振动,让湿化后的高分子充实微针成型孔;
130.12)将振实后的模具放置在密闭干燥箱中(相对湿度为不高于15%rh、温度不高于30℃)干燥24小时,使得湿化溶解后的高分子固化成型;
131.13)将粘性贴片粘贴到微针针体底部表面上,采用按压的方式将粘性贴片与可溶性微针针体底部表面接触并贴合,最后将其从微针模具中取出即可。
132.如图10所示为本发明实施例1中制得的微针的图片。由图可知,采用本发明的方案制得微针具有模具规则,药物位于针尖区域,且微针的底部未出现凹陷。
133.本发明的实施例1~3中采用压电喷射向模具针尖腔体内精准喷射定量药物溶液,然后将装有药物溶液的微针模具放置在高频振动平台上进行振动,让药物溶液填充到微针成型孔的针尖区域,干燥后形成药物层,再将水溶性的高分子粉末填充到微针成型孔的剩余腔体中,填平微针成型孔,然后将微针模具放置在潮湿环境下,使得高分子粉末完全湿化溶解为胶黏状进而药物层融合或是粘结为一体,同时将微针模具放置在高频振动平台上进行振动,让湿化后的高分子充实微针成型孔,将振实后的微针模具放置在密闭干燥箱中进行干燥后,使得胶黏状的高分子固化成型,即得微针。
134.采用这种方式可以保证微针的针尖部分载药剂量精准,背贴基底不含药物,针尖形态良好完整,彻底解决现有技术中存在的缺陷,并且本技术方案中通过压电喷射设备可有效解决微针贴片的剂量精密度问题。此外,不需要通过施加离心力、抽真空等方式将高分子溶液填充到微孔腔体内,振动平台可以实现工艺放大,较离心而言更易实现自动化产线,提高了微针的生产效率并降低了制造成本。同时,高频振动平台工艺可以让高分子溶液均匀的混合,从而实现高分子溶液填充于微孔成型孔的目的。
135.将药物溶液喷射到微针成型孔后,由于采用压电喷射设备,可以更加容易的填充到微针成型孔内,之后再填充干燥的高分子粉末,利用湿化溶解后的胶黏状的高分子的粘性,与固化成型后的药物层粘结为一体,再经过干燥使得湿化溶剂的高分子再固化成型,即得与模具规则一致的微针。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
