1.本发明属于微生物培养技术领域,具体涉及一种罗非鱼无乳链球菌的培养工艺。
背景技术:
2.罗非鱼(tilapia)为一种中小型鱼,它是世界水产业重点科研培养的淡水养殖鱼类,且被誉为未来动物性蛋白质的主要来源之一,罗非鱼是我国重要的出口型经济鱼类之一,其健康养殖的意义重大。
3.随着水产养殖集约化和规模化的迅猛发展,罗非鱼养殖密度不断加大,亩产可高达2万斤,随之带来的养殖病害、水体污染等问题不断加剧。当前,链球菌病是罗非鱼养殖所面临的严重重且难处理的病害之一,其传染性极强,死亡率高达 80%以上,严重影响罗非鱼产业发展。罗非鱼链球菌病的病原主要为无乳链球菌和海豚链球菌,其中以无乳链球菌为主。无乳链球菌是革兰氏阳性菌,表面光滑湿润并略显凸起,边缘比较整齐,呈圆形,乳白色,显微镜下可见一个或者多个球形或链状菌体。鱼体感染致病性链球菌后,表现功能异常、眼巩膜白浊和体表出血等特征,通常致死率较高。
4.对于罗非鱼链球菌病的防治,目前主要依赖于抗生素药物。但抗生素药物的长期使用所带来的菌株变异、药物残留和污染环境等严重问题已倍受社会关注。因此,从长远来看,开发有效的免疫防治技术,仍是控制罗非鱼链球菌病的主流方向,其中疫苗防治是一条国际推荐且被认可的既绿色又环保的重要途径之一。
5.疫苗的研制需要无乳链球菌的大规模培养,在无乳链球菌感染罗非鱼的过程中,荚膜多糖(gps)、β-溶血素/溶细胞素camp 因子、c5a肽酶、透明质酸酶、超氧化物歧化酶和丝氨酸/苏氨酸蛋白激酶等毒力因子扮演着重要的角色。无乳链球菌的多种表面蛋白、β蛋白质、5a 肽酶、lmb、fbsa、sip等)具有重要免疫原性,在致病过程中可能起着重要作用。通过不同血清型gbs的多基因组分析和筛查研究显示c5a肽酶(简称scpb)、sip蛋白、lrrg蛋白经现有技术中实验证实具有较好的免疫原性,并且理论上存在于所有的 gbs 菌株中,因此成为制备 gbs 疫苗的主要候选成分,而现有技术中,对罗非鱼无乳链球菌中培养,获得的这三种毒力蛋白的含量较低,而想要获得大量的c5a肽酶、sip蛋白、lrrg蛋白通常需要采用基因工程的方法,将所需的重组蛋白的编码基因构建到表达载体上,获得重组表达载体;将重组表达载体转化宿主细胞,培养转化的宿主细胞,使转化的宿主细胞表达产生所述无乳链球菌表面免疫原性重组蛋白。虽然通过上述方法能够特异性的得到用于生产疫苗所需要的蛋白,但是现有技术中,基因工程的技术方案复杂,同时对实验操作及实验条件的要求十分苛刻,不利于大规模的工业化生产。
6.因此,有必要提供一种罗非鱼链球菌的培养方法,通过简单的培养工艺,有效提高罗非鱼无乳链球菌中的三种毒力蛋白c5a肽酶、sip蛋白、lrrg蛋白的高效表达,从而可以应用于制备控制罗非鱼无乳链球菌疾病的发生的高效疫苗。
技术实现要素:
7.在为了解决现有技术中存在的问题,本发明的目的在于提供一种罗非鱼无乳链球菌的培养工艺。本发明提供的罗非鱼无乳链球菌的培养工艺,能够有效提高无乳链球菌的菌体浓度以及c5a肽酶、sip蛋白、lrrg蛋白等三种毒力蛋白的表达量。
8.本发明的技术方案是:一种罗非鱼无乳链球菌的培养工艺,具体包括如下步骤:s1、菌种活化:将罗非鱼无乳链球菌菌种划线于bhi固体培养基上,培养,得活化菌种;s2、菌种培养将步骤s1所得的活化菌种接种于复合液体培养基中,并培养8~16h,即得培养后的罗非鱼无乳链球菌。
9.进一步地,所述罗非鱼无乳链球菌菌株为hn01株,从海南感染无乳链球菌导致发病的罗非鱼肾脏组织分离鉴定,具体分离方法如下:将发病罗非鱼在无菌条件下取出肾脏组织,在生物安全柜中用接种环在酒精灯下消毒,冷却后蘸取肝脏组织,划线于bhi固体培养基中,于28℃恒温培养箱中培养24小时后,挑取单菌落部分进行分子鉴定,然后划线于bhi固体培养基,经纯净性检验合格后,添加30%甘油于-80℃保存备用。
10.进一步地,所述步骤s1菌种活化的过程为:将保存于-80℃的罗非鱼无乳链球菌菌种划线于bhi固体培养基上,然后置于22~30℃的生化培养箱中恒温倒置培养23~25h。
11.进一步地,所述bhi固体培养基的制备方法如下:向1000ml bhi液体培养基中加入150g琼脂粉末,搅拌均匀,然后高温高压(121.3℃,103.4kpa)灭菌15分钟,冷却后待用。
12.进一步地,所述步骤s2中的接种量为1~4%。
13.进一步地,所述步骤s2中的培养条件为:将接种后的复合液体培养基置于22~30℃振荡培养箱,在100~150r/min的转速下培养8~16h。
14.进一步地,所述复合液体培养基包括基础培养基和添加剂,所述添加剂包括如下组分:胎牛血清1~4vol%,酵母提取物2~8g/l,乳糖2~5 g/l,促生长剂4~16mg/l,l-半胱氨酸3~8 mg/l,硫酸软骨素0.2~1.4mg/l。
15.更进一步地,所述添加剂包括由如下组分组成:包括胎牛血清2 vol%,酵母提取物5g/l,乳糖3g/l,促生长剂12mg/l,l-半胱氨酸5mg/l,硫酸软骨素0.8mg/l。
16.进一步地,所述基础培养基为bhi液体培养基。
17.进一步地,所述促生长剂为异鼠李素、还原型谷胱甘肽和刺五加苷e按重量比1~5:2~7:3~13组成。
18.更进一步地,所述促生长剂为异鼠李素、还原型谷胱甘肽和刺五加苷e按重量比2:5:10组成。
19.本发明提供的罗非鱼无乳链球菌的培养工艺中,在菌种培养过程中采用了复合液体培养基,其中添加的胎牛血清能够为菌种提供丰富的必须的营养成份;添加的乳糖为可发酵的糖类物质,能够在菌种的培养过程中提供碳源和能源;添加的酵母提取物中富含丰富的蛋白质、维生素、酵母多糖和微量元素等。
20.另外,本发明在研究过程中发现,通过向基础培养基中添加特定量的酵母提取物
和由异鼠李素、还原型谷胱甘肽和刺五加苷e按特定比例组成的促生长剂进行协同作用,有效的促进了无乳链球菌的繁殖,同时能够提高制备工程中无乳链球菌的菌种活力及数量,从而有效增强了无乳链球菌对c5a肽酶、sip蛋白、lrrg蛋白的表达量,有利于大规模获得这三种毒力蛋白,从而为下一步研制进罗非鱼无乳链球菌疫苗提供原料。
21.进一步地,所述复合液体培养基的制备方法如下:向基础培养基中加入胎牛血清,乳糖,l-半胱氨酸和硫酸软骨素,在搅拌速度为80~120r/min的条件下,搅拌3~12min,然后加入酵母提取物和促生长剂,继续搅拌10~20min,最后用0.22μm滤膜过滤除菌,即得。
22.与现有技术相比,本发明提供的罗非鱼无乳链球菌的培养工艺具有以下优势:(1)本发明所提供的罗非鱼无乳链球菌的培养工艺中,所采用的复合液体培养基可以为无乳链球菌的生长和增殖提供必要的营养原料:所添加的酵母提取物与促生长剂协同作用,可以有效提高无乳链球菌培养过程中的活菌数,同时能够有效提高无乳链球菌的菌体浓度以及c5a肽酶、sip蛋白、lrrg蛋白等三种毒力蛋白的表达量,为进一步研制罗非鱼无乳链球菌疫苗奠定了基础。
23.(2)通过采用本发明提供的罗非鱼无乳链球菌的培养工艺对无乳链球菌进行培养,培养过程简单,发酵时间短,能够在短时间内获得大规模的c5a肽酶、sip蛋白、lrrg蛋白。
具体实施方式
24.以下通过具体实施方式的描述对本发明作进一步说明,但这并非是对本发明的限制,本领域技术人员根据本发明的基本思想,可以做出各种修改或改进,但是只要不脱离本发明的基本思想,均在本发明的保护范围之内。
25.刺五加苷e,cas号:39432-56-9,购自上海源叶生物科技有限公司,刺五加皂甙b,cas号:114902-16-8,购自上海源叶生物科技有限公司;胎牛血清购自bibco,型号16010-142;酵母提取物购自oxoid,型号e559-1;bhi液体培养基购自oxoid,型号cm1135。
26.另外本发明所用其他试剂均为常用试剂,均可在常规试剂生产销售公司购买。
27.实施例1一种罗非鱼无乳链球菌的培养工艺所述罗非鱼无乳链球菌菌株为hn01株,从海南感染无乳链球菌导致发病的罗非鱼肾脏组织分离鉴定,具体分离方法如下:将发病罗非鱼在无菌条件下取出肾脏组织,在生物安全柜中用接种环在酒精灯下消毒,冷却后蘸取肝脏组织,划线于bhi固体培养基中,于28℃恒温培养箱中培养24小时后,挑取单菌落部分进行分子鉴定,然后划线于bhi固体培养基,经纯净性检验合格后,添加30%甘油于-80℃保存备用。
28.所述的罗非鱼无乳链球菌的培养工艺,具体包括如下步骤:s1、菌种活化:将保存于-80℃的无乳链球菌菌种划线于bhi固体培养基上,置于22℃的生化培养箱中恒温倒置培养23h,得活化菌种;s2、菌种培养:将步骤s1所得的活化菌种接种于复合液体培养基中,接种量为1%,并且置于22℃的振荡培养箱中,在转速为100r/min的条件下进行培养8~16h,即得培养后的无乳链球菌。
然后分别在培养第8、10、12、14、16h时,进行试验例一的测试,具体实验结果见表1;并分别在培养第8、10、12h时,进行试验例二的测试,具体实验结果见表2。
29.所述复合液体培养基包括bhi液体培养基和添加剂,所述添加剂由如下组分组成:胎牛血清1vol%,酵母提取物2g/l,乳糖2g/l,促生长剂4mg/l,l-半胱氨酸3mg/l,硫酸软骨素0.2mg/l。
30.所述促生长剂为异鼠李素、还原型谷胱甘肽和刺五加苷e按重量比1:7:13组成。
31.所述复合液体培养基的制备方法如下:向bhi液体培养基中加入胎牛血清,乳糖,l-半胱氨酸和硫酸软骨素,在搅拌速度为80r/min的条件下,搅拌12min,然后加入酵母提取物和促生长剂,继续搅拌20min,最后用0.22μm滤膜过滤除菌,即得。
32.实施例2一种罗非鱼无乳链球菌的培养工艺所述罗非鱼无乳链球菌的分离方法与实施例1类似。
33.所述的罗非鱼无乳链球菌的培养工艺,具体包括如下步骤:s1、菌种活化:将保存于-80℃的无乳链球菌菌种划线于bhi固体培养基上,置于28℃的生化培养箱中恒温倒置培养24 h,得活化菌种;s2、菌种培养:将步骤s1所得的活化菌种接种于复合液体培养基中,接种量为2%,并且置于28℃的振荡培养箱中,在转速为130r/min的条件下进行培养8~16h,即得培养后的无乳链球菌。然后分别在培养第8、10、12、14、16h时,进行试验例一的测试,具体实验结果见表1;并分别在培养第8、10、12h时,进行试验例二的测试,具体实验结果见表2。
34.所述复合液体培养基包括bhi液体培养基和添加剂,所述添加剂由如下组分组成:包括胎牛血清2vol%,酵母提取物5g/l,乳糖3g/l,促生长剂12mg/l,l-半胱氨酸5mg/l,硫酸软骨素0.8mg/l。
35.所述促生长剂为异鼠李素、还原型谷胱甘肽和刺五加苷e按重量比2:5:10组成。
36.所述复合液体培养基的制备方法如下:向bhi液体培养基中加入胎牛血清,乳糖,l-半胱氨酸和硫酸软骨素,在搅拌速度为100r/min的条件下,搅拌8min,然后加入酵母提取物和促生长剂,继续搅拌15min,最后用0.22μm滤膜过滤除菌,即得。
37.实施例3一种罗非鱼无乳链球菌的培养工艺所述罗非鱼无乳链球菌的分离方法与实施例1类似。
38.所述的罗非鱼无乳链球菌的培养工艺,具体包括如下步骤:s1、菌种活化:将保存于-80℃的无乳链球菌菌种划线于bhi固体培养基上,置于30℃的生化培养箱中恒温倒置培养25h,得活化菌种;s2、菌种培养:将步骤s1所得的活化菌种接种于复合液体培养基中,接种量为4%,并且置于30℃的振荡培养箱中,在转速为150r/min的条件下进行培养8~16h,即得培养后的无乳链球菌。然后分别在培养第8、10、12、14、16h时,进行试验例一的测试,具体实验结果见表1;并分别
在培养第8、10、12h时,进行试验例二的测试,具体实验结果见表2。
39.所述复合液体培养基包括bhi液体培养基和添加剂,所述添加剂由如下组分组成:胎牛血清4 vol%,酵母提取物8g/l,乳糖5 g/l,促生长剂16mg/l,l-半胱氨酸8 mg/l,硫酸软骨素1.4mg/l。
40.所述促生长剂为异鼠李素、还原型谷胱甘肽和刺五加苷e按重量比5:2:3组成。
41.所述复合液体培养基的制备方法如下:向bhi液体培养基中加入胎牛血清,乳糖,l-半胱氨酸和硫酸软骨素,在搅拌速度为120r/min的条件下,搅拌3min,然后加入酵母提取物和促生长剂,继续搅拌10min,最后用0.22μm滤膜过滤除菌,即得。
42.对比例1 一种罗非鱼无乳链球菌的培养工艺与实施例2的相比,对比例1的区别在于,所述的复合液体培养基中,将添加剂中的酵母提取物替换为牛肉浸膏(cas:68990-09-0),其他组分与制备步骤与实施例2相同。
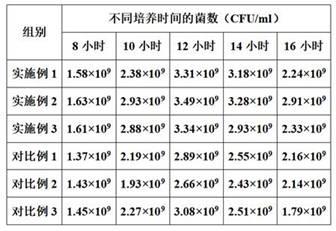
43.对比例2 一种罗非鱼无乳链球菌的培养工艺与实施例2的相比,对比例2的区别在于,所述添加剂中,用刺五加皂甙b替换促生长剂中的刺五加苷e,其他组分与制备步骤与实施例2相同。
44.对比例3 一种罗非鱼无乳链球菌的培养工艺与实施例2的相比,对比例3的区别在于,所述添加剂中,用硫辛酸替换促生长剂中的还原型谷胱甘肽,其他组分与制备步骤与实施例2相同。
45.试验例一、本发明的培养工艺对无乳链球菌活菌数的影响1. 试验对象:采用本发明实施例1~3,对比例1~3在不同的培养时间得到的发酵液。
46.2. 试验方法:将实施例1~3,对比例1~3在不同的培养时间得到的发酵液,分别用灭菌的生理盐水进行10倍系列稀释,取10-8
个稀释度,取0.1ml/碟,铺平,倒置放置于培养箱中,24h,进行两次重复活菌计数(取平均值)。
47.3. 试验结果:本发明的培养工艺对无乳链球菌活菌数的影响的试验结果如表1所示。
48.表1由表1可知:采用本发明实施例1~3的培养工艺培养得到的无乳链球菌,其中实施例2组效果最好,为本发明的最佳实施例。而对比例1~3与实施例1~3相比,在同样培养时间
下,无乳链球菌活菌数低。
49.试验例二、本发明的培养工艺对无乳链球菌三种毒力蛋白c5α、lrrg、sip影响1. 试验对象:采用本发明实施例1~3,对比例1~3在不同的培养时间得到的发酵液。
50.2. 试验方法:将本发明本发明实施例1~3,对比例1~3在不同的培养时间得到的发酵液采用分子筛截留方法进行分段收集纯化后,用bca蛋白浓度测定试剂盒(thermoscientific
tm pierce
tm
bca蛋白检测试剂盒,货号:23227)进行蛋白含量测定。
51.3. 试验结果:本发明的培养工艺对无乳链球菌三种毒力蛋白c5α、lrrg、sip影响的试验结果如表2所示。
52.表2由表2可知,采用本发明实施例1~3的培养工艺培养得到的无乳链球菌中c5α,lrrg,sip种毒力蛋白的表达量较对比例1~3中明显上升,其中实施例2组效果最好,为本发明的最佳实施例。
53.上述实施例仅例示性说明本发明的原理及其功效,而非用于限制本发明。任何熟悉此技术的人士皆可在不违背本发明的精神及范畴下,对上述实施例进行修饰或改变。因此,举凡所属技术领域中具有通常知识者在未脱离本发明所揭示的精神与技术思想下所完成的一切等效修饰或改变,仍应由本发明的权利要求所涵盖。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。