1.本发明属于医药技术和纳米医学技术领域,涉及一种长效缓释的苦杏仁苷脂质体、其制备方法和在化妆品领域的应用。
背景技术:
2.苦杏仁苷是常见的氰苷类物质,也是传统中药苦杏仁中的有效成分,广泛存在于枇杷、杏、桃、杨梅、青梅等植物的种仁中。大量研究表明苦杏仁苷具有止咳平喘、抗肿瘤、免疫调节作用及抗氧化、祛斑美容功效。然而,苦杏仁苷极性大、亲水性强以及油水分配系数小,存在跨膜吸收障碍,极大限制了其在医药及化妆品领域的应用。另外,苦杏仁苷能在β-葡萄糖苷酶的作用下产生夏枯草素和扁桃腈,最终分解成苯甲醛和氢氰酸,这也导致其在应用方面存在一定的争议。研究也显示,苦杏仁苷被酶水解生成的氢氰酸能够抑制体内的活性酪氨酸酶,消除色素沉着、雀斑、黑斑等,从而达到美容功效。因此,在苦杏仁苷合理用量下,通过制剂技术提高其跨膜吸收能力,可以开发其在化妆品应用领域的价值。
3.脂质体是由磷脂和胆固醇为膜材制备的具有脂质双分子层结构的纳米尺度或微米尺度的封闭囊泡。脂质体可同时包载亲水性和亲脂性活性成分,能提高药物的体内外稳定性,降低药物体内清除速度,延长药物作用时间,具有改善药物生物利用度进而增强药理作用等诸多优点。由于脂质体的结构与细胞膜十分相似,因此,该剂型也具有高生物相容性、低毒和低免疫原性的特点,在医药、食品、化妆品具有很大的应用价值。然而对于不同的活性成分,脂质体的载药量和包封率不一。
4.因此,仍需增强苦杏仁苷的脂溶性、提高其跨膜吸收能力,增强其稳定性、降低其细胞毒性、发挥其缓释特性等技术解决方案。
技术实现要素:
5.本公开的发明人经过大量实验,发现了一种缓释长效的苦杏仁苷脂质体的制备方法,可制得高载药量和包封率的苦杏仁苷脂质体,解决其脂溶性差、易氧化等问题,并意外地发现,其还可以降低苦杏仁苷的细胞毒性,并在此基础上完成了本公开。
6.本公开的一个目的是提供一种苦杏仁苷脂质体,从而提高苦杏仁苷脂质体的亲脂性、解决稳定性差的问题。
7.本公开的另一个目的是提供一种苦杏仁苷脂质体的制备方法。
8.本公开的又一个目的是提供所述苦杏仁苷脂质体在制备化妆品中的应用。
9.根据本公开的一个方面,其提供了一种苦杏仁苷脂质体,包括苦杏仁苷和包覆苦杏仁苷的膜材,所述膜材由磷脂和胆固醇双分子层组成。
10.根据本公开的另一个方面,其提供了所述苦杏仁苷脂质体的制备方法,该方法包括以下步骤:
11.s1:将磷脂和胆固醇溶于乙醇中得到中间体溶液,然后将所述中间体溶液滴加到酸性缓冲液中,室温下搅拌过夜;
12.s2:将步骤s1的产物经高压均质、超声或挤压法得到小单室脂质体;
13.s3:称取处方量的苦杏仁苷溶于中性或弱碱性缓冲液中,与步骤s2中的产物在40~80℃下搅拌混合20~60min进行载药;
14.s4:利用超滤法、离心法、透析法或体积排阻色谱法去除游离药物,得到苦杏仁苷脂质体。
15.根据本公开的另一个方面,其提供了使用所述苦杏仁苷脂质体在制备化妆品中的应用。
16.有益效果
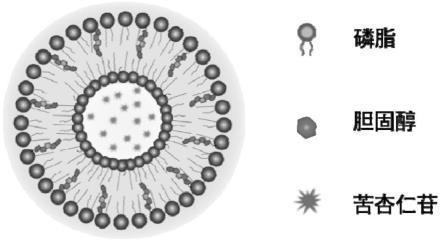
17.本公开通过ph梯度法载药,将苦杏仁苷包载于脂质体的内水相中(如图1所示),明显提高了苦杏仁苷脂质体的包封率,并增加了苦杏仁苷的脂溶性、稳定性,达到增加跨膜吸收、降低细胞毒性、发挥缓释作用的有益效果。
附图说明
18.图1为装载苦杏仁苷的脂质体的结构示意图。
19.图2为苦杏仁苷脂质体的粒径表征图。
20.图3为苦杏仁苷脂质体在4℃及25℃放置30天内脂质体的粒径的图。
21.图4为苦杏仁苷脂质体在4℃及25℃放置30天内脂质体的pdi的图。
22.图5为苦杏仁苷脂质体在4℃及25℃放置30天内脂质体的ζ电位的图。
23.图6为苦杏仁苷脂质体在4℃及25℃放置30天内脂质体的外观的图。
24.图7为苦杏仁苷脂质体的体外释放曲线,表明苦杏仁苷脂质体具有一定的缓释效果。
25.图8为苦杏仁苷脂质体对hs-27人皮肤成纤维细胞的体外毒性考察,横坐标所示药物浓度为苦杏仁苷的浓度,纵坐标为细胞活性。结果表明苦杏仁苷脂质体相比游离药物溶液具有更强的安全性。
具体实施方式
26.为使本领域具有普通知识的人员可了解本发明的特点及效果,以下谨就说明书及申请专利范围中提及的术语及用语进行一般性的说明及定义。除非另有指明,否则文中使用的所有技术及科学上的字词,皆具有本领域技术人员对于本发明所了解的通常意义,当有冲突情形时,应以本说明书的定义为准。
27.在本文中,用语“包含”、“包括”、“具有”、“含有”或其他任何类似用语均属于开放性连接词(open-ended transitional phrase),其意欲涵盖非排他性的包括物。举例而言,含有复数要素的一组合物或制品并不仅限于本文所列出的这些要素而已,而是还可包括未明确列出但却是该组合物或制品通常固有的其他要素。除此之外,除非有相反的明确说明,否则用语“或”是指涵盖性的“或”,而不是指排他性的“或”。例如,以下任何一种情况均满足条件“a或b”:a为真(或存在)且b为伪(或不存在)、a为伪(或不存在)且b为真(或存在)、a和b均为真(或存在)。此外,在本文中,用语“包含”、“包括”、“具有”、“含有”的解读应视为已具体公开并同时涵盖“由
…
所组成”及“实质上由
…
所组成”等封闭式或半封闭式连接词。
28.在本文中,所有以数值范围或百分比范围形式界定的特征或条件仅是为了简洁及
方便。据此,数值范围或百分比范围的描述应视为已涵盖且具体公开所有可能的次级范围及范围内的个别数值,特别是整数数值。举例而言,“1至8”的范围描述应视为已经具体公开如1至7、2至8、2至6、3至6、4至8、3至8等等所有次级范围,特别是由所有整数数值所界定的次级范围,且应视为已经具体公开范围内如1、2、3、4、5、6、7、8等个别数值。除非另有指明,否则前述解释方法适用于本发明全文的所有内容,不论范围广泛与否。
29.若数量或其他数值或参数是以范围、较佳范围或一系列上限与下限表示,则其应理解成是本文已特定公开了由任一对该范围的上限或较佳值与该范围的下限或较佳值构成的所有范围,不论这些范围是否有分别公开。此外,本文中若提到数值的范围时,除非另有说明,否则该范围应包括其端点以及范围内的所有整数与分数。
30.在本文中,在可实现发明目的的前提下,数值应理解成具有该数值有效位数的精确度。举例来说,数字40.0则应理解成涵盖从39.50至40.49的范围。
31.在本文中,对于使用马库什群组(markush group)或选项式用语以描述本发明特征或实例的情形,本领域技术人员应了解马库什群组或选项列表内所有要素的次级群组或任何个别要素亦可用于描述本发明。举例而言,若x描述成“选自于由x1、x2及x3所组成的群组”,亦表示已经完全描述出x为x1的主张与x为x1及/或x2的主张。再者,对于使用马库什群组或选项式用语以描述本发明的特征或实例的情况,本领域技术人员应了解马库什群组或选项列表内所有要素的次级群组或个别要素的任何组合亦可用于描述本发明。据此,举例而言,若x描述成“选自于由x1、x2及x3所组成的群组”,且y描述成“选自于由y1、y2及y3所组成的群组”,则表示已经完全描述出x为x1或x2或x3而y为y1或y2或y3的主张。
32.以下具体实施方式本质上仅是例示性,且并不欲限制本发明及其用途。此外,本文并不受前述现有技术或发明内容或以下具体实施方式或实施例中所描述的任何理论的限制。
33.根据本公开的一个实施方式,其提供了一种苦杏仁苷脂质体,包括苦杏仁苷和包覆苦杏仁苷的膜材,所述膜材由磷脂和胆固醇双分子层组成。
34.根据本公开的苦杏仁苷脂质体明显提高了苦杏仁苷脂质体的包封率,并增加了苦杏仁苷的脂溶性及稳定性。
35.根据本公开的一个实施方式,其中,所述的磷脂包括天然磷脂、半合成磷脂和合成磷脂,优选地,所述磷脂选自大豆卵磷脂(spc)、蛋黄卵磷脂(epc)、氢化大豆卵磷脂(hspc)、磷脂酰胆碱(pc)、磷脂酰甘油(pg)、磷脂酰乙醇胺(pe)中的一种或多种。
36.根据本公开的一个实施方式,其中,所述的磷脂与胆固醇的质量比为1:0.1~1:1,优选为1:0.2~1:0.5。
37.根据本公开的一个实施方式,其中,所述的磷脂与苦杏仁苷的质量比为1:0.02~1:0.2,优选为1:0.05~1:0.1。
38.根据本公开的上述特定种类的磷脂,以及特定的含量比,可以显著降低苦杏仁苷对hs-27人皮肤成纤维细胞的毒性,提高苦杏仁苷的安全性。
39.根据本公开的另一个实施方式,其提供了所述苦杏仁苷脂质体的制备方法,该方法包括以下步骤:
40.s1:将磷脂和胆固醇溶于乙醇中得到中间体溶液,然后将所述中间体溶液滴加到酸性缓冲液中,室温下搅拌过夜;
41.s2:将步骤s1的产物经高压均质、超声或挤压法得到小单室脂质体;
42.s3:称取处方量的苦杏仁苷溶于中性或弱碱性缓冲液中,与步骤s2中的产物在40-80℃下搅拌混合20-60进行载药;
43.s4:利用超滤法、离心法、透析法或体积排阻色谱法去除游离药物,得到苦杏仁苷脂质体。
44.通过上述方法将苦杏仁苷包载于脂质体的内水相中,可以明显提高苦杏仁苷脂质体的包封率,并增加苦杏仁苷的脂溶性及稳定性。
45.根据本公开的一个实施方式,其中,步骤s1中所述的磷脂包括天然磷脂、半合成磷脂和合成磷脂,优选地,所述磷脂选自大豆卵磷脂(spc)、蛋黄卵磷脂(epc)、氢化大豆卵磷脂(hspc)、磷脂酰胆碱(pc)、磷脂酰甘油(pg)、磷脂酰乙醇胺(pe)中的一种或多种,
46.步骤s1中所述的磷脂与胆固醇的质量比为1:0.1~1:1,优选为1:0.2~1:0.5,
47.在步骤s1和s3中所述的磷脂与苦杏仁苷的质量比为1:0.02~1:0.2,优选为1:0.05~1:0.1。
48.根据本公开的一个实施方式,其中,
49.在步骤s1中所述的酸性缓冲液选自磷酸盐缓冲液和柠檬酸盐缓冲液,其ph值为3.0~6.0;优选为4.0~5.0,在步骤s3中所述中性或弱碱性缓冲液选自磷酸盐缓冲液和柠檬酸盐缓冲液,其ph至为7.0~8.5,优选为7.2~8.0。
50.在上述特定的比例和参数的情况下,可以制备出具有更低的细胞毒性的苦杏仁苷,提高苦杏仁苷的安全性。
51.根据本公开的另一个实施方式,其提供了所述苦杏仁苷脂质体在制备化妆品中的应用。
52.本公开所制备的长效释药的苦杏仁苷脂质体一方面利用脂质体膜内外的ph差,使苦杏仁苷药物分子结合并跨越磷脂膜,包埋到的脂质体磷脂双分子层内部,从而显著提高了苦杏仁苷的包封率与载药量,并增加了苦杏仁苷的脂溶性、稳定性、生物利用度及缓释效果,拓展了苦杏仁苷在化妆品领域的应用范围;另一方面意外地发现该脂质体大幅降低了药物的细胞毒性,克服了苦杏仁苷的缺点,使其对皮肤的疗效更加安全可靠,因此,本发明具有极大的医学及化妆品领域应用前景。
53.下面结合具体实例对本发明加以进一步的说明,但是不限制本发明的内容。下列实施实例中未注明具体条件的实验方法,按常规方法和条件操作。
54.实施例1乙醇注入-ph梯度法制备脂质体
55.实施例1苦杏仁苷脂质体的制备方法
56.首先,采用乙醇注入制备空白脂质体,其次,以ph梯度载药法制备苦杏仁苷脂质体,制备的苦杏仁苷脂质体示意图见附图1。具体方法:称取100mg hspc,25mg胆固醇溶于5ml乙醇中;缓缓将磷脂乙醇溶液滴加入ph为4.0的磷酸盐缓冲溶液中,并充分混合,室温下搅拌过夜去除乙醇,在120w条件下冰水浴间歇超声20min,离心除去未包封的磷脂和胆固醇等;称取8mg苦杏仁苷溶于2ml ph为7.0的磷酸盐缓冲液中,将超声后的脂质体悬液在50℃下搅拌60min载药;利用葡聚糖凝胶柱去除游离药物,得到苦杏仁苷脂质体。
57.通过激光粒度仪测量所制备的苦杏仁苷脂质体的粒径为107
±
2.8nm,电位为-3.2
±
1.4mv,hplc法测定苦杏仁苷包封率约为80%,载药量约为4%(质量百分比)。粒径图见附
图2。
58.实施例2苦杏仁苷脂质体的稳定性考察
59.将实施例1制得的苦杏仁苷脂质体置于室温(25℃)和冷藏4℃分别贮存30天,其中于固定时间点取样,评价其外观、粒径、pdi及ζ电位,其结果见附图3至图6。从图中你可以看出,在30天内脂质体的粒径、ζ电位均无明显变化,表明其稳定性良好。
60.实施例3苦杏仁苷脂质体的体外释放测定
61.取实施例1的苦杏仁苷脂质体封装在透析袋中,以皮肤生理条件(ph为6.0)的磷酸盐缓冲溶液作为释放介质,37℃恒温振荡。于固定时间点,取透析袋外液,使用高效液相色谱法测定苦杏仁苷含量,计算累积释放百分率。结果见附图7,在24h,脂质体释放率低于40%,72h后,脂质体释放低于80%。表明苦杏仁苷脂质体在皮肤正常生理ph下呈现一定的缓释特征。
62.实施例4苦杏仁苷脂质体的体外毒性考察
63.取对数期生长的hs-27细胞铺于96孔板中,每孔1
×
104个,加入不同浓度的含药培养基,继续培养72h,加入10μl cck-8试剂,孵育4h后,使用酶标仪分别于450nm及630nm下读取吸光度值,计算ic50值。考察结果见附图8,苦杏仁苷脂质体的ic50是游离苦杏仁苷溶液的1.8倍,表明苦杏仁苷脂质体能够显著降低苦杏仁苷对hs-27细胞的毒性,提高了苦杏仁苷的安全性。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
