二甲双胍及其它含胍化合物在逆转gal-10结晶趋势并缓解相关疾病中应用
技术领域
1.本发明属于生物医药领域,具体涉及含胍化合物在逆转gal-10结晶趋势并缓解相关疾病中应用。
背景技术:
2.人体内各种各样的功能往往都需要不同的蛋白质来完成。这些蛋白质,要么溶解在体液中,要么结合在细胞膜等膜结构上,但却很少有结成晶体的。人类细胞中产生的异常蛋白质晶体通常都具有病理性特征。
3.在1853年,charcot和robin就在一位白血病患者的血液和脾脏中,发现了一种形态多样的晶体沉积,随后的1872年,leyden在哮喘患者的痰中也发现了同样的晶体,这种晶体也被称为charcot-leyden晶体(clcs,夏科-莱登晶体)。夏科-莱登晶体,菱形无色透明指南针样,其两端尖长,大小不等,折光性强,是嗜酸性粒细胞破裂后嗜酸性颗粒相互融合而成。最初clcs被认为是无机物结晶,直到1950年才被确认是由蛋白质结晶组成的。研究显示,clcs中的主要成分是半乳糖凝集素-10(gal-10)。gal-10是一种在嗜酸性粒细胞和嗜碱性粒细胞中十分丰富的蛋白,其形成与嗜酸性粒细胞胞外陷阱的释放密切相关,同时与多种疾病息息相关,所述疾病包括但不限于感染性疾病:化脓性淋巴腺炎、嗜酸性膀胱炎、肝脓肿等,炎症疾病:哮喘、过敏性鼻炎、嗜酸性结肠炎等。这些疾病的治疗通常针对病灶不同有不同的治疗方法,鲜有靶向标志物clcs/gal-10蛋白的治疗药物。
4.目前针对gal-10的靶向调控分子仅有一种人工单克隆抗体,该晶体的单克隆抗体可体外溶解晶体,并且可以抑制clcs引起的小鼠的肺部天然免疫反应。但考虑到单克隆抗体类药物造价高、稳定性差、后续药物运输难、储存条件苛刻等多种较难解决问题,这种药物后续的开发比较困难。
5.相对于单克隆抗体类药物,有机小分子类药物具有结构简单、成药性好、易于工业化生产的优点。寻找调控gal-10组装并抑制其病理作用的小分子至关重要。
技术实现要素:
6.本发明的目的在于筛选靶向clcs的小分子类抑制剂,进而开发能够调控clcs组装、抑制相关炎症的潜在药物。
7.第一方面,本发明提供了含胍化合物在溶解gal-10晶体、制备gal-10晶体相关疾病的药物中的应用。
8.9.优选地,所述含胍化合物由以下通式表示:
10.其中,r1、r2、r3、r4、r5、r6各自独立可以为氢原子或取代基。
11.优选地,所述取代基包括但不限于常见的以下取代基及含有杂原子的所述取代基:烃基、胍基、重氮基、羧基、磺酸基、烃氧羰基、甲酰基、卤甲酰基、氧代基、氨基甲酰基、氰基、酚烃基、酚羟基、醇羟基、氨基、烃氧基、硝基、亚硝基、巯基、氨基、硝基、酰基、硅基、酰基氧基、氧基酰基、二羟硼基、羟氨基、亚硝基、乙硅烷基;所述取代基还可以包括c
1-6
烷基、c
1-6
烷氧基、c
1-6
环烷基、芳基、杂芳基、杂环基、杂环基-(ch2)n-、芳基-c
1-6
烷基-、杂芳基-c
1-6
烷基-、芳基-(ch2)n-o-、杂芳基-(ch2)n-o-、c
3-8
环烷基-c(o)-、杂环基-c(o)-、芳基-c(o)-、或杂芳基-c(o),其中c
1-6
烷基、c
1-6
烷氧基、c
3-8
环烷基、芳基、杂环基-(ch2)n-、芳基-c
1-6
烷基-、杂芳基-c
1-6
烷基-、芳基-(ch2)n-o-、杂芳基-(ch2)n-o-、c
3-8
环烷基-c(o)-、杂环基-c(o)-、芳基-c(o)-。
12.优选地,所述取代基含有碳原子,其碳原子数没有特别限定;
13.优选地,所述取代基含有1~20个碳原子;具体包括1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20个碳原子。
14.优选地,所述烃基包括但不限于甲基(-ch3)、乙基(-c2h5)、丙基(-c3h7)、丁基(-c4h9),戊基(-c5h
11
)。
15.优选地,所述含胍化合物包括二甲双胍、1-甲基胍、1,1-二甲基胍、1,1,3,3-四甲基胍、1-乙基胍、1-苯基双胍、1-(邻甲苯基)双胍,链霉素、西咪替丁。
[0016][0017]
优选地,所述含胍化合物是二甲双胍,所述二甲双胍的结构式如下:
[0018]
优选地,所述含胍化合物是1-甲基胍,所述1-甲基胍的结构式如下:
[0019]
优选地,所述含胍化合物是1,1-二甲基胍,所述1,1-二甲基胍的结构式如下:
[0020]
优选地,所述含胍化合物是1,1,3,3-四甲基胍,所述1,1,3,3-四甲基胍的结构
[0021][0022]
式如下:
[0023]
优选地,所述含胍化合物是1-乙基胍,所述1-乙基胍的结构式如下:
[0024]
优选地,所述含胍化合物是1-苯基双胍,所述1-苯基双胍的结构式如下:
[0025][0026]
优选地,所述含胍化合物是1-(邻甲苯基)双胍,所述1-(邻甲苯基)双胍的结构式
如下:
[0027][0028]
优选地,所述含胍化合物是链霉素,所述链霉素的结构式如下:
[0029]
优选地,所述含胍化合物是西咪替丁,所述西咪替丁的结构式如下:
[0030]
本发明所述术语“gal-10晶体”、“半乳糖凝集素-10”、“夏科-莱登晶体”、“clcs”、“clc晶体”在本文中可互换使用,是指由半乳糖凝集素-10(gal-10)形成的晶体。由半乳糖凝集素-10形成的晶体通常为双锥体六边形晶体,长度为大约20-40μm,宽度为大约2-4μm。术语“gal-10晶体”足够宽泛,可以涵盖人蛋白质和任何物种同源物。
[0031]
本发明所述“溶解gal-10晶体”包括逆转gal-10结晶趋势、降低gal-10的的结晶速度、提高gal-10的溶解速率。
[0032]
优选地,所述gal-10晶体相关疾病包括感染性疾病、炎症疾病。
[0033]
优选地,所述感染性疾病的病原包括细菌、支原体、衣原体、分支杆菌、真菌、病毒和寄生虫等。示例性的,所述感染性疾病包括化脓性淋巴腺炎、嗜酸性膀胱炎、肝脓肿等。
[0034]
优选地,所述炎症包括任何本领域熟知的炎症,如本发明具体实施例所验证的,所述炎症包括clcs(gal-10晶体)刺激后引起il-1β,il-6,tnf-α,ccl-2在基因水平的升高的炎症,具体地,所述炎症例如哮喘、鼻炎、结肠炎等。
[0035]
优选地,所述炎症可以是过敏引起的。
[0036]
优选地,所述结肠炎是嗜酸性结肠炎。
[0037]
另一方面,本发明提供了包含如上所述含胍化合物的药物组合物。
[0038]
更具体地,所述含胍化合物在药物组合物中作为活性成分。
[0039]
本发明所述药物组合物可采用下面的任意方式施用:口服、喷雾吸入、直肠用药、鼻腔用药、颊部用药、非肠道用药,如皮下、静脉、肌内、腹膜内、鞘内、心内室、胸骨内或静脉内给药方式。
[0040]
优选地,所述药物组合物可以为片剂,丸剂,粉剂,颗粒剂,胶囊剂,锭剂,糖浆剂,液体(溶液),乳剂,混悬剂,控制释放制剂,气雾剂,膜剂,注射剂,静脉滴注剂,透皮吸收制剂,软膏剂,洗剂,粘附制剂,栓剂,小药丸,鼻制剂,肺制剂,眼睛滴剂等等,口服或胃肠外制剂。
[0041]
如本发明具体实施例所记载的,所述药物组合物可以是液体,溶剂为pbs(phosphate buffer saline,具体实施例中也写作pbs),所述含胍化合物根据其自身的溶解性可配置成各种浓度的溶液,具体地,所述浓度以摩尔浓度表示。所述液体还可以包括任何药学上可接受的溶剂,所述液体中还可以含有其他药学上常见的成分。
[0042]
如本发明所述pbs是磷酸缓冲盐溶液,通常作为溶剂,起溶解保护试剂的作用,是生物化学研究中使用最为广泛的一种缓冲液,主要成分为na2hpo4、kh2po4、nacl和kcl,由于na2hpo4和kh2po4它们有二级解离,缓冲的ph值范围很广;而nacl和kcl主要作用为增加盐离子浓度。所述pbs的缓冲的ph值范围很广,如本发明所应用的,所述pbs的ph是7.4。
[0043]
优选地,所述药物组合物还包括药学上可接受的载体、稀释剂或赋形剂。
[0044]
优选地,所述药学上可接受的载体、稀释剂或赋形剂包括但不限于已经由美国食品和药品管理局或中国食品药品监督管理局批准可用于人或家畜的任何佐剂、载体、赋形剂、助流剂、甜味剂、稀释剂、防腐剂、染料/着色剂、增味剂、表面活性剂、润湿剂、分散剂、悬浮剂、稳定剂、等渗剂、溶剂、表面活性剂或乳化剂。
[0045]
术语“药学上可接受的”是指当分子本体和组合物适当地给予动物或人时,它们不会产生不利的、过敏的或其它不良反应。
[0046]
另一方面,本发明提供了治疗gal-10晶体相关疾病的方法,所述方法包括向受试者施用本发明所述含胍化合物。
[0047]
优选地,所述gal-10晶体相关疾病包括感染性疾病、炎症疾病。
[0048]
优选地,所述感染性疾病的病原包括细菌、支原体、衣原体、分支杆菌、真菌、病毒和寄生虫等。示例性的,所述感染性疾病包括化脓性淋巴腺炎、嗜酸性膀胱炎、肝脓肿等。
[0049]
优选地,所述炎症包括哮喘、鼻炎、结肠炎等。
[0050]
优选地,所述炎症可以是过敏引起的。
[0051]
优选地,所述结肠炎是嗜酸性结肠炎。
[0052]
优选地,本发明所述受试者包括人或非人动物,所述非人动物,示例性的包括:鼠、猪、牛、马、羊、猴、兔等。
[0053]
优选地,本发明所述受试者是人。
[0054]
如本文所用,“治疗”疾病或病症的方法是指治愈疾病或病症和/或减轻或根除与所述疾病或病症相关的症状,从而减轻患者的痛苦。
[0055]
另一方面,本发明提供了一种溶解gal-10晶体的方法,所述方法包括将gal-10晶体与本发明所述含胍化合物相接触。
[0056]
优选地,所述方法是在体外进行的。
[0057]
优选地,所述方法是非治疗目的的。
[0058]
更具体地,本发明所述溶解gal-10晶体也可以被称为加速gal-10晶体的溶解。
附图说明
[0059]
图1是光镜下不同盐溶液中clc晶体形态变化的检测结果图。
[0060]
图2是不同浓度盐溶液中clc晶体的相对面积随时间变化的统计结果图,a:(ch3)4ncl,b:kcl,c:nacl,d:gdmcl。
[0061]
图3是不同盐溶液中clc晶体溶解的固有起始速率的统计结果图。
[0062]
图4是光镜下不同浓度二甲双胍溶液中clc晶体形态变化的检测结果图。
[0063]
图5是不同浓度西咪替丁中clc晶体的相对面积随时间变化的统计结果图。
[0064]
图6是不同浓度链霉素中clc晶体的相对面积随时间变化的统计结果图。
[0065]
图7是不同浓度二甲双胍中clc晶体的相对面积随时间变化的统计结果图。
[0066]
图8是不同含胍化合物溶液中clc晶体溶解的固有起始速率的统计结果图。(这种不能称之为“盐”)
[0067]
图9是对气管注射处理的小鼠进行il-1β、il-6、tnf-α、ccl-2qpcr的检测结果图,a:il-1β,b:il-6,c:tnf-α,d:ccl-2。
[0068]
图10是对口服给药处理的小鼠进行il-1β、il-6、tnf-α、ccl-2qpcr的检测结果图,a:il-1β,b:il-6,c:tnf-α,d:ccl-2。
[0069]
图11是对气管注射处理的小鼠进行elisa检测il-1β、il-6、tnf-α、ccl-2表达量的结果图,a:il-1β,b:il-6,c:tnf-α,d:ccl-2。
[0070]
图12是对口服给药处理的小鼠进行elisa检测il-1β、il-6、tnf-α、ccl-2表达量的结果图,a:il-1β,b:il-6,c:tnf-α,d:ccl-2。
[0071]
图13是肺组织病理样品染色结果,a:6小时,b:12小时。
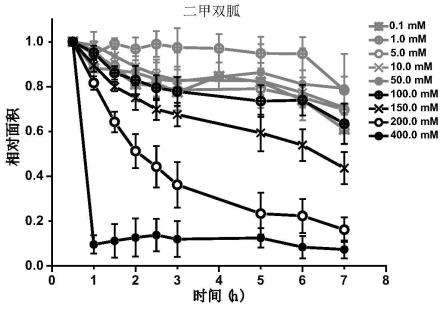
[0072]
图14是不同浓度不同含胍化合物溶液中clc晶体的相对面积随时间变化的统计结果图,a:1-乙基胍,b:1,1-二甲基胍,c:1-甲基胍,d:1,1,3,3-四甲基胍,e:1-苯基双胍,f:1-(邻甲苯基)双胍。
[0073]
图15是不同含胍化合物溶液中clc晶体溶解固有起始速率的统计结果图。
具体实施方式
[0074]
下面结合实施例对本发明做进一步的说明,以下所述,仅是对本发明的较佳实施例而已,并非对本发明做其他形式的限制,任何熟悉本专业的技术人员可能利用上述揭示的技术内容加以变更为同等变化的等效实施例。凡是未脱离本发明方案内容,依据本发明的技术实质对以下实施例所做的任何简单修改或等同变化,均落在本发明的保护范围内。
[0075]
实施例1、clcs的制备及盐溶解clcs的体外表征实验
[0076]
1、实验材料
[0077]
1.1质粒:将gal-10蛋白序列进行人源化密码子优化后,加上其n末端(mastthhhhhdtdipttgggsrpdddddkenlyfqghm)通过ncoi/xhoi双酶切位点克隆到pet-28a载体质粒上形成pet-28a-6his-tev-gal10。
[0078]
1.2试剂材料和仪器设备
[0079]
1.2.1化学试剂:
[0080]
卡那霉素(kanamycin)和氨苄青霉素(ampicillin)购自天根生物技术有限公司;异丙基-β-d-硫代半乳糖苷(isopropyl-beta-d-thiogalactoside,iptg)和大肠杆菌bl21
(de3)购自北京全式金公司;sds、trizol和咪唑购自sigma公司;tev酶购自北京义翘神州有限公司;考马斯亮蓝染液(自制);cdna逆转录试剂购自takara公司;实时荧光定量pcr试剂购自上海罗氏有限公司;elisa试剂盒购自r&d systems公司;nacl购自天津市大茂化学试剂厂;(ch3)4ncl、kcl、gdmcl、kac、kbr、链霉素、西咪替丁、地塞米松、1-甲基胍、1,1,3,3-四甲基胍、1,1-二甲基胍、1-乙基胍、1-苯基双胍、1-(邻甲苯基)双胍均购自上海麦克林生化科技有限公司;depc水,elisa终止液,tmb单组分显色液购于索莱宝公司。
[0081]
1.2.2耗材和仪器设备:
[0082]
ni-nta亲和层析柱购自ge公司;10kda浓缩管购自millipore公司;电热恒温培养箱(xmtd hh.b11-600);立式压力蒸汽灭菌锅(上海博讯,中国);恒温细菌培养箱(上海博讯,中国);pcr仪(biometra tgradient);384孔板实时荧光定量pcr仪(roche 480ⅱ);台式离心机(eppendorf,centrifuge 5415d);电热恒温水箱(shh w21 600);微量紫外分光光度计(nanodrop 2000);电子天平(sartorius 2000s);光学倒置显微镜(xds-1b);微量移液器(eppendorf research plus);-80℃超低温冰箱(sanyo,mdf-382e);高速冷冻离心机(beckman,德国);ph计(thermo orion 868);磁力搅拌器(ika rh-kt/c);超声波破碎仪;pure 25蛋白质纯化系统(superdex75,ge healthcare);sds-page电泳仪(bio-rad);凝胶成像仪(tanon);1ml一次性使用无菌注射器(购于碧迪医疗器械有限公司)。
[0083]
2、实验方法
[0084]
2.1gal10重组蛋白的表达、纯化和clc晶体的制备
[0085]
2.1.1转化:
[0086]
1)将bl21(de3)感受态细胞和pet-28a-6his-tev-gal10重组质粒置于冰上融化;
[0087]
2)取重组质粒0.5μl(0.2μg/μl)加入bl21(de3)感受态细胞中,冰上孵育15-20min;
[0088]
3)42℃水浴热激90s;
[0089]
4)快速置于冰上,冰浴5min;
[0090]
5)加入500μl无抗性lb,于37℃恒温培养箱培养40-50min;
[0091]
6)取40μl菌液,接种于含kanamycin(25μg/ml)的lb固体培养基上,于37℃恒温培养箱培养过夜。
[0092]
2.1.2细菌培养:
[0093]
以kanamycin(25μg/ml)作为选择标记,挑取上步骤中固体培养基上的阳性单克隆bl21(de3)/pet-28a-gal10-tev-6his,接种于20ml含有kanamycin抗性的lb液体培养基,于37℃、210r/min摇床振荡培养8h。将菌液按1:100的比例接种于1l含有kanamycin抗性的lb液体培养基,37℃、210r/min振荡条件下培养。
[0094]
2.1.3目的蛋白的诱导表达和获得:
[0095]
1)当大肠杆菌600nm处的光密度(od600)为0.6-0.8时,加入终浓度为1mm的iptg,28℃、210r/min振荡条件下培养12-16h,诱导目的蛋白表达;
[0096]
2)将过夜表达的细菌培养液富集,6000g、4℃离心20min,弃上清。用缓冲液lysis buffer(50mm nah2po4;300mm nacl ph7.4)重悬,将其集中于一个烧杯中,体积约为60-80ml,按1:100的比例加入pmsf(终浓度为1mm),防止目的蛋白被降解;
[0097]
3)超声破碎细菌:将烧杯置于冰上进行超声,功率25%,工作时间25min,超声开时
间3s,超声关时间9s;
[0098]
4)收集蛋白:离心(4℃、12000g、30min)除去细胞碎片,同时将细胞破碎后释放的核酸打碎,收集上清液,可溶性目的蛋白即存在于上清液中。
[0099]
2.1.4gal-10蛋白的纯化:
[0100]
2.1.4.1ni-nta亲和柱层析:
[0101]
1)平衡ni柱:用lysis buffer穿出ni柱约2-3个柱体积的容量,即可开始洗脱蛋白;
[0102]
2)离心得到的上清上样,穿出ni柱2-3遍;
[0103]
3)用含20mm咪唑和0.1%empigen洗涤剂的lysis buffer洗柱,目的是洗脱杂蛋白;
[0104]
4)用含500mm咪唑的lysis buffer洗柱,使目的蛋白与镍柱去结合;
[0105]
5)浓缩:将步骤(4)洗脱收集的目的蛋白置入10kda浓缩管中,4℃,3000
×
g离心10min,浓缩过程中加入少量lysis buffer或pbs对咪唑进行稀释,防止目的蛋白聚集沉淀。
[0106]
2.1.4.2pure 25蛋白纯化:
[0107]
1)清洗层析柱:使用无菌水对层析柱进行清洗,约清洗8ml。再将泵头放在pbs溶液中,重复上述步骤并执行,约清洗36ml;
[0108]
2)参数:system flow:0.4ml/min;column position:2;alarm delta column pressure enabled:3.0;alarm pre column pressure enabled:5.0;
[0109]
3)上样:先用pbs冲洗上样环2-3次,再将浓缩后大约1.5ml样品打入上样环,最后稍微吸取pbs再打入上样环中,避免样品残留。将收集管摆好,选择inject valve:inject;
[0110]
4)收集:当代表蛋白含量的uv280标识线出现上升时,利用样品自动收集器收集目标蛋白,设置每管的收集量为0.3ml;
[0111]
5)清洗层析柱:待收集完样品后,将泵头置于pbs中,继续运行至通过20ml,替换为无菌水进行清洗,运行10ml,后替换为20%的乙醇溶液运行20ml,即可关机;
[0112]
6)蛋白处理:将收集好的蛋白测出每管浓度并做好标记,置于液氮中速冻,于-80℃冰箱冷冻保存。实验前室温静置缓慢融化。
[0113]
2.1.4.3表达产物的sds-page鉴定:
[0114]
1)样品准备:全菌样品,离心后上清样品,蛋白上清穿出层析柱后样品,20mm咪唑穿出样品,500mm咪唑穿出样品,分子筛中峰头、峰尖和峰尾三处收集的蛋白样品;
[0115]
2)配胶:5%浓缩胶;根据蛋白的大小,选择15%的分离胶;
[0116]
3)制样:2x loading buffer与样品1:1混合;
[0117]
4)上样:全菌样品5μl,marker 3μl,其余样品10μl;
[0118]
5)跑胶:恒压80v跑浓缩胶;恒压120v跑分离胶;
[0119]
6)染色:将蛋白胶置于考马斯亮蓝染液中,微波中高火,2min;
[0120]
7)脱色:将染色完成后的蛋白胶置于自来水中,微波高火,20-40min。
[0121]
2.1.5clc晶体的产生与浓度测定:
[0122]
1)tev酶和pet-28a-gal10-tev-6his重组蛋白按质量比1:10的比例混合,4℃摇床酶切孵育过夜;
[0123]
2)600g、4℃条件下离心10min,离心完成后吸去上清,并加入适量pbs重悬,重复三
次,即得到纯净的clcs;
[0124]
3)6m盐酸胍使clcs去组装,用分光光度计one-drop测clcs浓度。
[0125]
2.2盐溶解clcs的体外表征实验
[0126]
2.2.1使clcs溶于pbs(ph7.4)中,调整浓度使clcs浓度为0.6mg/ml;
[0127]
2.2.2考虑溶解度及安全性等因素,选取(ch3)4ncl,kcl,nacl,gdmcl,kac,kbr六种盐,用pbs配置盐溶液,摩尔浓度为4m,ph7.4;
[0128]
2.2.3将clcs和盐溶液按比例混合,将其分别稀释到工作浓度:
[0129]
1)稀释clcs,工作浓度为0.15mg/ml;
[0130]
2)稀释(ch3)4ncl,摩尔浓度梯度为1.0m,1.5m,2.0m,3.0m;
[0131]
3)稀释kcl,摩尔浓度梯度为1.0m,1.5m,2.0m,3.0m;
[0132]
4)稀释nacl,摩尔浓度梯度为1.0m,1.5m,2.0m,3.0m;
[0133]
5)稀释gdmcl,摩尔浓度梯度为0.2m,0.4m,0.5m,0.6m;
[0134]
2.2.4将混合后的液体滴于晶体板上用光学显微镜进行观察,并每间隔一段时间进行拍照(光镜下不同盐溶液中clc晶体形态变化的检测结果如图1);
[0135]
2.2.5用photoshop处理所得图像,截取相同面积,用imagej对截取面积进行计算,取首个时间点10min所得数据进行归一(不同浓度盐溶液中clc晶体的相对面积随时间变化的统计结果如图2);
[0136]
2.2.6根据r(t)=k
·
a(t)
·
[1-exp(βδμ(c))]求起始反应速率r
int
(不同阴阳离子溶液中clc晶体溶解的固有起始速率的统计结果如图3)。
[0137]
以上实验结果证明gal-10晶体对以上选择的盐离子具有选择性响应,其中gdm
显著溶解gal-10晶体,且溶解gal-10晶体具有时间依赖性。
[0138]
2.3含胍化合物溶解clcs的体外表征实验
[0139]
2.3.1使clcs溶于pbs(ph7.4)中,调整浓度使clcs浓度为0.3mg/ml;
[0140]
2.3.2溶解二甲双胍于pbs缓冲液中,摩尔浓度梯度为0.2mm,2.0mm,10.0mm,20.0mm,100.0mm,200.0mm,300.0mm,400mm,800mm;
[0141]
所述二甲双胍的结构式如下:
[0142][0143]
2.3.3溶解链霉素于pbs缓冲液中,摩尔浓度梯度为0.2mm,2.0mm,10.0mm,20.0mm;
[0144]
所述链霉素的结构式如下:
[0145][0146]
2.3.4溶解西咪替丁于pbs缓冲液中,摩尔浓度梯度为0.2mm,2.0mm,10.0mm,20.0mm;
[0147]
所述西咪替丁的结构式如下:
[0148][0149]
2.3.5将盐溶液与clcs以1:1的体积比混合,滴于晶体板上用光学显微镜进行观察,并每隔一段时间进行拍照;(光镜下不同含胍化合物溶液中clc晶体形态变化的检测结果如图4)
[0150]
2.3.6用photoshop处理所得图像,截取相同面积,用imagej对截取面积进行计算,取首个时间点10min进行归一;(不同含胍化合物溶液中clc晶体的相对面积随时间变化的统计结果如图5-7)
[0151]
2.3.7根据r(t)=k
·
a(t)
·
[1-exp(βδμ(c))]求起始反应速率r
int
。(不同含胍化合物溶液中clc晶体溶解的固有起始速率的统计结果如图8)
[0152]
以上结果显示三种小分子药物中,二甲双胍溶解gal-10晶体的溶解性更好。
[0153]
实施例2、clcs的制备及盐溶解clcs的体外表征实验
[0154]
实验方法
[0155]
1气管注射给药
[0156]
1.1实验动物
[0157]
c57bl/6品系小鼠购于中国食品药品检定研究院实验动物资源研究所。将小鼠(野生型、雄性、6周龄、c57bl/6品系小鼠,体重20
±
2g)随机分为五组,每组6只;并制备以下各组灌注药物:
[0158]
1)pbs(阴性对照),
[0159]
2)clcs(1.5mg/ml),
[0160]
3)二甲双胍(0.45mg/kg),
[0161]
4)clcs加二甲双胍(clcs:1.5mg/ml,二甲双胍:0.45mg/kg),
[0162]
5)clcs加地塞米松(0.5mg/kg)(阳性对照);
[0163]
1.2给药阶段:
[0164]
1)使用无菌注射器向小鼠腹腔注射三溴乙醇麻醉剂,麻醉剂量为:小鼠体重(g)
×
15μl/只,观察小鼠充分麻醉(足挤压反射阴性)后固定小鼠;
[0165]
2)保持小鼠气道竖直,在其颈部腹侧皮肤正中下颌1.5cm处用眼科剪暴露一长度为0.5-0.8cm的纵向切口,使用眼科弯镊沿中线钝性分离皮下组织、结缔组织、颈部肌肉直至充分暴露气管;
[0166]
3)约30
°
倾斜小鼠固定装置,注射器吸取50μl空气后再吸入70μl预先制备好的药物,在气管正中甲状软骨下方使用注射器平行于气管纵轴进针,进针深度约为1cm,保持该位置快速将空气和灌注药物滴注至小鼠气管中;
[0167]
4)操作完成后可观察到小鼠呼吸频率骤然增快,将小鼠固定装置垂直于操作台放置约1min以帮助药物分布;复位小鼠固定装置,使用眼科弯镊按照解剖分层逐层夹合小鼠颈部组织,解除小鼠固定,侧卧位摆放小鼠并观察其状态至其回复自主活动。
[0168]
2口服给药
[0169]
2.1实验动物
[0170]
将小鼠(野生型、雄性、6周龄、c57bl/6品系小鼠,体重20
±
2g)随机分为6组,每组3只;并制备以下各组灌注药物:
[0171]
1)pbs(阴性对照),
[0172]
2)clcs(1.5mg/ml),
[0173]
3)二甲双胍(0.45mg/kg),
[0174]
4)clcs加二甲双胍1
×
(clcs:1.5mg/ml,二甲双胍:0.45mg/kg),
[0175]
5)clcs加二甲双胍3
×
(clcs:1.5mg/ml,二甲双胍:1.35mg/kg),
[0176]
6)clcs加二甲双胍10
×
(clcs:1.5mg/ml,二甲双胍:4.5mg/kg)。
[0177]
2.2给药阶段:
[0178]
抓住小鼠,使其头、颈和身体呈一直线。使用配有灌胃针头的注射器,针头从小鼠嘴角进入,压住舌头,抵住上颚,轻轻向内推进,进入食道后稍微深入并推注药液。
[0179]
3收样阶段:
[0180]
气管注射给药6h和12h后开始收样,口服给药组6h后开始收样。
[0181]
1)使用无菌注射器向小鼠腹腔注射三溴乙醇麻醉剂,麻醉剂量为:小鼠体重(g)
×
15μl/只,观察小鼠充分麻醉(足挤压反射阴性)后牺牲小鼠后固定;
[0182]
2)沿气管滴注切口再次暴露小鼠气管,在甲状软骨下方剪一倒“v”形切口,注意轻柔操作避免离断小鼠气管;
[0183]
3)吸取600μl无菌pbs后移液器平行于气管纵轴在切口处伸入,直至与小鼠气管内壁完全贴合,匀速将pbs经小鼠气管注入小鼠支气管中再匀速回吸,回吸过程中会发现大量气泡,是该操作成功的标志,注入-回吸过程重复4-5次后,将回收液放入1.5ml离心管中,并吹打混匀;
[0184]
4)重复步骤(3),将回收液放入同一1.5ml无菌ep管中,于-80℃保存;
[0185]
5)将小鼠胸腔打开,剪断胸骨,提取心脏剪掉肺组织和胸腔之间的结缔组织和筋膜,取出肺组织后用无菌pbs冲洗,加入1ml trizol裂解并保存于-80℃中。
[0186]
治疗效果检测
[0187]
1、rna的提取和cdna逆转录
[0188]
1.1rna提取:
[0189]
1)将保存在trizol中的裂解液置于冰上缓慢解冻;
[0190]
2)待rna样品完全解冻后,将样品拿到室温放置10min,使rna充分溶解,按照trizol:氯仿=5:1(v/v)的比例加入氯仿,并用力振荡使其充分混匀,室温放置10-15min;
[0191]
3)4℃,12000r/min,离心15min;
[0192]
4)将上层水相转移至新的无rnase的1.5ml离心管中;
[0193]
5)并加入0.6-0.8倍体积预冷的异丙醇,充分混匀,-20℃放置30min以上;
[0194]
6)4℃,12000r/min离心15min,弃上清后可见离心管底部有rna沉淀;
[0195]
7)加入1ml用depc处理过的水或无酶无菌水配置的75%乙醇,温和振荡离心管,使沉淀重悬;
[0196]
8)4℃,12000r/min离心15min,尽量弃上清,重复步骤7-8;
[0197]
9)室温晾干,待75%乙醇蒸发完后即可;
[0198]
10)用depc处理过的水或无酶无菌水溶解rna沉淀;
[0199]
11)取2μl rna样品用微量紫外分光光度计测定rna浓度,并加入适量depc处理过的水或无酶无菌水将rna溶液浓度调至200ng/μl,置于-80℃冻存。
[0200]
1.2rna逆转录成cdna:
[0201]
根据takara公司的cdna reverse transcription kits(cat.no rr036a)的说明书进行cdna的逆转录;
[0202]
1)5
×
primescript rt master mix(perfect real time):2μl
[0203]1×
total rna:0.5μg
[0204]
rnase free dh2o up to 10μl
[0205]
2)轻柔混匀后进行反转录反应,条件如下:
[0206]
37℃15min(反转录反应)
[0207]
85℃5sec(反转录酶的失活反应)
[0208]
4℃短期保存。
[0209]
2、实时荧光定量pcr(rt-qpcr)检测基因表达变化
[0210]
根据480sybr green i master的说明书进行实时荧光定量pcr实验;
[0211]
1)在每个反应体系中加入的工作液如下:
[0212][0213]
2)将工作液加入到384孔板中,并每孔加入1μl上步骤逆转得到的cdna并在384孔板上平整贴好封膜,瞬离90秒;
[0214]
3)将384孔板按照仪器的说明放入到反应托架上,并设置如下的反应程序;
[0215][0216][0217]
4)待反应结束后,使用480软件计算反应溶解曲线(melt curve),观察扩增曲线是否为单一峰以排除非特异性扩增,根据目的基因和内参基因的ct值自动计算出该检测基因的相对表达量,算法为:基因相对表达量值=2
(-(ct目的基因-ct内参基因))
;
[0218]
5)在graphpad prism 8.0软件中作图并进行显著性差异分析。
[0219]
气管注射qpcr结果如图9所示,clcs刺激后引起il-1β,il-6,tnf-α,ccl-2在基因水平的升高,而二甲双胍治疗组可明显降低肺组织中炎症因子的表达,并具有统计学意义。
[0220]
口服给药组qpcr结果如图10所示,clcs刺激后引起il-1β,il-6,tnf-α,ccl-2在基因水平的升高,图为给药6h的检测结果,口服二甲双胍治疗组1
×
可明显降低肺组织中炎症因子的表达,浓度升高后可能由于对细胞的毒性影响,降炎效果没有1
×
好。
[0221]
3、酶联免疫吸附剂测定(elisa)检测蛋白变化
[0222]
3.1包被elisa 96孔板:用无菌pbs按照工作浓度稀释捕获抗体,将稀释后的捕获抗体100μl/孔加入高结合力的96孔酶标板内,用封口膜完全覆盖上表面后,室温过夜孵育;
[0223]
3.2检测过程:
[0224]
1)弃去捕获抗体,每孔加入200μl洗液清洗,弃去洗液并用滤纸吸干残留液体,重复3次;
[0225]
2)每孔加入300μl稀释液(含1%bsa的pbs),室温孵育至少1h;
[0226]
3)弃去稀释液并重复步骤1);
[0227]
4)用新的稀释液配置标准品,每孔分别加入100μl配置好的标准品或者样品,每个样品两个复孔,轻轻摇匀,覆板贴,37℃孵育2h;
[0228]
5)弃去样品并重复步骤1);
[0229]
6)用新的稀释液稀释检测抗体至工作浓度,每孔加入100μl检测抗体工作液,覆板贴,室温孵育2h;
[0230]
7)弃去检测抗体并重复步骤1);
[0231]
8)按1:40的比例将streptavidin-hrp用新的稀释液稀释成工作液浓度,每孔加入100μl,覆板贴,室温避光孵育20min;
[0232]
9)弃去streptavidin-hrp工作液并重复步骤1);
[0233]
10)每孔加入100μl tmb单组分显色液,覆板贴,室温避光孵育10-20min;
[0234]
11)每孔加入50μl显色终止液,震荡混匀后,用全功能微孔板检测仪检测450nm和570nm的od值,并用450nm处od值减去570nm处od值;
[0235]
12)在graphpad prism 8.0软件中作图并进行显著性差异分析。(图11、图12)
[0236]
气管注射elisa结果如图11所示,clcs刺激后引起il-1β,il-6,nf-α,ccl-2在蛋白水平的升高,而二甲双胍治疗组可明显降低支气管肺泡灌洗液中的炎症因子,并具有统计学意义。
[0237]
口服给药组elisa结果如图12所示,clcs刺激后引起il-1β,il-6,tnf-α,ccl-2在蛋白水平的升高,口服二甲双胍治疗组1x可明显降低支气管肺泡灌洗液中的炎症因子。
[0238]
4、气管注射给药组小鼠肺组织病理样品h&e染色
[0239]
4.1气管注射给药组6h和12h以后小心收取小鼠左肺组织(n=3),于pbs中洗净并放入含有8ml多聚甲醛(4%)的10ml管中,然后将其置于室温固定48-72h;
[0240]
4.2脱水、包埋、脱蜡、染色、脱水封片(本步骤工作由武汉塞维尔生物科技有限公司完成)
[0241]
结果如图13,小鼠气管注射二甲双胍后肺组织炎性细胞浸润情况显著缓解。
[0242]
实施例3、构效关系(其他含胍化合物)
[0243]
1、稀释clc晶体至浓度为0.3mg/ml
[0244]
2、溶解1-甲基胍于pbs缓冲液中,摩尔浓度梯度为2mm;20mm;100mm;200mm;400mm。
[0245]
3、溶解1,1,3,3-四甲基胍于pbs缓冲液中,摩尔浓度梯度为0.2mm;1.0mm;4.0;10.0mm。
[0246]
4、溶解1,1-二甲基胍于pbs缓冲液中,摩尔浓度梯度为2mm;20mm;100mm;200mm;400mm。
[0247]
5、溶解1-乙基胍于pbs缓冲液中,摩尔浓度梯度为2mm;20mm;100mm;200mm;400mm。
[0248]
6、溶解1-苯基双胍于pbs缓冲液中,摩尔浓度梯度为0.2mm;2.0mm;4.0mm;10.0mm;20.0mm。
[0249]
7、溶解1-(邻甲苯基)双胍于pbs缓冲液中,摩尔浓度梯度为0.2mm;2.0mm;4.0mm;10.0mm。
[0250]
8、将盐溶液与clc晶体以1:1的体积比混合,于晶体板上观察,并每间隔一段时间进行拍照;
[0251]
9、用photoshop截取相同面积,用imagej对截取面积进行计算,取首个时间点10min进行归一;
[0252]
10、根据r(t)=k
·
a(t)
·
[1-exp(βδμ(c))]求起始反应速率rint。
[0253]
不同浓度不同含胍化合物溶液中clc晶体的相对面积随时间变化的统计结果如图14所示,不同含胍化合物溶液中clc晶体溶解固有起始速率的统计结果如图15所示。
[0254]
以上实验结果证明,非极性官能团的数量与胍离子衍生物溶解gal-10晶体的能力正相关。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。