1.本发明属于生物医药技术领域,涉及一种多肽水凝胶,具体涉及一种抗菌、快速止血并促进伤口愈合的多肽水凝胶。
背景技术:
2.出血和感染都是创伤和手术中常见的问题,在某些情况下甚至会致命。伤口失血过多是导致患者快速死亡的根本原因,因此实现出血口的快速有效止血具有重要的意义。此外,伤口感染是患者生存的第二大挑战,它可能引发一系列不良症状,包括脓毒症、化脓性溃疡和败血性休克。因此,迫切需要制定有效的凝血和抗感染策略,以拯救遭受创伤的患者,尤其是凝血障碍和免疫力低下的患者。尽管使用止血和抗菌生物材料已经取得了许多成功,但开发理想的临床多功能材料以控制出血和预防细菌感染,同时具有良好的生物安全性,仍然是一个挑战。
3.水凝胶具有类似于天然细胞外基质(ecm)的三维聚合物网络,能够吸收和保留大量水,使死亡组织重新水化,并增强自溶性清创作用。水凝胶有助于促进血凝块的形成,并在出血部位形成物理屏障。它还可以用作多种分子的载体,如抗菌剂和生长因子。水凝胶被认为是最合适的促进伤口愈合的生物材料。目前已经出现了两大类用于止血和/或杀菌的水凝胶材料。第一类是由天然聚合物制成的水凝胶,如透明质酸水凝胶(cn104721873a)、壳聚糖水凝胶(cn102675651b)、胶原蛋白水凝胶(cn111072769b)、明胶水凝胶(cn113999405a)和海藻酸钠水凝胶(cn112169015a)。上述天然水凝胶具有固有的生物相容性,但致敏性和批次差异限制了天然聚合物水凝胶的广泛应用。另一类是合成水凝胶,如聚乳酸(cn112451749b)、聚己内酯(cn101525789b)、聚二甘醇(补亚忠.聚乙二醇水凝胶的制备及生物医用[d].中国科学院大学,2018.)等。尽管精确的化学合成提高了聚合材料的可控性,但合成水凝胶仍然受到聚合物降解产生的生物毒性的限制。因此,基于生物材料,开发出安全、多功能、可精确合成水凝胶具有重要的意义。
[0004]
出血和感染是世界范围内各种医疗保健中常见的问题,并导致更高的死亡率,但仍然缺乏理想的多功能材料来控制出血和预防细菌感染,同时具有良好的生物安全性。天然和人工合成的多肽基水凝胶,特别是基于自组装多肽的水凝胶,作为止血材料受到了广泛的关注。各种自组装肽(例如rada
16
、ff8、d-eak16、i3qgk等)得到了广泛的应用。然而,大多数多肽基水凝胶往往缺乏多功能特性,如适当的机械性能和抗菌活性。因此,如何开发出一种具有止血和抗菌性能的水凝胶,实现快速止血、抗菌、促进伤口愈合的多功能应用,且兼具良好生物安全性,对外科止血有着重要价值。
技术实现要素:
[0005]
本发明的目的在于开发出一种具有止血和抗菌性能的水凝胶,实现快速止血、抗菌、促进伤口愈合的多功能应用,且兼具良好生物安全性。
[0006]
基于上述目的,本发明提供了一种抗菌、快速止血并促进伤口愈合的多肽水凝胶
来满足本领域的这种需要。
[0007]
一方面,本发明涉及一种抗菌、快速止血并促进伤口愈合的多肽水凝胶,其包括:酶反应链多肽、钙结合链多肽、cacl2、ce(no3)3;所述酶反应链多肽的氨基酸序列如seq id no.1所示;所述钙结合链多肽的氨基酸序列如seq id no.2所示;所述seq id no.1为:radaradaradarada-ggqqlk;所述seq id no.2为:radaradaradarada-gsvlgyiqir。
[0008]
进一步地,本发明提供的多肽水凝胶中,以质量分数计,所述酶反应链多肽和所述钙结合链多肽的浓度和为1%~7.5%;以质量比计,所述酶反应链多肽和钙结合链多肽的配比为3:1~1:3。
[0009]
进一步地,本发明提供的多肽水凝胶中,其特征在于,所述多肽水凝胶中cacl2的浓度为0.05~0.15mg/ml。
[0010]
进一步地,本发明提供的多肽水凝胶中,其特征在于,所述多肽水凝胶中ce(no3)3的浓度为0.2~0.4mg/ml。
[0011]
进一步地,本发明提供的多肽水凝胶中,所述多肽水凝胶的ph值为6.5~7.8。
[0012]
本发明实现了两种自组装多肽以及稀土元素的有效复合,得到了一种抗菌、快速止血并促进伤口愈合的多肽水凝胶。该水凝胶在体外抗菌试验、大鼠足部损伤感染试验、大鼠断尾试验、大鼠全层皮肤伤口感染试验和细胞毒性测试中均表现出优异的抗菌、快速止血并促进伤口愈合的功能。由此,本发明进一步请求保护一种水凝胶、一种医用敷料、一种抗菌、快速止血并促进伤口愈合的敷料、一种创可贴、一种创面注射剂。
[0013]
本发明与现有技术相比具有以下有益效果或者优点:
[0014]
本发明提供了一种抗菌、快速止血并促进伤口愈合的多肽水凝胶。所述水凝胶显示出优越的微孔结构和良好的剪切变稀特性,以及可注射性;所述水凝胶表现出较低的凝血指数,显著缩短了凝血时间和减少了出血量;所述水凝胶能阻止细菌感染,促进伤口愈合,减少炎症反应;所述水凝胶具有高度的血液相容性,并且没有细胞毒性。
附图说明
[0015]
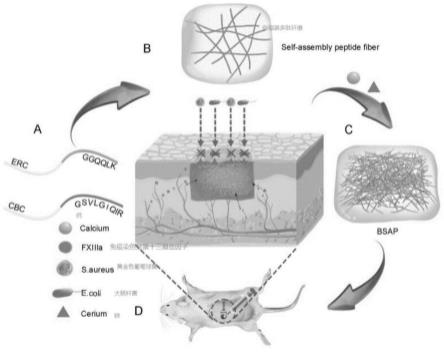
图1为本发明的原理表示、形成过程及功能演示图;a为肽链结构图:钙结合链(cbc)和酶反应链(erc);b为由(rada)4共轭形成的稀疏的纳米纤维骨干;c为多肽水凝胶具有紧密纠缠的网状纳米纤维网络,该网络由响应钙离子cbc的功能基序形成,钙和稀土元素铈结合在纳米纤维上;d为在伤口上一种抗菌、快速止血并促进伤口愈合的多肽水凝胶(bsap)的作用原理图:止血、抗菌。
[0016]
图2为一种抗菌、快速止血并促进伤口愈合的多肽水凝胶的微观结构和物理化学性质;a为不同浓度三个交联阶段多肽水凝胶的sem图像,比例尺:20μm;b为三阶段多肽水凝胶的纳米纤维tem图像,比例尺:100nm;c为三阶段多肽水凝胶的凝胶化摄影;d为凝胶化在600nm吸光度下量化;e为剪切速率范围为0.01s-1~100s-1的多肽水凝胶的粘度-剪切速率曲线-1
;f为bsap水凝胶在1%~1000%应变周期性交替时的剪切恢复性能。
[0017]
图3为一种抗菌、快速止血并促进伤口愈合的多肽水凝胶的止血性能;a为bsap水凝胶与全血结合的血凝块的扫描电镜,红细胞和变形的血小板聚集在一起形成致密的结构;b为bsap水凝胶和对照(全血、明胶、壳聚糖)基于时间的凝血指数(bci)(n=4),血液溶液在600nm处测量;c为大鼠足部创伤模型建立示意图;d为出血照片;e为bsap水凝胶在大鼠
足部创伤模型中的止血能力;f为大鼠断尾模型建立示意图;g为bsap水凝胶在大鼠断尾模型中的出血照片;h为止血能力(出血量和止血时间)。
[0018]
图4为实施例1~4制得的多肽水凝胶与常规凝血材料的凝血指数对比结果;basp1~basp4对应实施例1~4制得的多肽水凝胶。
[0019]
图5为一种抗菌、快速止血并促进伤口愈合的多肽水凝胶的抗菌性能;a为bsap水凝胶对大肠杆菌在细菌感染过程中粘附于huvec细胞的影响,粘附在细胞膜上的细菌菌落计数(1/1000稀释);b为bsap水凝胶对细菌感染过程中金黄色葡萄球菌粘附于huvec细胞的影响,粘附在细胞膜上的金黄色葡萄球菌菌落计数(1/100稀释);c为皮肤全层伤口感染模型建立示意图;d为用bsap水凝胶处理的感染伤口的代表性伤口照片;e为全层皮肤创面感染模型造模处理后第1天白细胞(wbc)计数;f为全层皮肤创面感染模型造模处理后中性粒细胞(neut)计数;g为造模后第14天创面愈合(比例尺:200nm)和炎症(比例尺:20μm)皮肤h&e染色组织学切片。
[0020]
图6为实施例1~4制得的basp水凝胶抗菌效果;basp1~basp4对应实施例1~4制得的多肽水凝胶。
[0021]
图7为一种抗菌、快速止血并促进伤口愈合的多肽水凝胶的生物毒性评价;a为0.075%、0.050%、0.025%、0%bsap对aml12的时间依赖性细胞毒活性;b为0.075%、0.050%、0.025%、0%bsap对huvec的时间依赖性细胞毒活性;c为全层皮肤创面模型bsap水凝胶处理后第14天脾、肺、小肠、胰腺、肾、肝组织切片经和未经bsap水凝胶处理的代表性组织学h&e染色图像,比例尺为100μm;d为全层皮肤创面模型(无感染)bsap水凝胶处理后第3天血常规分析;e为全层皮肤创面模型(无感染)bsap水凝胶处理后第3天的生化指标分析。
[0022]
图8为实施例1~4制得的多肽水凝胶促进伤口愈合效果;basp1~basp4对应实施例1~4制得的多肽水凝胶;大肠杆菌或金黄色葡萄球菌感染并用bsap水凝胶治疗的大鼠足部创伤模型的代表性伤口照片;“配对正常”是指左脚没有任何治疗,对应于一只大鼠的手术和治疗的右脚。
[0023]
bsap水凝胶为一种抗菌、快速止血并促进伤口愈合的多肽水凝胶的简称。上述图中每个数据以平均值
±
标准差表示,如果没有特别说明,每个实验重复三次(n=3)。统计显著性分析中,student-t检验依据:*p《0.05,**p《0.01,***p《0.001,****p《0.0001的概率,显示统计学显著性水平。
具体实施方式
[0024]
下面,结合实施例对本发明的技术方案进行说明,但是,本发明并不限于下述的实施例。
[0025]
实施例1
[0026]
本实施例提供了一种抗菌、快速止血并促进伤口愈合的多肽水凝胶(bsap)的制备。
[0027]
酶反应链多肽(erc)和钙结合链多肽(cbc)使用cs生物336x自动多肽合成仪,采用以fmoc-chemistry spps的hbtu/hobt步骤为基础开发的hbtu活化/diea原位中和步骤,以树脂为原料合成制得。
[0028]
以质量比计,将合成的erc和cbc按3:1的比例溶解于0.1mg/ml cacl2的去离子水
中,然后在室温下制备100mg包含0.1mg/ml cacl2和0.4mg/ml ce(no3)3的水凝胶,该水凝胶中以质量分数计,所述erc和cbc的浓度和为1%。然后将ph调整为7。
[0029]
实施例2
[0030]
本实施例提供了一种抗菌、快速止血并促进伤口愈合的多肽水凝胶的制备。
[0031]
本实施例的制备过程同实施例1,区别在于,该多肽水凝胶中,以质量分数计,erc和cbc的浓度和为2.5%;以质量比计,erc和cbc的配比为3:1;cacl2浓度为0.05mg/ml;ce(no3)3浓度为0.2mg/ml;ph调整为6.5。
[0032]
实施例3
[0033]
本实施例提供了一种抗菌、快速止血并促进伤口愈合的多肽水凝胶的制备。
[0034]
本实施例的制备过程同实施例1,区别在于,该多肽水凝胶中,以质量分数计,erc和cbc的浓度和为5%;以质量比计,erc和cbc的配比为1:1;cacl2浓度为0.1mg/ml;ce(no3)3浓度为0.3mg/ml;ph调整为7。
[0035]
实施例4
[0036]
本实施例提供了一种抗菌、快速止血并促进伤口愈合的多肽水凝胶的制备。
[0037]
本实施例的制备过程同实施例1,区别在于,该多肽水凝胶中,以质量分数计,erc和cbc的浓度和为7.5%;以质量比计,erc和cbc的配比为1:3;cacl2浓度为0.15mg/ml;ce(no3)3浓度为0.4mg/ml;ph调整为7.8。
[0038]
实施例5
[0039]
本实施例提供了一种抗菌、快速止血并促进伤口愈合的多肽水凝胶(简称:bsap水凝胶)的凝胶化分析、形态特征观察和流变分析。
[0040]
分别取实施例1~4制得的多肽水凝胶,用微孔分光光度计(epoch,biotek)检测到600nm处的吸光度代表凝胶密度。交联过程中,将多肽水凝胶浸泡在fxiiia(solarbio)中,37℃孵育12h,以获得更好的交联效果。
[0041]
分别冻干实施例1~4制得的多肽水凝胶,喷涂8nm的铂金后利用扫描电镜(hitachi s-4800)观察样品微观形态,元素分析使用扫描电镜能谱测量。此外,利用透射电镜(tem,tecnai g2 spirit、fei)对多肽水凝胶的微观结构进行进一步观察。将10μl 0.025%的多肽水凝胶溶液滴在碳膜铜栅网上制备样品,用2%磷钨酸溶液对样品进行染色后于透射电镜下进行观察。
[0042]
使用ta公司的discovery hr-2混合流变仪测量多肽水凝胶的流变特性。所有测量均在25℃下用间隙为1000μm、直径为40mm的平行平板进行。为了评估水凝胶的剪切减薄行为,将粘度记录为剪切速率的函数,剪切速率从0.01s-1上升到100s-1。为了评估自修复行为,采用三个交替的步进应变循环(1%60秒,1000%60秒)测量g'和g
″
。
[0043]
凝胶化分析、形态特征观察和流变分析试验结果如图2所示。
[0044]
由图2可得bsap水凝胶的形成经历了三个主要阶段。第一阶段的自组装是基于自组装的核心——rada基序,cbc和erc基于rada基序自组装成稀疏的纳米纤维。在图2a和图2b的sem和tem图像中可以进一步观察到这一过程。在第二阶段的自组装过程中,原本稀疏的肽纳米纤维在ca
2
的催化下进一步交联成缠绕紧密的纳米纤维,也就是形成了凝胶。同时,加入的稀土元素铈(ce
3
)进一步赋予止血水凝胶抗菌能力(图1)。在第三阶段反应中,erc纤维周围的功能基序ggqqlk通过凝血因子xiiia介导的酰基转移反应进一步介导了多
肽链之间的交联,使之形成致密的结构(图2a、2b)。bsap水凝胶与血液接触时也能观察到类似的现象,进一步证实了bsap的止血作用(图3a)。
[0045]
在凝胶化分析中,本实施例测试了不同浓度下不同阶段bsap的吸光值——它反映了凝胶密度。各阶段对应的增加值也证明了ca
2
和fxiiia的存在介导的交联(图2c)。同时,bsap水凝胶对钙的反应更加敏感,到凝胶密度为5%时,水凝胶转变为固态(图2c),吸收值增加(图2d)。此外,如图2的扫描电镜图像所示,在阶段ii中当水凝胶密度为5%时,结构的平均孔隙是20μm,这被认为是红血球和血小板吸附和运输最合适的孔径,因此最适于止血。
[0046]
为了进一步研究bsap水凝胶的力学性能,本实施例通过流变试验给出了水凝胶的粘度剪速率分布和剪切恢复率。从图2e的粘度剪速率剖面可以看出,bsap水凝胶的剪切变薄反应较强,说明随着剪切速率的增加,固态bsap水凝胶会转变为液态凝胶,这提高了bsap对各种形状伤口的适应性。本实施例还发现,在钙和fxiiia的条件下,bsap黏度增加,表现为三级交联。此外,剪切和恢复实验还发现bsap水凝胶具有良好的自愈合性能,进一步表明bsap水凝胶具有注射能力。总之,bsap水凝胶具有止血和抗菌的合适结构基础。
[0047]
实施例6
[0048]
本实施例提供了一种抗菌、快速止血并促进伤口愈合的多肽水凝胶(简称:bsap水凝胶)的促凝作用。
[0049]
本实施例通过测定血液凝血指数(bci)来评估bsap水凝胶的促凝作用。在新鲜采集的柠檬酸钠血液加入0.2m的氯化钙制备复钙全血。实验组将50μl复钙全血加入等体积的bsap水凝胶(分别为实施例1~4制得的多肽水凝胶)中。37℃孵育0、30、60、90、120、150、180、210秒后,每个平皿中用5ml去离子水冲洗,并立即将液体除去。明胶海绵、止血粉和复钙全血(50μl)作为对照,进行相同处理。在600nm吸光度下测定各组上清液的od值。bci量化为公式:
[0050][0051]
式中at为样品的吸光度,ar为参比品(50μl再钙全血加5ml去离子水)的吸光度,ac为去离子水的吸光度。
[0052]
由于实施例1~4制得的多肽水凝胶的止血原理相近,由此图3展示的为实施例3制得的多肽水凝胶的试验结果。
[0053]
如图3b所示,在bsap水凝胶条件下,凝血过程在60~90秒接近完成,与阴性对照(全血)的凝血时间180~210秒形成鲜明对比。此外,bsap的促凝活性也优于阳性对照(明胶和壳聚糖)。这些结果表明bsap水凝胶具有良好的止血效果。为了解bsap水凝胶与血液的反应,将bsap水凝胶注入新鲜全血,用扫描电子显微镜(sem)观察血凝块的表面形态。可以看到大量的血细胞,包括红细胞(rbc)和变形的血小板,粘附和聚集在bsap上(图3a)。bsap凝胶在与血液接触后形成致密结构,在出血部位形成致密的物理屏障,防止进一步出血。
[0054]
图4为实施例1~4制得的多肽水凝胶的basp水凝胶与常规凝血材料的凝血指数对比结果。basp1~basp4对应实施例1~4制得的多肽水凝胶。由图4可得,bsap具有良好的止血能力,而且相对明胶或壳聚糖等常规止血生物材料止血速度快。
[0055]
实施例7
[0056]
本实施例提供了一种抗菌、快速止血并促进伤口愈合的多肽水凝胶(简称:bsap水
凝胶)的体外抗菌试验。
[0057]
本实施例中使用的大肠杆菌(e.coli,atcc 25922)和金黄色葡萄球菌(s.aureus,atcc 25923)在lb肉汤中培养过夜。采用比浊法将细菌浓度调节至对应浓度,用于体外粘附实验和创面感染模型。
[0058]
在抗菌实验前,bsap水凝胶样品在紫外灯下消毒15分钟。测定前一天,将购自中国科学院上海细胞库的人脐静脉内皮细胞(huvecs)细胞株按1
×
105细胞/孔的密度接种于24孔板中在5%co2和37℃的培养环境中进行培养。次日,将bsap添加到实验组细胞的上方。然后在感染数为100(moi=100)时,将指数中期的细菌(大肠杆菌或金黄色葡萄球菌)加入到细胞中。孵育0、1、3、5、7小时后,去除上清和bsap,0.1%tritonx100/h2o裂解细胞轻洗后收集附着在细胞上的活菌。收集裂解液,用lb肉汤稀释计数cfu,cfu反映细菌对细胞的粘附数量。
[0059]
由于实施例1~4制得的多肽水凝胶的抗菌原理相近,由此图5展示的为实施例3制得的多肽水凝胶的试验结果。在体外实验中,当大肠杆菌和金黄色葡萄球菌感染huvecs时,使用bsap水凝胶来阻止其入侵。然后计算不同时间点粘附在细胞上的细菌数量,评价bsap水凝胶对细菌入侵的抑制能力。如图5a所示,孵育3小时后大量大肠杆菌粘附于huvecs,而bsap组在孵育7小时后才检测到大肠杆菌。金黄色葡萄球菌感染组也出现类似现象(图5b)。这些结果表明bsap具有显著的体外抗菌能力。
[0060]
图6为实施例1~4制得的多肽水凝胶的抗菌效果;basp1~basp4对应实施例1~4制得的多肽水凝胶。由图6可知,实施例1~4制得的多肽水凝胶的basp水凝胶在0~5h内,对大肠杆菌和金黄色葡萄球菌均表现出极为优秀的抗菌效果。在第7h时,实施例2制得的多肽水凝胶的抗菌效果减弱最大,实施例1制得的多肽水凝胶和实施例3制得的多肽水凝胶抗菌效果变低,实施例4制得的多肽水凝胶依然保持着优秀的抗菌效果。
[0061]
实施例7
[0062]
本实施例提供了一种抗菌、快速止血并促进伤口愈合的多肽水凝胶(简称:bsap水凝胶)的体内试验。
[0063]
所有实验均按照第四军医大学医学伦理委员会批准的动物实验准则委员会认可的伦理标准和规程进行。实验动物(雄性sprague-dawley大鼠200g)购自第四军医大学实验动物中心。建立大鼠足部创伤模型、断尾模型和全层皮肤创面模型,所有实验均在异氟烷(r510-22,veteasy)全身麻下进行。
[0064]
(1)大鼠足部损伤感染模型
[0065]
麻醉大鼠俯卧位,固定在无菌手术台上。将预称好的滤纸置于大鼠右脚下方,用70%酒精消毒。用手术刀沿大鼠脚垫纵向切开约1cm的皮肤,制造出血伤口。大鼠足底切开后,立即用200μl的bsap水凝胶处理创面。在伤口充分止血后测量滤纸的重量变化,同时记录出血时间。感染组:用basp水凝胶处理创面(对照组不处理)后将1
×
10
10
大肠杆菌或1
×
10
10
金黄色葡萄球菌加到创面上。实验结束后,用医用外科无菌敷料覆盖并固定脚垫表面。术后第3天监测创面愈合情况,取创面处足垫皮进行组织学观察。
[0066]
(2)大鼠断尾模型
[0067]
如上所述,麻醉后将大鼠置于俯卧位,固定在无菌手术台上。用70%酒精对大鼠全尾消毒。将预称量好的滤纸置于尾部下方,用手术刀将尾部尾部(8cm)横切。治疗组大鼠断
尾后立即用200μl bsap水凝胶处理创面。同样,记录创面充分止血后滤纸的重量增加情况,同时记录出血时间。术后用无菌敷料覆盖创面,术后第3天观察。
[0068]
(3)全层皮肤伤口感染模型
[0069]
实验前一天,将老鼠背部皮肤表面的毛发剃掉。实验过程中,麻醉大鼠俯卧位固定。实验部位皮肤用70%酒精消毒。用皮肤穿孔器和手术钳切除大鼠背部中线左侧的表皮和真皮,形成直径为8毫米的圆形切口。治疗组创面涂布bsap水凝胶200μl。感染组:用basp水凝胶处理创面(对照组不处理)后将1
×
10
10
大肠杆菌或1
×
10
10
金黄色葡萄球菌加到创面上。然后用医用外科无菌敷料覆盖伤口。此后,用无菌生理盐水擦拭创面,每3天更换一次敷料。在固定时间点观察创面愈合情况并拍照。造模及治疗后第1天(进行血常规检测及酶联免疫吸附试验)和第3天(进行血常规及血液生化检查)取麻醉大鼠后静脉血样。造模2周后取大鼠背部皮肤样品,4%多聚甲醛固定。
[0070]
(4)血常规、血生化检查
[0071]
全血用于常规血液检查,由自动血液分析仪(bc-2800vet,迈瑞)进行分析。在6000g离心10分钟后,从全血样本中分离血清进行血液生化检查,由自动生化分析仪(chemray 800)根据相应试剂盒(kayto)的说明进行评估。
[0072]
(5)酶联免疫吸附试验
[0073]
建立全层皮肤创面感染模型及处理后第1天采集血清进行elisa检测。根据厂家说明书(江莱生物),用elisa法测定血清中il-6和tnfα的含量。
[0074]
(6)hematoxylin-eosin染色
[0075]
对石蜡包埋组织片(40μm)进行苏木精和伊红染色,进行组织学分析。使用显微镜观察扫描所有切片(ix53,olympus,japan)。
[0076]
由于实施例1~4制得的多肽水凝胶的止血原理相同,由此图3展示的为实施例3制得的多肽水凝胶的动物止血试验结果。
[0077]
如图3所示,在大鼠足部创伤模型和断尾模型中,通过测量出血量和止血时间来评估bsap水凝胶的止血性能。在大鼠足部创伤模型中(图3c~图3e),在创建1cm长的切口时立即注射bsap水凝胶。如图3d和3e所示,与对照组相比,水凝胶在数秒内迅速止血,滤纸上没有积血。建模2天后,bsap水凝胶包扎的创面较对照组创面修复更好。在大鼠断尾模型中也可以观察到类似的结果,尽管断尾模型出血更严重,bsap水凝胶也显著减少了出血时间和出血量(图3f~h)。
[0078]
图5为一种抗菌、快速止血并促进伤口愈合的多肽水凝胶的抗菌性能,由于实施例1~4制得的多肽水凝胶的抑菌原理相同,由此图5展示的为实施例3制得的多肽水凝胶的动物试验结果。如图5所示,在bsap水凝胶能有效减少细菌对细胞的感染的体外实验结果的基础上,利用全层皮肤伤口感染模型进一步证明其对伤口的影响。图5c展示了水凝胶置于大鼠背部8mm
×
8mm全层感染创面内。如图5d所示,伤口部位随时间逐渐闭合,至第14天几乎完全闭合。但感染创面愈合速度较慢,尤其是金黄色葡萄球菌感染组,出现红肿,表现为严重炎症。相比之下,bsap水凝胶的加入显著降低了细菌引起的炎症反应,并加快了伤口愈合的速度。血液检测显示,与对照组相比,bsap组白细胞(wbc)和中性粒细胞(neut)水平降低,进一步证明了bsap水凝胶的抗菌能力(图5e、图5f)。
[0079]
此外,酶联免疫吸附试验(elisa)结果显示,bsap治疗后血清中il-6、tnf-α水平显
著降低,进一步证实bsap有效阻断了细菌侵袭引起的感染。另外,在第14天,h&e染色的组织学图像显示,与对照组和感染组相比,bsap处理组肉芽组织、形成表皮组织和毛囊更多,炎症细胞较少(图5g),说明basp水凝胶具有良好的创面愈合功能。图5结果说明bsap水凝胶能有效地保护创面免受细菌感染,促进创面愈合。在这个过程中,水凝胶作为一个物理屏障,防止污染和潜在的感染伤口。更重要的是,负载在水凝胶中的抗菌成分铈可以有效杀灭细菌,这可能是由于铈的电子空穴分离和产生活性氧,进一步阻止细菌攻击伤口。这将为伤口创造一个合适的愈合环境。
[0080]
实施例8
[0081]
本实施例提供了一种抗菌、快速止血并促进伤口愈合的多肽水凝胶(简称:bsap水凝胶)的毒性分析。
[0082]
采用来自中国科学院上海细胞库的aml12和huvecs细胞株评价bsap水凝胶的体外细胞毒性。简单地说,将细胞接种在96孔板中(每孔1000个细胞),并在相应的生长培养基中培养24h。然后分别用含浓度为0%、0.025%(由实施例2制得的bsap水凝胶稀释得到)、0.05%(由实施例3制得的bsap水凝胶稀释得到)、0.075%(由实施例4制得的bsap水凝胶稀释得到)的bsap水凝胶的新鲜培养基液替代基础培养基。每天更换配套的培养基。然后在第0、1、2、3、5、7天用cck8试剂检测细胞活力。用elisa仪在450nm波长下测定各孔的吸光度。将aml12细胞分别在含0.075%bsap的新鲜培养基和新鲜培养基中培养。此外,本实施例还将aml12细胞接种到5%bsap上,并在合适的培养基中培养。24h后加入4μmcalcein-am和1.5μm pi工作液,37℃孵育45min。然后,在荧光显微镜(leica,wentzler,germany)下观察带有样品的孔。
[0083]
由于实施例1~4制得的多肽水凝胶的原料构成相同,由此图7展示的为实施例3制得的多肽水凝胶的生物毒性试验结果。
[0084]
图7结果显示,bsap溶液中细胞的生长趋势与原始培养基中细胞的生长趋势相当(图7a和图7b)。在含bsap的培养基条件下,aml12细胞保持了较高的活力。此外,aml12细胞也能以高活力状态粘附在bsap水凝胶上。这些结果表明bsap水凝胶具有良好的细胞相容性。为了确定bsap水凝胶是否对宿主器官造成毒性,我们在全层皮肤伤口感染模型中采集bsap水凝胶治疗后第3天的大鼠主要器官和血浆,进行组织学评价和生物化学检测。如图7c~图7e所示,与对照组相比,bsap治疗组的器官病理、血常规和生化指标均无明显变化,提示不存在对器官和血液的一般或急性毒性风险。结果表明,bsap水凝胶具有良好的生物相容性。
[0085]
图8为实施例1~4制得的多肽水凝胶促进伤口愈合效果;basp1~basp4对应实施例1~4制得的多肽水凝胶;大肠杆菌或金黄色葡萄球菌感染并用bsap水凝胶治疗的大鼠足部创伤模型的代表性伤口照片;“配对正常”是指左脚没有任何治疗,对应于一只大鼠的手术和治疗的右脚。由图8可得,应用本发明提供的多肽水凝胶能有效促进伤口愈合,且即使采用大肠杆菌或金黄色葡萄球菌感染,也能表现出优异的促进伤口愈合效果。
[0086]
如上所述,即可较好地实现本发明,上述的实施例仅仅是对本发明的优选实施方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出的各种改变和改进,均应落入本发明确定的保护范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。