1.本发明属于生物催化合成技术领域,尤其涉及一种双功能血红素蛋白催化非天然氨基酸衍生物的方法。
背景技术:
2.α-氨基酸被广泛用于合成肽和蛋白质,这些肽和蛋白质存在于大量的天然生物体中。α-氨基酸在有机合成中也被用作合成中间体,并作为功能结构基序出现。尽管天然α-氨基酸仍然具有重要的作用,但对天然氨基酸进行修饰可以显著提高其生物活性和药代动力学。直接引入非天然氨基酸或者对肽或蛋白质中的天然残基进行修饰是药物开发中最重要的策略。其在诸多药物中,比如左乙拉西坦,培哚普利和阿扎那韦等,均是重要的母核结构。
3.甘氨酸是自然界最简单的氨基酸,对甘氨酸及其衍生物进行c(sp3)-h烷基化可以提供一种直接而有效的方法来构造非天然氨基酸。目前也有多种基于此方法的报道,例如:铜或碘化铵催化下,利用可见光诱导nhpi的氧化还原活性酯脱羧c(sp3)-h烷基化反应。或者利用katritzky盐作为亲电试剂,在可见光照射下将甘氨酸衍生物或多肽烷基化。最近,也有利用烷基硼酸在ru/cu光催化剂体系在在蓝色led照射下下产生烷基自由基从而通过烷基化反应生成非天然氨基酸的衍生物。除此之外,也有在氧气气氛下,使用在二氯乙烷为溶剂,加热至100℃,用三氟乙酸为添加剂实现了甘氨酸衍生物与脂肪族硼酸的c(sp3)-h 烷基化反应。尽管取得了这些进展,但由于底物(如nhpi氧化还原酯酯和katritzky 盐)难以制备、非原子经济、条件恶劣和有毒溶剂限制了这些方法的实际应用。因此,利用廉价易得的底物、温和的条件和环境友好的溶剂来实现非天然氨基酸的构建对于我们仍有极大的吸引力,亟待深入解决。
4.生物催化技术是一种用于功能性有机分子合成的可持续和环境友好的重要策略。随着酶催化技术的提出,使酶催化许多非自然反应成为可能。普遍存在的血红素蛋白使用铁血红素复合物作为其催化辅因子,并在生物体内执行多种功能。但是,不管是化学催化还是生物催化,都依然存在技术瓶颈,且目前不管是酶的种类数量还是催化性能都不能满足目前非天然氨基酸高效且经济性的制备需求。
技术实现要素:
5.本发明实施例的目的在于提供一种双功能血红素蛋白催化非天然氨基酸衍生物的方法,旨在解决在非天然氨基酸的构建中,不管是化学催化还是生物催化,都依然存在技术瓶颈,且目前不管是酶的种类数量还是催化性能都不能满足目前非天然氨基酸高效且经济性的制备需求的问题。
6.本发明实施例是这样实现的,一种双功能血红素蛋白催化非天然氨基酸衍生物的方法,包括以下步骤:
7.步骤1:通过第53位定点饱和突变和全序列易错pcr诱变技术改造vhb的基因,所述vhb的基因序列如seq id no.1所示;
8.步骤2:根据特定的改造目的,经过多轮随机突变,筛选出有价值的高效催化合成非天然氨基酸的vhb突变体;
9.步骤3:将筛选出的vhb突变体应用于催化级联反应合成非天然氨基酸。
10.进一步的技术方案,在步骤1中,所述第53位定点饱和突变以构建在puc19 质粒上的vhb基因为模板,设计引物将谷氨酰胺突变为其他19种氨基酸,筛选得到最佳突变体,命名为vhb df1,其将seq id no.1所示的氨基酸残基第53位的谷氨酰胺突变为组氨酸。
11.进一步的技术方案,在步骤1中,通过易错pcr诱导vhb df1随机突变,构建突变体文库,并利用高效液相色谱筛选出催化非天然氨基酸高产率合成的突变体vhb df2,突变体vhb df2具体的突变位点为第62位亮氨酸突变成色氨酸。
12.进一步的技术方案,在步骤2中,在突变体vhb df2基础之上进行第二轮定向进化,筛选出突变体vhb df3,突变体vhb df3具体的突变位点为第75位亮氨酸突变成丝氨酸,第132位缬氨酸突变成谷氨酸。
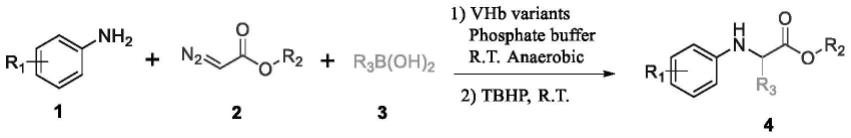
13.进一步的技术方案,步骤3中的催化级联反应合成非天然氨基酸的方程式如下所示:
[0014][0015]
其中,r1表示4-甲基、3-甲基、2-甲基、4-氟、4-氯、4-溴、4-甲氧基;r2 表示重氮酯类被甲基、乙基、叔丁基所取代;r3表示异丙基,环己基,乙基,正丙基,正丁基。
[0016]
进一步的技术方案,反应的底物为苯胺类化合物、重氮乙酸酯类化合物以及烷基硼酸类化合物的混合物,其中,所述底物的浓度范围为0.1μm-300mm;苯胺类化合物、重氮乙酸酯类化合物、烷基硼酸类化合物的摩尔比为1∶1∶1~1∶ 1∶2,最优选为1∶1∶1.5。
[0017]
进一步的技术方案,反应体系中突变体的加入量为0.01μm-1mm,所述突变体与苯胺类化合物与重氮乙酸酯类化合物加入至ph5.0-9.0的缓冲溶液中,厌氧条件下在25℃-45℃反应10min-4h,待卡宾转移的反应结束后,再添加烷基硼酸类化合物与1-4倍量的叔丁基过氧化氢,在温度相同的条件下反应1h-6h来实现底物的氧化烷基化。
[0018]
进一步的技术方案,反应的溶剂最优为ph7.4的0.1m的磷酸盐缓冲液。
[0019]
进一步的技术方案,最优温度为25℃。
[0020]
进一步的技术方案,第一步的卡宾转移反应时间最优为2小时,第二步氧化烷基化最优时间为6小时。
[0021]
进一步的技术方案,氧化剂用量最优选是3倍量。
[0022]
本发明实施例提供的一种双功能血红素蛋白催化非天然氨基酸衍生物的方法,通过定向进化技术,对于野生型的透明颤菌血红蛋白分子进行改造,实现了在单一位点同时具有卡宾转移和氧化活力。通过级联反应将简单小分子原料一锅法高效合成非天然氨基酸类化合物。同时,该发明中的生物催化系统相比于传统化学合成方法更加高效绿色。在水相中,较低的催化剂用量以及廉价易得的底物即可获得令人满意的收率,弥补了传统化学法的缺陷,并且为蛋白在催化非天然反应的应用中开阅了新的应用前景。
具体实施方式
[0023]
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
[0024]
以下结合具体实施例对本发明的具体实现进行详细描述。
[0025]
实施例1野生型vhb基因的构建
[0026]
设计vhb的上下游引物,以野生型vhb(seq id no.1)为模板用pcr技术来扩增获得目的基因。
[0027]
上游引物vhb-f:
[0028][0029]
下游引物vhb-r:
[0030][0031]
pcr反应体系如下:
[0032][0033]
反应条件:95℃2min
→
(95℃15s
→
65℃15s
→
72℃90s)
×
30
→ꢀ
72℃10min,;
[0034]
pcr扩增产物经琼脂糖凝胶电泳检测后,在紫外检测仪下,切下目的条带按照胶回收试剂盒的操作说明回收目的片段。
[0035]
建立双酶切体系
[0036]
用限制性内切酶hind iii、ecor i分别对载体puc19质粒和vhb目的片段进行双酶切。质粒和vhb目的片段酶切体系分别如下:
[0037][0038]
37℃酶切2h后通过琼脂糖凝胶电泳确认酶切产物大小,电泳完后在紫外检测仪
下,分别切下目的条带,然后按照胶回收试剂盒的操作说明回收目的片段。
[0039]
建立连接体系
[0040]
将用相同限制性内切酶处理过的vhb、puc19质粒进行连接反应,构建重组质粒vhb。连接体系如下:
[0041][0042]
16℃连接30min。
[0043]
采用热激法将连接产物转入大肠杆菌bl21(de3)感受态细胞中,测序正确的单菌落,即为构建成功的puc19-vhb。
[0044]
实施例253位定点饱和突变库的构建
[0045]
利用pcr诱变技术对野生型vhb的基因(基因序列如seq id no.1所示)进行 nnk单位点饱和诱变。
[0046]
以连接有vhb基因的重组质粒puc19-vhb为模板,设计一对包含突变位点的正反向引物,进行pcr,得到重组基因。
[0047]
正向引物53-f:ccaagaatctttggagnnkcctaaggctttggcga
[0048]
反向引物53-r:tcgccaaagccttaggmnnctccaaagattcttgg
[0049]
pcr的反应体系如下:
[0050][0051]
pcr程序:
[0052]
95℃2min
→
(95℃15s
→
55℃15s
→
72℃2min)
×
30
→
72℃10min。
[0053]
pcr后进行琼脂糖凝胶电泳鉴定大小,电泳后在紫外检测器下确认目的条带无误。
[0054]
将pcr扩增产物进行dpn i酶消化,去除甲基化的模板dna,体系如下:
[0055][0056]
37℃孵育2h。
[0057]
用热激法将消化后的产物转入大肠杆菌bl21(de3)感受态细胞中,挑单菌落测序,测序正确且53位突变成其他氨基酸即为构建成功的突变子。
[0058]
实施例3随机突变库的构建
[0059]
利用易错pcr诱变技术对vhbdf1的基因进行诱变。
[0060]
以连接有vhbdf1基因的重组质粒puc19-vhbdf1为模板,设计一对vhbdf1 基因包含19bp质粒同源臂的上下游引物,进行ep-pcr,得到目的基因片段突变库。
[0061]
上游引物tyvgb-f:gggccataataatgaacttaaggaagaccctc
[0062]
下游引物tyvgb-r:cgttgtaaaacgacggccagtgaattctta
[0063]
pcr的反应体系如下:
[0064][0065][0066]
pcr程序:
[0067]
95℃2min
→
(95℃15s
→
65℃15s
→
72℃2min)
×
35
→
72℃ 10min
[0068]
pcr扩增产物经琼脂糖凝胶电泳检测后,在紫外检测仪下,切下目的条带按照胶回收试剂盒的操作说明回收目的片段。
[0069]
建立双酶切体系
[0070]
用限制性内切酶bbs i、ecor i对载体puc19质粒进行双酶切。质粒酶切体系如下:
[0071][0072]
37℃酶切2h后通过琼脂糖凝胶电泳确认酶切产物大小,电泳完后在紫外检测仪下,分别切下目的条带,然后按照胶回收试剂盒的操作说明回收目的片段。
[0073]
建立同源重组连接体系
[0074]
将具有19bp同源臂puc19质粒进行连接反应,构建重组质粒vhb。连接体系如下:
[0075][0076][0077]
37℃连接30min后置于冰上冷却。
[0078]
采用热激法将连接产物转入大肠杆菌bl21(de3)感受态细胞中,用灭菌牙签挑单菌落至2ml
×
96深孔板中,即为构建成功的随机突变库。
[0079]
实施例4vhb突变库的表达与筛选
[0080]
在2ml
×
96深孔板中37℃200rpm培养、传代,24h后25℃120rpm厌氧表达30h。孔板离心4000rpm10min,弃上清,沉淀用180μlpbs缓冲液重悬。
[0081]
孔板初筛
[0082]
将重氮乙酸乙酯和苯胺溶于dmso,浓度为200mm,每孔加入20μl,室温 300rpm反应2h后,每孔再加入300mm异丙基硼酸的dmso溶液,继续第二步反应6h。反应结束后每孔加入200μl正己烷∶乙酸乙酯=3∶2的溶剂进行萃取,取上层过滤膜置于液相样品瓶中,进行液相高通量检测(正己烷∶异丙醇=95∶5),筛选产率较高的20个突变株进行复筛和测序。
[0083]
扩大培养复筛
[0084]
将上述20个突变株在20ml lb培养基中培养并表达,测定菌液od600,并调整至od600=30进行全细胞催化,液相检测筛选最佳突变株同上。最佳突变株将作为下一代突变的模板。
[0085]
筛选得到53位定点饱和突变最佳突变株q53h,命名为vhbdf1。在其基础上进行第一轮随机突变,筛选出最佳突变株q53h-l62w,命名为vhbdf2。在其基础上进行第二轮随机突变,筛选出最佳突变株q53h-l62w-l75s-v132e,命名为vhbdf3。
[0086]
实施例5突变体及野生型的大量表达及纯化
[0087]
挑取突变成功的单菌落,随机挑取单菌落至含amp的4ml lb培养基中,37℃180rpm活化一段时间后,转接500μl菌液于50ml的lb液体培养基 (amp),37℃180rpm活化一段时间后,转接10ml菌液于1l的lb液体培养基(amp),待37℃180rpm培养24小时后,封住瓶口,厌氧诱导表达,25℃, 110rpm,30h。
[0088]
将表达好的菌液于4500rpm,4℃的条件下离心30min,弃去上清,菌体用 10ml 10mm pbs缓冲液重悬,得菌体悬液。菌体悬液超声波破碎1h,将破碎后的产物于12000rpm,4℃的条件下离心30min去除细胞碎片,得突变体的粗酶液。
[0089]
粗酶液的纯化采用ni柱亲和层析。将粗酶液经0.22μm滤膜过滤。ni柱首先用10mm pbs缓冲液进行平衡,平衡后开始上样,上样后用上样缓冲液(10mmpbs缓冲液,20mm咪唑)进行平衡,再用洗脱液(10mm pbs缓冲液,200mm 咪唑)进行洗脱,收集有颜色的蛋白。收集的目的蛋白进行g-25脱盐柱脱盐,用nano-drop及sds-page检测目的蛋白,储存于4℃冰箱中备用。
[0090]
实施例6突变体裂解液的扩大反应
[0091]
核磁数据多重性定义如下:s(单峰);d(二重峰);t(三重峰);q(四重峰);m(多重峰);偶合常数j(赫兹)。
[0092][0093]
将4-甲氧基苯胺(200mm),重氮乙酸乙酯(200mm)以及含有40μmvhbdf3的细胞裂解液,加入(ph=7.4)的pbs(0.1m)将体积补充至1ml。25℃厌氧条件下反应2小时,之后加入异丙基硼酸(300mm,2%的dmso促溶),叔丁基过氧化氢(3倍量),室温反应6小时。用1毫升的乙酸乙酯萃取,进一步通过tlc分离获得产物ethyl(4-methoxyphenyl)valinate,43.7mg,黄色油状液体,产率为87%。1h nmr(400mhz,chloroform-d)66.82-6.77(m,1h),6.68-6.63 (m,1h),4.19(qd,j=7.1,3.0hz,1h),3.77(s,2h),2.20-2.05(m, 0h),1.27(t,j=7.1hz,2h),1.07(dd,j=8.0,6.8hz,3h)。
[0094]
实施例7突变体的底物适用性扩展
[0095]
按照实施例6的方法和步骤,在改变1的结构,保证2,3结构不变的情况下,可以合成出不同的非天然氨基酸的化合物4。
[0096][0097]
反应条件为:将苯胺类化合物(200mm),重氮乙酸酯类(200mm),含有40 μmvhbdf3的细胞裂解液,加入(ph=7.4)的pbs(0.1m)将体积补充至1ml中, 25℃厌氧条件下反应2小时,之后加入烷基硼酸类化合物(300mm,2%的dmso 促溶),叔丁基过氧化氢(3倍量),室温反应6小时。用1毫升的乙酸乙酯萃取,进一步通过tlc分离获得产物。
[0098]
4b:ethyl phenylvalinate,黄色油状液体,38.9mg,产率为88%。1h nmr(400 mhz,chloroform-d)δ7.23-7.17(m,2h),6.79-6.74(m,1h),6.70
ꢀ‑
6.65(m,2h),4.21(qd,j=7.2,1.2hz,2h),3.89(d,j=6.0hz,1h), 2.21-2.09(m,1h),1.28(t,j=7.2hz,3h),1.07(dd,j=12.0,6.8hz,6h)。
[0099]
4c:ethyl p-tolylvalinate,黄色油状液体,42.3mg,产率为90%。1h nmr(400 mhz,chloroform-d)δ7.07(d,j=8.0hz,2h),6.65(d,j=7.6hz,2h), 4.26(q,j=7.2hz,2h),3.90(d,j=5.6hz,1h),2.32(d,j=2.8hz,3h), 2.18(p,j=6.4hz,1h),1.34(td,j=6.0,5.2,2.8hz,h),1.15-1.08 (m,6h)。
[0100]
4d:ethyl m-tolylvalinate,黄色油状液体,38.1mg,产率为81%。1h nmr(400 mhz,chloroform-d)δ7.10(t,j=7.6hz,1h),6.60(d,j=7.2hz,1h), 6.54-6.47(m,2h),4.22(q,j=7.2hz,2h),3.89(d,j=6.0hz,1h), 2.31(s,3h),2.19-2.12(m,1h),1.30(t,j=7.2hz,3h),1.08(dd, j=10.4,6.8hz,6h)。
[0101]
4e:ethylo-tolylvalinate,黄色油状液体,34.8mg,产率为74%。1h nmr(400 mhz,chloroform-d)δ7.15-7.08(m,2h),6.71(td,j=7.2,1.2hz, 1h),6.60(dd,j=8.0,1.2hz,1h),4.22(q,j=7.2hz,2h),3.94(d, j=6.0hz,1h),2.25(s,3h),2.23-2.17(m,1h),1.30(t,j=7.2hz, 3h),1.09(dd,j=19.9,6.8hz,6h)。
[0102]
4f:ethyl(4-fluorophenyl)valinate,黄色油状液体,45.4mg,产率为95%。1hnmr(400mhz,chloroform-d)δ6.94-6.88(m,2h),6.64-6.58(m, 2h),4.20(qd,j=7.2,3.2hz,2h),3.79(d,j=6.0hz,1h),1.27(t, j=7.2hz,3h),1.07(dd,j=9.2,6.8hz,6h)。
[0103]
4g:ethyl(4-chlorophenyl)valinate,黄色油状液体,46.3mg,产率为92%。1hnmr(400mhz,chloroform-d)δ7.16-7.12(m,2h),6.60-6.57(m, 2h),4.24-4.18(m,2h),
3.82(d,j=6.0hz,1h),2.14(td,j=7.2,6.0hz,1h),1.27(d,j=7.2hz,3h),1.06(dd,j=11.6,6.8hz,6h)。
[0104]
4h:ethyl(4-bromophenyl)valinate,黄色油状液体,54.4mg,产率为91%。1h nmr(400mhz,chloroform-d)δ7.27(d,j=8.8hz,2h),6.54(d,j= 8.4hz,2h),4.21(qd,j=7.2,1.6hz,2h),3.82(d,j=6.0hz,1h), 2.14(q,j=6.4hz,1h),1.28(t,j=7.2hz,3h),1.05(dd,j=12.4,6.8 hz,6h)。
[0105]
4i:methyl(4-methoxyphenyl)valinate,40.3mg,黄色油状液体,产率为85%。1h nmr(400mhz,chloroform-d)δ6.83-6.78(m,2h),6.68-6.63(m, 2h),3.79(d,j=14.4hz,4h),3.73(s,3h),2.17-2.07(m,1h),1.06 (dd,j=9.6,6.8hz,6h)。
[0106]
4j:tert-butyl(4-methoxyphenyl)valinate,46.8mg,黄色油状液体,产率为 84%。1h nmr(400mhz,chloroform-d)δ6.83-6.76(m,2h),6.68-6.61 (m,2h),3.77(s,3h),3.68(d,j=5.6hz,1h),2.10(dq,j=13.6,6.8 hz,1h),1.44(s,9h),1.06(t,j=6.4hz,6h)。
[0107]
4k:ethyl 2-((4-methoxyphenyl)amino)butanoate,27.9mg,黄色油状液体,产率为59%。1h nmr(400mhz,chloroform-d)δ6.82-6.78(m,2h),6.69
ꢀ‑
6.63(m,2h),4.20(qd,j=7.2,1.2hz,2h),3.96(t,j=6.4hz,1h), 3.77(s,3h),1.93-1.79(m,2h),1.27(t,j=7.2hz,3h),1.04(t, j=7.2hz,3h)。
[0108]
4l:ethyl 2-((4-methoxyphenyl)amino)pentanoate,33.6mg,黄色油状液体,产率为62%。1h nmr(400mhz,chloroform-d)δ6.82-6.77(m,2h),6.70
ꢀ‑
6.65(m,2h),4.19(d,j=7.2hz,1h),4.00(s,3h),3.80(d,j=20.4 hz,2h),1.79(dt,j=14.8,6.8hz,2h),1.49(q,j=7.8hz,3h),1.29
ꢀ‑
1.25(m,9h),1.01-0.96(m,3h)。
[0109]
4m:ethyl2-((4-methoxyphenyl)amino)hexanoate,35.5mg,黄色油状液体,产率为67%。1h nmr(400mhz,chloroform-d)δ6.82-6.78(m,2h),6.66
ꢀ‑
6.62(m,2h),4.19(q,j=7.2hz,2h),3.99(t,j=6.4hz,1h),3.77 (s,3h),1.84(s,2h),1.48-1.35(m,4h),1.27(t,j=7.2hz,3h), 0.94(t,j=7.2hz,3h)。
[0110]
4n:ethyl 2-cyclohexyl-2-((4-methoxyphenyl)amino)acetate,44.2mg,黄色油状液体,产率为76%。1h nmr(400mhz,chloroform-d)δ6.79(d,j=9.2hz, 2h),6.68-6.63(m,2h),4.22-4.15(m,2h),3.77(s,4h),1.92
ꢀ‑
1.68(m,8h),1.27(t,j=7.2hz,6h)。
[0111]
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。