来源于肿瘤组织的具有肿瘤特异性杀伤效果的t淋巴细胞及其制备方法和细胞制剂
技术领域
1.本发明涉及t淋巴细胞制剂领域,特别涉及一种来源于肿瘤组织的具有肿瘤特异性杀伤效果的t淋巴细胞及其制备方法和细胞制剂。
背景技术:
2.近几年,随着生物医药领域的迅猛发展,免疫疗法逐渐成为继手术、放疗、化疗后第四类肿瘤治疗手段,其中过继性细胞治疗、免疫检查点阻断疗法、肿瘤疫苗以及双特异性抗体等治疗方法均取得了一定的临床疗效。然而在实体瘤发展过程中,实体肿瘤的物理屏障及其复杂的肿瘤微环境限制了非特异性免疫治疗的疗效。来自肿瘤内部或肿瘤组织附近的肿瘤组织浸润性淋巴细胞,对肿瘤细胞具有特异性识别能力,在1922年首次被提到,mac carty推测淋巴细胞到肿瘤组织内是体内免疫系统抵抗肿瘤的一种现象,提出了肿瘤组织浸润性淋巴细胞是一种高效抗癌的免疫效应细胞。1986年rosenberg等人在荷瘤小鼠的肿瘤组织内发现并分离出了肿瘤组织浸润性淋巴细胞,他们将分离出的细胞经过体外扩增培养后,再回输到荷瘤小鼠体内,发现肿瘤组织有明显消退,从而证明肿瘤组织浸润性淋巴细胞具有抗肿瘤的作用。
3.常规的肿瘤特异性杀伤t淋巴细胞培养方法,多采用两步法进行培养,先用高浓度的il-2扩增细胞数量,再用cd3单抗、cd28单抗或辐照的人外周血pbmc等对细胞进行刺激以提高效应细胞的比例,培养周期通常在20-25天,也有研究培养到36天,此方法最后收获的细胞,往往生物活性均有所降低,并且最终制剂中含有较高比例的调节性t淋巴细胞,严重影响临床治疗效果。
技术实现要素:
4.本发明为了解决上述技术问题,提供了一种来源于肿瘤组织的具有肿瘤特异性杀伤效果的t淋巴细胞及其制备方法和细胞制剂。
5.第一方面,本发明提供一种来源于肿瘤组织的具有肿瘤特异性杀伤效果的t淋巴细胞的制备方法,是通过以下技术方案得以实现的。
6.一种来源于肿瘤组织的具有肿瘤特异性杀伤效果的t淋巴细胞的制备方法,包括以下步骤:s1.将肿瘤组织进行清洗、分割,放入消化液中震荡消化30-40min;s2.组织消化后过滤、洗涤、离心,用t淋巴细胞完全培养基重悬沉淀后加入到预先包被的培养瓶中,补加ifn-γ至终浓度1000-1500iu/ml,进行细胞培养;所述包被的培养瓶的方法为:用含有cd3和cd28单抗的t淋巴细胞完全培养基包被培养瓶置于37℃,5.0% co2条件下0.5-1h;s3.每日观察细胞状态,取样计数,根据计数结果补加t淋巴细胞完全培养基,调整细胞浓度在0.5-0.8
×
109/l,继续细胞培养;
s4.继续每日观察细胞状态,当培养体系达到10-15ml时,取样计数,将细胞转移至预先包被的培养瓶中,包被方法同步骤s2;根据计数结果补加t淋巴细胞完全培养基,调整细胞浓度在0.5-0.8
×
109/l,补加ifn-γ至终浓度1000-1500iu/ml,继续细胞培养;s5.继续每日观察细胞状态,取样计数,当培养体系达到25-45ml时,将细胞转入另一培养瓶中,根据计数结果补加t淋巴细胞完全培养基,调整细胞浓度在0.5-0.8
×
109/l,继续细胞培养;s6.继续每日观察细胞状态,取样计数,当培养体系达到180-200ml时,将细胞转入细胞培养袋中,按照20-50ng/ml向培养袋中补加cd3和cd28单抗,根据计数结果补加t淋巴细胞完全培养基,调整细胞浓度在0.5-0.8
×
109/l,继续细胞培养;s7.继续每日观察细胞状态,取样计数,当培养体系达到1600-2000ml且细胞总数在4
×
109以上时,收获全部细胞。
7.通过采用上述技术方案,本技术对肿瘤组织进行消化分离,获得的种子细胞,给予连续刺激并使用特定培养基进行扩增培养,在较短培养周期内获得满足制剂需求的细胞数量并制成细胞悬液。本发明采用连续刺激加定向培养的扩增方式,在细胞接种初始即给予刺激,相比传统培养方法先扩增种子细胞数再刺激的方式,可大大提高细胞扩增效率,缩短培养周期,使细胞维持高水平的生物活性。
8.进一步的,步骤s1中,每立方厘米组织块加入10-15ml消化液。
9.进一步的,步骤s1中,消化液为含有0.075-0.15g/ml的ⅰ型胶原酶的1640培养基。
10.进一步的,t淋巴细胞完全培养基为含有10-20 v%胎牛血清、2 v% 50x必需氨基酸和4000-6000iu/ml il-2的x-vivo 15培养基。
11.进一步的,步骤s2中,cd3和cd28两种单抗的含量为20-50ng/cm2。
12.第二方面,本技术提供了一种来源于肿瘤组织的具有肿瘤特异性杀伤效果的t淋巴细胞,是通过以下技术方案得以实现的。
13.一种上述制备方法制备得到的来源于肿瘤组织的具有肿瘤特异性杀伤效果的t淋巴细胞。
14.第三方面,本技术提供了一种肿瘤特异性杀伤效果的t淋巴细胞制剂,是通过以下技术方案得以实现的。
15.一种肿瘤特异性杀伤效果的t淋巴细胞制剂,包括上述来源于肿瘤组织的具有肿瘤特异性杀伤效果的t淋巴细胞。
16.本技术具有以下有益效果。
17.本技术从含有大量具有特异性识别肿瘤抗原的免疫细胞的肿瘤组织及其周围组织中分离获得种子细胞,经体外定向培养,可大大提高具有特异性识别肿瘤抗原的细胞比例,并且此类细胞主要为t细胞,进入到人体除自身发挥抗肿瘤作用外,还可分泌多种细胞因子,积极调动人体免疫系统协同进行肿瘤杀伤。本发明采用连续刺激加定向培养的扩增方式,在细胞接种初始即给予刺激,相比传统培养方法先扩增种子细胞数再刺激的方式,可大大提高细胞扩增效率,缩短培养周期,使细胞维持高水平的生物活性,降低最终制剂中调节性t淋巴细胞比例。
附图说明
18.图1是本发明实施例1 d3镜下观察细胞扩增状态图(4倍镜);图2是本发明实施例1培养d16天流式结果图;图3是本发明实施例1细胞扩增曲线图;图4是本发明实施例2 d3镜下观察细胞扩增状态图(4倍镜);图5是本发明实施例2培养d18天流式结果图;图6是本发明实施例2细胞扩增曲线图。
具体实施方式
19.以下结合附图和实施例对本专利申请进行进一步的说明。
20.一种来源于肿瘤组织的具有肿瘤特异性杀伤效果的t淋巴细胞的制备方法,包括以下步骤:(1)种子细胞的提取:手术获得的肿瘤组织,体积不小于1cm
×
1cm
×
1cm。使用1640培养基清洗一遍后,将组织放入无菌培养皿中,用无菌手术刀和镊子将其分割成若干2-3mm3的小块,放入离心管中,补充消化液混匀,放入恒温振荡器37℃振荡消化30-40min。每立方厘米组织块补充10-15ml消化液,消化液成分:1640培养基含有0.075-0.15g/ml的ⅰ型胶原酶。
21.(2)t淋巴细胞培养:提前使用1ml含有cd3和cd28单抗的t淋巴细胞完全培养基包被t-25培养瓶置于37℃,5.0% co2条件下0.5-1h备用,两种单抗的含量为20-50ng/cm2。组织消化后以200um孔径滤网过滤,补加20-30ml 1640培养基300-500g条件下离心8-10min,然后弃上清,使用4-6ml t淋巴细胞完全培养基重悬沉淀后加入到已包被的t-25培养瓶中,该完全培养基为包括体积分数10-20%胎牛血清、体积分数2% 50x必需氨基酸(bi/01-325-1b)、4000-6000iu/ml il-2的x-vivo 15培养基(lonza/04-418q)。向培养瓶中补加ifn-γ至终浓度1000-1500iu/ml,放入37℃、5�2培养箱进行培养。
22.(3)每日观察细胞状态,取样计数,根据计数结果补加t淋巴细胞完全培养基,调整细胞浓度在0.5-0.8
×
109/l,混匀后放入37℃、5�2培养箱继续培养。
23.(4)继续每日观察细胞状态,当培养体系达到10-15ml时,取样计数,提前使用3ml 含有cd3和cd28单抗的t淋巴细胞完全培养基包被t-75培养瓶0.5-1h备用,两种单抗的含量为20-50ng/cm2。将细胞转移至已包被的t-75培养瓶中,根据计数结果补加t淋巴细胞完全培养基,调整细胞浓度在0.5-0.8
×
109/l,补加ifn-γ至终浓度1000-1500iu/ml,混匀后放入37℃、5�2培养箱继续培养。
24.(5)继续每日观察细胞状态,取样计数,当培养体系达到25-45ml时,将细胞转入新的t-175培养瓶中,根据计数结果补加t淋巴细胞完全培养基,调整细胞浓度在0.5-0.8
×
109/l,混匀后放入37℃、5�2培养箱继续培养。
25.(6)继续每日观察细胞状态,取样计数,当培养体系达到180-200ml时,将细胞转入新的细胞培养袋中,根据计数结果补加t淋巴细胞完全培养基,调整细胞浓度在0.5-0.8
×
109/l,按照20-50ng/ml向培养袋中补加cd3和cd28单抗,混匀后放入37℃、5�2培养箱继续培养。
26.(7)继续每日观察细胞状态,取样计数,当培养体系达到1600-2000ml且细胞总数
在4
×
109以上时,收获全部细胞悬液至4个500ml离心杯中,300-500g离心10-20min后弃掉离心上清,加入含0.2-0.4%人血白蛋白的氯化钠注射液重悬细胞后,300-500g离心10-20min清洗细胞2-3次,使用含1-3%人血白蛋白的氯化钠注射液重悬细胞,制成肿瘤特异性杀伤效果的t淋巴细胞制剂。
27.实施例1样本信息:男,60岁,肝癌术后,采自解放军总医院第五医学中心。
28.具有肿瘤特异性杀伤效果的t淋巴细胞制剂的制备:(1)种子细胞的提取:手术获得的肿瘤组织,1.2cm
×
0.9cm
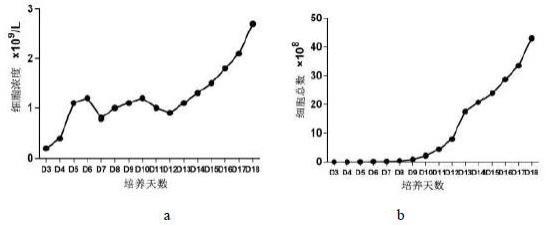
×
1cm。使用10ml 1640培养基清洗一遍后,将组织放在一个无菌培养皿上,用手术刀和镊子将其分割成2-3mm3的组织块,放入1个50ml离心管中,补充15ml 消化液(消化液成分:13.5ml 1640培养基和1.5ml
ꢀⅰ
型胶原酶原液(1640培养基含有1g/ml
ꢀⅰ
型胶原酶)),混匀后放入恒温振荡器37℃振荡消化30min。
29.(2)t淋巴细胞培养:使用1ml cd3和cd28单抗包被液包被1个t-25培养瓶0.5h备用(包被液成分:含浓度为1ug/ml 的cd3和cd28单抗的t淋巴细胞完全培养基),两种单抗的含量为40ng/cm2。组织消化后经200um孔径滤网过滤至1个新的50ml离心管中,补加20ml 1640培养基,500g离心10min后弃上清,使用4ml t淋巴细胞完全培养基重悬沉淀后加入到已包被的t-25培养瓶中,补加ifn-γ至终浓度1000iu/ml,混匀后放入37℃、5�2培养箱进行培养。t淋巴细胞完全培养基为包括体积分数10%胎牛血清、体积分数2% 50x必需氨基酸(bi/01-325-1b)、4000iu/ml il-2的x-vivo 15培养基(lonza/04-418q)。
30.(3)每日观察细胞状态,培养d3天镜下可见少量细胞团块(参见图1),吹打混匀细胞取样计数,计数结果:wbc:0.3
×
109/l。放入37℃、5�2培养箱继续培养。
31.(4)培养d4天,吹打混匀细胞取样计数,计数结果:wbc:1.0
×
109/l,补加5ml t淋巴细胞完全培养基,混匀后放入37℃、5�2培养箱继续培养。
32.(5)培养d5天,吹打混匀细胞取样计数,计数结果:wbc:1.0
×
109/l,使用3ml cd3和cd28单抗包被液包被1个t-75培养瓶0.5h备用,两种单抗的含量为40ng/cm2。将细胞转移至已包被的t-75培养瓶中,根据计数结果补加7ml t淋巴细胞完全培养基,调整细胞浓度至0.5
×
109/l,补加ifn-γ至终浓度1000iu/ml。混匀后放入37℃、5�2培养箱继续培养。
33.(6)培养d6天,吹打混匀细胞取样计数,计数结果:wbc:0.8
×
109/l,根据计数结果补加12 ml t淋巴细胞完全培养基,调整细胞浓度至0.5
×
109/l,混匀后放入37℃、5�2培养箱继续培养。
34.(7)培养d7天,吹打混匀细胞取样计数,计数结果:wbc:1.0
×
109/l,将细胞转入新的t-175培养瓶中,根据计数结果补加32ml t淋巴细胞完全培养基,调整细胞浓度至0.5
×
109/l,混匀后放入37℃、5�2培养箱继续培养。
35.(8)培养d8天,吹打混匀细胞取样计数,计数结果:wbc:1.0
×
109/l,根据计数结果补加64ml t淋巴细胞完全培养基,调整细胞浓度至0.5
×
109/l,混匀后放入37℃、5�2培养箱继续培养。
36.(9)培养d9天,吹打混匀细胞取样计数,计数结果:wbc:1.1
×
109/l,将细胞转入新的细胞培养袋中,根据计数结果补加148.36ml t淋巴细胞完全培养基,调整细胞浓度至0.5
×
109/l,按照cd3和cd28单抗为20ng/ml向培养袋中补加5.64ml cd3和cd28单抗包被液,混
匀后放入37℃、5�2培养箱继续培养。
37.(10)培养d10天,吹打混匀细胞取样计数,计数结果:wbc:0.9
×
109/l,根据计数结果补加226ml t淋巴细胞完全培养基,调整细胞浓度至0.5
×
109/l,混匀后放入37℃、5�2培养箱继续培养。
38.(11)培养d11天,吹打混匀细胞取样计数,计数结果:wbc:0.9
×
109/l,根据计数结果补加688ml t淋巴细胞完全培养基,调整细胞浓度至0.5
×
109/l,混匀后放入37℃、5%co2培养箱继续培养。
39.(12)培养d12天,吹打混匀细胞取样计数,计数结果:wbc:1.0
×
109/l,根据计数结果补加915ml t淋巴细胞完全培养基,调整细胞浓度至0.5
×
109/l,混匀后放入37℃、5�2培养箱继续培养。此时总液量已达1830ml。
40.(13)培养d13天,吹打混匀细胞取样计数,计数结果:wbc:1.2
×
109/l,放入37℃、5�2培养箱继续培养。
41.(14)培养d14天,吹打混匀细胞取样计数,计数结果:wbc:1.5
×
109/l,放入37℃、5�2培养箱继续培养。
42.(15)培养d15天,吹打混匀细胞取样计数,计数结果:wbc:1.8
×
109/l,放入37℃、5�2培养箱继续培养。
43.(16)培养d16天,吹打混匀细胞取样计数计活率,计数结果:wbc:2.2
×
109/l,细胞总数:4.026
×
109。取2.3ml细胞悬液(5
×
106个细胞)进行表面标志物检测(结果见图2)。其余细胞悬液全部收获至4个500ml离心杯中,配平500g离心10min后弃掉离心上清,使用两瓶洗液将细胞重悬至2个500ml离心杯中(每瓶洗液为500ml氯化钠注射液加1ml人血白蛋白,人血白蛋白浓度为0.2%)。重悬细胞后配平,500g离心10min清洗细胞3次,使用200ml保存液重悬细胞(保存液为194ml氯化钠注射液加6ml人血白蛋白,人血白蛋白浓度为3%),制成肿瘤特异性杀伤效果的t淋巴细胞制剂。扩增曲线见图3(3a:细胞扩增浓度曲线;3b:细胞扩增数量曲线),细胞活率见表1。
44.表1:d16天细胞活率实施例2样本信息:男,63岁,肝癌术后,来自解放军总医院第五医学中心。
45.肿瘤特异性杀伤效果的t淋巴细胞制剂的制备:(1)种子细胞的提取:手术获得的肿瘤组织,1.1cm
×
0.7cm
×
1.0cm。使用10ml 1640培养基清洗一遍后,将组织放在一个无菌培养皿上,用手术刀和镊子将其分割成2-3mm3的组织块,放入1个50ml离心管中,补充15ml消化液(消化液成分:13.5ml 1640培养基和1.5ml
ꢀⅰ
型胶原酶原液(1640培养基含有1g/mlⅰ型胶原酶)),混匀后放入恒温振荡器37℃振荡消化30min。
46.(2)t淋巴细胞培养:使用1ml cd3和cd28单抗包被液包被1个t-25培养瓶0.5h备用(包被液成分:含浓度为1ug/ml 的cd3和cd28单抗的t淋巴细胞完全培养基),两种单抗的含量为40ng/cm2。组织消化后经200um孔径滤网过滤至1个新的50ml离心管中,补加30ml 1640培养基离心10min后弃上清,使用4ml t淋巴细胞完全培养基重悬沉淀后加入到已包被的t-25培养瓶中,补加ifn-γ至终浓度1500iu/ml,混匀后放入37℃、5�2培养箱进行培养。t淋巴细胞完全培养基为包括体积分数10%胎牛血清、体积分数2% mem-eagle amino acids solution(bi/01-325-1b)、4000iu/ml il-2的x-vivo 15培养基(lonza/04-418q)。
47.(3)每日观察细胞状态,培养d3天镜下可见少量细胞团块(参见图4),吹打混匀细胞取样计数,计数结果:wbc:0.2
×
109/l。放入37℃、5�2培养箱继续培养。
48.(4)培养d4天,吹打混匀细胞取样计数,计数结果:wbc:0.4
×
109/l,放入37℃、5�2培养箱继续培养。
49.(5)培养d5天,吹打混匀细胞取样计数,计数结果:wbc:1.1
×
109/l,根据计数结果补加6ml t淋巴细胞完全培养基,调整细胞浓度至0.5
×
109/l,混匀后放入37℃、5�2培养箱继续培养。
50.(6)培养d6天,吹打混匀细胞取样计数,计数结果:wbc:1.2
×
109/l,使用3ml cd3和cd28单抗包被液包被1个t-75培养瓶0.5h备用,两种单抗的含量为40ng/cm2。将细胞转移至已包被的t-75培养瓶中,根据计数结果补加12ml t淋巴细胞完全培养基,调整细胞浓度至0.5
×
109/l,补加ifn-γ至终浓度1500iu/ml。混匀后放入37℃、5�2培养箱继续培养。
51.(7)培养d7天,吹打混匀细胞取样计数,计数结果:wbc:0.8
×
109/l,将细胞转入新的t-175培养瓶中,根据计数结果补加16ml t淋巴细胞完全培养基,调整细胞浓度至0.5
×
109/l,混匀后放入37℃、5�2培养箱继续培养。
52.(8)培养d8天,吹打混匀细胞取样计数,计数结果:wbc:1.0
×
109/l,根据计数结果补加42ml t淋巴细胞完全培养基,调整细胞浓度至0.5
×
109/l,混匀后放入37℃、5�2培养箱继续培养。
53.(9)培养d9天,吹打混匀细胞取样计数,计数结果:wbc:1.1
×
109/l,按照20ng/cm2向培养袋中补加3.7ml cd3和cd28单抗包被液,将细胞转入新的细胞培养袋中,根据计数结果补加97.3ml t淋巴细胞完全培养基,调整细胞浓度至0.5
×
109/l,混匀后放入37℃、5�2培养箱继续培养。
54.(10)培养d10天,吹打混匀细胞取样计数,计数结果:wbc:1.2
×
109/l,根据计数结果补加259ml t淋巴细胞完全培养基,调整细胞浓度至0.5
×
109/l,混匀后放入37℃、5�2培养箱继续培养。
55.(11)培养d11天,吹打混匀细胞取样计数,计数结果:wbc:1.0
×
109/l,根据计数结果补加444ml t淋巴细胞完全培养基,调整细胞浓度至0.5
×
109/l,混匀后放入37℃、5�2培养箱继续培养。
56.(12)培养d12天,吹打混匀细胞取样计数,计数结果:wbc:0.9
×
109/l,根据计数结果补加712ml t淋巴细胞完全培养基,调整细胞浓度至0.5
×
109/l,混匀后放入37℃、5�2培养箱继续培养。此时总液量已达1600ml。
57.(13)培养d13天,吹打混匀细胞取样计数,计数结果:wbc:1.1
×
109/l,放入37℃、5�2培养箱继续培养。
58.(14)培养d14天,吹打混匀细胞取样计数,计数结果:wbc:1.3
×
109/l,放入37℃、5�2培养箱继续培养。
59.(15)培养d15天,吹打混匀细胞取样计数,计数结果:wbc:1.5
×
109/l,放入37℃、5�2培养箱继续培养。
60.(16)培养d16天,吹打混匀细胞取样计数,计数结果:wbc:1.8
×
109/l,放入37℃、5�2培养箱继续培养。
61.(17)培养d17天,吹打混匀细胞取样计数,计数结果:wbc:2.1
×
109/l,放入37℃、5�2培养箱继续培养。
62.(18)培养d18天,吹打混匀细胞取样计数计活率,计数结果:wbc:2.7
×
109/l,细胞总数:4.31
×
109。取1.9ml细胞悬液(5
×
106个细胞)进行表面标志物检测(结果见图5),其余细胞悬液全部收获至4个500ml离心杯中,配平500g离心10min后弃掉离心上清,使用两瓶洗液将细胞重悬至2个500ml离心杯中(每瓶洗液为500ml氯化钠注射液加1ml人血白蛋白,人血白蛋白含量为0.2%)。重悬细胞后配平,500g离心10min清洗细胞3次,使用200ml保存液重悬细胞(保存液为194ml氯化钠注射液加6ml人血白蛋白,人血白蛋白含量为3%),制成肿瘤特异性杀伤效果的t淋巴细胞制剂。扩增曲线见图6(6a:细胞扩增浓度曲线;6b:细胞扩增数量曲线),细胞活率见表2。
63.表2:d18天细胞活率本具体实施方式的实施例均为本发明的较佳实施例,并非依此限制本发明的保护范围,故:凡依本发明的结构、形状、原理所做的等效变化,均应涵盖于本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。