1.本发明涉及生物工程技术领域,具体涉及一种小鼠马尔尼菲篮状菌潜伏再激活模型的构建方法。
背景技术:
2.马尔尼菲篮状菌(talaromyces marneffei,tm)是篮状菌属中的一种,也是迄今为止篮状菌属中已知的唯一致病菌,马尔尼菲篮状菌病(talaromycosis)就是由tm感染引起的一种全身侵袭性真菌病。tm感染属于区域高发机会性感染,主要流行于东南亚和中国南部地区。细胞免疫缺陷是tm感染的高危因素,在hiv感染人群中,合并tm感染会加速剥夺aids患者的生命健康。据报道,我国56.6%的tm病报告病例出现在广西地区,而广西hiv/tm感染的死亡风险居所有机会性感染之首(ahr=4.51)。近年来,非hiv感染者罹患这种疾病的病例也在增加,且感染呈现出感染人数增加、流行区域扩大的趋势,已成为疫源地国家和地区的重大公共卫生问题。目前tm也被who列入“重点真菌病原体清单”中。
3.tm在健康个体中并不发病,而是呈现无症状的潜伏性感染,主要隐藏和潜伏于网状内皮系统,一旦机体免疫功能低下(主要为后天免疫受损),则会通过血液逐渐传播至全身各个器官系统,感染涉及肺,胃肠道,淋巴结,肝脏,脾脏,血液,皮肤和骨髓等,容易造成全身器官衰竭,预后极差。由此可见,tm在体内可能会发展出一系列免疫逃避策略,以达到在体内潜伏的目的。
4.要研究tm潜伏感染发生的分子机制以及分析tm的致病机理,那么建立tm潜伏激活模型就很有必要。中国专利(cn111955415a)公开了一种小鼠肺部巨细胞病毒潜伏再激活感染模型的建立方法,将纯化的mcmv smith病毒株经腹腔注射实现原代mcmv感染,感染量为5
×
104pfu,持续饲养16周,每隔4周处死小鼠,获取肺组织。通过逆转录聚合酶链式反应(reverse transcription polymerase chain reaction,rt-pcr),体外空斑实验(in vitro plaqueassay,ivpa)和聚焦扩增测定(focused expansion assay,fea)方法以确认存在mc mv潜伏性感染。
5.另有学者公开了结核分枝杆菌潜伏感染豚鼠模型的建立,采用恢复毒力的h37rv株500cfu经腹股沟皮下注射攻毒,2周后给予异烟肼和吡嗪酰胺治疗,控制mtb增殖。使用地塞米松诱导复发,最后进行ppd试验并检测豚鼠的脾、肺荷菌量。(黎友伦,王国治,罗永艾.结核分枝杆菌潜伏感染动物模型及评价[j].中华结核和呼吸杂志,2005,(8))
[0006]
但是,目前尚未检索到关于如何构建tm潜伏再激活感染的实验小鼠模型的相关报道。值得注意的是,病毒、细菌与真菌感染的致病机理不同,tm作为全身侵袭性真菌,不同于病毒和细菌的感染致病机理,因此不适用于上述病原体潜伏感染模型的建立方法。而且tm感染在免疫力低下人群中可引起全身侵袭性真菌病,不仅仅局限于肺和脾感染,有着明显特异的感染特征和疾病进程,相较于上述两种病原体,病情更凶险,受累部位更多,死亡率更高。
[0007]
因此,亟需构建一种小鼠马尔尼菲篮状菌潜伏再激活的模型。
技术实现要素:
[0008]
本发明的目的是提供一种小鼠马尔尼菲篮状菌潜伏再激活模型的构建方法,通过在小鼠体内构建的tm潜伏激活模型,实现模拟真菌在人体内部的动态过程,为研究tm在机体发生的潜伏感染状态提供模型基础。而且,tm潜伏激活模型作为研究tm的工具模型,能够进一步阐明tm潜伏感染发生的分子机制,为深入挖掘tm潜伏感染机制提供了工具基础,同时促进本领域内相关药物的研发,在抗tm感染药物和疫苗等生物制剂的试验研究和制备开发上具备广泛的应用前景。
[0009]
为了实现上述目的,本发明采用了如下技术方案:
[0010]
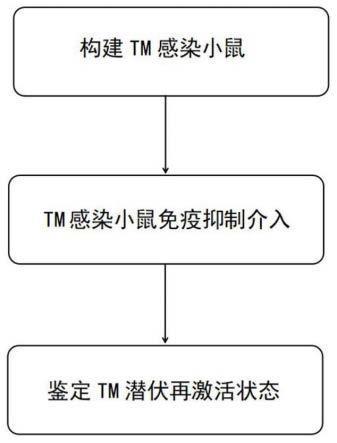
一种小鼠马尔尼菲篮状菌潜伏再激活模型的构建方法,所述构建方法包括:
[0011]
s1、构建tm感染小鼠:选用人工饲养的健康小鼠,采用tm标准株为小鼠给药,持续饲养tm感染小鼠;
[0012]
s2、tm感染小鼠免疫抑制介入:待tm感染小鼠体内检测不出tm时,采用环磷酰胺为小鼠给药;
[0013]
s3、检测tm潜伏再激活状态:监测并记录小鼠的各项生理指标。
[0014]
优选地,所述步骤s1的具体过程为:选用人工饲养的健康小鼠,采用tm标准株为小鼠给药,实现小鼠tm感染,感染后持续饲养tm感染小鼠。
[0015]
优选地,所述步骤s2的具体过程为:待步骤s1所述的tm感染小鼠体内检测不出tm时,再采用环磷酰胺为小鼠给药,单次给药剂量为20-200mg/kg,为维持小鼠免疫耐受状态采取间隔给药方式。
[0016]
优选地,所述步骤s3中监测小鼠的各项生理指标包括:脏器荷菌量、脏器系数和tm形态学鉴定。
[0017]
优选地,所述脏器荷菌量、脏器系数和tm形态学鉴定均为定期监测。
[0018]
优选地,所述tm形态学鉴定是将小鼠的组织样本经乳酸酚棉蓝染色液染色后置于光学显微镜下观察菌丝形态并拍照记录。
[0019]
优选地,所述持续饲养的时间为7n天,n为自然数;所述间隔给药的频次为每3天给药一次。
[0020]
优选地,所述tm标准株采用冷藏于3-10℃的tm标准株菌悬液,所述菌悬液浓度通过血球计数仪直接计数或比浊法进行确定。
[0021]
优选地,所述的小鼠马尔尼菲篮状菌潜伏再激活模型在制备预防或治疗tm感染中的药物中的应用。
[0022]
本技术的优点和效果如下:
[0023]
1、本发明所提供的一种小鼠马尔尼菲篮状菌潜伏再激活模型的构建方法,有效地解决了不同种类病原体之间的潜伏感染模型建立方法不能适用的问题。本发明首次成功建立一种小鼠马尔尼菲篮状菌潜伏再激活模型,所提供的构建方法更加契合于真菌病原体,为本领域技术人员进一步开展关于真菌病原体的学术研究提供了技术支撑。
[0024]
2、本发明所提供的一种小鼠马尔尼菲篮状菌潜伏再激活模型的构建方法,在动物体内构建的tm潜伏激活模型模拟了真菌在人体内部的动态过程,为tm感染的预防和药物研发提供了模型基础,同时为深入挖掘tm潜伏感染机制提供了工具基础。
[0025]
3、本发明所提供的一种小鼠马尔尼菲篮状菌潜伏再激活模型的构建方法,为研究
tm提供工具模型,拓宽了研究思路。尤其是tm作为一种温度双向型真菌,其致病机理不同与病毒和细菌,本发明所提供的tm潜伏再激活模型进一步为tm潜伏感染发生的分子机制研究提供了充分的依据和坚实的前期基础。
[0026]
4、本发明所提供的一种小鼠马尔尼菲篮状菌潜伏再激活模型的构建方法,建模周期相对较短,加快了后期基于该模型的试验研究进度。进而为抗tm感染中的疫苗药物或免疫佐剂中的应用提供了工具基础。
[0027]
上述说明仅是本技术技术方案的概述,为了能够更清楚了解本技术的技术手段,从而可依照说明书的内容予以实施,并且为了让本技术的上述和其他目的、特征和优点能够更明显易懂,以下以本技术的较佳实施例并配合附图详细说明如后。
[0028]
根据下文结合附图对本技术具体实施例的详细描述,本领域技术人员将会更加明了本技术的上述及其他目的、优点和特征。
附图说明
[0029]
为了更清楚地说明本技术实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,此处的附图被并入说明书中并构成本说明书的一部分,示出了符合本发明的实施例,并与说明书一起用于解释本发明的原理。
[0030]
显而易见地,下面描述中的附图是本技术的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
[0031]
其中:
[0032]
图1为构建小鼠马尔尼菲篮状菌潜伏感染与再激活模型的流程图;
[0033]
图2为构建小鼠马尔尼菲篮状菌潜伏感染与再激活模型的时间轴图;
[0034]
图3为小鼠感染tm后肝脾指数图;
[0035]
图4为小鼠感染tm后肝、脾荷菌量变化水平图;
[0036]
图5为小鼠感染21天后开始注射环磷酰胺(ctx)体重变化情况图;
[0037]
图6为小鼠注射环磷酰胺后肝脾指数图;
[0038]
图7为小鼠注射环磷酰胺21天后肝、脾荷菌量变化水平图;
[0039]
图8为小鼠注射环磷酰胺21天后提取培养物乳酸酚棉蓝染色镜下观图。
具体实施方式
[0040]
为使本技术的目的、技术方案和优点更加清楚,下面结合说明书附图和具体实施例来进一步说明本发明。显然,所描述的实施例是本技术一部分实施例,而不是全部的实施例,并不对本发明作任何形式的限定。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动的前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0041]
以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其他优点与功效。本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精神下进行各种修饰或改变。
[0042]
在进一步描述本发明具体实施方式之前,应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体
实施方案,而不是为了限制本发明的保护范围;在本发明说明书和权利要求书中,除非文中另外明确指出,单数形式“一个”、“一”和“这个”包括复数形式。
[0043]
本说明书使用的“持续”、“维持”均表示连续的意思。
[0044]
当实施例给出数值范围时,应理解,除非本发明另有说明,每个数值范围的两个端点以及两个端点之间任何一个数值均可选用。除非另外定义,本发明中使用的所有技术和科学术语与本技术领域技术人员通常理解的意义相同。除实施例中使用的具体方法、设备、材料外,根据本技术领域的技术人员对现有技术的掌握及本发明的记载,还可以使用与本发明实施例中所述的方法、设备、材料相似或等同的现有技术的任何方法、设备和材料来实现本发明。
[0045]
除非另外说明,本发明中所公开的实验方法和检测方法均采用本技术领域常规的技术及相关领域的常规技术,这些技术在现有文献中已有完善说明。
[0046]
实施例1
[0047]
本实施例主要介绍一种小鼠马尔尼菲篮状菌潜伏再激活模型的构建方法。
[0048]
请参考图1所示。
[0049]
s1、构建tm感染小鼠:
[0050]
①
动物饲养:在获取动物伦理审核通过后,小鼠饲养在动物生物安全实验室中,动物房的湿度恒定,温度为18~25℃,饲养过程中采取人工昼夜,喂养小鼠饲料和灭菌蒸馏水。
[0051]
②
tm感染小鼠:纯化的tm 18224标准株从美国模式菌种保藏中心(atcc)获得。取出冷藏于4℃的tm标准株菌悬液,菌悬液浓度可通过血球计数仪直接计数或比浊法进行确定,浓度分别为108cfu/ml,通过尾静脉注射0.2ml悬液实现小鼠tm感染。感染后维持饲养小鼠42天,分别在7天、14天、21天、28天、35天、42天处死小鼠,获取血液、肝、脾等组织标本。
[0052]
③
动物解剖及标本处理:小鼠在腹腔注射戊巴比妥钠麻醉后,摘除眼球获取血液,置于含edta抗凝管中,之后使用颈椎脱臼的方式进行安乐死。无菌解剖小鼠,剖开腹腔、胸腔,观察脏器病变情况和称重,取部分脏器于多聚甲醛中固定,经脱水、浸蜡和包埋,5μm连续切片后进行h&e和pas染色,光学显微镜下观察其病理改变。称取25mg肝脏及1/2脾脏于灭菌研磨器中,加入200ul无菌生理盐水,研磨成匀浆。将匀浆液进行10倍系列稀释,取原液、10-1
、10-2
、10-3
稀释液,分别接种酵母浸出粉胨葡萄糖琼脂培养基(ypd)(5ul/滴),置于37℃二氧化碳培养箱中培养3天,之后计算脏器荷菌量,荷菌量=菌落均数
×
稀释倍数
×
40
×
(脏器总重量/剪取组织重量)。
[0053]
s2、tm感染小鼠免疫抑制介入:
[0054]
①
腹腔注射环磷酰胺致tm再活化:待tm感染小鼠体内检测不出tm时,腹腔注射环磷酰胺,剂量为200mg/kg,每隔3天注射1次以维持免疫耐受状态,然后分别饲养小鼠至7天、14天和21天后处死小鼠,并获取血液及各脏器样本。
[0055]
②
动物解剖及标本处理:小鼠在腹腔注射戊巴比妥钠麻醉后,摘除眼球获取血液,置于含edta抗凝管中,之后使用颈椎脱臼的方式进行安乐死。无菌解剖小鼠,剖开腹腔、胸腔,观察脏器病变情况和称重,取部分脏器于多聚甲醛中固定,经脱水、浸蜡和包埋,5μm连续切片后进行h&e和pas染色,光学显微镜下观察其病理改变。称取25mg肝脏及1/2脾脏于灭菌研磨器中,加入200ul无菌生理盐水,研磨成匀浆。将匀浆液进行10倍系列稀释,取原液、
10-1
、10-2
、10-3
稀释液,分别接种酵母浸出粉胨葡萄糖琼脂培养基(ypd)(5ul/滴),置于37℃二氧化碳培养箱中培养3天,之后计算脏器荷菌量,荷菌量=菌落均数
×
稀释倍数
×
40
×
(脏器总重量/剪取组织重量)。
[0056]
s3、检测tm潜伏再激活状态:
[0057]
①
体重监测:每日监测小鼠体重变化评估生长状态。
[0058]
②
脏器系数监测:在规定时间点解剖小鼠,摘取脏器并用预冷的无菌生理盐水冲洗干净,将水分吸干后称重,计算脏器系数,脏器系数=脏器重量/小鼠重量,脏器系数反应tm感染后导致的各脏器的病理变化及环磷酰胺抑制免疫功能后的脏器(尤其是免疫器官)变化程度。
[0059]
③
荷菌量监测:小鼠在腹腔注射戊巴比妥钠麻醉后,摘除眼球获取血液,置于含edta抗凝管中,之后使用颈椎脱臼的方式进行安乐死。无菌解剖小鼠,剖开腹腔、胸腔,观察脏器病变情况和称重,取部分脏器于多聚甲醛中固定,经脱水、浸蜡和包埋,5μm连续切片后进行h&e和pas染色,光学显微镜下观察其病理改变。称取25mg肝脏及1/2脾脏于灭菌研磨器中,加入200ul无菌生理盐水,研磨成匀浆。将匀浆液进行10倍系列稀释,取原液、10-1
、10-2
、10-3
稀释液,分别接种酵母浸出粉胨葡萄糖琼脂培养基(ypd)(5ul/滴),置于37℃二氧化碳培养箱中培养3天,之后计算脏器荷菌量,荷菌量=菌落均数
×
稀释倍数
×
40
×
(脏器总重量/剪取组织重量)。
[0060]
④
tm形态学鉴定:荷菌量计数完毕后,将ypd培养板置于28℃培养14-21天,观察菌落是否产红(产红是tm鉴别诊断的特异性标志),轻柔刮取菌丝置于载玻片上,滴加4-5滴乳酸酚棉蓝染色液染色,之后置于光学显微镜下观察菌丝形态并拍照记录。
[0061]
本实施例的有益效果是,有效地解决了不同种类病原体之间的潜伏感染模型建立方法不能适用的问题。本发明所提供的构建方法更加契合于真菌病原体,为本领域技术人员进一步开展关于其他真菌的学术研究提供了技术支撑。面对tm患者经抗真菌治疗痊愈后,疾病复发的概率极高的问题,本发明所提供的模型构建方法,其在动物体内构建的tm潜伏激活模型模拟了真菌在人体内部的动态过程,为tm的防治及药物研发提供模型基础,同时为开发新的tm治疗手段和深入挖掘tm潜伏感染机制提供了工具基础。
[0062]
实施例2
[0063]
本实施例在实施例1的基础上,进一步介绍所述模型的构建方法。
[0064]
请参考图2所示。
[0065]
首先选取balb/c小鼠,所述小鼠为6-8周龄的雌鼠。然后在第0天时,让小鼠适应环境,并且使用耳标钳打孔,做好标记,以备后续实验使用。
[0066]
在第1天采用tm标准株为小鼠给药,定期监测小鼠的生理指标,所述生理指标包括:小鼠体重、脏器荷菌量、脏器系数和tm形态学鉴定。当各项指标表明小鼠已感染tm时,表明tm感染小鼠构建成功,然后持续饲养tm感染小鼠。
[0067]
所述持续饲养的时间为7n天,n为自然数。本实施例采用的持续饲养时间安排如下:
[0068]
感染后维持饲养小鼠42天,分别在7天、14天、21天、28天、35天、42天处死小鼠,获取血液、肝、脾等组织标本。
[0069]
其中对小鼠各项生理指标的监测,可以采取本实施例的方法,也可以根据实际需
要对小鼠进行活体监测等监测方法。
[0070]
其次,在第21天,实验发现,在tm感染小鼠体内无法检出tm,则说明部分可能发生潜伏无法检出。因此,我们进行了步骤s2,tm感染小鼠免疫抑制介入,采用环磷酰胺为小鼠给药。发现又可以检测出tm,说明感染21天后有tm潜伏下来,则说明此时小鼠体内的tm发生免疫逃避。
[0071]
最后,检测tm潜伏再激活状态:监测并记录小鼠的各项生理指标。具体主要过程为:
[0072]
①
体重监测:每日监测小鼠体重变化评估生长状态。
[0073]
②
脏器系数监测:在规定时间点解剖小鼠,摘取脏器并用预冷的无菌生理盐水冲洗干净,将水分吸干后称重,计算脏器系数,脏器系数=脏器重量/小鼠重量,脏器系数反应tm感染后导致的各脏器的病理变化及环磷酰胺抑制免疫功能后的脏器(尤其是免疫器官)变化程度。
[0074]
③
荷菌量监测:小鼠在腹腔注射戊巴比妥钠麻醉后,摘除眼球获取血液,置于含edta抗凝管中,之后使用颈椎脱臼的方式进行安乐死。无菌解剖小鼠,剖开腹腔、胸腔,观察脏器病变情况和称重,取部分脏器于多聚甲醛中固定,经脱水、浸蜡和包埋,5μm连续切片后进行h&e和pas染色,光学显微镜下观察其病理改变。称取25mg肝脏及1/2脾脏于灭菌研磨器中,加入200ul无菌生理盐水,研磨成匀浆。将匀浆液进行10倍系列稀释,取原液、10-1
、10-2
、10-3
稀释液,分别接种酵母浸出粉胨葡萄糖琼脂培养基(ypd)(5ul/滴),置于37℃二氧化碳培养箱中培养3天,之后计算脏器荷菌量,荷菌量=菌落均数
×
稀释倍数
×
40
×
(脏器总重量/剪取组织重量)。
[0075]
④
tm形态学鉴定:荷菌量计数完毕后,将ypd培养板置于28℃培养14-21天,观察菌落是否产红(产红是tm鉴别诊断的特异性标志),轻柔刮取菌丝置于载玻片上,滴加4-5滴乳酸酚棉蓝染色液染色,之后置于光学显微镜下观察菌丝形态并拍照记录。
[0076]
本实施例的有益效果是,通过对实验小鼠持续饲养42天,并监测小鼠的各项生理指标,可以使本领域技术人员直观地获取准确的实验信息,而且获得的数据具有统计学意义。当然,根据不同的实验需求,可以采取不同的饲养周期。
[0077]
实施例3
[0078]
本实施例介绍步骤s1构建tm感染小鼠的过程。
[0079]
请参考图3、图4所示。
[0080]
步骤s1,构建tm感染小鼠。
[0081]
在获取动物伦理审核通过后,小鼠饲养在动物生物安全实验室中,动物房的湿度恒定,温度为18~25℃,饲养过程中采取人工昼夜,喂养小鼠饲料和灭菌蒸馏水。本实验所使用的的小鼠为balb/c小鼠,且6-8周龄的雌鼠。
[0082]
在第0天,让小鼠适应环境,并且使用耳标钳打孔,做好标记。然后,从第0天起,每天对小鼠进行称重并记录数据,以备后续实验使用。
[0083]
在第1天,取出冷藏于4℃的tm标准株菌悬液,菌悬液浓度可通过血球计数仪直接计数或比浊法进行确定,浓度分别为108cfu/ml,本实验所使用的纯化的tm18224标准株从美国模式菌种保藏中心(atcc)获得。通过尾静脉给小鼠注射0.2mltm标准株悬液,实现小鼠tm感染。维持饲养tm感染小鼠,并监测小鼠的各项生理指标。
[0084]
在第2天,维持饲养,并监测小鼠的各项生理指标。
[0085]
在第3天,维持饲养,并监测小鼠的各项生理指标。
[0086]
在第4天,维持饲养,并监测小鼠的各项生理指标。
[0087]
在第5天,维持饲养,并监测小鼠的各项生理指标。
[0088]
在第6天,维持饲养,并监测小鼠的各项生理指标。
[0089]
在第7天,监测发现,小鼠的肝脏重量增加了32.6%,脾脏重量增加了266.7%;小鼠肝脏中的菌载量为359869cfu,脾脏中的菌载量为66350cfu。
[0090]
在第8-13天,维持饲养,并监测小鼠的各项生理指标。
[0091]
在第14天,监测发现,小鼠的肝脏重量增加了18.7%,脾脏重量增加了307.5%;小鼠肝脏和脾脏中的菌载量均下降。分别为15579cfu和8360cfu。
[0092]
在第15-20天,维持饲养,并监测小鼠的各项生理指标。
[0093]
在第21天,监测发现,小鼠的肝脏重量开始恢复正常,差异无统计学意义,小鼠的脾脏重量由之前的升高307.5%降为122.2%;此时,小鼠的肝脏和脾脏均未检出tm。
[0094]
本实施例只对前21天小鼠的状况进行说明。根据实验需要,维持饲养,并监测小鼠的各项生理指标。
[0095]
本实施例的有益效果是,选用人工饲养的健康小鼠,采用tm标准株为小鼠给药,持续饲养tm感染小鼠,定期监测小鼠的各项生理指标,包括:小鼠体重、脏器荷菌量、脏器系数和tm形态学鉴定。实验发现,用tm标准株为小鼠给药后,在一段时间内小鼠的脏器系数和脏器荷菌量发生变化。其中,脏器系数反应tm感染后导致的各脏器的病理变化,脏器荷菌量直观的表达了小鼠感染tm的具体情况。
[0096]
实施例4
[0097]
本实施例介绍步骤s2中tm感染小鼠免疫抑制介入的过程。
[0098]
请参考图5、图6和图7所示。
[0099]
在完成步骤s1构建tm感染小鼠后,持续饲养小鼠,并监测小鼠的各项生理指标。
[0100]
在第21天,实验发现,在tm感染小鼠体内无法检出tm,则说明部分可能发生潜伏无法检出。因此,我们进行了步骤s2,tm感染小鼠免疫抑制介入,采用环磷酰胺为小鼠给药。
[0101]
①
我们将tm感染21天的小鼠随机分为2组,其中一组注射ctx,命名为实验组(ct x tm)。另一组作为对照组(tm),注射等量的生理盐水。两组小鼠在未注射ctx时体重保持一致,分别为22.60g和22.24g。
[0102]
②
监测发现,实验组的小鼠在注射ctx(从基线起算)第3天(图5中3d)后,体重降为21.25g,差异有统计学意义。随着注射天数增加,实验组的小鼠体重逐渐降低,在注射ctx第21天(图5中21d)时,小鼠体重降至14.68g。在实验过程中,小鼠重量的其他详细数据请参考图5所示。
[0103]
③
监测发现,实验组的小鼠在注射ctx(从基线起算)7天(图6中7d)后,肝脏的重量未发生变化,脾脏重量下降了65.8%。持续注射21天(图6中21d)后,肝脏重量增加了49.3%,脾脏重量降低由之前的65.8%变为降低54.9%。
[0104]
④
监测发现,实验组的小鼠在注射ctx7天(图7中7d)和14天(图7中14d)后,肝脏和脾脏中均未检出tm。注射21天(图7中21d)后,实验组小鼠的肝脏和脾脏中的荷菌量分别为4400cfu和606cfu。
[0105]
本实施例的有益效果是,综上结果所述,我们发现在无法检出tm的tm感染小鼠中,进过步骤s2又可以检测出tm,说明感染21天后有tm潜伏下来,则说明此时小鼠体内的tm发生免疫逃避,这对本领域技术人员进一步研究tm的致病机理具有积极启示意义。
[0106]
实施例5
[0107]
本实施例介绍步骤s3监测tm潜伏再激活状态的过程。
[0108]
请参考图8所示。
[0109]
关于步骤s3中鉴定tm潜伏再激活状态,所述构建方法的模型再激活评价的指标包括:脏器荷菌量、脏器系数和tm形态学鉴定。
[0110]
1、cfu实验检测不同组织的荷菌量;
[0111]
2、不同温度下培养,在37℃时呈酵母状,有脑回样褶皱,菌落无色素产生。28℃时呈菌丝相,呈淡灰白色菌落,间有暗红色绒毛状,可产生特征性的水溶性葡萄酒红色素,这也是该真菌鉴别诊断的标志之一;
[0112]
3、菌丝经乳酸酚棉蓝染色液染色后,镜下观察可发现tm菌丝相具有帚状枝及分生孢子链,分生孢子梗光滑、无顶囊,小芽胞为圆形或椭圆形,分生孢子从梗尖端长出,帚状支分散,分生孢子呈椭圆形、球形,链长而弯曲。
[0113]
本实施例的有益效果是,从生物试验检测角度,科学定量地为tm潜伏再激活模型的构建提供判断依据。
[0114]
实施例6
[0115]
本实施例在实施例1或2或3或4或5任一实施例的基础上,进一步对模型构建作补充说明。
[0116]
请参考图1所示。
[0117]
通过尾静脉注射的方式建立感染模型(2
×
107cfu),血液传播可将真菌传输到机体的各个部位(包括突破血脑屏障,侵入脑组织),其目的是模拟tm在体内弥散性感染的过程。
[0118]
tm在健康个体中并不发病,而是呈现无症状的潜伏性感染,主要隐藏和潜伏于网状内皮系统。当通过尾静脉将tm注射至小鼠体内后,大部分真菌可在免疫系统的作用下逐渐被清除,部分可潜伏到组织中形成潜伏性感染状态。另外,大量tm的刺激可使小鼠肝组织发生炎症病变,这可能是肝脏肉芽肿形成的因素之一,肉芽肿可保护藏匿其中的tm免受免疫系统的攻击。
[0119]
上述情况可能导致tm在机体不同组织中发生潜伏,实验观察到tm感染21天后,小鼠血液、肝脏和脾脏中均未能检出tm,提示大部分tm已被清除,但不排除潜伏的可能。随后,对未检出tm的小鼠腹腔注射环磷酰胺(200mg/kg)以抑制机体免疫功能,为了维持免疫耐受的状态,每隔3天注射1次。一旦机体免疫功能低下(主要为后天免疫受损),tm则会通过血液逐渐传播至全身各个器官系统,容易造成全身器官衰竭。我们发现注射环磷酰胺3天后,小鼠体重显著下降,差异有统计学意义。小鼠肝脏在注射21天后发生肿大,而脾脏在第7天就表现出缩小的状态,因为环磷酰胺抑制了免疫系统,脾脏作为免疫器官,其功能也大大被抑制。我们在第21天时检测到肝脏和脾脏中存在的tm,提示潜伏在体内的tm在机体免疫力降低的情况下再度激活。
[0120]
本实施例的有益效果是,为研究tm提供工具模型,拓宽了研究思路。尤其是tm作为
一种温度双向型真菌,其致病机理不同与病毒和细菌,本发明所提供的tm潜伏再激活模型进一步为tm潜伏感染发生的分子机制研究提供了充分的依据和坚实的前期基础。而且在制备预防或治疗tm感染中的至少一种疫苗药物或免疫佐剂中的应用提供了工具基础。
[0121]
应当理解的是,本发明的上述具体实施方式仅仅用于示例性说明或解释本发明的原理,而不构成对本发明的限制。因此,在不偏离本发明的精神和范围的情况下所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。此外,本发明所附权利要求旨在涵盖落入所附权利要求范围和边界、或者这种范围和边界的等同形式内的全部变化和修改例。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。