1.本发明涉及脂肪酶的固定化,尤其涉及一种树脂固定化酶制备方法及其应用。
背景技术:
2.脂肪酶是重要的工业酶制剂品种之一,可以催化解脂、酯交换、酯合成等反应,广泛应用于油脂加工、食品、医药、日化等工业。然而直接使用游离的脂肪酶粉末,因其容易受到ph、温度等条件的影响使活性无法充分表达,同时由于其回收困难,大多数情况下只能使用一次,导致工业应用中成本高。因此,通常将脂肪酶进行固定化再应用于酯化和酯交换反应,常用的载体例如离子交换树脂、大孔吸附树脂等多孔性载体。
3.脂肪酸是由碳、氢、氧三种元素组成的一类化合物,一般来说,碳原子数在8个以上的脂肪酸才具有较好的表面活性,是一类弱电离表面活性剂,对溶液的ph值具有响应的性质,在不同ph条件下脂肪酸分子能够以不同的形式存在。在低ph条件下,脂肪酸分子几乎没有电离,全部以未解离的酸形式存在,在水中的溶解度极小;增加ph值脂肪酸去质子化,当ph值至pka附近(ph为7-9之间)时,未解离的脂肪酸分子和解离的脂肪酸分子所占比例大致相等,两种分子可以通过形成氢键的方式紧密结合,此时体系中形成大量的氢键;当溶液处于高ph值条件下,脂肪酸分子的羧酸基团全部为去质子化的羧酸根阴离子,分子之间由于静电作用相互排斥(徐文龙.脂肪酸皂水溶液聚集结构、形成机理及其功能研究[d].济南:山东大学,2016)。去质子化的脂肪酸具有很好的表面活性,能够在非极性固体表面单层吸附。
[0004]
公开号为cn106867989a公开了一种固定化酶及其制备方法,其包括:将强碱性离子交换树脂与脂肪酸盐溶液和脂肪酶溶液接触,获得混合液;(2)将上述步骤(1)所得混合液进行干燥。所得的固定化脂肪酶的专一性、酯交换活力和酯化活力优异。所述固定化酶载体为强碱性离子交换树脂,但以大孔吸附树脂为载体的固定化效果并没有报道。
[0005]
公开号为cn102016019a和cn1477201a公开了一种高活性固定化酶制备方法,其包括:将脂溶性脂肪酸或其衍生物在有机溶剂中溶解、分散后对固定化酶载体进行处理得到处理的载体,固定化时使用的酶溶液的ph值只要在不引起酶变性的范围内即可,可以根据温度相同时酶的特性决定,但优选ph值为3~9,制造高活性的酯化反应用固定化酶。同时作为脂溶性脂肪酸处理载体过程中需要使用有机溶剂,有机溶剂大部分都是易燃易爆(乙醇、正己烷等)或对人体具有毒性和致癌性如氯仿,且使用和储存过程中存在安全隐患,挥发性较强污染环境。在食品工业中,为了保证食品安全应尽可能减少有机溶剂的使用。
技术实现要素:
[0006]
本发明提供了一种树脂固定化酶的制备方法以及采用该方法制备获得的固定化脂肪酶。采用本发明方法制备的固定化酶具有活性高,操作稳定性好等优点。
[0007]
本发明提供的固定化酶的制备方法包括载体前处理步骤和固定化步骤,其中,
[0008]
所述载体前处理步骤包括:
[0009]
⑴
将非极性大孔吸附树脂载体与脂肪酸盐溶液接触,得到吸附脂肪酸盐的树脂载体;和
[0010]
⑵
将所述吸附脂肪酸盐的树脂载体使用酸或呈酸性的酸式盐进行处理,优选的酸为盐酸、磷酸、硫酸,优选的呈酸性的酸式盐为磷酸二氢钠、硫酸氢钠、硫酸氢铵,然后用水或缓冲液清洗,缓冲液优选为磷酸盐缓冲液、柠檬酸盐缓冲液、乙酸-乙酸盐缓冲液,得到脂肪酸修饰的非极性大孔吸附树脂载体;
[0011]
所述固定化步骤包括:
[0012]
①
将经脂肪酸修饰的非极性大孔吸附树脂载体与ph小于6.5的脂肪酶的溶液接触,以获得固定化完成率50%~80%的树脂载体;和
[0013]
②
将步骤
①
所得固定化完成率50%~80%的树脂载体与ph为7~9之间的脂肪酶的溶液接触进行固定至固定化完成,过滤,干燥得固定化酶;
[0014]
在本发明的一些具体实施方案中,步骤
①
和
②
所用脂肪酶为相同脂肪酶。在本发明的一些具体实施方案中,步骤
①
和
②
所用脂肪酶为米根霉脂肪酶。
[0015]
在本发明的一些具体实施方案中,所述非极性大孔吸附树脂为苯乙烯系大孔吸附树脂,例如,可以包括但不限于为ecr1090、d101、d3520、diaion hp-20、ads-5树脂。在本发明的一些具体实施方案中,所述苯乙烯系大孔吸附树脂的比表面积为350~1000m2/g,孔径为5nm~120nm。
[0016]
在本发明的一些具体实施方案中,所述非极性大孔吸附树脂的有效粒径小于650μm,范围粒度≥95%,和/或,均一系数<1.8,优选≤1.5。
[0017]
在本发明的一些具体实施方案中,所述脂肪酸盐为长链脂肪酸的碱金属盐。在本发明的一些具体实施方案中,碱金属盐为钠盐或钾盐中的至少一种。在本发明的一些具体实施方案中,所述脂肪酸盐选自油酸钠、亚油酸钠、油酸钾、亚麻酸钠。
[0018]
在本发明的一些具体实施方案中,所述脂肪酸盐溶液的浓度为0.001g/ml~0.20g/ml,和/或,所述脂肪酸盐溶液的ph为9.0~14.0,优选9.5~12,和/或,所述脂肪酸盐溶液的温度为25℃~95℃,和/或,大孔吸附树脂载体质量与脂肪酸盐溶液的体积比为1:1~1:20。
[0019]
在本发明的一些具体实施方案中,所述吸附脂肪酸盐的树脂载体使用酸或呈酸性的酸式盐处理ph为1~6.0,优选3.0~5.5,和/或,所述处理温度为25℃~95℃,优选50~75℃。
[0020]
在本发明的一些具体实施方案中,所述脂肪酸修饰的树脂载体中脂肪酸含量1%~25%,优选3%~20%。在本发明的一些具体实施方案中,所述脂肪酸可以为一种或多种脂肪酸。在本发明的一些具体实施方案中,脂肪酸为在常温下为液体的脂肪酸,例如油酸、亚油酸、亚麻酸。
[0021]
在本发明的一些具体实施方案中,所述脂肪酶的溶液的缓冲液选自磷酸盐缓冲液、tris-hcl缓冲液、甘氨酸缓冲液,所述缓冲溶液的浓度为0.05m~0.5m。
[0022]
本发明还提供了采用上述任一项所述方法制备的固定化脂肪酶。
[0023]
本发明还提供了采用上述任一项所述方法制备的固定化脂肪酶用于进行酯化或酯交换反应的用途。
具体实施方式
[0024]
以下,针对本发明的内容进行详细说明。以下所记载的技术特征的说明基于本发明的代表性的实施方案、具体例子而进行,但本发明不限定于这些实施方案、具体例子。需要说明的是:
[0025]
本说明书中,使用“数值a~数值b”表示的数值范围是指包含端点数值a、b的范围。
[0026]
本说明书中,使用“以上”或“以下”表示的数值范围是指包含本数的数值范围。
[0027]
本说明书中,使用“可以”表示的含义包括了进行某种处理以及不进行某种处理两方面的含义。
[0028]
本说明书中,使用“任选”或“任选的”表示某些物质、组分、执行步骤、施加条件等因素使用或者不使用。
[0029]
本说明书中,所使用的单位名称均为国际标准单位名称,并且如果没有特别声明,所使用的“%”均表示重量或质量百分含量。
[0030]
本说明书中,如没有特别声明,则“多(个/种)”指的是具有两个/种或两个/种以上的情况。
[0031]
本说明书中,所提及的“一些具体/优选的实施方案”、“另一些具体/优选的实施方案”、“实施方案”等是指所描述的与该实施方案有关的特定要素(例如,特征、结构、性质和/或特性)包括在此处所述的至少一种实施方案中,并且可存在于其它实施方案中或者可不存在于其它实施方案中。另外,应理解,所述要素可以任何合适的方式组合在各种实施方案中。
[0032]
本发明提供了一种树脂固定化酶的制备方法以及采用该方法制备获得的固定化脂肪酶。采用本发明方法制备的固定化酶具有活性高,操作稳定性好等优点。
[0033]
本发明提供的固定化酶的制备方法包括载体前处理步骤和固定化步骤,其中,
[0034]
所述载体前处理步骤包括:
[0035]
(1)将大孔吸附树脂载体,例如非极性大孔吸附树脂载体,与脂肪酸盐溶液接触,得到吸附脂肪酸盐的树脂载体;和
[0036]
⑵
将所述吸附脂肪酸盐的树脂载体使用酸或呈酸性的酸式盐进行处理,优选的酸为盐酸、磷酸、硫酸,优选的呈酸性的酸式盐为磷酸二氢钠、硫酸氢钠、硫酸氢铵,然后用水或缓冲液清洗,缓冲液优选为磷酸盐缓冲液、柠檬酸盐缓冲液、乙酸-乙酸盐缓冲液,得到脂肪酸修饰的非极性大孔吸附树脂载体;
[0037]
所述固定化步骤包括:
[0038]
①
将经脂肪酸修饰的非极性大孔吸附树脂载体与ph小于6.5的脂肪酶的溶液接触,以获得固定化完成率50%~80%的树脂载体;和
[0039]
②
将步骤
①
所得固定化完成率50%~80%的树脂载体与ph为7~9之间的脂肪酶的溶液接触进行固定至固定化完成,过滤,干燥得固定化酶;
[0040]
在本发明中,“将大孔吸附树脂载体与脂肪酸盐溶液接触”可采用包括但不限于以下方法进行:在带搅拌或振荡的容器中将大孔吸附树脂载体浸泡脂肪酸盐溶液中,通过搅拌或振荡进行吸附,或通过将脂肪酸盐溶液以一定的流速通过大孔吸附树脂载体填充的固定床层进行吸附或将树脂固定到旋转床反应器上浸泡到脂肪酸盐溶液中进行吸附,所述的旋转床反应器如spinchem旋转床反应器。
[0041]
在本发明中,“将吸附脂肪酸盐的树脂载体使用酸或呈酸性的酸式盐进行处理”可采用包括但不限于以下方法进行:在带搅拌或振荡的容器中将吸附脂肪酸盐的树脂载体浸泡酸或呈酸性的酸式盐溶液中,在搅拌或振荡下进行处理,或将酸或呈酸性的酸式盐溶液以一定的流速通过吸附脂肪酸盐的树脂载体填充的固定床层进行吸附或将吸附脂肪酸盐的树脂固定到旋转床反应器上浸泡到酸或呈酸性的酸式盐溶液中进行处理,所述的旋转床反应器如spinchem旋转床反应器。同样的,用水或缓冲液清洗可采用包括但不限于以下方法进行:在带搅拌或振荡的容器中将经过酸或呈酸性的酸式盐处理后的树脂载体浸泡水或缓冲液溶液中,在搅拌或振荡下进行清洗,或将水或缓冲液以一定的流速通过酸或呈酸性的酸式盐处理后的树脂载体填充的固定床层进行清洗或将酸或呈酸性的酸式盐处理后的树脂载体固定到旋转床反应器上浸泡到水或缓冲液中进行清洗,所述的旋转床反应器如spinchem旋转床反应器。
[0042]
在本发明中,“将经脂肪酸修饰的非极性大孔吸附树脂载体与ph小于6.5的脂肪酶的溶液接触”可采用包括但不限于以下方法进行:在带搅拌或振荡的容器中将经脂肪酸修饰的非极性大孔吸附树脂载体浸泡ph小于6.5的脂肪酶的溶液中,在搅拌或振荡下进行固定,或将经脂肪酸修饰的非极性大孔吸附树脂载体固定到旋转床反应器上浸泡到ph小于6.5的脂肪酶溶液中进行固定,所述的旋转床反应器如spinchem旋转床反应器。
[0043]
在本发明中,将固定化完成率50%~80%的树脂载体与ph为7~9之间的脂肪酶的溶液接触进行固定至固定化完成可采用包括但不限于以下方法进行:在带搅拌或振荡的容器中将固定化完成率50%~80%的树脂载体浸泡ph为7~9之间的脂肪酶的溶液中,在搅拌或振荡下进行固定至固定化完成,或将固定化完成率50%~80%的树脂载体固定到旋转床反应器上浸泡到ph为7~9之间的脂肪酶溶液中进行固定至固定化完成,所述的旋转床反应器如spinchem旋转床反应器。其中,“固定化完成”指:通过测定固定化过程中连续间隔一定时间(如1h)两次测定的酶溶液蛋白含量的差值与酶溶液初始蛋白含量的比值小于2%来判断固定化完成,可采用包括但不限于考马斯亮蓝法、双缩脲法、lowry法方法确定。
[0044]
在本发明中,可采用常规方法对固定化完成的固定化脂肪酶进行过滤,干燥,其中,过滤方法可采用真空过滤、加压过滤、离心过滤,干燥方法可采用流化床干燥、自然干燥、减压干燥。
[0045]
在本发明中,术语“苯乙烯系大孔吸附树脂”是指包括苯乙烯均聚物和以苯乙烯为主要成分的共聚物在内的以吸附为特点,具有多孔立体结构的一类高分子聚合物,具体而言,可包括但不限于:漂莱特(中国)有限公司的ecr1090树脂、天津南开和成科技有限公司的d101、d3520和ads-5树脂、日本三菱化学株式会社的diaion hp-20树脂。
[0046]
在本发明中,术语“呈酸性的酸式盐”是指可电离出氢离子,其水溶液呈酸性(即ph值小于7)的盐。
[0047]
在本发明中,术语“固定化完成率”定义如下:固定化酶制备过程树脂吸附酶液中酶蛋白是由一步吸附得到固定化酶定义为固定化完成率为100%,树脂上吸附的总酶蛋白量计为m;当把固定化酶制备过程中树脂吸附酶液中酶蛋白由一步吸附分成两步吸附制备固定化酶,则第一步树脂与酶液接触吸附酶液中酶蛋白,树脂吸附酶蛋白量计为m1;第二步是将第一步吸附有酶蛋白的树脂继续与酶液接触吸附酶液中的酶蛋白,吸附完成后得到固定化酶,则第一步固定化的固定化完成率为m1/m*100%。
[0048]
在本发明的一些具体实施方案中,步骤
①
和
②
所用脂肪酶为相同脂肪酶。在本发明的一些具体实施方案中,步骤
①
和
②
所用脂肪酶为米根霉脂肪酶。
[0049]
在本发明的一些具体实施方案中,所述非极性大孔吸附树脂为苯乙烯系大孔吸附树脂,例如,可以包括但不限于为漂莱特(中国)有限公司的ecr1090树脂、天津南开和成科技有限公司的d101、d3520和ads-5树脂、日本三菱化学株式会社的diaion hp-20树脂。在本发明的一些具体实施方案中,所述苯乙烯系大孔吸附树脂的比表面积为350~1000m2/g,孔径为5nm~120nm。
[0050]
在本发明的一些具体实施方案中,所述非极性大孔吸附树脂的有效粒径小于650μm,范围粒度≥95%,和/或,均一系数<1.8,优选≤1.5。在本发明的一些具体实施方案中,所述非极性大孔吸附树脂通过使用两个标准筛网筛分,取能从小目数筛网漏过而不能从大目数筛网漏过部分组分并去除有机杂质和其它不溶物而获得。在本发明的一些具体实施方案中,用乙醇、丙酮等亲水溶剂浸泡清洗去除有机杂质和其它不溶物,进一步的,还可以用水,例如去离子水冲洗至无乙醇或丙酮。在制备非极性大孔吸附树脂时,本领域的技术人员可根据需要选择所使用的小目数筛网与大目数筛网。在本发明的一些具体实施方案中,所述小目数筛网与大目数筛网可按下表的配合方式使用:
[0051]
小目数筛网/目大目数筛网可选/目2030、35、402530、35、403035、40、453540、45、504045、50、604550、60、705060、70、806070、80、1007080、100、120
[0052]
在本发明中,术语“有效粒径”指的gb/t 5758中定义的树脂试样颗粒按直径由大至小排列至排完90%体积的颗粒,规定其中最小颗粒的直径为有效粒径,用符号d
90
表示(单位:mm)。
[0053]
在本发明中,术语“均一系数”指的gb/t 5758中定义的树脂试样颗粒按直径由大至小排列至排完40%体积的颗粒,其中最小颗粒的直径为d
40
(单位:mm),规定d
40
和有效粒径的比值为其均一系数。
[0054]
在本发明的一些具体实施方案中,所述脂肪酸盐为长链脂肪酸的碱金属盐。在本发明的一些具体实施方案中,碱金属盐为钠盐或钾盐中的至少一种。在本发明的一些具体实施方案中,所述脂肪酸盐选自油酸钠、亚油酸钠、油酸钾、亚麻酸钠。
[0055]
在本发明的一些具体实施方案中,所述脂肪酸盐溶液的浓度为0.001g/ml~0.20g/ml,和/或,所述脂肪酸盐溶液的ph为9.0~14.0,优选9.5~12,和/或,所述脂肪酸盐溶液的温度为25℃~95℃,和/或,大孔吸附树脂载体质量与脂肪酸盐溶液的体积比为1:1~1:20。
[0056]
在本发明的一些具体实施方案中,所述吸附脂肪酸盐的树脂载体酸处理ph为1~
6.0,优选3.0~5.5,和/或,所述吸附脂肪酸盐的树脂载体酸处理温度为25℃~95℃,优选50~75℃。
[0057]
在本发明的一些具体实施方案中,所述脂肪酸修饰的树脂载体中脂肪酸含量1%~25%,优选3%~20%。在本发明的一些具体实施方案中,所述脂肪酸可以为一种或多种脂肪酸。在本发明的一些具体实施方案中,脂肪酸为在常温下为液体的脂肪酸,例如油酸、亚油酸、亚麻酸。
[0058]
在本发明的一些具体实施方案中,所述脂肪酶的溶液的缓冲液选自磷酸盐缓冲液、tris-hcl缓冲液、甘氨酸缓冲液,所述缓冲溶液的浓度为0.05m~0.5m。
[0059]
本发明还提供了采用上述任一项所述方法制备的固定化脂肪酶。
[0060]
本发明还提供了采用上述任一项所述方法制备的固定化脂肪酶用于进行酯化或酯交换反应的用途。
[0061]
实施例
[0062]
以下,将通过具体的实施例对本发明进行说明,但本发明不限定于这些实施例。
[0063]
树脂载体脂肪酸含量测定方法:准确称取5~10g含脂肪酸的干树脂载体(质量为m0),置于100ml容量瓶中,然后加入25ml乙醚,塞紧塞子,剧烈振荡萃取树脂上的脂肪酸,静置后将乙醚层倒入圆口烧瓶中,加入新的25ml乙醚继续萃取,萃取4次后,合并萃取的乙醚,旋转蒸发除去乙醚,真空干燥得到脂肪酸含量m1。
[0064]
树脂含脂肪酸的量p(%)=m1/m0*100%。
[0065]
大孔吸附树脂预处理:
[0066]
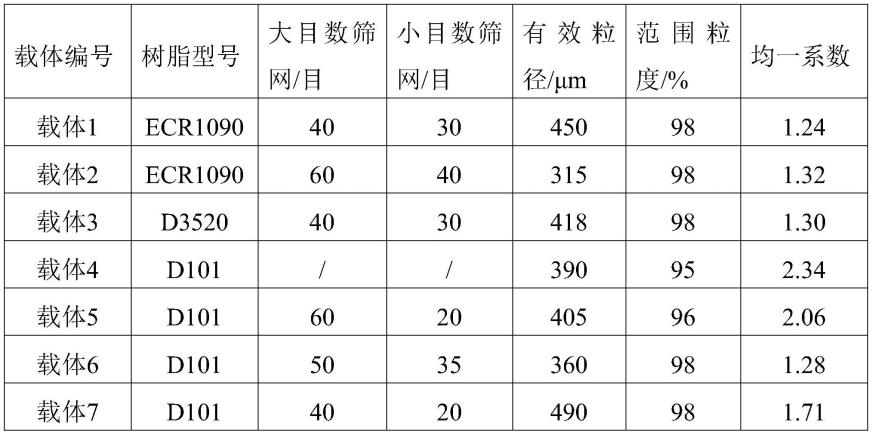
将购自漂莱特(中国)有限公司的大孔吸附树脂ecr1090(粒径0.3~0.71mm,范围粒度95%,均一系数1.9)和购自天津南开和成科技有限公司的大孔吸附树脂d101(粒径0.315~1.25mm,范围粒度95%,均一系数2.34)及大孔吸附树脂d3520(粒径0.315~1.25mm,范围粒度95%,均一系数2.41)用两个标准筛网筛分,取能从小目数筛网漏过而不能从大目数筛网漏过部分组分,用乙醇浸泡清洗去除有机杂质和其它不溶物,用去离子水冲洗至无醇味,置于去离子水中备用,获得不同要求大孔吸附树脂载体,树脂范围粒度、有效粒径和均一系数由激光粒度分析仪测定。
[0067]
表1树脂载体参数信息
[0068]
[0069][0070]
脂肪酶酶液制备:
[0071]
将40g米根霉脂肪酶粉末(购自广州溢多利)溶于200ml的0.2m一定ph的磷酸盐缓冲液中,3500rpm离心5min,除去不溶性杂质,得米根霉脂肪酶酶液(考马斯亮蓝法测得酶蛋白浓度13.1mg/ml);
[0072]
将40g米根霉脂肪酶df-15粉末(购自日本田野)溶于250ml的0.1m一定ph的甘氨酸缓冲液中,得df-15酶酶液(考马斯亮蓝法测得酶蛋白浓度8.3mg/ml);
[0073]
将40g疏绵状嗜热丝孢菌脂肪酶粉末(购自宁夏夏盛实业集团)溶于200ml的0.1m一定ph的甘氨酸缓冲液中,得疏绵状嗜热丝孢菌脂肪酶酶液(考马斯亮蓝法测得酶蛋白浓度12.5mg/ml);
[0074]
表2酶液参数信息
[0075][0076][0077]
实施例1
[0078]
1.1、载体前处理
[0079]
将250g载体1加入到600ml浓度为0.025g/ml,ph为10.0的油酸钠(购自阿拉丁试剂)水溶液中,25℃下吸附4h后;加入到400ml浓度为2.0mol/l的盐酸中55℃下搅拌6h,冷却室温后过滤,用去离子水清洗树脂,最后用20mm的ph为6.0磷酸盐缓冲液平衡得脂肪酸修饰载体1,脂肪酸含量10.8%。
[0080]
1.2、酶固定化
[0081]
取20g脂肪酸含量10.8%修饰的载体1与一定量酶液x进行固定化,吸附5h后(计算固定化完成率),将ph值调节至酶液y相同ph值后加入一定量酶液y继续吸附5h,过滤,干燥得固定化酶。
[0082]
1.3、固定化酶酯交换活力测定
[0083]
以精炼大豆油(嘉里(上海)食品工业有限公司)和极度氢化大豆油(嘉里(上海)特种油脂有限公司)的混合物为底物(w/w=73:27),以固定化酶和底物质量比为1:20,于70℃反应30min,反应完后测定产物40℃的固体脂肪含量(即sfc含量)。
[0084]
40℃的sfc含量测定方法为:将装有样品的固脂管分别放入100℃烘箱中15min,60℃水浴5min,0℃水浴60min,40℃水浴30min,然后用核磁共振仪测其固脂含量。
[0085]
酯交换活力的计算公式:
[0086]
酯交换活力/iun=(sfc
blank-sfc
样品
)/30*1260
[0087]
sfc
blank
指酯交换未反应的底物在40℃下sfc值;
[0088]
sfc
样品
指经过酶法酯交换反应产物样品的sfc值;
[0089]
表3固定化酶工艺和酯交换活力
[0090][0091]
由表3可见,按本发明方法制备的固定化酶a1、b1和c1比其他工艺条件制备的固定化酶d1、e1、f1、g1、h1、i1、j1、k1、l1和m1的酯交换活力都要高。
[0092]
1.4、固定化酶应用于催化合成1,3-二油酸-2-棕榈酸甘油三酯(opo)
[0093]
棕榈仁油与油酸按质量比1:2的比例混合熔化配成反应底物,加入反应底物6%固定化酶,60℃摇床200rpm反应6h,除去反应产物重新加入新的反应底物继续进行批次反应,
反应后的油样gc测定脂肪酸甘油酯组成(opo含量以c52计)。
[0094]
gc测定反应后油样脂肪酸甘油酯组成
[0095]
气相色谱条件:agilent 6890气相色谱仪,色谱柱是db-1ht毛细管柱(15m
×
0.25mm
×
0.1μm),fid检测器;检测条件为柱温250℃,恒温保持2min,以10℃/min升至350℃,保持10min,进样温度320℃,检测器温度350℃。测得样品c52含量如下表3所示:
[0096]
表4固定化酶催化合成opo不同批次反应油样c52含量
[0097][0098]
由表4可见,按本发明方法制备的固定化酶a1、b1和c1比其他工艺条件制备的固定化酶d1、e1、f1、g1、h1、i1、j1、k1、l1和m1应用于opo合成批次操作稳定性更好。
[0099]
实施例2
[0100]
2.1、载体前处理
[0101]
将250g载体2加入到350ml浓度为0.030g/ml,ph为13.5的大豆油脂肪酸钾(大豆油脂肪酸皂化制备的脂肪酸钾)水溶液中,65℃下吸附3h后;加入到500ml浓度为4.0mol/l的磷酸二氢钠水溶液中75℃下搅拌6h,冷却室温后过滤,用去离子水清洗树脂,最后用20mm的ph为6.0磷酸盐缓冲液平衡得脂肪酸修饰载体2,脂肪酸含量7.76%。
[0102]
将250g载体2加入到550ml浓度为0.030g/ml,ph为10的葵花籽油脂肪酸钾(葵花籽油脂肪酸皂化制备的脂肪酸钾)水溶液中,25℃下吸附3h后;加入到500ml浓度为4.0mol/l的磷酸氢二钠水溶液中65℃下搅拌6h,冷却室温后过滤,用去离子水清洗树脂,最后用20mm的ph为6.0磷酸盐缓冲液平衡得脂肪酸修饰载体2,脂肪酸含量12.52%。
[0103]
2.2、酶固定化
[0104]
取20g脂肪酸修饰的载体2与25ml酶液x进行接触固定化,吸附5后(固定化完成率62.5%),将ph值调节至酶液y相同ph值后加入15ml酶液y继续吸附5h,过滤,干燥得固定化酶。
[0105]
表5固定化酶工艺和酯交换活力
[0106][0107][0108]
由表5可见,按本发明方法制备的固定化酶a2、b2、c2、d2和e2比其他工艺条件制备的固定化酶f2、g2、h2、i2、j2、k2和l2的酯交换活力都要高。
[0109]
实施例3
[0110]
3.1、载体前处理
[0111]
将100g载体3加入到120ml ph为12.0的水中,25℃下作用5h后;加入到50ml浓度为3.0mol/l的盐酸中55℃下搅拌6h,冷却室温后过滤,用去离子水清洗树脂,最后用20mm的ph为6.0磷酸盐缓冲液平衡得载体3,脂肪酸含量0。
[0112]
将100g载体3加入到120ml浓度为0.003g/ml,ph为12.0的油酸钠(购自阿拉丁试剂)水溶液中,25℃下吸附5h后;加入到20ml浓度为3.0mol/l的盐酸中55℃下搅拌6h,冷却室温后过滤,用去离子水清洗树脂,最后用20mm的ph为6.0磷酸盐缓冲液平衡得脂肪酸修饰载体3,脂肪酸含量0.54%。
[0113]
将100g载体3加入到700ml浓度为0.003g/ml,ph为12.0的油酸钠(购自阿拉丁试剂)水溶液中,25℃下吸附5h后;加入到50ml浓度为3.0mol/l的盐酸中55℃下搅拌6h,冷却室温后过滤,用去离子水清洗树脂,最后用20mm的ph为6.0磷酸盐缓冲液平衡得脂肪酸修饰载体3,脂肪酸含量3.44%。
[0114]
将100g载体3加入到140ml浓度为0.060g/ml,ph为12.0的油酸钠(购自阿拉丁试
剂)水溶液中,25℃下吸附5h后;加入到120ml浓度为3.0mol/l的盐酸中55℃下搅拌6h,冷却室温后过滤,用去离子水清洗树脂,最后用20mm的ph为6.0磷酸盐缓冲液平衡得脂肪酸修饰载体3,脂肪酸含量15.76%。
[0115]
将100g载体3加入到140ml浓度为0.10g/ml,ph为12.0的油酸钠(购自阿拉丁试剂)水溶液中,25℃下吸附5h后;加入到120ml浓度为3.0mol/l的盐酸中55℃下搅拌6h,冷却室温后过滤,用去离子水清洗树脂,最后用20mm的ph为6.0磷酸盐缓冲液平衡得脂肪酸修饰载体3,脂肪酸含量23.73%。
[0116]
将100g载体3加入到280ml浓度为0.060g/ml,ph为12.0的油酸钠(购自阿拉丁试剂)水溶液中,25℃下吸附5h后;加入到180ml浓度为3.0mol/l的盐酸中55℃下搅拌6h,冷却室温后过滤,用去离子水清洗树脂,最后用20mm的ph为6.0磷酸盐缓冲液平衡得脂肪酸修饰载体3,脂肪酸含量30.66%。
[0117]
3.2、酶固定化
[0118]
取20g前处理好的载体3与33ml酶液8进行接触固定化,吸附5h后(固定化完成率55.0%),将ph值调节至8.5后加入27ml酶液9继续吸附5h,过滤,干燥得固定化酶。
[0119]
取20g前处理好的载体3与42ml酶液8进行接触固定化,吸附5h后(固定化完成率70.0%),将ph值调节至8.5后加入18ml酶液9继续吸附5h,过滤,干燥得固定化酶。
[0120]
表6固定化酶工艺和酯交换活力
[0121]
[0122][0123]
由表6可见,按本发明方法制备的固定化酶a3、b3、c3、d3、e3和f3比其他工艺条件制备的固定化酶g3、j3、k3、l3、m3、n3和p3的酯交换活力都要高。但采用没有脂肪酸修饰的树脂载体即使固定化时先与ph小于6.5的米根霉脂肪酶的溶液接触至固定化完成率50%~80%;然后将所得固定化完成率50%~80%的树脂载体与ph为7~9之间的米根霉脂肪酶的溶液接触进行固定至固定化完成,干燥得到的固定化酶h3和i3与其他工艺条件制备的固定化酶g3、j3和k3的酯交换活力没有显著的差异。
[0124]
实施例4
[0125]
4.1、载体前处理
[0126]
将载体4、5、6、7、8和9各100g分别加入到135ml浓度为0.022g/ml,ph为9.5的葵花籽油脂肪酸钠(葵花籽油脂肪酸皂化制备的脂肪酸钠)水溶液中,55℃下吸附4h后;加入到200ml浓度为2mol/l的磷酸中75℃下搅拌6h,冷却室温后过滤,用去离子水清洗树脂,最后用20mm的ph为6.0磷酸盐缓冲液平衡得脂肪酸修饰载体4、5、6、7、8和9。
[0127]
4.2、酶固定化
[0128]
取20g脂肪酸修饰的载体与20ml酶液2进行接触固定化,吸附5h后(固定化完成率66.7%),将ph值调节至8.0后,加入10ml酶液5继续吸附5h,过滤,干燥得固定化酶。
[0129]
表7固定化酶工艺和酯交换活力
[0130][0131]
由表7可见,树脂载体有效粒径、范围粒度和均一系数均在本发明范围内制备的固定化酶a4、b4和c4比均一系数不在范围内制备的固定化酶d4和e4及有效粒径不在范围内制备的固定化酶f4的酯交换活力都要高。
[0132]
4.3、酶固定化
[0133]
取20g脂肪酸含量5.22%修饰的载体6与一定量酶液x进行固定化,吸附5h后(计算固定化完成率),将ph值调节至酶液y相同ph值后加入一定量酶液y继续吸附5h,过滤,干燥得固定化酶。
[0134]
表8固定化酶工艺和酯交换活力
[0135][0136]
由表8可见,采用疏绵状嗜热丝孢菌脂肪酶按本发明方法制备的固定化酶g4和h4与其他工艺条件制备的固定化酶i4、j4、k4和l4的酯交换活力没有显著的差异,说明疏绵状嗜热丝孢菌脂肪酶不能实现本发明的效果。
[0137]
实施例5
[0138]
5.1、载体前处理
[0139]
将50g载体1加入到120ml由2.2g油酸(阿拉丁试剂.ar)通过10%氢氧化钠溶液皂化制备的ph为10.5的油酸钠水溶液中,45℃下吸附4h后;加入到100ml浓度为1mol/l的盐酸中55℃下搅拌6h,冷却室温后过滤,用去离子水清洗树脂,最后用20mm的ph为6.0磷酸盐缓冲液平衡得脂肪酸修饰载体1,载体1脂肪酸含量7.6%。
[0140]
将50g载体2采用公开号为cn102016019a和cn1477201a中的脂肪酸修饰载体的方法处理载体,脂肪酸油酸(阿拉丁试剂.ar),修饰后的树脂载体最后用20mm的ph为6.0磷酸盐缓冲液平衡得脂肪酸修饰载体1,载体1脂肪酸含量7.8%。
[0141]
5.2、酶固定化
[0142]
取20g脂肪酸含量7.6%修饰的载体1与24ml酶液8进行接触固定化,吸附5h后(固定化完成率60.0%),将ph值调节至8.5,然后加入16ml酶液9继续吸附5h,过滤,干燥得固定化酶a5。
[0143]
取20g脂肪酸含量7.6%修饰的载体1与40ml酶液8进行接触固定化,吸附5h后(固定化完成率57.1%),将ph值调节至8.5,然后加入30ml酶液9继续吸附5h,过滤,干燥得固定化酶b5。
[0144]
取20g脂肪酸含量7.8%修饰的载体1与24ml酶液8进行接触固定化,吸附5h后(固定化完成率60.0%),将ph值调节至8.5,然后加入16ml酶液9继续吸附5h,过滤,干燥得固定化酶c5。
[0145]
取20g脂肪酸含量7.8%修饰的载体1与40ml酶液8进行接触固定化,吸附5h后(固
定化完成率57.1%),将ph值调节至8.5,然后加入30ml酶液9继续吸附5h,过滤,干燥得固定化酶d5。
[0146]
取20g未经过脂肪酸修饰的载体1与24ml含有0.42g油酸(阿拉丁试剂)的酶液8进行接触固定化,吸附5h后,将ph值调节至8.5,然后加入16ml含有0.35g油酸钠(阿拉丁试剂)酶液9继续吸附5h,过滤,干燥得固定化酶e5。
[0147]
取20g未经过脂肪酸修饰的载体1与24ml含有0.42g油酸(阿拉丁试剂)的酶液8进行接触固定化,吸附5h后,然后加入16ml含有0.35g油酸(阿拉丁试剂)的酶液8继续吸附5h,过滤,干燥得固定化酶f5。
[0148]
取20g未经过脂肪酸修饰的载体1与24ml含有0.42g油酸钠(阿拉丁试剂)的酶液9进行接触固定化,吸附5h后,然后加入16ml含有0.35g油酸钠(阿拉丁试剂)酶液9继续吸附5h,过滤,干燥得固定化酶g5。
[0149]
表9固定化酶工艺和酯交换活力
[0150][0151]
由表9可见,按本发明方法制备的固定化酶a5和b5比现有技术脂肪酸修饰树脂载体ph6.0的酶液接触固定至固定化完成率50%~80%,之后与ph8.0的酶液接触固定至固定化完成制备的固定化酶c5和d5及树脂载体未脂肪酸修饰而是将脂肪酸或脂肪酸盐直接加入到酶液中固定制备的固定化酶e5、f5和g5的酯交换活力都高。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。