剪接调节子用于减慢亨廷顿氏病进展的治疗的用途
1.序列表
2.本技术含有已经以ascii格式电子递交的序列表并且该序列表通过引用以其全文特此并入。在2020年10月22日创建的所述ascii副本命名为pat058724-wo-pct_sl.txt并且大小为6,792字节。
技术领域
3.本发明涉及剪接调节子用于减慢亨廷顿氏病进展的治疗的用途。
背景技术:
4.亨廷顿氏病(hd)是一种遗传性的、神经退行性的和进展性的障碍,在世界范围内每10万人中约有5人患病。它是由亨廷顿基因(即编码亨廷顿蛋白的基因)中的cag重复扩增引起的,并且其特征是运动、认知、精神和功能能力衰退。cag三核苷酸重复扩增导致突变的亨廷顿蛋白(mhtt),突变的亨廷顿蛋白与神经功能障碍和最终死亡有关。
5.在健康个体中,htt基因中cag重复的数量为6到35(seq id no:19)。携带36至39个cag重复(seq id no:20)的个体的疾病外显率降低,但是具有40个或更多cag重复(seq id no:21)的个体几乎可以肯定会患上疾病。如european journal of neurology[欧洲神经病学杂志],2017,24-34所述,hd的临床诊断基于:
[0006]-确定的家族病史或阳性的基因检测结果(即确定cag重复扩增≥36(seq id no:22));和
[0007]-由统一的亨廷顿氏病评分量表(unified huntington’s disease rating scale,uhdrs)总运动得分(tms)诊断的置信度得分(dcs)定义的运动障碍发作,范围从0(无运动异常提示hd)到4(可能归因于hd的运动异常≥99%),其中得分4定义了“运动发作”或“显现的”hd。
[0008]
通常,发作年龄(即dcs达到4)在30至50岁之间,并且临床诊断后的平均存活时间为15至20年。目前,发作后,决定疾病分期的是“功能”(即功能能力的评估)而非运动体征(例如,neurology[神经病学],1979,29,1-3中或在neurology[神经病学],1981,31,1333-1335中)。总功能能力(tfc)量表(例如,在movement disorders[运动障碍],1996,11,136-142中)是uhdrs的组成部分,并且hd患者独立性水平范围从0(完全依赖于所有照护)到13(完全独立)。该量表根据工作能力、处理家庭财务、管理家务、进行日常生活活动以及所需的护理水平来评估hd患者的功能状态。根据uhdrs总功能能力(tfc),将hd分为疾病进展的1至5期。根据tfc评分(也称为shoulson和fahn期)对hd的分类也被描述为hd的早期(对应于基于tfc评分的1期或2期),中度hd或中期hd(对应于基于tfc得分的3期)和晚期或后期hd(对应于基于tfc得分的4期或5期)。
[0009]
目前,仅对症治疗可用。因此,迄今为止,尚无可用于减慢hd进展的疗法。因此,需要找到用于hd的疾病修饰型疗法(即,可以减慢疾病进展的治疗选项)。
技术实现要素:
[0010]
本发明涉及例如如本文定义的剪接调节子的以下用途:
[0011]-在减慢亨廷顿氏病进展的治疗中;
[0012]-在通过在htt mrna的外显子49和50之间产生框内终止密码子来减慢亨廷顿氏病进展的治疗中;
[0013]-在作为疾病修饰型疗法的亨廷顿氏病治疗中;
[0014]-在减慢与亨廷顿氏病相关的运动功能衰退的治疗中;
[0015]-在减慢与亨廷顿氏病相关的认知衰退的治疗中;
[0016]-在减慢与亨廷顿氏病相关的精神病学衰退的治疗中;
[0017]-在减慢与亨廷顿氏病相关的功能能力衰退的治疗中;或,
[0018]-在减慢亨廷顿氏病病理生理学进展的治疗中。
附图说明
[0019]
图1.用布雷那兰治疗的人成纤维细胞系的rna-seq分析。fc:倍数变化。rpkm:读段/千碱基/百万映射读段。
[0020]
图2.2a、2b、2c:htt转录本和蛋白的体外调节。
[0021]
图3.在bachd小鼠模型中,单次口服剂量的布雷那兰提高含有新颖外显子的脑htt转录本水平。p值:(媒剂8小时相比于50mg/kg,8小时)**p=0.0034,(媒剂24小时相比于50mg/kg,24小时)****p《0.0001,(媒剂24小时相比于50mg/kg,48小时)**p=0.0020。
[0022]
图4.在bachd小鼠模型中,单次口服剂量的布雷那兰降低了总脑htt转录本水平。
[0023]
图5.在bachd小鼠模型中,单次口服剂量的布雷那兰提高含有新颖外显子的血液htt转录本水平。
[0024]
图6.在bachd小鼠模型中,单次口服剂量的布雷那兰降低总血液htt转录本水平。
[0025]
图7.在bachd小鼠模型中重复口服剂量的布雷那兰降低纹状体中的突变亨廷顿蛋白。p值:(媒剂相比于12mg/kg,24小时)**p=0.048,(媒剂相比于24mg/kg,72小时)***p=0.0003,(媒剂相比于24mg/kg,72小时)****p《0.0001。
[0026]
图8.在bachd小鼠模型中重复口服剂量的布雷那兰降低皮质中的突变htt蛋白。p值-(媒剂相比于12mg/kg,24小时)**p=,(媒剂相比于24mg/kg,72小时)***p,(媒剂相比于24mg/kg,72小时)****p《0.0001。
[0027]
图9.在bachd小鼠模型中重复口服剂量的布雷那兰降低肝脏中的突变htt蛋白。
[0028]
图10.在bachd小鼠模型中重复口服剂量的布雷那兰降低血液中的总htt转录本。
[0029]
图11.在bachd小鼠模型中重复口服剂量的布雷那兰降低csf中的htt突变htt蛋白。
[0030]
图12.在每周施用布雷那兰情况下,sma 1型婴儿中在htt mrna中包含新颖外显子情况下血液转录本的归一化相对量。
[0031]
图13.在每周施用布雷那兰情况下,sma 1型婴儿中血htt mrna水平从基线的中位数变化。
[0032]
图14.适应性ph iib研究设计。tbd=待确定pbo=安慰剂。
[0033]
图15.口服布雷那兰施用后33-39个月大的sma 1型患者血浆中布雷那兰浓度的模
disorders[运动障碍],2015,30(14),1954-1960中])进行评估,它降低与亨廷顿氏病相关的精神病学衰退速率;
[0046]
vi)与安慰剂相比,例如通过使用标准量表(例如临床量表,例如uhdrs总功能能力量表(uhdrs total functional capacity)、功能评估和独立性量表(functional assessment and independence scale)(例如,在movement disorders[运动障碍],1996,11,136-142中)),它降低与亨廷顿氏病相关的功能能力衰退速率;
[0047]
vii)它降低亨廷顿氏病病理生理的进展速率[例如降低与亨廷顿氏病相关的脑(例如全脑、尾核、纹状体或皮质)体积损失速率(例如,相对于基线体积的%)[例如由mri评估,例如通过神经影像测量,例如在lancet neurol.[柳叶刀神经病学]2013,12(7),637-649中];
[0048]
viii)例如,与假手术或安慰剂相比,它减少生活质量的下降,例如通过亨廷顿氏病健康相关生活质量调查表(huntington’s disease health-related quality of life questionnaire,hdqol)评估(例如,在movement disorders[运动障碍],2018,33(5),742-749中)
[0049]
ix)它具有良好的治疗谱,例如良好的安全性谱或代谢谱;例如与脱靶效应,精神疾病不良事件,毒性(例如遗传毒性)或心血管不良事件(例如血压、心率、心电图参数)有关的有利谱
[0050]
下面描述本发明的实施例:
[0051]
实施例(a):
[0052]
实施例1a:一种剪接调节子,其用于在延缓亨廷顿氏病进展的治疗中使用。
[0053]
实施例2a:一种剪接调节子,其用于在作为疾病修饰型疗法的亨廷顿氏病治疗中使用。
[0054]
实施例3a:一种剪接调节子,其用于在减慢与亨廷顿氏病相关的运动功能衰退的治疗中使用。
[0055]
实施例4a:一种剪接调节子,其用于在减慢与亨廷顿氏病相关的认知衰退的治疗中使用。
[0056]
实施例5a:一种剪接调节子,其用于在减慢与亨廷顿氏病相关的精神病学衰退的治疗中使用。
[0057]
实施例6a:一种剪接调节子,其用于在减慢与亨廷顿氏病相关的功能能力衰退的治疗中使用。
[0058]
实施例7a:一种剪接调节子,其用于在减慢亨廷顿氏病病理生理学进展的治疗中使用[例如降低与亨廷顿氏病相关的脑(例如全脑、尾核、纹状体或皮质)体积损失速率(例如,相对于基线体积的%)(例如由mri评估)]。
[0059]
实施例8a:用于根据实施例3a所述使用的剪接调节子,其中运动功能包括选自由以下组成的组中的一种或多种:眼动功能、构音障碍、肌张力障碍、舞蹈症、姿势稳定性和步态。
[0060]
实施例9a:用于根据实施例4a所述使用的剪接调节子,其中认知衰退包括选自下组中的一种或多种的衰退,该组由以下组成:注意力、处理速度、视觉空间处理、时间选择、情绪处理、记忆、言语流畅性、精神运动功能和执行功能。
[0061]
实施例10a:用于根据实施例5a所述使用的剪接调节子,其中精神病学衰退包括选自由以下组成的组中的一种或多种:冷漠、焦虑、抑郁、强迫性行为、自杀念头、易怒和躁动。
[0062]
实施例11a:用于根据实施例6a所述使用的剪接调节子,其中功能能力包括选自由以下组成的组中的一种或多种:工作能力、处理财务的能力、管理家务的能力、进行日常生活活动的能力以及所需的护理水平。
[0063]
实施例12a:用于根据实施例1a至11a中任一项所述使用的剪接调节子,其中亨廷顿氏病的基因特征在于在4号染色体上的亨廷顿基因中从36到39的cag重复扩增(seq id no:20)。
[0064]
实施例13a:用于根据实施例1a至11a中任一项所述使用的剪接调节子,其中亨廷顿氏病的基因特征在于在4号染色体上的亨廷顿基因中》39的cag重复扩增(seq id no:21)。
[0065]
实施例14a:用于根据实施例1a至13a中任一项所述使用的剪接调节子,其中亨廷顿氏病是显现的亨廷顿氏病。
[0066]
实施例15a:用于根据实施例1a至14a中任一项所述使用的剪接调节子,其中亨廷顿氏病是青少年亨廷顿氏病或儿科亨廷顿氏病。
[0067]
实施例16a:用于根据实施例1a至15a中任一项所述使用的剪接调节子,其中亨廷顿氏病是亨廷顿氏病的早期、亨廷顿氏病的中期或亨廷顿氏病的晚期;特别是亨廷顿氏病的早期。
[0068]
实施例17a:用于根据实施例1a至16a中任一项所述使用的剪接调节子,其中亨廷顿氏病是亨廷顿氏病的i期、亨廷顿氏病的ii期、亨廷顿氏病的iii期、亨廷顿氏病的iv期或亨廷顿氏病的v期;特别是亨廷顿氏病的i期或亨廷顿氏病的ii期。
[0069]
实施例18a:用于根据实施例1a至13a中任一项所述使用的剪接调节子,其中亨廷顿氏病是显现前亨廷顿氏病。
[0070]
实施例19a:用于根据实施例1a至18a中任一项所述使用的剪接调节子,其中该剪接调节子根据间歇给药时间表施用。
[0071]
实施例20a:用于根据实施例1a至18a中任一项所述使用的剪接调节子,其中该剪接调节子每周一次或每周两次施用。
[0072]
实施例21a:用于根据实施例1a至20a中任一项所述使用的剪接调节子,其中该剪接调节子口服施用。
[0073]
实施例22a:用于根据实施例1a至21a中任一项所述使用的剪接调节子,其中该剪接调节子以药物组合物的形式提供。
[0074]
实施例23a:用于根据实施例1a至21a中任一项所述使用的剪接调节子,其中该剪接调节子以药物组合的形式提供。
[0075]
实施例24a:用于根据实施例1a至23a中任一项所述使用的剪接调节子,其中该剪接调节子在基因疗法或用反义化合物治疗后施用。
[0076]
实施例25a:用于根据实施例1a至24a中任一项所述使用的剪接调节子,其中该剪接调节子是布雷那兰或其药学上可接受的盐。
[0077]
实施例26a:用于根据实施例1a至24a中任一项所述使用的剪接调节子,其中该剪接调节子是布雷那兰盐酸盐。
[0078]
实施例27a:用于根据实施例1a至24a中任一项所述使用的剪接调节子,其中该剪接调节子选自由以下组成的组:列表4、列表5、列表6、列表7、列表8、列表9、列表10、列表11;列表12和列表13,特别是列表4、列表5、列表6、列表7。
[0079]
实施例28a:用于根据实施例1a至24a中任一项所述使用的剪接调节子,其中该剪接调节子选自由以下组成的组:列表1、列表2和列表3。
[0080]
实施例29a:用于根据实施例1a至24a中任一项所述使用的剪接调节子,其中该剪接调节子选自由以下组成的组:列表14、列表15、列表16、列表17、列表18、列表19、列表20、列表21、列表22、列表23和列表24。
[0081]
实施例(b):
[0082]
实施例1b:一种在有需要的受试者中减慢亨廷顿氏病进展的治疗方法,该方法包括向所述受试者施用有效量的剪接调节子。
[0083]
实施例2b:一种在有需要的受试者中治疗亨廷顿氏病的方法,该方法包括向所述受试者施用有效量的作为疾病修饰型疗法的剪接调节子。
[0084]
实施例3b:一种在有需要的受试者中减慢与亨廷顿氏病相关的运动功能衰退的治疗方法,该方法包括向所述受试者施用有效量的剪接调节子。
[0085]
实施例4b:一种在有需要的受试者中减慢与亨廷顿氏病相关的认知衰退的治疗方法,该方法包括向所述受试者施用有效量的剪接调节子。
[0086]
实施例5b:一种在有需要的受试者中减慢与亨廷顿氏病相关的精神病学衰退的治疗方法,该方法包括向所述受试者施用有效量的剪接调节子。
[0087]
实施例6b:一种在有需要的受试者中减慢与亨廷顿氏病相关的功能能力衰退的治疗方法,该方法包括向所述受试者施用有效量的剪接调节子。
[0088]
实施例7b:一种在有需要的受试者中减慢亨廷顿氏病病理生理学进展[例如降低与亨廷顿氏病相关的脑(例如全脑、尾核、纹状体或皮质)体积损失速率(例如,相对于基线体积的%)(例如由mri评估)]的治疗方法,该方法包括向所述受试者施用有效量的剪接调节子。
[0089]
实施例8b:根据实施例3b所述的方法,其中运动功能包括选自由以下组成的组中的一种或多种:眼动功能、构音障碍、肌张力障碍、舞蹈症、姿势稳定性和步态。
[0090]
实施例9b:根据实施例4b所述的方法,其中认知衰退包括选自下组中的一种或多种的衰退,该组由以下组成:注意力、处理速度、视觉空间处理、时间选择、情绪处理、记忆、言语流畅性、精神运动功能和执行功能。
[0091]
实施例10b:根据实施例5b所述的方法,其中精神病学衰退包括选自由以下组成的组中的一种或多种:冷漠、焦虑、抑郁、强迫性行为、自杀念头、易怒和躁动。
[0092]
实施例11b:根据实施例6b所述的方法,其中功能能力包括选自由以下组成的组中的一种或多种:工作能力、处理财务的能力、管理家务的能力、进行日常生活活动的能力以及所需的护理水平。
[0093]
实施例12b:根据实施例1b至11b中任一项所述的方法,其中亨廷顿氏病的基因特征在于在4号染色体上的亨廷顿基因中从36到39的cag重复扩增(seq id no:20)。
[0094]
实施例13b:根据实施例1b至11b中任一项所述的方法,其中亨廷顿氏病的基因特征在于在4号染色体上的亨廷顿基因中》39的cag重复扩增(seq id no:21)。
[0095]
实施例14b:根据实施例1b至13b中任一项所述的方法,其中亨廷顿氏病是显现的亨廷顿氏病。
[0096]
实施例15b:根据实施例1b至14b中任一项所述的方法,其中亨廷顿氏病是青少年亨廷顿氏病或儿科亨廷顿氏病。
[0097]
实施例16b:根据实施例1b至15b中任一项所述的方法,其中亨廷顿氏病是亨廷顿氏病的早期、亨廷顿氏病的中期或亨廷顿氏病的晚期;特别是亨廷顿氏病的早期。
[0098]
实施例17b:根据实施例1b至16b中任一项所述的方法,其中亨廷顿氏病是亨廷顿氏病的i期、亨廷顿氏病的ii期、亨廷顿氏病的iii期、亨廷顿氏病的iv期或亨廷顿氏病的v期;特别是亨廷顿氏病的i期或亨廷顿氏病的ii期。
[0099]
实施例18b:根据实施例1b至13b中任一项所述的方法,其中亨廷顿氏病是显现前亨廷顿氏病。
[0100]
实施例19b:根据实施例1b至18b中任一项所述的方法,其中该剪接调节子根据间歇给药时间表施用。
[0101]
实施例20b:根据实施例1b至18b中任一项所述的方法,其中该剪接调节子每周一次或每周两次施用。
[0102]
实施例21b:根据实施例1b至20b中任一项所述的方法,其中该剪接调节子口服施用。
[0103]
实施例22b:根据实施例1b至21b中任一项所述的方法,其中该剪接调节子以药物组合物的形式提供。
[0104]
实施例23b:根据实施例1b至21b中任一项所述的方法,其中该剪接调节子以药物组合的形式提供。
[0105]
实施例24b:根据实施例1b至23b中任一项所述的方法,其中该剪接调节子在基因疗法或用反义化合物治疗后施用。
[0106]
实施例25b:根据实施例1b至24b中任一项所述的方法,其中该剪接调节子是布雷那兰或其药学上可接受的盐。
[0107]
实施例26b:根据实施例1b至24b中任一项所述的方法,其中该剪接调节子是布雷那兰盐酸盐。
[0108]
实施例27b:根据实施例1b至24b中任一项所述的方法,其中该剪接调节子选自由以下组成的组:列表4、列表5、列表6、列表7、列表8、列表9、列表10、列表11,列表12和列表13;特别是列表4、列表5、列表6、列表7。
[0109]
实施例28b:根据实施例1b至24b中任一项所述的方法,其中该剪接调节子选自由以下组成的组:列表1、列表2和列表3。
[0110]
实施例29b:根据实施例1b至24b中任一项所述的方法,其中该剪接调节子选自由以下组成的组:列表14、列表15、列表16、列表17、列表18、列表19、列表20、列表21、列表22、列表23和列表24。
[0111]
实施例(c):
[0112]
出人意料地发现,布雷那兰促进包括新颖115-bp外显子,其在htt mrna的外显子49和50之间包含框内终止密码子(从新颖外显子的3'末端起55bp),从而降低htt转录本和蛋白质水平。因此,另一方面,本发明涉及:
[0113]
实施例1c:一种通过在htt mrna的外显子49和50之间产生框内终止密码子在有需要的受试者中减慢亨廷顿氏病进展的治疗方法,该方法包括向所述受试者施用有效量的剪接调节子,例如布雷那兰或其药学上可接受的盐。例如,剪接调节子选自由以下组成的组:列表1、列表2、列表3、列表4、列表5、列表6、列表7、列表8、列表9、列表10、列表11、列表12、列表13、列表14、列表15、列表16、列表17、列表18、列表19、列表20、列表21、列表22、列表23和列表24。
[0114]
实施例2c:一种剪接调节子,例如布雷那兰或其药学上可接受的盐,用于在通过在htt mrna的外显子49和50之间产生框内终止密码子来减慢亨廷顿氏病进展的治疗中使用。例如,剪接调节子选自由以下组成的组:列表1、列表2、列表3、列表4、列表5、列表6、列表7、列表8、列表9、列表10、列表11、列表12、列表13、列表14、列表15、列表16、列表17、列表18、列表19、列表20、列表21、列表22、列表23和列表24。
[0115]
实施例3c:根据实施例1c所述的方法,其中该剪接调节子是布雷那兰或其药学上可接受的盐,例如布雷那兰盐酸盐。
[0116]
实施例4c:用于根据实施例2c所述使用的剪接调节子,其中该剪接调节子是布雷那兰或其药学上可接受的盐,例如布雷那兰盐酸盐。
[0117]
通用术语定义
[0118]
如本文所用,术语“hd”或“亨廷顿氏病”是指神经退行性障碍,其特征在于运动、认知、精神和功能能力衰退,并且由亨廷顿基因中的cag重复扩增引起。
[0119]
如本文所用的术语“显现的hd”或“显现的亨廷顿氏病”是指在临床上已经建立了对hd的诊断{例如,基于如下:确定的家族病史或阳性的基因检测结果(确定cag重复扩增≥36(seq id no:22));以及运动障碍的发作[诊断的置信度得分(dcs)为4,如由统一亨廷顿评分量表(uhdrs)总运动得分(tms)定义]}。在一个实施例中,如本文所用的术语“显现的hd”或“显现的亨廷顿氏病”是指患者在临床上已经建立了对hd的诊断{例如,基于如下:确定的家族病史或阳性的基因检测结果(确定cag重复扩增≥36(seq id no:22));以及运动障碍的发作[诊断的置信度得分(dcs)为4,如由统一亨廷顿评分量表(uhdrs)总运动得分(tms)定义]}。
[0120]
如本文所用的术语“显现前hd”或“显现前亨廷顿氏病”是指具有hd的基因诊断{例如,基于如下:在没有临床建立的运动障碍发作情况下的阳性基因测试(确定cag重复扩增≥40(seq id no:21))},例如,根据标准量表(例如临床量表[例如基于由统一亨廷顿评分量表(uhdrs)总运动得分(tms)定义的诊断的置信度得分(dcs)《4])进行评估。在一个实施例中,如本文所用的术语“显现前hd”或“显现前亨廷顿氏病”是指患者具有hd的基因诊断{例如,基于如下:在没有临床建立的运动障碍发作情况下的阳性基因测试(确定cag重复扩增≥40(seq id no:21))},例如,根据标准量表(例如临床量表[例如基于由统一亨廷顿评分量表(uhdrs)总运动得分(tms)定义的诊断的置信度得分(dcs)《4])进行评估。
[0121]
在一个实施例中,本文所用的术语“减慢hd的进展”、“减慢亨廷顿氏病的进展”、“以减慢hd的进展”或“以减慢亨廷顿氏病的进展”指,例如:
[0122]-降低亨廷顿氏病的进展速率(例如,降低亨廷顿氏病各期之间的进展速率);
[0123]-延迟亨廷顿氏病的发作;
[0124]-延迟与亨廷顿氏病相关的症状的发作;
[0125]-降低与亨廷顿氏病相关的症状(例如一种或多种症状)的进展速率(例如,降低每年的衰退速率);或
[0126]-降低亨廷顿氏病病理生理的进展速率;
[0127]
(例如,与安慰剂相比或与自然历史对照组相比;例如,根据标准量表,例如根据本文以上或以下所述的临床量表,或根据神经影像学测量)。
[0128]
在一个实施例中,如本文所用的术语“进展速率”是指例如年变化速率(例如,衰退)或每年变化速率(例如,衰退),例如,根据标准量表(例如临床量表)评估,或根据神经影像学测量评估。
[0129]
如本文所用的术语“降低”是指例如,降低5%、10%、20%、30%、40%、50%、60%或70%/年治疗。
[0130]
如本文中所使用的,术语“延迟”是指延迟至少例如0.5、1、2、3、4、5、6、7、8、9、10、11、12、13、14或15年。
[0131]
在一个实施例中,本文所用的术语“减慢hd的进展”、“减慢亨廷顿氏病的进展”、“以减慢hd的进展”或“以减慢亨廷顿氏病的进展”是指延迟亨廷顿氏病的发作,例如针对如本文所定义的亨廷顿氏病发作增加时间。在另一个实施例中,如评估的,例如与安慰剂相比,根据标准量表,例如临床量表[例如根据uhdrs总功能能力(tfc)量表(例如,在neurology[神经病学],1979,29,1-3中)],它是指降低亨廷顿氏病各期之间的进展速率,例如降低从hd初始阶段到hd更晚期的进展速率。在一个实施例中,它是指降低从hd的1期到hd的2期的进展速率(例如与安慰剂相比)。在另一个实施例中,它是指降低从hd的2期到hd的3期的进展速率(例如与安慰剂相比)。在另一个实施例中,它是指降低从hd的3期到hd的4期的进展速率(例如与安慰剂相比)。在另一个实施例中,它是指降低从hd的4期到hd的5期的进展速率(例如与安慰剂相比)。在另一个实施例中,它是指降低从早期hd到中期hd的进展速率(例如与安慰剂相比)。在另一个实施例中,它是指降低从中期hd进展到晚期hd的进展速率(例如与安慰剂相比)。如本文所用的术语“降低进展速率”是指例如针对hd期的进展增加时间(例如,与安慰剂相比)。
[0132]
在另一个实施例中,本文所用的术语“减慢hd的进展”、“减慢亨廷顿氏病的进展”、“以减慢hd的进展”或“以减慢亨廷顿氏病的进展”是指将亨廷顿氏病的发作延迟(例如针对如本文所定义的亨廷顿氏病发作增加时间)至少25%(例如25%或更长,例如25%至50%)。
[0133]
如本文所用的术语“亨廷顿氏病的发作”是指如通常所建立的hd的临床诊断[例如,基于诊断的置信度得分(dcs)为4的运动障碍发作(如统一亨廷顿评分量表(uhdrs)总运动得分(tms)定义)]。
[0134]
在另一个实施例中,如本文所用,术语“减慢hd的进展”、“减慢亨廷顿氏病的进展”、“以减慢hd的进展”或“以减慢亨廷顿氏病的进展”是指延迟与亨廷顿氏病相关的症状的发作,例如针对与亨廷顿氏病相关的一种或多种症状的发作增加时间,该症状选自如本文所定义的与亨廷顿氏病相关的运动功能衰退、与亨廷顿氏病相关的认知衰退、与亨廷顿氏病相关的精神病学衰退以及与亨廷顿氏病相关的功能能力衰退。在另一个实施例中,它是指降低与亨廷顿氏病相关的一种或多种症状的进展速率,该症状选自如本文所定义的与亨廷顿氏病相关的运动功能衰退、与亨廷顿氏病相关的认知衰退、与亨廷顿氏病相关的精神病学衰退和与亨廷顿氏病相关的功能能力衰退。如本文所用的术语“降低
……
的速率”是
指例如针对发作增加时间或针对严重程度上升增加时间(例如,与安慰剂相比)。在一个实施例中,本文所用的术语“减慢hd的进展”、“减慢亨廷顿氏病的进展”、“以减慢hd的进展”或“以减慢亨廷顿氏病的进展”是指降低显现前hd到显现的hd的进展速率[延迟了显现的hd的发作;例如与安慰剂相比;例如通过诊断的置信度得分(dcs)为4(如由统一亨廷顿评分量表(uhdrs)总运动得分(tms)定义)评估]。
[0135]
在另一个实施例中,本文所用的术语“减慢hd的进展”、“减慢亨廷顿氏病的进展”、“以减慢hd的进展”或“以减慢亨廷顿氏病的进展”指减慢亨廷顿氏病的病理生理学进展。
[0136]
如本文所用,术语“减慢亨廷顿氏病的病理生理学进展”是指降低亨廷顿氏病病理生理学的进展速率,例如,如通过磁共振成像(mri)[通过神经影像测量,例如在lancet neurol.[柳叶刀神经病学]2013,12(7),637-649中]评估。例如,它是指降低与亨廷顿氏病相关的脑(例如全脑、尾核、纹状体或皮质)体积损失(例如,相对于基线体积的%)速率(例如降低例如相比于安慰剂的年速率)(例如由mri评估)。
[0137]
如本文所用的术语“运动功能”是指hd的运动特征,其包括例如选自由以下组成的组中的一种或多种:眼动功能、构音障碍、舞蹈症、姿势稳定性和步态。
[0138]
如本文所用的术语“运动功能衰退”是指运动功能衰退(例如,相对于正常运动功能或相对于先前的临床就诊)。可以例如根据标准量表(例如临床量表(例如,uhdrs运动评估量表,如通过uhdrs总运动得分测量;例如在movement disorders[运动障碍],1996,11,136-142中))来评估运动功能衰退。
[0139]
如本文所用的术语“减慢运动功能衰退”或“以减慢运动功能衰退”是指降低运动功能衰退速率(例如与安慰剂相比;例如,降低运动功能年衰退速率,例如,相比于安慰剂;例如,如通过uhdrs总运动评分评估)。如本文所用的术语“降低速率”是指针对发作增加时间或针对严重程度上升增加时间(例如,与安慰剂相比;例如,相比于安慰剂,降低年衰退速率)。
[0140]
如本文所用,术语“认知衰退”是指认知能力降低(例如,相对于正常的认知功能或相对于先前的临床就诊)。在一个实施例中,它包括例如选自下组中的一种或多种的衰退,该组由以下组成:注意力、处理速度、视觉空间处理、时间选择、情绪处理、记忆、言语流畅性、精神运动功能和执行功能。例如根据标准量表(例如临床量表)评估认知衰退[例如通过以下评估:符号数字模态测试(symbol digit modalities test),stroop单词阅读测试(stroop word reading test),蒙特利尔认知评估(montreal cognitive assessment)或hd认知评估组(hd cognitive assessment battery)(包括符号数字模态测试,连线测试b(trail making test b),单触长袜(one touch stockings),节奏轻拍(paced tapping),情绪识别测试(emotion recognition test,),霍普金斯言语学习测试(hopkins verbal learning test));例如在movement disorders[运动障碍],2014,29(10),1281-1288中]。
[0141]
如本文所用,术语“减慢认知衰退”或“以减慢认知衰退”是指降低认知衰退速率(例如与安慰剂相比;例如,相比于安慰剂,降低认知衰退年速率;例如,通过符号数字模态测试、stroop单词阅读测试、蒙特利尔认知评估或hd认知评估组评估)。如本文所用的术语“降低速率”是指针对发作增加时间或针对严重程度上升增加时间(例如,与安慰剂相比;例如,相比于安慰剂,降低年衰退速率)。
[0142]
如本文所用的术语“精神病学衰退”是指精神病学功能衰退(例如,相对于正常的
2期,通常,患者仍然可以工作,但是能力较低,尽管有一些困难,但通常能够进行日常活动,并且通常只需要少量帮助;通常是自亨廷顿氏病发作起3至13年。
[0151]
如本文所用的术语“hd 3期”、“hd iii期”、“亨廷顿氏病3期”、“亨廷顿氏病iii期”、“亨廷顿氏病的3期”或“亨廷顿氏病的iii期”是指临床建立的hd疾病期[例如根据标准量表(例如临床量表,例如基于uhdrs总功能能力(tfc)量表)评估,其中tfc得分为4到6]。在hd 3期,通常,患者无法进行工作或管理家务,在日常财务、家庭责任和日常生活中需要提供大量帮助;通常是自亨廷顿氏病发作起5至16年。
[0152]
如本文所用的术语“hd 4期”、“hd iv期”、“亨廷顿氏病4期”、“亨廷顿氏病iv期”、“亨廷顿氏病的4期”或“亨廷顿氏病的iv期”是指临床建立的hd疾病期[例如根据标准量表(例如临床量表,例如基于uhdrs总功能能力(tfc)量表)评估,其中tfc得分为1到3]。在hd 4期,通常,患者是不独立的,但仍可以在家人或专业人士的帮助下在家中居住,但是,在财务、家务和大多数日常活动中需要大量帮助;通常是自亨廷顿氏病发作起9至21年。
[0153]
如本文所用的术语“hd 5期”、“hd v期”、“亨廷顿氏病5期”、“亨廷顿氏病v期”、“亨廷顿氏病的5期”或“亨廷顿氏病的v期”是指临床建立的hd疾病期[例如根据标准量表(例如临床量表,例如基于uhdrs总功能能力(tfc)量表)评估,其中tfc得分为0]。在hd 5期,通常,患者在日常活动中需要专业护理的全面支持;通常是自亨廷顿氏病发作起11至26年。
[0154]
如本文所用,术语“早期hd”、“早期亨廷顿氏病”、“hd的早期”或“亨廷顿氏病的早期”是指hd的疾病期,其中患者在很大程度上是正常功能的并且可以继续独立地工作和生活,尽管遭受例如选自由以下组成的组中的一种或多种:轻微的非自主运动、轻微的协调失调和对复杂问题的思考困难。在一个实施例中,如本文所定义的“早期hd”、“早期亨廷顿氏病”、“hd的早期”或“亨廷顿氏病的早期”是指“hd1期”或“hd 2期”。
[0155]
如本文所用,术语“中期hd”、“中期亨廷顿氏病”、“hd的中期”、“亨廷顿氏病的中期”、“中间期hd”、“中间期亨廷顿氏病”、“hd的中间期”或“亨廷顿氏病的中间期”是指hd的疾病期,其中患者在该阶段可能无法工作,无法管理自己的财务或无法执行自己的家务,但能够进食、穿衣和在帮助下照顾个人卫生。通常,在这个期,例如,舞蹈症可能会突出,以及具有吞咽、平衡、跌倒、体重减轻和问题解决方面的问题。在一个实施例中,如本文所定义,“中期hd”、“中期亨廷顿氏病”、“hd的中期”、“亨廷顿氏病的中期”、“中间期hd”、“中间期亨廷顿氏病”、“hd的中间期”或“亨廷顿氏病的中间期”是指“hd 3期”。
[0156]
如本文所用的术语“晚期hd”、“晚期亨廷顿氏病”、“hd的晚期”、“亨廷顿氏病的晚期”、“后期hd”或“后期亨廷顿氏病”、“hd的后期”或“亨廷顿氏病的后期”是指hd的疾病期,其中患者在日常生活的所有活动中都需要帮助。通常,在该期,例如,舞蹈症可能是严重的,但更常被僵硬、肌张力障碍和运动迟缓所替代。在一个实施例中,如本文所定义的术语“晚期hd”、“晚期亨廷顿氏病”、“hd的晚期”、“亨廷顿氏病的晚期”、“后期hd”或“后期亨廷顿氏病”、“hd的后期”或“亨廷顿氏病的后期”是指“hd 4期”或“hd 5期”。
[0157]
如本文所用的术语“青少年hd”或“青少年亨廷顿氏病”是指如临床上建立的hd的诊断{例如,基于如下:确定的家族病史或阳性的基因检测结果(即确定cag重复扩增≥36(seq id no:22));以及在年龄《21岁症状发作}。在一个实施例中,如本文所用的术语“青少年hd”或“青少年亨廷顿氏病”是指受hd影响{例如基于如下:确定的家族病史或阳性的基因检测结果(即确定cag重复扩增≥36(seq id no:22))}并且在年龄《21岁症状发作的患者。
[0158]
如本文所用的术语“儿科hd”或“儿科亨廷顿氏病”是指受hd影响{例如基于如下:确定的家族病史或阳性的基因检测结果(即确定cag重复扩增≥36(seq id no:22))和临床诊断}并且年龄《18岁的患者。
[0159]
如本文所定义的术语“hd患者”、“亨廷顿氏病患者”、“有亨廷顿氏病的患者”或“有hd的患者”是指hd患者。
[0160]
如本文所用,术语治疗(“treat”、“treating”、“treatment”)或疗法(“therapy”)意指获得有益或所希望的结果,例如临床结果。有益或期望的结果可以包括但不限于稳定或改善hd的期的进展(例如与安慰剂相比)。治疗的一方面是,例如,所述治疗应对患者产生最小不良影响,例如,使用的药剂应具有较高的安全性水平,例如,不会产生不良的副作用。在一个实施例中,如本文所用的术语“用于治疗的方法”是指“用以治疗的方法”。
[0161]
如本文所用的术语“间歇给药方案”或“间歇给药时间表”是指给药方案,其包括施用剪接调节子,例如本文所定义的那些,随后是静息期。例如,根据至少两个周期的间歇给药时间表来施用剪接调节子,每个周期包括(a)给药期,然后(b)静息期。如本文所使用,术语“静息期”指,尤其是指,不向患者施用剪接调节子的时间段(即,其中停止使用剪接调节子的治疗的时间段)。例如本文所定义的那些,例如,如果每天给予剪接调节子,则如果每日施用中断一段时间(例如持续几天)或剪接调节子的血浆浓度在亚治疗水平上维持一段时间(例如持续几天),则会有静息期。剪接调节子的给药期和/或剂量在周期之间可以相同或不同。总治疗时间(即,治疗的周期数)也可以例如基于所治疗的特定患者(例如,hd i期患者),因患者而异。在一个实施例中,间歇给药时间表包括至少两个周期,每个周期包括(a)给药期,在此期间给所述患者施用治疗有效量的剪接调节子并且然后(b)静息期。如本文所用的术语“间歇给药方案”或“间歇给药时间表”是指用于单独施用剪接调节子的给药方案(即单一疗法)或用于与至少一种另外的活性成分组合施用剪接调节子的给药方案(即组合疗法)。在一个实施例中,术语“间歇给药方案”或“间歇给药时间表”是指重复的开/关治疗,其中该剪接调节子以规则的间隔定期施用,例如每周一次、每3天一次、每4天一次或每周两次。
[0162]
在施用药物的上下文中,术语“一周一次”或“每周一次”或“qw”在本文意指每周施用一个剂量的药物一次,其中该剂量是例如在一周的同一天施用。在一个实施例中,如在本文的上文或下文中使用,特别是在实施例和权利要求中,术语施用(administering或administration)每周一次布雷那兰是指施用的布雷那兰量是例如每周一次50mg至200mg,例如每周一次140mg,每周一次200mg至400mg,例如每周一次280mg,或每周一次400mg至700mg,例如每周一次560mg。
[0163]
在施用药物的上下文中,术语“一周两次”或“每周两次”或“biw”在本文意指每周施用一个剂量的药物两次,其中每次施用是例如在分开的两天,例如以规则的间隔,例如间隔72小时。在一个实施例中,如在本文的上文或下文中使用,特别是在实施例和权利要求中,术语施用每周两次布雷那兰是指施用的布雷那兰量是例如每周两次25mg至100mg、例如每周两次70mg,每周两次100mg至200mg,例如每周两次140mg,或每周两次200mg至350mg,例如每周两次280mg。
[0164]
如本文所用,提及布雷那兰或其药学上可接受的盐的量(例如,mg、mg/ml、mg/m2、百分比)应理解为是指如下文所述为游离形式的式(i)的化合物的量,其将相应地适于其药
学上可接受的盐,例如其盐酸盐(例如,布雷那兰盐酸盐一水合物)。
[0165]
如本文所用,术语“(一种或多种)游离形式”或“以游离形式”或“以该游离形式”是指非盐形式(如碱游离形式)的化合物。
[0166]
与数值x相关的术语“约”意指例如x
±
15%,包括该范围内的所有值。
[0167]
如本文所用的术语“疾病修饰型疗法”或“疾病修饰型治疗”是指可修饰或改变病症或障碍或疾病(例如如本文所定义的hd)的过程的药物(即疾病修饰型药物)。
[0168]
如本文所用,术语“受试者”是指哺乳生物,优选人类(男性或女性)。
[0169]
如本文所用,术语“患者”是指患病并将从治疗中受益的受试者。
[0170]
如本文所使用的,如果此类受试者(患者)会在生物学上、医学上或生活质量方面从这类治疗中获益,那么该受试者是对治疗“有需要的”。
[0171]
术语本发明化合物的“治疗有效量”或“有效量”是指将引起受试者的生物学或医学应答的本发明化合物的量。在另一个实施例中,该术语是指本发明化合物的量,该量当施用于受试者时有效用以至少部分地改善病症、或障碍或疾病。
[0172]
术语“一个或多个”是指一或大于一的数字(例如2、3、4、5等)。
[0173]
如本发明上文和下文所使用的术语“列表1”[在实施例(a)或(b)中]是指wo 2014/028459(其通过引用并入本文)中披露的化合物(例如实例和权利要求书中的化合物(例如,根据权利要求1至14中任一项所述的化合物,其中的每个通过引用并入本文(例如,按照原样或以其组合)))或其药学上可接受的盐。在一个实施例中,它是指wo2014/028459的实例的化合物或其药学上可接受的盐,例如实例1-1、1-2、1-3、1-4、1-5、1-6、1-7、1-8、1-9、1-10、1-11、1-12、1-13、1-4、1-5、1-16、1-17、1-8、1-19、1-20、1-21、1-22、2-1、2-2、2-3、3-1、3-2、3-3、3-4、3-5、3-6、3-7、3-8、3-9、3-10、3-11、3-12、4-1、5-1、6-1、7-1、8-1、9-1、10-1、11-1、12-1、13-1、14-1、15-1、16-1、16-1、16-1、16-4、16-5、17-1、17-2、17-3、17-4、17-5、17-6、17-7、17-8、17-9、17-10、17-11、17-12、17-13、18-1、18-2、18-3、18-4、18-5、18-6、18-7、18-8、18-9、18-10、18-11、18-12、18-13、18-14、18-15、18-16、18-17、18-18、19-1、19-2、19-3、19-4、19-5、19-6、19-7、20-1、20-2、20-3、20-4、20-5、20-6、20-7、20-8、20-9、21-1、21-2、22-1、23-1、24-1、24-2、24-3、24-4、-5、24-6、24-7、24-8、24-1、24-2、24-3、24-4、24-5、24-6、24-7、24-8、24-9、24-10、24-11、24-12、25-1、25-2、25-3、25-4、25-5、25-6、26-1、26-2、26-3、26-4、26-5、27-2、27-2、27-3、28-1、29-1、30-1、30-2、31-1、32-1、32-2、32-3、32-4、32-5、32-6、32-7、32-8、32-9、33-1、34-1、34-1、34-2、34-3、34-4、34-5、35-1、35-1、35-2、35-3、35-4、35-5、35-6、36-1、37-1、38-1、39-1、39-2、40-1、40-2、40-3、40-4、40-5、40-6、40-7、40-8、41-1、41-2、41-3、41-4、41-5、41-6、41-7、41-8、41-9、41-10、41-11、41-12、41-13、41-14、41-15、41-16、41-17、41-18、41-19、41-20、42-1、42-2、42-3、42-4、42-5、42-6、42-7、42-8、42-9、42-10、42-11、43-1、43-2、43-3、43-4、43-5、43-6或43-7,其中的每个通过引用并入本文,或其药学上可接受的盐。在另一个实施例中,它是指选自wo 2014/028459的权利要求14的一种或多种化合物(其中的每个通过引用并入本文)或其药学上可接受的盐。
[0174]
如本发明上文和下文所使用的术语“列表2”[在实施例(a)或(b)中]是指wo 2014/116845(其通过引用并入本文)中披露的化合物(例如实例和权利要求书中的化合物(例如,根据权利要求1至12中任一项所述的化合物,其中的每个通过引用并入本文(例如,按照原
样或以其组合)))或其药学上可接受的盐。在一个实施例中,它是指wo2014/116845的实例1至12或15至109的化合物(其中的每个通过引用并入本文)或其药学上可接受的盐。在另一个实施例中,它是指选自wo 2014/116845的权利要求12的一种或多种化合物(其中的每个通过引用并入本文)或其药学上可接受的盐。
[0175]
如本发明上文和下文所使用的术语“列表3”[在实施例(a)或(b)中]是指wo 2015/017589(其通过引用并入本文)中披露的化合物(例如实例和权利要求书中的化合物(例如,根据权利要求1至12中任一项所述的化合物,其中的每个通过引用并入本文(例如,按照原样或以其组合)))或其药学上可接受的盐。在一个实施例中,它是指wo 2015/017589的实例的化合物或其药学上可接受的盐,例如实例1-1、1-2、1-3、2-1、3-1、3-2、3-3、3-4、3-5、3-6、3-7、4-1、5-1、6-1、6-2、7-1、7-2、7-3、7-4、7-5、7-6、8-1、8-2、9-1、9-2、10-1、10-2、10-3、10-4、10-5、11-1、12-1、13-1、14-1、15-1、15-2、15-3、16-1、17-1、18-1、18-2、18-3、19-1、20-1、20-2、20-3、20-4、20-5、20-6、22-1、23-1、24-1、25-1、26-1、26-2、26-3、26-4、26-5、26-6、26-7、27-1、27-2、27-3、28-1、29-1、29-2、29-3、30-1、31-1、32-1、33-1、34-1、34-2、35-1、35-2、35-3、35-4、36-1、36-2、36-3、36-4、36-5、36-6或37-1,其中的每个通过引用并入本文,或其药学上可接受的盐。在另一个实施例中,它是指选自wo 2015/017589的权利要求12的一种或多种化合物(其中的每个通过引用并入本文)或其药学上可接受的盐。
[0176]
如本发明上文和下文所使用的术语“列表4”[在实施例(a)或(b)中]是指wo 2017/100726(其通过引用并入本文)中披露的化合物(例如实例和权利要求书中的化合物(例如,根据权利要求1至9中任一项所述的化合物,其中的每个通过引用并入本文))或其药学上可接受的盐。在一个实施例中,它是指wo 2017/100726的化合物1至465中的任一种(其中的每个通过引用并入本文)或其药学上可接受的盐,在一个实施例中,它是指wo 2017/100726的化合物26、31、47、258、307、352、424、425、426、427、428、429、430、431、432或433(其中的每个通过引用并入本文)或其药学上可接受的盐。在一个实施例中,它是指wo 2017/100726的化合物44、46、48、51、63、64、170、176、200、212、218、315、318、348、350、393、411、412、413、414、415、416、417、418、419、420、421、422或423(其中的每个通过引用并入本文)或其药学上可接受的盐。在另一个实施例中,它是指选自wo 2017/100726的权利要求6的一种或多种化合物(其中的每个通过引用并入本文)或其药学上可接受的盐。在另一个实施例中,它是指选自wo 2017/100726的权利要求7的一种或多种化合物(其中的每个通过引用并入本文)或其药学上可接受的盐。在另一个实施例中,它是指选自wo 2017/100726的权利要求8的一种或多种化合物(其中的每个通过引用并入本文)或其药学上可接受的盐。在另一个实施例中,它是指选自wo 2017/100726的权利要求9的一种或多种化合物(其中的每个通过引用并入本文)或其药学上可接受的盐。
[0177]
如本发明上文和下文所使用的术语“列表5”[在实施例(a)或(b)中]是指wo 2018/226622(其通过引用并入本文)中披露的化合物(例如实例和权利要求书中的化合物(例如,根据权利要求1至7中任一项所述的化合物,其中的每个通过引用并入本文))或其药学上可接受的盐。在一个实施例中,它是指wo 2018/226622的化合物1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、
87、88、89、90、91、92、93、94、95、96、97、98、99、100、101、102、103、104、105、106、107、108、109、110、111、112、113、114、115、116、117、118、119、120、121、122、123、124、125、126、127、128、129、130、131、132、133、134、135、136、137、138、139、140、141、142、143、144、145、146、147、148、149、150、151、152、153、154、155、156、157、158、159、160、161、162、163、164、165、166、167、168、169、170、171、172、173、714、175、176、177、178、179、180、181、182、183、184、185、186、187、188、189、190、191、192、193、194、195、196、197、198、199、200、201、202、203、204、205、206、207、208、209、210、211、212、213、214、215、216、217、218、219、220、221、222、223、224、225、226、227或228,其中的每个通过引用并入本文,或其药学上可接受的盐。在一个实施例中,它是指wo 2018/226622的化合物3、10、14、15、16、17、18、19、20、21、22、23、24、25、26、27、30、31、32、33、34、35、36、37、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、92、93、94、95、96、98、99、100、101、102、103、104、105、106、107、108、110、111、112、113、114、115、116、117、118、121、122、123、124、125、126、127、128、129、130、131、132、133、134、135、136、137、138、139、140、141、142、143、144、145、146、147、148、149、150、151、152、153、154、155、156、157、158、159、160、161、162、163、164、165、166、167、168、169、170、171、172、173、714、175、176、177、178、179、180、181、182、183、184、185、186、187、188、189、190、191、192、193、194、195、196、197、198、199、200、201、202、204、205、206、207、208、209、210、211、212、213、214、215、216、217、218、219、220、221、222、223、224、225、226、227或228,其中的每个通过引用并入本文,或其药学上可接受的盐。在一个实施例中,它是指wo 2018/226622的化合物15、17、19、20、21、22、25、26、32、33、34、35、36、37、43、45、46、47、48、49、50、51、52、55、56、57、58、59、62、63、64、66、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、86、87、88、89、90、92、93、95、96、99、100、101、102、103、104、105、106、107、108、110、111、112、113、114、115、117、121、122、123、124、125、126、127、128、129、130、131、132、133、134、135、136、137、139、140、141、143、144、145、146、148、149、150、151、152、153、154、155、156、157、158、159、160、161、162、163、164、165、166、167、169、171、172、173、714、175、176、177、178、179、180、181、182、183、184、185、186、187、188、189、190、192、193、195、196、197、199、200、201、202、204、206、207、210、211、215、216、217、218、219、221、223、224、225、226或227,其中的每个通过引用并入本文,或其药学上可接受的盐。在另一个实施例中,它是指选自wo 2018/226622的权利要求6的一种或多种化合物(其中的每个通过引用并入本文)或其药学上可接受的盐。在另一个实施例中,它是指选自wo 2018/226622的权利要求7的一种或多种化合物(其中的每个通过引用并入本文)或其药学上可接受的盐。
[0178]
如本发明上文和下文所使用的术语“列表6”[例如在实施例(a)或(b)中]是指wo 2019/005980中披露的化合物,例如权利要求及实例的化合物。特别地,它是指wo 2019/005980的实例的化合物(其通过引用并入本文),例如实例和权利要求的化合物(例如,根据权利要求1至9中任一项所述的化合物(其中的每个通过引用并入本文)),或其药学上可接受的盐。在一个实施例中,它是指wo 2019/005980的化合物1至877中的任一种(其中的每个通过引用并入本文)或其药学上可接受的盐。在一个实施例中,它是指wo2019/005980的化合物209、287、302、305、306、413、422、452、480、502、504、516、566、587、653、654、655、656、
2020/005882(其通过引用并入本文)中披露的化合物(例如实例和权利要求书中的化合物(例如,根据权利要求1至6中任一项所述的化合物,其中的每个通过引用并入本文(例如,按照原样或以其组合)))或其药学上可接受的盐。在一个实施例中,它是指wo 2020/005882的化合物1至226或其药学上可接受的盐中的任何一种,例如一种或多种(其中的每个通过引用并入本文),或其药学上可接受的盐。
[0183]
如本发明上文和下文所使用的术语“列表11”[在实施例(a)或(b)中]是指wo 2019/191092(其通过引用并入本文)中披露的化合物(例如实例和权利要求书中的化合物(例如,根据权利要求1至9中任一项所述的化合物,其中的每个通过引用并入本文(例如,按照原样或以其组合)))或其药学上可接受的盐。在一个实施例中,它是指wo 2019/191092的化合物1至65或其药学上可接受的盐中的任何一种,例如一种或多种(其中的每个通过引用并入本文),或其药学上可接受的盐。
[0184]
如本发明上文和下文所使用的术语“列表12”[在实施例(a)或(b)中]是指wo 2018/0232039(其通过引用并入本文)中披露的化合物(例如实例和权利要求书中的化合物(例如,根据权利要求1所述的化合物(其通过引用并入本文)))或其药学上可接受的盐。在一个实施例中,它是指wo 2018/0232039的化合物1至465或其药学上可接受的盐中的任何一种,例如一种或多种(其中的每个通过引用并入本文),或其药学上可接受的盐。
[0185]
如本发明上文和下文所使用的术语“列表13”[在实施例(a)或(b)中]是指wo 2019/028440(其通过引用并入本文)中披露的化合物(例如实例和权利要求书中的化合物(例如,根据权利要求1至43和170中任一项所述的化合物,其中的每个通过引用并入本文(例如,按照原样或以其组合)))或其药学上可接受的盐。在一个实施例中,它是指wo 2019/028440的表1a、表1b和表1c中的化合物1至357或其药学上可接受的盐中的任何一个,例如一个或多个(其中的每个通过引用并入本文),或其药学上可接受的盐。
[0186]
如本发明上文和下文所使用的术语“列表14”[在实施例(a)或(b)中]是指wo 2020/163544(其通过引用并入本文)中披露的化合物(例如实例、表和权利要求书中的化合物(例如,根据权利要求中任一项所述的化合物,其中的每个通过引用并入本文(例如,按照原样或以其组合)))或其药学上可接受的盐。在一个实施例中,它是指wo 2020/163544的表3和表5中的化合物的任何一个,例如一个或多个(其中的每个通过引用并入本文)或其药学上可接受的盐。在一个实施例中,它是指wo 2020/163544的表1a、表1b、表1c、表1d、表1e、表1f、表1g、表1h、表1i和表1j中的化合物的任何一个,例如一个或多个(其中的每个通过引用并入本文),或其药学上可接受的盐。
[0187]
如本发明上文和下文所使用的术语“列表15”[在实施例(a)或(b)中]是指wo 2020/163401(其通过引用并入本文)中披露的化合物(例如实例、表和权利要求书中的化合物(例如,根据权利要求中任一项所述的化合物,其中的每个通过引用并入本文(例如,按照原样或以其组合)))或其药学上可接受的盐。在一个实施例中,它是指wo 2020/163401的表1a、表1b和表1c中的化合物中的任何一个,例如一个或多个(其中的每个通过引用并入本文),或其药学上可接受的盐。
[0188]
如本发明上文和下文所使用的术语“列表16”[在实施例(a)或(b)中]是指wo 2020/163405(其通过引用并入本文)中披露的化合物(例如实例、表和权利要求书中的化合物(例如,根据权利要求中任一项所述的化合物,其中的每个通过引用并入本文(例如,按照
原样或以其组合)))或其药学上可接受的盐。在一个实施例中,它是指wo 2020/163405的表3、表4、表5、表6和表7中的化合物的任何一个,例如一个或多个(其中的每个通过引用并入本文),或其药学上可接受的盐。在一个实施例中,它是指wo2020/163405的表1a、表1b、表1c、表1d、表1e、表1f、表1g、表1h、表1j、表1k、表1l和表1m中的化合物的任何一个,例如一个或多个(其中的每个通过引用并入本文),或其药学上可接受的盐。
[0189]
如本发明上文和下文所使用的术语“列表17”[在实施例(a)或(b)中]是指wo 2020/163409(其通过引用并入本文)中披露的化合物(例如实例、表和权利要求书中的化合物(例如,根据权利要求中任一项所述的化合物,其中的每个通过引用并入本文(例如,按照原样或以其组合)))或其药学上可接受的盐。在一个实施例中,它是指wo 2020/163409的表1a、表1b、表1c、表1d、表1e和表1f中的化合物中的任何一个,例如一个或多个(其中的每个通过引用并入本文),或其药学上可接受的盐。
[0190]
如本发明上文和下文所使用的术语“列表18”[在实施例(a)或(b)中]是指wo 2020/163323(其通过引用并入本文)中披露的化合物(例如实例、表和权利要求书中的化合物(例如,根据权利要求中任一项所述的化合物,其中的每个通过引用并入本文(例如,按照原样或以其组合)))或其药学上可接受的盐。在一个实施例中,它是指wo 2020/163323的表1a、表1b、表1c、表1d、表1e、表1f、表1g、表1h、表1i、表1j、表1k和表1l中的化合物的任何一个,例如一个或多个(其中的每个通过引用并入本文),或其药学上可接受的盐。在一个实施例中,它是指wo 2020/163323的表3、表4和表5中的化合物的任何一个,例如一个或多个(其中的每个通过引用并入本文)或其药学上可接受的盐。
[0191]
如本发明上文和下文所使用的术语“列表19”[在实施例(a)或(b)中]是指wo 2020/163375(其通过引用并入本文)中披露的化合物(例如实例、表和权利要求书中的化合物(例如,根据权利要求中任一项所述的化合物,其中的每个通过引用并入本文(例如,按照原样或以其组合)))或其药学上可接受的盐。在一个实施例中,它是指wo 2020/163375的表1、表2、表3、表4、表5、表6、表7、表8、表9、表10、表11、表12、表13、表14、表15,表16、表17、表18、表19、表20、表21、表22和表23中的化合物的任何一个,例如一个或多个(其中的每个通过引用并入本文),或其药学上可接受的盐。在一个实施例中,它是指wo 2020/163375的表a-10、表a-12和表24中的化合物中的任何一个,例如一个或多个(其中的每个通过引用并入本文),或其药学上可接受的盐。
[0192]
如本发明上文和下文所使用的术语“列表20”[在实施例(a)或(b)中]是指wo 2020/163406(其通过引用并入本文)中披露的化合物(例如实例、表和权利要求书中的化合物(例如,根据权利要求中任一项所述的化合物,其中的每个通过引用并入本文(例如,按照原样或以其组合)))或其药学上可接受的盐。在一个实施例中,它是指wo 2020/163406的表1中的化合物的任何一个,例如一个或多个(其中的每个通过引用并入本文)或其药学上可接受的盐。
[0193]
如本发明上文和下文所使用的术语“列表21”[在实施例(a)或(b)中]是指wo 2020/163541(其通过引用并入本文)中披露的化合物(例如实例、表和权利要求书中的化合物(例如,根据权利要求中任一项所述的化合物,其中的每个通过引用并入本文(例如,按照原样或以其组合)))或其药学上可接受的盐。在一个实施例中,它是指wo 2020/163541的表1a、表1c、表1e、表1g和表1h中的化合物中的任何一个,例如一个或多个(其中的每个通过引
用并入本文),或其药学上可接受的盐。在一个实施例中,它是指wo 2020/163541的表15中的化合物的任何一个,例如一个或多个(其中的每个通过引用并入本文)或其药学上可接受的盐。
[0194]
如本发明上文和下文所使用的术语“列表22”[在实施例(a)或(b)中]是指wo 2020/163647(其通过引用并入本文)中披露的化合物(例如实例、表和权利要求书中的化合物(例如,根据权利要求中任一项所述的化合物,其中的每个通过引用并入本文(例如,按照原样或以其组合)))或其药学上可接受的盐。在一个实施例中,它是指wo 2020/163647的表1、表2和表5中的化合物的任何一个,例如一个或多个(其中的每个通过引用并入本文)或其药学上可接受的盐。在一个实施例中,它是指wo 2020/163647的表b、表c、表a-5和表a-6中的化合物中的任何一个,例如一个或多个(其中的每个通过引用并入本文),或其药学上可接受的盐。
[0195]
如本发明上文和下文所使用的术语“列表23”[在实施例(a)或(b)中]是指wo 2020/163248(其通过引用并入本文)中披露的化合物(例如实例、表和权利要求书中的化合物(例如,根据权利要求中任一项所述的化合物,其中的每个通过引用并入本文(例如,按照原样或以其组合)))或其药学上可接受的盐。在一个实施例中,它是指wo 2020/163248的表1a、表1b、表1c、表1d、表1e、表1f、表1g、表1h、表1i和表1j中的化合物的任何一个,例如一个或多个(其中的每个通过引用并入本文),或其药学上可接受的盐。在一个实施例中,它是指wo2020/163248的表3b、表4、表6、表7、表8和表9中的化合物的任何一个,例如一个或多个(其中的每个通过引用并入本文),或其药学上可接受的盐。
[0196]
如本发明上文和下文所使用的术语“列表24”[在实施例(a)或(b)中]是指wo 2020/163382(其通过引用并入本文)中披露的化合物(例如实例、表和权利要求书中的化合物(例如,根据权利要求中任一项所述的化合物,其中的每个通过引用并入本文(例如,按照原样或以其组合)))或其药学上可接受的盐。在一个实施例中,它是指wo 2020/163382的表1a和表1b中的化合物的任何一个,例如一个或多个(其中的每个通过引用并入本文)或其药学上可接受的盐。
[0197]
如本文所用,如本发明上文和下文所使用的名为布雷那兰的化合物是剪接调节子,也称为式(i)的5-(1h-吡唑-4-基)-2-(6-((2,2,6,6-四甲基哌啶-4-基)氧基)哒嗪-3-基)苯酚:
[0198][0199]
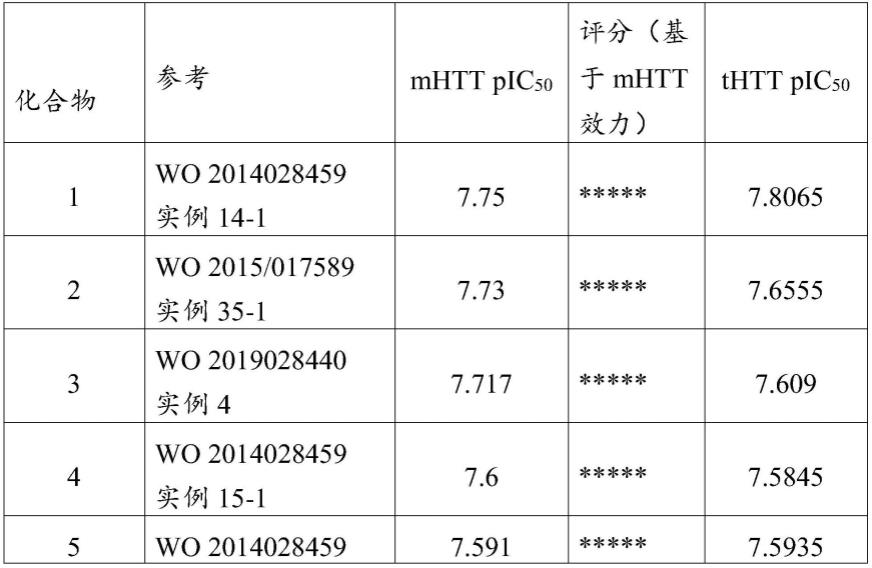
可以如wo 2014/028459(例如实例17-13中)中所述制备布雷那兰或其药用盐(例如布雷那兰盐酸盐),该文献通过引用并入本文。如本文所用,“布雷那兰”是指游离形式,并且任何提及“其药学上可接受的盐”是指其药学上可接受的酸加成盐。如本文所用,术语“布雷那兰或其盐,例如其药学上可接受的盐”,除非另有说明,否则在本发明上下文中(特别是在任何实施例、以上或以下、以及权利要求的上下文中)因此应解释为涵盖其游离形式及其
药学上可接受的盐。如本文所用,术语“布雷那兰盐酸盐”或“布雷那兰单盐酸盐”是指5-(1h-吡唑-4-基)-2-(6-((2,2,6,6-四甲基哌啶-4-基)氧基)哒嗪-3-基)苯酚单盐酸盐或其水合物,例如5-(1h-吡唑-4-基)-2-(6-((2,2,6,6-四甲基哌啶-4-基)氧基)哒嗪-3-基)苯酚单盐酸盐一水合物,也称为布雷那兰盐酸盐一水合物。具体地,布雷那兰为布雷那兰盐酸盐的形式。
[0200]
在一个实施例中,如本文所用,术语“剪接调节子”是指直接或间接增加靶前mrna序列与剪接体的缔合以增强或减少基因表达的小分子。
[0201]
在一个实施例中,如本文所用,术语“剪接调节子”是指改变前体信使rna(缩写为前mrna)的剪接的化合物,例如小分子。示例性的剪接调节子改变剪接体对剪接位点的识别,例如通过与剪接机器的组件(例如蛋白质和/或核酸(例如mrna和/或前mrna))的相互作用,该相互作用导致靶向的前mrna的正常剪接的改变。因此,示例性的剪接调节子改变了靶向的前mrna的成熟rna产物的序列(或一个或多个序列的相对水平)。示例性的剪接调节子通过以下来起作用:直接或间接改变例如增加靶前mrna序列与剪接体的缔合来例如增强或减少基因表达。剪接调节子的非限制性实例是小分子(例如布雷那兰)和寡核苷酸,例如反义寡核苷酸和剪接切换寡核苷酸(sso)。剪接调节子的更多实例可以在例如wo 2014/028459、wo 2014/116845和wo 2015/017589(其全部内容通过引用并入本文)中找到,或在wo 2020/005873、wo 2020/005877、wo 2020/005882和wo 2019/191092(其全部内容通过引用并入本文)中找到。可以用于改变前mrna的剪接的某些寡聚化合物和核碱基序列可在以下中找到:例如美国专利号6,210,892;美国专利号5,627,274;美国专利号5,665,593;5,916,808;美国专利号5,976,879;us 2006/0172962;us 2007/002390;us 2005/0074801;us 2007/0105807;us 2005/0054836;wo 2007/090073;wo 2007/047913,hua等人.,plos biol[公共科学图书馆杂志]5(4):e73;vickers等人,j.immunol.[免疫学杂志]2006年3月15日;176(6):3652-61;hua等人,american j.of human genetics[美国人类遗传学杂志](2008年4月)82,1-15,出于任何目的将其通过引用以其全文特此并入。反义化合物也已经用于改变天然存在的替代剪接变体(例如长和短形式的bcl-x前mrna)的比例(美国专利号6,172.216:美国专利号6,214,986:taylor等人,nat.biotechnol.[自然生物技术]1999,17,1097-1100)或强制跳读含有过早成熟的终止密码子的特定外显子(wilton等人,neuromuscul.disord[神经肌肉障碍],1999,9,330-338)。美国专利号5,627,274和wo 94/26887披露了使用不激活rna酶h的反义寡核苷酸来对抗包含突变的前mrna分子中的异常剪接的组合物和方法。
[0202]
在一个实施例中,天然存在的替代剪接变体的相对表达水平被改变,例如一个衍生自靶前mrna的剪接变体比例相对于另一剪接变体或衍生自该前mrna的剪接变体的整个库被改变。
[0203]
在另一个实施例中,新的剪接变体产生,而天然存在的替代剪接变体的比例可以改变或可以不改变。在一个实施例中,通过从以其他方式在无剪接调节子的情况下产生的mrna中去除一个或多个核酸来产生所述新的剪接变体。这可以例如通过外显子跳读(即其中外显子被剪接出前mrna,并且因此不存在于成熟mrna中)发生。在另一个实施例中,所述新的剪接变体通过替代供体位点的激活而产生,其中使用替代的5'剪接连接(供体位点),从而改变上游外显子的3'边界。在另一个实施例中,所述新的剪接变体通过激活替代受体
11097644、wo 11097641、wo 11032045、wo 07089584、wo 07089611,其全部内容通过引用并入本文。针对亨廷顿氏病的反义化合物的其他实例包括rg6042(罗氏公司(roche))、wve-120101(波/武田公司(wave/takeda))和wve-120102(波/武田公司)。
[0212]
如本文所用的术语基因疗法指例如在例如wo 2016/102664(通过引用以其全文特此并入)中描述的amt-130。
[0213]
本文所定义的术语“药物组合物”是指例如含有至少一种将被施用给受试者以治疗受试者的活性成分或治疗剂的混合物或溶液,例如本文所定义。本文指定的化合物[例如选自由以下组成的组的剪接调节子:列表1、列表2、列表3、列表4、列表5、列表6、列表7、列表8、列表9、列表10、列表11、列表12和列表13、例如列表1、列表2、列表3、列表4、列表5、列表6和列表7;例如布雷那兰]可以通过常规途径施用,特别是口服施用,其可以根据本领域已知的制药技术来制备(例如,remington essentials of pharmaceutics[雷明顿药剂学要点],2013,第1版,linda felton编辑,制药出版社(pharmaceutical press)出版2012,isbn978 0 85711 105 0;特别是第30章),其中药物赋形剂例如如handbookof pharmaceutical excipients[药物赋形剂手册],2012,第7版,raymond c.rowe,paul j.sheskey,walter g.cook和marian e.fenton编辑,isbn978 0 85711 027 5所述。
[0214]
如本文所用,术语“药学上可接受的赋形剂”包括如本领域技术人员所知的任何和所有溶剂、分散介质、包衣、表面活性剂、抗氧化剂、防腐剂(例如,抗细菌剂、抗真菌剂)、等渗剂、吸收延迟剂、盐、防腐剂、药物稳定剂、粘合剂、赋形剂、崩解剂、润滑剂、甜味剂、调味剂、染料等及其组合(参见,例如,remington's pharmaceutical sciences[雷明顿医药科学],第22版mack printing company[马克出版公司],2013,第1049-1070页)。除了任何常规载剂与活性成分均不相容的情况外,考虑其在治疗或药物组合物中的用途。
[0215]
对于上述用途/治疗方法,适当的剂量可以根据多种因素(例如年龄、体重、性别、施用途径或所用的盐)而变化。
[0216]
如本文所用,术语“一个”、“一种”、“所述(the)”以及在本发明的上下文中(尤其是在实施例和权利要求的上下文中)使用的类似术语应被解释为涵盖单数和复数二者,除非本文中另外指示或与上下文明显相矛盾。
[0217]
本文提供的任何和所有实例或示例性语言(例如“如”)的使用仅旨在更好地说明本发明,而不对另外要求保护的本发明范围做出限制。
[0218]
如本文所用,术语“本发明的化合物”是指如本文所定义的“剪接调节子”,并且应理解为呈游离形式或药学上可接受的盐形式。
[0219]
如本文所用,术语一种或多种“游离形式”是指非盐形式的化合物,例如相应化合物的碱游离形式或酸游离形式,例如本文指定的化合物[例如选自由以下组成的组:表1、列表2、列表3、列表4、列表5、列表6、列表7、列表8、列表9、列表10、列表11、列表12和列表13,尤其是本文定义的列表1、列表2、列表3、列表4、列表5、列表6和列表7]。
[0220]
如本文所用,术语一种或多种“盐”或“盐形式”是指相应化合物的酸加成盐或碱加成盐,例如本文指定的化合物[例如选自由以下组成的组:表1、列表2、列表3、列表4、列表5、列表6、列表7、列表8、列表9、列表10、列表11、列表12和列表13,尤其是本文定义的列表1、列表2、列表3、列表4、列表5、列表6和列表7]。“盐”特别地包括“药学上可接受的盐”。术语“药学上可接受的盐”是指保留化合物的生物有效性和特性的盐,并且这些盐典型地不是生物
学上或其他方面不希望的。
[0221]
可以用无机酸和有机酸形成药学上可接受的酸加成盐。
[0222]
可以衍生出盐的无机酸包括,例如盐酸、氢溴酸、硫酸、硝酸、磷酸等。
[0223]
可以衍生出盐的有机酸包括例如乙酸、丙酸、乙醇酸、草酸、马来酸、丙二酸、琥珀酸、富马酸、酒石酸、柠檬酸、苯甲酸、扁桃酸、甲磺酸、乙磺酸、甲苯磺酸、磺基水杨酸等。
[0224]
可以用无机碱和有机碱形成药学上可接受的碱加成盐。
[0225]
可以衍生出盐的无机碱包括,例如铵盐和来自元素周期表第i至xii列的金属。在某些实施例中,盐衍生自钠、钾、铵、钙、镁、铁、银、锌和铜;特别合适的盐包括铵盐、钾盐、钠盐、钙盐和镁盐。
[0226]
可以衍生出盐的有机碱包括例如伯胺、仲胺和叔胺;取代的胺(包括天然存在的取代的胺);环胺;碱性离子交换树脂等。某些有机胺包括异丙胺、苄星、胆碱盐、二乙醇胺、二乙胺、赖氨酸、葡甲胺、哌嗪和氨丁三醇。
[0227]
药学上可接受的盐可以通过常规化学方法由碱性或酸性部分合成。通常,可以通过使化合物的游离酸形式与化学计量的适当碱(例如na、ca、mg或k的氢氧化物、碳酸盐、碳酸氢盐等)反应,或通过使化合物的游离碱形式与化学计量量的适当酸反应来制备这些盐。这样的反应典型地在水或有机溶剂或两者的混合物中进行。通常,在可行的情况下,希望使用非水性介质,如醚、乙酸乙酯、乙醇、异丙醇或乙腈。其他合适的盐的列表可以参见例如:“remington's pharmaceutical sciences[雷明顿医药科学]”,第22版mack printing company[马克出版公司](2013);以及stahl和wermuth撰写的“handbook of pharmaceutical salts:properties,selection,and use[药用盐手册:性质、选择和用途]”(wiley-vch,weinheim,2011,第2版)。
[0228]
术语“药物”、“活性物质”、“活性成分”、“药物活性成分”、“活性剂”、“治疗剂”或“药剂”应理解为意指游离形式或药学上可接受的盐形式的化合物。
[0229]
术语“组合”或“药物组合”是指一种单位剂型的固定组合、非固定组合或用于组合施用的部件试剂盒,其中本发明化合物和一种或多种组合配偶体(例如另一种药物,也称为另外的“药物活性成分”、“治疗剂”或“助剂”)可以同时或在时间间隔内分别独立施用,尤其是在这些时间间隔允许组合配偶体显示出合作,例如协同效应的情况下。如本文所用,术语“共同施用”或“组合施用”等意指涵盖向有需要的单个受试者(例如患者)施用所选择的组合配偶体,并且旨在包括其中药剂不一定通过相同的施用途径施用或同时施用的治疗方案。术语“固定组合”意指活性成分(例如本发明化合物和一种或多种组合配偶体)都以单一实体或剂量的形式同时施用于患者。术语“非固定组合”是指活性成分(例如本发明化合物和一种或多种组合配偶体)均作为分开的实体同时或在没有特定的时间限制下顺序地施用于患者,其中这种施用在患者体内提供了这两种化合物的治疗有效水平。
[0230]
本发明化合物可以通过与其他药剂相同或不同的施用途径分开施用,或在相同的药物组合物中一起施用。在本发明的组合疗法中,本发明化合物和其他治疗剂可以由相同或不同的制造商生产和/或配制。此外,可以将本发明化合物和另一种治疗剂一起形成组合疗法:(i)在向医师发布组合产品(例如,在包含本发明的化合物和其他治疗剂的试剂盒的情况下)之前进行;(ii)在施用前不久由医师本人(或在医师指导下)进行;(iii)在患者本身中,例如在顺序施用本发明的化合物和其他治疗剂期间进行。
[0231]
缩写:
[0232]
h=hr=小时
[0233]
min=分钟
[0234]
sec=秒
[0235]
msec=毫秒
[0236]
mg=毫克
[0237]
kg=kg=千克
[0238]
ml=ml=毫升
[0239]
ul==ul=微升
[0240]
pcr=聚合酶链式反应
[0241]
rpm=每分钟转数
[0242]
℃=摄氏度
[0243]
xg=乘以重力(离心力)
[0244]
htt=亨廷顿
[0245]
mhtt=突变的亨廷顿
[0246]
thtt=总亨廷顿
[0247]
htrf=均匀时间分辨荧光
[0248]
n=动物的数目
[0249]
csf=脑脊液
[0250]
cp=厘泊,粘度单位
[0251]
pic
50
=-log(ic
50
)其中ic
50
以摩尔或mol/l表示
[0252]
rt=室温(25℃
±
3℃)
[0253]
56-fam=5’6-fam(荧光素)
[0254]
3iabkfq=3’iowafam淬灭剂
[0255]
zen=zen
tm
内部淬灭剂
[0256]
usa=美利坚合众国
[0257]
bachd=bach=细菌人工染色体介导的转基因亨廷顿氏病模型
[0258]
acat=高级隔室和转运
[0259]
auc=曲线下面积
[0260]
biw=每周两次
[0261]
cd=环糊精
[0262]
cl=从中心隔室消除的清除率
[0263]
cmax=最大浓度
[0264]
ctrough=最低浓度
[0265]
f=生物利用度
[0266]
fa=吸收分数
[0267]
ic50=半最大抑制浓度
[0268]
imax:最大抑制作用
[0269]
k12=从隔室1到隔室2的一阶速率常数
[0270]
k21=从隔室2到隔室1的一阶速率常数
[0271]
ka=一阶吸收速率常数
[0272]
kin=突变htt蛋白的合成速率
[0273]
kout=突变htt蛋白合成的降解速率或分数周转参数
[0274]
logp=有机溶液与水溶液之间分配系数的对数
[0275]
mtd=最大耐受剂量
[0276]
pbpk=基于生理的药代动力学(pbpk)
[0277]
pd=药效学
[0278]
peff=有效渗透率
[0279]
pk=药代动力学
[0280]
pka=酸解离常数的负对数
[0281]
q=隔室间清除率
[0282]
qw=每周一次
[0283]
r=给定时间的突变htt蛋白水平
[0284]
ro=突变htt蛋白浓度的基线(例如在脑中)
[0285]
rse=以近似标准偏差量表报告的相对标准误差(se/方差)/2
[0286]
se=标准偏差量表
[0287]
ss=稳定状态
[0288]
sma=脊髓性肌萎缩
[0289]
tlag=吸收滞后时间
[0290]
tmax=最大浓度时间
[0291]
v1=2-隔室pk模型的中心容积
[0292]
v2,vc=2-隔室pk模型的外周容积
[0293]
t1/2=表观终末消除半衰期
[0294]
实例:
[0295]
实例1a:布雷那兰的临床前评估
[0296]
方法
[0297]
用剪接调节子治疗的人细胞的rna-seq分析
[0298]
正常人成纤维细胞系(hd1994)用布雷那兰和剪接调节子2(wo2015017589中描述的实例3-2)和剪接调节子3(在nat chem biol.[自然化学与生物学]2015年7月;11(7):511-7.doi:10.1038/nchembio.1837中描述的nvs-sm3)或dmso处理24小时。使用了以下化合物剂量:
[0299]-布雷那兰以有效剂量(100nm)和细胞毒性剂量(5um)使用。
[0300]-剪接调节子2以750nm使用。
[0301]-剪接调节子3以5um使用。
[0302]
每组有3个生物学重复。
[0303]
使用凯杰rneasy微量分离试剂盒(qiagen rneasy mini isolation kit)分离总rna。使用illumina truseq rna样品制备试剂盒v2制备rna-seq文库,并使用illumina hiseq 2500平台测序。
[0304]
每个样品在属于相同流动池的四个不同泳道上测序为长度2x 76个碱基对(bp)。通过在fastq文件上运行fastqc(版本0.10.1)来评估生成的读段的质量。为每个样品计算了以phred得分的每碱基平均质量。读段的质量非常好(所有碱基位置的平均phred得分》28)。使用tophat(2.0.3),共有8.47亿个76-碱基对(bp)配对末端读段被映射到智人基因组(hg19)(人refseq(pruitt等人,2007)转录本(版本59,2013年5月3日))。
[0305]
为了提高检测外显子的能力,针对五个条件(dmso,5um的布雷那兰、100nm的布雷那兰、500nm的剪接调节子2和5um的剪接调节子3)中的每个条件,在用cufflinks(2.1.1)的转录本组装之前,合并三个比对文件(bam文件)。转录本组装后,从转录本gtf文件中提取外显子坐标。排除了替代染色体和m染色体上的外显子,忽略了链信息。这产生了273866个推定外显子。不与任何refseq外显子(2013年5月3日,版本59)相交的外显子被视为事件中未注释的剪接的候选者。结果有19474个候选者。为了获得更大的置信度,我们将所有refseq外显子加上最初的19474个候选者的完整集中的重叠外显子合并,从而产生了229665个不重叠的外显子。对于这组外显子,考虑了每个refseq基因内的所有可能的外显子-外显子连接。使用r(2.15.2)脚本和bedtool(2.15.0)创建了连接数据库。然后将每个配对末端读段的第一配对针对数据库进行映射。仅保留了由至少一个连接比对支持的未注释的外显子。这尤其排除了不与refseq基因附接的候选者。剩下10898个最终候选者。使用bedtools从hg19提取这些候选者的序列。为了评估可变性,还计算了每个重复的单独cufflinks组装,并检查了该组装中每个候选者的存在。另外,针对连接数据库的比对用于确定跳过新颖外显子的连接的数目。该信息用于估计以分数而言的剪接。此外,使用bedtool在tophat比对(bam文件)上确定每个重复的10898个候选者的读段覆盖率,并且然后在五个条件中的每个条件中进行合计。将原始fastq文件用star(020201)重新处理,并与人基因组(hg38)比对。使用ucsc基因组浏览器工具将10898个候选外显子转换至hg38——7个候选者无法转换。将star检测到的连接映射到其余10891个候选者,并提供了连接计数的替代来源。
[0306]
一个落入htt基因区域(chr4:3213622-3213736)的候选者被检测,并且似乎被活性化合物调节。用star比对重新分析为它提供了支持。此外,3’末端显示了aga/gt基序,该基序与活性化合物的作用方式有关。最后,可以如下所述通过pcr验证该候选者(包含在本文的称为含新颖外显子的htt转录本的剪接变体中)。候选chr4:3213622-3213736引入了框内终止密码子(tag),该密码子距离外显子3'末端55个核苷酸,因此可触发无义介导的衰变。ngs数据显示,htt的表达被活性化合物下调了约六倍(图1)。包含新颖外显子的htt转录本的部分序列(仅显示对应于外显子49、新颖外显子和外显子50的部分)在本文中包括为seq id no:9。带下划线的是新颖外显子。
[0307]
seq id no:9
[0308]
gggatgctgcactgtatcagtccctgcccactctggcccgggccctggcacagtacctggtggtggtctccaaactgcccagtcatttgcaccttcctcctgagaaagagaaggacattgtgaaattcgtggtggcaacccttgagaggcaagccctggtgctgtgggagccccaaggaagagcctctggcctggtggccacgtagcccaggagagatttctacaggagcccacagcgctgaaggagagagaggcagcagagccctgtcctggcatttgatccatgagcagatcccgctgagtctggatctccaggcagggctggactgctgctgcctggccctgcagctgcctggcctctggagcgtggtctcctccacagagtttgtgacccacgcctgctccctcatctactgtgtgcacttcatcctggaggccg
[0309]
布雷那兰的体外评估
[0310]
将培养的人神经母细胞瘤(sh-sy5y细胞系)细胞以5nm-125nm范围的剂量处理24小时(用于转录本评估)或48小时(用于蛋白质评估)。rna通过nanodrop 2000(赛默飞世尔科技公司(thermo scientific))进行定量。如下从140-400ng rna合成cdna:使用maxima第一链cdna合成试剂盒,使用聚dt和无规六聚体(赛默飞世尔科技公司)的混合物,以20ul反应(在25℃下10分钟,50℃下15分钟然后85℃下5分钟)。使用20ul taqman快速高级母混合物(taqman fast advanced master mix)(赛默飞世尔科技公司)和4ul cdna反应和针对每个基因特异的引物进行定量pcr。pcr步骤如下:95℃20秒,然后95>1秒、55℃20秒,40个循环。对于wt人htt而言,引物的序列,正向,5
’‑
gtcatttgcaccttcctcct-3’(seq id no:1);反向,5
’‑
tggatcaaatgccaggacag-3’(seq id no:2),并且探针序列为56-fam/ttg tga aat/zen/tcg tgg tgg caa ccc/3iabkfq/(seq id no:8),对于htt新颖外显子,正向,5
’‑
tcctgagaaagagaaggacattg-3’(seq id no:3);反向,5
’‑
ctgtgggctcctgtagaaatc-3’(seq id no:4)并且探针序列为/56-fam/aat tcg tgg/zen/tgg caa ccc ttg aga/3iabkfq/(seq id no:7)。基因表达的相对定量使用2-δδct
方法进行。在标准化为作为内源参考的小鼠葡糖醛酸糖苷酶β(gusb)后,计算了mrna表达水平的倍数变化(图2a和2b)。
[0311]
为了进行蛋白质分析,将细胞在含有蛋白酶和磷酸酶抑制剂(赛默飞世尔科技公司)的ripa缓冲液中裂解。通过在4℃以13,000rpm离心20分钟获得上清液。使用bca蛋白测定法(赛默飞世尔科技公司)定量总蛋白浓度。在还原条件下,将样品溶解在3%-8%的tris-醋酸盐蛋白凝胶中。将蛋白转移到pvdf膜(密理博公司(millipore))上,并使用兔抗亨廷顿抗体(密理博公司#mab2166)、小鼠抗肌动蛋白(西格玛公司(sigma),#a5316)和小鼠抗粘着斑蛋白(伯乐公司(bio-rad),#mca465)进行蛋白质印迹分析。蛋白带通过image j定量。
[0312]
bachd小鼠
[0313]
28只bachd小鼠(fvb/n-tg(htt*97q)ixwy/j转基因小鼠-杰克森实验室(jackson laboratories))用于实验。动物实验方案已获得费城儿童动物医院机构动物护理和使用委员会(children’s hospital of philadelphia institutional animal care and use committee)的批准。将小鼠以12小时的明/暗周期饲养在温度受控的环境中。任意提供食物和水。
[0314]
对于重复给药研究,将二十八只bachd小鼠(fvb/n-tg(htt*97q)ixwy/j转基因小鼠-杰克森实验室(jackson laboratories))用于实验。动物实验方案已获得费城儿童动物医院机构动物护理和使用委员会(children’s hospital of philadelphia institutional animal care and use committee)的批准。将小鼠以12小时的明/暗周期饲养在温度受控的环境中。任意提供食物和水。
[0315]
布雷那兰治疗
[0316]
通过口服强饲法施用单剂量的布雷那兰或媒剂溶液。将小鼠分为七组(n=4只小鼠/组),并用布雷那兰(10mg/kg-2个组和50mg/kg-3个组)或作为对照的媒剂(2个组)进行治疗。抓住松弛的皮肤以固定头部来牢牢地束缚小鼠,保持在垂直位置,然后将22-到26-规格的强饲针插入口中。将针沿嘴顶引导至食道,并使其轻轻进入胃内。给每只小鼠施用的布雷那兰或媒剂的量基于治疗前记录的重量。
[0317]
对于重复给药研究,布雷那兰或媒剂经口服强饲法施用每周3次,连续3周。将小鼠
分为4组(n=6只小鼠/组),并用布雷那兰(12mg/kg-1个组,或24mg/kg-2个组)或作为对照的媒剂(1个组)进行治疗。抓住松弛的皮肤以固定头部来牢牢地束缚小鼠,保持在垂直位置,然后将22-到26-规格的强饲针插入口中。将针沿嘴顶引导至食道,并使其轻轻进入胃内。给每只小鼠施用的布雷那兰或媒剂的量基于给药当天记录的重量。
[0318]
血液采集和组织采样
[0319]
口服强饲后8小时、24小时(媒剂和布雷那兰分别为10mg/kg和50mg/kg)和48小时(布雷那兰50mg/kg),获得血液和组织样品用于pk和pd分析。用异氟烷麻醉小鼠,并通过下颌下静脉抽血获得血液,并使用rna保护性动物血液管(rnaprotect animal blood tube)采集血液用于rna提取(pd分析),并使用k2edta涂覆的管进行血浆采集(pk分析)。通过在4℃以2000x g离心10分钟从血浆中去除细胞,并将血浆样品保存在-80℃。血液采集后,用致死剂量的氯胺酮/甲苯噻嗪(100ml,10mg:1mg)麻醉小鼠,并灌注与2ml的rnalater(安比昂公司(ambion))溶液混合的18ml 0.9%冷盐水以进行组织采集。将肝、骨骼肌、大脑、和小脑样品在液氮中快速冷冻,并保存在-80℃。
[0320]
血液和csf采集,和组织采样用于重复剂量研究
[0321]
在最后一次处理后24小时(媒剂和布雷那兰为12mg/kg和24mg/kg)和72小时(布雷那兰为24mg/kg),获得了血液、csf和组织样品用于pk和pd分析。为了收集csf,将小鼠置于啮齿动物麻醉诱导室中,在此处将小鼠暴露于100%氧载气中的4%-5%异氟烷。一旦达到适当的麻醉平面,将它们移至鼻锥,以便在整个手术过程中都能维持异氟烷的浓度(1%-3%)。手术准备其颈和枕骨区的背侧,以便在显微镜下观察硬脑膜。将附接于微操作器的玻璃微量移液管通过硬脑膜穿刺到小脑延髓池中的看不到脉管的点,并且允许csf通过毛细管作用流入微量移液管。大约15-30分钟后,将微量移液管从小脑延髓池中取出,将csf样品转移到eppendorf管中,在液氮中速冻,并保存在-80℃。
[0322]
收集csf后,将小鼠继续保持异氟烷麻醉。通过下颌下静脉抽血获得血液,并使用rna保护性动物血液管(rnaprotect animal blood tube)采集血液用于rna提取(pd分析),并使用k2edta涂覆的管进行血浆采集(pk分析)。通过在4℃以2000xg离心10分钟从血浆中去除细胞,并将血浆样品保存在-80℃。血液采集后,给予小鼠致死剂量的氯胺酮/甲苯噻嗪(100ml,10mg:1mg),并灌注与2ml的rnalater(安比昂公司(ambion))溶液混合的18ml 0.9%冷盐水以进行组织采集。将肝、骨骼肌、脑纹状体、脑皮质、半脑和小脑样品在液氮中速冻,并储存在-80℃。
[0323]
血液和csf采集,和组织采样用于重复剂量时程研究
[0324]
在最后处理(媒剂或24mg/kg布雷那兰持续1周或3周)后72小时、168小时、240小时和336小时(布雷那兰24mg/kg)后,获得了血液、csf和组织样品以进行pk和pd分析。为了收集csf,将小鼠置于啮齿动物麻醉诱导室中,在此处将小鼠暴露于100%氧载气中的4%-5%异氟烷。一旦达到适当的麻醉平面,将它们移至鼻锥,以便在整个手术过程中都能维持异氟烷的浓度(1%-3%)。手术准备其颈和枕骨区的背侧,以便在显微镜下观察硬脑膜。将附接于微操作器的玻璃微量移液管通过硬脑膜穿刺到小脑延髓池中的看不到脉管的点,并且允许csf通过毛细管作用流入微量移液管。大约15-30分钟后,将微量移液管从小脑延髓池中取出,将csf样品转移到eppendorf管中,在液氮中速冻,并保存在-80℃。
[0325]
收集csf后,将小鼠继续保持异氟烷麻醉。通过下颌下静脉抽血获得血液,并使用
rna保护性动物血液管采集血液用于rna提取(pd分析),并使用k2edta涂覆的管进行血浆采集(pk分析)。通过在4℃以2000x g离心10分钟从血浆中去除细胞,并将血浆样品保存在-80℃。血液采集后,给予小鼠致死剂量的氯胺酮/甲苯噻嗪(100ml,10mg:1mg),并灌注与2ml的rnalater(安比昂公司(ambion))溶液混合的18ml 0.9%冷盐水以进行组织采集。将肝、骨骼肌、脑纹状体、脑皮质、半脑和小脑样品在液氮中速冻,并储存在-80℃。
[0326]
布雷那兰剂量
[0327]
在实验中,如本文所述,布雷那兰剂量以布雷那兰单盐酸盐在甲基纤维素中的溶液(10mg/ml悬浮液)(对于1%溶液中等粘度400cp),tween 80(1%v/v),纯净水悬浮液配制品提供。
[0328]
rna提取和实时定量pcr
[0329]
在precellys中以6000rpm匀浆40秒后,使用rneasy plus试剂盒(凯杰公司(qiagen))提取来自大脑和小脑的总rna。使用paxgene血液rna试剂盒(凯杰公司)根据生产商方案从血液中提取rna。rna通过nanodrop 2000(赛默飞世尔科技公司)进行定量。如下从140-400ng rna合成cdna:使用maxima第一链cdna合成试剂盒,使用聚dt和无规六聚体(赛默飞世尔科技公司)的混合物,以20ul反应(25℃10分钟,50℃15分钟,然后85℃5分钟)。使用20ul taqman快速高级母混合物(taqman fast advanced master mix)(赛默飞世尔科技公司)和4ul cdna反应和针对每个基因特异的引物进行定量pcr。pcr步骤如下:95℃20秒,然后95℃1秒、55℃20秒,40个循环。对于wt人htt而言,引物的序列,正向,5
’‑
gtcatttgcaccttcctcct-3’(seq id no:1);反向,5
’‑
tggatcaaatgccaggacag-3’(seq id no:2),并且探针序列为56-fam/ttg tga aat/zen/tcg tgg tgg caa ccc/3iabkfq/(seq id no:8),对于htt新颖外显子,正向,5
’‑
tcctgagaaagagaaggacattg-3’(seq id no:3);反向,5
’‑
ctgtgggctcctgtagaaatc-3’(seq id no:4)并且探针序列为/56-fam/aat tcg tgg/zen/tgg caa ccc ttg aga/3iabkfq/(seq id no:7)。基因表达的相对定量使用2-δδct
方法进行。在标准化为作为内源参考的小鼠葡糖醛酸糖苷酶β(gusb)后,计算了mrna表达水平的倍数变化。
[0330]
蛋白质制备和蛋白质印迹分析
[0331]
将速冻的小鼠组织样品在具有蛋白酶和磷酸酶抑制剂(赛默飞世尔科技公司)的ripa缓冲液中通过precellys在6000rpm下匀浆40秒。通过在4℃以13,000rpm离心20分钟获得上清液。使用bca蛋白测定法(赛默飞世尔科技公司)定量总蛋白浓度。在还原条件下,将样品溶解在3%-8%的tris-醋酸盐蛋白凝胶中。将蛋白转移到pvdf膜(密理博公司(millipore))上,并使用兔抗亨廷顿抗体(密理博公司#mab2166)、小鼠抗肌动蛋白(西格玛公司(sigma),#a5316)和小鼠抗粘着斑蛋白(伯乐公司(bio-rad),#mca465)进行蛋白质印迹分析。蛋白带通过image j定量。
[0332]
csf样品的蛋白质分析
[0333]
在4℃,在离心机中以14,000rpm离心5分钟后,将csf样品澄清。在96孔v型底板上加载2.5-5ul csf样品的csf缓冲液。随后添加在erenna测定缓冲液中稀释的mp-2b7(磁性颗粒抗体缀合悬浮液)htt抗体。将测定板在室温下振荡(600rpm)孵育1小时,然后在biotek-405上进行转移后洗涤程序。将20ul/孔的mw1检测抗体添加至测定板。将板在室温下振荡(以750rpm)孵育1小时。在biotek-405上洗涤,并在连续缓冲液洗涤后,将测定板置
于磁力架上,直到将所有珠子拉到磁体上(约5分钟),将来自测定板的10ul样品转移至384孔板。将板在室温下放置30分钟,然后在erenna机器上以60秒的运行时间运行。
[0334]
结论
[0335]
布雷那兰在人神经母细胞瘤细胞系(shsy5y)中的体外评估表明,布雷那兰治疗在剂量范围从5nm-125nm导致总亨廷顿转录本剂量依赖性降低至正常内源性水平的30%-90%,以及含有新颖外显子的htt转录本的伴随增加(100-500倍)(图2a和2b)。此外,蛋白质印迹分析表明,在相同剂量范围内,转录本的这种减少伴随着正常亨廷顿蛋白的稳健减少(50%-70%)(图2c)。布雷那兰降低htt转录本的ec50在20-25nm范围内,而针对htt蛋白降低的ec50在10-25nm范围内。
[0336]
为了在体内证实这些发现,使用hd的人源化的小鼠模型bachd模型(gray等人,j.neurosci[神经科学杂志]2008;28(24);6182-6195),该模型包含具有97的cag扩增(seq id no:23)的全长突变人htt基因,并以约1.5x正常小鼠htt表达突变蛋白。bachd小鼠接受了10mg/kg或50mg/kg水平的布雷那兰单口服剂量。总htt转录本和含新颖外显子的htt转录本在8小时和24小时(对于10mg/kg剂量)以及在8小时、24小时和48小时(对于50mg/kg剂量)测量。通过定量pcr评估脑组织(大脑,图3和图4)中由布雷那兰治疗产生的总htt和包含新颖外显子的htt转录本水平的变化。给药后8小时和24小时,在两个脑区域中,包含新颖外显子的htt形式明显剂量依赖性增加。给药后48小时从50mg/kg组收集的样品显示有恢复至媒剂水平的趋势。在给药后24小时,两种剂量水平的总htt转录本水平在8小时显示降低趋势,而在50mg/kg水平显示更大程度的降低趋势。
[0337]
此外,对来自相同动物的血液样品的评估表明含有新颖外显子的htt转录本的稳健调节和总htt转录本的降低(图5和6)。
[0338]
为了评估布雷那兰对突变htt蛋白的作用,在相同的小鼠模型中进行了重复给药研究。bachd小鼠每周三次接受12mg/kg或24mg/kg的布雷那兰剂量,持续三周。蛋白质印迹分析显示,在纹状体(图7)和皮质(图8)中以12mg/kg和24mg/kg剂量在给药后24小时,突变htt蛋白剂量依赖性显著降低,其中纹状体中有更大的htt明显降低。对来自相同动物的csf样品中突变htt蛋白的评估显示以12mg/kg和24mg/kg在最后剂量后24小时的约50%的降低(图11)。相对于24小时观察到的,突变htt蛋白进一步降低的趋势从给药后72小时从24mg/kg群组分解看是明显的。另外,通过肝脏中的mhtt蛋白(图9)和血液中的总htt转录物(图10)的稳健降低,证实了对htt水平的外周影响。布雷那兰的作用对人htt特异,而对内源性小鼠htt转录本或蛋白质未看到降低作用。
[0339]
为了表征htt蛋白降低和恢复的时间过程并更好地建模pk-pd关系,进行了扩展的时间过程研究。bachd小鼠每周三次口服剂量的24mg/kg布雷那兰,持续三周。在最后剂量后72、168、240或336小时将动物处死并收集组织,另一群组的动物接受24mg/kg剂量,持续一周,在最后剂量后72小时收集组织。蛋白质印迹分析显示突变htt蛋白的时间依赖性下降趋势是从给药1周到给药3周。在使用布雷那兰给药3周后,在72小时观察到htt蛋白最大降低约45%(相对于媒剂),并在72-168小时(皮质,图21)或72-336小时(纹状体,图20)回到基线。
[0340]
我们的研究结果表明,布雷那兰间歇每周给药导致亨廷顿氏病所影响的脑关键区域(纹状体和皮质)中突变htt蛋白的稳健降低。cns中观察到的突变htt蛋白水平降低与预
期基于用其他htt降低模式情况下的临床前观察而提供治疗益处(减慢hd进展)的水平一致(stanek等人,hum gen ther[人类基因疗法]2014,25,461-474;kordasiewicz等人,neuron[神经元]2012,74(6),1031-1044;southwell等人,sci transl med[科学转化医学]2018,10,1-12)。布雷那兰还降低了外周htt水平,为解决与亨廷顿氏病相关的系统性问题(例如心脏、骨骼或代谢问题)提供了潜在的机会(van der burg等人,the lancet(neurology)[柳叶刀(神经病学)]2009;第8卷,第8期,765-774)。
[0341]
实例1b:其他剪接调节子的临床前评估:化合物1至82
[0342]
q48 htt人胚胎干细胞系的突变htt和总htt多重测定
[0343]
多重测定是在人胚胎干细胞(hesc)中进行,人胚胎干细胞已由缉拿生物细胞公司(genea biocells)衍生自hd供体的人胚泡。将细胞以10,000个细胞/孔的密度接种到384孔胶原蛋白包被的平板中,并粘附24小时,然后将化合物1至82加入细胞并孵育48小时(37℃,5%co2),然后裂解细胞,将内容物分开进入黑色的384孔板。
[0344]
黑色板中添加了htrf标记的单克隆抗体的组合,这些单克隆抗体识别htt蛋白的不同区域,2b7-tb“供体”抗体(0.2ng/孔)识别蛋白n末端的序列,mw1-alexa488“受体1”抗体(30ng/孔)识别聚q区中的区域,而mab2166-d2“受体2”抗体(6ng/孔)识别超出聚q区域外的序列。所述2b7抗体获得自coriell公司(ch02024),mw1抗体获得自密理博公司(mabn2427),并且mab2166抗体获得自密理博公司(1hu-4c8)。
[0345]
这些检测试剂在室温下与细胞裂解物一起孵育4-6小时,然后在615nm(供体)、535nm和665nm(分别为受体1和受体2)处定量其荧光。这些信号之间的供体/受体比表明mhtt和thtt蛋白的相对量。如表1所示,其中和表2中所述的化合物1至82具有以下pic
50
值。对于mhtt pic
50
,低于5的pic
50
值由零个星()表示,5和6之间的pic
50
值由单个星(*)表示,6和6.5之间的pic
50
值由两个星(**)表示,6.5和7.0之间的pic
50
值由三个星(***)表示,7.0和7.5之间的pic
50
值由四个星(****)表示,并且大于7.5的pic
50
值由五个星(*****)表示。
[0346]
表1
[0347]
[0348]
[0349]
[0350]
[0351]
[0352]
[0353][0354]
表2
[0355]
[0356]
[0357]
[0358]
[0359]
[0360]
[0361]
[0362]
[0363]
[0364]
[0365]
[0366]
[0367]
[0368]
[0369][0370]
实例1c:布雷那兰临床评估的剂量选择
[0371]
实例1c.1:药代动力学模型描述
[0372]
在gastroplus
tm
软件9.6版(simulationplus,兰卡斯特(lancaster),加利福尼亚州,美国)中,使用高级隔室和转运(acat)/基于生理的药代动力学(pbpk)模型开发了成人受试者的药代动力学(pk)模型。
[0373]
建模策略
[0374]
·
在gastroplus
tm
软件中建立了儿科acat/pbpk模型的主要设置,包括理化参数、生理参数和配制因子。acat模型与完整的pbpk模型(其中通过gastroplus
tm
软件提供的计算机模拟方法估计了组织与血浆的浓度比)联系。
[0375]
·
使用布雷那兰的血浆浓度估计清除率(cl),该血浆浓度来自口服布雷那兰概念研究的开放式多部分人中首次证明,仅第1部分。这项研究的第1部分的目的是确定每周递增剂量的安全性和耐受性,并估计口服/肠内布雷那兰(实例3中所述的配制品)在患有1型sma婴儿中的最大耐受剂量(mtd)。所有患者均具有2个smn2基因拷贝。每周给患者给予布雷那兰一次。在随后的群组研究中,将布雷那兰剂量逐步增加直到确定mtd或pk结果确认由于较高剂量下的潜在药代动力学暴露平台而无法达到mtd为止。涉及游离碱的起始剂量为6mg/m2(等于0.3125mg/kg)。后续剂量为12mg/m2、24mg/m2、48mg/m2和60mg/m2(分别为0.625mg/kg,1.25mg/kg,2.5mg/kg和3.125mg/kg)。第1部分登记了14名患者;13名患者暴露于布雷那兰。暴露持续时间在4-33个月的范围内,有7名患者保持在研究中。7名患者中有六名正在接受60mg/m2,1名患者正在接受48mg/m2。没有观察到剂量限制性毒性。
[0376]
·
60mg/m2的布雷那兰标称剂量(3.125mg/kg,如上所述,使用布雷那兰进行的人中首次概念验证研究)并且在gastroplus
tm
软件中优化功能后使用33-39个月大的1型sma患者中的血浆浓度-时间过程估计布雷那兰的体内溶解度和体内溶解。
[0377]
·
60mg/m2的布雷那兰标称剂量(3.125mg/kg,如上所述,使用布雷那兰进行的人中首次概念验证研究)并且在gastroplus
tm
软件中优化功能后使用33-39个月大的1型sma患者中的浓度-时间过程估计布雷那兰的分布参数。
[0378]
·
通过比较35-44个月和22-29个月的1型sma患者(来自如上所述使用布雷那兰进行的人中首次概念验证研究)中的模拟血浆浓度-时间过程与观察到的过程,对儿科acat/pbpk模型进行定性。
[0379]
模型开发
[0380]
标称布雷那兰剂量60mg/m2(3.125mg/kg,如上所述使用布雷那兰进行的人中首次概念验证研究)后的33-39个月大的1型sma患者中观察到的布雷那兰血浆浓度用于通过gastroplus
tm
软件构建儿科acat/pbpk。通常,一种或多种药物代谢酶/转运蛋白大约在2岁时成熟(lin w,yan jh,heimbach t等人(2018)pediatric physiologically based pharmacokinetic model development:current status and challenges[儿科生理学基础的药代动力学模型开发:现状和挑战].curr pharmacol rep[当前药理学报道];4:491-501)。可以根据体型大小、肝血流量和其他发育生理因素对2岁以上儿童患者进行可靠的cl预测(lin w等人,2018,参见上文)。假设可以将pk参数转移到成人群体。
[0381]
重新评估了布雷那兰的体内溶解度参数,以考虑增溶剂环糊精(cd)对布雷那兰的溶解度的影响,该增溶剂环糊精(cd)在目前使用的配制品(实例3)中存在。应用gastroplus
tm
软件中的优化功能以匹配在33-39个月的1型sma患者中观察到的全身暴露(标称剂量:60mg/m2,3.125mg/kg,如上所述使用布雷那兰进行的人中首次概念验证研究)并评估在cd存在时布雷那兰的体内溶解度。
[0382]
在口服布雷那兰施用后的1型sma患者中,在所有研究剂量水平下,血浆中布雷那兰最大浓度(tmax)的中位数时间范围为2.97至4.00h(标称剂量范围:6至60mg/m2,如上所述使用布雷那兰进行的人中首次概念验证研究)。尽管使用含cd的布雷那兰溶液提示吸收迅速,但tmax值表明吸收延迟。应用gastroplus
tm
软件中的优化功能以匹配33-39个月大的1型sma患者中观察到的布雷那兰血浆浓度-时间谱(标称剂量:60mg/m2、3.125mg/kg,如上所述使用布雷那兰进行的人中首次概念验证研究),其控释溶解谱在0.25、1、3.25小时分别产生2%、5%和95%的释放特性。
[0383]
将儿科acat模型与血浆中的隔室pk模型(gastroplus
tm
软件)相关联,以更准确地描述年龄在33-39个月的1型sma患者中布雷那兰的血浆浓度-时间过程(标称剂量范围:6至60mg/m2,如上所述使用布雷那兰进行的人中首次概念验证研究)。这是通过gastroplus
tm
软件中的优化功能执行,从而产生了拟合的分布参数(k12,从隔室1到隔室2的一阶速率常数;k21,从隔室2到隔室1的一阶速率常数;vc,中心隔室的容积)。
[0384]
结果-儿科acat/pbpk模型
[0385]
成功开发儿科acat/pbpk模型。该模型基于标称布雷那兰剂量60mg/m2(3.125mg/kg,如上所述使用布雷那兰进行的人中首次概念验证研究)后的33-39个月大的1型sma患者中观察到的布雷那兰血浆浓度。表3列出了模型的使用和衍生的输入参数。图15显示了33-39个月大的1型sma患者的布雷那兰模拟血浆浓度-时间过程。
[0386]
构建儿科acat/pbpk模型后,使用衍生自35-44个月和22-29个月大的1型sma患者的布雷那兰血浆浓度-时间过程进一步鉴定(标称剂量:60mg/m2,3.125mg/kg,如上所述使
用布雷那兰进行的人中首次概念验证研究)。图16和图17中显示两个患者群体的模拟血浆浓度-时间过程。两个图均表明,由儿科acat/pbpk模型模拟的布雷那兰血浆浓度-时间过程与另外的1型sma患者群体的血浆浓度-时间过程适当匹配,表明恰当的acat/pbpk模型开发。
[0387]
表3 33-39个月大的1型sma患者的建立的布雷那兰儿科acat/pbpk模型的输入参数
[0388]
[0389][0390]
cl:清除率;k12:隔室1和隔室2之间的一阶速率常数;k21:隔室2和隔室1之间的一阶速率常数;logp:有机溶液与水溶液之间分配系数的对数;peff:有效渗透率;pka:酸解离常数的负对数;vc:中心隔室的容积;
[0391]
a:artursson p,karlsson j(1991)correlation between oral drug absorption in humans and apparent drug permeability coefficients in human intestinal epithelial(caco-2)cells[人口服药物吸收与人肠上皮(caco-2)细胞表观药物渗透系数之间的相关性].biochem biophys res comm[生物化学和生物物理研究通讯];175:880-5。
[0392]
将儿科acat/pbpk模型放大到成人acat/pbpk模型
[0393]
为了将布雷那兰儿科acat/pbpk模型放大到成人acat/pbpk模型,应用从非临床物种预测的成人cl代替儿科cl,并且使用的体重为70公斤。剂量设定为250ml。将为儿科患者估计的分布参数输入成人pk模型。成人中估计的表观终末消除半衰期(t1/2)为62小时。表4总结了成人acat/pbpk模型中的一般输入参数。表5显示了成人单次口服施用布雷那兰后布雷那兰暴露的模型预测。
[0394]
表4建立的布雷那兰成人acat/pbpk模型的输入参数
[0395][0396]
cl:清除率;k12:隔室1和隔室2之间的一阶速率常数;k21:隔室2和隔室1之间的一阶速率常数;logp:有机溶液与水溶液之间分配系数的对数;peff:有效渗透率;pka:酸解离常数的负对数;t1/2:表观终末消除半衰期;vc:中心隔室的容积;
[0397]
a:artursson p,karlsson j(1991)correlation between oral drug absorption in humans and apparent drug permeability coefficients in human intestinal epithelial(caco-2)cells[人口服药物吸收与人肠上皮(caco-2)细胞表观药物渗透系数之间的相关性].biochem biophys res comm[生物化学和生物物理研究通讯];175:880-5。
[0398]
表5成人中单次施用布雷那兰后预测的布雷那兰暴露
[0399][0400]
auc:曲线下面积;cmax:最大浓度;fa:吸收分数;tmax:最大浓度时间
[0401]
实例1c.2:药效/药代动力学模型描述
[0402]
使用如实例1c.1所述的成人pbpk模型开发成人受试者的药效/药代动力学(pd/pk)模型,并在gastroplus tm
软件9.6版(simulationplus,兰卡斯特,加利福尼亚州,美国)中与pd模型偶联。
[0403]
建模策略
[0404]
·
在bachd小鼠模型中建立pk/pd关系(参见实例1a)并开发pk/pd模型。
[0405]
·
开发成人患者pk/pd模型
[0406]
·
估计预期的有效剂量范围
[0407]
模型开发
[0408]
为了建立pk/pd关系并开发小鼠pk/pd模型,考虑来自雄性c57bl/6小鼠(10mg/kg,单剂量)、rash2小鼠(1、3、4和10mg/kg,重复的每日剂量)和bachd小鼠(10和50mg/kg,单剂量;12和24mg/kg,每周重复三次剂量)的研究的pk数据,估计小鼠血浆中的pk参数。该数据池的pk参数分析是通过具有额外血管施用、滞后时间(tlag)、2-隔室(v1:隔室1的容积;v2隔室2的容积,q:隔室间清除率,ka:一阶吸收速率;cl:清除率)的群体pk模型进行的。群体pk模型由monolix软件(版本2018r1,lixoft)描述和执行。
[0409]
为了开发pk/pd关系,将bachd小鼠脑中的突变htt蛋白的浓度及其在施用布雷那兰后的变化用作pd生物标志物(实例1a)。为了增加数据基数,汇总了突变htt蛋白的所有浓度。通过周转模型(如下所述),考虑到脑中突变htt蛋白产生的抑制,研究了血浆中布雷那兰浓度与脑中突变htt蛋白浓度之间的相关性。由于确定了脑皮质和脑纹状体中的突变htt蛋白,因此分开地对两个脑部分执行pk/pd相关性。群体pk/pd模型可以描述血浆中布雷那兰的cmax(给药后3至6小时之间)与脑中突变htt蛋白最大降低(给药后约72h)之间的观察到的时间延迟。为了执行群体pk/pd模型,固定先前描述的群体pk模型的pk参数(表6中所示),并计算pd参数。monolix软件(版本2018r1,lixoft)及文库中描述的其周转模型(pkpd/
oral1_2cpt_sigmoidindirectmodelinhibitionkin_tlagkaciv1qv2r0koutimaxic50gamma)用于确定小鼠的pd参数。模型的pd部分可用以下等式描述:
[0410]
突变htt蛋白随时间的变化=
[0411]
kin*(1-imax*max(cc,0)^γ/(max(cc,0)^γ ic50^γ))-kout*r
[0412]
kin:突变htt蛋白的合成速率
[0413]
kout:突变htt蛋白的降解速率
[0414]
imax:最大抑制作用
[0415]
ic50:半最大抑制浓度
[0416]
γ:药物作用的s形因子(sigmoidicity)
[0417]
max(cc,0):布雷那兰血浆浓度
[0418]
r:由于在bachd小鼠模型中仅确定了相对于基线的相对变化(实例1a),因此在给定时间的基线r0时突变htt蛋白水平为1,
[0419]
必须指出的是,由于在bachd小鼠中仅确定了相对于基线的相对变化(实例1a),所以将最大抑制作用设置为1,并且将突变htt蛋白基线r0设置为1。因此,比率r0=kin/kout(突变htt蛋白合成速率/突变htt蛋白降解速率)表示kin和kout相等。
[0420]
为了在开发成人pk/pd模型,使用成人acat/pbpk模型(实例1c.1)来预测口服布雷那兰后血浆中布雷那兰的浓度-时间过程。根据以下假设,将小鼠中的群体pk/pd模型的pd参数针对脑皮层和脑纹状体从bachd小鼠缩放至人:
[0421]
·
脑中的突变htt基线水平(r0)保持等于1。
[0422]
·
假定药物效力(ic50)在人中与在bachd小鼠中相同。该值没有被血浆蛋白结合校正,因为小鼠和人中的值在小鼠和人中分别为0.741和0.8。
[0423]
·
考虑异速缩放法(基于以下假设:蛋白质、肽和激素的内源性周转可以跨不同物种进行缩放并且与能量周转或代谢速率相关),将突变htt蛋白合成(kout)的降解速率或分数周转参数从bachd小鼠缩放至人(gabrielsson j,hjorth s,quantitative pharmacology:an introduction to integrative pharmacokinetic-pharmacodynamic analysis[定量药理学:综合药代动力学-药效学分析导论].swedish pharmaceutical press[瑞典制药出版社];第1版(2012年5月7日))。经验上用于缩放速率常数的指数-0.2(mahmood i等人,1996,interspecies scaling:predicting clearance of drugs in humans:three different approaches[物种间缩放:预测人类药物的清除率:三种不同的方法].xenobiotica 26:887-895和mahmood i,2005,prediction of oral pharmacokinetic parameters in humans,in interspecies pharmacokinetic scaling:principles and application of allometric scaling[在物种间药代动力学缩放中人中口服药代动力学参数的预测:异速缩放的原理和应用]第144-167页,pine house publishers[松家出版公司],罗克维尔市(rockville),马里兰州)用于异速缩放,并且等式kout人=kout小鼠*(体重人/体重小鼠)^-0.2用于估计。
[0424]
为了估计预期的有效剂量范围,将成人acat/pbpk模型(实例1c.1)和成人pd模型偶联,并通过gastroplus tm
软件9.6版(pd plus模块,simulationplus,兰卡斯特,加利福尼亚州,美国)执行模拟。在成人中模拟了每周两次给药和每周一次给药方案的几种剂量水平,以预测相应的pk/pd谱(相比于时间)和pk/pd参数(例如最大浓度,cmax和曲线下面积
auc;脑内mhtt降低)。模拟的目标是脑中的突变htt蛋白减少约50%,这被认为对于临床上有意义减慢疾病进展是必要的(kaemmerer wf和grondin rc,2019,the effects of huntingtin-lowering:what do we know so far?[降低亨廷顿蛋白的作用:目前我们知道什么?],degenerative neurological and neuromuscular disease[退化性神经病和神经肌肉疾病],9,第3-17页)。
[0425]
结果-基于bachd小鼠的pk/pd模型
[0426]
表6列出了pk/pd模型的参数估计。图18和图19显示了三重口服施用布雷那兰3周后bachd小鼠的脑(皮质和纹状体)中突变htt蛋白的预测分布。
[0427]
表6基于bachd小鼠的小鼠pk/pd模型的参数估计
[0428][0429][0430]
cl:从中央隔室消除的清除率;f:生物利用度;ic50:半最大抑制浓度;imax:最大抑制作用;ka:一阶吸收速率常数;kout:突变htt蛋白的降解速率;q:隔室间清除率;ro:脑中突变htt蛋白浓度的基线;rse:以近似标准偏差量表报告的相对标准误差(se/方差)/2;tlag:吸收滞后时间;v1:2-隔室pk模型的中心容积;v2:2-隔室pk模型的外周容积
[0431]
结果-成人患者的pk/pd模型
[0432]
实例1c.1给出了成人acat/pbpk模型的参数估计,并且表7列出了缩放的群体pd数据。
[0433]
表7基于bachd小鼠的人pk/pd模型的参数估计
[0434][0435][0436]
a:基于体重的蛋白质周转的异速缩放,kout人=kout小鼠x(bw人/bw小鼠)^-0.2;b:突变htt蛋白t1/2=ln(2)/kout;c:假定人中的与bachd小鼠中的ic50相同
[0437]
ic50:imax的50%的浓度;imax:最大抑制作用;kout:突变htt蛋白的分数周转参数;ro:脑中突变htt蛋白浓度的基线;t1/2:半衰期
[0438]
结果-成人患者中的预期的有效剂量
[0439]
在成人患者中开发的pk/pd模型用于模拟每周或每周两次布雷那兰口服剂量后布雷那兰的血浆浓度-时间过程以及脑(皮质和纹状体)中突变htt蛋白的相应减少。模拟的目标是脑中的突变htt蛋白最大减少约50%,这被认为对于临床上有意义减慢疾病进展是必要的(kaemmerer wf和grondin rc,2019,the effects of huntingtin-lowering:what do we know so far?[降低亨廷顿蛋白的作用:目前我们知道什么?],degenerative neurological and neuromuscular disease[退化性神经病和神经肌肉疾病],9,第3-17页)。布雷那兰的预期有效剂量范围预计为每周一次140至560mg,以及每周两次70至280mg。较高剂量被认为导致脑中突变htt蛋白的更高减少,具有潜在的更高益处。但是,在风险-益处评估中必须平衡不良事件的潜在增加。
[0440]
表8显示了在确定的剂量范围内在稳定状态下预期的暴露参数以及脑中突变htt蛋白的预期相应减少。
[0441]
表8稳定状态下成人患者的pk和pd预测值
[0442][0443]
auc:曲线下面积;biw:每周两次;cmax:最大浓度;ctrough:最低浓度qw:每周一次;ss:稳定状态
[0444]
实例2:布雷那兰的临床评估
[0445]
实例2.1:
[0446]
一项两部分、安慰剂对照剂量范围发现研究,用于评估亨廷顿氏病受试者每周一次或每周两次口服剂量施用时布雷那兰的安全性、耐受性、药代动力学和药效学。
[0447]
[0448][0449]
共有64名受试者以适应性方式随机分配到4个治疗组中的1个(图14)。每个治疗组都是随机的活性:安慰剂3:1。将前32名受试者随机分配到两个治疗组之一,而将后32名受试者根据数据监控委员会(dmc)建议随机分配到剂量方案。在研究的第1部分中,总共计划进行2个中期分析(ia)。ia-1,在16名受试者完成6周治疗后进行,以针对最近2个治疗组提供剂量选择信息。ia-2,在所有受试者(64)完成12周治疗后进行,以针对第2部分提供剂量
选择信息。
[0450]
两个ia均由外部dmc进行。
[0451]
第1部分:剂量范围发现
[0452]
确认资格后,受试者将完成基线评估(约经一天)和以指定的治疗方案的多剂量治疗期(受试者之间不同)。如评估时间表所述,收集与hd相关的安全性、耐受性、pk/pd和临床终点。由于研究的性质,在治疗的前12周内,赝品收集/研究评估的频率更高。确认资格后,使患者随机接受作为每周两次施用的口服溶液的活性治疗或安慰剂治疗。在前12周内,总共需要进行7次就诊。如果认为合适,则可以由合格的就诊医疗保健专业人员在家中进行一些就诊。在为期12周的就诊中,患者将有机会继续参与研究。如果受试者选择保留在研究中,则他们将继续接受分配的研究治疗并以每月为基础完成临床就诊,直到激活开放标签扩展。受试者。如果受试者不希望继续,则结束研究评估。
[0453]
第2部分:开放标签扩展
[0454]
一旦最终受试者(64)完成第1部分中的第12周,dmc就会审查所有可用数据,以为第2部分提出最终剂量建议。通知站点,并且受试者返回研究诊所开始第2部分。在第一开放标签剂量之前,如评估时间表中所列出,收集了一系列评估。每6周进行一次临床就诊,直到受试者达到研究参与的第52周。
[0455]
群体
[0456]
这项研究登记了大约62个患有确诊的i或ii期亨廷顿氏病的男性或女性受试者,以允许完成60名受试者(治疗12周后)。
[0457]
纳入标准
[0458]
有资格纳入本研究的受试者必需满足以下所有标准:
[0459]
1.必须在进行任何评估之前获得书面知情同意书。
[0460]
2.必须能够提供知情同意(根据研究者的意见)
[0461]
3.筛查时临床诊断的显现的亨廷顿氏病的uhdrs总功能能力(tfc)》7
[0462]
4.经过基因证实的亨廷顿氏病,其中亨廷顿基因中存在≥36个cag重复(seq id no:22)
[0463]
5.知情同意书签署当天,年龄在25至75岁(含)之间的男性和女性受试者
[0464]
排除标准
[0465]
符合任何以下标准的受试者不具有纳入此研究的资格。
[0466]
1.任何会干扰腰椎穿刺过程、csf循环或安全性评估的脑或脊柱疾病的病史。
[0467]
2.如果在过去6个月内发生自杀意念,请在c-ssrs的自杀意念部分的项目4或5上打“是”,或者,如果该行为发生在过去两年中,在自杀行为部分的任何项目上打“是”(除了“非自杀式自残行为”(该行为也包括在自杀行为部分中)之外)。
[0468]
3.性活跃男性在服用药物时且在停用布雷那兰药物治疗后6个月内在性交期间必须使用安全套且不应在此期间孕育子女。切除输精管的男性也需要使用避孕套,以防止药物通过精液递送。
[0469]
4.在登记的5个半衰期内或30天内(以较长者为准)使用其他研究药物。
[0470]
5.对任何研究药物或赋形剂或对类似化学类别的药物具有超敏反应史。
[0471]
6.心脏异常或心脏复极化异常,包括以下任何一种:
[0472]
·
在开始研究治疗之前的6个月内,有心肌梗塞(mi)、心绞痛或冠状动脉旁路手术(cabg)的病史。
[0473]
·
临床上显著的心律失常(例如室性心动过速)、完全左束支传导阻滞、高级av阻滞(例如双分支阻滞、mobitz ii型和三度av阻滞)。
[0474]
7.治疗前[筛选和基线]静息qtcf≥450毫秒(男性)或≥460毫秒(女性)或无法确定qtcf间隔。
[0475]
8.服用抑制cyp3a4的药物的受试者(例如,克拉霉素、考尼伐坦、茚地那韦、依托康唑(itroconazole),酮康唑、利托那韦、米贝拉地尔、奈法唑酮、奈非那韦、泊沙康唑、沙奎那韦、特拉匹韦、泰利霉素、伏立康唑等)。
[0476]
9.在过去5年内(无论是否存在局部复发或转移的迹象)已治疗的或未治疗的任何器官系统的恶性病史(局部皮肤基底细胞癌或原位宫颈癌除外)。
[0477]
10.孕妇或哺乳期(泌乳)妇女。
[0478]
11.有生育能力的妇女,定义为所有在生理上能够怀孕的妇女,除非她们在给药期间以及停止使用研究药物后6个月内使用高效避孕方法。高效的避孕方法包括:
[0479]
·
完全禁欲(当这符合受试者的优选和通常的生活方式时)。周期禁欲(例如按日历、按排卵期、按体温、排卵期后方法)和体外射精不是可被接受的避孕法。
[0480]
·
女性绝育(已行双侧卵巢切除术,进行或未进行子宫切除术),在服用研究药物前至少六周进行全子宫切除术或输卵管结扎术。在仅进行卵巢切除术的情况下,仅当女性生殖状况已通过后续的激素水平评估确认时。
[0481]
·
男性绝育(筛选前至少6个月)。对于研究中的女性受试者,经输精管切除术的男性伴侣应为该受试者的唯一伴侣。
[0482]
·
使用口服(雌性激素和黄体酮)、注射或植入的荷尔蒙的避孕方法或放置宫内节育器(iud)或宫内节育系统(ius)或其他具有类似功效(失败率《1%)的激素避孕方法,例如激素阴道环或透皮激素避孕。
[0483]
如果使用口服避孕药,则在服用研究药物之前,妇女应已在同一药上稳定至少3个月。
[0484]
如果当地法规与上述避孕方法不同,则适用当地法规,并在知情同意书(icf)中进行说明。
[0485]
妇女在其12个月自然(自发)闭经且具有适当的临床概况(例如年龄适当、血管舒缩症状史)或在至少六周之前进行了外科双侧卵巢切除术(进行或不进行子宫切除术)、全子宫切除术或输卵管结扎时被认为是停经后且不能生育的。在仅进行卵巢切除术的情况下,仅当妇女的生殖状况已通过后续的激素水平评估确认时,她被认为没有生育潜能。
[0486]
12.任何会干扰完成方案指定评估的能力的病史或病情。例如,植入的分流器、排除mri扫描的病症等。
[0487]
13.如研究者评估,处于自杀、重大抑郁发作、精神病、精神混乱状态或暴力行为的重大风险中。
[0488]
15.抗抑郁药或苯二氮卓的使用,除非筛选前至少12周稳定剂量且研究期间预计不会改变剂量方案。
[0489]
16.需要系统性抗病毒或抗微生物疗法的活动性感染,在首次研究药物施用(第1
天)之前至少3天不能完成。
[0490]
17.基因疗法或细胞移植或任何其他实验性脑手术的任何历史。
[0491]
18.无法表示同意的受试者,依赖于发起人、研究者或工作地点的人员,以及已经通过官方或司法命令被送到机构的人员。
[0492]
19.乙型或丙型肝炎病史或活动性病毒性肝炎的血清学证据(hbsag和hcvab测试)。
[0493]
20.在参与研究的情况下可能使受试者面临危险的任何手术或医学状况。研究者应在考虑到受试者的病史和/或任何以下情况的临床或实验室证据的情况下来做出此决定:
[0494]
·
脂肪酶和/或淀粉酶不得超过正常上限(uln)的1.5x
[0495]
·
异常肝功能检查表明存在肝疾病或肝损伤。将检查alt(sgpt)、ast(sgot)、γ-gt、碱性磷酸酶和血清胆红素。
[0496]
·
血清中alt、ast、γ-gt、碱性磷酸酶或胆红素中的任何单一参数不得超过正常上限(uln)的1.5x。
[0497]
·
alt、ast、γ-gt、碱性磷酸酶或血清胆红素中多于一个参数高于uln的任何升高将排除受试者参与该研究。
[0498]
·
肾损伤/肾疾病史或存在肾功能受损,如肌酐或bun和/或尿素值高于uln的任何升高或存在尿液成分异常(例如蛋白尿)所指示。
[0499]
·
筛选时存在尿路梗阻或排尿困难的证据。
[0500]
21.免疫缺陷病史,包括hiv阳性(elisa和蛋白质印迹)检测结果。
[0501]
22.药物或酒精滥用史,或通过在筛选期间进行的实验室检测所表明的这种滥用的证据。
[0502]
23.在初次给药前两(2)周内未消退的重大疾病。
[0503]
25.筛选之前和在登记时持续至少12周的稳定的医学、精神病和神经病学状况。
[0504]
26.无法或不愿意完成方案中的所有评估。
[0505]
27.通过超声评估,睾丸异常的临床重要体征。
[0506]
28.临床上显著的视网膜异常。
[0507]
实例2.2:评估布雷那兰对i型脊髓性肌萎缩症婴儿亨廷顿(htt)mrna表达水平的影响
[0508]
方法
[0509]
口服布雷那兰的开放标签多部分人中首次概念验证研究
[0510]
在i型脊髓性肌萎缩症婴儿中评估了布雷那兰对亨廷顿(htt)mrna表达水平的影响,这些婴儿参加了口服布雷那兰的开放标签多部分人中首次概念验证研究。
[0511]
这项研究的第一部分的目的是确定每周递增剂量的安全性和耐受性,并估计口服/肠内布雷那兰(参见实例3)在患有1型sma婴儿中的最大耐受剂量(mtd)。所有患者精确具有smn2基因的2个拷贝,例如通过定量实时pcr或液滴数字pcr确定。
[0512]
每周给患者给予布雷那兰一次。在随后的群组研究中,将布雷那兰剂量逐步增加直到确定mtd或pk结果确认由于较高剂量下的潜在药代动力学暴露平台而无法达到mtd为止。
(seq id no:4)和探针5
’‑
56-fam/aattcgtgg/zen/tggcaacccttgaga/3iabkfq-3’(seq id no:7))来定量htt mrna中新颖外显子的包含量。
[0522]
将所有基因表达值归一化为葡糖醛酸糖苷酶β(gusb)mrna水平。预先设计的定量pcr测定(测定hs.pt.39a.22214857,其使用正向引物5
’‑
tcactgaagagtaccagaaaagtc-3’(seq id no:16),反向引物5
’‑
ttttattccccagcactctcg-3’(seq id no:17)和探针5
’‑
hex/acgcagaaa/zen/atacgtggttggagagc/3iabkfq-3’(seq id no:18),购自集成dna技术公司)用以评估gusb mrna水平。
[0523]
结论
[0524]
在i型脊髓性肌萎缩症婴儿中评估了布雷那兰对亨廷顿(htt)mrna表达水平的影响,这些婴儿参加了口服布雷那兰的开放标签多部分人中首次概念验证研究。每周给患者给予布雷那兰一次。血液样品的纵向基因表达分析表明,在第一每周剂量的布雷那兰后诱导新颖外显子包含进入htt mrna中,并在1450个研究日期间持续保持恒定水平(图12)。此外,在904个研究日期间,血液htt mrna水平较基线下降了多达50%(图13)。此后,如根据临床研究的进展仅对1-5名长期接受治疗的受试者进行的评估,在研究的第904天至1450天之间,htt mrna水平恢复至基线水平附近的值(图13)。我们的研究结果表明,使用布雷那兰治疗i型脊髓性肌萎缩症的婴儿诱导血液htt mrna中包含新颖外显子,并且与基线相比将血液htt mrna的水平降低多达50%。这些结果表明,可以通过间歇给药布雷那兰来将htt持续降低至目标治疗水平。
[0525]
图12:每周口服剂量的布雷那兰诱导和升高sma 1型婴儿中的包含需要外显子的血液htt转录本水平。取决于研究中各个受试者的进展,从研究日358到1450的纵向数据仅可从1-5名受试者获得。误差条代表标准误差。
[0526]
图13:每周口服剂量的布雷那兰降低sma 1型婴儿中血液htt转录本水平。取决于研究中各个受试者的进展,从研究日358到1450的纵向数据仅可从1-5名受试者获得。误差条代表标准误差。
[0527]
实例3:布雷那兰的口服配制品
[0528]
程序
[0529]
将所需量的2-羟丙基-β-环糊精溶解于80%体积(即最终预期体积)的目标水中并搅拌30分钟。然后在室温下将所需量的布雷那兰单盐酸盐在搅拌下添加到所述溶液中。添加完成后,将溶液搅拌45分钟或更长的时间直到获得无(即,肉眼可见的)颗粒的溶液。使用naoh 0.1m或hcl 0.1m进行初始ph调节以达到预期的ph(
±
0.25)。将所需体积的水添加到溶液中以达到最终预期体积,并在添加完成后在25℃
±
3℃下搅拌至少10分钟。使用naoh 0.1m或hcl 0.1m进行最终的ph调节以达到预期的ph。
[0530][0531]
{*}无水的基础上盐/碱比1.093
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。