hdac2和dnmt1抑制剂在联合靶向治疗非酒精性脂肪性肝炎中的应用
技术领域
1.本发明属于生物医药领域,主要涉及hdac2和dnmt1抑制剂在治疗非酒精性脂肪性肝炎中的应用。
背景技术:
2.肝脏在损伤后具有自我修复的再生能力。然而,非酒精性脂肪性肝炎(nash)中,肝再生受到抑制。nash同糖尿病和代谢综合征类似,全球发病率呈上升趋势。nash可导致肝纤维化、肝硬化和肝衰竭,如果没有有效的抗纤维化治疗,nash导致的肝纤维化和肝硬化通常会导致系统性并发症,将成为全球的主要健康负担。临床上发展nash治疗的一个主要障碍是缺少系统模拟nash发病机制的细胞和分子网络的临床及临床前研究。
3.肝由实质细胞(肝细胞)和非实质细胞(npcs)如星状细胞、血管内皮细胞(ecs)和造血细胞等组成。肝再生依赖于不同细胞组分间的协同作用。然而,nash中持续的应激经常引起异常的细胞互作(在本文中,“互作”、“串扰”都可以理解为“交互调控(crosstalk)”)和导致失调的修复和纤维化。星状细胞的激活是肝纤维化的关键步骤,但仍然要确定nash中的慢性应激是如何导致其他肝脏npcs之间的互作以促进这一步骤的。
4.在npcs中,血管内皮细胞和造血细胞属于循环系统,可以直接传递系统性刺激(如代谢应激),还可以促进实质细胞与间充质细胞相互作用,共同建立血管微环境。血管内皮细胞是肝脏npcs的主要组成部分。肝的血液供应由肝静脉、肝动脉和门静脉之间的窦状血管系统完成。窦状血管系统有一层表达clec4g和oit3的窦内皮细胞(secs)和表达cd34的大血管内皮细胞(mecs)。因此,不同解剖部位的肝ecs表现出特殊的形态和表型标记,具有“窦内皮-大血管内皮”血管层次和器官内分类。在器官修复过程中,血管ecs会产生大量调节因子来调控造血细胞、间充质细胞和实质细胞之间的通讯(communication,在本文中还可以理解为“信息传递”)。窦内皮细胞(secs)的异常改变(如毛细血管化)与肝纤维化密切有关。然而,目前的临床和临床前模型中,在单细胞水平上还没有系统地阐明肝脏ec亚群对人类肝硬化或nash病理学的功能作用。
技术实现要素:
5.有鉴于此,本发明提供了hdac2抑制剂和dnmt1抑制剂在联合靶向治疗非酒精性脂肪性肝炎中的应用。
6.进一步地,所述非酒精性脂肪性肝炎伴有肝硬化或肝纤维化。
7.进一步地,所述肝纤维化的病理等级包括f2-f4级。
8.进一步地,所述hdac2抑制剂为莫西司他(mocetinostat),剂量为1-20mg/kg/天或0.1-2.0mg/kg/天(优选为1.1mg/kg/天)。
9.进一步地,所述dnmt1抑制剂为阿扎胞苷,剂量为0.1-2.0mg/kg/天或0.001-0.100mg/kg/天(优选为0.055mg/kg/天)。
10.进一步地,所述hdac2抑制剂和dnmt1抑制剂通过注射方式给药,所述注射方式包括腹腔注射、肌肉注射、皮下注射或静脉注射中的一种或多种。
11.进一步地,采用注射方式给药的具体操作为:第一周前5天注射dnmt1抑制剂治疗,每天1次,然后停药2天;第二周前5天注射hadc2抑制剂,每天1次,然后停药2天,重复治疗5-10个疗程(优选为6个疗程)。
12.进一步地,所述hdac2抑制剂和dnmt1抑制剂联合靶向使用减轻非酒精性脂肪性肝炎肝脏的纤维化程度并促进肝再生;和/或逆转肝硬化肝脏中的窦内皮-大血管内皮失调;和/或减少非酒精性脂肪性肝炎肝脏中促纤维化th17细胞的募集。
13.进一步地,所述hdac2抑制剂和dnmt1抑制剂联合靶向使用降低血糖、肝纤维化指数和/或血清肝功能指数。
14.进一步地,所述hdac2抑制剂和dnmt1抑制剂联合靶向使用降低血清总胆固醇水平。
15.进一步地,所述hdac2抑制剂和dnmt1抑制剂联合靶向使用减轻肝硬化并增加肝细胞增殖。
16.进一步地,所述hdac2抑制剂和dnmt1抑制剂联合靶向使用阻断肝硬化肝脏中igfbp7和adamts1的增加。
17.有益技术效果:
18.本发明提供hdac2抑制剂和dnmt1抑制剂在联合靶向治疗非酒精性脂肪性肝炎中的应用。本发明技术方案通过一系列实验揭示:肝脏内皮细胞亚群中的表观遗传改变,即hdac2和dnmt1的异常激活(其中,hdac2和dnmt1的表达在f2-f4级患者的肝脏中变化显著;肝硬化患者肝脏和肝硬化小型猪肝脏的内皮细胞中hdac2和dnmt1表达显著上调),会导致“窦内皮-大血管内皮失调”,刺激细胞外囊泡中促纤维化的igfbp7和adamts1产生,募集th17细胞,从而在nash中抑制肝脏再生和诱导纤维化。而通过靶向抑制小型猪和小鼠nash模型的hdac2和dnmt1,在一定程度上正常化肝脏内皮细胞的表观遗传变化、阻断igfbp7和adamts1的表达并抑制th17细胞的募集。
19.本发明技术方案通过使用hdac2抑制剂和dnmt1抑制剂以联合靶向hdac2和dnmt1,在一定程度上减轻nash肝脏的纤维化程度并促进肝再生:例如,在实施例4中的小型猪nash模型中,经hdac2抑制剂(例如,莫西司他(mocetinostat))和dnmt1抑制剂(例如,阿扎胞苷)联合治疗的小型猪与对照组相比:(i)其血糖、肝纤维化指数、血清肝功能指数、血清总胆固醇都显著降低;(ii)其肝硬化减少、胶原蛋白沉积和脂质积聚减轻且肝细胞增殖增加。并且在实施例5中,经hdac2抑制剂(例如,莫西司他(mocetinostat))和dnmt1抑制剂(例如,阿扎胞苷)联合处理的肝硬化小型猪,明显逆转了治疗组中nash引起的“窦内皮-大血管内皮失调”。
20.进一步地,本发明技术方案通过使用hdac2抑制剂和dnmt1抑制剂以联合靶向hdac2和dnmt1,治疗组nash肝脏中促纤维化th17细胞的募集显著减少:例如,在实施例6和实施例7中,经hdac2抑制剂(例如,莫西司他(mocetinostat))和dnmt1抑制剂(例如,阿扎胞苷)联合处理的肝硬化小型猪,治疗组的窦内皮细胞(secs)中igfbp7和adamts1的mrna和蛋白质水平的增加被有效阻断,且其血浆细胞外囊泡(evs)中igfbp7/adamts1的浓度的升高也被减少;并且,在实施例8和实施例9中,经hdac2抑制剂(例如,莫西司他(mocetinostat))
和dnmt1抑制剂(例如,阿扎胞苷)联合处理的肝硬化小型猪和小鼠nash模型中,治疗组th17细胞数的增加被有效阻断。
21.现有技术中,单一的药物治疗可能难以同时缓解或治疗非酒精性脂肪性肝炎和其伴有的肝硬化和肝纤维化。综上所述,本发明技术方案提供的hdac2和dnmt1抑制剂在治疗非酒精性脂肪性肝炎中的应用,有助于在一定程度上系统地缓解或治疗非酒精性脂肪性肝炎及其伴有的肝硬化和/或肝纤维化。
附图说明
22.图1为单细胞rna测序(scrna-seq)揭示人肝硬化肝脏中hdac2/dnmt1选择性诱导的“窦内皮-大血管内皮失调”的实验图;
23.图2为肝内皮细胞中hdac2和dnmt1的联合靶向抑制减轻小型猪nash模型中肝脏纤维化的实验图;
24.图3为小型猪nash模型中靶向抑制表观遗传失调的肝脏内皮细胞逆转“窦内皮-大血管内皮失调”、使内皮分类正常化并阻断肝硬化的实验图;
25.图4为人类患者和小型猪中表观遗传失调的肝脏内皮细胞发生旁分泌/血管分泌因子重编程的实验图;
26.图5为血浆细胞外囊泡(evs)中的旁分泌/血管分泌因子igfbp7和adamts1作为评估人类患者和小型猪nash模型中纤维化进展的生物标记物的实验图;
27.图6为人类患者和小型猪nash模型中失调的血管内皮微环境诱导促纤维化的th17应答的实验图;
28.图7为失调的肝脏窦内皮细胞(secs)中抑制hdac2/dnmt1减少小鼠nash模型的促纤维化的th17细胞的募集的实验图;
29.图8为igfbp7促进小鼠nash模型的肝脏纤维化和促纤维化的th17应答的实验图;
30.图9为adamts1的抑制减轻小鼠肝纤维化模型中促纤维化的th17细胞应答的实验图;
31.图10为单细胞rna测序(scrna-seq)分析2个健康人和2个肝硬化患者的肝脏非实质细胞(npcs)的实验图;
32.图11为scrna-seq分析来自gse136103数据的人肝脏npcs的实验图;
33.图12为人肝脏scrna-seq数据中内皮细胞(ecs)分析的实验图;
34.图13为人类肝脏、肝脏cd45
npcs和肝脏内皮细胞的基因表达分析的实验图;
35.图14为scrna-seq分析小型猪肝脏npcs的实验图;
36.图15为小型猪肝脏scrna-seq数据中内皮细胞(ecs)分析;
37.图16为肝硬化人类和小型猪肝脏的差异基因分析及旁分泌因子基因在肝脏npcs中的表达的实验图;
38.图17为人和小型猪肝脏的th17细胞分析的实验图。
具体实施方式
39.为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述。显然,所描述的实施例是
本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
40.需要说明的是,在本文中,术语“包括”、“包含”或者其任何其他变体意在涵盖非排他性的包含,从而使得包括一系列要素的过程、方法、物品或者装置不仅包括那些要素,而且还包括没有明确列出的其他要素,或者是还包括为这种过程、方法、物品或者装置所固有的要素。在没有更多限制的情况下,由语句“包括一个
……”
限定的要素,并不排除在包括该要素的过程、方法、物品或者装置中还存在另外的相同要素。
41.如在本说明书中使用的,术语“大约”,典型地表示为所述值的 /-5%,更典型的是所述值的 /-4%,更典型的是所述值的 /-3%,更典型的是所述值的 /-2%,甚至更典型的是所述值的 /-1%,甚至更典型的是所述值的 /-0.5%。
42.在本说明书中,某些实施方式可能以一种处于某个范围的格式公开。应该理解,这种“处于某个范围”的描述仅仅是为了方便和简洁,且不应该被解释为对所公开范围的僵化限制。因此,范围的描述应该被认为是已经具体地公开了所有可能的子范围以及在此范围内的独立数字值。例如,范围的描述应该被看作已经具体地公开了子范围如从1到3,从1到4,从1到5,从2到4,从2到6,从3到6等,以及此范围内的单独数字,例如1,2,3,4,5和6。无论该范围的广度如何,均适用以上规则。
43.名词解释
44.本发明所述的“交互调控”是指:肝脏纤维化同时受hdac2和dnmt1调控,单独抑制hdac2或dnmt1的一种,另一种(dnmt1或hdac2)发生向着促纤维化的方向变化(升高)。例如,在内皮细胞中抑制hdac2,dnmt1表达升高,抑制dnmt1,hdac2表达升高,肝脏纤维化受hdac2和dnmt1交互调控影响。
45.本发明所述的“血管微环境”是指:血管内皮细胞通过与周围细胞的相互作用,主动性调控周围细胞的功能和表型,从而形成引导性微环境。
46.本发明所述的“失调”是指:与正常肝脏相比,肝硬化肝脏中内皮细胞亚群的比例发生变化或基因表达发生变化。
47.本发明所述的“窦内皮-大血管内皮失调”或“窦内皮-大血管内皮分类异常”是指:与正常肝脏相比,肝硬化肝脏中窦内皮细胞数量减少,大血管内皮细胞数量增加,窦内皮细胞表达大血管内皮标记物(marker)的一种病理现象。
48.本发明所述的“表观遗传治疗”是指:用表观遗传抑制剂对肝硬化或纤维化小型猪及小鼠进行治疗,从而减轻肝脏纤维化。
49.附图详细说明
50.图1:(a)华西医院人类患者的肝脏非实质细胞(npcs)的scrna-seq的方法。(b,c)2个健康肝脏和2个肝硬化肝脏npcs的scrna-seq数据的聚类分析。(b)热图显示npcs的不同细胞系及其标记基因(右)。(c)umap图显示npcs的不同细胞系。endo(ec),内皮细胞;dc,树突状细胞;neu,中性粒细胞;mac,巨噬细胞;epcam
,epcam
细胞和胆管细胞。(d)饼图显示npcs不同细胞系的差异基因数(肝硬化肝脏vs.健康肝脏)。(e)2个健康肝脏和2个肝硬化肝脏的内皮细胞的聚类分析。左上:umap图显示内皮细胞的不同细胞系;左下:饼图显示内皮细胞的不同亚群的比例;右:内皮细胞的不同细胞系的标记基因表达。clce4g和oit3标记窦内皮细胞,cd34标记大血管内皮细胞。sec,窦内皮细胞;mec,大血管内皮细胞。(f)健康和肝
硬化的人肝脏内皮细胞的不同亚群的拟时分析。拟时分析显示,肝硬化的人肝脏发生“窦内皮-大血管内皮失调”。(g)健康和肝硬化的人肝脏的实质细胞(肝细胞)和非实质细胞(npcs)中组蛋白修饰的液相芯片分析。右:组蛋白h3和h4不同修饰位点的乙酰化的定量。hep,肝细胞;npcs,非实质细胞。n=3。(h)热图显示与组蛋白修饰和dna甲基化相关基因在健康和肝硬化的人肝脏的非实质细胞(npcs)的不同细胞系中的表达。上:与组蛋白修饰和dna甲基化相关的差异基因数。(i)组蛋白去乙酰化酶(hdacs)在人肝脏纤维化不同病理等级的表达(数据来自gse84044)。f0-f4,人肝脏纤维化的不同病理等级。f1-f4级肝脏的hdacs的表达水平相对于健康肝脏(f0)进行量化。(j)小提琴图显示hdacs在健康和肝硬化人的肝脏内皮细胞中的表达。(k)定量pcr(qpcr)显示hdac2在健康和肝硬化人的肝脏内皮细胞中的表达。n=3。(l)dna甲基化转移酶(dnmts)在人肝脏纤维化不同等级的表达(数据来自gse84044)。f0-f4,人肝纤维化不同病理等级。f1-f4级肝脏的dnmts的表达水平相对于健康肝脏(f0)进行量化。(m)小提琴图显示dnmts在健康和肝硬化人肝脏内皮细胞中的表达。(n)qpcr显示dnmt1在健康和肝硬化人肝脏的内皮细胞中的表达。n=3。(o)qpcr显示hdac2和dnmt1在健康和肝硬化人肝脏的secs中表达。n=3。(p)假说示意图:肝硬化肝脏的窦内皮细胞获得大血管内皮细胞的表型标记。肝脏内皮细胞表观遗传重编程促进“窦内皮-大血管内皮失调”,引起内皮细胞分类异常,并导致肝脏纤维化或肝硬化。在所有统计分析中,2组比较的数据通过双尾学生t检验(two-tailed student’st-test)进行分析;多于2组比较的数据通过单因素方差分析和随后的tukey事后检验(one-way anova followed by tukey’s post-hoc test)进行分析。数据用平均值
±
sem表示。*,肝硬化vs.健康或f1-f4 vs.f0;*,p《0.05;**,p《0.01;***,p《0.001;****,p《0.0001。
51.图2:(a)小型猪nash模型和治疗方案。小型猪nash模型由西方饮食(wd:高脂肪、高胆固醇、高蔗糖和果糖)和重复腹腔注射肝脏毒性的四氯化碳(ccl4)诱导。治疗组:通过wd ccl4持续诱导nash 5个月,在诱导2个月后开始进行表观遗传治疗,持续3个月。肝硬化组:用wd ccl4持续诱导小型猪5个月。(b)hdac2和dnmt1联合抑制治疗小型猪nash模型的给药方案。小型猪用hdac2抑制剂(hdac2i)和dnmt1抑制剂(hdac2i)处理。小型猪共分3组:1)对照组(正常饮食 玉米油);2)肝硬化组(模型组)(wd ccl4诱导nash)3)治疗组(hdac2i和dnmt1i治疗)。(c)对照组、肝硬化组和治疗组小型猪的血糖水平。glu,葡萄糖。n=3。(d)对照组、肝硬化组和治疗组小型猪的肝脏组织的肝纤维化指数。pc iii,iii型前胶原;iv-c,iv型胶原;ha,透明质酸;hyp,羟脯氨酸。n=3。(e)对照组、肝硬化组和治疗组小型猪血清的肝脏功能水平。alp,碱性磷酸酶;alt,谷丙转氨酶;ast,谷草转氨酶;tc,总胆固醇。n=3。(f)通过h&e、天狼星红、i型胶原、油红o和ki67染色评估小型猪的肝脏组织学、胶原和脂滴沉积以及细胞增殖情况。右:左图虚线区域的高倍放大图。比例尺,200μm。n=3。(g)图2f中天狼星红、油红o、胶原i和ki67染色的定量。阳性染色的比例相对于对照组进行量化。n=3。(h)qpcr显示对照组、肝硬化组和治疗组小型猪的肝脏窦内皮细胞(secs)和大血管内皮细胞(mecs)中hdac2和dnmt1的mrna表达水平。n=3。(i)小型猪nash模型中靶向促纤维化的表观遗传交互调控的示意图:在失调的肝脏内皮细胞中联合靶向抑制异常激活的hdac2和dnmt1减轻小型猪nash模型的肝脏纤维化并促进肝再生。所有数据均通过单因素方差分析和随后的tukey事后检验进行统计分析。数据用平均值
±
sem表示。*,肝硬化组vs对照组;#,治疗组vs肝硬化组;*,p《0.05;**,p《0.01。#,p《0.05;##,p《0.01。
52.图3:(a)小型猪nash模型中肝脏的非实质细胞(npcs)的单细胞测序的方法。(b,c)对照组、肝硬化组和治疗组小型猪肝脏的非实质细胞(npcs)聚类分析。(b)热图显示npcs的不同细胞系及其标记基因(右)。(c)umap图显示npcs的不同细胞系。endo(ec),内皮细胞;dc,树突状细胞;neu,中性粒细胞;mac,巨噬细胞;epcam
,epcam
细胞和胆管细胞。(d)饼图显示小型猪肝脏的非实质细胞(npcs)的不同细胞系的比例。(e)维恩图分别显示肝硬化组和对照组以及治疗组和肝硬化组之间小型猪肝脏的非实质细胞(npcs)的不同细胞系中的差异基因数。括号中的数字表示治疗后恢复的基因数。(f)小型猪肝脏内皮细胞的kegg通路富集分析。在肝硬化组与对照组小型猪肝脏内皮细胞之间有79条kegg通路显著改变,在治疗组与肝硬化组小型猪肝脏内皮细胞之间有99条kegg通路显著改变。通过hdac2i和dnmt2i的表观遗传治疗使肝硬化组小型猪肝脏内皮细胞中大部分改变的kegg通路正常化。白色数字表示校正p值的排序顺序。校正p值《0.05被认为具有统计学意义。(g)对照组、肝硬化组和治疗组小型猪肝脏内皮细胞的聚类分析。(h)饼图显示小型猪肝脏内皮细胞的不同亚群的比例。与对照组相比,肝硬化组小型猪肝脏中大血管内皮细胞(mecs)数量增加和窦内皮细胞(secs)数量减少,提示发生“窦内皮-大血管内皮失调”。(i)维恩图显示小型猪肝脏内皮细胞的不同亚群中的差异基因数。肝硬化组中肝脏窦内皮细胞(secs)的差异基因数相对最多,hdac2i dnmt1i治疗后大部分差异基因得以恢复。括号中的数字代表恢复的差异基因数。(j)对照组、肝硬化组和治疗组小型猪肝脏内皮细胞的不同亚群的拟时分析:hdac2i dnmt1i治疗后逆转了肝硬化小型猪肝脏中的“窦内皮-大血管内皮失调”。(k)肝硬化小型猪肝脏中靶向异常的hdac2/dnmt1逆转“窦内皮-大血管内皮失调”,增强再生,减轻纤维化。
53.图4:(a)肝硬化人肝脏内皮细胞的旁分泌/血管分泌因子基因差异性表达。热图显示ephrin/eph、notch、胰岛素生长因子相关蛋白、adam/adamts和semaphorin/plexin家族等代表性血管分泌因子。(b)纤维化不同等级的人肝脏中旁分泌/血管分泌因子基因表达(数据来源于gse84044)。f0-f4,人肝纤维化不同病理等级。f1-f4级肝脏的旁分泌/血管分泌因子基因的表达水平相对于健康肝脏(f0)进行量化。(c)小提琴图显示人和小型猪肝脏的非实质细胞(npcs)的不同细胞系中代表性旁分泌/血管分泌因子基因的表达。igfbp7和adamts1在人和小型猪的肝脏内皮细胞中高表达。(d)与“窦内皮-大血管内皮失调”相关的旁分泌/血管分泌因子重编程的示意图,该重编程包括内皮细胞中igfbp7和adamts1的诱导。(e)健康和肝硬化人肝脏中总内皮细胞、内皮细胞不同亚群和窦内皮细胞中igfbp7的表达水平。左:小提琴图显示肝脏总内皮细胞igfbp7的表达;中:小提琴图显示肝脏内皮细胞的不同亚群中igfbp7的表达;右:qpcr显示肝脏窦内皮细胞中igfbp7的表达,n=3。(f)健康和肝硬化人肝脏中总内皮细胞、内皮细胞不同亚群和窦内皮细胞中adamts1的表达水平。左:小提琴图显示肝脏总内皮细胞adamts1的表达;中:小提琴图显示肝脏内皮细胞的不同亚群中adamts1的表达;右:western blot显示肝脏窦内皮细胞中adamts1的表达,n=3。(g)对照组、肝硬化组和治疗组小型猪肝脏的总内皮细胞和内皮细胞不同亚群中igfbp7的表达。(h,i)qpcr(h)和elisa(i)显示对照组、肝硬化组和治疗组小型猪肝脏窦内皮细胞(secs)和大血管内皮细胞(mecs)中igfbp7的表达。n=3。(j)对照组、肝硬化组和治疗组小型猪肝脏的总内皮细胞和内皮细胞不同亚群中adamts1的表达。(k,l)qpcr(k)和elisa(l)显示对照组、肝硬化组和治疗组小型猪肝脏窦内皮细胞(secs)和大血管内皮细胞(mecs)中adamts1的表达。n=3。(m)atac-seq结果显示对照组、肝硬化组和治疗组小型猪肝脏内皮细
胞中igfbp7和adamts1启动子的染色质开放性:肝硬化组小型猪肝脏内皮细胞中hdac2/dnmt1依赖性地诱导igfbp7和adamts1。(n)人类患者和小型猪中表观遗传重编程的肝脏窦内皮细胞产生促纤维化igfbp7和adamts1的示意图。在所有统计分析中,2组比较的数据通过双尾学生t检验进行分析;多于2组比较的数据通过单因素方差分析和随后的tukey事后检验进行分析。数据用平均值
±
sem表示。*,肝硬化vs对照(小型猪)/健康(人类),或者f1-f4 vs.f0;#,治疗组vs.肝硬化组(小型猪)。*,p《0.05;**,p《0.01;***,p《0.001。#,p《0.05;##,p《0.01。
54.图5:(a)健康和肝硬化/肝纤维化患者的igfbp7、adamts1、alt、ast血浆浓度。(b,c)肝脏功能正常或异常的肝硬化/肝纤维化患者igfbp7和adamts1血浆浓度。肝硬化/肝纤维化患者分为两组(b):alt/ast浓度正常和alt/ast浓度异常。(d)健康和不同诱因的肝硬化/纤维化患者igfbp7和adamts血浆浓度。肝硬化/肝纤维化患者根据病因分为五类:非酒精性脂肪性肝炎相关的肝硬化/肝纤维化(nash)、乙型肝炎相关的肝硬化/肝纤维化(hbc)、自身免疫性肝炎相关的肝硬化/肝纤维化(aih)、原发性胆汁性肝硬化/肝纤维化(pbc)和隐源性肝硬化/肝纤维化(cc)。(e)健康和不同病理等级的nash患者的alt和ast血浆浓度。(f)健康、单纯性脂肪肝和不同病理等级的nash患者的igfbp7和adamts1血浆浓度。(g)人血浆分离出细胞外囊泡(evs)。上:分离出的evs的电子显微镜分析;下:western blot检测evs的阳性(cd81)和阴性(grp94)标记物。(h)小型猪和人的血浆细胞外囊泡(evs)的igfbp7/adamts1浓度。(i,j)正常或异常肝脏功能(alt/ast)的肝硬化患者(i)或不同纤维化等级nash患者(j)的evs的igfbp7/adamts1浓度。(k)假说示意图:表观遗传失调的肝脏窦内皮细胞(secs)产生促纤维化的igfbp7和adamts1,并通过细胞外囊泡(evs)促进肝硬化/纤维化。所有统计分析中,2组比较数据通过双尾学生t检验进行分析;多于2组比较数据通过单因素方差分析和随后的tukey事后检验进行分析。数据用平均值
±
sem表示。*,肝硬化、纤维化或nash vs.对照组(小型猪)或健康(人类);#,nash vs.单纯性脂肪肝(人类)或治疗组vs.肝硬化组(小型猪)。*,p《0.05;**,p《0.01;***,p《0.001。#,p《0.05。
55.图6:(a)基于人和小型猪肝脏(npcs)的不同细胞系的受体配体谱的细胞相互作用分析:肝硬化患者和小型猪的肝脏内皮细胞与t细胞相互作用显著。(b)western blot显示健康和肝硬化cd45
肝脏npcs中磷酸化的smad2的蛋白水平。磷酸化的smad2的水平相对于总smad2进行定量。结果显示肝硬化人肝脏的cd45
npcs中tgf-β1-smad2激活。上:蛋白表达的定量;下:代表性的蛋白条带。数据通过双尾学生t检验进行分析,并用平均值
±
sem表示。*,肝硬化vs.健康,p《0.05。n=4。(c)健康和肝硬化人类肝脏的cd4
t细胞的聚类分析。(d)th17
标记基因在健康和肝硬化人类肝脏的t细胞簇中的表达。(e)健康和肝硬化人类肝脏npcs中th17细胞的比例。肝硬化人类肝脏th17细胞的比例相对于健康人进行量化。(f,g)对照组、肝硬化组和治疗组小型猪肝脏的t细胞和cd4
t细胞的聚类分析。(h)th17
标记基因在小型猪肝脏cd4
t细胞簇(cluster)中的表达。(i)对照组、肝硬化组和治疗组小型猪肝脏npcs中th17细胞的比例。肝硬化组和治疗组小型猪th17细胞的比例相对于对照组进行量化。(j)热图显示肝硬化组和治疗组小型猪肝脏的th17细胞中纤维化相关差异基因的表达。(k)表观遗传失调的肝脏secs产生igfbp7和adamts1,以刺激人和小型猪的促纤维化的th17细胞应答。这种细胞互作可能依赖于循环系统中内皮来源的igfbp7/adamts1介导的tgfβ1-smad2信号增强。
56.图7:(a)hdac2内皮特异性敲除小鼠的nash模型及治疗示意图。通过内皮特异的cre小鼠与hdac2 flox小鼠杂交获得内皮特异性hdac2敲除的小鼠(hdac2
iδec
)。为了检测hdac2/dnmt1交互调控的联合靶向抑制的效果,hdac2
iδec
小鼠也用dnmt1抑制剂阿扎胞苷(aza)(hdac2
iδec
aza)处理。然后分析肝脏纤维化、肝脏功能和th17细胞的富集。(b)h&e、天狼星红和i型胶原染色分析对照组和hdac2
iδec
aza小鼠的肝脏组织病理学。hdac2
iδec
aza小鼠的肝脏纤维化与对照组(hdac2
/
)小鼠进行比较。右:天狼星红和i型胶原染色的定量。hdac2
iδec
aza小鼠的阳性染色的比例相对于对照组小鼠进行量化。比例尺,200μm。n=6。(c)小鼠的alt和ast血清浓度及肝脏羟脯氨酸(hyp)含量。n=6。(d)小鼠的肝脏secs的hdac2和dnmt1的蛋白水平。上:蛋白表达的定量;下:代表性的western blot图像。n=3。(e,f)小鼠肝脏切片的cd34(绿色)和结蛋白(红色)(e)或lyve1(红色)和cd34(绿色)(f)的共染色。f图中cd34阳性染色面积的比例相对于对照组进行量化。比例尺,20μm。n=5。(g)流式细胞分析小鼠的th17细胞数。小鼠nash模型中靶向抑制内皮细胞中的hdac2和dnmt1阻断了th17细胞应答。右:th17细胞的百分比。n=5。所有统计分析中,2组比较数据通过双尾学生t检验进行分析;多于2组比较数据通过单因素方差分析和随后的tukey事后检验进行分析。数据用平均值
±
sem表示。*,hdac2
iδec
或hdac2
iδec
aza vs.对照组或nash模型vs.野生型;#,hdac2
iδec
aza vs.nash模型(对照)。*,p《0.05;***,p《0.001。##,p《0.01。
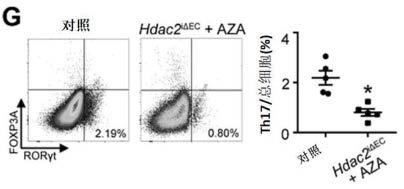
57.图8:(a)igfbp7在对照组及表观遗传治疗组(hdac2
iδec
aza)小鼠肝脏内皮细胞(ecs)中的表达。n=6。(b-e)igfbp7的基因敲除减轻小鼠nash模型中促纤维化的th17应答。(b)诱导igfbp7敲除(igfbp7-/-)小鼠nash模型的示意图。(c)通过h&e、天狼星红和i型胶原染色评估对照组和igfbp7-/-小鼠的肝脏组织病理学。右:天狼星红和i型胶原染色的定量。(d)血清alp和ast浓度及肝脏羟脯氨酸(hyp)含量。(e)流式细胞分析igfbp7-/-小鼠th17 细胞在肝脏中的百分比。n=6。(f)重组igfbp7蛋白诱导小鼠th17应答的示意图。c57bl/6j小鼠每周腹腔注射四氯化碳(ccl4)2次,共注射3周;从第2周开始,每2天尾静脉注射igfbp7重组蛋白1次。th17应答在用igfbp7和对照处理的小鼠之间比较。(g)流式细胞分析igfbp7蛋白诱导小鼠肝脏npcs的th17细胞数。右:th17细胞的百分比。n=4。在所有统计分析中,数据通过双尾学生t检验进行分析,用平均值
±
sem表示。*,hdac2
iδec
aza,igfbp7-/-或igfbp7 vs.对照组。*,p《0.05;**,p《0.01。
58.图9:(a)adamts1在nash及表观遗传治疗(hdac2
iδec
aza)小鼠肝脏窦内皮细胞(secs)中的表达。n=6。(b)western blot显示用adamts1 shrna(shadamts1)或对照shnc转导的人脐静脉内皮细胞(huvecs)中smad2的磷酸化(p-smad2)水平。n=3。(c)人内皮细胞来源的细胞外囊泡(ev)移植到小鼠的方法示意图。受体小鼠反复注射ccl4以诱导肝脏纤维化。用tgf-β处理shadamts1转导的huvec 2天。从shadamts1或shnc(对照)转导的huvecs培养基分离出evs,并分别移植到肝脏纤维化小鼠体内。纤维化的应答在移植shadamts1或shnc evs的受体小鼠之间比较。(d)注射ccl4并移植shadamts1或shnc evs后小鼠肝脏的天狼星红染色。n=5。(e)流式细胞分析evs移植后小鼠肝脏npcs中th17细胞数。右:th17细胞的百分比。n=5。(f)nash中“内皮hdac2/dnmt1-igfbp7/adamts1-th17”轴促进肝脏纤维化示意图。肝脏内皮细胞(ecs)的表观遗传重编程导致“窦内皮-大血管内皮失调”,促进在evs中促纤维化的igfbp7/adamts1的产生。来自表观遗传失调的secs的igfbp7/adamts1刺激促纤维化的th17细胞应答。在所有统计分析中,数据通过双尾学生t检验进行分析,用平均值
±
sem表示。*,shadamts1或hdac2
iδec
aza vs.对照组。*,p《0.05;**,p《0.01。
59.图10:(a)2个健康和2个肝硬化患者肝脏的22,374个肝脏非实质细胞(npcs)的聚类情况。左:总npcs;右:健康和肝硬化npcs。(b)umap图分别显示每个样本的肝脏npcs的聚类分析。(c)健康和肝硬化人类肝脏中不同npcs细胞系的比例。ec,内皮细胞;dc,树突状细胞;neu,中性粒细胞;mac,巨噬细胞;epcam
,epcam
细胞和胆管细胞。(d)2个健康和2个肝硬化患者的肝脏ecs的聚类分析。(e)健康和肝硬化ecs的不同亚群展示。
60.图11:(a)4个健康和3个肝硬化人类肝脏的42,314个npcs的聚类分析。流式分选cd45
和cd45-npcs,以用于scrna-seq分析。左:总npcs;右:健康和肝硬化npcs。(b)热图显示npcs聚类标记基因及其标记的细胞系(右)。(c)umap图显示npcs的不同细胞系。ec,内皮细胞;dc,树突状细胞;neu,中性粒细胞;mac,巨噬细胞;epcam
,epcam
细胞和胆管细胞。(d)4个健康和3个肝硬化人类肝脏ecs的聚类分析。(e)umap图显示ecs的不同亚群。左:总ecs;右:健康和肝硬化ecs。(f)umap图显示内皮细胞中选择的标记基因表达。(g)饼图显示ecs亚群的比例。(h)健康和肝硬化人类肝脏ecs的不同亚群的拟时分析。
61.图12:(a,b)热图显示内皮细胞和间充质细胞标记基因在人总npcs(a)和肝硬化患者npcs(b)的不同细胞系中的表达。(c)健康和肝硬化人类肝脏内皮细胞中间充质细胞分化的gsea富集分析。(d)肝硬化人类肝脏中可能存在“窦内皮-大血管内皮失调”的示意图。
62.图13:(a)gse84044数据中hdacs在人肝纤维化不同等级的表达。f0-f4,人肝脏纤维化的不同病理等级。f1-f4级肝脏hdacs的表达水平相对于健康肝脏(f0)进行量化。(b)qpcr显示hdac2和dnmt1在健康和肝硬化患者肝脏cd45
npcs中的表达。n=3。(c)western blot显示hdac2和dnmt1在培养的人脐静脉内皮细胞中的表达,利用shhdac2敲低hdac2上调了dnmt1的表达。上:蛋白表达的定量;下:代表性蛋白条带。数据采用双尾学生t检验进行统计分析,以平均值
±
sem表示;*,shhdac2 vs.对照组;*,p《0.05,**,p《0.01。n=3。
63.图14:(a)来自1个对照组、2个肝硬化组和2个治疗组小型猪肝脏的40,570个npcs的聚类分析。(b)小型猪肝脏ecs的go富集分析。hdac2i和dnmt2i的表观遗传治疗恢复了小型猪nash模型中肝脏ecs的大部分改变的功能。
64.图15:(a)1个对照组、2个肝硬化组和2个治疗组小型猪肝脏ecs的聚类分析;(b)ecs中选择的标记基因表达。(c)umap图显示对照组、硬化组和治疗组ecs的不同亚群。(d,e)热图显示与表观遗传变化(组蛋白修饰和dna甲基化)相关的基因在对照组、肝硬化组和治疗的小型猪肝脏npcs的不同细胞系(d)和ecs的不同亚群(e)的表达。(f)维恩图分别显示肝硬化组和对照组以及治疗组和肝硬化组之间小型猪肝脏npcs的不同细胞系或亚群(d和e)中差异基因的数量。红色数字代表恢复的基因数量。
65.图16:(a)维恩图显示人类和小型猪肝硬化肝脏的差异基因。括号中的数字表示治疗后小型猪中恢复的基因数。(b,c)小提琴图显示代表性旁分泌因子在人(b)和小型猪(c)肝脏的非实质细胞(npcs)的不同细胞系中的表达。(d)qpcr和elisa显示,对照组、肝硬化组和治疗组的小型猪肝脏cd45
npcs中igfbp7和adamts1的表达。左:qpcr;右:elisa。数据通过单因素方差分析和随后的tukey事后检验进行分析,并以平均值
±
sem表示。*,肝硬化vs.对照组,p<0.05。n=3。
66.图17:(a)2个健康和2个肝硬化人类肝脏中t细胞的聚类分析。(b)umap图显示人类t细胞的不同细胞系(cd8
和cd4
细胞)。(c-i)来自gse136103数据中人类cd45
细胞的
scrna-seq分析。(c)5个健康和5个肝硬化患者肝脏的35,806个cd45
细胞的聚类分析。(d)umap图显示npcs的不同细胞系。ec,内皮细胞;dc,树突状细胞;neu,中性粒细胞;mac,巨噬细胞;epcam
,epcam
细胞和胆管细胞。(e)umap图显示t细胞标记基因在cd45
细胞中的表达。(f)5个健康的和5个肝硬化人类肝脏中的t细胞的聚类分析。(g)umap图显示人类t细胞的不同细胞系(cd8
和cd4
细胞)。(f-g)为来源于gse136103的t细胞数据。(h)小提琴图显示th17
标记基因在t细胞不同群中的表达。(i)5个健康和5个肝硬化患者的cd45
细胞中th17细胞的比例。(h-i)为来源于gse136103的th17细胞数据。(j)umap图显示小型猪t细胞中t细胞的不同细胞系(cd8
和cd4
细胞)。
67.实施例一:材料和方法
68.1.患者和临床样本。患者的肝脏和血浆样品在知情同意下在四川大学华西医院收集。健康的肝组织(无纤维化)获取自接受内窥镜肝脏切除术的肝血管瘤患者。肝硬化肝组织获取自经组织学诊断为肝纤维化的患者。表1中显示了用于scrna-seq、液相芯片分析和基因表达分析的患者信息。血浆样本获取自健康志愿者(n=21)、单纯性脂肪肝(n=16)、早期非酒精性脂肪性肝炎(f0-f1)(n=12)和不同病理等级的肝硬化/纤维化患者(无癌症)(n=75)。通过纤维化-4指数(fib-4)和瞬态弹性成像(te)来确定非nash肝脏的纤维化等级,并使用nafld纤维化指数(nfs)、fib-4、te和受控衰减参数(cap)来确定nash肝脏的纤维化和脂肪变性等级。早期nash主要通过肝活检标本的组织学鉴定,其他一些标本也通过肝活检标本的组织学鉴定。表2显示了用于血浆分析的样本信息。四川大学华西医院医学伦理委员会批准了本发明的研究。对人体的研究符合《赫尔辛基宣言》的原则。
69.表1患者的基本信息表1患者的基本信息备注:tbil,总胆红素;dbil,直接胆红素;ibil,间接胆红素;ast,谷草转氨酶;alt,谷丙转氨酶;alp,碱性磷酸酶;ggt,谷氨酰转肽酶。f0或f4,人类肝纤维化的不同病理等级。健康和肝硬化肝脏的#1和#2用于scrna-seq,健康和肝硬化肝脏的#1、#2和#3用于液相芯片分析和基因表达分析。
70.表2血浆样本临床数据
biological technology co.,ltd)。小型猪饲养在成都达硕实验动物中心(dossy experimental animals center)的独立笼子里,喂食含2%胆固醇和30%脂肪(按重量计)的饮食,并补充果糖和葡萄糖。四川大学华西第二医院的实验动物伦理委员会和成都达硕生物科技有限公司批准了小型猪实验。
72.3.小鼠。c57bl/6j小鼠获取自南京大学模式动物研究所。c57bl/6j-hdac2
em1(flox)smoc
小鼠获取自上海南方模式生物科技股份有限公司。igfbp7-/-小鼠如前所述(参考文献94)。表达ec特异的cdh5-(pac)-cre
ert2
的小鼠由ralf h.adam提供(参考文献95)。将cdh5-(pac)-cre
ert2
小鼠与floxed hdac2小鼠杂交产生hdac2
iδec/iδec
小鼠(hdac2
iδec
)。hdac2
iδec
小鼠在出生后两个月,用他莫昔芬(250mg/kg)腹腔注射处理6次,每天1次(第3次给药后中断3天),诱导hdac2内皮特异性缺失。小鼠饲养在华西第二医院spf级实验动物中心中,并按标准的12小时明/暗周期喂食。动物实验方案经四川大学华西第二医院实验动物伦理委员会批准。
73.4.细胞系。从人脐带中分离人脐静脉内皮细胞(huvec)。huvec在endogro-vegf完全培养基(scme002,millipore)中,于37℃、5%co2的湿润环境中培养。hek293t获取自美国菌种保藏中心(atcc)。将hek293t在含10%胎牛血清(fbs)(1600044,gibco)的dmem(11965092,gibco)中,于37℃、5%co2的湿润环境中培养。
74.5.nash模型。小型猪nash模型:6月龄雄性小型猪喂养西方饮食(western diet,wd)即2%胆固醇、30%脂肪并补充高糖饮水:23.1g/l d-果糖和18.9g/l d-葡萄糖,腹腔注射剂量为0.1ml/kg的四氯化碳(ccl4),每周2次,连续注射5个月。对照组小型猪注射ccl4赋形剂(ccl
4 vehicle)(玉米油)。每15天收集血清样本1次,并且每月收集血浆样本1次。为了检测肝硬化的进展和相关的分子和细胞改变,每2个月手术活检1次,取下肝组织用于不同的分析。最后一次注射ccl4的2天后,处死全部小型猪并收集血清、血浆和肝脏样本。小鼠nash模型:8周龄小鼠(对照c57bl/6j、hdac2
iδec
及igfbp7-/-小鼠)喂养西方饮食即21.1%脂肪、41%蔗糖、1.25%胆固醇并补充高糖饮水:23.1g/l果糖和18.9g/l葡萄糖;腹腔注射剂量为0.5μl/g(0.8g/kg)的ccl4,每周1次,连续注射3个月。野生型对照小鼠喂养正常饮食并注射玉米油。最后一次注射ccl4的2天后,处死全部小鼠并收集血清和肝脏样本。
75.6.hdac2和dnmt1的联合靶向抑制。hdac2和dnmt1的联合靶向抑制小型猪nash模型的策略如图2b所示。小型猪在注射ccl4两个月后开始治疗:2周为1个治疗疗程,第一周进行dnmt1抑制剂阿扎胞苷(azacitidine,aza)治疗:前5天腹腔注射aza(剂量为0.1-2.0mg/kg/天,还可以为0.001-0.100mg/kg/天,优选为0.055mg/kg/天),每天1次,然后停药2天;第二周进行hadc2抑制剂mocetinostat(mgcd0103)治疗:前5天腹腔注射mgcd0103(剂量为1-20mg/kg/天,还可以为0.1-2.0mg/kg/天,优选为1.1mg/kg/天),每天1次,然后停药2天。重复治疗6个疗程(根据实际情况,可调整为5-10个疗程,实验数据未显示)。hdac2
iδec
小鼠治疗策略如图7a所示。hdac2
iδec
小鼠注射ccl4一个月后,腹腔注射aza,每两天1次,治疗两个月。
76.7.小型猪手术活检。小型猪经剖腹进行肝脏活检术。禁食一晚后,耳静脉注射50麻醉小型猪,所有手术均在全身麻醉下进行。开腹后,用钝性解剖技术取下一小块肝组织,肝切口止血后,设置引流管,缝合腹腔。术后小型猪静脉补充葡萄糖,手术后一天允许饮水和饮食。
77.8.肝细胞、npcs、cd45
npcs、ecs、secs和mecs的分离。人、小型猪和小鼠的肝组织用冷pbs洗涤两次,切碎,并在消化混合物(溶于pbs的1mg/ml i型胶原酶和1mg/ml ii型中性蛋白酶)中37℃孵育30分钟。30分钟后,将肝组织悬浮以确保完全分离。消化后的肝脏样本是均匀的最小限度的块。消化后的组织用细胞滤网过滤多次,并且细胞用300g离心5分钟收集。用rbc裂解液(r1010,solarbio)去除红细胞后,洗涤一次,通过另外的4℃、50g离心5min步骤,分离肝细胞和npcs。底部的肝细胞用于液相芯片分析和dna甲基化分析,上清中的npcs用于液相芯片、dna甲基化、磁珠分选和western blot。对于cd45
npcs、ecs(cd45-cd31
)、mecs(cd45-cd34
)和secs(cd45-cd34-cd31
)的分离,用1ml预冷的macs洗涤缓冲液(溶于dpbs的2mm edta、0.1%bsa、1%青霉素/链霉素)洗涤dynabeads磁珠3次,与cd45、cd34或cd31抗体在4℃下孵育4小时后,用macs洗涤缓冲液洗涤磁珠3次。将npcs重悬于300μl macs洗涤缓冲液中,并添加200μldynabeads-cd45抗体偶联物,然后在旋转器上4℃孵育45分钟。孵育后,用磁铁分离cd45
细胞结合的磁珠,并将上清液转移至含有dynabeads-cd31或-cd34抗体偶联物的管中。类似于cd45
细胞收集,将dynabeads-cd31或-cd34抗体偶联物与收集的上清液在旋转器上4℃孵育45分钟,并用磁铁分离cd31
cd45-细胞(ecs)或cd34
cd45-细胞(mecs)的磁珠。对于secs分离,首先使用dynabeads-cd45和-cd34抗体偶联物进行阴性分选,然后使用dynabeads-cd31抗体偶联物进行阳性分选。将具有cd45
、cd31
cd45-、cd34
cd45-或cd31
cd45-cd34-细胞的磁珠用冷的macs洗涤缓冲液洗涤5次,然后用于后续实验。小型猪npcs与percp-cy5.5-cd45、fitc-cd34和pe-cd31抗体孵育30分钟,通过流式细胞术分离的小型猪cd45
npcs、mecs(cd45-cd34
)和secs(cd45-cd34-cd31
)。洗涤后,通过facsaria
tm iii流式细胞仪(bd biosciences)分离cd45
细胞、mecs和secs。
78.9.流式细胞分析。分离出小鼠npcs,与bv421标记的大鼠抗小鼠的cd4抗体(bv421-rat anti-mouse cd4)(562891,bd biosciences)孵育30分钟。洗涤后,用bd cytofix/cytoperm溶液(554714,bd biosciences)固定并透膜30分钟,然后用fitc标记的大鼠抗foxp3(fitc-rat anti-foxp3)(11-5773-82,invitrogen)和pe标记的大鼠抗rorγt(pe-rat anti-rorγt)(12-6988-82,invitrogen)染色30分钟。细胞固定后,在facs calibur(bd biosciences)上进行流式细胞分析,并用flow jo v10进行分析。
79.10.样本收集和组织学分析。人、小型猪和小鼠的肝脏组织用4%多聚甲醛固定或oct包埋后切片。小型猪和小鼠的血清样本保存在-20℃,人和小型猪的血浆样本保存在-80℃。石蜡包埋的肝组织用苏木精-伊红(h&e)和天狼星红染色,oct包埋的肝组织用油红o染色。
80.11.免疫荧光分析。将oct包埋的肝组织切成6μm切片,用4%多聚甲醛固定5min后,用pbs冲洗,室温下用10%驴血清封闭30min。然后,用溶于pbs的0.3%triton x-100透膜20分钟,并分别与抗lyve1(70r-lr003,fitzgerad)、抗cd34(ab81289,abcam)、抗desmin(ab15200,abcam)、抗i型胶原(ab34710,abcam)或抗ki67(b15580,abcam)抗体4℃孵育过夜。清洗后,将切片与alexa fluor 488或alexa fluor 647标记的二抗(驴抗兔igg(711-605-152或711-545-152,jackson immunoresearch labs))孵育1小时。pbs洗涤切片,用4,6-二氨基-2-苯基吲哚(dapi)(c0065,solarbio)染核并安上盖玻片。图像由激光共聚焦显微镜(lsm880,zeiss)捕获并用zen(zeiss)处理。
81.12.天狼星红、油红o、i型胶原、ki67染色以及cd34-lyve1和cd34-desmin共染色的
半定量。用image-pro plus 6.0(media cybernetics,rockville,md)对天狼星红、油红o和i型胶原染色进行半定量分析。通过选定区域中的颜色深度和染色面积来评估阳性染色信号,以阳性染色信号与选定区域总面积之比计算天狼星红、油红o、和i型胶原染色的半定量。用photoshop cc 2018(adobe systems,ca)对ki67和cd34-lyve1染色进行半定量。分别通过与所选区域的总细胞数或阳性染色面积相比,计算出阳性细胞数(ki67)和染色阳性面积(cd34)的百分比。每组3个(小型猪)或5到6个(小鼠)样品用于定量,并从每个样品中选择3个视野用于定量。将3个视野的平均值用作每个样品的定量值。为了量化各个组之间的差异,将每组每个样本的值(阳性信号/阳性细胞数/阳性面积的百分比)与野生型或对照组的值进行量化。每组的结果用“对照的倍数或野生型的倍数”显示。
82.13.体外敲低hdac2、adamts1。将人类hdac2(shhdac2:5'-cagactgatatggctgttaat-3')或adamts1(shadamts1:5'-caaaaaccacaggaactggaagcataa-3')的shrna克隆到plko.1中,并转染到hek293t细胞中,生成携带sh-hdac2(即靶向hdac2的shrna)或sh-adamts1(即靶向adamts1的shrna)的慢病毒颗粒(也按照实验需求获得阴性对照)。huvecs用慢病毒颗粒转导,然后分别用嘌呤霉素(1μg/ml)选择48小时,然后用于后续实验。
83.14.血浆细胞外囊泡(evs)分离。通过超速离心分离血浆evs。将人和小型猪的血浆在4℃解冻,并在4℃850g离心30分钟,以去除死细胞和颗粒物。将上清液在4℃12,000g离心45分钟以除去细胞碎片。接下来,将上清液在4℃110,000g离心2小时。弃去上清液。收集含有evs的颗粒,将其重悬于冷的pbs中,通过0.22μm的过滤器过滤,并在4℃以110,000g离心2小时以除去污染的蛋白质。弃去上清液,并收集细胞外囊泡用于后续实验。huvec培养基上清evs的分离根据制造商的说明书用总外泌体分离试剂(从细胞培养基)(4478359,invitrogen)进行。收集的细胞培养基上清evs用于移植实验。
84.15.细胞外囊泡(ev)移植实验。ev移植实验如图9c所示。8周龄c57bl/6j小鼠喂食正常饮食,每周2次腹腔注射1ml/kg的ccl4,共1周,然后腹腔注射ccl4,尾静脉注射细胞外囊泡(10μg蛋白/小鼠,每剂量约10
10
个细胞外囊泡)每周2次,共2周。将小鼠随机分为两组,并通过尾静脉注射来自shnc感染的huvecs培养基(高adamts1)的evs,和来自shadamts1感染的huvecs培养基(低adamts1)的evs。最后一次注射ccl4和细胞外囊泡的两天后,处死所有小鼠,并收集肝脏样品。
85.16.重组igfbp7治疗实验。重组igfbp7蛋白处理实验如图8f所示。8周龄c57bl/6j小鼠喂食正常饮食,每周2次腹腔注射剂量为1ml/kg的ccl4,共1周,然后腹腔注射ccl4,并静脉注射外源重组小鼠igfbp7蛋白(20μg蛋白/小鼠)两天1次,共2周。最后一次注射igfbp7的两天后,处死所有小鼠,并收集肝脏样品。
86.17.实时定量pcr(qpcr)。使用rneasy mini kit(qiagen)提取人、小型猪和小鼠肝脏中的ecs、secs、mecs和cd45
npcs的总rna,并使用takara反转录试剂盒(takaraprimescript
tm rt master mix)(rr036a)进行反转录。使用brilliant iii ultra fast sybr green qpcr master mix试剂盒(agilent technologies)测量所有的基因表达。将所有样品重复三次,通过gapdh对数据归一化,并通过ddct方法进行分析,误差线表示标准误(standard error of mean,sem)。
87.18.elisa测定。将肝脏组织称重并匀浆,以2,000g离心20分钟,收集上清。参照iii
型前胶原(pc iii)、透明质(ha)和iv型胶原蛋白(iv-c)测定试剂盒的说明书,设置空白对照并制作标准曲线,经酶标试剂、显色液及终止液孵育后,450nm测od值。样本浓度根据标准曲线换算获得。人和小型猪血浆、细胞外囊泡、secs、mecs和cd45
npcs的igfbp7和adamts1水平按照相同方法测量。细胞外囊泡在分析前用超声波(40khz)处理3分钟。
88.19.羟脯氨酸分析。将小型猪和小鼠肝脏组织称重,用羟脯氨酸试剂盒(bc0255,solarbio)提取并测定羟脯氨酸,肝脏中羟脯氨酸水平根据所用的肝脏重量来测定。
89.20.血清和血浆分析。使用多参数分析仪(au 5400;olympus,日本)测量小型猪和小鼠血清及人血浆alt、ast、alp和总胆固醇水平。使用血糖仪(accu-chek performa,roche,德国)测量小型猪的血糖水平。
90.21.蛋白质印迹(wb)分析。用ripa裂解缓冲液(p0013b,beyotime biotechnology)并补充蛋白酶抑制剂和磷酸酶抑制剂,来提取人和小型猪的huvecs和evs及人肝脏cd45
npcs的总蛋白。一抗包括兔抗hdac2(57156,cell signaling technology)和抗dnmt1(5032,cell signaling technology),兔抗gapdh(gb11002,servicebio),兔抗cd81(bs-6954r,bioss)和抗grp94(bs-0194r,bioss)和兔抗smad2(5339,cell signaling technology)和抗phospho-smad2(18338,cell signaling technology)。过氧化物酶偶联的山羊抗兔二抗(gb23303)购买自武汉赛维尔生物科技有限公司。每个样本上样20μg蛋白。每组三个生物样本用于统计分析。通过nih image j(http://rsb.info.nih.gov/ij/download.html)对蛋白带的光密度进行定量。
91.22.组蛋白翻译后修饰(ptm)多重检测。从人类肝脏中分离肝细胞和npcs,使用epiquik总组蛋白提取试剂盒提取肝细胞和npcs中的组蛋白。用不同的位点特异性抗体分别进行组蛋白h3和h4翻译后修饰(post-translational modification,ptm)多重分析(表3)。首先,针对组蛋白ptm的捕获抗体共价偶联到磁珠上(表4),偶联珠与含有组蛋白ptm的样品反应后,连续洗涤以去除未结合的蛋白。添加生物素化的组蛋白h3或h4抗体形成夹层复合体(sandwich complex),最后添加作为荧光指示剂的链霉亲和素-藻红素(streptavidin-phycoerythrin,sa-pe)偶联物以形成最终的检测复合体。使用bio-plex 200液相芯片系统(171000207,bio-rad)检测不同的组蛋白ptms。不同的组蛋白h3和h4 ptms分别用总h3和h4进行归一化处理。ptm多重检测由杭州景杰生物科技有限公司进行。
92.表3 ptm多重检测的抗体信息
备注:1.ptm-1002和ptm-1004需要生物素处理。生物素化的h3抗体用作h3面板的检测抗体,生物素化的h4抗体用作h4面板的检测抗体。2.其他抗体与不同的磁珠偶联。
93.表4 ptm多重检测的磁珠信息
94.23.人和小型猪npcs的scrna-seq。从人和小型猪的肝脏中分离npcs,获得单细胞并重悬于pbs。通过chromium单细胞平台(10x genomics)进行scrna-seq。单细胞通过gem(gel bead-in-emulsion)的形成和barcode序列化、gem-rt(gel bead-in-emulsion
–
reverse transcription)清理和cdna扩增、文库构建等步骤,最后在illumina nova-seq 6000(illumina,美国)上进行测序。小型猪npcs的scrna-seq由广州基底奥生物科技有限公司进行,人npcs的scrna-seq由北京诺禾致源科技股份有限公司进行。
95.24.小型猪ecs的atac-seq。从小型猪肝脏中分离ecs(cd45-cd31
),分离细胞核,通过转位反应、pcr扩增和纯化、文库构建等步骤,最后使用illumina hiseqtm 4000进行测序。小型猪ecs的atac-seq由广州基底奥生物科技有限公司进行,数据经质量控制和参考序列比对后用于后续分析。
96.25.公共数据的再利用。肝硬化患者的肝脏活检样本的微阵列(microarray)数据(gse84044)和肝硬化患者npcs的scrna-seq数据(gse136103)来自geo数据库。微阵列数据中,纤维化f1-f4级的肝脏中hdacs、dnmts和igfbp7的表达水平相对于健康肝脏(f0)进行量化。scrna-seq数据中,cd45
和cd45-细胞(gsm4041150、gsm4041151、gsm4041153、
gsm4041154、gsm4041155、gsm4041156、gsm4041158、gsm4041159、gsm4041161、gsm4041162、gsm4041164、gsm4041165、gsm4041166和gsm4041167)用于分析ecs图谱;cd45
细胞(gsm4041150、gsm4041153、gsm4041155、gsm4041158、gsm4041160、gsm4041161、gsm4041164、gsm4041166、gsm4041168和gsm4041169)用于分析t细胞图谱。
97.26.生物信息学分析。scrna-seq数据预处理:利用hisat2 v2.0.5将人和小型猪肝脏npcs的scrna-seq的序列分别与人(homo sapiens)转录组(grch38.p13)和猪(sus scrofa)转录组(sscrofa11.1)进行比对。使用seurat r包v3.1.1分别对小型猪、来自华西医院的人的样本及gse136103数据进行无监督聚类和差异基因表达分析。细胞过滤:将表达少于200个基因的低质量细胞和表达少于3个细胞的基因过滤。通过设定不同的线粒体基因含量百分比阈值来过滤小型猪和人肝脏npcs。对于两种小型猪数据,线粒体基因含量》15%的细胞被过滤掉,而对于华西医院的人的样本数据,》10%的细胞被过滤掉。实验人员过滤掉了肝细胞标记物(alb、apoe、apob等)和间充质细胞标记物(col1a1、col3a1等)高表达的群。数据归一化:通过“normalizedata”函数中的“lognormalize”全局尺度归一化方法对数据进行归一化处理。样本整合:利用函数“findintegrationanchors”和“integratedata”合并数据并消除批次效应(batch effects)。维度1到20用于指定邻居搜索空间(neighbor search space)以查找整合锚点。通过函数“scaledata”进行标准化(scaled)和中心化(centered)。聚类和可视化:函数“runpca”用于主成分分析(principal component analysis,pca),主成分1-15用于函数“findneighbors”。用函数“findclusters”对细胞进行聚类(分辨率:0.77),并用umap方法可视化。umap图、小提琴图、热图和点图用seuratr包(ggplot2、pheatmap和grid)构建。实验人员采用数据库(http://biocc.hrbmu.edu.cn/cellmarker/index.jsp)中推荐的细胞系标记基因及已发表文章(参考文献35、36)中使用的标记基因来定义不同的细胞系。通过标记基因的表达定义了7种细胞系:t细胞(cd2
、klrb1
、ptprc
、cd3e
、trac
等)、b细胞(cd19
、cd22
、cd79b
、ms4a1
、mzb1
、igkc
等)、内皮细胞(pecam1
、clecc4g
、flt1
、oit3
、clecc4m
、cd34
等)、巨噬细胞(cd163
、vsig4
、cd68
、adgr1
、msr1
、c1qc
等)、中性粒细胞(s100a8
、s100a9
、cxcl8
、msrb1
等)、树突细胞(clec9a
、lgals2
、ido1
、clorf54
、clec4a
、cd83
、cd40
、cst3
、cd74
等)和epcam
细胞和胆管细胞(epcam
、krt7
、sox9
、cftr
、mmp7
、krt19
等)。内皮细胞被重新聚类和定义为窦内皮细胞(clec4g
、oit3
、clec4m
)、大血管内皮细胞(cd34
)和中间内皮细胞(clec4g-,cd34-)。t细胞重新聚类并定义为cd4
(cd4
)和cd8
(cd8a
)t细胞。通过检测cd4
t细胞中klrb1
、foxp3-、ccr6
、ccr4
、ahr
、il23r
、il17a
的表达来鉴定th17细胞。显示不同细胞系的标记基因表达的热图由这些细胞系标记基因的平均计数生成。使用wilcoxon rank sum检验鉴定了两组细胞之间的差异表达基因,差异基因同时满足在超过10%的细胞中表达以及两组细胞之间至少0.25的对数倍数变化。所有差异表达基因分析均具有相同的阈值。对于小型猪scrna-seq,1个对照组、2个肝硬化组和2个治疗组的小型猪肝脏npcs中共获得了40,570个细胞,展示了28个群体。对于华西医院人scrna-seq,2个健康和2个肝硬化的人肝脏npcs中共获得223,74个细胞,展示了25个群。通过细胞系标记基因来确认不同的细胞系。在小型猪和人的scrna-seq数据分析中,整合多组样本、聚类、鉴定不同细胞系和差异表达基因分析的方法是相似的。拟时分析:r包-monocle v2.12.0用于构建拟时分析。将标记为内皮细胞的细胞及其亚群的信息输入并构建monocle对象。表达矩阵中的所有数值均进行
对数变换。利用函数“differential genetest”分析不同组间的差异表达基因(有不同的q值,小型猪《0.045,华西医院人《1e-12)。“ddrtree”用于减少维度(max_components=2)。细胞受体配体互作分析:scrna-seq结果上传到cell phone db的网站上进行细胞受体配体互作分析。
98.27.定量与统计分析:所有计算或分析均通过prism 8软件包(graphpad)或r进行。实验数据通过双尾学生t检验(2组比较)和单因素方差分析(anova)及tukey事后检验(2组以上比较)进行统计分析。所有数据均以平均值
±
sem表示。p《0.05被认为统计学显著,所有误差线代表sem。在体内实验中,“n”值表示每组生物样本重复数。*,肝硬化/nash组vs.健康/对照组;#,治疗组vs.肝硬化/nash组或肝硬化/nash组vs.单纯性脂肪肝组。*或#,p《0.05;**或##,p《0.01;***或###,p《0.001;****,p<0.0001。
99.实施例二:scrna-seq揭示人肝硬化肝脏中血管失调和内皮分类异常
100.从新鲜的正常和硬化的人肝脏中分离npcs,并进行scrna-seq(10xgenomics)(图1a,表s1)。健康的肝脏组织(无纤维化)获得自华西医院的肝血管瘤患者,肝硬化肝脏组织获得自经组织学诊断为肝硬化的患者。2个健康肝脏和2个肝硬化肝脏的22,374个npcs聚类成25个群(图10a-b)。通过标记基因的表达定义了7种细胞系:t细胞、b细胞、内皮细胞(ec)、巨噬细胞(mac)、中性粒细胞(neu)、树突状细胞(dc)以及epcam
细胞和胆管细胞(epcam
)(图1b-c)。本发明实验人员发现,在检验的所有细胞类型中,ecs的差异基因最多(图1d)。与健康肝脏相比,肝硬化肝脏ecs的比例显著增加(图10c)。
101.本发明实验人员的前研究表明,血管内皮细胞能够形成血管微环境,通过旁分泌/血管分泌因子调控肝脏再生和纤维化(参考文献28)。因此,本发明进一步分析了人肝脏中的ecs亚群。人肝脏ecs聚类成12个群(图10d),由标记基因clec4g、oit3和cd34定义为窦内皮细胞(sec)和大血管内皮(mec)(图1e,图10e)。mec的数量显著增加,sec的数量显著减少,这意味着肝硬化肝脏中发生一种从sec到mec的失调(图1e-f)。为了验证这种“窦内皮-大血管内皮分类异常”,实验人员还分析了人肝脏数据库gse136103的数据。4个健康肝脏和3个肝硬化肝脏的42,314个npc聚类成28个群(图11a),定义了7个细胞系(图11b-c)。肝脏ecs进一步聚类,并定义为成sec和mec(图11d-f)。gse136103数据也显示肝硬化肝脏中mecs显著增加、secs显著减少(图11g),并存在“窦内皮-大血管内皮失调”(图11h)。实验人员发现,在总ecs和肝硬化ecs中,间充质细胞标记基因的表达较低,并且在肝脏ecs的所检验的类型中,“间充质细胞分化”富集程度相对较低(图12a-c)。这些数据表明,在纤维化的肝脏中,肝脏secs可能发生血管失调(图12d)。
102.实施例三:肝脏ecs表观遗传重编程诱导促纤维化的“窦内皮-大血管内皮失调”103.表观遗传调控(组蛋白修饰和dna甲基化)在肝纤维化进程中起重要作用。然而,组蛋白修饰和dna甲基化在人肝脏硬化/纤维化的npcs不同细胞系的功能性作用尚不明确。为此,实验人员首先确定了健康肝脏和肝硬化肝脏中实质细胞和npcs的组蛋白修饰,组蛋白h3和h4修饰的液相芯片分析显示,与健康肝脏相比,人肝硬化肝脏中npcs的组蛋白乙酰化显著降低,而实质细胞(肝细胞)没有明显差异(图1g),这表明人肝硬化肝脏中的npcs发生表观遗传重编程。
104.实验人员进一步研究了健康和肝硬化的人肝脏中不同npcs亚群的表观遗传变化。通过基因组富集分析(gsea)和string数据库筛选了1,239个与组蛋白修饰和dna甲基化相
关的基因,其中1,008个在本发明的人肝脏的scrna-seq数据中发现。与正常组相比,在检验的的7个npcs细胞系中,血管ecs中组蛋白修饰和dna甲基化相关基因变化最多(图1h)。这些发现提示,内皮细胞的表观遗传改变可能通过刺激血管微环境功能的失调来促进纤维化。
105.组蛋白乙酰化受组蛋白去乙酰化酶(hdacs)调控。为了确定哪些hdac(s)在肝硬化肝脏的组蛋白修饰中起重要作用,实验人员分别分析了所有hdacs在纤维化肝脏和内皮细胞中的表达。人纤维化肝脏被分为不同的病理等级,f0-f4级,f4级为最严重的纤维化阶段。在所有hdacs中,hdac2的表达在f2-f4级患者的肝脏中的持续增加(图1i,图13a,数据来自gse84044)。此外,与健康人肝脏相比,人肝硬化肝脏的内皮细胞中hdac2表达上调(图1j)。定量pcr(qpcr)显示,虽然hdac2和dnmt1也在其他细胞类型(cd45
npcs)中表达,但在健康组和肝硬化组之间,肝脏内皮细胞(cd45-cd31
)中hdac2的表达有显著差异(图1k,图13b)。
106.dna甲基化是另一种常见的表观遗传修饰形式,通常与组蛋白修饰协同作用。因此,实验人员评估了dna甲基转移酶(dnmts)在人纤维化肝脏中的表达。发现dnmt1在f2-f4级患者的纤维化肝脏中变化相对最显著(图1l,来自gse84044的数据),并且相对于人类健康肝脏,dnmt1在人类肝硬化肝脏ecs中的表达显著增强。
107.在分离出的人肝硬化肝脏cd45-cd34-cd31
secs中,与健康人肝脏相比,hdac2和dnmt1表达水平显著上调(图1o)。在人脐静脉内皮细胞(huvecs)中,通过shrna(shhdac2)敲低hdac2可以上调dnmt1的表达(图13c)。这些数据表明,肝脏ecs中hdac2和dnmt1的异常激活可能导致“窦内皮-大血管内皮失调”,从而促进肝纤维化和肝硬化。
108.实施例四:联合靶向抑制hdac2和dnmt1减轻小型猪nash模型的肝脏纤维化
109.小型猪生理学特点与人类相似,能够较好的模拟人的代谢紊乱。因此,实验人员构造了一种小型猪nash模型,以探讨血管失调对肝硬化和相关机制的作用。文献报道的研究表明(参考文献66),西方饮食(高脂肪、高胆固醇、高果糖和蔗糖饮食)和化学药品(ccl4)损伤会诱导快速的纤维化发展的小鼠nash。因此,实验人员采用所述西方饮食(wd)结合重复的ccl4注射来诱导小型猪nash模型。为了描述内皮来源的hdac2/dnmt1在所述小型猪nash模型中的病理学作用,实验人员还用hdac2抑制剂(hdac2i)和dnmt1抑制剂(dnmt1i)处理了小型猪(图2a-b)。与对照组相比,肝硬化组小型猪的血糖水平更高(图2c),而且肝硬化组的肝纤维化指数和血清肝功能指数升高,这与人类nash病理学类似(图2d-e)。与肝硬化小型猪组相比,hdac2i dnmt1i联合治疗降低了血糖、肝纤维化指数和血清肝功能指数(图2c-e)。另外,肝硬化组血清总胆固醇升高,而治疗后降低(图2e)。因此,在小型猪nash模型中,ecs中hdac2和dnmt1的异常诱导导致肝纤维化和肝功能损伤。
110.接下来,实验人员通过h&e、天狼星红、i型胶原、油红o和ki67染色评估了对照组、肝硬化组和治疗组的小型猪肝脏的组织病理学、胶原蛋白沉积、脂质滴沉积和细胞增殖(图2f-g)。与显示出正常的组织学特点的对照组相比,肝硬化动物的肝脏表现出独特的假小叶表型。wd ccl4诱导了肝硬化小型猪组的晚期肝硬化、胶原沉积和脂质沉积。hdac2i dnmt1i联合治疗改善了组织病理学表型,减少了肝硬化,并减轻了胶原蛋白沉积和脂质积聚。ki67染色证明,hdac2i dnmt1i治疗也增加了肝细胞增殖。
111.然后实验人员通过流式细胞术分离小型猪secs(cd45-cd34-cd31
)、mecs(cd45-cd34
cd31
)和其他cd45
npcs。cd45
npcs中hdac2和dnmt1的表达在不同组间无显著差异。与对照组相比,肝硬化小型猪肝脏的secs和mecs中hdac2和dnmt1的表达显著上调。hdac2i
dnmt1i治疗阻断了肝硬化小型猪肝脏secs和mecs中hdac2和dnmt1表达的上调(图2h)。hdac2i和dnmt1i对小型猪nash模型的治疗效果意味着hdac2/dnmt1的异常诱导在nash中起致病作用(图2i)。
112.实施例五:小型猪nash模型中联合表观遗传靶向抑制使失调的肝脏内皮分类正常
113.实验人员接下来分析了小型猪中hdac2/dnmt1的异常诱导是否导致在人类肝硬化肝脏中发现的“窦内皮-大血管内皮失调”(图1p)。分离出小型猪(正常组、硬化组及治疗组)肝脏npcs,并进行scrna-seq,在单细胞水平上分析小型猪nash模型(图3a)。1个对照组、2个肝硬化组和2个治疗组的40,570个npcs聚类成28个群(图14a)。与人类scrna-seq类似,通过标记基因的表达鉴定了7个细胞系,包括t细胞、b细胞、ec、mac、neu、dc和epcam
细胞(图3b-c)。实验人员还发现,与健康肝脏相比,小型猪肝硬化肝脏中ecs的比例(9.70%对5.90%)明显增加,而这种增加的ecs的比例通过hdac2i dnmt1i的治疗而被明显降低(4.55%对9.70%)(图3d)。为了揭示hdac2/dnmt1在不同npcs细胞系中的影响,实验人员分别对肝硬化组和对照组(肝硬化vs.对照)以及治疗组和肝硬化组(治疗vs.肝硬化)的7个细胞系中的基因差异情况进行了比较。肝硬化小型猪组的血管内皮细胞的基因差异程度在所有检测的细胞类型中最大,其中大部分在hdac2i dnmt1i治疗后得以恢复(图3e)。go和通路富集显示,参与分子功能(molecular function)、生物过程(biological process)和细胞组成(cellular component)的信号传导发生了显著变化(图14b),以及th17细胞分化、非酒精性脂肪肝、趋化因子、tnf、hif-1、mapk、pi3k-akt等kegg信号通路也发生了显著变化(图3f)。此外,hdac2i和dnmt2i的表观遗传治疗恢复了nash组的肝脏ecs的大部分上述go及kegg变化,表明治疗后的小型猪ecs的正常化(图3f,图14b)。
114.在小型猪nash模型中,在ecs的表观遗传变化的独特影响使实验人员探索了hdac2/dnmt1活性与肝纤维化中“窦内皮-大血管内皮分类异常”之间的联系。小型猪ecs聚类成15个群(图15),通过基因标记鉴定为sec和mec(图3g,图15b-c)。与人肝硬化肝脏的所述血管失调相似,与对照组小型猪肝脏相比,肝硬化小型猪肝脏的mec比例增加而sec比例减少。在治疗后的小型猪肝脏中,hdac2i dnmt1i治疗后明显逆转了nash引起的“窦内皮-大血管内皮失调”(图3h)。
115.在ec亚群中,secs的差异基因数量相对最多(硬化组vs.对照组),hdac2i dnmt1i治疗后大部分差异基因得以恢复(治疗组vs.硬化组)(图3i)。肝脏ec亚群拟时分析也表明肝硬化小型猪肝脏存在“窦内皮-大血管内皮失调”,hdac2i dnmt1i治疗使其正常化(图3j)。实验人员还发现在肝硬化小型猪中,secs中组蛋白修饰和dna甲基化相关基因变化相对最多,hdac2i dnmt1i治疗后,大多数基因得以恢复(图15d-f)。因此,小型猪nash模型的数据表明,异常的表观遗传改变会刺激“窦内皮-大血管内皮失调”、内皮分类异常,并增加肝脏纤维化(图3k)。
116.实施例六:人类患者和小型猪nash模型中表观遗传失调的secs发生旁分泌/血管分泌因子重编程
117.ecs可以通过旁分泌/血管分泌因子与周围细胞相互作用来调节肝脏再生。为了解析表观遗传失调的肝脏ecs促纤维化的机制,实验人员在单细胞水平上分析了肝硬化人和小型猪ecs中差异基因(图16a),并观察到与“窦内皮-大血管内皮失调”相关的血管分泌因子重编程(图4a-d)。与健康ecs比较,肝硬化人肝脏ecs中金属肽酶adamts1、胰岛素样生长
因子结合蛋白7(igfbp7)、dll1、adamts6均发生明显变化(图4a)。利用人类公共数据库分析了这些血管分泌因子与人纤维化进展的关系。在f2-f4级患者的纤维化肝脏中,igfbp7和adamts1的表达逐渐升高(图4b)。实验人员发现,在血管分泌因子基因中,igfbp7和adamts1在人和小型猪ecs中的特异性表达在相对最高水平(图4c,图16b-c)。此外,与健康ecs相比,igfbp7和adamts1在人肝硬化肝脏ecs中选择性上调,并且肝硬化secs中的igfbp7和adamts1的mrna及蛋白水平显著升高(图4e-f)。这些结果提示在失调的人肝脏ecs中发生血管分泌因子表观遗传重编程,并且igfbp7和admats1的内皮生成可能促进肝纤维化和肝硬化。
118.在小型猪nash模型中,肝硬化的secs和mecs中igfbp7和adamts1的mrna水平明显升高,而igfbp7和adamts1的蛋白水平仅在肝硬化的secs中上调。此外,hdac2i和dnmt1i的治疗阻断了肝硬化小型猪肝脏secs中igfbp7和adamts1的mrna和蛋白水平的增加(图4g-l,图16d)。分析染色质开放性有助于揭示基因表达的表观遗传调控,因此实验人员用对照组、肝硬化组和治疗组的小型猪肝脏ecs进行染色质开放性检测(atac-seq)。与对照组ecs相比,肝硬化ecs中igfbp7和adamts1启动子的染色质开放性明显增强,并且hdac2i dnmt1i治疗后其染色质开放性明显逆转(图4m)。因此,igfbp7和adamts1上调可能在肝硬化肝脏中区分正常的secs和失调的secs,而表观遗传靶向促纤维化的igfbp7
adamts1
失调的ec亚群的表观遗传治疗可能阻断肝纤维化(图4n)。
119.实施例七:来自失调的secs的igfbp7和adamts1预测人和小型猪的肝纤维化的进展
120.为了确定循环igfbp7和adamts1在人肝硬化/肝纤维化或nash中的临床价值,实验人员评估了人类患者血浆中igfbp7和adamts1的浓度(表s2)。肝硬化/肝纤维化患者的igfbp7、adamts1、谷丙转氨酶(alt)和谷草转氨酶(ast)的血浆浓度明显高于健康人样本(图5a)。由于一些肝硬化/肝纤维化患者可以有正常的血浆alt或ast水平,因此需要发现敏感的生物标记物在临床上诊断肝脏肝硬化/肝纤维化。因此,实验人员评估了血浆igfbp7和adamts1作为临床生物标记物的价值。根据肝硬化/肝纤维化患者的血浆肝功能指数,把他们分为两组:正常血浆alt和ast浓度组和异常血浆alt和ast浓度组(图5b)。比较肝功能正常和异常的肝硬化/肝纤维化患者igfbp7和adamts1的血浆浓度。重要的是,alt或ast正常的肝硬化/肝纤维化患者的igfbp7和adamts1血浆浓度明显高于健康人(图5c)。肝硬化/肝纤维化队列包括非酒精性脂肪性肝炎相关的肝硬化/肝纤维化(nash),乙型肝炎相关性肝硬化/肝纤维化(hbc),自身免疫性肝炎相关性肝硬化/肝纤维化(aih),原发性胆汁性肝硬化/肝纤维化(pbc)和隐源性肝硬化/肝纤维化(cc)。与健康人相比,所有这些患者的血浆igfbp7和adamts1水平均观察到升高(图5d)。因此,在没有肝功能障碍的情况下,血管分泌的igfbp7和adamts1可能作为用于诊断肝硬化/肝纤维化的生物标记物。
121.接下来,实验人员评估了血浆igfbp7和adamts1是否可以用作诊断标记物,以预测nash的严重程度或区分nash与单纯性脂肪肝(表现为单纯性脂肪变性)。根据肝纤维化阶段将nash患者分为不同的组。早期阶段nash(f0-f1)患者的血浆alt或ast浓度没有明显增加(图5e)。相比之下,nash患者血浆igfbp7和adamts1浓度显著升高(图5f)。此外,单纯性脂肪肝患者的血浆igfbp7和adamts1浓度在统计学上没有升高,这表明血浆igfbp7/adamts1浓度在区分nash和单纯性脂肪肝中有重要的临床价值(图5f)。
122.igfbp7/adamts1与nash进展的相关性提出了一种可能性,即失调的secs的促纤维化作用取决于血管分泌的igfbp7和adamts1。然后实验人员评估了表观遗传失调的secs释放igfbp7或adamts1以有助于nash的假说。细胞外囊泡(evs)是细胞释放的独特的脂质双层颗粒。包装在evs中的分子可能在许多生物过程中促进细胞通讯。因此,实验人员分析了内皮细胞产生的igfbp7和adamts1是否在evs中组装并释放到循环中。为此,通过超速离心法从人和小型猪血浆中提取evs,并通过电子显微镜和免疫印迹分析对其进行验证(图5g)。肝硬化组小型猪和人evs中的igfbp7和adamts1的浓度高于对照组。在小型猪nash模型中,hdac2i dnmt1i治疗可降低肝硬化组ev igfbp7/adamts1的浓度的升高(图5h)。alt/ast正常的肝硬化/肝纤维化患者或nash患者evs中的igfbp7/adamts1浓度也比健康人类明显升高(图5i-j)。本发明的数据表明evs中的igfbp7和adamts1是评估在肝功能障碍之前的nash进展的有用的生物标记物(图5k)。
123.实施例八:肝硬化患者和小型猪nash模型中igfbp7
adamts1
失调的secs诱导促纤维化的th17细胞应答
124.失调的ecs可以通过形成失调的血管微环境与相邻细胞相互作用以促进纤维化。本发明试图揭示igfbp7
adamts1
失调的secs通过细胞通讯增强肝纤维化的细胞机制。基于cellphonedb数据库分析了不同npcs细胞系的受体和配体表达谱。细胞相互作用预测表明,在肝硬化患者和nash小型猪中,失调的ec与t细胞的相互作用明显(图6a)。值得注意的是,尽管在人类数据中预测的相互作用是在ecs和巨噬细胞之间互作明显,但在小型猪npcs中ec-巨噬细胞的相互作用较少。由于t细胞是相对最丰富的肝脏npcs类型,因此本发明主要分析ecs和t细胞之间的相互作用。
125.已有的研究表明,在igfbp7、adamts1和转化生长因子-β1(tgf-β1)之间存在协同(synergistic)或补充(complementary)作用(参考文献77、78),该作用可以募集th17细胞,其是参与nash和肝纤维化进展(参考文献80、81)的一个cd4
t亚群(参考文献79)。由于smad2是tgf-β1诱导th17细胞中重要的下游因子,因此实验人员分析了人肝脏cd45
npcs中smad2的磷酸化。与健康npcs相比,肝硬化人类cd45
npcs中smad2磷酸化水平显著升高(图6b)。接下来实验人员分析了募集的人类和小型猪t细胞的细胞系。2个肝硬化和2个健康肝脏的人类t细胞聚类并鉴定成20个群(图17a),定义为cd4
和cd8
t细胞(图17b)。cd4
t细胞进一步聚类(图6c),th17细胞被th17
标记基因标记出(图6d)。肝硬化患者肝脏中th17细胞的细胞数明显高于健康肝脏(图6e)。为了验证人类患者的结果,实验人员分析了gse136103数据中的th17细胞(图17c-i)。与健康人类肝脏相比,肝硬化人类肝脏中的th17细胞数量也类似地明显增加。这些数据暗示了th17细胞在人类肝硬化中的促纤维化作用。
126.接下来实验人员探讨了小型猪nash模型中肝ecs和th17亚群之间的细胞互作。与人类t细胞相似,对照组、肝硬化组和治疗组的小型猪肝脏的t细胞聚类鉴定16个群,定义为cd4
t细胞和cd8
t细胞(图6f,图17j)。cd4
t细胞中,th17细胞被th17
标记基因鉴定出(图6g-h)。与对照组小型猪相对,在硬化小型猪肝脏中th17细胞数也明显增加。此外,hdac2i dnmt1i的联合治疗阻断了在损伤的小型猪肝脏中th17细胞数的增加(图6i)。实验人员还发现,与肝硬化小型猪相比,治疗组小型猪的th17细胞中纤维化相关基因的表达显著降低(图6j)。根据本发明的数据,提出假说即表观遗传失调的secs可能募集并激活人和小型猪肝脏中促纤维化的th17细胞,其可能由分泌的igfbp7/adamts1介导(图6k)。
127.实施例九:小鼠nash模型中表观遗传失调的secs产生促纤维化的th17应答
128.为了确定ecs中hdac2/dnmt1-igfbp7/adamts1轴对th17细胞应答和肝纤维化的功能上的作用,实验人员生成了hdac2
iδec
小鼠(选择性敲除ecs中hdac2),并通过wd ccl4诱导生成小鼠nash模型。通过用dnmt1抑制剂aza处理hdac2
iδec
小鼠(hdac2
iδec
aza)获得联合靶向抑制hdac2 dnmt1的效果(图7a)。dnmt1i治疗后的hdac2
iδec
小鼠,与对照组损伤小鼠相比,肝纤维化、炎症、胶原沉积以及肝纤维和肝功能的指数显著降低(图7b-c)。为了进一步研究小鼠肝secs中内皮来源的hdac2与dnmt1之间的交互调控,实验人员通过免疫磁珠(dynabeads)分离出对照组、hdac2
iδec
和hdac2
iδec
aza小鼠的肝secs(cd45-cd34-cd31
)。western blot显示,敲除小鼠肝脏secs中的hdac2上调了secs中dnmt1的表达(图7d)。值得注意的是,在这种小鼠nash模型中,发现cd34在一些窦内皮细胞中表达,并且治疗组中靶向抑制内皮来源的hdac2和dnmt1降低了cd34的表达(图7e-f)。这一染色结果提示,在这种小鼠nash模型中存在“窦内皮-大血管内皮失调”。流式分析显示,治疗组小鼠肝脏中靶向抑制内皮来源的hdac2和dnmt1减少了th17细胞数(图7g)。因此,在小鼠nash模型中,表观遗传失调的肝脏ecs可能激活促纤维化的th17应答。
129.实施例十:小鼠nash模型中igfbp7增强促纤维化的th17应答
130.qpcr显示联合靶向抑制内皮来源的hdac2和dnmt1降低了纤维化肝脏ecs中igfbp7的表达(图8a)。为了确定肝纤维化中igfbp7在刺激th17应答中的作用,实验人员分析了igfbp7敲除(igfbp7-/-)小鼠的nash表型(图8b)。小鼠中igfbp7的基因敲除明显减轻了肝纤维化反应即胶原沉积(图8c)、血清肝功指数、肝脏羟脯氨酸含量(图8d)和th17应答(图8e)。为了进一步研究igfbp7是否直接影响th17生物学,将c57bl/6j小鼠尾静脉注射重组小鼠igfbp7蛋白(图8f)。与对照组相比,升高的igfbp7水平显著增强了损伤的小鼠肝脏的促纤维化的th17应答(图8g)。这些结果表明,igfbp7是增强th17应答以促进肝脏纤维化的调节因子。
131.实施例十一:小鼠纤维化模型中adamts1的遗传失活减轻促纤维化的th17应答
132.与igfbp7表达相似,实验人员发现adamts1表达在hdac2
iδec
aza小鼠的secs中明显降低(图9a)。此外,通过adamts1 shrna(shadamts1)基因敲低人ecs中的adamts1,阻断了tgf-β刺激下smad2的磷酸化(图9b)。因此,实验人员利用“人到小鼠”细胞外囊泡(evs)移植方法(图9c)来研究内皮来源的adamts1是否调节th17生物学。从shadamts1和对照(shnc)感染的huvecs的培养基中分离evs,并通过尾静脉移植到小鼠中。与用对照evs处理的小鼠相比,移植缺乏adamts1的evs的小鼠的肝纤维化和th17应答显著降低(图9d-e)。这些结果暗示,在肝脏纤维化进程中adamts1在促进th17应答的功能作用。
133.本发明数据揭示了人类患者、小型猪和小鼠nash模型中促进肝纤维化的内皮来源的hdac2/dnmt1-igfbp7/adamts1-th17轴。肝脏ecs亚群的表观遗传异常互作导致“窦内皮-大血管内皮失调”,其特点是内皮分类异常和失调的secs产生促纤维化的igfbp7/adamts1,通过细胞外囊泡募集th17细胞,形成促纤维化的血管微环境(图9f)。
134.总结
135.nash的发病机制涉及包括代谢功能障碍在内的系统性影响。循环系统中内皮细胞和造血细胞与系统性刺激直接联系,nash与循环/血管并发症的许多危险因素相似。本发明利用多组学分析,揭示了血管特异性表观遗传改变如何在单细胞水平上对肝脏循环系统
(血管和造血细胞)中的促纤维化的交互调控进行重编程。本发明整合了人和大型动物nash模型的scrna-seq数据,揭示“窦内皮-大血管内皮失调”是如何刺激nash中的促纤维化的th17细胞应答。此外,本发明发现,nash中,肝ecs中异常的hdac2-dnmt1交互调控会导致内皮细胞分类异常并产生失调的igfbp
adamts1
肝ec亚群,以在循环系统中形成促纤维化的失调血管微环境。本发明采用从病床到实验室(bed to benchside)的方法,系统地研究了人类患者和补充的大型动物和啮齿动物的nash模型的细胞表型,这种多物种探究策略阐明了在血管微环境的异常的表观遗传交互调控是如何导致内皮细胞和免疫细胞之间的促纤维化的通讯。
136.本发明表明,在人和大型动物nash模型中,血管内皮细胞的异常的表观遗传交互调控促进肝脏纤维化。整合scrna-seq、组蛋白修饰和人类患者队列分析,本发明实验人员发现肝血管ecs的特定亚群中hdac2和dnmt1的选择性诱导与肝纤维化的进展密切相关。大型动物和啮齿动物nash模型的hdac2/dnmt1的药理学和遗传学的靶向进一步揭示,失调的ec亚群中的hdac2/dnmt1交互调控会刺激细胞外囊泡中促纤维化的igfbp7和adamts1的产生,从而募集th17细胞,在nash中抑制肝脏再生和诱导纤维化。
137.实验人员首先在单细胞水平上分析了人类患者npcs中内皮细胞和造血细胞的表型和分子特征。在检验的npcs中,血管ecs表观遗传相关基因变化最大,这表明,在nash等慢性疾病中,ecs可能更容易受到表观遗传改变的影响。与造血细胞相比,内皮细胞可能在循环系统中有更长的体内半衰期,从而积累更多的微环境或系统性刺激(如代谢应激)。scrna-seq揭示,在nash中,ecs的选择性表观遗传改变导致“窦内皮-大血管内皮失调”及内皮分类异常,形成促纤维化的内皮微环境。通过多组学和多物种分析,本发明的实验人员在失调的肝脏ecs亚群中发现了促纤维化的hdac2/dnmt1-igfbp7/adamts1轴。先前的报道显示,肝纤维化会导致secs毛细血管化并改变肝窦中的血流(参考文献22、23、57)。应当指出的是,肝脏ecs是npcs的主要成分,据报道约占npcs的5%-15%。根据个体差异和特定的分离方法不同,纯化的npcs中ecs的比例在不同的研究和个体之间似乎有所不同。在本发明中,对肝脏ecs的scrna-seq分析表明,在nash中,对ecs的慢性/代谢性损伤以及由此产生的表观遗传修饰异常促进了肝纤维化。在nash中,异质的肝血管系统中组蛋白和dna修饰异常可能诱导肝脏ecs的失调,并且这些失调的ecs亚群进一步与其它循环细胞如th17细胞相互作用,共同形成促进肝脏纤维化的微环境。
138.scrna-seq分析能够在单细胞水平上揭示肝硬化肝脏中的血管失调。人类患者和小型猪nash模型的分析表明,异常的表观遗传交互调控会导致从窦内皮到大血管内皮的失调,从而导致内皮分类的异常。在检测的肝脏样本中,观察到的血管失调似乎主要表现为ecs谱系内的表型和功能性转变。所检测的纤维化肝脏表现出ecs数量增加,并且在ec群体中“间质细胞分化”的富集度较低。因此,这种血管失调过程似乎与内皮间质转化(endmt)不同。从治疗上讲,联合靶向抑制异常的hdac2/dnmt1交互调控使内皮分类及肝脏功能(ast和alt血浆水平正常)恢复正常,提示内皮失调可能发生在肝脏损伤之前。器官的再生需要有功能的血管系统,其包括血液供应和促进再生和维持体内平衡的旁分泌因子。因此,肝脏内皮失调导致旁分泌因子异常,从而导致肝脏修复异常。本发明的研究显示,nash中的表观遗传依赖的肝脏ecs失调导致促纤维化的igfbp7和adamts1分泌到细胞外囊泡中,而且,在人和小型猪nash模型中,血浆igfbp7和adamts1水平的升高在可检测的实质损伤之前(血浆
alt和ast的升高),联合靶向抑制hdac2/dnmt1的异常交互调控恢复了小型猪血浆igfbp7和adamts1的水平。在人类患者上的临床发现与小型猪nash模型中联合靶向抑制ecs中hdac2/dnmt1使血浆ast和alt水平正常化的数据一致。因此,本发明的实验数据表明,nash中的慢性应激会刺激表观遗传重编程的igfbp7
adamts1
secs的生成,并产生促纤维化的igfbp7和adamts1来增强肝脏实质损伤。在此过程中,参与内皮分类异常的分子标记(例如细胞外囊泡igfbp7或adamts1)可能用作治疗靶点或生物标记物来评估nash患者的纤维化进展,特别是区分nash患者与单纯性脂肪肝患者。
139.nash中异常的细胞互作能够促进肝纤维化。本发明揭示了循环系统中促纤维化的血管失调的单细胞图谱,通过对肝硬化患者队列、转基因小鼠以及小型猪和啮齿动物nash模型的多组学分析,确定了参与血管失调的关键分子。在所述血管失调过程中,表观遗传的重编程的肝脏secs产生igfbp7或adamts1到细胞外囊泡中以募集促纤维化的th17细胞。免疫细胞的异常募集和激活可刺激肝纤维化。在本发明中,使用npcs的scrna-seq进行的细胞相互作用预测分析显示,在人肝硬化患者和小型猪nash模型中,t细胞与重编程的ecs之间的互作。这个预测通过数据证明,小型猪和小鼠nash模型中,靶向hdac2/dnmt1治疗后使肝脏ecs的表观遗传变化正常并抑制了th17的募集。scrna-seq、igfbp7基因敲除小鼠和细胞外囊泡移植表明,所述ec-th17的互作至少部分取决于表观遗传重编程的肝脏secs产生的igfbp7/adamts1。因此,本发明整合了生物信息学和实验方法以揭示这种由表观遗传依赖性血管失调引起的独特的促纤维化的内皮-th17细胞的相互作用。鉴于血管和造血细胞(循环系统)在多个器官中的系统分布,解码参与循环失调的分子和细胞网络可能有助于系统性鉴定治疗靶点或生物标记物。
140.基于人类患者的临床发现,实验人员利用补充的临床前nash模型(小型猪及小鼠)来确定了表观遗传依赖的血管失调的作用。采用含有高蔗糖和果糖、高胆固醇和高脂肪的西方饮食喂养与反复的肝脏损伤相结合来诱导nash模型,表现出临床相关的nash表型,包括组织学特征和转录组学特征。小型猪和小鼠的临床前模型也有助于了解nash的发病机制。小型猪的消化系统与人的消化系统非常相似,具有类似人类代谢紊乱相关疾病(如nash)的独特优势。大型动物如小型猪可以进行肝脏活检,用于多组学评估治疗效果和潜在机制。与小型猪相比,转基因小鼠,如ec特异性hdac2基因敲除小鼠和igfbp7基因敲除小鼠,为研究参与表观遗传依赖的血管失调的细胞和分子机制提供了有效工具。的确,在小型猪和小鼠nash模型中进行的药理和遗传靶向实验表明,异常的hdac2/dnmt1交互调控会导致血管失调,并随后产生igfbp7/adamts1到细胞外囊泡中。该数据与人类肝硬化队列中鉴定出的hdac2、dnmt1、igfbp7或adamts1与纤维化等级之间的相关性相符。在小鼠和小型猪nash模型中,联合靶向抑制hdac2和dnmt1显示协同的抗纤维化效果。注射外源igfbp7或adamts1敲低的内皮来源的ev的实验进一步表明adamts1/igfbp7通过刺激肝脏中的th17应答而促进肝脏纤维化。本发明实验虽然只采用了雄性小型猪来构造nash模型,但是无论是人类患者样本还是小鼠模型都不具有性别特异性,因此,本发明的临床前平台可能有助于设计各种纤维化相关疾病(与全球范围内40%的死亡相关)的治疗策略。在本发明中,实验人员阐述了血管失调的单细胞图谱,其中表观遗传重编程的ec亚群诱导了促纤维化因子的释放,刺激了th17细胞募集,以共同促进多个物种的肝脏纤维化。所述失调的血管微环境的形成,包括内皮分类异常和在evs中促纤维化因子的产成。阐明这种血管失调下的分子和细
胞网络可能有助于探索纤维化疾病的诊断或治疗方案。
141.上面结合附图对本发明的实施例进行了描述,但是本发明并不局限于上述的具体实施方式,上述的具体实施方式仅仅是示意性的,而不是限制性的,本领域的普通技术人员在本发明的启示下,在不脱离本发明宗旨和权利要求所保护的范围情况下,还可做出很多形式,这些均属于本发明的保护之内。
142.参考文献1.friedman s l,et al.mechanisms of nafld development and therapeutic strategies[j].nature medicine,2018.2.schwabe r f,et al.mechanisms of fibrosis development in nash[j].gastroenterology,2020.3.bataller r,et al.liver fibrosis[j].the journal of clinical investigation,2005.4.seki e,et al.tlr4 enhances tgf-beta signaling and hepatic fibrosis[j].nature medicine,2007.5.wang x,et al.hepatocyte taz/wwtr1 promotes inflammation and fibrosis in nonalcoholic steatohepatitis[j].cell metabolism,2016.6.rajagopal j,et al.plasticity in the adult:how should the waddington diagram be applied to regenerating tissues?[j].developmental cell,2016.7.asrani s k,et al.burden of liver diseases in the world[j].journal of hepatology,2019.8.younossi z m,et al.global epidemiology of nonalcoholic fatty liver disease-meta-analytic assessment of prevalence,incidence,and outcomes[j].hepatology,2016.9.sookoian s,et al.repurposing drugs to target nonalcoholic steatohepatitis[j].world journal of gastroenterology,2019.10.weiskirchen r,et al.relevance of autophagy in parenchymal and non-parenchymal liver cells for health and disease[j].cells,2019.11.macparland s a,et al.single cell rna sequencing of human liver reveals distinct intrahepatic macrophage populations[j].nature communications,2018.12.kron p,et al.hypoxia-driven hif2a coordinates mouse liver regeneration by coupling parenchymal growth to vascular expansion[j].hepatology,2016.13.michalopoulos g k,et al.liver regeneration[j].science(new york,ny),1997.14.schaub j r,et al.de novo formation of the biliary system by tgfbeta-mediated hepatocyte transdifferentiation[j].nature,2018.15.krizhanovsky v,et al.senescence of activated stellate cells limits liver fibrosis[j].cell,2008.
16.cai b,et al.macrophage mertk promotes liver fibrosis in nonalcoholic steatohepatitis[j].cell metabolism,2020.17.friedman s l,et al.therapy for fibrotic diseases:nearing the starting line[j].science translational medicine,2013.18.yin c,et al.hepatic stellate cells in liver development,regeneration,and cancer[j].the journal of clinical investigation,2013.19.armulik a,et al pericytes:developmental,physiological,and pathological perspectives,problems,and promises[j].developmental cell,2011.20.mukai k,et al.mast cells as sources of cytokines,chemokines,and growth factors[j].immunological reviews,2018.21.marrone g,et al sinusoidal communication in liver fibrosis and regeneration[j].journal of hepatology,2016.22.wang l,et al.liver sinusoidal endothelial cell progenitor cells promote liver regeneration in rats[j].the journal of clinical investigation,2012.23.lee j s,et al.sinusoidal remodeling and angiogenesis:a new function for the liver-specific pericyte?[j].hepatology,2007.24.jang c,et al.a branched-chain amino acid metabolite drives vascular fatty acid transport and causes insulin resistance[j].nature medicine,2016.25.wilhelm k,et al.foxo1 couples metabolic activity and growth state in the vascular endothelium[j].nature,2016.26.yu p,et al.fgf-dependent metabolic control of vascular development[j].nature,2017.27.potente m,et al.involvement of foxo transcription factors in angiogenesis and postnatal neovascularization[j].the journal of clinical investigation,2005.28.ding b s,et al.divergent angiocrine signals from vascular niche balance liver regeneration and fibrosis[j].nature,2014.29.wang b,et al.self-renewing diploid axin2( )cells fuel homeostatic renewal of the liver[j].nature,2015.30.yoshioka k,et al.hepatocyte nuclear factor 1beta induced by chemical stress accelerates cell proliferation and increases genomic instability in mouse liver[j].journal of receptor and signal transduction research,2011.31.lujambio a,et al.non-cell-autonomous tumor suppression by p53[j].cell,2013.32.duncan a w,et al.the ploidy conveyor of mature hepatocytes as a source of genetic variation[j].nature,2010.
prevention of nonalcoholic fatty liver disease in the male rat[j].journal of lipid research,2013.97.satija r,et al.spatial reconstruction of single-cell gene expression data[j].nature biotechnology,2015.98.butler a,et al.integrating single-cell transcriptomic data across different conditions,technologies,and species[j].nature biotechnology,2018.
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
