1.本发明属于生物提取物技术领域,尤其涉及一种苦木提取物、其制备方法及应用。
背景技术:
2.苦木(picrasma quassioides benn.)为苦木科(simaroubaceae)苦树属植物,具有清热、祛湿、解毒、消肿等功效,分布于黄河以南各省,以广东广西山区资源最为丰富。已知的化学成分研究表明,该植物主要含有吲哚类生物碱和苦木苦味素类成分。药理研究表明苦木总碱或单体成分具有抗菌消炎、抑制黄嘌呤氧化酶、抗肿瘤等多方面药理作用。国内外植物化学及药理学研究主要集中于在脂溶性生物碱类成分的抗炎、抗肿瘤和降压方面,且对抗炎作用的研究多为口服或注射给药。仅有《苦木提取物的体外抗菌活性和抗炎作用研究》文章中提及苦木水煎液对2,4-二硝基氟苯(dnfb)诱导小鼠耳部变应性接触性皮炎(acd)有抗炎作用,可缓解acd小鼠的耳部红肿,降低血清免疫球蛋白e(lge)及白细胞介素-6(il-6)的水平。而苦木提取物在化妆品方面的应用鲜有人研究。
3.苦木提取物常规的提取方法主要采用95%乙醇、二氯甲烷、乙酸乙酯和正丁醇等有机溶剂进行提取,由于原料为苦木的干燥茎和枝,存在大量的纤维素、果胶、蛋白质等,质坚硬,破碎存在较大的难度,提取普通采用长时间的浸泡及反复提取,例如文献《苦木主要生物碱成分的分离及肠道微生物的转化研究》中提到的苦木生物碱的提取需要用95%的乙醇浸泡4天,反复2次之后过滤,滤液减压浓缩来获取含有生物碱的苦木粗体物,后经过氨水处理、乙酸乙酯萃取等工艺处理后,10kg苦木仅获得17g总生物碱。整体提取方法存在耗时长、耗能大、有机溶剂用量大、提取效率低等问题。
技术实现要素:
4.有鉴于此,本发明要解决的技术问题在于提供一种苦木提取物、其制备方法及应用,该制备方法的提取效率较高且得到的苦木提取物具有较好的抗炎效果和修复效果。
5.本发明提供了一种苦木提取物的制备方法,包括:
6.将苦木粉末、猕猴桃蛋白酶与菠萝蛋白酶混合进行发酵水解,然后加热提取,得到苦木提取物。
7.优选的,所述苦木粉末的粒径为10~20mm;
8.所述猕猴桃蛋白酶由猕猴桃破碎物汁液提供;所述猕猴桃破碎物汁液按照以下方法制备:将猕猴桃破碎后过滤,得到猕猴桃破碎物汁液;
9.所述菠萝蛋白酶由菠萝破碎物汁液提供;所述菠萝破碎物汁液按照以下方法制备:将菠萝破碎后过滤,得到菠萝破碎物汁液。
10.优选的,所述苦木粉末、猕猴桃破碎物汁液与菠萝破碎物汁液的质量比为10:(1~10):(1~10)。
11.优选的,苦木粉末、猕猴破碎物汁液与菠萝破碎物汁液混合后还加入水进行发酵水解;所述苦木粉末与水的质量比为10:(70~88)。
12.优选的,所述发酵水解的温度为2℃~6℃;所述发酵水解的时间为1~14天。
13.优选的,所述加热提取的温度为50℃~90℃;所述加热提取的时间为1~5h。
14.优选的,所述加热提取在搅拌的条件下进行;所述搅拌的速度为200~500rpm/h。
15.优选的,加热提取后,离心过滤,得到苦木提取物。
16.本发明还提供了一种上述制备方法所制备的苦木提取物,由混合物发酵水解后提取得到;所述混合物包括苦木粉末、猕猴桃蛋白酶与菠萝蛋白酶。
17.本发明还提供了一种化妆品,包括上述的苦木提取物。
18.本发明提供了一种苦木提取物的制备方法,包括:将苦木粉末、猕猴桃蛋白酶与菠萝蛋白酶混合进行发酵水解,然后加热提取,得到苦木提取物。与现有技术相比,本发明采用猕猴桃蛋白酶与菠萝蛋白酶联合水解苦木,不仅提高了苦木提取物的提取效率,还提高了苦木提取物的功效,尤其是苦木提取物的抗炎效果与修复效果,使其应用于化妆品中具有更好的功效。
附图说明
19.图1为本发明实施例及对比例中il-6浓度与吸光度的关系图;
20.图2为本发明实施例及对比例中不同的苦木粉末:猕猴桃蛋白酶:菠萝蛋白酶的比例发酵物对il-6分泌量的抑制率柱形图;
21.图3为不同发酵时间下发酵物对il-6分泌量的抑制率柱形图;
22.图4为连续使用样品7天后皮肤屏障修复效果图。
具体实施方式
23.下面将结合本发明实施例,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
24.本发明提供了一种苦木提取物的制备方法,包括:将苦木粉末、猕猴桃蛋白酶与菠萝蛋白酶混合进行发酵水解,然后加热提取,得到苦木提取物。
25.其中,本发明对所述原料的来源并没有特殊的限制,为市售或自制均可。
26.在本发明中,所述苦木粉末的粒径优选为10~20mm;所述苦木粉末优选通过对干燥的苦木破碎后得到;所述干燥的苦木优选先经水清洗后去除泥沙等异物再干燥后得到;所述干燥的温度优选为50℃~80℃,更优选为60℃~70℃。
27.所述猕猴桃蛋白酶优选由由猕猴桃破碎物汁液提供;所述猕猴桃破碎物汁液优选按照以下方法进行制备:将猕猴桃破碎后过滤,得到猕猴桃破碎物汁液;所述猕猴桃优选为七~九成熟的猕猴桃,更优选为八成熟的猕猴桃;所述猕猴桃优选经水洗除去异物质沥干后再进行破碎;所述破碎优选采用破壁机进行;所述过滤优选采用滤网进行;所述滤网的目数优选为80~200目,更优选为80~150目,再优选为100目。猕猴桃成熟果实中除含有丰富的维生素c、多糖,矿物元素等营养成份外,还含有猕猴桃酶(actinidin)。猕猴桃蛋白酶在食品、医药、纺织印染、皮革制造、祛斑美容、生化试剂等领域有广泛的应用,在医药上有抗炎消肿作用。
28.所述菠萝蛋白酶由菠萝破碎物汁液提供;所述菠萝破碎物汁液按照以下方法制备:将菠萝破碎后过滤,得到菠萝破碎物汁液;所述菠萝优选为七~九成熟的菠萝,更优选为八成熟的菠萝;所述菠萝优选去掉枯萎的叶子与根茎经水洗除去异物质沥干后再进行破碎;所述破碎优选采用破壁机进行;所述过滤优选采用滤网进行;所述滤网的目数优选为80~200目,更优选为80~150目,再优选为100目。菠萝蛋白酶bromelain是从菠萝的果实和茎中制取分离出的蛋白水解酶的总称,根据制取分离部位的不同,分为果菠萝蛋白酶(fruit bromelain)和茎菠萝蛋白酶(stembromelain)。菠萝蛋白酶中含有多种不同蛋白水解酶组分对多种蛋白质及多肽具有催化水解活性,在医药上主要用于抗炎消除水肿、烧伤后脱痂等。粗菠萝蛋白酶是各种成分的混合物,除了蛋白水解酶系外,含有磷酸酯酶、过氧化物酶、纤维素酶、其它糖苷酶等。菠萝蛋白酶在各种组织中能有效地治疗炎症和水肿(包括血栓静脉炎、骨骼肌损伤、血肿、口腔炎、糖尿病人溃疡及运动损伤),能在体外激活鼠巨噬细胞等。
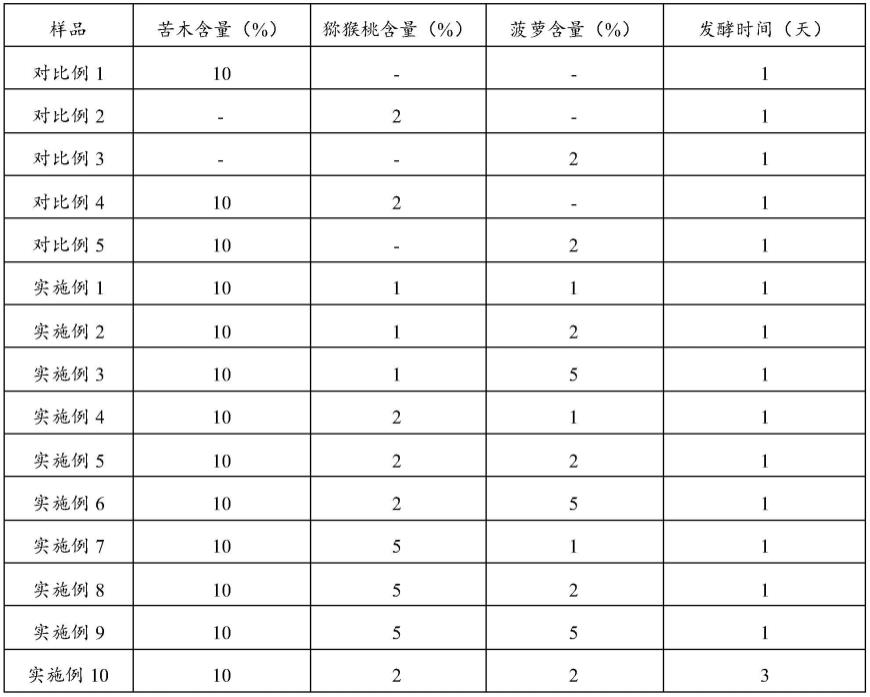
29.将苦木粉末、猕猴桃破碎物汁液与菠萝破碎物汁液混合进行发酵水解;本发明采用破碎后的菠萝及猕猴桃按照比例与破碎后的苦木直接进行发酵。菠萝及猕猴桃中含有的丰富的菠萝蛋白酶、猕猴桃蛋白酶、纤维素酶及其他酶类,共同对苦木进行水解发酵;所述苦木粉末、猕猴桃破碎物汁液与菠萝破碎物汁液的质量比优选为10:(1~10):(1~10),更优选为10:(1~8):(1~8),再优选为10:(1~5):(1~5);在本发明提供的实施例中,所述苦木粉末、猕猴桃破碎物汁液与菠萝破碎物汁液的质量比具体为10:1:1、10:1:2、10:1:5、10:2:1、10:2:2、10:2:5、10:5:1、10:5:2、10:5:5;混合后优选还加入水进行发酵水解;所述苦木粉末与水的质量比优选为10:(70~88);所述发酵水解的温度优选为2℃~6℃,更优选为3℃~5℃,再优选为4℃;所述发酵水解的时间优选为1~14天;在本发明提供的实施例中,所述发酵水解的时间具体为1天、3天、7天或14天。
30.发酵水解后,加热提取;所述加热提取的温度优选为50℃~90℃,更优选为60℃~80℃,再优选为70℃;所述加热提取的时间优选为1~5h,更优选为2~4h,再优选为3h;所述加热提取优选在搅拌的条件下进行;所述搅拌的转速优选为200~500rpm/h,更优选为300~400rpm/h,再优选为350rpm/h。
31.加热提取后,优选离心过滤,得到苦木提取液。
32.所述苦木提取液优选经膜过滤,得到苦木提取物;得到的苦木提取物可直接使用,也可根据需要进行进一步的操作以改变其形态;在本发明中膜过滤后还可经浓缩、冷冻干燥,得到苦木提取物的粉末;所述膜过滤所用的膜优选为0.2~0.3μm的膜,更优选为0.22~0.25μm的膜;所述浓缩优选浓缩至40%~60%,更优选为浓缩至45%~55%,再优选为浓缩至50%。
33.本发明采用猕猴桃蛋白酶与菠萝蛋白酶联合水解苦木,不仅提高了苦木提取物的提取效率,还提高了苦木提取物的功效,尤其是苦木提取物的抗炎效果与修复效果,使其应用于化妆品中具有更好的功效。
34.本发明还提供了一种上述方法制备的苦木提取物,由混合物发酵水解后提取得到;所述混合物包括苦木粉末、猕猴桃蛋白酶与菠萝蛋白酶。
35.所述苦木粉末、猕猴桃蛋白酶与菠萝蛋白酶的种类及比例均同上所述,在此不再赘述。
36.本发明还提供了一种化妆品,包括上述的方法制备的苦木提取物。
37.为了进一步说明本发明,以下结合实施例对本发明提供的一种苦木提取物、其制备方法及应用进行详细描述。
38.以下实施例中所用的试剂均为市售。
39.苦木的处理
40.苦木采用清水清洗3遍,将泥沙等异物清洗掉后,于60℃热风干燥箱中进行烘干;烘干后采用破碎机进行破碎得到苦木粉末,粉末粒径为10~20mm。
41.猕猴桃、菠萝处理
42.取八成熟猕猴桃,采用清水冲洗3遍,将异物质清洗掉、沥干后,采用破壁机进行破碎,破碎后的猕猴桃破碎产物采用100目滤网进行过滤,得到猕猴桃蛋白酶粗制液;取八成熟菠萝,去掉枯萎的叶子和根茎后,采用清水冲洗3遍,将异物质清洗掉、沥干后,菠萝全株采用破壁机进行破碎,破碎后的菠萝破碎产物采用100目滤网进行过滤,得到菠萝蛋白酶粗制液。
43.对比例1
44.苦木粉末含量为10%,其余90%为纯净水;混合均匀后平均分成2份,一份为发酵前样品,具体处理方法为:加热至70℃,搅拌速度为350rpm/h,提取时间为3小时;另一份为发酵后样品,具体处理方法为:于4℃冰箱中放置1日后加热至70℃,搅拌速度为350rpm/h,提取时间为3小时。发酵前后的2份样品通过离心过滤后得到苦木粗提液,苦木粗提液采用0.22μm的膜过滤后进行旋蒸浓缩至50%,然后进行冻干,最终得到苦木提取物的粉末。
45.对比例2
46.苦木粉末含量为0%,猕猴桃蛋白酶粗制液含量为2%,菠萝蛋白酶粗制液含量为0%。其余采用纯净水补足至100%;混合均匀后平均分成2份,一份为发酵前样品,具体处理方法为:加热至70℃,搅拌速度为350rpm/h,提取时间为3小时;另一份为发酵后样品,具体处理方法为:于4℃冰箱中放置1日后加热至70℃,搅拌速度为350rpm/h,提取时间为3小时。发酵前后的2份样品通过离心过滤后得到粗提液,粗提液采用0.22μm的膜过滤后进行旋蒸浓缩至50%,然后进行冻干,最终得到粉末。
47.对比例3
48.苦木粉末含量为0%,猕猴桃蛋白酶粗制液含量为0%,菠萝蛋白酶粗制液含量为2%。其余采用纯净水补足至100%;混合均匀后平均分成2份,一份为发酵前样品,具体处理方法为:加热至70℃,搅拌速度为350rpm/h,提取时间为3小时;另一份为发酵后样品,具体处理方法为:于4℃冰箱中放置1日后加热至70℃,搅拌速度为350rpm/h,提取时间为3小时。发酵前后的2份样品通过离心过滤后得到粗提液,粗提液采用0.22μm的膜过滤后进行旋蒸浓缩至50%,然后进行冻干,最终得到粉末。
49.对比例4
50.苦木粉末含量为10%,猕猴桃蛋白酶粗制液含量为2%,菠萝蛋白酶粗制液含量为0%。其余采用纯净水补足至100%;混合均匀后平均分成2份,一份为发酵前样品,具体处理方法为:加热至70℃,搅拌速度为350rpm/h,提取时间为3小时;另一份为发酵后样品,具体处理方法为:于4℃冰箱中放置1日后加热至70℃,搅拌速度为350rpm/h,提取时间为3小时。发酵前后的2份样品通过离心过滤后得到粗提液,粗提液采用0.22μm的膜过滤后进行旋蒸浓缩至50%,然后进行冻干,最终得到粉末。
51.对比例5
52.苦木粉末含量为10%,猕猴桃蛋白酶粗制液含量为0%,菠萝蛋白酶粗制液含量为2%。其余采用纯净水补足至100%;混合均匀后平均分成2份,一份为发酵前样品,具体处理方法为:加热至70℃,搅拌速度为350rpm/h,提取时间为3小时;另一份为发酵后样品,具体处理方法为:于4℃冰箱中放置1日后加热至70℃,搅拌速度为350rpm/h,提取时间为3小时。发酵前后的2份样品通过离心过滤后得到粗提液,粗提液采用0.22μm的膜过滤后进行旋蒸浓缩至50%,然后进行冻干,最终得到粉末。
53.实施例1
54.苦木粉末含量为10%,猕猴桃蛋白酶粗制液含量为1%,菠萝蛋白酶粗制液含量为1%。其余采用纯净水补足至100%;混合均匀后平均分成2份,一份为发酵前样品,具体处理方法为:加热至70℃,搅拌速度为350rpm/h,提取时间为3小时;另一份为发酵后样品,具体处理方法为:于4℃冰箱中放置1日后加热至70℃,搅拌速度为350rpm/h,提取时间为3小时。发酵前后的2份样品通过离心过滤后得到苦木粗提液,苦木粗提液采用0.22μm的膜过滤后进行旋蒸浓缩至50%,然后进行冻干,最终得到苦木提取物的粉末。
55.实施例2
56.苦木粉末为10%,猕猴桃蛋白酶粗制液含量为1%,菠萝蛋白酶粗制液含量为2%。其余采用纯净水补足至100%;混合均匀后平均分成2份,一份为发酵前样品,具体处理方法为:加热至70℃,搅拌速度为350rpm/h,提取时间为3小时;另一份为发酵后样品,具体处理方法为:于4℃冰箱中放置1日后加热至70℃,搅拌速度为350rpm/h,提取时间为3小时。发酵前后的2份样品通过离心过滤后得到苦木粗提液,苦木粗提液采用0.22μm的膜过滤后进行旋蒸浓缩至50%,然后进行冻干,最终得到苦木提取物的粉末。
57.实施例3
58.苦木粉末为10%,猕猴桃蛋白酶粗制液含量为1%,菠萝蛋白酶粗制液含量为5%。其余采用纯净水补足至100%;混合均匀后平均分成2份,一份为发酵前样品,具体处理方法为:加热至70℃,搅拌速度为350rpm/h,提取时间为3小时;另一份为发酵后样品,具体处理方法为:于4℃冰箱中放置1日后加热至70℃,搅拌速度为350rpm/h,提取时间为3小时。发酵前后的2份样品通过离心过滤后得到苦木粗提液,苦木粗提液采用0.22μm的膜过滤后进行旋蒸浓缩至50%,然后进行冻干,最终得到苦木提取物的粉末。
59.实施例4
60.苦木粉末含量为10%,猕猴桃蛋白酶粗制液含量为2%,菠萝蛋白酶粗制液含量为1%。其余采用纯净水补足至100%;混合均匀后平均分成2份,一份为发酵前样品,具体处理方法为:加热至70℃,搅拌速度为350rpm/h,提取时间为3小时;另一份为发酵后样品,具体处理方法为:于4℃冰箱中放置1日后加热至70℃,搅拌速度为350rpm/h,提取时间为3小时。发酵前后的2份样品通过离心过滤后得到苦木粗提液,苦木粗提液采用0.22μm的膜过滤后进行旋蒸浓缩至50%,然后进行冻干,最终得到苦木提取物的粉末。
61.实施例5
62.苦木粉末含量为10%,猕猴桃蛋白酶粗制液含量为2%,菠萝蛋白酶粗制液含量为2%。其余采用纯净水补足至100%;混合均匀后平均分成2份,一份为发酵前样品,具体处理方法为:加热至70℃,搅拌速度为350rpm/h,提取时间为3小时;另一份为发酵后样品,具体
处理方法为:于4℃冰箱中放置1日后加热至70℃,搅拌速度为350rpm/h,提取时间为3小时。发酵前后的2份样品通过离心过滤后得到苦木粗提液,苦木粗提液采用0.22μm的膜过滤后进行旋蒸浓缩至50%,然后进行冻干,最终得到苦木提取物的粉末。
63.实施例6
64.苦木粉末含量为10%,猕猴桃蛋白酶粗制液含量为2%,菠萝蛋白酶粗制液含量为5%。其余采用纯净水补足至100%;混合均匀后平均分成2份,一份为发酵前样品,具体处理方法为:加热至70℃,搅拌速度为350rpm/h,提取时间为3小时;另一份为发酵后样品,具体处理方法为:于4℃冰箱中放置1日后加热至70℃,搅拌速度为350rpm/h,提取时间为3小时。发酵前后的2份样品通过离心过滤后得到苦木粗提液,苦木粗提液采用0.22μm的膜过滤后进行旋蒸浓缩至50%,然后进行冻干,最终得到苦木提取物的粉末。
65.实施例7
66.苦木粉末含量为10%,猕猴桃蛋白酶粗制液含量为5%,菠萝蛋白酶粗制液含量为1%。其余采用纯净水补足至100%;混合均匀后平均分成2份,一份为发酵前样品,具体处理方法为:加热至70℃,搅拌速度为350rpm/h,提取时间为3小时;另一份为发酵后样品,具体处理方法为:于4℃冰箱中放置1日后加热至70℃,搅拌速度为350rpm/h,提取时间为3小时。发酵前后的2份样品通过离心过滤后得到苦木粗提液,苦木粗提液采用0.22μm的膜过滤后进行旋蒸浓缩至50%,然后进行冻干,最终得到苦木提取物的粉末。
67.实施例8
68.苦木粉末含量为10%,猕猴桃蛋白酶粗制液含量为5%,菠萝蛋白酶粗制液含量为2%。其余采用纯净水补足至100%;混合均匀后平均分成2份,一份为发酵前样品,具体处理方法为:加热至70℃,搅拌速度为350rpm/h,提取时间为3小时;另一份为发酵后样品,具体处理方法为:于4℃冰箱中放置1日后加热至70℃,搅拌速度为350rpm/h,提取时间为3小时。发酵前后的2份样品通过离心过滤后得到苦木粗提液,苦木粗提液采用0.22μm的膜过滤后进行旋蒸浓缩至50%,然后进行冻干,最终得到苦木提取物的粉末。
69.实施例9
70.苦木粉末含量为10%,猕猴桃蛋白酶粗制液含量为5%,菠萝蛋白酶粗制液含量为5%。其余采用纯净水补足至100%;混合均匀后平均分成2份,一份为发酵前样品,具体处理方法为:加热至70℃,搅拌速度为350rpm/h,提取时间为3小时;另一份为发酵后样品,具体处理方法为:于4℃冰箱中放置1日后加热至70℃,搅拌速度为350rpm/h,提取时间为3小时。发酵前后的2份样品通过离心过滤后得到苦木粗提液,苦木粗提液采用0.22μm的膜过滤后进行旋蒸浓缩至50%,然后进行冻干,最终得到苦木提取物的粉末。
71.实施例10
72.苦木粉末含量为10%,猕猴桃蛋白酶粗制液含量为2%,菠萝蛋白酶粗制液含量为2%。其余采用纯净水补足至100%;混合均匀后平均分成2份,一份为发酵前样品,具体处理方法为:加热至70℃,搅拌速度为350rpm/h,提取时间为3小时;另一份为发酵后样品,具体处理方法为:于4℃冰箱中分别放置3日后加热至70℃,搅拌速度为350rpm/h,提取时间为3小时。发酵前后的2份样品通过离心过滤后得到苦木粗提液,苦木粗提液采用0.22μm的膜过滤后进行旋蒸浓缩至50%,然后进行冻干,最终得到苦木提取物的粉末。
73.实施例11
74.苦木粉末含量为10%,猕猴桃蛋白酶粗制液含量为2%,菠萝蛋白酶粗制液含量为2%。其余采用纯净水补足至100%;混合均匀后平均分成2份,一份为发酵前样品,具体处理方法为:加热至70℃,搅拌速度为350rpm/h,提取时间为3小时;另一份为发酵后样品,具体处理方法为:于4℃冰箱中分别放置7日后加热至70℃,搅拌速度为350rpm/h,提取时间为3小时。发酵前后的2份样品通过离心过滤后得到苦木粗提液,苦木粗提液采用0.22μm的膜过滤后进行旋蒸浓缩至50%,然后进行冻干,最终得到苦木提取物的粉末。
75.实施例12
76.苦木粉末含量为10%,猕猴桃蛋白酶粗制液含量为2%,菠萝蛋白酶粗制液含量为2%。其余采用纯净水补足至100%;混合均匀后平均分成2份,一份为发酵前样品,具体处理方法为:加热至70℃,搅拌速度为350rpm/h,提取时间为3小时;另一份为发酵后样品,具体处理方法为:于4℃冰箱中分别放置14日后加热至70℃,搅拌速度为350rpm/h,提取时间为3小时。发酵前后的2份样品通过离心过滤后得到苦木粗提液,苦木粗提液采用0.22μm的膜过滤后进行旋蒸浓缩至50%,然后进行冻干,最终得到苦木提取物的粉末。
77.苦木提取物功效验证
78.1)抗炎功效
79.测试样品:
[0080][0081][0082]
角质形成细胞复苏后,用含10%fbs的dmem作为培养液培养细胞。
[0083]
取对数期细胞,用0.25%胰酶消化细胞,含10%fbs的dmem作为培养液,以每孔细胞数1.0
×
105接种至96孔板,200μl/孔,37℃,5%co2培养箱中培养24h左右至细胞融合率达到60~70%。
[0084]
于实验组和对照组中每孔加入20μl浓度为0.5%的sds处理10min,诱导角质形成细胞炎症模型的产生。空白组正常添加培养基进行培养。
[0085]
诱导完毕后去掉孔板中的培养基,实验组加入含有同浓度不同的受检样品的新鲜培养液200μl,每组重复至少三个孔,同时设置空白组和对照组,于37℃,5%co2培养箱中培养24h。
[0086]
孵育培养结束后,每孔收集150μl细胞培养上清液于1.5ml无菌离心管中,置于-80℃超低温冰箱冷冻保存,用于后续炎症因子含量测定。
[0087]
炎症因子il-6的分泌量采用elisa进行检测,具体根据炎症因子il-6含量测定检测试剂盒的使用说明书进行检测。
[0088]
2)皮肤屏障修复
[0089]
测试目的:通过人为皮肤屏障损伤后,涂抹含有苦木提取物及未含苦木提取物的乳液,连续使用样品7天后皮肤屏障修复效果。
[0090]
测试样品:
[0091][0092]
其中实验组及安慰组的配方如下:
[0093][0094][0095]
制备工艺为:
[0096]
1)苦木提取物制备方法:采用实施例-10的条件发酵的到苦木发酵液,具体为:苦木粉末含量为10%,猕猴桃蛋白酶粗制液含量为2%,菠萝蛋白酶粗制液含量为2%。其余采
用纯净水补足至100%;混合均匀后于4℃冰箱中放置3日后加热至70℃,搅拌速度为350rpm/h,提取时间为3小时。发酵后的样品通过离心过滤后得到苦木粗提液,苦木粗提液中加入30%丁二醇,0.5%对羟基苯乙酮及0.2%苯氧乙醇,混合均匀后加热至80℃。待恢复室温后采用0.22μm的膜过滤得到苦木提取物混合液。
[0097]
2)实验组及安慰组乳液制备方法:按照上表的配方将a相加入主锅,搅拌加热至80~82℃,均质2分钟;将b相原料加入油锅,搅拌加热至80~82℃至溶解完全后,加入到主锅,均质2分钟;降温至50℃,加入c相原料,均质3分钟,搅拌均匀;降温至35℃后,用滤布过滤出料,制得待测试样品。
[0098]
测试方法:
[0099]
测试仪器:皮肤水分散失测试仪tewameter tm300(courage&khazaka,德国);
[0100]
测试环境:温度22.0℃
±
1.0℃;湿度50%
±
10%;
[0101]
测试过程:
[0102]
①
首次到访,对受试者进行试验说明,并签署知情同意书。
[0103]
②
对参加试验的受试者按照试验要求进行筛选,先筛选入组10名,最终保证完成10人。
[0104]
③
筛选合格的受试者用清水清洁完手臂内侧后,在测试环境中休息30分钟。30分钟后,用仪器对手臂内侧固定2个区域进行测试。
[0105]
④
测试完成后对受试者进行2个区域的诱导皮肤刺激,具体方法为:采用70%ethanol擦拭后,晾干,采用含有0.5%sls的finn chamber进行24h的密闭斑贴实验。
[0106]
⑤
24小时后,去掉斑贴,30分钟后测试2个区域的水分散失量记为t0。
[0107]
⑥
初始值测试完成后,受试者按照说明分别于2个区域涂抹苦木提取物乳液、乳液base等2个样品。受试者在家连续7天隔天使用试验样品。期间,受试者按照试验的指示在产品使用后第1天、第3天、第7天后进行会场回访,然后按照步骤
③
进行面部测试。
[0108]
试验日程:
[0109]
观察项目/观察日d0d1d3d7受试者到访oooo测试说明和取得同意o
‑‑‑
tewameter-手臂内侧3处o oo
[0110]
观察/测试项目:
[0111]
手臂内侧3个部位;诱导刺激前、诱导刺激后、使用后1天、使用后3天、使用后7天,共5次对受试者仪器测试。
[0112]
皮肤水分散失量:使用tewameter测试。诱导刺激后的皮肤水分散失量记为t0,第n天的水分散失量记为tn。参数解释:测试值越低,表明皮肤水分散失量越少。
[0113]
结果判定:产品使用后,测试区域水分散失量呈显著性降低,表示该受试样品具有修复皮肤屏障的效果。
[0114]
皮肤水分散失量的减少量(%)=(t0-tn)/t0*100%
[0115]
实验结果:
[0116]
1)抗炎功效
[0117]
根据标准品的己知浓度和所测od值计算标准曲线回归方程(r2》0.99),将样品孔
的od值代入计算所测样品的浓度,再乘稀释倍数即得到原样品的实际il-6的分泌量,得到结果如表1与图1所示,其中图1为il-6浓度与吸光度的关系图。
[0118]
表1 il-6的浓度与吸光度
[0119][0120][0121]
根据各个样品处理后的细胞培养上清液测试得到吸光度计算得到各个样品处理后il-6的分泌量,如表2所示;计算得到不同的苦木粉末:猕猴桃蛋白酶:菠萝蛋白酶的比例发酵物对il-6分泌量的抑制率柱形图如图2所示;得到不同发酵时间下发酵物对il-6分泌量的抑制率柱形图如图3所示。
[0122]
表2样品处理后il-6的分泌量
[0123][0124][0125]
从表2中il-6的分泌量中可以看到,单纯的水体的苦木提取物、菠萝蛋白酶液、猕猴桃蛋白酶液均具有一定的il-6分泌抑制的效果。苦木粉与菠萝蛋白酶液、猕猴桃蛋白酶液混合发酵后制备得到的苦木提取物在il-6的分泌抑制效果有明显的提升。当苦木粉末:猕猴桃蛋白酶:菠萝蛋白酶的比例为10:2:2的条件下制备得到的苦木提取物的il-6分泌的抑制效果最好,抑制率达到74.61%。对比发酵前,il-6分泌量的抑制率提升了34.85%。
[0126]
由图3可知,当苦木粉末:猕猴桃蛋白酶:菠萝蛋白酶的比例为10:2:2的条件下,通过优化发酵时间可以发现,随着发酵时间的增长,il-6分泌量的抑制率逐步上升,在3天的时候出现拐点,3天的发酵物对il-6分泌量的抑制率达到76.19%,对比发酵前的话,il-6分泌量的抑制率提升了36.23%。
[0127]
2)皮肤屏障修复
[0128]
通过人为皮肤屏障损伤后,涂抹含有苦木提取物及未含苦木提取物的乳液,连续使用样品7天后皮肤屏障修复效果如表3与图4所示。
[0129]
表3皮肤屏障修复效果
[0130] 刺激诱导前刺激诱导后1天3天7天安慰组9.5219.3214.5211.7610.59实验组9.6219.6810.969.989.74
[0131]
通过0.5%sls的finn chamber进行24h的密闭斑贴诱导皮肤屏障造成损伤,实验组及安慰组的平均tewl提升到19.68(g/cm2h)及19.32(g/cm2h),实验组早晚涂抹含有苦木提取物的乳液,1天后tewl下降到10.96(g/cm2h),经皮水分散失量的减少量为44.31%,3天后tewl下降到9.98(g/cm2h),经皮水分散失量的减少量为49.29%,基本上恢复到sls刺激诱导之前的水平。而安慰组的结果来看,7天后tewl下降到10.59(g/cm2h),经皮水分散失量的减少量为45.19%,仍未恢复到sls刺激诱导之前的水平。通过与安慰组的对比可知,添加了含有苦木提取物的乳液可以有效的改善受损的皮肤屏障,减少皮肤的经皮水分散失量。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。