一种神经干细胞或neuro2a细胞来源线粒体的制备方法
技术领域
1.本发明属于线粒体制备领域,具体涉及一种神经干细胞或neuro2a细胞来源线粒体的制备方法。
背景技术:
2.脑卒中是全球第二致死原因及首要致残原因,2017年,脑卒中是中国首位致死因素以及首位致残因素。脑卒中是一种由脑血管突然闭塞和/或破裂导致神经功能障碍的急性脑血管疾病,主要分为缺血性脑卒中和出血性脑卒中两大类。
3.缺血性脑卒中占脑卒中的比例更高,其致死率和致残率高,造成巨大的社会和个人负担。缺血-再灌注是一个很常见的病理生理过程,除了在缺血性脑卒中和心肌梗死血管再通治疗过程中可见外,还常常见于器官移植、低血容量休克等情况,在缺血性脑卒中的治疗过程中,常见脑缺血-再灌注损伤。
4.脑组织缺血时,会出现一系列病理生理改变,但其核心是线粒体的功能障碍,细胞正常的代谢,氧化磷酸化、氧化呼吸不能进行,产生的能量不足使其维持正常的生命活动,导致细胞凋亡坏死。
5.有研究表明,缺血-再灌注损伤的始动核心是线粒体。在缺血期间,呼吸链、氧化还原活性酶和电子载体库(如nadh和辅酶q)最大限度地减少。同时,由于atp耗竭、缺乏离子稳态、钙超载和ph变化等因素,线粒体逐渐被抑制。因此,当缺血组织被富含氧气的血液再次灌注时,线粒体组分会将电子不适当地转移到氧气上,产生大量的活性氧簇(reactive oxygen species,ros),造成后续的病理改变,导致细胞的凋亡、坏死。
6.目前缺血性脑卒中的治疗方法主要包括血管再通治疗(取栓、溶栓等)、抗凝、抗血小板、神经保护等治疗。早期治疗中又以血管再通治疗最为重要,及时地再通阻塞的脑血管能够最大程度地改善神经功能障碍。然而,再通的血流可能会进一步地造成严重的损伤。目前的治疗策略大多聚焦于减轻缺血-再灌注后的损伤,如减少ros的产生、减轻钙离子超载、抗凋亡等治疗策略,但这些效果有限。针对脑缺血-再灌注损伤的研究已经很多,但是目前仍然没有一个具有确切临床效果的药物或者方法。因此,有必要进一步开发新的治疗手段。
7.聚焦于线粒体本身,改善受损线粒体功能的状态,是改善脑缺血损伤的一个重要方向。线粒体除了作为细胞的能量工厂为细胞提供大量能量之外,还与钙平衡、细胞凋亡、ros产生、代谢物合成、激素合成、细胞分化等相关。
8.以前的研究主要将线粒体作为一个干预的靶点或者观察的对象,近年来已经有研究将提取的线粒体作为一种干预手段去治疗某些疾病,如利用线粒体治疗肺动脉高压,治疗心肌缺血再灌注损伤,治疗肝脏的缺血再灌注损伤,治疗脂肪肝,修复神经等等。但线粒体治疗脑缺血再灌注损伤更关注改善局部能量代谢的作用,对炎症的调节作用次之。
9.由于恢复线粒体的功能对改善脑缺血后的损伤反应至关重要,因此,利用线粒体治疗脑缺血-再灌注损伤有较强的理论基础。然而,在利用线粒体治疗疾病时,需要解决的最基本的问题之一为线粒体的来源问题。
技术实现要素:
10.本发明的目的在于提供一种神经干细胞或neuro2a细胞来源线粒体的制备方法,制备的线粒体为棒状形态并连接成网,能够维持一定的膜电位,最大ocr较基础ocr有较高涨幅,线粒体氧化呼吸储备能力充足,氧化呼吸功能保存良好,获得的线粒体能够从脑室进入到脑实质,小鼠来源的线粒体能够跨物种转移到活体动物的细胞内,移植后能进入到神经元细胞内,发挥减少梗死面积、促进行为学改善的作用。
11.为了达到上述目的,本发明提供如下技术方案:
12.一种神经干细胞或neuro2a细胞来源线粒体的制备方法,包括以下步骤:
13.1)分离及培养细胞系
14.分离新生小鼠的神经干细胞,加入适量神经干细胞培养基进行重悬、过滤,分装后进行悬浮培养,3-4天半量或全量换液,神经球直径为100-200μm时进行传代,传代时取细胞悬液,静置后待细胞自然沉降,去除上清液,加入accutase酶,室温孵育8-12min,摇晃、离心,弃去上清液,用神经干细胞培养基重悬,传代5-10代内的神经球用于提取线粒体;
15.或从小鼠神经母细胞瘤分离出neuro2a细胞,形态呈神经元样或阿米巴样,使用含胎牛血清的dmem高糖培养基培养,每隔2-3天待培养液变黄时换液,当细胞汇合度在70%-90%时进行传代、冻存或干预;
16.2)提取线粒体
17.利用线粒体提取试剂盒对培养的神经干细胞或neuro2a细胞进行提取,用胰酶消化生长状态良好、形态正常的待提取细胞,消化后收集细胞并用预处理试剂进行预处理,再加入裂解试剂进行裂解,细胞膜被裂解,释放细胞核、细胞浆及包括线粒体在内的细胞器,离心后得到细胞核和细胞碎片沉淀,上清中包括线粒体和细胞浆,上清中加入离心介质后对其再离心,得到线粒体。
18.优选地,步骤1)中,所述神经干细胞分装后密度为4-6
×
105个/ml。
19.优选地,步骤1)中,神经干细胞或neuro2a细胞的培养条件为37℃,5%co2。
20.又,步骤1)中所述神经干细胞培养基中包括:dmem/f12培养基,添加了营养因子b27 1.5-2.5ml/100ml、n2 0.5-1.5ml/100ml和青霉素/链霉素双抗。
21.进一步,步骤2)中,在提取线粒体前,还包括线粒体检测步骤,利用荧光染色法检测待提取线粒体的形态;检测神经干细胞或neuro2a细胞中的线粒体膜电位;以活细胞的耗氧率来判定线粒体呼吸功能情况。
22.又,所述待提取线粒体的形态检测过程为:将神经干细胞或neuro2a细胞制成单细胞悬液后接种于共聚焦皿以matrigel预处理1小时,用mitotracker red工作液培养,hoechst33342染料染色,共聚焦显微镜下检测观察、拍照。
23.再,在线粒体膜电位的检测过程中,包括以下步骤:消化细胞,分别制备神经干细胞单细胞及neuro2a细胞单细胞悬液,以jc-1染料将mnsc细胞及neuro2a细胞的线粒体进行染色,经jc-1染色后利用流式细胞学法检测神经干细胞或neuro2a细胞中的线粒体膜电位。
24.优选地,步骤2)中,待提取细胞为小鼠神经干细胞时,神经球的直径为100-200μm。
25.优选地,在线粒体检测步骤中,制备的单细胞悬液中包括了培养基和相应细胞,单细胞悬液中细胞的密度为4-6
×
105个/ml。
26.线粒体来源细胞需要具备的其中一个重要特征是能够大量扩增,而符合这点要求
的有干细胞、肿瘤细胞以及某些永生化细胞。
27.neuro2a细胞是从小鼠神经母细胞瘤分离出的神经母细胞细胞系,形态呈神经元样或阿米巴样,表现出许多神经元特性,常用于神经系统疾病细胞模型的建立,并且其表现出了一些干细胞的特征,在特定的条件下可以分化,本发明以神经干细胞或neuro2a为来源细胞,均能在体外大量扩增,提取可供移植的线粒体,提取的线粒体具有正常的膜电位和形态,氧化呼吸功能保存良好,本发明从神经干细胞或neuro2a的传代细胞中提取线粒体,提取的蛋白量为180μg-200μg/107个细胞,移植后能进入到神经元细胞内,并发挥减少梗死面积、促进行为学改善的作用。
28.本发明对提取的线粒体进行了系统性的评价,评价其形态、膜电位及氧化呼吸功能,以表明所提取的线粒体具有正常的形态和功能,适合进行移植,提供了质量检测及经颈动脉给药等步骤。
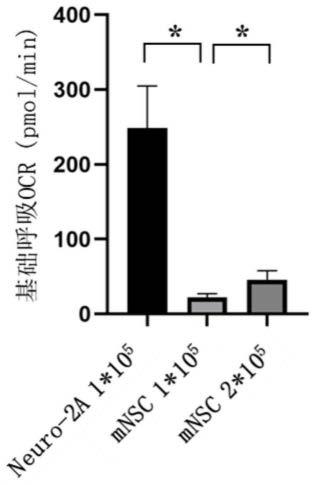
29.与现有技术相比,本发明具备如下有益效果:
30.本发明以神经干细胞或neuro2a为来源细胞提取可供移植的线粒体,这两种细胞系均能在体外大量扩增,方便进行大规模提取;提取的线粒体具有正常的膜电位,通过jc-1染色,neuro2a细胞可以维持在红绿色荧光比值为10左右,神经干细胞维持在2-3左右。
31.本发明提取的线粒体形态为棒状,并连接成网,有利于进入细胞内并替代受损的线粒体发挥作用,氧化呼吸功能保存良好,移植后能进入到神经元细胞内,并发挥减少梗死面积、促进行为学改善的作用。
32.本发明对神经干细胞和neuro2a细胞来源的线粒体进行质量检测,包括形态、膜电位、氧化呼吸功能,最大ocr较基础ocr有较高涨幅,线粒体氧化呼吸储备能力充足,神经干细胞接种密度为1
×
105个/ml时,基础ocr为22.14
±
5.09pmol/min,最大ocr为28.14
±
7.50pmol/min;神经干细胞接种密度为2
×
105个/ml时,基础ocr为45.83
±
11.85pmol/min,最大ocr为70.23
±
27.48pmol/min;neuro2a接种密度为1
×
105个/ml时,基础ocr为248.70
±
56.33pmol/min,最大ocr为363.90
±
123.70pmol/min。
附图说明
33.图1为本发明实施例1中mnsc线粒体形态,mnsc细胞线粒体,蓝色代表细胞核hoechst 33342,红色代表线粒体。
34.图2为本发明实施例2中neuro2a细胞线粒体形态,蓝色代表细胞核hoechst 33342,红色代表线粒体。
35.图3为本发明实施例1中mnsc线粒体膜电位的共聚焦显微镜检测结果,红色代表聚合态jc-1,绿色代表单体jc-1。
36.图4为本发明实施例2中中neuro2a细胞线粒体膜电位的共聚焦显微镜检测结果红色代表聚合态jc-1,绿色代表单体jc-1。
37.图5-6为本发明实施例1中neuro2a与两种密度的mnsc细胞线粒体氧化呼吸功能对比结果,其中,neuro2a(1
×
105个/ml)、mnsc(1
×
105个/ml)、mnsc(2
×
105个/ml)基础ocr柱状统计图见图5;neuro2a(1
×
105个/ml)、mnsc(1
×
105个/ml)、mnsc(2
×
105个/ml)最大ocr柱状统计图见图6。
38.图7-10为本发明实施例2中经neuro2a线粒体治疗的sd大鼠神经功能相关行为学
评分结果,其中,图7为本发明实施例2中clark一般功能损伤评分的柱状图;图8为本发明实施例2中clark局灶功能损伤评分的柱状图;图9为本发明实施例2中改良神经功能评分的柱状图;图10为本发明实施例2中bederson评分(中位数,四分位间距)的柱状图。
39.图11为本发明实施例2中经neuro2a细胞线粒体治疗的sd大鼠脑梗死面积测定结果。
40.图12-13为本发明实施例2中提纯的neuro2a细胞线粒体进入到脑内的示踪情况;其中,图12为小鼠立体定向注射红色的提纯线粒体,线粒体进入到细胞中,蓝色为细胞核;图13为大鼠脑缺血再灌注途径注射红色的提纯线粒体,线粒体进入到细胞中,蓝色为细胞核。
具体实施方式
41.以下结合具体实施例对本发明作进一步说明。
42.本发明实施例中的线粒体提取试剂盒购自thermofisher scientific公司,货号89874。
43.实施例1一种神经干细胞或neuro2a细胞来源线粒体的制备方法,包括以下步骤:
44.1.分离及培养细胞系
45.(1).小鼠神经干细胞分离及培养
46.取新生1天的c57bl/6小鼠若干,颈椎脱臼法处死,在75%酒精中浸泡5分钟,用剪刀剪下头部,放入10cm无菌培养皿中,转移至生物安全柜。剪开头皮,打开颅骨,取出大脑放入新的10cm无菌培养皿中,滴加少许hbss溶液润湿大脑,将皿置于冰上,保持细胞活性,在体视纤维镜下尽可能地去除脑膜和脑表面的血管,然后用手术刀将脑组织切成半透明的鱼肉状。将切碎的脑组织转移至15ml离心管中,1个大脑组织加入解离液5ml,所述解离液的配方为:10ml解离液体系中胶原酶iv 10mg、dnasei 1mg,其余为hbss。
47.用1000μl枪头吹打开解离液中的大脑组织,然后在37℃水浴锅中孵育10-20min。放入离心机,300g离心5min,弃去上清液,加入红细胞裂解液,吹打混匀,裂解10min,300g离心5min。加入适量小鼠神经干细胞培养基重悬,40μm网筛过滤,分装在3-5个培养瓶中,密度5
×
105/ml,所述红细胞裂解液中含nh4cl 8.02g/l,khco
3 1g/l,na2edta 37.2mg/l;小鼠神经干细胞培养基组成见表1。
48.表1小鼠神经干细胞培养基
49.成分含量b272%n21%表皮细胞生长因子egf20ng/ml碱性成纤维细胞生长因子bfgf20ng/ml谷氨酰胺glutamine2mm双抗(青/链霉素)1%dmem/f12培养基余量,定容至500ml
50.小鼠神经干细胞的悬浮培养:3-4天半量或全量换液,7天左右后待神经球形成直径为100-200μm时进行传代,传代5-10代。取细胞悬液,置入15ml离心管,静置5-10min,待细
胞自然沉降,去除上清液,加入适量accutase酶,室温孵育10min,每隔1min摇晃数次,300g离心5min。弃去上清液,用神经干细胞培养基重悬,种入培养瓶中,放入细胞培养箱,5%co2,37℃。
51.(2)培养neuro2a细胞
52.neuro2a细胞购自中国科学院典型培养物保藏委员会细胞库,按照其说明书使用含10%胎牛血清(fbs)的dmem高糖培养基培养,每隔2-3天待培养液变黄时换液,当细胞汇合度在70%-90%时进行传代、冻存或干预,培养条件:37℃,5%co2。
53.2.提取线粒体
54.采用thermofisher线粒体提取试剂盒进行提取:用胰酶消化待提取的传代细胞,收集细胞后pbs洗3次,300g离心5min,弃去上清液。加入预冷的预处理试剂a 800μl vortex最大幅度震荡5s,然后冰上孵育2min。然后加入裂解试剂b10μl,vortex 5s,冰上孵育1min,记录第1次;再vortex 5s,冰上孵育1min,记录第2次;共5次;加入800μl离心介质c,颠倒混匀,700g 4℃离心10min取上清液,转移至2ml ep管,12000g 4℃离心15min。此时线粒体沉淀在ep管圆柱体和圆锥底的交界处,倾斜ep管,在最深处吸干液体。用相应的神经干细胞培养基或含胎牛血清的dmem高糖培养基重悬线粒体沉淀,注意操作轻柔,然后立即加入到需要干预的细胞当中。
55.3.检测细胞线粒体形态
56.荧光染色检测线粒体形态,将相应的小鼠神经干细胞(mnsc)或neuro2a细胞制成单细胞悬液,种入共聚焦皿中,共聚焦皿需要基质胶matrigel预处理1小时,数量2
×
105个/ml,37℃,5%co2,培养24小时,成为单层贴壁细胞。
57.将mitotracker red粉末用dmso制备成1mm的储存液,再用无血清的培养基稀释成250nm的工作液。弃去共聚焦皿中的培养基,用pbs洗3次,加入1ml mitotracker red工作液,放入二氧化碳培养箱培养45min。弃去共聚焦皿中的培养基,pbs洗3次,加入hoechst33342染料,对贴壁细胞内的线粒体染色10min,pbs洗3次,再加入少许pbs湿润,共聚焦显微镜下观察、拍照。
58.利用mitotracker
tm red cmxros将贴壁mnsc及neuro2a细胞的线粒体染上红色后观察其形态,结果参见图1-2,发现mnsc细胞线粒体及neuro2a细胞线粒体形态主要为棒状,并连接成网。
59.4.流式细胞学检测线粒体膜电位
60.消化细胞,分别制备神经干细胞单细胞及neuro2a细胞单细胞悬液,pbs洗3次。再用0.5mlpbs重悬,加入0.5ml jc-1染色工作液,多次颠倒混匀,37℃孵育20min。孵育期间,配置1x jc-1染色缓冲液,置于冰上。孵育结束后,4℃,600g离心5min,弃去上清液,再用配置好的1x jc-1染色缓冲液洗2次。最后用300-500μl 1x jc-1染色缓冲液重悬细胞,流式上机检测。
61.利用jc-1染料将mnsc细胞及neuro2a细胞的线粒体进行染色,正常情况下,线粒体维持了一定的膜电位,jc-1染料聚集于线粒体的基质中,形成聚合物状态,呈现红色荧光;当由于某种原因导致线粒体膜电位下降,聚合状态的jc-1染料移出线粒体基质,变成单体jc-1,呈现绿光。通过共聚焦显微镜检测发现mnsc细胞的jc-1红绿荧光比例如图3所示,mnsc细胞绿色成分较多;neuro2a细胞的jc-1红绿荧光比例如图4所示,neuro2a细胞的红色
成分明显高于绿色。
62.5.细胞氧化呼吸特征检测
63.主要利用seahorse xf分析平台检测小鼠神经干细胞和neuro2a细胞线粒体的氧化呼吸功能,以活细胞的耗氧率来判定线粒体呼吸功能情况。
64.利用seahorse xf细胞线粒体压力测试试剂盒去评估neuro2a细胞和mnsc细胞线粒体的氧化呼吸功能,包括:基础呼吸、最大呼吸等,以氧气消耗速率(耗氧率oxygen consumption rate,ocr)代表呼吸速率,neuro2a与两种密度mnsc线粒体氧化呼吸功能对比结果参见图5-6,其中,neuro2a(1
×
105个/ml)、mnsc(1
×
105个/ml)、mnsc(2
×
105个/ml)基础ocr柱状统计图见图5;neuro2a(1
×
105个/ml)、mnsc(1
×
105个/ml)、mnsc(2
×
105个/ml)最大ocr柱状统计图见图6。
65.可见,neuro2a(1
×
105个/ml)的基础和最大ocr分别为:22.14
±
5.09pmol/min,28.14
±
7.50pmol/min;mnsc(2
×
105个/ml)的基础ocr为45.83
±
11.85pmol/min,最大ocr为70.23
±
27.48pmol/min;neuro2a(1
×
105个/ml)的基础ocr为248.70
±
56.33pmol/min,最大ocr为363.90
±
123.70pmol/min。
66.可见,neuro2a细胞的线粒体氧化呼吸活动明显要大于mnsc细胞。
67.实施例2 neuro2a细胞中提纯的线粒体进行体内治疗
68.1.建立.脑缺血-再灌注损伤动物模型
69.用2%浓度的戊巴比妥钠溶液将250g-280g重的sd雄性大鼠麻醉,将大鼠固定于固定板上,用75%酒精棉球消毒颈部皮肤3次,做颈部正中切口,切开腺体,分离组织,沿胸锁乳突肌分离肌肉,找到颈总动脉,逐渐分离出颈动脉分叉处、颈内动脉、颈外动脉。用6-0缝线在远离动脉分叉处远心端处结扎颈外动脉,在颈外动脉靠近分叉处夹上一个动脉夹,并且在颈总动脉和颈内动脉处分别夹上一个动脉夹。在颈外动脉缝线结扎处和颈外动脉动脉夹处,用眼科剪在动脉壁上剪开一个小口子,往心脏方向插入对应的硅胶线栓,待线栓头端到达动脉夹处,松开动脉夹,继续向前插入颈内动脉;当约二分之一的线栓头插入到颈总动脉时,双手持显微镊配合,将线栓头端翻转到颈内动脉。然后打开颈内动脉的动脉夹,继续向内、向下送入线栓,然后在颈外动脉原动脉夹处用6-0缝线打一个不太紧的活结,拔出硅胶线栓,结扎颈外动脉,松开颈总动脉动脉夹。
70.2.线粒体染色
71.采用mitotracker
tm red cmxros试剂盒对将单细胞悬液接种至共聚焦皿后贴壁生长形成的单层细胞进行染色:
72.将mitotracker
tm red cmxros粉末用dmso配置成1mm储存液,保存于-20℃,避光,用10cm培养皿培养细胞至1
×
10
7-2
×
107个/ml量的细胞,吸取上清液,用pbs洗3次;利用无血清的dmem培养基将mitotracker
tm red储存液稀释成500nm的工作液,加入到要染色的细胞中;培养箱培养45min,37℃,避光;弃去上清液,pbs洗3次,注意避光,按照实施例1中的提取方法进行线粒体提取,从1
×
107个/ml量的neuro2a细胞中提取的线粒体,其蛋白含量为180μg-200μg。
73.3.线粒体移植
74.在结扎颈外动脉前经动脉切口一次性打入从1
×
107个/ml量的neuro2a细胞中提取的线粒体,其蛋白含量为180μg-200μg,然后逐层缝合皮肤,最后将大鼠放在动物电热毯
上,注意保温。
75.4.行为学检测
76.检测对象为经neuro2a细胞提取的线粒体移植治疗或未治疗的脑卒中大鼠,用clark一般功能损伤评分、clark局灶功能损伤评分、改良神经功能评分(mnss)、bederson评分,从不同的角度来评估sd大鼠的行为学。
77.clark一般功能损伤评分的柱状图(中位数,四分位间距)见图7,假手术组为0分,模型组评分明显高于线粒体治疗组;clark局灶功能损伤评分的柱状图见图8,假手术组为0分,模型组评分明显高于线粒体治疗组;改良神经功能评分的柱状图见图9,假手术组为0分,模型组评分明显高于线粒体治疗组;bederson评分(中位数,四分位间距)的柱状图见图10,假手术组为0分,模型组评分与线粒体治疗组差异不具有统计学显著性。
78.由图7-10可见,clark一般功能损伤评分的非正态分布表示为:中位数(25%分位,75%分位),对假手术组、模型组、线粒体治疗组的clark一般功能损伤评分为:0(0,0)分、3(1.5,6)分、1(0,1)分,可见,线粒体治疗组分数明显低于模型组,差异具有统计学显著性(mann-whitney检验,p《0.05)。
79.对假手术组、模型组、线粒体治疗组的clark局灶功能损伤评分分别为:0
±
0分,8.33
±
5.57分,2.57
±
1.81分,可见,线粒体治疗组分数明显低于模型组,差异具有统计学显著性(t检验,p《0.05)。
80.假手术组、模型组、线粒体治疗组的改良神经功能评分(mnss)分别为:0
±
0分,8.56
±
3.01分,4.71
±
2.63分,可见,线粒体治疗组分数明显低于模型组,差异具有统计学显著性(t检验,p《0.05)。
81.假手术组、模型组、线粒体治疗组的bederson评分分别为:0(0,0)分、2(1,3)分、1(0,2)分,可见,线粒体治疗组与模型组差异不具有统计学显著性(mann-whitney检验,p》0.05)。
82.5.ttc检测脑梗死面积
83.取2,3,5-三苯基氯化四氮唑(ttc)粉末1g,溶于50ml pbs中,配置2%ttc溶液(一定要现配现用),用2%浓度的戊巴比妥钠溶液麻醉大鼠,麻醉后,处死大鼠,剪下头颅,放入-20℃冰箱中速冻10分钟,待鼠脑质地稍硬,放入脑槽中,每隔2mm切一片,直至小脑前。
84.将脑片放入2%ttc溶液中,37℃避光,孵育30min,每5min轻微晃动容器(或10min翻面1次),使充分染色;取出脑片用pbs溶液洗涤3次,用4%多聚甲醛固定10min,用pbs溶液洗涤2次,取出脑片,吸取表面水分,放在适合的背景布上拍照,计算梗死面积。
85.通过线栓法制作了sd大鼠脑缺血-再灌注模型(i/r model),并用neuro2a细胞提取的线粒体进行了治疗,24小时后取脑,进行ttc染色,结果参见图11,结果显示,缺血再灌注组脑梗面积百分比为26.02
±
3.24%,线粒体治疗组脑梗面积百分比为13.36
±
4.00%。
86.由三组大鼠脑梗面积的统计柱状图可见,缺血再灌注组梗死区域明显大于线粒体治疗组,差异具有统计学显著性。
87.6.提纯线粒体动物体内示踪
88.用线粒体荧光染料将neuro-2a细胞线粒体染成带红色荧光的线粒体,通过脑立体定向仪打入c57bl/6小鼠侧脑室;并且在sd大鼠脑缺血再灌注的模型中的再灌注过程中打入线粒体;24小时取脑后,做冰冻切片在共聚焦显微镜下观察、拍照,参见图12-13,结果显
示:带红色荧光的线粒体能够从脑室进入到脑实质(图12);通过颈动脉系统到达在sd大鼠脑内(图13),并且小鼠来源的线粒体能够跨物种转移到活体动物(大鼠)的细胞内(neuro-2a细胞为小鼠来源)。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
![一种吡嗪-2,3-二羧酸双[(5-氯-吡啶-2-基)-酰胺]的合成方法与流程](/upload/img/20220615/ftaah8vg9.jpg)