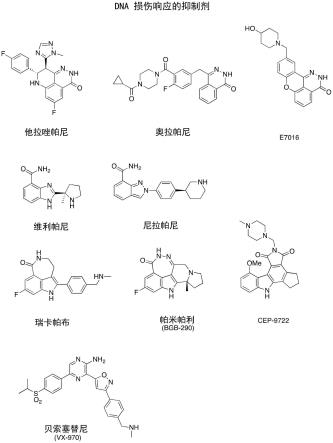
dna损伤响应的偶联抑制剂
相关申请的交叉引用
1.本技术要求2019年8月28日提交的美国临时专利申请62/893,075的优先权,将其全部内容结合入本文作参考。发明背景
2.在每个细胞周期中,dna都会受到多次损伤,例如通过活性氧、紫外线和电离辐射的作用。dna损伤响应(ddr)有多种形式,具体取决于损伤的性质。单链断裂(缺口)可以通过错配修复(mmr)、核苷酸切除修复(ner)或碱基切除修复(ber)来修复。如果在dna复制之前(必须在细胞分裂之前)未能修复单链dna断裂,则在复制过程中可能会形成高毒性的双链dna断裂。据估计,细胞每天累积约50个双链断裂,主要由活性氧诱导。双链断裂修复有两种主要途径。当姐妹染色单体可用时,在s期晚期和g2期,同源重组修复(hrr)提供无错误修复。当没有姐妹染色单体可用时,非同源末端连接(nhej)在没有模板的情况下直接连接断裂末端,这通常会导致错误和遗传信息丢失。
3.酶如brca1、brca2和palb2对于通过无错误同源重组修复(hrr)的过程修复这种双链dna断裂具有重要意义。这些蛋白质的突变大大增加了对癌症的易感性,并且在乳腺癌、卵巢癌和前列腺癌中最常见。
4.抑制dna损伤响应(ddr)是治疗癌症的潜在有价值的疗法,因为许多癌症在一个或多个单独的修复途径中存在缺陷,因此更高度依赖于剩余的功能途径。对基因毒性疗法的抗性也可能与增加的ddr信号传导有关,抑制这种信号传导可能会增强放射和基因毒性疗法。
5.parp抑制剂阻断酶聚(adp-核糖)聚合酶(parp)的作用,其是一个参与dna修复、基因组稳定性和程序性细胞死亡的蛋白质家族。parp检测单链dna断裂,例如由化学试剂或辐射引起的断裂,并通过合成聚(adp-核糖)启动修复反应,聚(adp-核糖)作为参与dna链断裂修复的酶的信号。因此,parp抑制剂会导致双链dna断裂的积累,并最终导致hrr缺陷的细胞死亡,例如brca1、brca2或palb2突变的细胞。类似地,由于hrr成分rad51的下调,缺乏肿瘤抑制因子pten的细胞可能对parp抑制敏感。
6.几种parp抑制剂已被批准用于治疗癌症,包括奥拉帕尼(olaparib)(生殖系brca突变的晚期卵巢癌患者)、瑞卡帕布(rucaparib)(brca突变卵巢癌)、尼拉帕尼(niraparib)(上皮癌、输卵管癌和原发性腹膜癌)、和他拉唑帕尼(talazoparib)(生殖系brca突变乳腺癌)。其他parp抑制剂正在临床试验中,包括维利帕尼(veliparib)(晚期卵巢癌、三阴性乳腺癌和非小细胞肺癌)、帕米帕利(pamiparib)、cep-9722(非小细胞肺癌)和e7016(黑色素瘤)。
7.ddr通路中的其他主要靶标是atm和atr激酶,它们通过下游目标(例如chk1和chk2)诱导细胞周期停滞并促进dna损伤修复。这些作用可降低细胞周期蛋白依赖性激酶(cdk)活性,从而导致g1-s、s内和g2-m细胞周期检查点的细胞周期进程减慢和停滞,从而增加了在复制或有丝分裂之前修复dna损伤的时间。atm和atr进一步诱导dna修复蛋白的转录,并通过翻译后修饰增强其活化。
8.由于它们对dna修复的影响,dna损伤响应的抑制剂也可能协同dna损伤化学治疗剂的作用,特别是拓扑异构酶抑制剂(喜树碱、伊立替康、拓扑替康、sn-38、依托泊苷和类似化合物),其导致dna链通过捕获在dna复制和转录过程中发生的拓扑异构酶-1/dna切割复合物而发生断裂;dna链交联剂,如铂络合物(奥沙利铂、顺铂、卡铂);和单链断裂诱导剂,如辐射、博来霉素和烯二炔。
9.单链dna损伤也可能由化疗药物治疗引发,因此在癌症治疗中可能与parp抑制剂协同作用。不幸的是,这些药物的不良毒性通常也是协同作用的,这极大地限制了用这些组合治疗的能力。由于不希望的毒性是由于两种药物在正常(即非肿瘤)组织中以高水平联合存在,因此需要一种方法来防止化疗药物和parp抑制剂同时全身暴露,同时提供同时肿瘤暴露。在2019年1月11日提交的未决pct专利申请pct/us19/13314“协同癌症治疗”中公开了一种实现此目的的方法。本公开使用由于增强的通透性和滞留(epr)效应而积聚在肿瘤组织中的拓扑异构酶抑制剂的可释放peg偶联物,这在2019年1月11日提交的未决pct申请pct/us19/13306“用于最小化组合剂量和验证成像剂毒性的方案”中公开。在该方法中,化疗剂可释放地与流体动力学半径约为10nm的大聚乙二醇载体偶联。由于肿瘤组织相对于正常组织的淋巴引流受损,这种纳米微粒偶联物在从全身循环和正常组织中清除的同时被捕获并积聚在肿瘤组织中。当被捕获在肿瘤中时,偶联物释放化学治疗剂,然后将其吸收到肿瘤细胞中并起到启动dna损伤的作用。一旦偶联物从全身循环中清除,然后在偶联的化学治疗剂存在于肿瘤中但不存在于正常组织中的期间提供dna损伤修复抑制剂。
10.作为一种替代方法,dna修复抑制剂也可以作为肿瘤蓄积偶联物提供,从而放大肿瘤组织中的蓄积,并最大限度地减少正常组织对dna损伤修复剂的暴露。本发明提供了这样的dna损伤修复偶联物。
技术实现要素:
11.本发明提供了适合用作治疗疾病的治疗剂的dna损伤响应抑制剂的可释放偶联物。鉴于可溶性偶联物在肿瘤组织中积累的倾向,以及通过瘤内注射将不溶性偶联物直接施用至肿瘤组织的潜力,这些偶联物有望在肿瘤中提供高局部浓度的dna损伤响应抑制剂,同时最大限度地减少全身暴露,从而改善全身毒性。
12.在个一方面,本发明因此提供了具有式(i)的dna损伤响应的偶联抑制剂m-(z*-l-d)yꢀꢀꢀ
(i)其中m是高分子运载体;y是描述与m相连的接头-药物l-d的数量的数字;z*是连接官能度;l是可释放接头;并且d是dna损伤响应抑制剂。在一些实施方式中,m是可溶性高分子运载体且y=1-8。在一些实施方式中,m是分子量1,000-100,000道尔顿的可溶性高分子运载体且y=1-8。在其他实施方式中,m是不溶性高分子运载体,y是描述d在m上的浓度的多重数。
13.在一些实施方式中,本发明提供式(i)的偶联物,其中d包含通过可释放的氨基甲酸酯基团连接至接头l的伯胺或仲胺。在另一方面,本发明提供式(i)的偶联物,其中d包含通过氨基甲酰基亚甲基连接至接头l的酰基腙。
14.在一些实施方式中,本发明提供了制备本发明化合物的方法及其在治疗疾病中的用途。
附图说明
15.图1显示各种dna损伤响应抑制剂的结构。
16.图2说明了parp抑制剂他拉唑帕尼(talazoparib)(tlz)的可释放的peg偶联物的一个实施方式,其中z*是三唑,及其制备方法。
17.图3说明了parp抑制剂他拉唑帕尼(talazoparib)(tlz)的可释放的peg偶联物的第二个实施方式,其中z*是羧酰胺,及其制备方法。
18.图4说明了parp抑制剂瑞卡帕布(rucaparib)的可释放的peg偶联物的一个实施方式,及其制备方法。
19.图5显示了可释放的peg-他拉唑帕尼(peg-tlz)对mx-1小鼠异种移植物的功效。图a显示了用单次ip剂量的可释放的peg-tlz(5、10、20或30μmol tlz/kg)与每日口服剂量的游离tlz(0.25或0.4μmol/kg tlz)治疗后的肿瘤体积。还显示了一种不可释放的聚乙二醇化tlz,它是无效的。
20.图6显示了图5中总结的实验的单个肿瘤体积。
21.图7显示了图5中总结的实验的无事件生存数据。
22.图8显示了可释放的peg-他拉唑帕尼偶联物在ph 9.4(
●
)、8.4(
■
)、7.4(
▲
)、5.0(
▼
)和ph 1.1(
◆
)下的稳定性。
23.图9a显示了不可释放的酰化他拉唑帕尼偶联物(mod=h)的稳定性。图9b显示了可释放的酰化他拉唑帕尼偶联物(r1=so2me)的释放动力学和稳定性。
24.图10显示了曼尼希碱r
7-ch
2-tlz(r7=取代的芳基)的累积,当他拉唑帕尼(bmn-673)(r7=取代的芳基)的可释放的偶联物被置于不同缓冲液中时:图a,ph 9.0;图b:ph 7.4。
25.图11显示了实施例11的不可释放的peg-他拉唑帕尼偶联物(虚线,空心圆圈)和可释放的peg-他拉唑帕尼偶联物(实心圆圈)以及从可释放偶联物中释放的游离他拉唑帕尼(三角形)在小鼠中的药代动力学研究结果。
26.图12显示了与每天28次口服剂量的游离他拉唑帕尼相比,在第0天作为单剂量给予的可释放的peg-他拉唑帕尼偶联物对kt-10(图a、b)、mx-1(图c、d)、tc-71(图e、f)、dld-1brca2-/-(图g、h)、和dld-1brca2
wt/wt
(图i、j)小鼠异种移植物的功效。
具体实施方式
27.本发明提供了具有式(i)的dna损伤响应的偶联抑制剂m-(z*-l-d)yꢀꢀꢀ
(i)其中m是高分子运载体;y是描述与m相连的接头-药物l-d的数量的数字(例如,1到多重数);z*是连接官能度;l是可释放接头;并且d是dna损伤响应抑制剂。在一些实施方式中,m是1至多重数。在一些实施方式中,m是可溶性高分子运载体且y=1-8。在一些实施方式中,m是分子量1,000-100,000道尔顿的可溶性高分子运载体且y=1-8。在一些实施方式中,m是不溶性高分子运载体,y是描述d在m上的浓度的多重数。
28.本发明的接头可释放地将抑制剂连接至运载体。在适当的条件下,接头裂解以释放游离抑制剂。在本发明的实施方式中,接头-药物具有式(ii)并通过例如美国专利第8,680,315号和第8,754,190号中公开的非水解β-消除机制释放药物(两者均以引用方式并入
本文)。其中z是允许接头-药物与高分子运载体偶联的连接基团;n=0-6;r1和r2各自独立地是h、cn、和so2r5,其中r5是任选取代的c
1-c6烷基、任选取代的芳基、任选取代的杂芳基、或n(r6)2,其中每个r6独立地是任选取代的c
1-c6烷基、任选取代的芳基、任选取代的杂芳基、或者其中n(r6)2形成4-8个原子的环;每个r4独立地是h或c
1-c3烷基或一起形成3-6元环;并且y不存在或具有式n(r7)ch2,其中r7是任选取代的c
1-c4烷基或任选取代的芳基;并且其中r1和r2至少一个不是h。在一些实施方式中,z是允许接头-药物与高分子运载体偶联的连接基团;n=1-4;r1和r2各自独立地是h、cn、或so2r5,其中r5是任选取代的c
1-c6烷基、任选取代的芳基、任选取代的杂芳基、或n(r6)2,其中每个r6独立地是任选取代的c
1-c6烷基、任选取代的芳基、任选取代的杂芳基、或其中n(r6)2形成4-8个原子的环;每个r4独立地是h或c
1-c3烷基或一起形成3-6元环;并且y不存在或具有式n(r7)ch2,其中r7是任选取代的c
1-c4烷基;并且其中r1和r2至少一个不是h。
29.应理解术语“烷基”包括1-20、1-12、1-8、1-6或1-4个碳原子的直链、支链或环状饱和烃基。在一些实施方式中,烷基是直链或支链。直链或支链烷基基团的例子包括但不限于甲基、乙基、正丙基、异丙基、正丁基、叔丁基、异丁基、仲丁基、正戊基、正己基、正庚基、正辛基、正壬基、正癸基等。在一些实施方式中,烷基是环状。环状烷基的例子包括但不限于环丙基、环丁基、环戊基、环戊二烯基、环己基等。
30.应理解术语“烷氧基”包括结合至氧的烷基基团,包括甲氧基、乙氧基、异丙氧基、环丙氧基、环丁氧基等。
31.应当理解,术语“烯基”包括具有碳-碳双键和2-20、2-12、2-8、2-6或2-4个碳原子的非芳族不饱和烃。
32.应当理解,术语“炔基”包括具有碳-碳三键和2-20、2-12、2-8、2-6或2-4个碳原子的非芳族不饱和烃。
33.应当理解,术语“芳基”包括6-18个碳、优选6-10个碳的芳烃基,包括如苯基、萘基和蒽基等基团。术语“杂芳基”包括含有3~15个碳原子和至少一个n、o或s原子,优选含有3~7个碳原子和至少一个n、o或s原子的芳环,包括如下基团:吡咯基、吡啶基、嘧啶基、咪唑基、噁唑基、异噁唑基、噻唑基、异噻唑基、喹啉基、吲哚基、茚基等。
34.在一些情况下,烯基、炔基、芳基或杂芳基部分可以通过烷基连接与分子的其余部分偶联。在这些情况下,取代基将被称为烯基烷基、炔基烷基、芳基烷基或杂芳基烷基,表示亚烷基部分位于烯基、炔基、芳基或杂芳基部分和与烯基、炔基、芳基或杂芳基偶联的分子之间。
35.应当理解,术语“卤素”或“卤代”包括溴、氟、氯和碘。
36.应理解,术语“杂环”或“杂环基”是指包含至少一个n、o或s原子的3-15元芳族或非
芳族环。实例包括但不限于哌啶基、哌嗪基、四氢吡喃基、吡咯烷和四氢呋喃基,以及为上述术语“杂芳基”提供的示例性基团。在一些实施方式中,杂环或杂环基是非芳族的。在一些实施方式中,杂环或杂环基是芳族的。
37.应理解,除非另有说明,“任选取代”是指基团可以未被取代或被一个或多个(例如,1、2、3、4或5)可以相同或不同的取代基取代。取代基的实例包括但不限于、烷基、烯基、炔基、卤素、-cn、-or
aa
、-sr
aa
、-nr
aarbb
、-no2、-c=nh(or
aa
)、-c(o)r
aa
、-oc(o)r
aa
、-c(o)or
aa
、-c(o)nr
aarbb
、-oc(o)nr
aarbb
、-nr
aa
c(o)r
bb
、-nr
aa
c(o)or
bb
、-s(o)r
aa
、-s(o)2r
aa
、-nr
aa
s(o)r
bb
、-c(o)nr
aa
s(o)r
bb
、-nr
aa
s(o)2r
bb
、-c(o)nr
aa
s(o)2r
bb
、-s(o)nr
aarbb
、-s(o)2nr
aarbb
、-p(o)(or
aa
)(or
bb
)、杂环基、杂芳基、或芳基,其中烷基、烯基、炔基、环烷基、杂环基、杂芳基、和芳基各自独立地被r
cc
任选取代,其中r
aa
和r
bb
各自独立地是h、烷基、烯基、炔基、杂环基、杂芳基、或芳基,或者r
aa
和r
bb
与它们连接的氮原子一起形成杂环基,其被烷基、烯基、炔基、卤素、羟基、烷氧基、或-cn任选取代,并且其中:每个r
cc
独立地是烷基、烯基、炔基、卤素、杂环基、杂芳基、芳基、-cn、或-no2。
38.对于本文的使用,除非另有明确说明,术语“一个”、“一个”等的使用是指一个或多个。
39.消除速率主要由基团r1和r2控制,其中至少一个是吸电子基团,例如cn或c
1-c6烷基砜、芳基砜或杂芳基砜、或磺酰胺,各自任选被取代。合适的吸电子基团的描述可以在美国专利第8,680,315号和第8,754,190号中找到。在一些实施方式中,r1和r2的至少一个是
–
cn、-so2n(ch3)2、-so2ch3、-so2ph、-so2phcl、-so2n(ch2ch2)2o、-so2ch(ch3)2、-so2n(ch3)(ch2ch3)、或-so2n(ch2ch2och3)2。在一些实施方式中,r1和r2的一个是so2r5且另外的是h。在一些实施方式中,r1和r2的一个是-so2ch3且另外的是h。在一些实施方式中,选择r1和r2以在ph 7.4、37℃下为d释放提供100-1000小时的半衰期。基团r4可以是h或任选取代的c
1-c3烷基,或两个r4一起可形成3-6元环。在一些实施方式中,每个r4独立地是-h或c
1-c3烷基。在一些实施方式中,每个r4独立地是h或甲基。在一些实施方式中,r4是h。z是允许通过与同源官能团z'反应将接头连接到高分子运载体m的官能团。z的典型例子包括卤素、叠氮化物、烯烃、炔烃、硫醇、马来酰亚胺、羰基、羧酸、胺和氨基氧基,获得m-z*-l连接,其中,当z’如下所述时,x是醚、硫醚、1,2,3-三唑、肟或羧酰胺(甲酰胺)。
40.在一些实施方式中,y不存在或是n(r7)ch2。在一些实施方式中,y不存在。在一些实施方式中,y是n(r7)ch2。在一些实施方式中,r7是任选取代的c
1-c6烷基。在一些实施方式中,r7是被c
1-c6烷氧基或
–
oh任选取代的c
1-c6烷基。在一些实施方式中,r7是
–
ch2ch2och3或
–
ch3。在一些实施方式中,r7是任选取代的芳基。在一些实施方式中,r7是任选取代的苯基。在一些实施方式中,r7被-c(o)nr
aarbb
任选取代的苯基。
41.dna损伤响应抑制剂是指干扰一种或多种修复dna链断裂的过程的化合物。。典型的dna损伤响应抑制剂抑制dna修复酶如parp、atr、或atm的活性。
42.可用于本发明的dna损伤响应抑制剂通常分为两个结构类别。在一个实施方式中,所述抑制剂包括碱性胺基团,药物通过该碱性胺基团偶联,偶联方式是通过氨基甲酸酯基团连接接头l。这些抑制剂包括例如维利帕尼(veliparib)、尼拉帕尼(niraparib)、瑞卡帕布(rucaparib),和贝索塞替尼(berzosertib)(vx-970,ve-822)。此类抑制剂产生式中的接
头-药物,其中y不存在并且d通过碱性氮连接。
43.在另一个实施方式中,dna损伤响应抑制剂不包括碱性胺基团,而是包含酰基腙,其通常为酞酮(phthalazone)(或酞嗪-1(2h)-酮)或相关的多环2,7,8,9-四氢-3h-吡啶并[4,3,2-de]酞嗪-3-酮形式。这些抑制剂可以通过使用类似于美国专利第8,754,190号中公开的那些的n-(氯甲基)氨基甲酸酯对酰基腙的nh进行烷基化来偶联以提供连接基团y=n(r8)ch2。这些抑制剂包括例如他拉唑帕尼(talazoparib)(tlz,bmn673),奥拉帕尼(olaparib),帕米帕利(pamiparib)、cep-9722和e7016。此类抑制剂产生式(ii)的接头-药物,其中y具有式n(r7)ch2。在一些实施方式中,y具有式n(r7)ch2并且d通过与d的非碱性氮原子的烷基连接连接至接头l。与us8,754,190的硫醇和苯酚偶联物相比,典型的酞酮的pka为12,需要r8=h或任选取代的c
1-c4烷基以实现由β-消除产生的中间曼尼希碱y-d的适当分解速率。这些接头-药物可以如下面实施例中所述通过(n-氯甲基)-氨基甲酸酯与通过药物与强碱(例如二异丙基氨基锂(lda),或金属六甲基二硅叠氮化物,例如钠、锂或钾hmds)反应形成的阴离子形式的药物反应来制备。也可以使用非烷基化胍碱类,例如7-甲基-1,5,7-三氮杂双环[4.4.0]癸-5-烯(mtbd)。n-(氯甲基)氨基甲酸酯可以类似于美国专利8,754,190中描述的那些制备,使用通过接头-氯甲酸酯与任选取代的胺r
7-nh2反应形成的接头-氨基甲酸酯。
[0044]
在某些实施方式中,dna损伤响应抑制剂包含碱性和非碱性氮基团两者,在这种情况下,最终获得的接头-药物将取决于用于形成产物的反应条件。例如,他拉唑帕尼包括碱性和非碱性氮两者。虽然可以用接头-氯甲酸酯酰化他拉唑帕尼以提供其中y不存在的式(ii)接头-药物,但发现这些酰化他拉唑帕尼的偶联物易于水解分解。因此,对于包含酰基腙的ddr抑制剂,优选其中y=n(r7)ch2的式(ii)化合物。
[0045]
在一个实施方式中,式(ii)的接头-药物连接至可溶性高分子运载体m以提供偶联物。m的合适例子是合成聚合物例如聚乙二醇,和天然聚合物例如葡聚糖、透明质酸和蛋白质例如随机序列蛋白质和抗体。m的一个功能是根据增强的通透性和保留(epr)效应诱导偶联药物在肿瘤组织中的积累,这依赖于发育不良的淋巴引流将纳米颗粒捕获在快速生长的肿瘤组织中。根据该机制,可以强调抗肿瘤药物向肿瘤组织的递送,并最大限度地减少非肿瘤组织的药物暴露,从而改善不良毒性。如pct申请pct/us2019/13306和pct公开wo2019/140271中所证明的,预计流体动力学半径在5到50nm之间的偶联物特别有效,使用平均分子量约为40,000道尔顿的多臂聚乙二醇制备的偶联物在肿瘤组织中显示出高积累和长寿命。在某些实施方式中,m是平均分子量在20,000和60,000道尔顿之间、流体动力学半径在5和50nm之间的聚乙二醇。在一些实施方式中,y=1-4。最优选地,m是具有4-8个臂(y=4-8)且平均分子量约为40,000道尔顿的多臂聚乙二醇。在一些实施方式中,m是平均分子量在1,000和100,000道尔顿之间的聚乙二醇。在一些实施方式中,m具有5和50nm之间的流体动力学半径。应当理解,大聚合物如聚乙二醇、葡聚糖、透明质酸等通常是多分散的;由于存在的单体单元的数量范围,它们包含具有大约平均分子量的分子量范围的物质的混合物。这种单体含量(以及因此分子量)的多分散性通常约为
±
15%、10%或5%,并且不影响用于本发明的聚合物的效用。因此,当指定平均分子量为40,000的聚乙二醇时,这描述了大约40,000
±
5,000道尔顿的多分散聚合物,其包含具有900
±
100个环氧乙烷单元的单个聚合物。在图2和3中,示例性结构显示了4臂聚合物,其中每个臂包含z个环氧乙烷单体单元;当聚合物的
平均分子量约为40,000道尔顿时,z为227
±
25。
[0046]
在另一个实施方式中,式(ii)的接头-药物连接至不溶性运载体m以提供偶联物。不溶性m的合适例子包括水凝胶贮库,作为块状材料或作为微粒悬浮液例如微球。在该实施方式中,由于m是具有极高分子量的交联聚合物,y是描述连接到不溶性m基质的接头-药物浓度的多重数。例如,当通过交联4臂聚合物形成m时,1、2、3或4个接头-药物可以连接到每个聚合物-聚合物单元。因此,可以通过使接头-药物与m以合适的比例反应来实现所需的多重数。因此,可以在m上实现合适的药物浓度。此外,m中聚合物-聚合物单元的密度可以通过选择聚合物分子量而改变;例如,由平均分子量为20kda的交联4臂peg组成的水凝胶每毫升水凝胶可允许多达5微摩尔的附着药物,而由10kda peg组成的水凝胶每毫升水凝胶可允许多达10微摩尔的附着药物。典型值在每毫升水凝胶m 0.1和50微摩尔之间的附着接头-药物,优选在每毫升0.1和10微摩尔之间。在该实施方式中,m优选包含可降解的交联键,其允许在d已释放后清除不溶性运载体。例如在美国专利9,649,385中可以找到这样的水凝胶材料和将接头-药物连接到它们的方法的例子。
[0047]
m通过官能团z*与接头-药物连接,该官能团由接头-药物上的z基团与m上的同源基团z'反应形成。z/z'的典型例子是其中一个是叠氮化物,另一个是炔烃或环辛炔,得到z*=1,2,3-三唑;一个是胺,另一个是羧酸或活性酯,得到z*=甲酰胺;一个是氯甲酸酯或活性碳酸酯,另一个是胺,得到z*=氨基甲酸酯;一个是醇,另一个是异氰酸酯,得到z*=氨基甲酸酯;一个是异氰酸酯,另一个是胺,得到z*=脲;一个是酮或醛,另一个是氨基氧基,得到z*=肟;其中一个是硫醇,另一个是马来酰亚胺或卤代羰基,得到z*=硫醚。在某些实施方式中,z*是由叠氮化物与环辛炔如氮杂二苯并环辛炔(dbco)、双环[6.1.0]壬-4-炔(bcn)或5-羟基环辛炔(5hco)的环加成得到的三唑。在一些实施方式中,提供了制备偶联的dna损伤响应抑制剂(例如式(iii)的偶联物)的方法,所述方法包括使式(ii)的接头-药物与活化的高分子运载体接触、并且任选地分离偶联物的步骤,所述活化的高分子运载体包含能够在形成连接基团z*的条件下与官能团z反应的同源官能团z'。
[0048]
在一些实施方式中,式(i)的偶联物是式(iii)的偶联物,其中m、z*、d、n、r1、r2、r4、y、和y如本文的式(i)或(ii)中所述。在一些实施方式中,z*是连接基团;n=0-6;r1和r2各自独立地是h、cn、或so2r5,其中r5是任选取代的c
1-c6烷基、任选取代的芳基、任选取代的杂芳基、或n(r6)2,其中每个r6独立地是任选取代的c
1-c6烷基、任选取代的芳基、任选取代的杂芳基、或其中n(r6)2形成4-8个原子的环;每个r4独立地是h或c
1-c3烷基或一起形成3-6元环;并且y不存在或具有式n(r7)ch2,其中r7是任选取代的c
1-c4烷基或任选取代的芳基;并且其中r1和r2的至少一个不是h。在一些实施方式中,n是1-4并
且r7是任选取代的c
1-c4烷基。
[0049]
在一些实施方式中,式(i)的偶联物是式(iv)的偶联物,其中m、z*、n、r1、r2、r4、r7、和y如本文的式(i)或(ii)中所述。在一些实施方式中,m是40-kda 4臂peg。在一些实施方式中,n是4。在一些实施方式中,z*是羧酰胺、氨基甲酸酯、肟、硫醚、或三唑。在一些实施方式中,y是4。在一些实施方式中,m是40-kda 4臂peg;n是4;z*是羧酰胺、氨基甲酸酯、肟、硫醚、或三唑;并且y是4。在一些实施方式中,m是40-kda 4臂peg;n是1;每个r4是烷基;r7是任选取代的烷基;z*是羧酰胺、氨基甲酸酯、肟、硫醚、或三唑;并且y是4。
[0050]
在一些实施方式中,式(i)的偶联物是式(v)的偶联物,其中m、z*、n、r1、r2、r4、和y如本文的式(i)或(ii)中所述。在一些实施方式中,m是40-kda 4臂peg。在一些实施方式中,n是4。在一些实施方式中,z*是羧酰胺、氨基甲酸酯、肟、硫醚、或三唑。在一些实施方式中,y是4。在一些实施方式中,m是40-kda 4臂peg;n是4;z*是羧酰胺、氨基甲酸酯、肟、硫醚、或三唑;并且y是4。在一些实施方式中,m是40-kda 4臂peg;n是1;每个r4是烷基;r7是任选取代的烷基;z*是羧酰胺、氨基甲酸酯、肟、硫醚、或三唑;并且y是4。
[0051]
在本文的描述中,应当理解,一个部分的每个描述、变体、实施方式或方面可以与其他部分的每个描述、变体、实施方式或方面组合,如同每个描述的组合被具体和单独列出一样。例如,本文提供的关于式(i)的m的每个描述、变体、实施方式或方面可以与z*、l、d和y的每个描述、变体、实施方式或方面组合,就好像每个组合都被具体和单独列出一样。还应理解,在适用的情况下,任何公式的所有描述、变化、实施方式或方面,同样适用于本文详述的其他式(如式(i)、(ii)、(iii)或(iv)),并且被同等描述,就好像每个描述、变化、实施方式或方面针对所有公式被单独和单独列出一样。例如,在适用的情况下,式(ii)的所有描
述、变化、实施方式或方面同样适用于本文详述的其他式(如式(i)、(iii)或(iv)),并且被同等描述,就好像每个描述、变化、实施方式或方面针对所有公式被单独和单独列出一样。
[0052]
可以使用本领域已知的标准方法配制本发明的偶联物。通常在3至6、优选4至5之间的ph值的制剂中观察到最佳稳定性。制剂缓冲剂可以任选地包含本领域已知的用于控制渗透压、离子强度、无菌性和稳定性的赋形剂。制剂可以作为用于注射的水溶液或作为用于重构的冻干粉提供。
[0053]
本发明的偶联物可用于治疗需要此类治疗的对象(人或动物)的各种疾病或病症。在一些实施方式中,所述疾病是癌症。在一些实施方式中,所述疾病是乳腺癌、卵巢癌或胰腺癌。
[0054]
parp抑制在治疗基因突变导致dna损伤响应缺陷的癌症中的效用,这一概念被称为“合成致死率”,已得到公认(例如,参见nijman,febs letts 2011 jan 3;585(1):1-6和其中的参考文献)。基因突变的突出例子是那些在brca1、brca2和pten基因中的突变,由于这些突变细胞对parp修复dna损伤的依赖性增加,已发现这些基因导致对parp抑制剂治疗的敏感性。在这种突变遗传背景的背景下,parp抑制剂在治疗乳腺癌、卵巢癌和胰腺癌方面取得了特别成功(zhu等,mol cancer 19,49(2020).https://doi.org/10.1186/s12943-020-01167-9)。由于本发明的偶联物提供对parp抑制剂的长期释放和暴露,因此预期它们也可用于治疗在dna损伤响应中具有此类遗传缺陷的癌症。
[0055]
parp抑制剂也被发现在与其他药物联合使用时是有效的。组合药剂的非限制性例子是:dna损伤剂包括喜树碱,例如伊立替康(irinotecan)、依沙替康(exatecan)、sn-38,以及例如美国专利7,462,627;7,744,861;8,906,353;9,855,261;10,653,689;10,016,411;和10,729,782和pct公布wo2015/155976中描述的此类试剂的偶联物;替莫唑胺(temozolomide)和其他烷化剂;免疫治疗药物,包括德瓦鲁单抗(durvalumab)、帕博利珠单抗(pembrolizumab)和纳武单抗(ivolumab);激酶抑制剂,包括atm、atr和akt抑制剂,例如帕他色替(ipatasertib)、贝索塞替尼(berzosertib)、达托里昔布(dactolisib)、azd6738、ve-821和ve-822;抗血管生成剂,例如西地尼布(cediranib);雄激素受体配体,例如恩杂鲁胺(enzalutamide)和阿比特龙(abiraterone);和放射治疗。参见例如c.pezaro,ther adv med oncol.2020;12:1758835919897537。在没有基因突变的情况下,已发现parp抑制剂与表观遗传修饰剂如dna甲基转移酶抑制剂(如二核苷抗代谢物瓜德希他滨(guadecitabine))联合使用是有效的(pulliam等人,clin cancer res.2018;24(13):3163-75)。类似地预期本发明的偶联物将在与此类药剂组合治疗癌症中有用。
[0056]
parp抑制剂已显示出对各种神经退行性疾病的活性,其中parp的过度激活会导致一种特定形式的程序性细胞死亡,称为par死亡(wang等,sci signal.2011年4月5日;4(167):ra20)。parp抑制剂在神经退行性疾病中的活性,例如色素性视网膜炎(sahaboglu等,sci.rep.2016;6:39537)、青光眼性视网膜病变和视神经视网膜病变(美国专利号6,444,676)和阿尔茨海默病(gao等,j.enzyme inhibition and med chem 2019,34:1,150-162)。
[0057]
可以通过任何途径施用偶联物,包括静脉内、腹膜内、肌内、皮下、颅内和玻璃体内。
[0058]
下面提供了某些代表性实施方式。
实施方式1.具有下式的偶联物m-(z*-l-d)y其中m是可溶性高分子运载体;y=1至8;z*是连接基团;l是可释放的接头;并且d是dna损伤响应抑制剂。实施方式2.如实施方式1的偶联物,其中d是parp抑制剂、atm抑制剂、或atr抑制剂。实施方式3.如实施方式1的偶联物,其中,其具有下式其中z*是连接基团;n=1-4;r1和r2各自独立地是h、cn、或so2r5,其中r5是任选取代的c
1-c6烷基、任选取代的芳基、任选取代的杂芳基、或n(r6)2,其中每个r6独立地是任选取代的c
1-c6烷基、任选取代的芳基、任选取代的杂芳基、或其中n(r6)2形成4-8个原子的环;每个r4独立地是h或c
1-c3烷基或一起形成3-6元环;并且y不存在或具有式n(r7)ch2,其中r7是任选取代的c
1-c4烷基;并且其中r1和r2的至少一个不是h。实施方式4.如实施方式3的偶联物,其中y不存在且d通过与d的伯胺或仲胺氮原子的氨基甲酸酯连接连接至接头l。实施方式5.如实施方式4的偶联物,其中d是瑞卡帕布、维利帕尼、尼拉帕尼、或贝索塞替尼。实施方式6.如实施方式3的偶联物,其中y具有式n(r7)ch2且d通过与d的非碱性氮原子的烷基连接连接至接头l。实施方式7.如实施方式6的偶联物,其中d是他拉唑帕尼、奥拉帕尼、帕米帕利、e7016、或cep-9722。实施方式8.如实施方式1的偶联物,其中m是分子量在1000和100,000之间的peg,并且y=1-8。实施方式9.如实施方式1的偶联物,其中m的流体动力学半径在5到50nm之间。实施方式10.如实施方式1的偶联物,其中z*是羧酰胺、氨基甲酸酯、脲,肟,硫醚、或1,2,3-三唑。实施方式11.如实施方式1的偶联物,其中选择r1和r2以在ph 7.4、37℃下为d释放提供100-1000小时之间的半衰期。实施方式12.如实施方式1的偶联物,其中,其具有下式
其中m是高分子运载体;n=1-4;z*是连接基团;r1和r2各自独立地是h、cn、或so2r5,其中r5是任选取代的c
1-c6烷基、任选取代的芳基、任选取代的杂芳基、或n(r6)2,其中每个r6独立地是任选取代的c
1-c6烷基、任选取代的芳基、任选取代的杂芳基、或其中n(r6)2形成4-8个原子的环;每个r4独立地是h或c
1-c3烷基或一起形成3-6元环;并且r7是任选取代的c
1-c3烷基;并且y=1至多重数;并且其中r1和r2的至少一个不是h。实施方式13.如实施方式12的偶联物,其中m是40-kda 4臂peg且y=4。实施方式14.如实施方式12的偶联物,其中m是40-kda 4臂peg;n=4;z*是羧酰胺、氨基甲酸酯、肟、硫醚、或三唑;且y=4。实施方式15.如实施方式1的偶联物,其中,其具有下式其中m是高分子运载体;n=1-4;z*是连接基团;r1和r2各自独立地是h、cn、或so2r5,其中r5是任选取代的c
1-c6烷基、任选取代的芳基、任选取代的杂芳基、或n(r6)2,其中每个r6独立地是任选取代的c
1-c6烷基、任选取代的芳基、任选取代的杂芳基、或其中n(r6)2形成4-8个原子的环;每个r4独立地是h或c
1-c3烷基或一起形成3-6元环;并且y=1至多重数;并且其中r1和r2的至少一个不是h。实施方式16.如实施方式15的偶联物,其中m是40-kda 4臂peg;n=4;z*是羧酰胺、氨基甲酸酯、肟、硫醚、或三唑;且y=4。实施方式17.下式的接头-药物
其中z是连接基团;n=1-4;r1和r2各自独立地是h、cn、或so2r5,其中r5是任选取代的c
1-c6烷基、任选取代的芳基、任选取代的杂芳基、或n(r6)2,其中每个r6独立地是任选取代的c
1-c6烷基、任选取代的芳基、任选取代的杂芳基、或其中n(r6)2形成4-8个原子的环;每个r4独立地是h或c
1-c3烷基或一起形成3-6元环;并且y不存在或具有式n(r7)ch2,其中r7是任选取代的c
1-c4烷基;并且d是dna损伤响应抑制剂;并且其中r1和r2的至少一个不是h。
[0059]
以下实施例说明但不限制本发明。制备a接头醇、氯甲酸酯和琥珀酰亚胺碳酸酯的合成
[0060]
某些接头醇、氯甲酸酯和琥珀酰亚胺碳酸酯的合成先前已在例如美国专利8,680,315和8,754,190以及santi等(2012)proc natl acad sci usa 109:6211-6中进行了描述。根据以下方法制备额外的接头。(1)4-叠氮基-1-氰基-3,3-二甲基-2-丁醇(n=1,r1=cn,r2=h,r4=ch3,z=n3)。
[0061]
在-30℃下,将1m叔丁醇钾的thf溶液(3.5ml,3.5mmol)添加到3-叠氮基-2,2-二甲基丙酸甲酯(根据kim,synthetic communications制备;300mg,1.9mmol)和乙腈(0.365ml,7.0mmol)的7ml thf溶液中。将混合物在-30℃搅拌30分钟,然后在1小时内升温至环境温度并再搅拌30分钟。将混合物在冰上冷却并通过加入6n hcl(0.62ml,3.7mmol)淬灭,然后在etoac和水之间分配。水相用etoac萃取2次,合并的有机物用盐水洗涤,用mgso4干燥,过滤,浓缩,得到粗品酮。
[0062]
将硼氢化钠(33mg,0.88mmol)加入到粗品酮(300mg,约1.75mmol)在7ml甲醇中的溶液中。将混合物搅拌15分钟,然后通过加入6n hcl(0.7ml)淬灭,并在etoac和水之间分配。水相用etoac萃取2次,合并的有机物用盐水洗涤,用mgso4干燥,过滤,浓缩,得到粗品醇。在sio2(20-40%etoac/己烷)上纯化,提供4-叠氮基-1-氰基-3,3-二甲基-2-丁醇(142mg,0.85mmol)。1h-nmr(cdcl3,300mhz)d 3.83-3.92(m,1h),3.43(d,j=12.1hz,1h),3.21(d,j=12.1hz,1h),2.41-2.62(m,3h),0.97(s,3h),和0.96(s,3h).(2)4-叠氮基-1-氰基-3,3-二甲基-2-氯甲酸丁酯(n=1,r1=cn,r2=h,r4=ch3,z=n3)。
[0063]
将吡啶(136ul,1.7mmol)滴加到4-叠氮基-1-氰基-3,3-二甲基-2-丁醇(142mg,0.85mmol)和三光气(425mg,1.44mmol)在冰上冷却的8ml thf中的溶液中。使所得悬浮液升温至环境温度并搅拌15分钟,然后过滤并浓缩以提供氯甲酸酯。(3)4-叠氮基-1-氰基-3,3-二甲基-2-丁基琥珀酰亚胺碳酸酯(n=1,r1=cn,r2=h,r4=ch3,z=n3)。
[0064]
将上述氯甲酸酯溶解在8ml thf中,在冰上冷却,并用n-羟基琥珀酰亚胺(291mg,2.5mmol)和吡啶(204ul,2.53mmol)处理。使所得悬浮液升温至环境温度并搅拌15分钟,然后在etoac和5%khso4之间分配。水相用etoac萃取2次,合并的有机物用盐水洗涤,用mgso4干燥,过滤,浓缩,得到粗品琥珀酰亚胺碳酸酯。在sio2(20-40%etoac/己烷)上纯化,提供4-叠氮基-1-氰基-3,3-二甲基-2-丁基琥珀酰亚胺碳酸酯(174mg,0.56mmol)。1h-nmr(cdcl3,300mhz)d 5.03(dd,j=7.0,5.1,1h),3.27-3.41(m,6h),3.43(d,j=12.1hz,1h),3.21(d,j=12.1hz,1h),2.41-2.62(m,3h),0.97(s,3h),和0.96(s,3h).
[0065]
其中n=2-6的接头从所示的相应同源化卤代酯开始制备。4-叠氮基-1-氰基-3,3-二甲基-2-戊基琥珀酰亚胺碳酸酯(n=2,r1=cn,r2=h,r4=ch3,z=n3)。(a)4-氯-2,2-二甲基丁酸乙酯。
[0066]
在配备搅拌棒、橡胶隔垫、氮气入口和热电偶探头的热风枪干燥的500ml圆底烧瓶中装入ipr2nh(5.30ml,37.4mmol,1.1当量,0.27m终浓度)和thf(100ml)。将反应混合物冷却至0℃,同时通过注射器以使得内部温度不超过 10℃的速率(~10分钟)滴加nbuli溶液(己烷中1.28m,27.8ml,35.7mmol,1.05当量,0.26m最终浓度)。将反应混合物在0℃搅拌15分钟,冷却至-78℃并通过注射器以使得内部温度不超过-65℃的速率(约5分钟)滴加异丁酸乙酯(4.6ml,4.0g,34mmol,1.0当量,0.24m终浓度)的thf溶液(5ml)。将反应混合物在
–
78℃搅拌45分钟,然后以使得内部温度不超过-68℃的速率加入1-溴-2-氯乙烷(2.8ml,34mmol,1.0当量,0.24m终浓度)的thf(5ml)溶液。将反应混合物在-78℃搅拌15分钟,使其升温至0℃,并在0℃搅拌15分钟。反应混合物用etoac(100ml)和5%khso4(100ml)稀释。分
离水相并用etoac(3
×
50ml)萃取。分离水相并用etoac(3
×
50ml)萃取。将合并的有机相用盐水洗涤,经mgso4干燥,过滤并从甲苯(10ml
×
2)中浓缩,得到4.85g(27mmol,79%)的所需氯化物,为淡黄色油状物:1h nmr(cdcl3,300mhz)δ4.14(q,j=7.2hz,2h),3.43-3.57(m,2h),1.94-2.19(m,2h),1.27(t,j=7.1hz,3h),1.22(s,6h)(b)4-叠氮基-2,2-二甲基丁酸乙酯。
[0067]
在配备搅拌棒、橡胶隔垫和氮气入口的100-ml圆底烧瓶中装入4-氯-2,2-二甲基丁酸乙酯(2-1)(4.85g,27mmol,1.0当量,0.54m终浓度)、dmso(50ml)和叠氮化钠(2.28g,35mmol,1.3当量,0.70m)。将反应混合物在防爆罩后面在70℃搅拌18小时。将反应混合物冷却至环境温度并用etoac(200ml)和h2o(100ml)稀释。分离有机相,用h2o(3
×
100ml)和盐水(100ml)洗涤,经mgso4干燥,过滤并浓缩。通过柱层析(40g硅胶柱;逐步梯度洗脱:0%、5%、10%、20%etoac/己烷)纯化得到4.33g(23.3mmol,87%)所需的叠氮化物,为淡黄色油状物。1h nmr(cdcl3,300mhz)δ4.15(q,j=7.1hz,2h),3.22-3.35(m,2h),1.81-1.96(m,2h),1.27(t,j=7.2hz,3h),1.15-1.24(m,6h)(c)5-叠氮基-1-(甲基磺酰基)-3,3-二甲基-2-戊酮。
[0068]
在配备搅拌棒、三个橡胶隔垫、热电偶探头和氮气入口针的500-ml、3颈圆底烧瓶中装入二甲基砜(5.59g,59.4mmol,2.2当量,0.42m终浓度)和thf(100ml)。将混合物在环境温度搅拌15分钟,然后在0℃冷却,同时以使得内部温度不超过 5℃的速率滴加n-buli溶液(42ml,54mmol,2.0当量,0.39m终浓度)(添加需要~10分钟)。将反应混合物在0℃搅拌15分钟,冷却至-78℃并同时通过套管以使得内部温度不超过
–
70℃的速率滴加酯(5.0g,27.0mmol,1.0当量,0.19m终浓度)的thf(10ml)溶液(需要添加约5分钟)。将反应混合物在
–
78℃搅拌10分钟,让其升温至0℃(除去水浴),并在0℃搅拌30分钟。通过tlc分析反应进程并显示起始材料转化为更具极性的产物。将反应混合物冷却至0℃,同时加入1m hcl并将反应混合物进一步用h2o(100ml)和etoac(200ml)稀释。分离水相并用etoac(3
×
100ml)萃取。合并的有机相用盐水洗涤,经mgso4干燥,过滤并浓缩,得到黄色油状物。通过柱层析(120g硅胶柱;逐步梯度洗脱:30%、40%、50%etoac/己烷)纯化得到3.49g(15.0mmol,55%产率)所需产物,为白色固体。(d)5-叠氮基-1-(甲基磺酰基)-3,3-二甲基-2-戊醇。
[0069]
向配备橡胶隔垫、搅拌棒和氮气入口的200ml回收烧瓶中装入5-叠氮基-1-(甲基磺酰基)-3,3-二甲基-2-戊酮(3.44g,14.8mmol,1.0当量,0.25m最终浓度)和甲醇(60ml)。
(30ml)水溶液稀释。分离水相并用etoac(3
×
30ml)萃取。合并的有机相用盐水(30ml)洗涤,经mgso4干燥,过滤并浓缩。通过柱色谱(80sio2;逐步梯度洗脱:50%、60%、70%、100%etoac/己烷)纯化得到318mg(0.948mmol,63%)的氨基甲酸酯,为无色油状物。1h nmr(cdcl3,300mhz)δ5.14-5.23(m,1h),5.04-5.13(m,1h),3.43-3.50(m,2h),3.32-3.41(m,6h),3.28(t,j=6.8hz,2h),3.15(m,j=4.9hz,1h),3.00(s,3h),1.78(br.s.,2h),1.51-1.69(m,2h),1.42(d,j=4.3hz,4h).lcms(esi)m/z[m na]
c12h24
n4o
5s
的计算值:337.2;实测值:337.1.
[0074]
向配备有搅拌棒和螺旋盖的20ml闪烁小瓶中装入氨基甲酸酯(150mg,0.445mmol,1.0当量,0.1m终浓度),1,2-二氯乙烷(4.5ml),多聚甲醛(27mg,0.892mmol,2当量,0.2m),和tmscl(0.23ml,1.8mmol,4当量,0.40m)。将反应混合物在50℃加热24小时。通过c18 hplc(elsd,0-100%b)监测反应进程并显示起始材料(r
t
=8.92分钟)转化为极性较小的产物(r
t
=10.89分钟)。使反应混合物冷却至环境温度,过滤,浓缩,并溶解在50%etoac/己烷(10ml)中。所得混浊溶液通过0.2μm注射式过滤器过滤并将所得滤液浓缩以提供175mg(约0.45mmol,定量产率)。将产物n-(氯甲基)氨基甲酸酯立即溶解在thf(1.8ml)中,无需进一步纯化即可使用。
[0075]
n-(氯甲基)氨基甲酸酯,其中z=叠氮化物,n=2,r1=meso2,r2=h,各r4=me,并且y=n(r7)ch2,其中r7=2-甲氧基乙基,类似地从制备a的相应接头琥珀酰亚胺碳酸酯开始制备。向配备搅拌棒、橡胶隔垫和氮气入口的25ml圆底烧瓶中装入琥珀酰亚胺碳酸酯(1.0g,2.7mmol,1.0当量,0.23m终浓度),乙腈(10.8ml),和甲氧基乙胺(0.28ml,3.2mmol,1.2当量)。将反应混合物在环境温度下搅拌,同时通过注射器滴加ipr2net(0.71ml,4.1mmol,1.5当量)。将反应混合物在环境温度搅拌30分钟。tlc分析显示碳酸盐完全转化为新产物。将反应混合物用etoac(30ml)和5%khso4(20ml)稀释。分离水相并用etoac(3
×
20ml)萃取。合并的有机相用盐水洗涤,经mgso4干燥,过滤并浓缩。通过柱层析(40g硅胶;逐步梯度洗脱:40、50、80%etoac/己烷)纯化得到828mg(2.71mmol,91%产率)所需产物,为无色油。向配备有搅拌棒和螺旋盖的20ml闪烁小瓶中装入氨基甲酸酯(153mg,0.45mmol,1.0当量,0.10m终浓度),dce(4.5ml),多聚甲醛(55mg,1.82mmol,4.0当量),和tmscl(230μl,1.82mmol,4当量)。用塑料螺帽密封小瓶并将反应混合物在50℃加热24小时。通过c18 hplc/elsd(0-100%b)监测反应进程,将反应混合物的等分试样(2μl)稀释成5mm ipr2net的丁醇溶液(200μl),并显示氨基甲酸酯(rt=8.56分钟)完全转化为极性较小的产物(rt=10.64分钟)。使反应混合物冷却至环境温度,通过棉塞过滤,浓缩,重新溶解在50%etoac/己烷(5ml)中,过滤,浓缩成淡黄色油。将粗产物溶解在thf中并立即使用而无需进一步纯化。
[0076]
可释放的接头-他拉唑帕尼的合成(式(ii)其中d=他拉唑帕尼)。在配备有搅拌棒、橡胶隔垫和氮气入口针头的10ml热风枪干燥圆底烧瓶中装入他拉唑帕尼(100mg,
0.263mmol,1.0当量,65mm终浓度)和thf(2.5ml)。将溶液冷却至-78℃,同时通过注射器缓慢滴加nahmds溶液(1m在thf中,0.26ml,0.263mmol,1.0当量,65mm终浓度)。将反应混合物在-78℃下搅拌5分钟,然后通过注射器滴加n-(氯甲基)氨基甲酸酯溶液(0.26m在thf中,1.3ml,0.342mmol,1.3当量,84mm终浓度)。将反应混合物在-78℃搅拌15分钟,在15分钟内升温至0℃,并在0℃搅拌30分钟。通过c18hplc(0-100%b,310nm)监测反应进程并显示他拉唑帕尼(r
t
=8.55分钟)转化为极性较小的产物(r
t
=10.67分钟)。反应混合物用etoac(10ml)和10%柠檬酸(10ml)稀释。分离水相并用etoac(3
×
10ml)萃取。合并的有机相用盐水(10ml)洗涤,经mgso4干燥,过滤并浓缩,得到黄色残余物。通过c18制备型hplc(35-70%b,无tfa)纯化,得到95mg(0.130mmol,50%)的所需产物(式(ii)的接头-药物,其中z=叠氮化物,n=4,r1=meso2,r2并且各个r4=h,y=n(r7)ch2,r7=2-甲氧基乙基,并且d=他拉唑帕尼),为白色固体。lcms(esi)m/z[m h]
c32h38
f2n
10
o6s的计算值:729.3;实测值:729.2.在310nm监测c
18 hplc:91%(0-100%b,r
t
=9.95分钟)。烷基化的区域化学由2d-nmr相关性确定。
[0077]
还根据以下提供的程序制备可释放的接头-他拉唑帕尼(式(ii),其中d=他拉唑帕尼)。在配备有搅拌棒、橡胶隔垫、氮气入口针头和热电偶探头的10ml热风枪干燥圆底烧瓶中装入tlz(100mg,0.263mmol,1.0当量,0.1m终浓度)和thf(2.6ml)。将混合物冷却至-78℃,同时滴加nahmds溶液(1m在thf中,0.26ml,0.26mmol,1.0当量,0.1m最终浓度),以使内部温度不升高至高于-72℃(大约2分钟)。将反应混合物在-78℃搅拌5分钟,然后以使得内部温度不高于-72℃的速率滴加接头氨基甲酸氯甲酯溶液(thf中0.5m,0.68ml,0.34mmol,1.3equiv,0.1m最终浓度)。将反应混合物在-78℃搅拌5分钟,用15分钟升温至0℃,并在0℃搅拌1小时。通过c18 hplc(0-100%超过10分钟,310nm)监测反应进程,并显示tlz(r
t
=8.43分钟)转化为极性较小的产物(r
t
=7.64分钟)。然后将反应混合物冷却至-78℃并缓慢加入0.1m tris(ph 7.5,3ml),使得内部温度不超过-50℃。尽可能在剧烈搅拌下使所得混合物升温至环境温度(除去冷浴)(水层必须解冻)。然后将混合物在etoac(30ml)和0.1m tris(ph 7.5,30ml)之间分配。分离有机层并用etoac(3
×
30ml)萃取。合并的有机相用盐水洗涤,经mgso4干燥,过滤并浓缩,得到黄色油状物。通过制备型c18 hplc(35-70%b,15分钟,310nm)纯化,得到90mg(0.141mmol,54%产率)所需偶联物,为黄色玻璃状油。
[0078]
使用类似的方法,制备式(ii)的接头-药物,其中z=叠氮化物,n=2,r1=meso2,r2=h,各个r4=me,y=n(r7)ch2,r7=2-甲氧基乙基,d=他拉唑帕尼。将tlz(22mg,0.06mmol,1当量,50mm终浓度)和thf(0.6ml)装入配备搅拌棒、隔膜螺帽和氮气入口的4-ml小瓶中。加入胍碱7-甲基-1,5,7-三氮杂双环[4.4.0]癸-5-烯(mtbd)(11μl,0.080mmol,1.3当量)并将反应混合物搅拌1-2分钟,然后加入氨基甲酸氯甲酯溶液(100mm的thf溶液(0.78ml,0.080mmol,1.3当量))。将反应混合物在环境温度搅拌1小时。通过稀释到丁醇中的5mm ipr2net(200μl)中的反应等分试样(2μl)上的c18 hplc监测反应进程。hplc分析显示tlz(rt=8.53分钟)转化为极性较小的产物(10.07分钟),总转化率约为53%(15分钟到1小时的转化率变化为5%)。将反应混合物冷却至-78℃并滴加2ml 0.1n tris(ph 7.5)。尽可能在剧烈搅拌下使所得混合物升温至环境温度。将反应混合物用etoac(10ml)和0.1n tris(ph 7.5)(10ml)稀释。分离水相并用etoac(3
×
5ml)萃取。合并的有机相用mgso4干燥,过滤并浓缩。通过制备型hplc(35-70%b,无tfa)纯化,得到14mg(0.02mmol,32%产率)所需的接
头-tlz。通过在310nm处监测的c18 hplc测量纯度:98%(0-100%b,rt=10.00分钟)。
[0079]
使用相同的方法,制备了另外的式(ii)的接头-药物,其中:z=叠氮化物,n=4,r1=meso2,r2=h,各个r4=h,y=n(r7)ch2,r7=2-甲氧基乙基,和d=奥拉帕尼;z=叠氮化物,n=4,r1=meso2,r2=h,各个r4=h,y=n(r7)ch2,r7=4-(n,n-二乙基羧酰胺)苯基,和d=他拉唑帕尼;z=叠氮化物,n=2,r1=硫代吗啉-so2,r2=h,each r4=me,y=n(r7)ch2,r7=2-甲氧基乙基,和d=他拉唑帕尼。
[0080]
可释放的peg-他拉唑帕尼偶联物的合成。将peg
40kda-[5hco]4(mecn中24.5mm,4.1ml,0.1mmol,1.0当量,25mm终浓度)和式(ii)的叠氮基-接头-他拉唑帕尼的溶液装入20ml闪烁小瓶,其中z=叠氮化物,n=4,r1=meso2,r2且各个r4=h,y=n(r7)ch2,r7=2-甲氧基乙基,并且d=他拉唑帕尼(95mg,0.130mmol,1.3当量,32mm终浓度)。将反应混合物在37℃加热24小时。通过c18 hplc(0-100%b,310nm)监测反应进程并显示接头-他拉唑帕尼(r
t
=9.95分钟)转化为更具极性的产物(r
t
=9.17分钟)。然后将反应混合物对400ml meoh透析(12,000-14,000mwco)18小时。将保留物浓缩,再溶解在thf(10ml)中,并通过缓慢加入剧烈搅拌的mtbe(100ml)中使其沉淀。通过在烧结玻璃漏斗上真空过滤收集所得固体,用mtbe(3
×
100ml)洗涤,并在高真空下干燥,得到700mg(0.064mmol tlz,64%产率)的peg偶联物,为无色残余物。在310nm监测c
18 hplc:90%(0-100%b,r
t
=9.17分钟)。
[0081]
将根据上述程序制备的可释放peg-tlz偶联物样品溶解在ph 9.0或9.4的缓冲液中,并保持在37℃。hplc分析表明游离他拉唑帕尼的释放半衰期分别为3.40和1.69小时,估计在ph 7.4的半衰期为168-135小时。相反,类似的稳定偶联物(r1为h)在ph 5.0、7.4或9.4的18小时内未显示游离他拉唑帕尼的释放。
[0082]
根据上述提供的程序(式(iii),其中z*=三唑,n=4,r1=meso2,r2且各个r4=h,y=n(r7)ch2,r7=2-甲氧基乙基,y=4,和d=他拉唑帕尼)制备的可释放peg-tlz偶联物的溶液在37℃下在ph 9.4、8.4、7.4、5.0和ph1.1的缓冲液中加热。测量每种溶液中释放的tlz级分的量,结果如图8所示。在ph 7.4至9.4范围内观察到氢氧化物催化释放。插图显示了tlz释放的ph-log
obsd
图,m=1.00,r2=0.9980。
[0083]
使用20-kda peg-dbco类似地制备式(iii)的类似偶联物并释放在ph7.4下具有对应于300小时的半衰期的他拉唑帕尼,其中z*=三唑,n=2,r1=meso2,r2=h,各个r4=me,y=n(r7)ch2,r7=2-甲氧基乙基,y=1,并且d=他拉唑帕尼。实施例2酰化他拉唑帕尼偶联物的制备及稳定性研究
[0084]
通过酰化的“不可释放”peg-他拉唑帕尼。在配备搅拌棒、橡胶隔垫和氮气入口的10ml热风枪干燥圆底烧瓶中装入他拉唑帕尼(15mg,39μmol,1.0当量)和thf(1ml),然后冷却至-78℃。通过注射器滴加nahmds溶液(1.0m在thf中,39μl,39μmol,1.0当量)并将反应混
合物在-78℃下搅拌5分钟。通过注射器滴加接头氯甲酸酯1-1溶液(thf中0.5m,94μl,47μmol,1.2当量),将反应混合物在
–
78℃下搅拌5分钟,在20分钟内升温至0℃,并在0℃下搅拌45分钟。通过c18 hplc(0-100%b,310nm)监测反应进程,并显示他拉唑帕尼(r
t
=8.36分钟)转化为极性较小的产物(r
t
=10.78分钟)。将反应混合物在etoac(10ml)和10%柠檬酸(10ml)之间分配。分离水相并用etoac(3
×
10ml)萃取。合并的有机相用盐水洗涤,经mgso4干燥,过滤并浓缩。将该粗产物溶解在mecn(2ml)中,无需进一步纯化即可使用。lcms(esi)m/z[m h]
c26h25
f2n9o3的计算值:550.2;实测值:550.1.在310nm监测c
18 hplc:90%(10%tlz;0-100%b,r
t
=10.78分钟)
[0085]
将peg
20kda-dbco(4.4mm,1.0ml,4.4μmol,1.0当量)溶液和上述稳定的接头-他拉唑帕尼溶液(mecn中23mm,240μl,5.5μmol,1.3当量)装入1.5-ml离心管。将反应混合物在37℃加热1小时。通过c18 hplc(0-100%b,310nm)监测反应进程并显示n
3-l(st)-他拉唑帕尼(r
t
=10.78分钟)和peg-dbco(r
t
=9.20分钟)转化为中间极性的产物(r
t
=9.36分钟)。将反应混合物冷却至环境温度并对400ml meoh透析(12,000-14,000mwco)24小时。将保留物浓缩成黄色残余物并溶解在mecn(2ml)中。在310nm监测c
18 hplc:83%(0-100%b,r
t
=9.36分钟)。
[0086]
通过酰化的“可释放”peg-他拉唑帕尼。在配备搅拌棒、橡胶隔垫和氮气入口的10ml热风枪干燥圆底烧瓶中装入他拉唑帕尼(8mg,20μmol,1.0当量)和thf(1ml),然后冷却至-78℃。通过注射器加入nahmds溶液(1.0m在thf中,21μl,21μmol,1.0当量)并将反应混合物在-78℃下搅拌10分钟。通过注射器滴加接头氯甲酸酯1-4溶液(thf中400m,63μl,25μmol,1.2当量),将反应混合物在
–
78℃下搅拌5分钟,在20分钟内升温至0℃,并在0℃下搅拌45分钟。将反应混合物在etoac(10ml)和h2o(10ml)之间分配。分离水相并用etoac(3
×
10ml)萃取。合并的有机相用盐水洗涤,经mgso4干燥,过滤并浓缩。该粗产物无需进一步纯化即可使用。lcms(esi)m/z c
28h29
f2n9o5s的计算值:642.2;实测值:642.1.在310nm监测c
18 hplc:50%(50:50产品:tlz;0-100%b,r
t
=10.21分钟)。
[0087]
在4ml玻璃小瓶中,将粗品接头-tlz(12mm meoh中的溶液,417μl,5.0μmol,1.0当量)溶液添加到peg
20kda-dbco溶液(mecn中4.3mm,1.8ml,7.7μmol,1.5当量)中。将反应混合物在37℃加热1小时。通过对400ml meoh透析(12,000-14,000mw co)进行16小时的纯化,并浓缩保留物,得到所需的化合物。在310nm监测c
18 hplc:93%(0-100%b,r
t
=9.28分钟)。
[0088]
在37℃、ph 9.4、7.4和5.0条件下评估偶联物1-3(mod=h)的稳定性,结果如图9a所示。偶联物在ph 5.0时相当稳定,11小时内损失2%。然而,观察到ph依赖性不稳定性,在ph 9.4和7.4时偶联物显著损失,分别损失95%和75%。偶联物1-6的稳定性也在37℃、ph 9.0和5.0下进行了评估,结果如图9b所示。可释放的偶联物(r1=so2me)在ph 9.4时表现出快速的偶联物损失,在ph 5时显著消除。实施例3具有r7=取代芳基的他拉唑帕尼的可释放偶联物
[0089]
根据上面实施例1中描述的方法,使用美国专利8,754,190的接头,即,其中r7=芳
基,制备他拉唑帕尼偶联物。在用接头-氨基甲酸氯甲酯处理之前,用nahmds使他拉唑帕尼去质子化以50-80%的转化率进行。稳定的烷基化-他拉唑帕尼偶联物表现出优异的稳定性,在37℃、ph 9.4、7.4和5.0下约15小时内没有观察到损失。如图10所示,当可释放偶联物置于缓冲液中时,在ph9.0和7.4都观察到中间体的累积。中间体通过lcms确定为曼尼希碱r
7-ch
2-tlz。在ph 7.4时,peg-偶联物的半衰期约为88小时,曼尼希碱的tlz释放估计t
1/2
为11.73小时。实施例4接头-奥拉帕尼的制备及稳定性研究
[0090]
步骤1。n-(2-甲氧基乙基)-n-氯甲基 氨基甲酸6-叠氮己酯。将多聚甲醛(37mg,1.2mmol)和三甲基氯硅烷(311μl,2.46mmol)依次添加到n-(2-甲氧基乙基)氨基甲酸6-叠氮己酯(150mg,0.615mmol,0.1m终浓度)在6ml 1,2-二氯乙烷中的溶液中。将搅拌的反应置于50℃油浴中,并通过c18hplc监测。24小时后,判断反应完成。将反应混合物浓缩至干,所得残余物用10ml 1:1etoac:己烷处理。将悬浮液通过0.2μm注射式过滤器过滤,将滤液浓缩至干,得到标题化合物粗品(187mg),为无色液体,无需进一步纯化即可使用。
[0091]
步骤2。n-(2-甲氧基乙基)-n-(亚甲基-奥拉帕尼) 氨基甲酸6-叠氮己酯。在加热枪/真空干燥的圆底烧瓶中,将奥拉帕尼(10.8mg,24.9μmol,0.02m终浓度)在n2下悬浮在1.0ml thf中。将悬浮液在-78℃丙酮/干冰浴中冷却,然后加入1.0m nahmds(30μl,30μmol)的thf溶液。在-78℃搅拌5分钟后,将反应物在空气中加热5分钟,在此期间反应物变成橙
色。冷却至-78℃后,加入0.3m n-(2-甲氧基乙基)-n-氯甲基 氨基甲酸6-叠氮己酯(108μl,32.4μmol)在thf中的溶液。移去冷浴,将橙色反应物用空气加热。在20分钟内,颜色从橙色变为亮黄色。2小时后,反应混合物在20ml 1:1etoac:h2o之间分配。分离各层,有机相用h2o和盐水(各10ml)洗涤。然后分离有机层,用mgso4干燥,过滤,并通过旋转蒸发浓缩。将粗浓缩物加载到siliasep 4g柱上,并用己烷中的丙酮(0%、20%、40%;各30ml,然后60%、80%;各40ml)逐步梯度洗脱产物。合并含有清洁产物的级分并浓缩至干,得到标题化合物(6mg,9μmol,37%产率),为无色膜。c18 hplc,在280nm处测定纯度:92.1%(rv=10.56ml)。lc-ms(m/z):计算值,691.3;观测值,691.4[m h]
.
[0092]
步骤3。n-(2-甲氧基乙基)-n-(亚甲基-奥拉帕尼) 氨基甲酸6-叠氮己酯的meo-peg
20kda-dbco三唑(不可释放的peg-奥拉帕尼)。在1.5ml埃彭多夫管中,将5mm m-peg
20kda-dbco(400μl,2.0μmol)溶液与5mm n-(2-甲氧基乙基)-n-(亚甲基-奥拉帕尼)氨基甲酸6-叠氮己酯(0.42ml,2.1μmol,2.5mm终浓度)在mecn中的溶液混合。将反应管置于37℃水浴中1小时,然后使用速度真空(speed vac)浓缩至0.1ml。将残余物用水稀释至1.0ml,并在pd miditrap柱上纯化。用水洗脱,得到1.2ml水溶液形式的标题化合物。c18 hplc,在280nm处测定纯度:93.6%(rv=10.56ml)。
[0093]
步骤1。n-(2-甲氧基乙基)-n-氯甲基 氨基甲酸7-叠氮基-1-(甲基磺酰基)-2-庚基酯。将多聚甲醛(24mg,0.80mmol)和三甲基氯硅烷(101μl,0.80mmol)依次添加到n-(2-甲氧基乙基)-n-氯甲基 氨基甲酸7-叠氮基-1-(甲基磺酰基)-2-庚酯(67mg,0.20mmol,0.2m终浓度)在1ml 1,2-二氯乙烷中的溶液中。将搅拌的反应置于50℃油浴中,并通过hplc监测。20小时后,判断反应完成。将反应混合物浓缩至干,所得残余物用1.5ml 1:1etoac:己烷处理。将悬浮液通过0.2μm注射式过滤器过滤,将滤液浓缩至干,得到标题化合物粗品(80mg),为无色液体,无需进一步纯化即可使用。
[0094]
步骤2。n-(2-甲氧基乙基)-n-(亚甲基-奥拉帕尼) 氨基甲酸7-叠氮基-1-(甲基磺酰基)-2-庚酯。在加热枪/真空干燥的圆底烧瓶中,将奥拉帕尼(44mg,0.10μmol,0.05m终浓度)在n2下悬浮在1.5ml thf中。将悬浮液在-78℃丙酮/干冰浴中冷却,然后加入1.0m nahmds(100μl,100μmol)的thf溶液。悬浮液变成紫色。在-78℃搅拌5分钟后,将反应物在空气中加热5分钟。再冷却至-78℃后,加入0.3m n-(2-甲氧基乙基)-n-氯甲基氨基甲酸-7-叠氮基-1-(甲基磺酰基)-2-庚酯(0.43ml,0.13mmol)的thf溶液。紫色立即被消耗掉,由此产生的橙色反应被空气加热。在20分钟内,颜色从橙色变为亮黄色。2小时后,反应混合物在40ml 1:1etoac:h2o之间分配。分离各层,有机相用h2o和盐水(各20ml)洗涤。然后分离有机
层,用mgso4干燥,过滤,并通过旋转蒸发浓缩。通过制备型hplc对粗浓缩物进行纯化。将含有清洁产物的级分合并并浓缩至约50%以去除mecn。所得含水浓缩物用40ml etoac萃取,有机相用h2o、nahco3(饱和水溶液)和盐水(各40ml)洗涤。然后将有机层用mgso4干燥,过滤,并通过旋转蒸发浓缩至干,得到标题化合物(20mg,26μmol,26%产率),为无色油。c18 hplc,在280nm处测定纯度:88.0%(rv=9.87ml)。lc-ms(m/z):计算值,783.3;观测值,783.4[m h]
.
[0095]
步骤3。n-(2-甲氧基乙基)-n-(亚甲基-奥拉帕尼) 氨基甲酸7-叠氮基-1-(甲基磺酰基)-2-庚酯的meo-peg
20kda-dbco三唑(可释放的peg-奥拉帕尼其中r
1=
meso2)。在1.5ml埃彭多夫管中,将5mm m-peg
20kda-dbco(0.40ml,2.0μmol)溶液与10mm n-(2-甲氧基乙基)-n-(亚甲基-奥拉帕尼)氨基甲酸7-叠氮基-1-(甲基磺酰基)-2-庚酯(0.21ml,2.1μmol,3mm终浓度)在mecn中的溶液混合。将反应管置于37℃水浴中1小时,然后使用速度真空(speed vac)浓缩至0.1ml。将残余物用h2o稀释至1.0ml,并在pd miditrap柱上纯化。用水洗脱,得到1.2ml水溶液形式的标题化合物((式(iii),其中z*=三唑,n=4,r1=meso2,r2且各个r4=h,y=n(r7)ch2,r7=2-甲氧基乙基,y=1,和d=奥拉帕尼)。c18 hplc,在280nm处测定纯度:97.2%(rv=9.29ml)。
[0096]
奥拉帕尼稳定连接的peg偶联物的体外稳定性。在1.5ml玻璃hplc小瓶中,将n-(2-甲氧基乙基)-n-(亚甲基-奥拉帕尼)氨基甲酸6-叠氮己酯的meo-peg
20kda-dbco三唑水溶液(0.1ml)添加到预热的缓冲液(0.85ml)和dmso(45μl)溶液中,该溶液含有h-lys(dnp)-oh(10mm在dmso中,5μl;内标)。将小瓶保存在加热(37℃)的hplc自动进样器中,并通过c18 hplc定期监测稳定性测定。一周后,未观察到游离的奥拉帕尼。
[0097]
奥拉帕尼从具有r1=meso2的可溶性peg偶联物中裂解的体外动力学。在两个1.5ml玻璃hplc小瓶中的每一个中,将聚乙二醇化接头-奥拉帕尼(0.1ml)的水溶液添加到缓冲液(0.85ml)和dmso(45μl)的预热混合物中,该混合物含有h-lys(dnp)-oh(10mm在dmso中,5μl,内标)。将小瓶保存在加热(37℃)的hplc自动进样器中,并通过c18 hplc定期监测β-消除反应。在37℃时,在ph 9.58硼酸盐中观察到的奥拉帕尼释放半衰期为1.56小时。使用这些数据,在ph 7.4下计算的半衰期为236小时。实施例54-臂peg-奥拉帕尼偶联物的制备
[0098]
peg
40kda-{7-[(氨甲酰氧基)-4,5,6,7,8,9-六氢-1h-环辛[d][1,2,3]三唑-1-基]-1-(甲基磺酰基)-2-庚基n-(2-甲氧基乙基)-n-(亚甲基-奥拉帕尼}4,。将10mm n-(2-甲氧基乙基)-n-(亚甲基-奥拉帕尼)氨基甲酸7-叠氮基-1-(甲基磺酰基)-2-庚酯(实施例4、2.3ml、23μmol、7mm终浓度)在mecn中的溶液与peg
40kda-[5hco]4(21.2mm环辛炔,0.94ml,20μmol环辛炔;5μmol peg;根据henise等人制备,工程报告2020年4月7日;e12213)在mecn中的溶液混合。将反应瓶用封口膜密封,置于37℃水浴中,并通过c18 hplc定期监测。52小时后,将反应混合物对meoh透析(12-14k mwco)20小时。去除保留物并浓缩至~0.2ml。将浓缩物
用1ml thf稀释,然后添加到15ml falcon管中的10ml冰冷mtbe中。将混合物在0℃下保持20分钟,然后离心(2000
×
g,1分钟)并倾析。用mtbe(2
×
10ml)洗涤固体并如上分离。将湿固体在高真空下干燥以提供呈白色固体状的标题化合物(191mg,4.31μmol peg,86%产率)。c
18 hplc,在280nm处测定纯度:97.5%(rv=9.32ml)。实施例6可释放的peg-瑞卡帕布(r1=meso2)的制备。
[0099]
叠氮-接头-瑞卡帕布的合成。在装有盖子和搅拌棒的1.5-ml玻璃小瓶依次加入琥珀酰亚胺碳酸7-叠氮基-1-(甲基磺酰基)-2-庚酯(18mg,47μmol,1.0当量,47mm终浓度),mecn(1ml),瑞卡帕布磷酸盐(20mg,47μmol,1.0当量,47mm终浓度),ipr2net(16μl,94μmol,2.0当量,94mm终浓度),和dmso(0.5ml)。将反应在环境温度搅拌30分钟。通过c
18 hplc(0-100%b,355nm)监测反应进程并显示瑞卡帕布(r
t
=7.25分钟)转化为极性较小的产物(r
t
=10.79分钟)。将反应混合物在etoac(5ml)和10%柠檬酸(5ml)之间分配。分离水相并用etoac(3
×
5ml)萃取。合并的有机相用盐水洗涤,经mgso4干燥,过滤并浓缩。通过柱色谱法(4g硅胶柱:50%、75%、100%etoac/己烷、10%丙酮/etoac)纯化得到17mg(29μmol,62%)的所需产物。lcms(esi)m/z[m h]
c28h33
fn6o5s的计算值:585.2;实测值:585.2.在355nm监测c
18 hplc:98%(0-100%b,r
t
=9.93分钟)。
[0100]
可释放的peg-瑞卡帕布偶联物的合成。将peg
20kda-dbco溶液(4.9mm、1.0ml、4.9μmol、1.0当量、4.9mm终浓度)和叠氮-接头-瑞卡帕布溶液(31mm接头-瑞卡帕布,174μl,5.4μmol,1.1当量,5.5mm终浓度)装入1.5-ml离心管。将反应混合物在37℃加热16小时。通过c18 hplc(0-100%b,355nm)监测反应进程,并显示接头-瑞卡帕布(r
t
=9.94分钟)转化为更具极性的产物(r
t
=9.23分钟)。然后将反应混合物对着400ml透析(12-14,00mwco)18小时。浓缩保留物,得到97mg peg偶联物,为无色残余物。在355nm监测c
18 hplc:96%(0-100%b,r
t
=9.23分钟)。实施例7可释放的peg-vx970(r1=meso2)的制备。
[0101]
叠氮-接头-vx970(r1=meso2)。在装有盖子和搅拌棒的1.5-ml玻璃小瓶中依次加入琥珀酰亚胺碳酸7-叠氮基-1-(甲基磺酰基)-2-庚酯(15mg,39μmol,0.9当量),mecn(0.5ml),vx970(20mg,43μmol,1.0当量),ipr2net(10μl,60μmol,1.5当量),和dmso(0.5ml)。将反应在环境温度搅拌30分钟。通过c
18 hplc(0-100%b,310nm)监测反应进程并显示vx970(r
t
=8.56分钟)转化为极性较小的产物(r
t
=10.85分钟)。反应混合物无需后处理或进一步纯化即可使用。lcms(esi)m/z[m h] c
33h40
n8o7s2的计算值:725.3;实测值725.3.在310nm监测c
18 hplc:90%(0-100%b,r
t
=10.85分钟)。
[0102]
可释放的peg-vx-970(r1=meso2)。向1.5ml离心管中加入peg
20kda-dbco(mecn中4.4mm,1.0ml,4.4μmol,1.0当量)溶液和叠氮-接头-vx970溶液(171μl,4.8μmol,1.1当量)。将反应混合物在37℃下加热30分钟,然后加入额外的peg-dbco(100μl,0.4μmol,0.1当量)。将反应混合物在37℃加热1小时。通过c18 hplc(0-100%b,310nm)监测反应进程并显示接头-vx970(r
t
=10.85分钟)转化为更具极性的产物(r
t
=9.42分钟)。使反应混合物冷却至环境温度,并对500ml meoh透析18小时(12,000-14,000mwco)。浓缩保留物,将所得白色残余物溶解在10mm naoac(ph 5)中,得到无色溶液(约4mm)。在310nm监测c
18 hplc:》98%(0-100%b,r
t
=9.42分钟)。实施例8peg-他拉唑帕尼的药代动力学研究式(iii)的偶联物其中z*=三唑,n=4,r1=meso2,r2且各个r4=h,y=n(r7)ch2,r7=2-甲氧基乙基,y=4,且d=他拉唑帕尼
[0103]
给雄性cd-1小鼠(n=20,平均体重30g)腹腔注射根据实施例1制备的可释放的peg-他拉唑帕尼(r1=so2me)或不可释放的peg-他拉唑帕尼(30μmol/kg,2.03mm,14.8ml/kg)在等渗乙酸盐(ph 5)中的溶液。在不同时间点采集血样(n=4只小鼠,200μl),立即用1m柠檬酸盐/0.1%pluronic f68(ph 4.5)溶液(获得的样品体积的10%)处理,离心得到血浆样品(100μl),在处理过程中将其保持在冰上并在-80℃下冷冻直至分析。抽血时间表如下:在1小时和24小时对小鼠1-4进行取样;在2小时和48小时对小鼠5-8取样;在4小时和72小时对小鼠9-12进行取样;在8小时和96小时对小鼠13-16进行取样;并在12小时和120小时对小鼠17-20进行取样。
[0104]
用含有15μm dnp-lys作为内标的meoh/0.5%acoh(50μl)处理每个pk样品或标准
的等分试样(10μl)。将样品剧烈涡旋、离心(21,000
×
g,4℃,10分钟),然后转移到含有h2o/0.5%acoh(200μl)的hplc小瓶中。将样品(220μl)注射到c18 hplc柱上,并用h2o/mecn/0.1%tfa(0-100%b,15分钟)洗脱。通过在冰上的小鼠血清中连续稀释peg-他拉唑帕尼(peg上1mm他拉唑帕尼;0.25mm偶联物)溶液产生标准曲线。如上所述处理和分析等分试样。峰面积对浓度作图并拟合线性方程。peg-他拉唑帕尼的lloq确定为16pmol(10μl血清中2μm)。根据标准曲线的插值峰面积计算pk样品浓度,并根据时间作图,结果如图11所示。吸收和消除半衰期通过将双指数方程拟合到加权点为1/y2的所得数据来计算。
[0105]
pk参数在下表1中提供。表1.可释放的peg-他拉唑帕尼(mod=so2me)a的pk参数apk参数源自药代动力学数据与双指数(y=c0*((exp(-k1*t)-exp(-k2*t))的拟合。bc0是通过外推t
1/2,β
获得的t=0时的理论浓度,并在上述等式中计算。cc
max
和t
max
是最大浓度和最大浓度时间。实施例9peg-他拉唑帕尼偶联物在小鼠mx-1异种移植物中的功效
[0106]
mx-1人三阴性乳腺癌细胞系获自查尔斯河实验室(charles river labs)(马里兰州弗雷德里克)。细胞在rpmi-1640、10%fbs和1%2mm l-谷氨酰胺中于37℃在95%空气/5%co2气氛中培养。
[0107]
通过将mx-1肿瘤细胞(在100μl与matrigel 1:1混合的无血清培养基中的2
×
106个细胞)皮下注射到雌性ncr裸鼠的右侧腹中来建立肿瘤异种移植物。当供体小鼠的肿瘤异种移植物达到1000-1500mm3时,将它们切除,分成均匀大小的片段(约2.5
×
2.5mm),嵌入matrigel中并通过皮下套管针植入受体小鼠重新植入。
[0108]
他拉唑帕尼(50μm)溶液的制备方法是将他拉唑帕尼在dmso(55mm,454μl)中的溶液添加到由10%二甲基乙酰胺、6%索卢妥(solutol)和84%pbs组成的口服给药缓冲液中。他拉唑帕尼含量通过10%二甲基乙酰胺、6%索卢妥和84%pbs中的ε
310nm
=9872m-1
cm-1
测定。溶液以8.5-19ml/kg口服递送以递送0.4至0.9μmol/kg他拉唑帕尼。在等渗醋酸盐(ph 5)中制备含有高达8mm他拉唑帕尼(2mm peg~[他拉唑帕尼]4)的peg-他拉唑帕尼(实施例1,r1=meso2,r7=meo(ch2)2)溶液,通过0.2μm注射器过滤器无菌过滤,tlz含量通过10%二甲基乙酰胺、6%索卢妥和84%pbs中的ε
310nm
=9872m-1
cm-1
测定。以约15ml/kg ml/kg的腹腔
注射递送剂量以递送15-120μmol药物/kg。
[0109]
当肿瘤达到约100-300mm3大小时,对携带mx-1肿瘤的小鼠进行给药。如上所述施用给药溶液。每周两次测量肿瘤体积(卡尺测量:0.5
×
(长度
×
宽度2))和体重。数据绘制为相对肿瘤体积与时间的关系,并显示为平均值 /-sem。当肿瘤达到1000-3000mm3时,给带有大肿瘤的小鼠给药。结果示于下面的图5-7和表3中。
[0110]
用于描述个体小鼠疾病的命名法是由houghton等提出的(pediatric blood&cancer,2007 49:928-40),总结于表2。根据以事件发生天数计算的肿瘤生长延迟(tgd)值,将进行性疾病(pd)分类为pd1或pd2。对于每只小鼠,通过将事件发生时间除以对照组中事件发生时间的中值来计算tgd。对于在治疗组中患有pd并发生事件的每只个体小鼠,通过将该小鼠的事件发生时间除以对照组中事件发生时间的中值来计算tgd值。根据kaplan-meier无事件生存分布估计事件发生时间的中值。表2.描述个体小鼠疾病的命名法表3 peg~tlz针对mx-1肿瘤的houghton分析*=发现死亡d14
实施例10peg-他拉唑帕尼偶联物在小鼠异种移植物中的功效
[0111]
类似于实施例9,还在鼠mx-1、kt-10、tc-71、dld-1brca2-/-、和dld-1brca2
wt/wt
异种移植物中研究了根据实施例1制备的可释放的peg-他拉唑帕尼偶联物的功效。结果如图12所示。
[0112]
以5-至40-μmol/kg的peg-他拉唑帕尼偶联物单次腹膜内注射治疗携带皮下kt-10肿瘤的小鼠群组(n=5)。每周测量肿瘤体积,并计算每组的无事件生存期(efs),其中事件定义为治疗第一天初始肿瘤体积的四倍。以40μmol/kg的剂量给药peg-他拉唑帕尼偶联物在第7天导致平均约17%的体重减轻,但所有动物在第14天恢复。peg-他拉唑帕尼偶联物的剂量依赖性肿瘤生长响应和kaplan-meier无事件生存期分布如图12a和12b所示;对照肿瘤的中位efs为11天。使用5μmol/kg tlz的peg-他拉唑帕尼偶联物,3个肿瘤显示轻微消退,中位efs为25天,所有肿瘤均发生事件。在10μmol/kg时,所有肿瘤均消退》50%,中位efs为48天,其中4/5肿瘤发生事件。在20和40μmol/kg的较高剂量的peg-他拉唑帕尼偶联物下,所有肿瘤均显示efs》8周;在用20μmol/kg治疗的组中,5个肿瘤中有4个肿瘤完全消退后又再生长,在用40μmol/kg治疗的小鼠中,5个肿瘤中有2个肿瘤完全消退后又再生长。10μmol/kg peg-他拉唑帕尼偶联物剂量的efs t/c为4.3,这使其成为抗这种肿瘤的高活性药物。-[0113]
每天口服tlz和单次腹腔内注射peg-他拉唑帕尼偶联物对携带tlz敏感brca1缺陷型mx-1肿瘤的小鼠进行治疗。peg-他拉唑帕尼偶联物的剂量依赖性肿瘤生长响应和kaplan-meier无事件生存期分布如图12c和12d所示。每日剂量为0.4μmol/kg(0.15mg/kg)tlz时,并非所有肿瘤的初始大小都增加了四倍,因此事件被定义为初始肿瘤体积增加一倍(图12d);对照肿瘤的中位2x-efs为7天,0.4μmol/kg tlz抑制生长约3周,之后肿瘤生长并在35天时达到中位efs。显然,mx-1肿瘤对tlz的敏感性不如kt-10,后者仅通过0.1mg/kg tlz每日给药就显示在12周内保持cr(26)。使用40μmol/kg tlz的peg-他拉唑帕尼偶联物,动物在第8天体重减轻约9%,5只动物中有2只死亡。剩下的3只小鼠恢复了最初的体重,并且在长达50天后没有出现肿瘤生长;审查后的已死小鼠不允许进行可靠的efs分析。小鼠耐受5至30μmol/kg的单剂量peg-他拉唑帕尼偶联物,体重没有减轻。13μmol/kg的peg-他拉唑帕尼偶联物导致31天的中位efs,这与0.4μmol(0.15mg)/kg/天的游离tlz的35天efs相似。13μmol/kg peg-他拉唑帕尼偶联物的efs t/c为4.4,表明该药物在此低剂量下具有高活性。
[0114]
每天口服tlz和单次腹腔内注射peg-他拉唑帕尼偶联物对携带tc-71肿瘤的小鼠进行治疗。浓度高达40μmol/kg的peg-他拉唑帕尼偶联物不会抑制肿瘤生长,efs曲线表明活性不显著(图12e和12f)。
[0115]
每天口服tlz和单次腹腔内注射peg-他拉唑帕尼偶联物对携带brca2-/-和dld-1brca2
wt/wt
肿瘤的小鼠进行治疗。对于brca2-/-,1次注射20μmol/kg的peg-他拉唑帕尼偶联物在抑制肿瘤生长方面与21次0.87μmol(0.33mg)/kg/天的每日剂量相同(图12g)。用10μmol/kg的peg-他拉唑帕尼偶联物治疗的动物的中位无事件生存期增加了约5倍,用每日tlz
×
21天或单剂量20μmol/kg peg-他拉唑帕尼偶联物治疗的动物的中位无事件生存期分别增加了11或13倍(图12h)。相反,brca2丰富的dld-1肿瘤对qd口服tlz或ip peg~tlz具有抗性(图12i和12j);在这里,与对照组相比,治疗动物的中位efs没有增加。
实施例114臂可释放偶联物的制备
[0116]
在20-ml闪烁小瓶中装入接头-他拉唑帕尼(实施例1)(其中z=叠氮化物,n=5,r1=meso2,r2并且各个r4=h,y=n(r7)ch2,r7=2-甲氧基乙基,并且d=他拉帕尼(392mg,0.538mmol,1.3当量,34mm最终浓度))和peg
40kda-[5hco]4溶液(15.6ml,0.414mmol,1当量,27mm终浓度)。将反应混合物在37℃加热48小时。通过c
18 hplc(0-100%b,310nm)的分析显示接头-tlz转化为极性更强的产物。然后将反应混合物对50%meoh/h2o(1l)透析18小时、对100%meoh透析4小时和对100%meoh透析4小时。将透析保留物浓缩,溶解在thf(30ml)中,并添加到搅拌的mtbe(250ml)中。将所得悬浮液在环境温度下搅拌15分钟,通过烧结玻璃漏斗真空过滤收集固体。收集的固体用mtbe(3
×
100ml)洗涤并在真空下干燥,得到2.93g(0.264mmol tlz,64%产率)白色固体状所需产物(式(iii)其中z*为三唑,n=5,r1是meso2,r2为h,各个r4为h,y为n(r7)ch2,r7为2-甲氧基乙基),d为他拉唑帕尼)。在310nm处测定c18 hplc纯度:92%(0-100%b,rt=10.39)。
[0117]
测定含有100mg/ml偶联物的溶液的peg和tlz含量。使用改进的bacl2/i2测定法(4,5)测量peg含量,使用9872m-1
cm-1
通过a310在等渗醋酸盐中测量peg~tlz含量,得到3.6的比率(95%的理论值基于peg reg)。
[0118]
在含有h-lys(dnp)-oh(10mm dmso,10μl,100μm终浓度)的动力学缓冲液(100mm硼酸盐,ph 9.4或9.0,37℃;100mm二甘氨酸(bicine),ph 8.4,37℃;100mm hepes,ph 7.4,37℃;100mm naoac,ph 5.0,37℃)中,将含有偶联物(~100μm)的溶液在37℃下加热。通过直接注射反应等分试样(10μl)并用h2o/mecn/0.1%tfa洗脱,通过c18hplc(310nm)定期监测反应进程。峰面积对时间作图。测定了在ph 7.4下对应于160小时的他拉唑帕尼释放的半衰期。实施例12z*=甲酰胺的偶联物的制备
[0119]
其中z*=甲酰胺的偶联物的制备通过制备其中r1=meso2的peg-他拉唑帕尼偶联物来说明,并且相关偶联物可以通过替换来自上述实施例的式(ii)的合适的接头-药物来制备。
[0120]
将式(ii)的叠氮-接头-他拉唑帕尼(其中z=叠氮化物,n=2,r1=meso2,r2=h,各个r4=me,y=n(r7)ch2,r7=2-甲氧基乙基,并且d=他拉唑帕尼(实施例1))溶解在thf中,在冰上冷却,并用乙酸(2.5当量)处理,然后用1.0m三甲基膦的thf溶液(5.0当量)处理。使反应继续进行直到通过hplc分析叠氮化物消失(~2小时),然后加入水(10当量)以分解中间体膦亚胺。使混合物升温至环境温度,加入20体积的甲基叔丁基醚(mtbe),并分离各相。收集水相,用mtbe洗涤,然后在真空下干燥以提供铵盐,其可以通过制备型反相hplc使用水和含有0.1%三氟乙酸的乙腈进行纯化,然后在真空下干燥。将干燥的铵盐溶解在thf中并在n2气氛下添加到4-臂40-kda peg-(琥珀酰亚胺酯)4(0.9当量琥珀酰亚胺酯,相对于铵盐)在thf中的溶液中,然后添加n,n-二异丙基-乙胺(2当量)。一旦反应完成(~1小时),通过将反应混合物缓慢加入到5体积搅拌的冰冷mtbe中沉淀产物,过滤收集,真空干燥,得到式(iii)偶联物,其中m是40-kda,4臂peg,z*是羧酰胺,n=2,r1=meso2,r2=h,各个r4=me,y=n(ch2ch2ome)ch2,d=他拉唑帕尼,且y=4。
[0121]
平均分子量为10-40kda的多种peg-琥珀酰亚胺酯是可商购的并且适用于上述方法。它们具有通式w-{[ch2ch2o]q(ch2)rcoosu}y,其中w是核心基团或封端基团,q=如上所述的每条peg链的环氧乙烷单体的数量,r=1-6,并且y=1-8。典型的w核心基团包括季戊四醇(y=4)、六甘油(y=8)、三季戊四醇(y=8)、二季戊四醇(y=6)、山梨糖醇(y=6)、甘油(y=3)、以及用于将多个peg链连接到中心点的其他多元醇。在特定实施方式中,w是季戊四醇并且y=4。典型的封端w基团包括(c
1-c6)烷氧基和碳水化合物基团。当y=2时,peg的分子式为式(suooc)(ch2)ro[ch2ch2o]q(ch2)rcoosu。
[0122]
其中z*=氨基甲酸酯的偶联物可以通过将peg-(琥珀酰亚胺酯)替换为活化的peg-碳酸酯,例如peg-(碳酸硝基苯酯)来制备。z*=脲的偶联物可以通过将peg-(琥珀酰亚胺酯)替换为peg-异氰酸酯来制备。实施例13偶联物的制备,其中m是不溶性高分子运载体
[0123]
包含通过β-消除降解的交联的水凝胶载体的制备及其作为可注射微球的制备先
前已被描述,例如在美国专利9,649,385、pct公布wo2019/152672和henise等,工程报告,2020年4月7日,e12213中。这些不溶性高分子运载体可用于按照如下已知方法制备dna损伤响应抑制剂的偶联物。在一个实施方式中,用将活化基团z'连接到氨基的试剂来处理悬浮在非反应性有机溶剂如乙腈中的包含游离氨基的水凝胶微球的无菌悬浮液。在用溶剂清洗活化的运载体m-z'以去除任何多余的试剂和副产物后,将式(ii)的接头-药物与实现接头-药物上的官能团z与活化运载体上的z'反应所需的任何其他试剂一起添加,以形成式(i)m-(z*-l-d)y的偶联物,其中m是不溶性高分子运载体,y是描述m上l-d浓度的数字。
[0124]
按照henise等(2020)的程序,水凝胶微球在乙腈中的无菌悬浮液与过量(1.5摩尔当量,超过水凝胶胺)的环辛炔试剂5-羟基环辛炔琥珀酰亚胺碳酸酯和三乙胺(4摩尔当量)反应。在环境温度下搅拌14小时后,排干悬浮液并洗涤活化的微球m-(z')y(其中z'=环辛炔)以去除多余的试剂和副产物。任何未反应的氨基都通过用乙酸酐处理来封端。接着,将1.2当量(相对环辛炔基团)的实施例1的叠氮基-接头-药物添加到反应器中,随后将反应器加热至37℃并保持90小时以完成偶联反应。然后洗涤得到的偶联物m-(z*-l-d)y以除去未反应的试剂和副产物,然后任选地交换成适合给药的制剂缓冲液。
[0125]
在本公开中引用的所有文件通过引用并入本文。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
