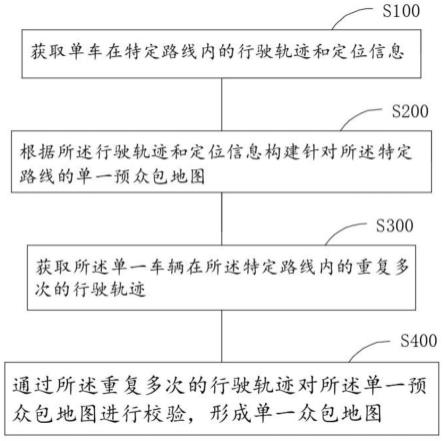
1.本发明涉及分析化学领域,是一种针对少量细胞采用微探针取样-多通道芯片纳喷-高分辨质谱技术的高灵敏、高通量脂质组学分析方法。
背景技术:
2.代谢组学是系统研究生命体受内在基因突变、病理生理改变或外在环境刺激作用时,体内多元动态的代谢物应答。细胞是生命体结构与功能的基本单位,以细胞为对象的代谢组学研究,有助于揭示生命活动的过程和规律。传统的细胞代谢组学研究为了增加细胞提取物中可量化代谢物的数量,通常使用大量细胞(如数百万个细胞)进行代谢组学分析。然而,减少代谢组学所需的细胞数量将有利于许多研究,如干细胞、循环肿瘤细胞和从组织获得的原代细胞数目稀少、很难获得;另一方面,如少量细胞的代谢组学研究可行,则不需要培养很多细胞,既可节约人力和物力,缩短试验周期,从而大大降低实验成本,同时也使得细胞生物学研究更为便捷。因此,开发针对少量细胞的代谢组学分析方法具有重要意义。
3.少量细胞代谢组学分析的挑战在于代谢物的高灵敏和高通量检测。液相色谱-质谱联用(lc-ms)技术因具有灵敏度高、特异性强、多样化等特性,已成为当前代谢组学分析研究的主流技术。然而,质谱检测前的lc色谱分离往往较为耗时,难以实现高通量分析。此外,常规的电喷雾电离源(esi)通常存在较强的基质干扰和离子抑制作用,无法满足少量细胞代谢物分析的灵敏度需求。另一方面,现已报道的少量细胞代谢组学研究中少量细胞的获取仍需从常量细胞稀释计数得到,非常不利于难以大规模培养的稀有细胞的研究,且其细胞裂解、代谢物提取等繁琐耗时的样品前处理步骤,不仅会造成样品的损失,也限制了分析通量的提高。
4.针对当前少量细胞代谢组学研究存在的难题,本发明中采用了微探针精准取样15-25个细胞,在孔板中直接加入喷雾溶剂进行脂质提取,无需复杂的样品前处理,避免了样品损失;直接进样的纳升电喷雾电离源在降低基质效应、提高检测灵敏度的同时,又具有很高的分析通量;采用的高分辨质谱拼接式分段扫描模式不仅能显著提升检测灵敏度,还能保持较高的质量精度,大大提高了代谢物定性的准确性。
技术实现要素:
5.本发明为了实现少量细胞代谢组学分析,建立了基于微探针取样-多通道芯片纳喷-高分辨质谱技术的高灵敏、高通量分析方法。该方法具有细胞取样精准、无需样品前处理、兼具高灵敏和高通量等优点。
6.为实现上述目的,本发明采用的技术方案如下:
7.(1)使用拉针仪(p-1000,sutter instrument,novato,u.s.a.)拉制毛细管微探针并固定在与三维微移动操作平台相连的移动滑轨上,借助显微镜将毛细管微探针精准移动至目标细胞的上方,在负压作用下吸取15-25个动物细胞,取样过程耗时0.4-0.6min;
8.(2)将吸取的15-25个动物细胞经注射泵注入96-384孔板中,并加入10-20μl喷雾
溶剂进行脂质提取,其在正离子模式下的组成为氯仿:甲醇:异丙醇(1:2:4,v/v/v),5mm甲酸铵和0.2%甲酸作为修饰剂;负离子模式下组成为氯仿:甲醇:异丙醇(2:3:5,v/v/v),5mm乙酸铵作为修饰剂;两者皆含有12种脂质内标,包括lpc 12:0、pc(15:0/15:0)、pe(15:0/15:0)、pg(15:0/15:0)、pa(17:0/17:0)、ps(16:0/16:0-d62)、cer(d18:1/17:0)、sm(d18:1/12:0)、tg(15:0/15:0/15:0)、dg(12:0/12:0)、choe 17:0、ffa 18:0-d3,内标物浓度为0.01-0.05μg/ml。上述混合溶液在0-4℃静置0.5-1min,完成脂质提取;
9.(3)上述脂质提取样品经多通道芯片纳喷离子源的自动进样器直接进入高分辨质谱进行分析,采用拼接式分段扫描模式采集一级质谱信息。操作条件如下:
10.①
多通道芯片纳喷离子源条件:d型芯片(喷嘴内径4.1μm);正离子模式下的喷雾电压为 1.5kv,负离子模式下的喷雾电压为-1.8kv;气压为0.6psi;进样室温度为4℃;进样体积为5μl;
11.②
高分辨组合型四级杆-轨道阱质谱条件:离子传输管温度为275℃;正离子模式下的一级m/z拼接式分段扫描窗口设置为290-390、380-480、470-570、560-610、600-650、640-690、680-730、720-770、760-810、800-850、840-940、930-1030、1020-1120、1110-1210、1200-1300da,负离子模式下则分别设置为150-250、240-340、330-430、420-520、510-610、600-650、640-690、680-730、720-770、760-810、800-850、840-940、930-1030、1020-1120、1110-1210、1200-1300da;微扫描设为3;分辨率为240k;注射时间设为200ms;动态增益控制为1e6,采集时间为0.6min;
12.(4)对(1-3)过程进行6-10次重复;采用xcalibur软件导出一级质谱数据,对数据进行峰匹配,得到包含m/z和峰强度的特征离子总峰表。扣除溶剂空白、信噪比小于10及在6-10次重复中出现频率低于80%的特征离子后,得到稳定存在的特征离子列表,将其与lipid maps数据库中的精确m/z进行匹配,质量精度设为
±
3ppm,得到可定性的脂质列表;
13.(5)向常量细胞(1
×
10
6-5
×
106)培养皿中加入1-2ml脂质提取溶剂,其在正离子模式的组成为氯仿:甲醇:异丙醇(1:2:4,v/v/v),其中5mm甲酸铵和0.2%甲酸作为修饰剂;负离子模式为氯仿:甲醇:异丙醇(2:3:5,v/v/v),其中5mm乙酸铵作为修饰剂。上述两种提取溶剂中皆含有12种脂质内标,包括lpc 12:0、pc(15:0/15:0)、pe(15:0/15:0)、pg(15:0/15:0)、pa(17:0/17:0)、ps(16:0/16:0-d62)、cer(d18:1/17:0)、sm(d18:1/12:0)、tg(15:0/15:0/15:0)、dg(12:0/12:0)、choe 17:0、ffa 18:0-d3,内标浓度为0.01-0.05μg/ml。上述混合溶液经震荡、静置、离心后的上清液即为细胞脂质提取物,其经多通道芯片纳喷离子源的自动进样器直接进入高分辨质谱进行分析,采用拼接式分段扫描模式采集一级质谱信息。对样品进行6-10次重复分析,操作条件同(3)。
14.(6)采用xcalibur软件导出上述(5)的一级质谱数据,对数据进行峰匹配,得到包含m/z和峰强度的特征离子总峰表。扣除溶剂空白、信噪比小于10及在6-10次重复中出现频率低于80%的特征离子后,得到稳定存在的特征离子列表,将其与lipid maps数据库中的精确m/z进行匹配,设置质量精度为
±
3ppm,匹配的m/z作为脂质列表进行prm二级质谱采集。操作条件如下:
15.①
多通道芯片纳喷离子源条件同(3);
16.②
高分辨组合型四级杆-轨道阱质谱条件:离子传输管温度为275℃;分辨率为120k;注射时间为200ms;动态增益控制为5e5,隔离窗口为0.4m/z;碰撞能量为10ev、20ev、
25ev、30ev、40ev;
17.对二级质谱图中的特征离子、中性丢失和/或脂肪酰基离子碎片进行逐一核对,对脂质进行详细的结构注释,由此获得常量细胞脂质数据库,包括ms和/或ms/ms信息。具有碎片信息的脂质使用ms、ms/ms定性;否则,仅用ms定性。
18.(7)将少量细胞定性脂质的m/z匹配常量细胞脂质数据库中的精确m/z,设置质量精度为
±
3ppm,若其能与常量细胞脂质数据库中含有ms、ms/ms信息的脂质匹配,则定性等级为level 1;若其能与常量细胞脂质数据库中含有ms信息的脂质匹配,则定性等级为level 2;若不能与常量细胞脂质数据库中的脂质匹配,则定性等级为level 3。如定性等级为level 3的脂质占所有定性脂质的比例小于10%,则认为仅依托少量细胞一级m/z匹配lipid maps数据库中精确m/z的定性方法可靠,后续研究则无需依托常量细胞辅助定性,可直接用于稀有细胞的代谢组学分析。
19.本发明实现了单次分析仅需2分钟的通量,从20个乳腺癌细胞中就可鉴定出超过500个脂质,具有流程简单、灵敏度高、分析通量高的特点,适合于难以获取的稀有细胞,如干细胞、循环肿瘤细胞脂质组的高灵敏、高通量分析。
20.本发明采用了微探针精准取样15-25个细胞,在孔板中直接加入喷雾溶剂完成脂质提取,无需样品前处理,尽可能避免了样品损失;直接进样的纳升电喷雾电离源在降低基质效应、提高检测灵敏度的同时,又具有很高的分析通量;采用的高分辨质谱拼接式分段扫描模式不仅能进一步提升检测灵敏度,还能保持较高的质量精度,大大提高了代谢物定性的准确性。
附图说明
21.图1(a)少量细胞的脂质定性策略;(b)常量细胞脂质数据库的构建流程示意图。
22.图2拼接式分段扫描的m/z质量窗口设置示意图。
23.图3正、负离子模式少量(20个)细胞定性的不同类别脂质百分比。
24.图4 20个mcf7细胞的定性脂质在常量细胞脂质数据库中的验证结果示意图。
25.图5mcf7、mhcc97h及vcap三种癌症细胞中p《0.05的脂质的主成分分析得分图。
具体实施方式
26.下面结合附表附图对本发明的实施例作详细说明:实施例在以本发明技术方案为前提下进行实施,给出了详细的实施方式和具体的操作过程,但本发明的保护范围不限于下述的实施例。
27.实施例一
28.基于微探针取样-多通道芯片纳喷-高分辨质谱技术的少量细胞脂质组学高灵敏、高通量分析方法建立的流程图如图1所示,具体实施步骤如下:
29.(1)20个mcf7细胞取样:
30.使用拉针仪(p-1000,sutter instrument,novato,u.s.a.)拉制毛细管微探针(针尖内径5-10μm)并固定在与三维微移动操作平台相连的移动滑轨上,借助显微镜将毛细管微探针精准移动至目标细胞的上方,在负压作用下吸取20个乳腺癌细胞(mcf7),重复取样6次;
31.(2)脂质提取:
32.将吸取的20个mcf7细胞经注射泵注入96孔板中,并加入15μl喷雾溶剂进行脂质提取,其正离子模式下组成为氯仿:甲醇:异丙醇(1:2:4,v/v/v),内含5mm甲酸铵和终体积浓度0.2%甲酸作为修饰剂;负离子模式下组成为氯仿:甲醇:异丙醇(2:3:5,v/v/v),内含5mm乙酸铵作为修饰剂;上述两种喷雾溶剂中皆含有12种脂质内标,包括lpc 12:0、pc(15:0/15:0)、pe(15:0/15:0)、pg(15:0/15:0)、pa(17:0/17:0)、ps(16:0/16:0-d62)、cer(d18:1/17:0)、sm(d18:1/12:0)、tg(15:0/15:0/15:0)、dg(12:0/12:0)、choe 17:0、ffa 18:0-d3,内标物浓度为0.01-0.05μg/ml。上述混合溶液在4℃静置1min,完成脂质提取;
33.(3)直接进样-高分辨质谱采集:
34.上述脂质提取物样品经多通道芯片纳喷离子源的自动进样器直接进入高分辨质谱进行分析,采用拼接式分段扫描模式采集一级质谱信息。m/z质量窗口分段式扫描设置如图2所示。
35.①
多通道芯片纳喷离子源条件:d型芯片(喷嘴内径4.1μm);正离子模式下的喷雾电压为 1.5kv,负离子模式下喷雾电压为-1.8kv;气压为0.6psi;进样室温度为4℃;进样体积为5μl;
36.②
高分辨组合型四级杆-轨道阱质谱条件:离子传输管温度为275℃;正离子模式下拼接式分段扫描的质量窗口设置为290-390、380-480、470-570、560-610、600-650、640-690、680-730、720-770、760-810、800-850、840-940、930-1030、1020-1120、1110-1210、1200-1300da,负离子模式下拼接式分段扫描的质量窗口设置为150-250、240-340、330-430、420-520、510-610、600-650、640-690、680-730、720-770、760-810、800-850、840-940、930-1030、1020-1120、1110-1210、1200-1300da;微扫描设为3;分辨率为240k;注射时间设为200ms;动态增益控制为1e6,采集时间为0.6min;
37.(4)脂质定性:
38.采用xcalibur软件导出一级质谱数据,对数据进行峰匹配,得到包含m/z和峰强度的特征离子总峰表。扣除溶剂空白、信噪比小于10及在6次重复中出现频率低于80%的特征离子后,得到稳定存在的特征离子列表,将其与lipid maps数据库中的精确m/z进行匹配,质量精度设置为
±
3ppm,得到可定性的脂质,见表1、2和图3;
39.(5)常量(5
×
106)mcf7细胞脂质提取:
[0040]5×
106个mcf7细胞样品于培养皿中,依次移走培养液、pbs清洗三次后,加入1ml脂质提取溶剂,其正离子模式下组成为氯仿:甲醇:异丙醇(1:2:4,v/v/v),内含5mm甲酸铵和0.2%甲酸作为修饰剂;负离子模式下组成为氯仿:甲醇:异丙醇(2:3:5,v/v/v),内含5mm乙酸铵作为修饰剂;两种提取溶剂中皆含有12种脂质内标,包括lpc 12:0、pc(15:0/15:0)、pe(15:0/15:0)、pg(15:0/15:0)、pa(17:0/17:0)、ps(16:0/16:0-d62)、cer(d18:1/17:0)、sm(d18:1/12:0)、tg(15:0/15:0/15:0)、dg(12:0/12:0)、choe 17:0、ffa 18:0-d3,内标浓度为0.01-0.05μg/ml。将上述混合溶液转移至2ml ep管中,涡旋10s,震荡10min,4℃静置10min,14000g条件下离心10min,取上清液(即为常量细胞的脂质提取物)800μl待进样分析;
[0041]
(6)常量mcf7细胞直接进样-高分辨质谱一级采集:
[0042]
常量细胞脂提物样品经多通道芯片纳喷离子源的自动进样器直接进入高分辨质
谱进行分析,采用拼接式分段扫描模式采集一级质谱信息,并对样品进行6次重复分析,操作条件同(3);
[0043]
(7)常量mcf7细胞直接进样-高分辨质谱二级采集:
[0044]
上述(6)的一级质谱数据经xcalibur软件导出,采用自主编写的python程序对数据进行峰匹配,得到包含m/z和峰强度的特征离子总峰表。扣除溶剂空白、信噪比小于10及在6次重复中出现频率低于80%的特征离子后,得到稳定存在的特征离子列表,将其与lipid maps数据库中精确m/z进行匹配,设置质量精度为
±
3ppm,匹配后的特征离子作为脂质列表进行prm的二级质谱采集。多通道芯片纳喷离子源-高分辨质谱的操作条件如下:
[0045]
①
多通道芯片纳喷离子源条件同(3);
[0046]
②
高分辨组合型四级杆-轨道阱质谱条件:离子传输管温度为275℃;分辨率为120k;注射时间为200ms;动态增益控制为5e5,隔离窗口为0.4m/z;碰撞能量为10ev、20ev、25ev、30ev、40ev;
[0047]
(8)常量mcf7细胞脂质数据库的建立:
[0048]
对二级质谱图中的特征离子、中性丢失和/或脂肪酰基离子碎片进行逐一核对,对脂质进行详细的结构注释,由此获得常量细胞脂质数据库,包括ms和/或ms/ms信息。具有碎片信息的脂质使用ms、ms/ms定性;否则,仅用ms定性。
[0049]
(9)基于常量细胞脂质数据库对20个mcf7细胞定性脂质进行验证:
[0050]
20个mcf7细胞定性脂质的m/z匹配常量mcf7细胞脂质数据库的精确m/z,设置质量精度为
±
3ppm,若其能与常量细胞脂质数据库中含有ms、ms/ms信息的脂质匹配,则定性等级为level 1;若其能与常量细胞脂质数据库中含有ms信息的脂质匹配,则定性等级为level 2;若不能与常量细胞脂质数据库中的脂质匹配,则定性等级为level 3,验证结果见图4。
[0051]
实施例二
[0052]
不同癌症细胞(乳腺癌细胞mcf7、肝癌细胞mhcc97h、前列腺癌细胞vcap)分型:
[0053]
(1)20个不同癌症细胞取样:
[0054]
使用拉针仪(p-1000,sutter instrument,novato,u.s.a.)拉制毛细管微探针(针尖内径5-10μm)并固定在与三维微移动操作平台相连的移动滑轨上,借助显微镜将毛细管微探针精准移动至目标细胞的上方,在负压作用下分别吸取20个乳腺癌细胞mcf7、肝癌细胞mhcc97h、前列腺癌细胞vcap细胞,每种癌症细胞分别进行10次取样;
[0055]
(2)脂质提取:
[0056]
将分别吸取的20个mcf7、mhcc97h、vcap细胞经注射泵注入96孔板中,并加入15μl喷雾溶剂进行脂质提取,其正离子模式下组成为氯仿:甲醇:异丙醇(1:2:4,v/v/v),内含5mm甲酸铵和0.2%甲酸作为修饰剂;负离子模式下组成为氯仿:甲醇:异丙醇(2:3:5,v/v/v),内含5mm乙酸铵作为修饰剂;上述两种喷雾溶剂中皆含有12种脂质内标,包括lpc 12:0、pc(15:0/15:0)、pe(15:0/15:0)、pg(15:0/15:0)、pa(17:0/17:0)、ps(16:0/16:0-d62)、cer(d18:1/17:0)、sm(d18:1/12:0)、tg(15:0/15:0/15:0)、dg(12:0/12:0)、choe 17:0、ffa18:0-d3,内标物浓度为0.01-0.05μg/ml。上述混合溶液在4℃静置1min,完成脂质提取;
[0057]
(3)直接进样-高分辨质谱采集:
[0058]
上述脂质提取物样品经多通道芯片纳喷离子源的自动进样器直接进入高分辨质
谱进行分析,采用拼接式分段扫描模式采集一级质谱信息。
[0059]
①
多通道芯片纳喷离子源条件:d型芯片(喷嘴内径4.1μm);正离子模式下的喷雾电压为 1.5kv,负离子模式下喷雾电压为-1.8kv;气压为0.6psi;进样室温度为4℃;进样体积为5μl;
[0060]
②
高分辨组合型四级杆-轨道阱质谱条件:离子传输管温度为275℃;正离子模式下拼接式分段扫描的质量窗口设置为290-390、380-480、470-570、560-610、600-650、640-690、680-730、720-770、760-810、800-850、840-940、930-1030、1020-1120、1110-1210、1200-1300da;微扫描设为3;分辨率为240k;注射时间设为200ms;动态增益控制为1e6,采集时间为0.6min;
[0061]
(4)脂质定性:
[0062]
采用xcalibur软件导出一级质谱数据,对数据进行峰匹配,得到包含m/z和峰强度的特征离子总峰表。扣除溶剂空白、信噪比小于10及在10次重复中出现频率低于80%的特征离子后,得到稳定存在的特征离子列表,将其与lipid maps数据库中的精确m/z进行匹配,质量精度设置为
±
3ppm,分别得到不同癌症细胞中可定性的脂质(表1、2);
[0063]
(5)统计学分析:
[0064]
将不同癌症细胞中可定性的脂质校正至样本的总响应强度,使用student’s t检验进行显著性分析,选取p《0.05的脂质进行主成分分析(图5),可以看出不同癌症细胞得到了有效区分,表明不同癌症细胞的脂质组成及相对含量有明显差别。
[0065]
表1正离子模式20个mcf7细胞中定性的脂质信息。
[0066]
表2负离子模式20个mcf7细胞中定性的脂质信息。
[0067]
表1.正离子模式20个mcf7细胞中定性的脂质信息
[0068][0069]
表1.正离子模式20个mcf7细胞中定性的脂质信息(续)
[0070][0071]
表1.正离子模式20个mcf7细胞中定性的脂质信息(续)
[0072][0073]
表1.正离子模式20个mcf7细胞中定性的脂质信息(续)
[0074][0075]
表1.正离子模式20个mcf7细胞中定性的脂质信息(续)
[0076][0077]
表1.正离子模式20个mcf7细胞中定性的脂质信息(续)
[0078][0079]
表1.正离子模式20个mcf7细胞中定性的脂质信息(续)
[0080][0081]
表1.正离子模式20个mcf7细胞中定性的脂质信息(续)
[0082][0083]
表1.正离子模式20个mcf7细胞中定性的脂质信息(续)
[0084][0085]
表2.负离子模式20个mcf7细胞中定性的脂质信息
[0086][0087]
表2.负离子模式20个mcf7细胞中定性的脂质信息(续)
[0088][0089]
表2.负离子模式20个mcf7细胞中定性的脂质信息(续)
[0090][0091]
表2.负离子模式20个mcf7细胞中定性的脂质信息(续)
[0092][0093]
表2.负离子模式20个mcf7细胞中定性的脂质信息(续)
[0094][0095]
表2.负离子模式20个mcf7细胞中定性的脂质信息(续)
[0096]
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。