通关藤苷g在制备预防和/或治疗骨性关节炎药物中的应用
技术领域
1.本发明属于预防骨性关节炎药物制备技术领域,具体涉及通关藤苷g在制备预防和/或治疗骨性关节炎药物中的应用。
背景技术:
2.通关藤为萝蘑科植物通关藤(marsdenia tenacissima)的干燥藤茎,秋、冬二季采收,具有止咳平喘、祛痰、通乳以及清热解毒的功效,用于喘咳痰多、产后乳汁不通、风湿肿痛以及疮痈,是一种广泛分布于亚洲许多热带和亚热带地区的草本植物。现代药理研究表明,通关藤在抗炎解毒、止咳平喘、抗艾滋病毒和抗癌方面的效果均显著。通关藤苷g,是从通关藤中分离出的天然提取物,由藤麻茎经水提醇沉纯化而成,具有多种活性作用。研究资料显示通关藤苷g有抗炎、抗癌和抗肿瘤等方面的作用,当前,未见通关藤苷g预防骨性关节炎相关的报道。
3.骨性关节炎(osteoarthritis,oa)是一系列复杂、动态的生物学和力学因素共同作用下的非炎症性的退行性关节病变,软骨的退变是骨关节炎发病的核心因素。当前对于oa的发病机制尚不明确,但是许多研究表明oa和炎性通路密切相关。其中的nf-κb转录因子通过调节下游炎症介质如肿瘤坏死因子-α、白细胞介素和基质金属蛋白酶(mmps),并在关节退化和炎症过程中激活软骨细胞,促进关节软骨分解,广泛参与oa病理生理,从而影响其进程,由此可发现nf-κb通路在oa分子机制中的重要地位。其中炎性细胞因子il-1β和tnf-α在oa的病理发展中起关键作用,il-1β通过下调了细胞外基质(ecm)主要成分ii型胶原和蛋白多糖的合成,抑制软骨细胞的合成活性,同时还可刺激软骨细胞释放基质金属蛋白酶如mmp-13,通过破坏关节软骨细胞的中ii型胶原和蛋白多糖加速软骨细胞外基质(ecm)的降解。此外,il-1β刺激软骨细胞可诱导cox-2和一氧化氮合酶(inos)的释放,直接刺激关节软骨、滑膜组织、关节液前列腺素e2(pge2)和一氧化氮(no)的过量生成,这也是造成oa患者疼痛的主要原因之一。同时有研究表明在oa患者的滑液滑膜、软骨下骨和软骨中检测il-1β和tnf-α和水平显著升高。因此,有理由相信以nf-κb通路为治疗靶点抑制il-1β和tnf-α所诱导的炎症介质可能会减弱oa的进展。
4.当前临床中治疗oa主要集中在疼痛缓解方面,治疗方式包括口服非甾体抗炎药(nsaids)和关节内注射透明质酸和类固醇,在疾病终末期的治疗策略是关节置换手术。但目前尚无有效药物可以对oa造成的软骨破坏进行修复治疗。因此,急需确定一种能够预防或治疗oa药物来缓解和逆转oa的病程进展。有研究表明中医药治疗在改善膝关节oa治疗中的疼痛、功能和健康方面是安全有效的,且与标准的西方治疗相比,中医显示出较低的不良事件风险。这是中医药具备的独特优势。因此如何深入研究中药预防或治疗oa,成为我们解决问题的重要手段之一。
技术实现要素:
5.为了克服上述现有技术的缺点,本发明的目的在于提供通关藤苷g在制备预防和/
或治疗骨性关节炎药物中的应用。
6.为了达到上述目的,本发明采用以下技术方案予以实现:
7.本发明公开了通关藤苷g在制备预防和/或治疗骨性关节炎药物中的应用。
8.优选地,所述的药物为抑制炎症因子释放的药物。
9.优选地,所述的药物为保护关节软骨的药物。
10.优选地,所述的药物为减轻关节疼痛的药物。
11.优选地,所述的药物为治疗骨性关节炎、滑膜炎或关节退变疾病的药物。
12.优选地,所述的药物用于治疗骨性关节炎时,动物给药量为4-16μg/kg。
13.本发明还公开了一种预防和/或治疗骨性关节炎的药物,所述药物是由通关藤苷g及药学上可接受的辅料制成。
14.优选地,所述辅料包括淀粉、乳糖、微晶纤维素、糊精、磷酸钙、聚乙二醇-4000、聚乙二醇-6000、羧甲基纤维素钠、羟丙纤维素或交联聚维酮中一种以上。
15.优选地,所述药物的剂型为片剂、胶囊剂、颗粒剂、注射剂或丸剂。
16.进一步优选地,所述注射剂中,通关藤苷g由纯度》98%的通关藤苷g溶于10%dmso制成
17.与现有技术相比,本发明具有以下有益效果:
18.本发明提供的通关藤苷g在制备预防和/或治疗骨性关节炎药物中的应用,通过考察小鼠原代软骨细胞炎性因子表达、小鼠原代软骨细胞ii型胶原表达、oa小鼠膝关节软骨形态、oa小鼠膝关节micro-ct结果、oa小鼠膝关节切片he染色、so染色和oarsi评分,以评价药物对骨关节炎疾病的治疗效果,确定通关藤苷g能够用于预防骨关节炎药物的制备。通关藤苷g能够有效减轻小鼠膝关节骨性关节炎症状;减少小鼠膝关节软骨退变;减少小鼠膝关节软骨中ii型胶原丢失,对骨性关节炎造成的软骨破坏和关节退变具有显著改善作用,能够对骨性关节炎的治疗提供新的思路。
附图说明
19.图1为本发明的mirco-ct扫描假手术组、阳性对照组、不同剂量通关藤苷g组的小鼠右膝关节胫骨软骨下骨结果图;
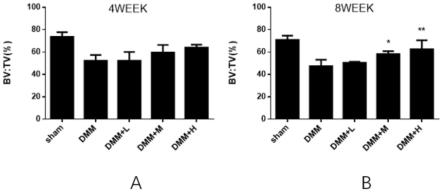
20.图2为本发明中对假手术组、阳性对照组、不同剂量通关藤苷g组的小鼠右膝关节胫骨软骨下骨的mirco-ct扫描结果进行测量,判断胫骨软骨下骨中固含量(bv/tv)的改变图;其中,a为给药4周时造模小鼠的骨量变化,b为给药8周时造模小鼠的骨量变化;
21.图3为本发明中对假手术组、阳性对照组、不同剂量通关藤苷g组的小鼠右膝关节的he染色和so染色结果图;
22.图4本发明中对假手术组、阳性对照组、不同剂量通关藤苷g组的小鼠右膝关节的so染色标本进行oarsi评分的结果图;其中,a为给药4周时的oarsi评分,b为给药8周时的oarsi评分;
23.图5为本发明的通关藤苷g对经il-1β(20ng/ml)刺激的c57小鼠原代软骨细胞炎性因子的抑制图;其中,a为tnf-α的rna表达,b为mmp-13的rna表达;
24.图6为本发明的通关藤苷g对经il-1β(20ng/ml)刺激的c57小鼠原代软骨细胞中ii型胶原的保护效果图。
具体实施方式
25.为了使本技术领域的人员更好地理解本发明方案,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分的实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都应当属于本发明保护的范围。
26.需要说明的是,本发明的说明书和权利要求书及上述附图中的术语“第一”、“第二”等是用于区别类似的对象,而不必用于描述特定的顺序或先后次序。应该理解这样使用的数据在适当情况下可以互换,以便这里描述的本发明的实施例能够以除了在这里图示或描述的那些以外的顺序实施。此外,术语“包括”和“具有”以及他们的任何变形,意图在于覆盖不排他的包含,例如,包含了一系列步骤或单元的过程、方法、系统、产品或设备不必限于清楚地列出的那些步骤或单元,而是可包括没有清楚地列出的或对于这些过程、方法、产品或设备固有的其它步骤或单元。
27.下面结合附图对本发明做进一步详细描述:
28.实施例1:通关藤苷g对经综合dmm手术进行oa造模的c57小鼠的膝关节软骨具有保护作用
29.1、实验材料
30.10-12周龄c57雄鼠(购于西安交通大学实验动物中心),通关藤苷g(购于成都格利普),金霉素软膏,10%dmso,生理盐水,10%水合氯醛,4%多聚甲醛,微量注射器,mirco-ct(德国sky-scan 1276)。
31.2、实验方法
32.本实验采用dmm actl-cut(综合dmm)手术方法建立小鼠膝关节oa模型。
33.将48只c57bl/6小鼠随机分为假手术组(sham 右膝关节注射dmso生理盐水)、阳性对照组(dmm actl-cut 右膝关节注射dmso生理盐水)、通关藤苷g低剂量组(dmm actl-cut 右膝关节注射通关藤苷g 4μg/kg)、通关藤苷g中剂量组(dmm actl-cut 右膝关节注射通关藤苷g 8μg/kg)和通关藤苷g高剂量组(dmm actl-cut 右膝关节注射通关藤苷g16μg/kg)。
34.部分实验试剂的配制:dmso生理盐水,将10%dmso按1:1000比例溶于0.9%生理盐水;通关藤苷g注射液:取纯度》98%的通关藤苷g结晶溶于10%dmso中,根据不同需求药物浓度配制。
35.对c57bl/6小鼠采用4%水合氯醛。小鼠麻醉生效后固定于手术台上,备皮术区,固定小鼠于仰卧位。以膝关节胫骨平台水平为中心,沿胫骨内侧切开皮肤,切断内侧副韧带,水平打开膝关节腔,游离内侧半月板并从中间位置离断,在关节腔深处离断前交叉韧带,关闭关节腔,缝合皮肤,术后予以金霉素软膏涂抹切口预防感染。其中假手术组仅切开右侧皮肤及关节囊,暴露关节后即缝合。在术后第二日开始对给药组小鼠右膝关节注射不同剂量通关藤苷g进行干预,假手术组和阳性对照组的小鼠注射等量的dmso生理盐水,分别于第4周、第8周处死各组一定数量小鼠,进行mirco-ct分析和各类染色实验,并进行oarsi评分。
36.3、实验结果
37.结果参见图1至图4。图1中可见所有小鼠右膝关节胫骨软骨下骨形态的改变,综合dmm组较假手术组小鼠的胫骨软骨下骨退变,骨小梁丢失,而不通关藤苷g组小鼠的胫骨软
骨下骨退变较综合dmm组减轻,骨小梁保留较完好;图2中可见,测量小鼠右膝关节胫骨软骨下骨的mirco-ct扫描结果:第4周时,所有给药组相对于综合dmm组的bv/tv比值有所提升,但是没有统计学差异。在第8周,相对于综合dmm对照组,通关藤苷g高剂量组(dmm actl-cut 右膝关节注射通关藤苷g16μg/kg)的bv/tv(骨体积分数)比值较高,说明通关藤苷g剂量依赖性的对oa小鼠膝关节胫骨软骨下骨中的骨含量具有保护作用。图3中对小鼠右膝关节胫骨软骨下骨的he染色和so染色结果显示,dmm手术后小鼠关节软骨受损严重,通关藤苷g对关节软骨具有保护作用。图4中oarsi评分结果显示,在第4周时,通关藤苷g中剂量组和高剂量组的oarsi评分高于阳性对照组;第8周时,所有经通关藤苷g干预的小鼠的oarsi评分均高于阳性对照组。
38.实施例2:通关藤苷g对il-1β所刺激的c57小鼠原代软骨细胞炎性因子表达的抑制作用
39.1、实验材料
40.il-1β(购于proteintech公司),6天鼠龄c57乳鼠(购于西安交通大学实验动物中心),通关藤苷g(购于成都格利普),10%dmso,dmem-f12培养基,pbs溶液,trizol,氯仿,异丙醇,无水乙醇,depc水,hiscript ii q rt supermix for qpcr( gdna wiper),sybr ii,实时荧光定量pcr仪(美国bio-rad)。
41.2、实验方法
42.(1)备制细胞:将小鼠软骨细胞重悬配置成1
×
106细胞/ml浓度的细胞悬液,按每孔2ml接种在6孔板中,分为空白对照组、阳性对照组及给药组,孵育12小时;
43.(2)使用dmso将通关藤苷g配置成80mmol的母液,再使用dmem-f12培养基进行稀释。使用通关藤苷g(2.5μm、5μm、10μm)对给药组细胞预处理2小时,空白组和阳性对照组则加入dmso培养基(1:8000)。然后使用20ng/ml浓度的il-1β诱导阳性对照组和给药组的软骨细胞48小时;
44.(3)提取rna:将处理过的空白对照组、阳性对照组及给药组细胞重悬后离心,弃上清,使用pbs清洗两遍,加入1ml trizol,室温静置5分钟,在4℃环境下离心12000rpm 10min,吸取1ml上清液至ep管。加入200ul氯仿,涡旋15s,室温静置3min,在4℃环境下离心12000rpm 10min。采用多次少量的方法吸取无色上清(rna)至新无菌无核酶离心管。加入与无色上清rna等体积的异丙醇,轻轻颠倒混匀,放在冰上静置10min,使rna充分沉淀出来。4℃离心12000rpm,10min,弃上清,用0.8ml 75%乙醇(depc水配制)清洗1次,再用无水乙醇清洗一次。置于超净台中自然干燥后加入20μl depc水溶解rna,置于-80℃冰箱内保存。
45.(4)取2μg总rna按照反转录步骤进行配制反应体系,并进行逆转录反应。利用实时荧光定量pcr仪检测通关通苷g对经il-1β诱导的鼠软骨细胞中tnf-α的rna表达和变化。
46.3、实验结果
47.结果参见图5。图5中显示相对于空白对照组,20ng/ml il-1β可以显著性提高c57小鼠原代软骨细胞中炎性细胞因子tnf-α和mmp-13的rna表达,而通关藤苷g可以剂量依赖性的抑制c57小鼠原代软骨细胞中炎性细胞因子tnf-α和mmp-13的rna表达。
48.实施例3:通关藤苷g对il-1β所刺激的c57小鼠原代软骨细胞中ii型胶原的保护作用
49.1、实验材料
50.il-1β(购于proteintech公司),6天鼠龄c57乳鼠(购于西安交通大学实验动物中心),通关藤苷g(购于成都格利普),10%dmso,dmem-f12培养基,pbs溶液,4%多聚甲醛,吐温20,triton x-100,bsa(购于proteintech公司),collagen type ii polyclonal antibody(28459-1-ap),conjugated affinipure goat anti-rabbit igg(sa00013-2),dapi,荧光显微镜。
51.2、实验方法
52.(1)备制细胞:将小鼠软骨细胞重悬配置成1
×
104细胞/ml浓度的细胞悬液,按每孔2ml接种在铺有盖玻片的6孔板中,分为空白对照组、阳性对照组及给药组,孵育12小时;
53.(2)使用dmso将通关藤苷g配置成80mmol的母液,再使用dmem-f12培养基进行稀释。使用通关藤苷g(2.5μm、5μm、10μm)对给药组细胞预处理2小时,空白组和阳性对照组则加入dmso培养基(1:8000)。然后使用20ng/ml浓度的il-1β诱导阳性对照组和给药组的软骨细胞48小时;pbs溶液中按1000:1加入吐温20配置成pbst。
54.(3)将贴有软骨细胞的盖玻片从六孔板中取出,使用pbs清洗3遍,每次5分钟;用4%的多聚甲醛固定细胞15分钟,使用pbs配置的0.5%triton x-100在室温下透化60分钟;pbs清洗3遍,每次5分钟。滴加含5%bsa的pbst封闭30分钟;加入一抗(collagen type ii polyclonal antibody,1:200稀释)放置于湿盒中,在室温下孵育2小时;pbs清洗3遍,每次5分钟,加入荧光二抗(conjugated affinipure goat anti-rabbit igg,1:200稀释)放置于湿盒中,在37℃条件下孵育1小时;滴加dapi后在室温下避光孵育10分钟;pbs清洗去除多余的dapi,然后在荧光显微镜下观察采集图像。
55.3、实验结果
56.结果参见图6。图6中显示相对于空白对照组,20ng/ml il-1β刺激后的软骨细胞中的ii型胶原的荧光表达较空白组减弱,通关藤苷g给药组软骨细胞中ii型胶原的荧光表达较阳性对照组增强,通关藤苷g可以剂量依赖性地保护c57小鼠原代软骨细胞中ii型胶原。
57.以上内容仅为说明本发明的技术思想,不能以此限定本发明的保护范围,凡是按照本发明提出的技术思想,在技术方案基础上所做的任何改动,均落入本发明权利要求书的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。