抗cd154抗体及其使用方法
1.相关申请的交叉引用
2.本技术要求2016年7月28日提交的美国临时申请序列号62/367,660和2015年8月5日提交的美国临时申请序列号62/201,150的权益,上述申请的全部内容全文以引用方式并入本文中。
技术领域
3.本发明涉及特异性地结合cd154的抗体、编码该抗体或片段的多核苷酸以及制备和使用前述物质的方法。
背景技术:
4.cd154,也称为cd40配体(cd40l)、gp39、tnf相关激活蛋白(trap)、5c8抗原或t-bam,是肿瘤坏死因子(tnf)超家族的三聚体跨膜蛋白。cd154在cd4
t细胞表面上以活化依赖性、时间限制性方式表达。活化之后,cd154也在cd8
t细胞、嗜碱粒细胞、肥大细胞、嗜酸粒细胞、自然杀伤细胞、b细胞、巨噬细胞、树突状细胞和血小板的子组上表达。cd154也以可溶形式存在于血液中。
5.cd154与抗原呈递细胞(apc)上的cd40结合,这导致取决于靶细胞类型的各种应答。cd40-cd154相互作用对于包括增强共刺激、t细胞启动、细胞因子产生、抗体类别转换和亲和力成熟以及抗体和自身抗体产生的正常t-b细胞相互作用是必不可少的。
6.已证实经由cd154阻断而破坏cd40/cd154途径在自身免疫性疾病诸如系统性红斑狼疮(sle)、类风湿性关节炎(ra)、多发性硬化症(ms)、炎性肠病(ibd)、i型糖尿病(t1d)和同种异体移植物排斥中是有益的。在人体中,cd40或cd154突变导致以缺乏igg或iga同种型为特征的高igm综合征(aruffo等人,cell 72:291,1993)。
7.抗cd154抗体已在以下国际专利公布中有所描述:no.wo1993/08207、wo1994/10308、wo1996/40918、wo1993/009812、wo1999/051258、wo1995/006480、wo1995/006481、wo1995/006666、wo2001/002057、wo1997/017446、wo1999/012566、wo2001/068860、wo2005/003175、wo2006/033702、wo2006/030220、wo2008/118356、wo2012/052205、wo2012/138768、wo2012/138768、wo2013/055745和wo2013/056068。
8.已证实抗cd154抗体在治疗人自身免疫性疾病方面是有效的。然而,在治疗后观察到由于血小板活化而导致的血栓栓塞,从而禁止继续进行临床开展。已证实与血小板上的fcγriia接合是抗cd154抗体5c8引起血小板活化的原因(xie等人,j immunol 192:4083-4092,2014)。
9.因此,需要具有改善的安全性和功效特征的另外的抗cd154抗体。
技术实现要素:
10.本发明提供了特异性地结合seq id no:1的人cd154的拮抗性抗体或其抗原结合部分,该拮抗性抗体或其抗原结合部分包含seq id no:17(sygis)的重链互补决定区
(hcdr)1、seq id no:23(wispifgntnyaqkfqg)的hcdr2和seq id no:30(sryygdldy)的hcdr3,其中任选地
11.hcdr1残基s1突变为a、c、d、e、g、i、k、l、m、n、q、r、t或v;
12.hcdr1残基i4突变为m、l或v;
13.hcdr1残基s5突变为a;
14.hcdr2残基s3突变为a、t或v;
15.hcdr2残基p4突变为v、t、l、q或e;
16.hcdr2残基n8突变为a、c、d、e、f、g、h、i、k、l、m、q、r、s、t、v、w或y;
17.hcdr2残基t9突变为a、c、d、e、f、g、h、i、k、l、m、q、r、s、t、v、w或y;
18.hcdr2残基n10突变为a、c、d、e、f、g、h、i、k、l、m、q、r、s、t、v、w或y;
19.hcdr3残基s1突变为a或m;
20.hcdr3残基r2突变为a、s、q或k;并且
21.hcdr3残基l7突变为m。
22.本发明还提供了特异性地结合seq id no:1的cd154的分离的拮抗性抗体,其中该抗体包含如本文所述的某些vh和vl氨基酸序列。
23.本发明还提供了特异性地结合seq id no:1的cd154的分离的拮抗性抗体,其中该抗体包含如本文所述的某些hcdr1、hcdr2、hcdr3、lcdr1、lcdr2和lcdr3氨基酸序列。
24.本发明还提供了特异性地结合seq id no:1的cd154的分离的拮抗性抗体,其包含:
25.分别为seq id no:17、23、30、37、44和52的hcdr1、hcdr2、hcdr3、lcdr1、lcdr2和lcdr3;
26.seq id no:59的vh和seq id no:66的vl;或者
27.seq id no:80的重链和seq id no:81的轻链。
28.本发明还提供了特异性地结合seq id no:1的cd154的分离的拮抗性抗体或其抗原结合部分,其中cd154是同源三聚体,并且该抗体在cd154的氨基酸残基182-207内结合同源三聚体中的第一cd154单体并且在cd154的氨基酸残基176-253内结合同源三聚体中的第二cd154单体,其中根据seq id no:1对残基进行编号。
29.本发明还提供了免疫缀合物,该免疫缀合物包含连接至治疗剂或显像剂的本发明的抗体或抗体的抗原结合部分。
30.本发明还提供了包含本发明的抗体和药学上可接受的载体的药物组合物。
31.本发明还提供了编码本发明的抗体vh、本发明的抗体vl或本发明的抗体vh和vl的多核苷酸。
32.本发明还提供了包含本发明的多核苷酸的载体。
33.本发明还提供了包含本发明载体的宿主细胞。
34.本发明还提供了制备抗体的方法,该方法包括在使抗体表达的条件下培养本发明的宿主细胞,以及回收由宿主细胞产生的抗体。
35.本发明还提供了治疗自身免疫性疾病或免疫介导的炎性疾病的方法,该方法包括将治疗有效量的本发明的分离的抗体或本发明的药物组合物施用给对其有需要的患者,维持足以治疗该疾病的一段时间。
36.本发明还提供了结合至本发明抗体的抗独特型抗体。
37.本发明还提供了包括本发明抗体的试剂盒。
附图说明
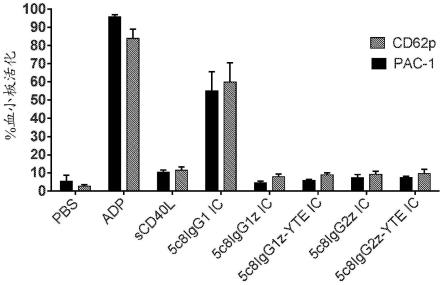
38.图1示出了抗体fc对由cd154:抗体免疫复合物(ic)引起的血小板活化的影响。可溶性人cd154(shcd154,在图中表示为scd40l)和抗cd154抗体5c8(igg1同种型)的ic(5c8igg1 ic)活化血小板,而shcd154和克隆在沉默的igg1主链igg1sigma、igg1sigma-yte、igg2sigma或igg2sigma-yte上的5c8(分别为5c8igg1z、5c8igg1z-yte、5c8igg2z或5c8igg2z-yte)的ic没有效果。血小板活化评估为表达pac-1(pac-1抗体特异性识别αiibβ3整联蛋白的构象活性形式)和cd62p(p-选择素表面表达)的总血小板%。adp:阳性对照。pbs:阴性对照。对五名供体进行血小板活化评估。结果示出为每个实验的平均值 sd。
39.图2示出,shcd154(图中的scd40l)和效应子沉默igg2sigma/κ抗cd154抗体c4lb5、c4lb89、c4lb189、c4lb191、c4lb199和c4lb150的免疫复合物(ic)不活化血小板。血小板活化评估为表达pac-1和cd62p的总血小板%。shcd154和5c8igg1的ic(5c8igg1 ic)活化血小板。adp:阳性对照。对五名供体进行血小板活化评估。结果示出为每个实验的平均值 sd。
40.图3示出,shcd154(scd40l)和抗cd154抗体c4lb89(igg2sigma/κ)、c4lb231(igg1sigma/κ)和c4lb232(igg1sigma/κ)的免疫复合物(ic)不活化血小板。血小板活化评估为表达pac-1和cd62p的总血小板%。5c8-igg1ic活化血小板,但其活化被抗-fcγiia抗体阻断,从而表明cd154/5c8-igg1 ic的血小板活化是由血小板上的fcγriia介导的。adp:阳性对照。pbs:阴性对照。对五名供体进行血小板活化评估。结果示出为每个实验的平均值 sd。
41.图4示出了cd154和c4lb89之间的相互作用表面。hcdr2和hcdr3中的芳香族残基f55、y101和y102有助于大部分相互作用(根据seq id no:59对残基进行编号)。c4lb89的轻链不参与结合。
42.图5示出了从绒猴cd154与c4lb89复合的晶体结构中鉴定的表位和互补位残基的二维动画。表位残基以椭圆形圈出,并且示出了重链hcdr1、hcdr2和hcdr3中的互补位残基(在图中表示为cdr1、cdr2和cdr3)。该抗体同时结合至两个cd154单体a和b。根据人cd154(seq id no:1)对表位残基进行编号,根据c4lb89(seq id no:59)的重链可变区对互补位残基进行编号。
43.图6a示出了人cd154(seq id no:1,顶行)和绒猴cd154(sq id no:2,底行)的残基1-180的比对,表明c4lb89表位残基在人cd1514和绒猴cd1514之间是保守的。cd154单体1上的表位残基用下划线表示,单体2上的表位残基用双下划线表示。
44.图6b示出了人cd154(seq id no:1,顶行)和绒猴cd154(sq id no:2,底行)的残基181-261的比对,表明c4lb89表位残基在人cd1514和绒猴cd1514之间是保守的。cd154单体1上的表位残基用下划线表示,单体2上的表位残基用双下划线表示。
45.图7示出,shcd154(图中的scd40l)和igg1/κ抗cd154抗体c4lb237的免疫复合物(ic)不会活化血小板,而shcd154和另一igg1抗体5c8的ic活化血小板。单独的抗体对血小板活化没有效果,血小板活化评估为表达pac-1和cd62p的总血小板%。adp:阳性对照。pbs:阴性对照。对五名供体进行血小板活化评估。结果显示为每个实验的平均值
±
sd。每组n=
4。
46.图8a示出,shcd154(图中的scd40l)和fc沉默c4lb119的免疫复合物(ic)以fcγriia非依赖方式活化血小板,而shcd154和以igg1(c4lb287)表示的具有c4lb119 vh/vl结构域的抗体的ic以fcγriia依赖方式活化血小板。adp:阳性对照。pbs:阴性对照。
47.图8b示出,shcd154(图中的scd40l)和fc沉默c4lb94的免疫复合物(ic)以fcγriia非依赖方式活化血小板,而shcd154和以igg1(c4lb289)表示的具有c4lb94 vh/vl结构域的抗体的ic以fcγriia依赖方式活化血小板。adp:阳性对照。pbs:阴性对照。
48.图8c示出,shcd154(图中的scd40l)和fc沉默c4lb83的免疫复合物(ic)适度活化血小板,而shcd154和以igg1(c4lb288)表示的具有c4lb83 vh/vl结构域的抗体的ic以fcγriia依赖方式活化血小板。adp:阳性对照。pbs:阴性对照。
具体实施方式
49.本说明书中引用的所有出版物(包括但不限于专利和专利申请)均以引用方式并入本文,如同在本文中完整阐述。
50.应当理解,本文所用的术语只是为了描述具体实施方案的目的,并非旨在进行限制。除非另有定义,否则本文使用的所有技术和科学术语的含义与本发明所属领域的普通技术人员通常所理解的含义相同。
51.说明书和权利要求书中所用的单数形式“一个”、“一种”和“所述”包括复数指代,除非上下文清楚表明并非如此。
52.本文描述了示例性材的料和方法,但类似或等同于本文所述的那些方法和材料的任何方法和材料都可用于检验本发明的实践中。在描述和要求保护本发明时,将使用以下术语。
[0053]“特异性结合”、“特异性地结合”或“结合”是指抗体以比针对其他抗原更高的亲和力结合至某个抗原或该抗原内的表位。通常,抗体以约1
×
10-8
m或更小(例如约1
×
10-9
m或更小、约1
×
10-10
m或更小、约1
×
10-11
m或更小、或者约1
×
10-12
m或更小)的解离常数(kd)结合至抗原或抗原内的表位,通常该kd最多不超过该抗体结合至非特异性抗原(如bsa、酪蛋白)的kd的百分之一。可使用标准程序来测量解离常数。然而,特异性地结合至抗原或抗原内的表位的抗体可能对其它相关的抗原具有交叉反应性,例如,对来自其它物种(同源)(诸如人或猴,例如食蟹猴(macaca fascicularis)(cynomolgus,cyno)、黑猩猩(pan troglodytes)(chimpanzee,chimp)或普通狨(callithrixjacchus)(common marmoset,marmoset))的相同抗原具有交叉反应性。虽然单特异性抗体特异性地结合一个抗原或一个表位,而双特异性抗体特异性地结合两个不同的抗原或两个不同的表位。
[0054]“中和”或“经中和的”或“中和抗体”或“抗体拮抗剂”或“拮抗剂”或“拮抗的”是指部分或完全抑制人cd154的生物学活性的抗体或其抗原结合部分。可使用如本文所述的cd154生物学活性测定法来鉴定拮抗性抗体。特异性地结合人cd154的拮抗性抗体可使人cd154的生物学活性抑制约20%、30%、40%、50%、60%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%。
[0055]“cd154”是指人cd154(hcd154)(例如,人cd40l)蛋白。人cd154全长蛋白质氨基酸序列以seq id no:1示出。人cd154在细胞膜上被发现为ii型膜蛋白,而在血浆中以可溶形
式存在。cd154膜结合形式包含seq id no:1的残基1-261,其中跨膜结构域位于残基23-46和胞外结构域跨度残基47-261之间。可溶形式的人cd154(shcd154)由膜结合形式的蛋白水解处理形成,并且包含seq id no:1的残基113-261(shcd154氨基酸序列以seq id no:4示出)。膜结合和可溶性的cd154均形成生物学活性三聚体。“cd154”涵盖cd154的各种形式,包括单体、二聚体、三聚体、膜结合和可溶形式以及天然存在的人cd154的变体。可溶性人cd154三聚体(shcd154三聚体)由三条多肽链构成,每条链具有seq id no:4的氨基酸序列。
[0056]
如本文所用,“抗体”广义上是指并包括免疫球蛋白分子,该免疫球蛋白分子包括单克隆抗体(包括鼠科动物单克隆抗体、人单克隆抗体、人源化单克隆抗体和嵌合单克隆抗体)、抗体片段、双特异性或多特异性抗体,二聚、四聚或多聚抗体,单链抗体、结构域抗体,以及包含所需特异性的抗原结合位点的免疫球蛋白分子的任何其他经修饰构型。“完整抗体分子”及其多聚体(例如,igm)由通过二硫键相互连接的两条重链(hc)和两条轻链(lc)构成。每条重链由重链可变区(vh)和重链恒定区(由结构域ch1、ch2和ch3构成)构成。每条轻链由轻链可变区(vl)和轻链恒定区(cl)构成。该vh和vl区域可被进一步细分成超可变区,称为互补性决定区(cdr),该超可变区散布在骨架区(fr)内。每个vh和vl由按照以下顺序从氨基末端到羧基末端排列的三个cdr和四个fr片段构成:fr1、cdr1、fr2、cdr2、fr3、cdr3和fr4。
[0057]“互补决定区(cdr)”是抗体中的“抗原结合位点”。可使用不同术语来定义cdr:(i)三个在vh(hcdr1、hcdr2、hcdr3)中并且三个在vl(lcdr1、lcdr2、lcdr3)中的互补决定区(cdr)基于序列变异性(wu和kabat,j exp med 132:211-50,1970;kabat等人,sequences of proteins of immunological interest,第5版,public health service,national institutes of health,bethesda,md.,1991)。(ii)三个在vh(h1、h2、h3)中并且三个在vl(l1、l2、l3)中的“超变区”、“hvr”或“hv”是指抗体可变结构域的在结构上超变的区域,如chothia和lesk所定义(chothia和lesk,mol biol 196:901-17,1987)。国际免疫遗传学(imgt)数据库(http://www_imgt_org)提供了抗原结合位点的标准化编号和定义。cdr、hv和imgt描述之间的对应关系在lefranc等人,dev comparat immunol 27:55-77,2003中有所描述。术语“cdr”“hcdr1”“hcdr2”“hcdr3”“lcdr1”“lcdr2”和“lcdr3”包括由上文所述的方法、kabat、chothia或imgt中的任一者所定义的cdr,除非在本说明书中另有明确说明。
[0058]
根据重链恒定结构域氨基酸序列,可将免疫球蛋白指定为五大类,iga、igd、ige、igg和igm。iga和igg进一步亚分类为同种型iga1、iga2、igg1、igg2、igg3和igg4。任何脊椎动物物种的抗体轻链都可基于其恒定结构域的氨基酸序列被指定为两种完全不同的类型(即κ和λ)之一。
[0059]“抗体片段”或“抗体的抗原结合部分”是指免疫球蛋白分子的一部分,其保留重链和/或轻链抗原结合位点,例如重链互补决定区(hcdr)1、2和3,轻链互补决定区(lcdr)1、2和3,重链可变区(vh)或轻链可变区(vl)。抗体片段包括众所周知的fab、f(ab')2、fd和fv片段,以及由一个vh结构域组成的结构域抗体(dab)。vh和vl结构域可经由合成接头连接在一起以形成各种类型的单链抗体设计,其中在vh和vl结构域由单独的单链抗体构建体表达的情况下,vh/vl结构域在分子内或分子间配对,以形成单价抗原结合位点,诸如单链fv(scfv)或双价抗体;例如在国际专利公布no.wo1998/44001、国际专利公布no.wo1988/01649、国际专利公布no.wo1994/13804、国际专利公布no.wo1992/01047中所述。
[0060]“单克隆抗体”是指在每条重链和每条轻链中具有单一氨基酸组成的抗体群,除了可能的熟知改变,诸如从抗体重链中除去c末端赖氨酸之外。除了双特异性单克隆抗体结合两个不同的抗原表位之外,单克隆抗体通常结合一个抗原表位。单克隆抗体可在抗体群内具有异质糖基化。单克隆抗体可以是单特异性的或多特异性的,或者是单价的、二价的或多价的。术语“单克隆抗体”中包括双特异性抗体。
[0061]“分离的抗体”是指基本上不含具有不同抗原特异性的其他抗体的抗体或抗体片段(例如,特异性地结合cd154的分离的抗体基本上不含特异性地结合cd154之外的抗原的抗体)。“分离的抗体”涵盖分离至更高纯度的抗体,诸如80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%纯度的抗体。
[0062]“chothia残基”是根据al-lazikani编号的抗体vl和vh残基(al-lazikani等人,jmol biol 273:927-48,1997)。
[0063]“人源化抗体”是指其中抗原结合位点来源于非人物种且可变区框架来源于人免疫球蛋白序列的抗体。人源化抗体在框架区中可包含置换,使得该框架可能不是表达的人免疫球蛋白序列或种系基因序列的精确拷贝。
[0064]“人抗体”是指具有重链可变区和轻链可变区的抗体,其中框架和抗原结合位点均来源于人起源的序列。如果所述抗体包含恒定区或恒定区的一部分,则该恒定区也来源于人起源的序列。
[0065]
如果人抗体的可变区获自使用人种系免疫球蛋白或重排免疫球蛋白基因的系统,则该抗体包含“来源于”人起源序列的重链可变区或轻链可变区。此类示例性系统为噬菌体上展示的人免疫球蛋白基因文库,以及转基因非人动物,诸如携带如本文所述的人免疫球蛋白基因座的小鼠或大鼠。在与人种系免疫球蛋白序列或重排免疫球蛋白序列进行比较时,“人抗体”可包含由于例如天然存在的体细胞突变或者向框架或抗原结合位点或两者中特意引入置换所引起的氨基酸差异。通常,“人抗体”的氨基酸序列与由人种系或重排免疫球蛋白基因编码的氨基酸序列具有至少约80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的同一性。在一些情况下,“人抗体”可包含由人框架序列分析得到的共有框架序列(例如knappik等人,j mol biol 296:57-86,2000中所述);或结合到噬菌体上展示的人免疫球蛋白基因文库中的合成hcdr3(例如shi等人,j mol biol397:385-96,2010和国际专利公布wo2009/085462中所述)。
[0066]
分离的人源化抗体是合成的。虽然人抗体来源于人免疫球蛋白序列,但可使用诸如噬菌体展示的系统结合合成的cdr和/或合成的框架来生成该人抗体,或者可对其进行体外诱变以改善抗体特性,从而得到体内整套人抗体种系不表达的抗体。
[0067]“人抗体”的定义中不包括抗原结合位点来源于非人物种的抗体。
[0068]“重组”包括通过重组手段制备、表达、产生或分离的抗体和其他蛋白质。
[0069]
如本文所用,“表位”是指抗原的与抗体特异性地结合的部分。表位通常由部分诸如氨基酸或多糖侧链的化学活性(诸如,极性、非极性或疏水性)表面基团组成,并且可具有特定三维结构特征以及特定电荷特征。表位可由形成构象空间单元的连续和/或不连续氨基酸构成。对于不连续表位,来自抗原的线性序列的不同部分的氨基酸因蛋白质分子的折
叠而在三维空间上靠近。
[0070]“互补位”是指抗体的与抗原特异性地结合的部分。互补位可以是本质上线性的,或者可以是不连续的,通过抗体的非邻近氨基酸之间的空间关系形成,而非通过线性系列的氨基酸的空间关系形成。“轻链互补位”和“重链互补位”或“轻链互补位氨基酸残基”和“重链互补位氨基酸残基”分别指与抗原接触的抗体轻链和重链残基,或者通常,“抗体互补位残基”是指与抗原接触的那些抗体氨基酸。
[0071]“双特异性”是指特异性地结合两个不同抗原或同一抗原内的两个不同表位的抗体。双特异性抗体可对其他相关的抗原具有交叉反应性,或者可结合两个或更多个不同抗原之间共有的表位。
[0072]“多特异性”是指特异性地结合至少两个不同抗原或同一抗原内的至少两个不同表位的抗体。多特异性抗体可结合例如二、三、四或五种不同的抗原或同一抗原内的不同表位。
[0073]“与
……
组合”意指将药物或治疗剂以混合物一起、作为单一试剂同时或作为单一试剂以任何顺序依次施用给受试者。
[0074]“cd154生物学活性”是指由于cd154结合至其受体cd40而出现的任何活性。cd154生物学活性可以是例如cd154介导的cd40
b细胞或树突细胞(dc)的活化,或cd40信号传导途径的下游激活。可使用众所周知的方法和本文所述的方法来测量cd154生物学活性,诸如通过评估icam-1上调或b细胞产生的细胞因子增加来测量cd154介导的b细胞增殖或b细胞活化,通过评估cd80和/或cd86的表面表达增加或dc细胞分泌细胞因子来测量cd154介导的dc活化,或者通过报告基因测定评估cd40信号传导途径的激活来测量(诸如测量在nf-κb诱导型启动子控制下表达seap的细胞对分泌型胚胎碱性磷酸酶(seap)的分泌)。
[0075]“载体”意指能够在生物系统内复制或可在这类系统之间移动的多核苷酸。载体多核苷酸通常含有诸如复制起点、聚腺苷酸化信号或选择标记的元件,其功能是促进这些多核苷酸在生物系统中的复制或保持。此类生物系统的示例可包括细胞、病毒、动物、植物和用能够复制载体的生物组分再造的生物系统。包含载体的多核苷酸可为dna或rna分子或这些分子的杂合分子。
[0076]“表达载体”意指可用于在生物系统或再造生物系统中指导由存在于表达载体中的多核苷酸序列所编码的多肽进行翻译的载体。
[0077]“多核苷酸”是指包含由糖-磷酸主链或其他等同的共价化学方式共价连接的核苷酸链的分子。双链dna和单链dna以及双链rna和单链rna是多核苷酸的典型示例。
[0078]“多肽”或“蛋白质”意指包含由肽键连接以形成多肽的至少两个氨基酸残基的分子。少于50个氨基酸的小多肽可以称作“肽”。
[0079]
本文使用常规的单字母氨基酸代码和三字母氨基酸代码,如表1中所示。
[0080]
表1:
[0081][0082][0083]
物质的组成
[0084]
本发明提供了以高亲和力特异性地结合cd154并有效中和cd154生物学活性的拮抗性抗体。本发明至少部分地基于与现有理解相反的以下鉴定:特异性地结合cd154的抗体与血小板上的fcγriia结合导致血小板的活化和聚集以及随后的血栓栓塞,本文已经发现,血小板活化还取决于与抗体结合的cd154表位。本文已经发现,本发明抗体与cd154上的某些能够接合fcγriia的表位的结合不介导血小板活化。另外,本发明抗体任选地被fc工程化以防止触发另外的不需要的免疫刺激功能。因此,与现有的特异性地结合cd154的抗体相比,本发明的抗体在临床环境中可具有更有利的安全性。
[0085]
cd154是小鼠、非人灵长类动物(nhp)和人的自身免疫、移植排斥和其他免疫相关疾病的靶标。在几个ii期临床试验中,已证实特异性地结合cd154的抗体有效地阻断了体内cd154的活性并改善疾病。cd154拮抗剂在对免疫应答的影响方面不同于所有其他治疗剂;它们是唯一能诱导功能性免疫耐受性的治疗剂,如在小鼠和猴中所证明的。在小鼠中,几乎所有的自身免疫性疾病模型都可用cd154拮抗剂有效地改善(noelle等人,ann n y acad sci 815:384-391,1997;mackey等人,j leukoc biol 63:418-428,1998;noelle,agents actions suppl 49:17-22,1998;quezada等人,annu rev immunol 22:307-328,2004),并且观察到长期缓解。
[0086]
本发明提供了特异性地结合seq id no:1的cd154的分离的拮抗性抗体或其抗原结合部分。
[0087]
本发明还提供了特异性地结合cd154的分离的拮抗性抗体或其抗原结合部分,其中cd154是同源三聚体,并且该抗体在cd154的氨基酸残基182-207内结合同源三聚体中的
第一cd154单体并且在cd154的氨基酸残基176-253内结合同源三聚体中的第二cd154单体,其中根据seq id no:1对残基进行编号。
[0088]
此类示例性抗体是抗体c4lb89。由于抗体c4lb235和c4lb236可变区与c4lb89可变区相比在lcdr2中相差一个氨基酸残基,并且由于c4lb231和c4lb232与c4lb89具有相同的vh/vl序列,因此预计这些抗体也与c4lb89一样结合相同的cd154表位。在182-207和176-253残基内结合cd154的抗体即使能够与fcγr(包括fcγriia)结合也不能活化血小板。因此,与特异性地结合cd154的其他拮抗性抗体相比,这些抗体可具有改善的安全性。
[0089]
本发明还提供了特异性地结合seq id no:1的人cd154的拮抗性抗体或其抗原结合部分,其包含seq id no:17(sygis)的重链互补决定区(hcdr)1、seq id no:23(wispifgntnyaqkfqg)的hcdr2和seq id no:30(sryygdldy)的hcdr3,其中任选地
[0090]
hcdr1残基s1突变为a、c、d、e、g、i、k、l、m、n、q、r、t或v;
[0091]
hcdr1残基i4突变为m、l或v;
[0092]
hcdr1残基s5突变为a;
[0093]
hcdr2残基s3突变为a、t或v;
[0094]
hcdr2残基p4突变为v、t、lq或e;
[0095]
hcdr2残基n8突变为a、c、d、e、f、g、h、i、k、l、m、q、r、s、t、v、w或y;
[0096]
hcdr2残基t9突变为a、c、d、e、f、g、h、i、k、l、m、q、r、s、t、v、w或y;
[0097]
hcdr2残基n10突变为a、c、d、e、f、g、h、i、k、l、m、q、r、s、t、v、w或y;
[0098]
hcdr3残基s1突变为a或m;
[0099]
hcdr3残基r2突变为a、s、q或k;并且
[0100]
hcdr3残基l7突变为m。
[0101]
在一些实施方案中,本发明的抗体包含seq id no:37(rasqsissyln)的轻链互补决定区(lcdr)1、seq id no:44(yanslqs)的lcdr2和seq id no:52(qqsdsipwt)的lcdr3,其中任选地
[0102]
lcdr1残基q4突变为a、c、d、e、f、g、h、i、k、l、m、n、r、s、t、v、w或y;
[0103]
lcdr1残基s5突变为a、c、d、e、f、g、h、i、k、l、m、n、q、r、t、v、w或y;
[0104]
lcdr1残基s7突变为a、c、d、e、f、g、h、i、k、l、m、n、q、r、t、v、w或y;
[0105]
lcdr1残基s8突变为a、c、d、e、f、g、h、i、k、l、m、n、q、r、t、v、w或y;
[0106]
lcdr2残基a2突变为s;
[0107]
lcdr2残基n3突变为a、c、d、e、f、g、h、i、k、l、m、q、r、s、t、v、w或y;
[0108]
lcdr2残基s4突变为a、c、d、e、f、g、h、i、k、l、m、n、q、r、t、v、w或y;
[0109]
lcdr2残基l5突变为a、c、d、e、f、g、h、i、k、m、n、q、r、s、t、v、w或y;
[0110]
lcdr2残基q6突变为e、d或n;
[0111]
lcdr2残基s7突变为a、c、d、e、f、g、h、i、k、l、m、n、q、r、t、v、w或y;
[0112]
lcdr3残基s3突变为a;
[0113]
lcdr3残基d4突变为n;
[0114]
lcdr3残基s5突变为a、c、d、e、f、g、h、i、k、l、m、n、q、r、t、v、w或y;并且
[0115]
lcdr3残基i6突变为a、c、d、e、g、k、l、m、n、q、r、s、t或v。
[0116]
抗体c4lb89和cd154的复合物的晶体结构表明抗体仅通过vh残基与cd154结合。进
一步分析表明,预计该抗体cdr中的如上文所指的表19和表20所示的某些置换不会影响该复合物的整体结构,因此也不会影响该抗体的特征。
[0117]
在一些实施方案中,本发明的抗体包含以下的轻链互补决定区(lcdr)1、lcdr2和lcdr3:
[0118]
分别为seq id no:36、43和51;
[0119]
分别为seq id no:37、44和52;
[0120]
分别为seq id no:38、45和53;
[0121]
分别为seq id no:39、46和54;
[0122]
分别为seq id no:40、47和55;
[0123]
分别为seq id no:41、47和56;
[0124]
分别为seq id no:42、48和57;
[0125]
分别为seq id no:37、49和52;或者
[0126]
分别为seq id no:37、50和52。
[0127]
在一些实施方案中,本发明的抗体包含分别为seq id no:37、44和52的lcdr1、lcdr2和lcdr3。
[0128]
在一些实施方案中,本发明的抗体包含分别为seq id no:17、23、30、37、44和52的hcdr1、hcdr2、hcdr3、lcdr1、lcdr2和lcdr3。
[0129]
在一些实施方案中,本发明的抗体包含分别为seq id no:17、23、30、37、49和52的hcdr1、hcdr2、hcdr3、lcdr1、lcdr2和lcdr3。
[0130]
在一些实施方案中,本发明的抗体包含分别为seq id no:17、23、30、37、50和52的hcdr1、hcdr2、hcdr3、lcdr1、lcdr2和lcdr3。
[0131]
在一些实施方案中,本发明的抗体和可溶性人cd154(shcd154)的免疫复合物不活化血小板,其中血小板活化通过血小板上的p-选择素表面表达来测量。
[0132]
血小板活化是一个众所周知的过程,即将光滑的非粘附性血小板转变成释放并表达生物学活性物质的粘性刺状颗粒,然后获得结合血浆蛋白纤维蛋白原的能力。活化也可由于高流体剪切应力的物理刺激而发生,诸如在临界动脉狭窄部位中所发现的(quinn等人,2005,platelet function:assessment,diagnosis,and treatment,humana press,第3-20页)。血小板活化导致细胞内信号传导途径的激活,从而导致血小板的p-选择素表面表达上调以及纤维蛋白原对整联蛋白受体αiibβ3的结合亲和力增加。因此可通过使用例如流式细胞术测量增加的p-选择素表面表达或探针配体(例如,pac-1)与血小板上的αiibβ3整联蛋白的结合来测量血小板活化。当本发明的抗体与shcd154的复合物与shcd154诱导的p-选择素表面表达以及探针配体(例如,pac-1)与αiibβ3整联蛋白的结合增加相比,没有以统计意义上显著的方式升高p-选择素表面表达或增加探针配体(例如,pac-1)与αiibβ3整联蛋白的结合时,该抗体不活化人血小板。
[0133]
在一些实施方案,本发明的抗体具有以下特性中的至少一者:
[0134]
以约5
×
10-9
m或更小的解离常数(kd)结合至cd154,其中kd是使用proteon xpr36系统在25℃下在含有0.03%聚山梨酯p20和100μg/ml牛血清白蛋白的达尔贝科磷酸盐缓冲盐水中进行测量的;
[0135]
以约2.7
×
10-9
m或更小的ic
50
值抑制cd154介导的人b细胞增殖;或者
[0136]
在稳定地表达seap和人cd40的hek293细胞中以约2.1
×
10-8
m或更小的ic
50
值在nf-κb诱导型干扰素-β(ifn-β)最小启动子下抑制cd154介导的分泌型胚胎碱性磷酸酶(seap)的表达。
[0137]
在一些实施方案中,本发明的抗体以约5
×
10-9
m或更小、约1
×
10-9
m或更小、约5
×
10-10
m或更小、约1
×
10-10
m或更小、约5
×
10-11
m或更小、或者约1
×
10-11
m或更小的解离常数(kd)结合cd154。
[0138]
在一些实施方案中,特异性地结合cd154的抗体与食蟹猴(macaca fascicularis)(猕猴)cd154或普通狨(callithrixjacchus)(狨猴)cd154交叉反应。
[0139]
抗体对人、猕猴或狨猴cd154的亲和力可使用任何合适的方法通过实验测定。这类方法可采用本领域技术人员已知的proteon xpr36、biacore3000或kinexa仪器,elisa或竞争性结合测定法。如果在不同的条件(例如,同渗容摩、ph)下测量,特定抗体与cd154的测量亲和力可变化。因此,亲和力和其他结合参数(例如,kd、k
on
、k
off
)的测量通常用标准化条件和标准化缓冲液(诸如本文所述的缓冲液)进行。本领域技术人员将会知道,使用例如biacore 3000或proteon进行亲和力测量的内部误差(测量为标准偏差,sd)通常可在典型检出限内的测量值的5-33%内。因此术语“约”反映测定中的典型标准偏差。例如,1
×
10-9
m的kd的典型sd为至多
±
0.33
×
10-9
m。
[0140]
在一些实施方案中,本发明的抗体以约2.7
×
10-9
m或更小的ic
50
值抑制cd154介导的人b细胞增殖。
[0141]
在b细胞增殖测定中,可用最终体积为200μl/孔的100ng/ml重组人il-21、0.5μg/ml以亮氨酸拉链融合蛋白表示的三聚重组可溶性人cd154和0.000064-25μg/ml范围内的抗cd154抗体培养1
×
105人扁桃体b细胞。在温育2天后,可将甲基(-3h)-胸苷(0.5μci/孔)加入到培养物中,在温育过夜后,可测定该抗体对人b细胞增殖的影响。
[0142]
在一些实施方案中,本发明的抗体在稳定地表达seap和人cd40的hek293细胞中以约2.1
×
10-8
m或更小的ic
50
值在nf-κb诱导型干扰素-β(ifn-β)最小启动子下抑制cd154诱导的分泌型胚胎碱性磷酸酶(seap)的表达。
[0143]
在一些实施方案中,本发明的抗体在稳定地表达seap和人cd40的hek293细胞中以介于约2.1
×
10-8
m和5.4
×
10-10
m之间的ic
50
值在nf-κb诱导型ifn-β最小启动子下抑制cd154诱导的分泌型胚胎碱性磷酸酶(seap)的表达。
[0144]
可使用的细胞是例如hek-blue
tm
cd40l细胞(invivogen,san diego,ca)。可提供人cd154作为三聚可溶性cd154-亮氨酸拉链融合蛋白。可检测来自分泌的碱性磷酸酶的信号,并且可使用熟知的方法来计算抑制的ic
50
。
[0145]
在一些实施方案中,本发明的抗体同时结合cd154同源三聚体中的第一cd154单体和第二cd154单体。
[0146]
在一些实施方案中,本发明的抗体在seq id no:1的cd154的氨基酸残基182-207内结合第一cd154单体中的至少一个、两个、三个、四个、五个、六个、七个或八个cd154残基。
[0147]
在一些实施方案中,本发明的抗体在seq id no:1的cd154的氨基酸残基176-253内结合第二cd154单体中的至少一个、两个、三个、四个、五个、六个、七个或八个cd154残基。
[0148]
在一些实施方案中,本发明的抗体结合第一cd154单体中的残基e182、s185、q186、a187、p188、s214、a215和r207,其中根据seq id no:1对残基进行编号。
[0149]
在一些实施方案中,本发明的抗体结合第二cd154单体中的残基t176、f177、c178、q220、s248、h249、g250和f253,其中根据seq id no:1对残基进行编号。
[0150]“在...内”是指抗体仅结合氨基酸段182-207、176-354或182-207和176-354内的残基。
[0151]
此类示例性抗体是抗体c4lb89。由于抗体c4lb235和c4lb236可变区与c4lb89可变区相比在lcdr2中相差一个氨基酸残基,并且由于c4lb231和c4lb232与c4lb89具有相同的vh/vl序列,因此预计这些抗体也与c4lb89一样结合相同的cd154表位。
[0152]
在一些实施方案中,本发明的抗体通过存在于抗体vh中的互补位残基与人cd154结合。
[0153]“互补位残基”是抗体vh或vl中的距cd154残基以内的残基。可从抗体与cd154的复合物的晶体结构中鉴定互补位残基。
[0154]
仅通过vh互补位残基而不通过与抗原接触的vl而结合cd154的示例性抗体是包含抗体c4lb89的vh和vl的抗体。由于c4lb235和c4lb236可变区与c4lb89可变区相比在lcdr2中相差一个氨基酸残基,并且由于c4lb231和c4lb232与c4lb89具有相同的vh/vl序列,因此预计这些抗体也仅通过vh残基与cd154结合。在seq id no:1的残基182-207或176-354内或在cd154同源三聚体中的第一cd154单体中的残基e182、s185、q186、a187、p188、s214、a215和r207内和第二cd154单体中的残基t176、f177、c178、q220、s248、h249、g250和f253内结合cd154的抗体不能活化血小板,即使其能与fcγr(包括fcγriia)结合也是如此。因此,与特异性地结合cd154的其他抗体相比,这些抗体可具有改善的安全性。
[0155]
在一些实施方案中,本发明的抗体包含seq id no:59的重链可变区(vh),任选地该vh包含一、二、三、四、五、六、七、八、九、十、十一、十二、十三、十四或十五个氨基酸置换。
[0156]
在一些实施方案中,本发明的抗体包含seq id no:59的重链可变区(vh)。
[0157]
包含分别为seq id no:17、23和30的hcdr1、hcdr2和hcdr3或者具有seq id no:59的vh的hcdr或seq id no:59的vh的抗体仅通过抗体vh与cd154结合。因此,seq id no:59的vh或包含分别为seq id no:17、23和30的hcdr1、hcdr2和hcdr3的vh可与任何轻链可变区(vl)序列组合,并且可使用本文所述的测定法来测试所得的抗体与cd154的结合以产生特异性第结合cd154的抗体。
[0158]
例如,包含分别为seq id no:17、23和30的hcdr1、hcdr2和hcdr3的vh或seq id no:59的vh可用于筛选能够形成能够结合至cd154的二结构域特异性抗原结合片段的vl结构域。所述筛选可通过噬菌体展示筛选方法来完成,其中使用例如在pct公布no.wo1992/01047中公开的分级双重组合法。在该组合法中,使用包含h链克隆或l链克隆(例如,seq id no:59的vh)的单个菌落来感染编码另一条链(l或h)的克隆的完全文库,然后根据本文所述的噬菌体展示技术来选择所得的双链特异性抗原结合结构域,并测试其对cd154的结合和拮抗活性。
[0159]
或者,可将seq id no:59的vh或包含分别为seq id no:17、23和30的hcdr1、hcdr2和hcdr3的vh与现有cd154抗体或本文所述的cd154抗体的vl结构域组合,并测试所得的抗体对cd154的结合和拮抗活性。
[0160]
在一些实施方案中,本发明的抗体包含seq id no:65、66、67、68、69、70、71、72或73的轻链可变区(vl),任选地该vl包含一、二、三、四、五、六、七、八、九、十、十一、十二、十
三、十四或十五个氨基酸置换。
[0161]
在一些实施方案中,本发明的抗体包含seq id no:59的vh和seq id no:65、66、67、68、69、70、71、72或73的vl。
[0162]
在一些实施方案中,本发明的抗体包含seq id no:66、72或73的轻链可变区(vl),任选地该vl包含一、二、三、四、五、六、七、八、九、十、十一、十二、十三、十四或十五个氨基酸置换。
[0163]
在一些实施方案中,本发明的抗体包含seq id no:59的vh和seq id no:66的vl。
[0164]
在一些实施方案中,本发明的抗体包含seq id no:59的vh和seq id no:72的vl。
[0165]
在一些实施方案中,本发明的抗体包含seq id no:59的vh和seq id no:73的vl。
[0166]
在一些实施方案中,本发明的抗体在fc区中包含至少一处置换,其中该抗体不活化人血小板。
[0167]
在一些实施方案中,本发明的抗体对fcγri、fcγriia、fcγriib、fcγriiia或fcγriiib具有降低的结合。
[0168]“降低的结合”是指在fc区中具有至少一处置换的本发明的抗体与fcγr受体的结合相比于没有置换的亲本抗体与相同fcγr受体的结合有所降低。“降低的结合”可以是至少约100倍、至少约500倍、至少约1000倍、至少约5000倍、至少约10,000倍或至少约20,000倍的降低的结合。实际上,对特定fcγr表现出“降低的结合”的抗体是指具有统计意义上不显著的由该特定fcγ介导的效应子功能的抗体。
[0169]
在一些实施方案中,本发明的抗体在fc区中包含至少一处置换。
[0170]
在一些实施方案中,fc区中的至少一处置换是置换l234a、l235a、g237a、p238s、m252y、s254t、t256e、h268a、a330s或p331s,其中根据eu索引对残基进行编号。
[0171]
在一些实施方案中,本发明的抗体在fc区中包含置换l234a、l235a、g237a、p238s、h268a、a330s或p331s,其中根据eu索引对残基进行编号。
[0172]
在一些实施方案中,fc区中的至少一处置换是置换v234a、g237a、p238s、m252y、s254t、t256e、h268a、v309l、a330s或p331s,其中根据eu索引对残基进行编号。
[0173]
在一些实施方案中,本发明的抗体在fc区中包含置换v234a、g237a、p238s、h268a、v309l、a330s和p331s,其中根据eu索引对残基进行编号。
[0174]
本发明还提供了特异性地结合seq id no:1的cd154的拮抗性抗体或其抗原结合部分,其包含seq id no:80的重链和seq id no:81的轻链。
[0175]
本发明还提供了特异性地结合seq id no:1的cd154的拮抗性抗体或其抗原结合部分,其包含seq id no:82的重链和seq id no:81的轻链。
[0176]
本发明还提供了特异性地结合seq id no:1的cd154的拮抗性抗体或其抗原结合部分,其包含seq id no:83的重链和seq id no:81的轻链。
[0177]
seq id no:80(igg1sigma:c4lb231 hc上的c4lb89vh)
[0178]
qvqlvqsgaevkkpgssvkvsckasggtfssygiswvrqapgqglewmgwispifgntnyaqkfqgrvtitadeststaymelsslrsedtavyycarsryygdldywgqgtlvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkkvepkscdkthtcppcpapeaagassvflfppkpkdtlmisrtpevtcvvvdvsaedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpssiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsd
iavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk
[0179]
seq id no:81(c4lb89和c4lb231的轻链)
[0180]
diqmtqspsslsasvgdrvtitcrasqsissylnwyqqkpgkapklliyyansl
[0181]
qsgvpsrfsgsgsgtdftltisslqpedfatyycqqsdsipwtfgqgtkveikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec
[0182]
seq id no:82(igg1sigmayte上的c4lb89 vh)
[0183]
qvqlvqsgaevkkpgssvkvsckasggtfssygiswvrqapgqglewmgwispifgntnyaqkfqgrvtitadeststaymelsslrsedtavyycarsryygdldywgqgtlvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkkvepkscdkthtcppcpapeaagassvflfppkpkdtlyitrepevtcvvvdvsaedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpssiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk
[0184]
seq id no:83(igg2sigma上的c4lb89 vh)
[0185]
qvqlvqsgaevkkpgssvkvsckasggtfssygiswvrqapgqglewmgwispifgntnyaqkfqgrvtitadeststaymelsslrsedtavyycarsryygdldywgqgtlvtvssastkgpsvfplapcsrstsestaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssnfgtqtytcnvdhkpsntkvdktverkccvecppcpappaaassvflfppkpkdtlmisrtpevtcvvvdvsaedpevqfnwyvdgvevhnaktkpreeqfnstfrvvsvltvlhqdwlngkeykckvsnkglpssiektisktkgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppmldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk
[0186]
本发明的抗体的免疫效应子特性可通过本领域技术人员已知的技术经由fc修饰得到增强或沉默。例如,fc效应子功能诸如c1q结合、补体依赖性细胞毒性(cdc)、抗体依赖性细胞介导的细胞毒性(adcc)、吞噬作用、细胞表面受体(例如b细胞受体;bcr)的下调等,可通过修饰促成这些活性的fc中的残基来提供和/或控制。例如,可将fc置换v234a/g237a/p238s、v234a/g237a/h268q、h268a/v309l/a330s/p331或v234a/g237a/p238s/h268a/v309l/a330s/p331s(国际专利公布no.wo11/066501)或者l234a/l235a/g237a/p238s/h268a/a330s/p331s引入本发明的抗体。
[0187]
本发明的抗体与fcγri、fcγriia、fcγriib、fcγriiia和fcγriiib的结合可使用fcγ受体的重组可溶形式或细胞相关形式来评估。例如,可应用直接或间接(例如,竞争性结合)测量来评估本发明抗体对各种fcγr的相对亲和力和抗体亲抗原性。在示例性测定中,使用1μg/ml生物素酰化人igg1和系列稀释度的与抗原预先复合的测试抗体之间的竞争性结合来评估板上捕获的与可溶性fcγr结合的测试抗体。
[0188]
在一些实施方案中,本发明的抗体具有降低的抗体依赖细胞毒性(adcc)、抗体依赖性细胞吞噬作用(“adcp”)和/或补体依赖性细胞毒性(cdc)。
[0189]“抗体依赖性细胞的细胞毒性”、“抗体依赖性细胞介导的细胞毒性”或“adcc”是诱导细胞死亡的机制,该机制依赖于抗体包被靶细胞与具有裂解活性的效应子细胞(诸如自然杀伤细胞、单核细胞、巨噬细胞和中性粒细胞)经由效应子细胞上表达的fcγ受体(fcγr)发生的相互作用。例如,nk细胞表达fcγriiia,而单核细胞表达fcγri、fcγrii和fcγriiia。为评估本发明抗体的adcc活性,可将抗体与免疫效应子细胞组合加入到靶细胞中,
该免疫效应子细胞可被抗原抗体复合物激活,从而使靶细胞发生细胞裂解。通常根据从裂解细胞中释放的标记(例如放射性底物、荧光染料或天然胞内蛋白)来检测细胞溶解。用于此类测定法的示例性效应子细胞包括外周血单核细胞(pbmc)和nk细胞。示例性靶细胞包括d1.1 jurkat细胞(crl-10915
tm
)或表达cd154的t细胞。
[0190]“抗体依赖性细胞吞噬作用”(“adcp”)是指通过吞噬细胞(诸如巨噬细胞或树突状细胞)的内化作用消除抗体包被的靶细胞的机制。可使用单核细胞来源的巨噬细胞作为效应子细胞和经工程化以表达gfp或其他标记分子的表达cd154的d1.1 jurkat细胞作为靶细胞来评估adcp。效应子细胞:靶细胞比率可为例如4:1。可在含或不含测试cd154抗体的情况下,将效应子细胞与靶细胞一起温育4小时。在温育后,可使用细胞消化液(accutase)分离细胞。可使用偶联至荧光标记的抗-cd11b抗体和抗-cd14抗体鉴定巨噬细胞,并且可使用标准方法基于cd11
cd14
巨噬细胞中的gfp荧光%确定吞噬百分比。
[0191]“补体依赖性细胞毒性”或“cdc”是指诱导细胞死亡的机制,其中靶结合抗体的fc效应子结构域结合并激活补体组分c1q,c1q继而激活补体级联,从而导致靶细胞死亡。补体的激活也可导致补体组分沉积在靶细胞表面上,这些补体成分通过结合白细胞上的补体受体(例如,cr3)来促进adcc。cd154表达细胞的cdc可例如通过以下方式来测量:将jurkat细胞接种到合适的培养基中,将抗cd154抗体加入到该混合物中,随后加入混合的人血清。在温育期之后,可使用标准方法检测facs测定中的碘化丙锭染色细胞%,作为裂解细胞百分比(%)。
[0192]“降低的adcc”“降低的cdc”和“降低的adcp”是指在测量adcc、cdc和/或adcp的标准测定(诸如本文所述的测定和美国专利no.8,871,204中所述的测定)中统计意义上不显著的抗体诱导的adcc、cdc和/或adcp。
[0193]
通过人cd154或狨猴cd154淘选并且任选地通过进一步抗体亲和力成熟,可从变体或片段的文库中选择具有所需的亲和力与中和分布的本发明的抗体。在示例性的淘选活动中,可用狨猴cd154淘选噬菌体文库。另选地,可用人cd154或狨猴cd154或两者使小鼠免疫,接着筛选结合至人cd154的杂交瘤,随后使用本文所述的方法评估抗体的拮抗特性,由此产生本发明的抗体。
[0194]
在一些实施方案中,本发明的抗体与包含seq id no:59的vh和seq id no:66的vl的抗体竞争结合至cd154。
[0195]
使用熟知的方法,可在体外测定特异性结合至cd154的抗体与包含特定vh序列和vl序列的本发明抗体之间的竞争。例如,msd sulfo-tag
tm
nhs酯标记抗体在未标记抗体的存在下对cd154的结合可通过elisa进行评估,或者可使用bioacore分析法或流式细胞术来证实与本发明的抗体的竞争作用。当该抗体抑制参考抗体(例如,包含seq id no:59的vh和seq id no:66的vl的抗体)与cd154的结合达80%或以上(例如,85%或以上、90%或以上或者95%或以上)时,该抗体与参考抗体竞争结合至cd154。
[0196]
在一些实施方案中,seq id no:59的vh可与国际专利公布no.wo1993/08207、wo1994/10308、wo1996/40918、wo1993/009812、wo1999/051258、wo1995/006480、wo1995/006481、wo1995/006666、wo2001/002057、wo1997/017446、wo1999/012566、wo2001/068860、wo2005/003175、wo2006/033702、wo2006/030220、wo2008/118356、wo2012/052205、wo2012/138768、wo2012/138768、wo2013/055745和wo2013/056068中所述的抗cd154抗体中的任一
者的vl组合以产生拮抗性抗cd154抗体。所得抗体的结合和拮抗活性可使用本文所述的测定法和方案来测试。
[0197]
本发明还提供了特异性地结合seq id no:1的cd154的拮抗性抗体,其包含以下的hcdr1、hcdr2和hcdr3:
[0198]
分别为seq id no:16、22和29;
[0199]
分别为seq id no:17、23和30;
[0200]
分别为seq id no:16、24和31;
[0201]
分别为seq id no:18、25和32;
[0202]
分别为seq id no:19、26和33;
[0203]
分别为seq id no:20、27和34;或者
[0204]
分别为seq id no:21、28和35。
[0205]
本发明还提供了特异性地结合seq id no:1的cd154的拮抗性抗体,其包含以下的hcdr1、hcdr2和hcdr3:
[0206]
分别为seq id no:16、22和29;
[0207]
分别为seq id no:17、23和30;
[0208]
分别为seq id no:16、24和31;
[0209]
分别为seq id no:18、25和32;
[0210]
分别为seq id no:19、26和33;
[0211]
分别为seq id no:20、27和34;或者
[0212]
分别为seq id no:21、28和35,以及以下的lcdr1、lcdr2和lcdr3:
[0213]
分别为seq id no:36、43和51;
[0214]
分别为seq id no:37、44和52;
[0215]
分别为seq id no:38、45和53;
[0216]
分别为seq id no:39、46和54;
[0217]
分别为seq id no:40、47和55;
[0218]
分别为seq id no:41、47和56;
[0219]
分别为seq id no:42、48和57;
[0220]
分别为seq id no:37、49和52;或者
[0221]
分别为seq id no:37、50和52。
[0222]
在一些实施方案中,本发明的抗体包含分别为seq id no:16、22和29的hcdr1、hcdr2和hcdr3,以及分别为seq id no:36、43和51的lcdr1、lcdr2和lcdr3;或者seq id no:58的vh和seq id no:65的vl。
[0223]
在一些实施方案中,本发明的抗体包含分别为seq id no:17、23和30的hcdr1、hcdr2和hcdr3,以及分别为seq id no:37、44和52的lcdr1、lcdr2和lcdr3;或者seq id no:59的vh和seq id no:66的vl。
[0224]
在一些实施方案中,本发明的抗体包含分别为seq id no:16、24和31的hcdr1、hcdr2和hcdr3,以及分别为seq id no:38、45和53的lcdr1、lcdr2和lcdr3;或者seq id no:60的vh和seq id no:67的vl。
[0225]
在一些实施方案中,本发明的抗体包含分别为seq id no:18、25和32的hcdr1、
hcdr2和hcdr3,以及分别为seq id no:39、46和54的lcdr1、lcdr2和lcdr3;或者seq id no:61的vh和seq id no:68的vl。
[0226]
在一些实施方案中,本发明的抗体包含分别为seq id no:19、26和33的hcdr1、hcdr2和hcdr3,以及分别为seq id no:40、47和55的lcdr1、lcdr2和lcdr3;或者seq id no:62的vh和seq id no:69的vl。
[0227]
在一些实施方案中,本发明的抗体包含分别为seq id no:20、27和34的hcdr1、hcdr2和hcdr3,以及分别为seq id no:41、47和56的lcdr1、lcdr2和lcdr3;或者seq id no:63的vh和seq id no:70的vl。
[0228]
在一些实施方案中,本发明的抗体包含分别为seq id no:21、28和35的hcdr1、hcdr2和hcdr3,以及分别为seq id no:42、48和57的lcdr1、lcdr2和lcdr3;或者seq id no:64的vh和seq id no:71的vl。
[0229]
在一些实施方案中,本发明的抗体包含分别为seq id no:17、23和30的hcdr1、hcdr2和hcdr3,以及分别为seq id no:37、49和52的lcdr1、lcdr2和lcdr3;或者seq id no:59的vh和seq id no:72的vl。
[0230]
在一些实施方案中,本发明的抗体包含分别为seq id no:17、23和30的hcdr1、hcdr2和hcdr3,以及分别为seq id no:37、50和52的lcdr1、lcdr2和lcdr3;或者seq id no:59的vh和seq id no:73的vl。
[0231]
在一些实施方案中,本发明的抗体包含vh和vl,其中vh包含seq id no:58、59、60、61、62、63或64的氨基酸序列。
[0232]
在一些实施方案中,本发明的抗体包含vh和vl,其中vl包含seq id no:65、66、67、68、69、70、71、72或73的氨基酸序列。
[0233]
在一些实施方案中,本发明的抗体包含为seq id no:58、59、60、61、62、63或64的vh和seq id no:65、66、67、68、69、70、71、72或73的vl。
[0234]
在一些实施方案中,本发明的抗体包含seq id no:65、66、67、68、69、70、71、72或73的vh的hcdr1、hcdr2和hcdr3氨基酸序列和seq id no:65、66、67、68、69、70、71、72或73的vl的lcdr1、lcdr2和lcdr3氨基酸序列,其中这些cdr根据kabat、chothia和/或imgt定义。
[0235]
包含表8、表9和表14所示的vh或vl氨基酸序列的本发明抗体的变体在本发明的范围内。例如,变体可在vh和/或vl中包含一、二、三、四、五、六、七、八、九、十、十一、十二、十三、十四或十五个不会对抗体特性产生不利影响的氨基酸置换。在一些实施方案中,相对于本发明的vh或vl氨基酸序列的序列同一性可为约90%、91%、92%、93%、94%、95%、96%、97%、98%或99%。
[0236]
两个序列之间的同一性百分比是序列所共有的相同位置数目的函数(即,同一性%=相同位置的数目/位置总数
×
100),考虑到空位数目和每个空位的长度,需要引入这些参数用于两个序列的最佳比对。
[0237]
两个氨基酸序列之间的同一性百分比可采用e.meyers和w.miller(comput.appl.biosci.,4:11-17(1988))算法来确定,该算法已经并入align程序(版本2.0)中并使用pam120加权残基表、空位长度罚分12和空位罚分4。此外,两个氨基酸序列之间的同一性百分比可采用needleman和wunsch(j.mol.biol.48:444-453(1970))算法来确定,该算法已经并入gcg软件包的gap程序中(可从http://_www_gcg_com获得)并使用
blossum 62矩阵或pam250矩阵以及空位权重16、14、12、10、8、6或4和长度权重1、2、3、4、5或6。
[0238]
在一些实施方案中,本发明的抗体包含与seq id no:58、59、60、61、62、63或64的vh具有至少90%、90%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的vh,其中该抗体表现出以下特性中的一者或多者:
[0239]
抗体和shcd154的免疫复合物不活化血小板,其中血小板活化通过血小板上的p-选择素表面表达来测量;
[0240]
以约5
×
10-9
m或更小的解离常数(kd)结合至cd154,其中该kd是利用proteon xpr36系统使用实施例1中描述的亲和力测量实验设计进行测量的;
[0241]
以约2.7
×
10-9
m或更小的ic
50
值抑制cd154介导的人b细胞增殖;或者
[0242]
在稳定地表达seap和人cd40的hek293细胞中以约2.1
×
10-8
m或更小的ic
50
值在nf-κb诱导型干扰素-β(ifn-β)最小启动子下抑制cd154介导的分泌型胚胎碱性磷酸酶(seap)的表达。
[0243]
在一些实施方案中,本发明的抗体包含与seq id no:65、66、67、68、69、70、71、72或73的vl具有至少90%、90%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的vl,其中该抗体表现出以下特性中的一者或多者:
[0244]
抗体和shcd154的免疫复合物不活化血小板,其中血小板活化通过血小板上的p-选择素表面表达来测量;
[0245]
以约5
×
10-9
m或更小的解离常数(kd)结合至cd154,其中该kd是利用proteon xpr36系统使用实施例1中描述的亲和力测量实验设计进行测量的;
[0246]
以约2.7
×
10-9
m或更小的ic
50
值抑制cd154介导的人b细胞增殖;或者
[0247]
在稳定地表达seap和人cd40的hek293细胞中以约2.1
×
10-8
m或更小的ic
50
值在nf-κb诱导型干扰素-β(ifn-β)最小启动子下抑制cd154介导的分泌型胚胎碱性磷酸酶(seap)的表达。
[0248]
在一些实施方案中,本发明的抗体包含与seq id no:58、59、60、61、62、63或64的vh具有至少90%、90%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的vh和与seq id no:65、66、67、68、69、70、71、72或73的vl具有至少90%、90%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的vl,其中该抗体表现出以下特性中的一者或多者:
[0249]
抗体和shcd154的免疫复合物不活化血小板,其中血小板活化通过血小板上的p-选择素表面表达来测量;
[0250]
以约5
×
10-9
m或更小的解离常数(kd)结合至cd154,其中该kd是利用proteon xpr36系统使用实施例1中描述的亲和力测量实验设计进行测量的;
[0251]
以约2.7
×
10-9
m或更小的ic
50
值抑制cd154介导的人b细胞增殖;或者
[0252]
在稳定地表达seap和人cd40的hek293细胞中以约2.1
×
10-8
m或更小的ic
50
值在nf-κb诱导型干扰素-β(ifn-β)最小启动子下抑制cd154介导的分泌型胚胎碱性磷酸酶(seap)的表达。
[0253]
在一些实施方案中,本发明的抗体包含与seq id no:58的vh具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的vh。
[0254]
在一些实施方案中,本发明的抗体包含与seq id no:59的vh具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的vh。
[0255]
在一些实施方案中,本发明的抗体包含与seq id no:60的vh具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的vh。
[0256]
在一些实施方案中,本发明的抗体包含与seq id no:61的vh具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的vh。
[0257]
在一些实施方案中,本发明的抗体包含与seq id no:62的vh具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的vh。
[0258]
在一些实施方案中,本发明的抗体包含与seq id no:63的vh具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的vh。
[0259]
在一些实施方案中,本发明的抗体包含与seq id no:64的vh具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的vh。
[0260]
在一些实施方案中,本发明的抗体包含与seq id no:65的vl具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的vl。
[0261]
在一些实施方案中,本发明的抗体包含与seq id no:66的vl具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的vl。
[0262]
在一些实施方案中,本发明的抗体包含与seq id no:67的vl具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的vl。
[0263]
在一些实施方案中,本发明的抗体包含与seq id no:68的vl具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的vl。
[0264]
在一些实施方案中,本发明的抗体包含与seq id no:69的vl具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的vl。
[0265]
在一些实施方案中,本发明的抗体包含与seq id no:70的vl具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的vl。
[0266]
在一些实施方案中,本发明的抗体包含与seq id no:71的vl具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的vl。
[0267]
在一些实施方案中,本发明的抗体包含与seq id no:72的vl具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的vl。
[0268]
在一些实施方案中,本发明的抗体包含与seq id no:73的vl具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的vl。
[0269]
在一些实施方案中,本发明的抗体包含seq id no:58的vh和seq id no:65的vl,其中vh、vl或vh和vl二者任选地包含一、二、三、四、五、六、七、八、九、十、十一、十二、十三、十四或十五个氨基酸置换。
[0270]
在一些实施方案中,本发明的抗体包含seq id no:59的vh和seq id no:66的vl,其中vh、vl或vh和vl二者任选地包含一、二、三、四、五、六、七、八、九、十、十一、十二、十三、十四或十五个氨基酸置换。
[0271]
在一些实施方案中,本发明的抗体包含seq id no:60的vh和seq id no:67的vl,其中vh、vl或vh和vl二者任选地包含一、二、三、四、五、六、七、八、九、十、十一、十二、十三、十四或十五个氨基酸置换。
[0272]
在一些实施方案中,本发明的抗体包含seq id no:61的vh和seq id no:68的vl,其中vh、vl或vh和vl二者任选地包含一、二、三、四、五、六、七、八、九、十、十一、十二、十三、十四或十五个氨基酸置换。
[0273]
在一些实施方案中,本发明的抗体包含seq id no:62的vh和seq id no:69的vl,其中vh、vl或vh和vl二者任选地包含一、二、三、四、五、六、七、八、九、十、十一、十二、十三、十四或十五个氨基酸置换。
[0274]
在一些实施方案中,本发明的抗体包含seq id no:63的vh和seq id no:70的vl,其中vh、vl或vh和vl二者任选地包含一、二、三、四、五、六、七、八、九、十、十一、十二、十三、十四或十五个氨基酸置换。
[0275]
在一些实施方案中,本发明的抗体包含seq id no:64的vh和seq id no:71的vl,其中vh、vl或vh和vl二者任选地包含一、二、三、四、五、六、七、八、九、十、十一、十二、十三、十四或十五个氨基酸置换。
[0276]
在一些实施方案中,本发明的抗体包含seq id no:59的vh和seq id no:72的vl,其中vh、vl或vh和vl二者任选地包含一、二、三、四、五、六、七、八、九、十、十一、十二、十三、十四或十五个氨基酸置换。
[0277]
在一些实施方案中,本发明的抗体包含seq id no:59的vh和seq id no:73的vl,其中vh、vl或vh和vl二者任选地包含一、二、三、四、五、六、七、八、九、十、十一、十二、十三、十四或十五个氨基酸置换。
[0278]
在一些实施方案中,本发明的抗体包含表8、表9和表14所示的hcdr1、hcdr2、hcdr3、lcdr1、lcdr2和lcdr3氨基酸序列或其保守修饰,并且其中所述抗体保留拮抗性抗体特异性地结合cd154的所需的功能特性。
[0279]
在一些实施方案中,本发明的抗体包含分别为seq id no:16、22和29的hcdr1、hcdr2和hcdr3,以及它们的保守修饰。
[0280]
在一些实施方案中,本发明的抗体包含分别为seq id no:17、23和30的hcdr1、hcdr2和hcdr3,以及它们的保守修饰。
[0281]
在一些实施方案中,本发明的抗体包含分别为seq id no:16、24和31的hcdr1、hcdr2和hcdr3,以及它们的保守修饰。
[0282]
在一些实施方案中,本发明的抗体包含分别为seq id no:18、25和32的hcdr1、hcdr2和hcdr3,以及它们的保守修饰。
[0283]
在一些实施方案中,本发明的抗体包含分别为seq id no:19、26和33的hcdr1、hcdr2和hcdr3,以及它们的保守修饰。
[0284]
在一些实施方案中,本发明的抗体包含分别为seq id no:20、27和34的hcdr1、hcdr2和hcdr3,以及它们的保守修饰。
[0285]
在一些实施方案中,本发明的抗体包含分别为seq id no:21、28和35的hcdr1、hcdr2和hcdr3,以及它们的保守修饰。
[0286]
在一些实施方案中,本发明的抗体包含分别为seq id no:36、43和51的lcdr1、lcdr2和lcdr3,以及它们的保守修饰。
[0287]
在一些实施方案中,本发明的抗体包含分别为seq id no:37、44和52的lcdr1、lcdr2和lcdr3,以及它们的保守修饰。
[0288]
在一些实施方案中,本发明的抗体包含分别为seq id no:38、45和53的lcdr1、lcdr2和lcdr3,以及它们的保守修饰。
[0289]
在一些实施方案中,本发明的抗体包含分别为seq id no:39、46和54的lcdr1、lcdr2和lcdr3,以及它们的保守修饰。
[0290]
在一些实施方案中,本发明的抗体包含分别为seq id no:40、47和55的lcdr1、lcdr2和lcdr3,以及它们的保守修饰。
[0291]
在一些实施方案中,本发明的抗体包含分别为seq id no:41、47和56的lcdr1、lcdr2和lcdr3,以及它们的保守修饰。
[0292]
在一些实施方案中,本发明的抗体包含分别为seq id no:42、48和57的lcdr1、lcdr2和lcdr3,以及它们的保守修饰。
[0293]
在一些实施方案中,本发明的抗体包含分别为seq id no:37、49和52的lcdr1、lcdr2和lcdr3,以及它们的保守修饰。
[0294]
在一些实施方案中,本发明的抗体包含分别为seq id no:37、50和52的lcdr1、lcdr2和lcdr3,以及它们的保守修饰。
[0295]
本发明的抗体包含表现出以下特性中的一者或多者的某些hcdr1、hcdr2、hcdr3、lcdr1、lcdr2和lcdr3序列
[0296]
以及它们的保守修饰:
[0297]
抗体和shcd154的免疫复合物不活化血小板,其中血小板活化通过血小板上的p-选择素表面表达来测量;
[0298]
以约5
×
10-9
m或更小的解离常数(kd)结合至cd154,其中该kd是利用proteon xpr36系统使用实施例1中描述的亲和力测量实验设计进行测量的;
[0299]
以约2.7
×
10-9
m或更小的ic
50
值抑制cd154介导的人b细胞增殖;或者
[0300]
在稳定地表达seap和人cd40的hek293细胞中以2.1
×
10-8
m或更小的ic
50
值在nf-κb诱导型干扰素-β(ifn-β)最小启动子下抑制cd154介导的分泌型胚胎碱性磷酸酶(seap)的表达。
[0301]“保守修饰”是指不会显著影响或改变含有氨基酸序列的抗体的结合特征的氨基酸修饰。保守修饰包括氨基酸置换、添加和缺失。保守置换是其中氨基酸被具有相似侧链的氨基酸残基替换的置换。具有相似侧链的氨基酸残基家族是明确定义的,包括具有如下侧链的氨基酸:酸性侧链(例如,天冬氨酸、谷氨酸)、碱性侧链(例如,赖氨酸、精氨酸、组氨酸)、非极性侧链(例如,丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、甲硫氨酸)、不带电极性侧链(例如,甘氨酸、天冬酰胺、谷氨酰胺、半胱氨酸、丝氨酸、苏氨酸、酪氨酸、色氨酸)、芳香族侧链(例如,苯丙氨酸、色氨酸、组氨酸、酪氨酸)、脂肪族侧链(例如,甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、丝氨酸、苏氨酸)、酰胺(例如,天冬酰胺、谷氨酰胺)、β-分支侧链(例如,苏氨酸、缬氨酸、异亮氨酸)以及含硫侧链(半胱氨酸、甲硫氨酸)。此外,多肽中的任何天然残基还可用丙氨酸来置换,如此前对于丙氨酸扫描诱变所述的(maclennan等人,acta physiol.scand.suppl.643:55-67,1998;sasaki等人,adv.biophys.35:1-24,1998)。对本发明的抗体的氨基酸置换可通过众所周知的方法进行,例如通过pcr诱变进行(美国专利no.4,683,195)。另选地,可使用已知的方法生成变体文库,例如使用随机(nnk)或非随机密码子(例如dvk密码子,其编码11个氨基酸(ala、cys、asp、glu、gly、lys、asn、
monoclonal technology,inc.(omt)(http://_www_omtinc_net)、kymab(http://_www_kymab_com)、trianni(http://_www.trianni_com)和ablexis(http://_www_ablexis_com)等公司使用上述技术以提供抗所选抗原的人抗体。
[0307]
人抗体可选自噬菌体展示文库,其中噬菌体经工程化以表达人免疫球蛋白或其部分,诸如fab、单链抗体(scfv)或者未配对或配对抗体可变区(knappik等人,j.mol biol 296:57-86,2000;krebs等人,j immunol meth 254:67-84,2001;vaughan等人,nature biotechnology 14:309-314,1996;sheets等人,pitas(usa)95:6157-6162,1998;hoogenboom和winter,j mol biol 227:381,1991;marks等人,j mol biol 222:581,1991)。可例如用噬菌体pix外壳蛋白从将抗体重链和轻链可变区表达为融合蛋白的噬菌体展示文库中分离出本发明的抗体,如shi等人,jmol biol 397:385-96,2010和国际专利公布wo09/085462中所述。可筛选文库中结合至人、狨猴和/或猕猴cd154的噬菌体,并可进一步表征获得的阳性克隆,从克隆裂解物分离fab,将其表达为全长igg。此类用于分离人抗体的噬菌体展示方法在以下专利中有所描述:例如授予ladner等人的美国专利no.5,223,409、no.5,403,484和no.5,571,698;授予dower等人的美国专利no.5,427,908和no.5,580,717;授予mccafferty等人的美国专利no.5,969,108和no.6,172,197;以及授予griffiths等人的美国专利no.5,885,793、no.6,521,404、no.6,544,731、no.6,555,313、no.6,582,915和no.6,593,081。
[0308]
免疫原性抗原的制备以及单克隆抗体的产生可用任何合适的技术诸如重组蛋白产生来执行。免疫原性抗原可按纯化蛋白质或蛋白质混合物(包括全细胞或细胞提取物或组织提取物)的形式施用于动物,或者抗原可在动物体内由编码所述抗原或其部分的核酸从头形成。
[0309]
本发明的抗体可为人抗体或人源化抗体。
[0310]
在一些实施方案中,本发明的抗体包含源自人种系基因vh1_1-69、vh4_4-39、vh1_1-02或vh4_4-59的vh框架。
[0311]
在一些实施方案中,本发明的抗体包含源自人种系基因vkiv_b3、vki_o12或vl3_3r的vl框架。
[0312]
本发明的抗体可为iga、igd、ige、igg或igm型。本发明的抗体可为igg1、igg2、igg3、igg4型。
[0313]
本发明的抗体可进一步工程化以产生与亲本抗体相比具有相似或改变的特性的经修饰的抗体。可对本发明抗体中的vh、vl、vh和vl、恒定区、vh框架、vl框架或六个cdr中的任一者或全部进行工程化。
[0314]
可通过cdr接枝来工程化本发明的抗体。本发明抗体的一个或多个cdr序列可被接枝到不同的框架序列中。cdr接枝可使用本文所述的方法来完成。在一些实施方案中,本发明的抗体包含vh和vl,该vh包含seq id no:16、17、18、19、20或21的hdcr1、seq id no:22、23、24、25、26、27或28的hcdr2、seq id no:29、30、31、32、33、34或35的hcdr3,该vl包含seq id no:36、37、38、39、40、41或42的lcdr1、seq id no:43、44、45、6、47、48、49或50的lcdr2和/或seq id no:51、52、53、54、55、56或57的lcdr3,其中该vh框架不源自vh1_1-69、vh4_4-39、vh1_1-02或vh4_4-59,并且该vl框架不源自vkiv_b3、vki_o12或vl3_3r。可从包括种系抗体基因序列的公共dna数据库或公开的参考文献中获得待使用的框架序列。例如,种系
dna和人重链和轻链可变区基因的编码蛋白质序列可见于国际免疫遗传学信息系统http://_www-imgt_org。可用于替换本发明抗体中现有框架序列的框架序列是显示出与c4lb5、c4lb89、c4lb94、c4lb150、c4lb189、c4lb191、c4lb199、c4lb231、c4lb232、c4lb35和c4lb256具有最高同一性百分比的那些。
[0315]
如例如在美国专利no.6,180,370中所述,可例如通过回复突变以恢复和/或改善所得抗体与抗原的结合来进一步修饰亲本抗体和工程化抗体的框架序列。可通过突变框架区内或者甚至一个或多个cdr区内的一个或多个残基以移除t细胞表位来进一步修饰亲本抗体和工程化抗体的框架序列,从而降低抗体的潜在免疫原性。这种方法也被称为“去免疫化”,并且在美国专利公布no.20030153043中有更详细的描述。
[0316]
本发明抗体的cdr残基可突变以改善感兴趣的抗体的一种或多种结合特性。可执行定点诱变或pcr介导的诱变来引入一个或多个突变,并且可在如本文所述的和实施例中提供的体外和体内测定中评估对抗体结合或感兴趣的其他功能特性的影响。可引入的示例性置换是如上文所讨论的保守修饰。此外,通常改变cdr区内不超过一、二、三、四或五个残基。
[0317]
可对本发明的抗体进行fc置换以调节抗体半衰期。例如,可引入置换m252y、s254t和t256e中的一者或多者以增加所得抗体的半衰期(dall’acqua等人,jbiol chem281:23514
–
240,2006)。
[0318]
另外,本发明的抗体可通过诸如糖基化、异构化、去糖基化或非天然存在的共价修饰(例如添加聚乙二醇部分(聚乙二醇化)和脂质化)等过程进行翻译后修饰。此类修饰可在体内或体外进行。例如,本发明的抗体可缀合至聚乙二醇(聚乙二醇化),以改善抗体的药代动力学特性。缀合可通过本领域技术人员已知的技术来执行。治疗抗体与peg的缀合已示出在不干扰功能的情况下增强药效学(knigh等人,platelets 15:409-18,2004;leong等人,cytokine 16:106-19,2001;yang等人,protein eng.16:761-70,2003)。
[0319]
经修饰以改善稳定性、选择性、交叉反应性、亲和力、免疫原性或其他所需生物学或生物物理学特性的本发明抗体或其片段处于本发明的范围内。抗体的稳定性受许多因素影响,包括(1)影响其内在稳定性的单独结构域的核心堆叠,(2)对hc和lc配对具有影响的蛋白质/蛋白质界面相互作用,(3)极性和带电残基的包埋,(4)极性和带电残基的h键网络;以及(5)其他分子内力和分子间力中的表面电荷和极性残基分布(worn等人,j mol biol 305:989-1010,2001)。潜在的结构不稳定残基可根据该抗体的晶体结构或在某些情况下通过分子建模来鉴定,并且所述残基对于抗体稳定性的影响可通过生成并评估在所鉴定残基中携带突变的变体来测试。一种增加抗体稳定性的方法是升高由差示扫描量热法(dsc)测得的热转变中点温度(tm)。一般来讲,蛋白质tm与其稳定性相关联,并且与其对溶液中的解折叠和变性以及依赖于蛋白质解折叠趋向的降解过程的敏感性负相关(remmele等人,biopharm 13:36-46,2000)。大量研究已经发现,通过dsc以热稳定性测得的制剂物理稳定性的级别与通过其他方法测得的物理稳定性之间存在相关性(gupta等人,aaps pharmsci 5e8,2003;zhang等人,j pharm sci 93:3076-89,2004;maa等人,int j pharm 140:155-68,1996;bedu-addo等人,pharm res 21:1353-61,2004;remmele等人,pharm res 15:200-8,1997)。制剂研究表明,fab tm对相应mab的长期物理稳定性有影响。
[0320]
在一些实施方案中,本发明的抗体是双特异性抗体。
[0321]
在一些实施方案中,本发明的抗体是多特异性抗体。
[0322]
本发明的特异性地结合cd154的单特异性抗体可工程化为双特异性抗体,该双特异性抗体也涵盖在本发明的范围内。可使用已公布的方法将本发明抗体的vl区和/或vh区工程化成结构诸如设计(国际专利公布no.wo1999/57150、美国专利公布no.2011/0206672)的单链双特异性抗体,或结构诸如美国专利no.5,869,620、国际专利公布wo1995/15388、国际专利公布wo1997/14719或国际专利公布no.wo2011/036460中所公开的那些的双特异性scfv。
[0323]
本发明抗体的vl区和/或vh区可被工程化为双特异性全长抗体,其中每条抗体臂结合不同的抗原或表位。可使用诸如以下专利中所述的那些技术,通过调节两条抗体重链之间的ch3相互作用以形成双特异性抗体,从而制备此类双特异性抗体:美国专利no.7,695,936、国际专利公布no.wo2004/111233、美国专利公布no.2010/0015133、美国专利公布no.2007/0287170、国际专利公布wo2008/119353、美国专利公布no.2009/0182127、美国专利公布no.2010/0286374、美国专利公布no.2011/0123532、国际专利公布no.wo2011/131746、国际专利公布no.wo2011/143545、或美国专利公布no.2012/0149876。
[0324]
例如,双特异性抗体可通过如下过程在无细胞环境中体外产生:根据国际专利公布no.wo2011/131746所述的方法,在两个单特异性同源二聚抗体的ch3区域中引入非对称突变,并在允许二硫键异构化的还原条件下由两个亲本单特异性同源二聚抗体形成双特异性异源二聚抗体。在该方法中,两种单特异性二价抗体被工程化以在ch3结构域处具有某些促进异源二聚体稳定性的置换;将这些抗体在足以使铰链区中的半胱氨酸发生二硫键异构化的还原条件下一起温育;从而通过fab臂交换产生双特异性抗体。温育条件最理想地可恢复到非还原条件。可使用的示例性还原剂为2-巯基乙胺(2-mea)、二硫苏糖醇(dtt)、二硫赤藓糖醇(dte)、谷胱甘肽、三(2-羧乙基)膦(tcep)、l-半胱氨酸和β-巯基乙醇,优选地为选自2-巯基乙胺、二硫苏糖醇和三(2-羧乙基)膦的还原剂。例如,可使用如下条件:在至少25mm 2-mea的存在下或至少0.5mm二硫苏糖醇的存在下,在5-8的ph例如ph7.0或ph7.4,至少20℃的温度下,温育至少90分钟。
[0325]
可用于双特异性抗体的第一重链和第二重链的示例性ch3突变是k409r和/或f405l。
[0326]
可在其中结合本发明的抗体的vl区和/或vh区的另外的双特异性结构,是例如双可变结构域免疫球蛋白(dual variable domain immunoglobulins,dvd)(国际专利公布wo2009/134776),或包括多种二聚化结构域以连接具有不同特异性的两条抗体臂的结构,诸如亮氨酸拉链或胶原二聚化结构域(国际专利公布wo2012/022811、美国专利5,932,448、美国专利no.6,833,441)。dvd为包含具有结构vh1-接头-vh2-ch的重链和具有结构vl1-接头-vl2-cl的轻链的全长抗体;接头是任选的。
[0327]
本发明还提供了特异性地结合seq id no:1的cd154的具有某些vh和vl序列的拮抗性抗体,其中抗体vh由第一多核苷酸编码且抗体vl由第二合成多核苷酸编码。该多核苷酸可为互补脱氧核酸(cdna),并且可经过密码子优化,以便在合适的宿主中表达。密码子优化是一种熟知的技术。
[0328]
在一些实施方案中,编码本发明的抗体vh或vl的多核苷酸包含seq id no:76、77、78或79的序列。
[0329]
seq id no:76(编码c4lb231的vh)
[0330]
gacatccagatgacccagagccccagcagcctgagcgccagcgtgggcgacagagtgaccatcacctgtcgggccagccagagcatcagcagctacctgaactggtatcagcagaagcccggcaaggcccccaagctgctgatctactacgccaacagcctgcagagcggcgtgcccagcagattcagcggcagcggctccggcaccgacttcaccctgaccatcagcagcctgcagcccgaggacttcgccacctactactgccagcagagcgacagcatcccctggaccttcggccagggcaccaaggtggaaatcaag
[0331]
seq id no:77(编码c4lb231的vl)
[0332]
caggtccagctggtgcagtctggcgccgaagtgaagaaacccggcagcagcgtgaaggtgtcctgcaaggccagcggcggcaccttcagcagctacggcatcagctgggtccgacaggccccaggacagggcctggaatggatgggctggatcagccccatcttcggcaacaccaactacgcccagaaattccagggcagagtgaccatcaccgccgacgagagcaccagcaccgcctacatggaactgagcagcctgcggagcgaggacaccgccgtgtactactgcgccagaagccggtactacggcgacctggactactggggccagggcaccctggtcaccgtgtcctct
[0333]
seq id no:78(编码c4lb191的vh)
[0334]
caggtgcagctggtgcagagcggcgctcaggtgcagctggtgcagtctggcgccgaagtgaagaaacctggcgccagcatgaaggtgtcctgcaaggccagcggctacaccttcaccgactactacatccactgggtgcgccaggccccaggccagggactggaatgggtgggacggttcaaccccaacagcggcgacaccaacggcgcccagaaattccagggcagagtgaccatgacccgggacaccagcatcagcaccgcctacatggaactgacccggctgcggagcgacgacaccgccgtgtaccactgtgccagagagggcgagctggccggcatcttcttcgactactggggccagggcaccctggtgacagtgtccagc
[0335]
seq id no:79(编码c4lb191的vl)
[0336]
agctacgagctgacccagccccccagcgtgtccgtgtctcctggccagaccgccagcatcacctgtagcggcgacaagctgggcgacaaatacgtgtcctggaaccaccagaagcccggccagagccccgtgctggtgatctaccaggaccggaagaggcccagcggcatccccgagagattcagcggcagcaacagcggcaacaccgccaccctgaccatcagcggcacccaggccatggacgaggccgactactactgccaggcctgggacagcagcaccgtggtgttcggcggaggcaccaagctgaccgtgctg
[0337]
本发明还提供了编码本发明的抗体重链可变区、抗体轻链可变区、抗体重链和/或抗体轻链中的任一者的分离的多核苷酸。本文公开了某些示例性的多核苷酸,但是,鉴于在给定表达系统中的遗传密码简并性或密码子优先性而编码本发明抗体的其它多核苷酸也在本发明的范围内。示例性的多核苷酸为例如具有以seq id nos:76、77、78和79示出的序列的多核苷酸。编码本发明抗体的vh或vl或它们的片段的多核苷酸序列可有效连接至一个或多个调控元件,诸如启动子或增强子,所述调控元件允许核苷酸序列在预期宿主细胞中表达。多核苷酸可为cdna。
[0338]
本发明还提供了包含本发明的多核苷酸的载体。此类载体可以是质粒载体、病毒载体、用于杆状病毒表达的载体、基于转座子的载体或任何其他适于通过任何手段将本发明的合成多核苷酸引入给定生物体或遗传背景中的载体。例如,将任选地连接至恒定区并且编码本发明抗体的轻链可变区和/或重链可变区的多核苷酸插入表达载体中。可将轻链和/或重链克隆到相同或不同的表达载体中。可将编码免疫球蛋白链的dna片段有效连接至一个或多个表达载体中确保免疫球蛋白多肽表达的对照序列。对此类对照序列进行选择以使其与选择用于表达抗体的宿主细胞相容,此类对照序列包括信号序列、启动子(例如,天
然相关联的或异源的启动子)、增强子元件和转录终止子序列。载体被结合到适当的宿主后,将宿主保持在适于蛋白质的高水平表达的条件下,所述蛋白质由结合的多核苷酸编码。
[0339]
合适的表达载体通常可以在宿主生物体中作为游离基因或作为宿主染色体dna的一体部分进行复制。通常,表达载体包含选择标记,诸如氨苄青霉素抗性、潮霉素抗性、四环素抗性、卡那霉素抗性或新霉素抗性,以便对那些用所需dna序列转化的细胞进行检测。
[0340]
合适的启动子和增强子元件是本领域已知的。为了在真核细胞中表达,示例性启动子包括:轻链和/或重链免疫球蛋白基因启动子和增强子元件、细胞巨化病毒立即早期启动子、单纯疱疹病毒的胸苷激酶启动子、sv40早期和晚期启动子、存在于逆转录病毒的长末端重复序列中的启动子、小鼠金属硫蛋白-i启动子、和各种本领域已知的组织特异性启动子。选择适当的载体和启动子在本领域普通技术人员的水平范围内。
[0341]
许多合适的载体和启动子是本领域技术人员已知的,它们中的很多可商购获得以用于生成目标重组构建体。以下载体以举例的方式提供。细菌载体:pbs、phagescript、psix174、pbluescript sk、pbs ks、pnh8a、pnh16a、pnh18a、pnh46a(stratagene,la jolla,calif.,usa);ptrc99a、pkk223-3、pkk233-3、pdr540和prit5(pharmacia,uppsala,sweden)。真核载体:pwlneo、psv2cat、pog44、pxr1、psg(stratagene),psvk3、pbpv、pmsg和psvl(pharmacia)。
[0342]
本发明还提供包含本发明的一种或多种载体的宿主细胞。“宿主细胞”是指其中已引入载体的细胞。应当理解,术语宿主细胞不仅旨在指特定的受试细胞,还指这种细胞的子代,而且也指由特定受试细胞产生的稳定细胞系。由于突变或者由于环境影响,在后代中可能出现某些修饰,因此这种子代可能与亲本细胞不同,但仍包含在本文所用的术语“宿主细胞”的范围内。此类宿主细胞可以是真核细胞、原核细胞、植物细胞或古菌细胞。
[0343]
大肠杆菌(escherichia coli)、杆菌属(bacilli)(诸如枯草芽孢杆菌(bacillus subtilis))和其他肠杆菌科(enterobacteriaceae)(诸如沙门氏菌(salmonella)、沙雷氏菌(serratia))以及各种假单胞菌属(pseudomonas)物种是原核宿主细胞的示例。其他微生物诸如酵母也可用于表达。酵母属(saccharomyces)(例如,酿酒酵母(s.cerevisiae))和毕赤酵母是合适的酵母宿主细胞的示例。示例性真核细胞可以是哺乳动物、昆虫、禽类或其它动物来源。哺乳动物真核细胞包括无限增殖化细胞系,诸如杂交瘤或骨髓瘤细胞系,诸如sp2/0(美国典型培养物保藏中心(atcc),manassas,va,crl-1581)、ns0(欧洲细胞培养物保藏中心(ecacc),salisbury,wiltshire,uk,ecacc no.85110503)、fo(atcc crl-1646)和ag653(atcc crl-1580)鼠细胞系。一种示例性人骨髓瘤细胞系是u266(attc crl-tib-196)。其他可用的细胞系包括衍生自中国仓鼠卵巢(cho)细胞的那些细胞系,诸如cho-k1sv(lonza biologics,walkersville,md)、cho-k1(atcc crl-61)或dg44。
[0344]
本发明还提供了制备本发明抗体的方法,该方法包括在使抗体表达的条件下培养本发明的宿主细胞,以及回收由宿主细胞产生的抗体。制备抗体并将其纯化的方法是本领域所熟知的。全部抗体、其二聚体、各条轻链和/或重链、或者其他抗体片段(诸如vh和/或vl)一旦被合成(以化学方式或重组方式),就可根据标准程序进行纯化,所述标准程序包括硫酸铵沉淀、亲和色谱柱、柱层析法、高效液相色谱(hplc)纯化、凝胶电泳等等(参见generally scopes,protein purification(springer-verlag,n.y.,(1982))。受试抗体可以基本上是纯化的,例如,至少约80%至85%纯化、至少约85%至90%纯化、至少约90%至
95%纯化、或至少约98%至99%纯化,或者更加纯化,例如不含污染物(诸如细胞碎片、除受试抗体之外的大分子等)。
[0345]
本发明还提供了制备特异性地结合seq id no:1的cd154的拮抗性抗体的方法,该方法包括:
[0346]
将编码抗体vh的第一多核苷酸和编码抗体vl的第二多核苷酸结合到表达载体中;
[0347]
用该表达载体转化宿主细胞;
[0348]
在使vl和vh表达以及形成所述抗体的条件下,在培养基中培养宿主细胞;以及
[0349]
从宿主细胞或培养基回收抗体。
[0350]
可使用标准分子生物学方法将编码本发明的特定vh或vi序列的多核苷酸结合到载体中。使用熟知的方法完成宿主细胞转化、培养、抗体表达和纯化。
[0351]
治疗方法
[0352]
特异性地结合cd154的本发明的拮抗性抗体,例如抗体c4lb5、c4lb89、c4lb94、c4lb150、c4lb189、c4lb191、c4lb199、c4lb231、c4lb232、c4lb35和c4lb236,可用于治疗和/或预防其中拮抗cd154的作用可以是治疗有效的并且可减轻疾病症状的任何病症或疾病。其示例包括过敏、自身免疫、癌症、移植、gvhd、炎症和其他病症的治疗,尤其是其中耐受性的诱导和/或体液免疫的抑制是治疗上期望的那些病症。可用本发明的抗体治疗的疾病是免疫介导的炎性疾病或自身免疫性疾病,诸如关节炎、系统性红斑狼疮(sle)、炎性肠病、移植、肾移植、皮肤移植、骨髓移植、移植物抗宿主病(gvhd)、免疫性血小板减少症(itp)、多发性硬化症、甲状腺炎、i型糖尿病或动脉粥样硬化。
[0353]
除了简单地阻断cd154-cd40相互作用之外,抗cd154疗法还造成诱导免疫耐受性(gordon等人,diabetes,1988年第47期:第1199-1206页;markees等人,transplantation,1997年第64期:第329-335页;jarvinen等人,transplantation,2003年第76期:第1375-1379页;quezada等人,blood,2003年第102期:第1920-1926页;frleta等人,j immunother,2003年第26期:第72-84页;elster等人,transplantation,2001年第72期:第1473-1478页;benda等人,cell transplantation,2002年第11期:第715-720页;wekerle和sykes,annual review of medicine,2001年第52期:第353-370
19
页;camirand等人,transplantation,2002年第73期:第453-461页)。
[0354]
本发明还提供了一种治疗免疫介导的炎性疾病或自身免疫性疾病的方法,该方法包括将治疗有效量的本发明的抗体施用给对其有需要的受试者,维持足以治疗免疫介导的炎性疾病或自身免疫性疾病的一段时间。
[0355]
本发明还提供了一种治疗关节炎的方法,该方法包括将治疗有效量的本发明的抗体施用给对其有需要的受试者,维持足以治疗关节炎的一段时间。
[0356]
在一些实施方案中,关节炎是幼年型关节炎、类风湿性关节炎、银屑病关节炎、莱特氏综合征、强直性脊柱炎或痛风性关节炎。
[0357]
本发明还提供了一种治疗狼疮的方法,该方法包括将治疗有效量的本发明的抗体施用给对其有需要的受试者,维持足以治疗狼疮的一段时间。
[0358]
在一些实施方案中,狼疮为系统性红斑狼疮(sle)或皮肤型红斑狼疮(cle)。
[0359]
在一些实施方案中,受试者患有狼疮性肾炎。
[0360]
本发明还提供了一种治疗炎性肠病的方法,该方法包括将治疗有效量的本发明的
抗体施用给对其有需要的受试者,维持足以治疗炎性肠病的一段时间。
[0361]
在一些实施方案中,炎性肠病是克罗恩氏病。
[0362]
在一些实施方案中,炎性肠病是溃疡性结肠炎。
[0363]“治疗”是指用治疗药物进行治疗。需要治疗的个体包括被诊断患有疾病或呈现疾病症状的受试者。可治疗的受试者还包括倾向于或易于患上疾病、但其疾病将得到预防的那些。有益或期望的临床结果包括症状的减轻、疾病程度的减弱、疾病状态的稳定(即,未恶化)、疾病进展的延迟或减慢、疾病状态的改善或缓和,以及缓解(不论是部分缓解还是完全缓解),不论是可检测的还是不可检测的。有益的临床结果包括,在已经接受治疗的受试者体内,例如b细胞或树突细胞的增殖减少;炎性细胞因子、粘附分子、蛋白酶、免疫球蛋白(在cd40携带细胞是b细胞的情况下)及其组合减少;抗炎蛋白质的产生增加;自身反应性细胞数量的减少;免疫耐受性的增加;自身反应性细胞存活的抑制,和/或由cd154刺激cd40表达细胞所介导的一种或多种症状的减少。
[0364]
可以使用如下筛查技术来评估临床反应,诸如磁共振成像(mri)扫描、x射线照相成像、计算机断层(ct)扫描、流式细胞术或荧光激活细胞分选仪(facs)分析、组织学、总体病理学和血液化学,包括但不限于可通过elisa、ria、色谱法等而检测的变化。
[0365]
可用于本发明方法中的示例性抗体包含表2、表3、表4、表5、表6、表7、表8、表9、表13和表14中所示的vh,vl,hcdr和/或lcdr区,和抗体c4lb5、c4lb89、c4lb94、c4lb150、c4lb189、c4lb191、c4lb199、c4lb231、c4lb232、c4lb35以及c4lb236。
[0366]
本发明的方法可用于治疗属于任何动物分类的受试者。可受治疗的受试者示例包括哺乳动物,诸如人、啮齿动物、犬类、猫类和农畜。
[0367]
本发明的抗体可用于制备用于此类治疗的药物,其中所述药物被制备用于按本文限定的剂量施用。
[0368]
本发明的抗体可与第二治疗剂联合施用。
[0369]
第二治疗剂可以是任何已知的用于自身免疫疾病和炎性疾病的疗法,包括已知可用的、或已经使用的、或正在用于治疗自身免疫疾病和炎性疾病的任何试剂或试剂的组合。这种疗法和治疗剂包括手术或外科手术(例如脾切除术、淋巴结切除术、甲状腺切除术,血浆去除术、白细胞介导、细胞移植、组织移植或器官移植、肠手术、器官灌注等)、放射疗法、诸如类固醇疗法和非类固醇疗法的疗法、激素疗法、细胞因子疗法、皮肤病试剂疗法(例如,用于治疗皮肤病症如过敏、接触性皮炎和牛皮癣的局部试剂)、免疫抑制疗法和其他抗炎单克隆抗体疗法。
[0370]
第二治疗剂可为皮质类固醇、抗疟疾药物、免疫抑制剂、细胞毒性药物或b细胞调节剂。
[0371]
在一些实施方案中,第二治疗剂为泼尼松、泼尼松龙、甲泼尼龙、地夫可特、羟氯喹、硫唑嘌呤、甲氨蝶呤、环磷酰胺、麦考酚酸莫酯(mmf)、霉酚酸钠、环胞素、来氟米特、他克莫司、(利妥昔单抗)或(贝利单抗)。
[0372]
在一些实施方案中,本发明的抗体与第二治疗剂联合施用。示例性的第二治疗剂是皮质类固醇、非甾体类抗炎药(nsaid)、水杨酸盐、羟氯喹、柳氮磺吡啶、细胞毒性药物、免疫抑制药物、免疫调节抗体、甲氨蝶呤、环磷酰胺、咪唑立宾、苯丁酸氮芥、环孢菌素、他克莫司(fk506;prografrm)、吗替麦考酚酯和硫唑嘌呤(6-巯基嘌呤)、西罗莫司(雷帕霉素)、脱
氧精胍菌素、来氟米特及其丙二壬二酰胺类似物;抗ctla4抗体和ig融合体、抗b淋巴细胞刺激物抗体(例如lymphostat-btm)和ctla4-ig融合体(blys-lg)、抗cd80抗体、抗t细胞抗体(诸如抗cd3(okt3)、抗cd4)、皮质类固醇,诸如氯倍他索、卤倍他索、氢化可的松、曲安西龙、倍他米松、氟轻松、氟轻松醋酸酯、泼尼松、泼尼松龙、甲泼尼龙;非甾体抗炎药物(nsaid),诸如柳氮磺吡啶、含有氨水杨酸的药物(被称为5-asa试剂)、塞来考昔、双氯芬酸、依托度酸、芬洛洛芬、氟比洛芬、布洛芬、酮洛芬、甲氯芬酯、美洛昔康、萘丁美酮、萘普生、奥沙普秦、吡罗昔康、罗非考昔、水杨酸盐、舒林酸和托美丁;磷酸二酯酶-4抑制剂、抗tnfα抗体、(英夫利昔单抗)、(戈利木单抗)和(阿达木单抗)、沙利度胺或其类似物,诸如来那度胺。
[0373]
本发明的抗体可与第二治疗剂组合同时、按顺序或单独施用。
[0374]
可以使用由美国风湿病学会标准、欧洲风湿病联盟标准或任何其他标准定义的临床反应所测量的有效性来评估治疗有效性或ra。参见例如,felson等人,arthritis rheum.,1995年第38期:第727-735页,以及van gestel等人,arthritis rheum.,1996年第39期:第34-40页。
[0375]
施用/药物组合物
[0376]
本发明提供了本发明的特异性地结合cd154的拮抗性抗体的药物组合物,以及药学上可接受的载体。对于治疗性用途,可将本发明的抗体制备为药物组合物,其含有有效量的该抗体作为药学上可接受的载体中的活性成分。术语“载体”是指用以施用活性化合物的稀释剂、辅助剂、赋形剂或媒介物。此类媒介物可以是液体,诸如水和油,包括来源于石油、动物、植物的油或合成的那些油,诸如花生油、大豆油、矿物油、芝麻油等。例如,可使用0.4%盐水和0.3%甘氨酸。这些溶液是无菌的,并且通常不含颗粒物。它们可通过熟知的常规灭菌技术(例如过滤)进行灭菌。所述组合物可根据需要含有药学上可接受的辅助物质,以接近生理条件,所述辅助物质诸如ph调节剂和缓冲剂、稳定剂、增稠剂、润滑剂和着色剂等。此类药物制剂中的本发明分子或抗体的浓度可在很大范围内变化,即,从小于约0.5重量%,通常到至少约1重量%至多达5重量%、10重量%、15重量%、20重量%、25重量%、30重量%、35重量%、40重量%、45重量%或50重量%,并且将根据所选择的具体施用模式,主要基于所需的剂量、流体体积、粘度等进行选择。包含其它人蛋白(例如,人血清白蛋白)在内的合适的媒介物和制剂在例如remington:the science and practice ofpharmacy,第21版,troy,d.b.编辑,lipincott williams and wilkins,philadelphia,pa 2006,第5部分,pharmaceutical manufacturing,第691-1092页(特别参见第958-989页)中有所描述。
[0377]
本发明方法中的本发明抗体的施用模式可为任何合适的途径,诸如胃肠外施用,例如真皮内、肌肉内、腹膜内、静脉内或皮下、粘膜(口腔、鼻内、阴道内、直肠)或如本领域所熟知的技术人员了解的其他方式。
[0378]
本发明的抗体可通过任何合适的途径施用给受试者,例如通过静脉(i.v.)输注或弹丸式注射以非肠道方式、以肌肉内方式或皮下方式或腹膜内方式。可在例如15、30、60、90、120、180或240分钟内,或1、2、3、4、5、6、7、8、9、10、11或12小时内给予静脉内输注。
[0379]
向患有免疫介导的炎性疾病或自身免疫性疾病(诸如类风湿性关节炎)的受试者给予的剂量足以缓解或至少部分地遏止正在治疗的疾病(“治疗有效量”),有时可为0.005mg/kg至约100mg/kg,例如约0.05mg/kg至约20mg/kg或约0.1mg/kg至约20mg/kg,或约
1mg/kg至约20mg/kg,或约4mg/kg、约8mg/kg、约16mg/kg或约24mg/kg,或者例如约1、2、3、4、5、6、7、8、9或10mg/kg,但甚至可能更高,例如约15、16、17、18、19、20、21、22、23、24、25、30、40、50、60、70、80、90或100mg/kg。
[0380]
也可以给予固定的单位剂量,例如50mg、100mg、200mg、500mg或1000mg,或者剂量可基于患者的表面积,例如500mg/m2、400mg/m2、300mg/m2、250mg/m2、200mg/m2或100mg/m2。通常可施用介于1剂和8剂之间的剂量(例如,1、2、3、4、5、6、7或8剂),以治疗免疫介导的炎性疾病(诸如类风湿性关节炎),但是可给予9、10、11、12、13、14、15、16、17、18、19、20剂或更多剂。
[0381]
可在一天、两天、三天、四天、五天、六天、一周、两周、三周、一个月、五周、六周、七周、两个月、三个月、四个月、五个月、六个月或更长时间之后重复施用本发明的抗体。也可以重复治疗过程,按照慢性施用一样。重复施用可为相同剂量或不同剂量。例如,本发明的抗体可通过静脉输注以0.1mg/kg、1mg/kg、5mg/kg、8mg/kg或16mg/kg按一周的时间间隔施用8周,接着以8mg/kg或16mg/kg按每两周一次的方式再施用16周,然后以8mg/kg或16mg/kg按每四周一次的方式施用。
[0382]
本发明的抗体可通过维持疗法来提供,例如按每周一次的方式持续6个月或更长时间。
[0383]
例如,本发明的抗体可在治疗开始后第1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39或40天中的至少一天,或者另选地,在第1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20周中的至少一周,或其任何组合,使用单次剂量或者每24、12、8、6、4或2小时一次的分次剂量或其任何组合,以约0.1-100mg/kg的量作为日剂量提供,诸如0.5、0.9、1.0、1.1、1.5、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、40、45、50、60、70、80、90或100mg/kg/天。
[0384]
本发明的抗体也可以预防性地施用,以降低发展免疫介导的炎性疾病或自身免疫性疾病(诸如关节炎或类风湿性关节炎)的风险,并且/或者延缓免疫介导的炎性疾病或自身免疫性疾病的发作。
[0385]
因此,本发明的用于肌内注射的药物组合物可被制备为包含1ml无菌缓冲水,以及介于约1ng/kg至约100mg/kg之间(例如,约50ng/kg至约30mg/kg,或更优选地约5mg/kg至约25mg/kg)的本发明的抗体。
[0386]
例如,可将用于静脉输注的包含本发明抗体的药物组合物制成含有约200ml无菌林格氏溶液以及约8mg至约2400mg、约400mg至约1600mg或约400mg至800mg的本发明的抗体,用于施用给80kg的患者。用于制备可非肠道施用的组合物的方法是熟知的并且在例如“remington's pharmaceutical science”,第15版,mack publishing company,easton,pa中更详细地描述。
[0387]
有效地治疗免疫介导的炎性疾病或自身免疫性疾病的本发明抗体的“治疗有效量”可通过标准研究技术确定。例如,可采用体外测定法来帮助鉴定最佳剂量范围。任选地,可有效治疗免疫介导的炎性疾病或自身免疫性疾病(诸如关节炎或类风湿性关节炎)的本发明抗体的剂量可通过将该抗体施用给本领域熟知的相关动物模型来确定。对具体的有效剂量的选择可由本领域的技术人员根据对多种因素的考量(例如,经由临床试验)来确定。
此类因素包括待治疗或预防的疾病、所涉及的症状、患者体重、患者免疫状态以及技术人员已知的其他因素。在制剂中待使用的精确剂量也将取决于给药途径以及疾病的严重程度,并且应该根据医生的判断和每个患者的情况来决定。有效剂量可通过源自体外或动物模型测试体系的剂量反应曲线来推导。可以使用本文所述模型中的任何一个来测试本发明抗体的功效和有效剂量。
[0388]
可将本发明的抗体低压冻干用于贮存,并在使用前在合适的载体中复原。此项技术已被证实对常规的蛋白制剂有效,并且可采用熟知的冻干和复原技术。
[0389]
抗独特型抗体
[0390]
本发明提供了结合至本发明抗体的抗独特型抗体。
[0391]
本发明还提供了特异性地结合如下抗体的抗独特型抗体:包含seq id no:58的vh和seq id no:65的vl的抗体。
[0392]
本发明还提供了特异性地结合如下抗体的抗独特型抗体:包含seq id no:59的vh和seq id no:66的vl的抗体。
[0393]
本发明还提供了特异性地结合如下抗体的抗独特型抗体:包含seq id no:60的vh和seq id no:67的vl的抗体。
[0394]
本发明还提供了特异性地结合如下抗体的抗独特型抗体:包含seq id no:61的vh和seq id no:68的vl的抗体。
[0395]
本发明还提供了特异性地结合如下抗体的抗独特型抗体:包含seq id no:62的vh和seq id no:69的vl的抗体。
[0396]
本发明还提供了特异性地结合如下抗体的抗独特型抗体:包含seq id no:63的vh和seq id no:70的vl的抗体。
[0397]
本发明还提供了特异性地结合如下抗体的抗独特型抗体:包含seq id no:64的vh和seq id no:71的vl的抗体。
[0398]
本发明还提供了特异性地结合如下抗体的抗独特型抗体:包含seq id no:59的vh和seq id no:72的vl的抗体。
[0399]
本发明还提供了特异性地结合如下抗体的抗独特型抗体:包含seq id no:59的vh和seq id no:73的vl的抗体。
[0400]
抗独特型(id)抗体是识别该抗体的抗原决定簇(例如,互补位或cdr)的抗体。id抗体可以是抗原阻断的或非阻断的。抗原阻断性id可用于检测样品中的游离抗体(例如,本文所述的本发明的cd154抗体)。非阻断性id可用于检测样品中的总抗体(游离抗体、与抗原部分结合的抗体、或与抗原完全结合的抗体)。id抗体可以通过用正在制备的抗id的抗体对动物进行免疫处理来制备。
[0401]
抗id抗体还可以用作“免疫原”以在另一动物中诱导免疫应答,从而产生所谓的抗-抗id抗体。抗-抗id抗体可以与诱导抗-id的原始mab在表位上相同。因此,通过使用mab独特型决定簇的抗体,可以鉴定出表达具有相同特异性的抗体的其他克隆体。抗-id抗体可以是变化的(从而产生抗-id抗体变体),并且/或者通过任何合适的技术(诸如本文其他地方关于特异性地结合hla-dr抗体的抗体所描述的那些)而衍生。
[0402]
免疫缀合物
[0403]“免疫缀合物”是指与一个或多个异源分子缀合的本发明的抗体。
[0404]
在一些实施方案中,本发明的抗体与一种或多种细胞毒性剂缀合。示例性的此类细胞毒性剂包括化疗剂或药物、生长抑制剂、毒素(例如,蛋白质毒素,细菌、真菌、植物或动物来源的酶活性毒素或其片段)和放射性同位素。
[0405]
在一些实施方案中,免疫缀合物是抗体-药物缀合物(adc),其中本发明的抗体缀合于一种或多种药物,例如美登木素生物碱(参见例如美国专利no.5,208,020、5,416,06);奥瑞斯他汀,诸如单甲基奥瑞斯他汀药物部分de和df(mmae和mmaf)(参见例如美国专利no.5,635,483、5,780,588和7,498,298)、多拉司他汀、加利车霉素或其衍生物(参见例如美国专利no.5,712,374、5,714,586、5,739、116、5,767,285、5,770,701、5,770,710、5,773,001和5,877,296;hinman等人,cancer res,1993年第53期:第3336-3342页;和lode等人,cancer res,1998年第58期:第2925-2928页);蒽环素,诸如道诺霉素或多柔比星(参见例如kratz等人,current med.chem,2006年第13期,第477-523页;jeffrey等人,bioorganic&med chem letters,2006年第16期:第358-362页;torgov等人,bioconj chem,2005年第16期:第717-721页;nagy等人,proc natl acad sci usa,2000年第97期:第829-834页;dubowchik等人,bioorg.&med.chem.letters,2002年第12期:第1529-1532页;king等人,j med chem,2002年第45期:第4336-4343页;和美国专利no.6,630,579)、甲氨蝶呤、长春地辛、紫杉烷诸如多西他赛、紫杉醇、拉罗他赛、替他塞尔和奥他他赛。
[0406]
在一些实施方案中,免疫缀合物包含缀合至酶促活性毒素或其片段的本发明的抗体,该酶促活性毒素或其片段为诸如白喉a链、白喉毒素的非结合活性片段、外毒素a链(来自铜绿假单胞菌(pseudomonas aeruginosa))、蓖麻毒素a链、相思豆毒素a链、蒴莲根毒素a链、α-八叠球菌素、油桐(aleurites fordii)蛋白质、石竹素蛋白质、美洲商陆(phytolaca americana)蛋白质(papi、papii和pap-s)、苦瓜(momordica charantia)抑制剂、麻疯树毒素、巴豆毒素、肥阜草(sapaonaria officinalis)抑制剂、白树毒素、迈托毒素、局限曲霉素、酚霉素、伊诺霉素和单端孢霉烯族化合物。
[0407]
在一些实施方案中,本发明的抗体缀合至放射性原子,从而形成放射缀合物。存在各种可用于生成放射缀合物的放射性同位素。示例包括at211、1131、i125、y90、re186、re188、sm153、bi212、p32、pb212和lu的放射性同位素。当放射缀合物用于检测时,其可以包含用于闪烁显像研究的放射性原子,例如tc99m或1123,或者用于核磁共振(nmr)成像(也称为磁共振成像,mri)的自旋标记,诸如碘-123、碘-131、铟-11、氟-19、碳-13、氮-15、氧-17、钆、锰或铁。
[0408]
本发明的抗体和细胞毒素剂的缀合使用多种双功能蛋白偶联剂进行,所述双功能蛋白偶联剂为诸如n-琥珀酰亚胺-3-(2-吡啶基二巯基)丙酸酯(spdp)、琥珀酰亚胺基-4-(n-马来酰亚胺甲基)环己烷-1-羧酸酯(smcc)、亚氨基噻吩(it)、亚氨酸酯的双功能衍生物(诸如,二甲基己二酰亚胺酯hq)、活性酯(诸如,双琥珀酰亚胺辛二酸酯)、醛(诸如,戊二醛)、双-叠氮化合物(诸如,双(对叠氮苯甲酰基)己二胺)、双重氮衍生物(诸如,双(对重氮苯甲酰基)乙二胺)、二异氰酸酯(诸如,甲苯2,6-二异氰酸酯)和双活性氟化合物(诸如,1,5-二氟-2,4-二硝基苯)。例如,可以如vitetta等人在science,1987年第238期第1098页中所述那样制备蓖麻毒素免疫毒素。碳-14标记的1-异硫氰酸根合苄基-3-甲基二亚乙基三胺五乙酸(mx-dtpa)是用于将放射性核苷酸缀合至抗体的示例性螯合剂。参见,例如,w094/11026。接头可以是促进细胞内细胞毒性药物释放的“可切割接头”。例如,可使用酸不稳定
接头、肽酶敏感接头、光不稳定接头、二甲基接头或含二硫化物接头(chari等人,cancer res,1992年第52期:第127-131页;美国专利no.5,208,020)。
[0409]
可以用如下交联剂来制备免疫缀合物或adc:诸如bmps、emcs、gmbs、hbvs、lc-smcc、mbs、mpbh、sbap、sia、siab、smcc、smpb、smph、磺基-emcs、磺基-gmbs、磺基-kmus、磺基-mbs、磺基-siab、磺基-smcc和磺基-smpb,以及svsb(琥珀酰亚胺基-(4-乙烯基砜)苯甲酸酯),这些交联剂可商购获得(例如,来自pierce biotechnology,inc.,rockford,il.,u.s.a)。
[0410]
本发明还提供了这样的免疫缀合物,该免疫缀合物包含本发明的特异性地结合seq id no:1的cd154的抗体,该抗体连接至治疗剂或显像剂。
[0411]
本发明的其它实施方案
[0412]
下文根据本文别处的公开内容陈述了本发明的某些其它实施方案。上文陈述为与本文所公开的发明相关的本发明的实施方案的特征还涉及所有这些其它带编号的实施方案中的每一者。
[0413]
1)一种特异性地结合seq id no:1的人cd154的分离的拮抗性抗体或其抗原结合部分,该分离的拮抗性抗体或其抗原结合部分包含seq id no:17(sygis)的重链互补决定区(hcdr)1、seq idno:23(wispifgntnyaqkfqg)的hcdr2和seq id no:30(sryygdldy)的hcdr3,其中任选地
[0414]
a)hcdr1残基s1突变为a、c、d、e、g、i、k、l、m、n、q、r、t或v;
[0415]
b)hcdr1残基i4突变为m、l或v;
[0416]
c)hcdr1残基s5突变为a;
[0417]
d)hcdr2残基s3突变为a、t或v;
[0418]
e)hcdr2残基p4突变为v、t、l、q或e;
[0419]
f)hcdr2残基n8突变为a、c、d、e、f、g、h、i、k、l、m、q、r、s、t、v、w或y;
[0420]
g)hcdr2残基t9突变为a、c、d、e、f、g、h、i、k、l、m、q、r、s、t、v、w或y;
[0421]
h)hcdr2残基n10突变为a、c、d、e、f、g、h、i、k、l、m、q、r、s、t、v、w或y;
[0422]
i)hcdr3残基s1突变为a或m;
[0423]
j)hcdr3残基r2突变为a、s、q或k;并且
[0424]
k)hcdr3残基l7突变为m。
[0425]
2)根据权利要求1所述的抗体,该抗体包含seq id no:37(rasqsissyln)的轻链互补决定区(lcdr)1、seq id no:44(yanslqs)的lcdr2和seq id no:52(qqsdsipwt)的lcdr3,其中任选地
[0426]
a)lcdr1残基q4突变为a、c、d、e、f、g、h、i、k、l、m、n、r、s、t、v、w或y;
[0427]
b)lcdr1残基s5突变为a、c、d、e、f、g、h、i、k、l、m、n、q、r、t、v、w或y;
[0428]
c)lcdr1残基s7突变为a、c、d、e、f、g、h、i、k、l、m、n、q、r、t、v、w或y;
[0429]
d)lcdr1残基s8突变为a、c、d、e、f、g、h、i、k、l、m、n、q、r、t、v、w或y;
[0430]
e)lcdr2残基a2突变为s;
[0431]
f)lcdr2残基n3突变为a、c、d、e、f、g、h、i、k、l、m、q、r、s、t、v、w或y;
[0432]
g)lcdr2残基s4突变为a、c、d、e、f、g、h、i、k、l、m、n、q、r、t、v、w或y;
[0433]
h)lcdr2残基l5突变为a、c、d、e、f、g、h、i、k、m、n、q、r、s、t、v、w或y;
[0434]
i)lcdr2残基q6突变为e、d或n;
[0435]
j)lcdr2残基s7突变为a、c、d、e、f、g、h、i、k、l、m、n、q、r、t、v、w或y;
[0436]
k)lcdr3残基s3突变为a;
[0437]
l)lcdr3残基d4突变为n;
[0438]
m)lcdr3残基s5突变为a、c、d、e、f、g、h、i、k、l、m、n、q、r、t、v、w或y;并且
[0439]
n)lcdr3残基i6突变为a、c、d、e、g、k、l、m、n、q、r、s、t、v。
[0440]
3)根据实施方案1或2所述的抗体,该抗体包含seq id no:17
[0441]
(sygis)的hcdr1、seq id no:23(wispifgntnyaqkfqg)的hcdr2、seq id no:30(sryygdldy)的hcdr3、seq id no:37(rasqsissyln)的lcdr1、seq id no:44(yanslqs)的lcdr2,以及seq id no:52(qqsdsipwt)的lcdr3。
[0442]
4)根据实施方案1-3中任一项所述的抗体,该抗体包含:
[0443]
a)seq id no:59的vh和seq id no:66的vl;或者
[0444]
b)seq id no:80的重链和seq id no:81的轻链。
[0445]
5)一种分离的拮抗性抗体,该分离的拮抗性抗体特异性地结合seq id no:4的可溶性人cd154(shcd154)。
[0446]
6)根据实施方案1-5中任一项所述的抗体,该抗体在fc区中包含至少一处置换。
[0447]
7)根据实施方案1-6中任一项所述的抗体,其中该抗体不活化人类血小板。
[0448]
8)根据实施方案1-7中任一项所述的抗体,其中该抗体以如下解离常数kd结合至shcd154:约5
×
10-9
m或更小、约1
×
10-9
m或更小、约5
×
10-10
m或更小、约1
×
10-10
m或更小、约5
×
10-11
m或更小、或者约1
×
10-11
m或更小,当所述kd使用proteon xpr36系统使用实施例1中描述的亲和力测量实验设计进行测量的。
[0449]
9)根据实施方案1-8中任一项所述的抗体,其中该抗体以介于约7.0
×
10-11
m至约6
×
10-10
m之间的ic
50
值来抑制shcd154介导的人b细胞增殖。
[0450]
10)根据实施方案1-9中任一项所述的抗体,其中该抗体在稳定地表达seap和人cd40的hek293细胞中以约2.1
×
10-8
m或更小的ic
50
值在nf-κb-诱导型干扰素-β(ifn-β)最小启动子下抑制shcd154介导的分泌型胚胎碱性磷酸酶(seap)的表达。
[0451]
11)根据实施方案1-10中任一项所述的抗体,其中该抗体与包含重链可变区(vh)和轻链可变区(vl)的抗体竞争结合至shcd154,其中vh包含seq id no:59的序列,并且vl包含seq id no:66的序列。
[0452]
12)根据实施方案1-11中任一项所述的抗体,其中该抗体包含seq id nos:58、59、60、61、62、63或64的vh的重链互补决定区(hcdr)1(即hcdr1)、2(即hcdr2)和3(即hcdr3)氨基酸序列,该抗体在hcdr1、hcdr2和/或hcdr3中任选地具有一个、两个或三个保守氨基酸置换,其中hcdr由kabat、chothia的或imgt所定义。
[0453]
13)根据实施方案1-12中任一项所述的抗体,其中该抗体包含seq id nos:65、66、67、68、69、70、71、72或73的vl的轻链互补决定区(lcdr)1(即lcdr1)、2(即lcdr2)和3(即lcdr3)氨基酸序列,在lcdr1、lcdr2和/或lcdr3中任选地具有一个、两个或三个保守氨基酸置换,其中lcdr由kabat、chothia的或imgt所定义。
[0454]
14)根据实施方案1-13中任一项所述的抗体,其包含以下的hcdr1、hcdr2和hcdr3氨基酸序列
[0455]
a)分别为seq id no:16、22和29,以及它们的保守修饰;
[0456]
b)分别为seq id no:17、23和30,以及它们的保守修饰;
[0457]
c)分别为seq id no:16、24和31,以及它们的保守修饰;
[0458]
d)分别为seq id no:18、25和32,以及它们的保守修饰;
[0459]
e)分别为seq id no:19、26和33,以及它们的保守修饰;
[0460]
f)分别为seq id no:20、27和34,以及它们的保守修饰;或者
[0461]
g)分别为seq id no:21、28和35,以及它们的保守修饰。
[0462]
15)根据实施方案1-10中任一项所述的抗体,该抗体包含以下的lcdr1、lcdr2和lcdr3氨基酸序列
[0463]
a)分别为seq id no:36、43和51,以及它们的保守修饰;
[0464]
b)分别为seq id no:37、44和52,以及它们的保守修饰;
[0465]
c)分别为seq id no:38、45和53,以及它们的保守修饰;
[0466]
d)分别为seq id no:39、46和54,以及它们的保守修饰;
[0467]
e)分别为seq id no:40、47和55,以及它们的保守修饰;
[0468]
f)分别为seq id no:41、47和56,以及它们的保守修饰;
[0469]
g)分别为seq id no:42、48和57,以及它们的保守修饰;
[0470]
h)分别为seq id no:37、49和52,以及它们的保守修饰;或者
[0471]
i)分别为seq id no:37、50和52,以及它们的保守修饰。
[0472]
16)根据实施方案1-15中任一项所述的抗体,其包含以下的hcdr1、hcdr2和hcdr3
[0473]
a)分别为seq id no:16、22和29;
[0474]
b)分别为seq id no:17、23和30;
[0475]
c)分别为seq id no:16、24和31;
[0476]
d)分别为seq id no:18、25和32;
[0477]
e)分别为seq id no:19、26和33;
[0478]
f)分别为seq id no:20、27和34;或者
[0479]
g)分别为seq id no:21、28和35。
[0480]
17)根据实施方案1-16中任一项所述的抗体,该抗体包含以下的lcdr1、lcdr2和lcdr3
[0481]
a)分别为seq id no:36、43和51;
[0482]
b)分别为seq id no:37、44和52;
[0483]
c)分别为seq id no:38、45和53;
[0484]
d)分别为seq id no:39、46和54;
[0485]
e)分别为seq id no:40、47和55;
[0486]
f)分别为seq id no:41、47和56;
[0487]
g)分别为seq id no:42、48和57;
[0488]
h)分别为seq id no:37、49和52;或者
[0489]
i)分别为seq id no:37、50和52。
[0490]
18)根据实施方案1至17中任一项所述的抗体,该抗体包含分别为seq id no:16、22和29的hcdr1、hcdr2和hcdr3,以及分别为seq id no:36、43和51的lcdr1、lcdr2和lcdr3。
[0491]
19)根据实施方案1至17中任一项所述的抗体,该抗体包含分别为seq id no:17、23和30的hcdr1、hcdr2和hcdr3,以及分别为seq id no:37、44和52的lcdr1、lcdr2和lcdr3。
[0492]
20)根据实施方案1至17中任一项所述的抗体,该抗体包含分别为seq id no:16、24和31的hcdr1、hcdr2和hcdr3,以及分别为seq id no:38、45和53的lcdr1、lcdr2和lcdr3。
[0493]
21)根据实施方案1至17中任一项所述的抗体,该抗体包含分别为seq id no:18、25和32的hcdr1、hcdr2和hcdr3,以及分别为seq id no:39、46和54的lcdr1、lcdr2和lcdr3。
[0494]
22)根据实施方案1至17中任一项所述的抗体,该抗体包含分别为seq id no:19、26和33的hcdr1、hcdr2和hcdr3,以及分别为seq id no:40、47和55的lcdr1、lcdr2和lcdr3。
[0495]
23)根据实施方案1至17中任一项所述的抗体,该抗体包含分别为seq id no:20、27和34的hcdr1、hcdr2和hcdr3,以及分别为seq id no:41、47和56的lcdr1、lcdr2和lcdr3。
[0496]
24)根据实施方案1至17中任一项所述的抗体,该抗体包含分别为seq id no:21、28和35的hcdr1、hcdr2和hcdr3,以及分别为seq id no:42、48和57的lcdr1、lcdr2和lcdr3。
[0497]
25)根据实施方案1至17中任一项所述的抗体,该抗体包含分别为seq id no:17、23和30的hcdr1、hcdr2和hcdr3,以及分别为seq id no:37、49和52的lcdr1、lcdr2和lcdr3。
[0498]
26)根据实施方案1至17中任一项所述的抗体,该抗体包含分别为seq id no:17、23和30的hcdr1、hcdr2和hcdr3,以及分别为seq id no:37、50和52的lcdr1、lcdr2和lcdr3。
[0499]
27)根据实施方案1-26中任一项所述的抗体,该抗体包含与seq id no:58、59、60、61、62、63或64的vh具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的vh。
[0500]
28)根据实施方案1-27中任一项所述的抗体,该抗体包含与seq id no:65、66、67、68、69、70、71、72或73的vl具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的vl。
[0501]
29)根据实施方案1-28中任一项所述的抗体,该抗体包含seq id no:58的vh和seq id no:65的vl,其中vh、vl、或vh和vl二者任选地包含一、二、三、四、五、六、七、八、九、十、十一、十二、十三、十四或十五个氨基酸置换。
[0502]
30)根据实施方案1-28中任一项所述的抗体,该抗体包含seq id no:59的vh和seq id no:66的vl,其中vh、vl、或vh和vl二者任选地包含一、二、三、四、五、六、七、八、九、十、十一、十二、十三、十四或十五个氨基酸置换。
[0503]
31)根据实施方案1-28中任一项所述的抗体,该抗体包含seq id no:60的vh和seq id no:67的vl,其中vh、vl、或vh和vl二者任选地包含一、二、三、四、五、六、七、八、九、十、十一、十二、十三、十四或十五个氨基酸置换。
[0504]
32)根据实施方案1-28中任一项所述的抗体,该抗体包含seq id no:61的vh和seq id no:68的vl,其中vh、vl、或vh和vl二者任选地包含一、二、三、四、五、六、七、八、九、十、十一、十二、十三、十四或十五个氨基酸置换。
[0505]
33)根据实施方案1-28中任一项所述的抗体,该抗体包含seq id no:62的vh和seq id no:69的vl,其中vh、vl、或vh和vl二者任选地包含一、二、三、四、五、六、七、八、九、十、十一、十二、十三、十四或十五个氨基酸置换。
[0506]
34)根据实施方案1-28中任一项所述的抗体,该抗体包含seq id no:63的vh和seq id no:70的vl,其中vh、vl、或vh和vl二者任选地包含一、二、三、四、五、六、七、八、九、十、十
一、十二、十三、十四或十五个氨基酸置换。
[0507]
35)根据实施方案1-28中任一项所述的抗体,该抗体包含seq id no:64的vh和seq id no:71的vl,其中vh、vl、或vh和vl二者任选地包含一、二、三、四、五、六、七、八、九、十、十一、十二、十三、十四或十五个氨基酸置换。
[0508]
36)根据实施方案1-28中任一项所述的抗体,该抗体包含seq id no:59的vh和seq id no:72的vl,其中vh、vl、或vh和vl二者任选地包含一、二、三、四、五、六、七、八、九、十、十一、十二、十三、十四或十五个氨基酸置换。
[0509]
37)根据实施方案1-28中任一项所述的抗体,该抗体包含seq id no:59的vh和seq id no:73的vl,其中vh、vl、或vh和vl二者任选地包含一、二、三、四、五、六、七、八、九、十、十一、十二、十三、十四或十五个氨基酸置换。
[0510]
38)根据实施方案1-37中任一项所述的抗体,其中该抗体在fc区中包含至少一处置换。
[0511]
39)根据实施方案1-38中任一项所述的抗体,其中fc区中的所述至少一处置换是置换l234a、l235a、g237a、p238s、h268a、a330s和p331s,其中根据eu索引对残基进行编号。
[0512]
40)根据实施方案1-38中任一项所述的抗体,其中fc区中的所述至少一处置换是置换v234a、g237a、p238s、h268a、v309l、a330s和p331s,其中根据eu索引对残基进行编号。
[0513]
41)根据实施方案1-40中任一项所述的抗体,其中该抗体具有igg1、igg2、igg3或igg4同种型。
[0514]
42)根据实施方案1-41中任一项所述的抗体,其中所有抗体互补位残基均存在于vh中。
[0515]
43)根据实施方案1-42中任一项所述的抗体,其中该抗体在可溶性人cd154三聚体中同时结合第一cd154单体和第二cd154单体。
[0516]
44)根据实施方案43所述的抗体,其中该抗体在seq id no:1的cd154的氨基酸残基182-207内结合第一cd154单体中的至少一个、两个、三个、四个、五个、六个、七个或八个cd154残基,其中根据seq id no:1对残基进行编号。
[0517]
45)根据实施方案43或44所述的抗体,其中该抗体在seq id no:1的cd154的氨基酸残基176-253内结合第二cd154单体中的至少一个、两个、三个、四个、五个、六个、七个或八个cd154残基,其中根据seq id no:1对残基进行编号。
[0518]
46)根据实施方案43-45中任一项所述的抗体,其中该抗体结合第一cd154单体中的残基e182、s185、q186、a187、p188、s214、a215和r207,其中根据seq id no:1对残基进行编号。
[0519]
47)根据实施方案43-46中任一项所述的抗体,其中该抗体结合第二cd154单体中的残基t176、f177、c178、q220、s248、h249、g250和f353,其中根据seq id no:1对残基进行编号。
[0520]
48)一种双特异性分子,所述双特异性分子包含根据实施方案1-47中任一项所述的抗体或其抗原结合部分,该抗体或其抗原结合部分连接至具有不同结合特异性的第二抗原结合分子。
[0521]
49)根据实施方案1-47中任一项所述的抗体或根据权利要求48所述的双特异性分子,该抗体或双特异性分子
[0522]
a)以与shcd154的免疫复合物不活化人血小板;
[0523]
b)以约5
×
10-9
m或更小的解离常数kd结合至shcd154;
[0524]
c)抑制shcd154介导的人b细胞增殖;或者
[0525]
d)在nf-κb-seap报告基因测定中抑制cd154生物活性。
[0526]
50)一种免疫缀合物,该免疫缀合物包含连接至治疗剂或显像剂的根据实施方案1-47中任一项所述的抗体或其抗原结合部分。
[0527]
51)一种药物组合物,该药物组合物包含根据实施方案1-47中任一项所述的抗体以及药学上可接受的载体。
[0528]
52)一种多核苷酸,该多核苷酸编码实施方案1-47中任一项所述的抗体vh、抗体vl,或抗体vh和vl。
[0529]
53)一种载体,该载体包含实施方案52的多核苷酸。
[0530]
54)一种宿主细胞,该宿主细胞包含实施方案53的载体。
[0531]
55)一种制备抗体的方法,该方法包括:在使该抗体表达的条件下培养实施方案54的宿主细胞,以及回收由该宿主细胞产生的抗体。
[0532]
56)根据实施方案1-47中任一项所述的抗体或根据实施方案51所述的药物组合物,该抗体或药物组合物用于治疗自身免疫性疾病或免疫介导的炎性疾病。
[0533]
57)根据实施方案1-47中任一项所述的抗体,该抗体用于关节炎、系统性红斑狼疮(sle)、炎性肠病、移植、肾移植、皮肤移植、骨髓移植、移植物抗宿主病(gvhd)、免疫性血小板减少症(itp)、多发性硬化症、甲状腺炎、i型糖尿病或动脉粥样硬化。
[0534]
58)根据实施方案1-47中任一项所述的抗体,该抗体用于治疗类风湿性关节炎。
[0535]
59)根据实施方案1-47中任一项所述的抗体,该抗体用于治疗狼疮。
[0536]
60)根据实施方案1-47中任一项所述的抗体,该抗体用于治疗移植。
[0537]
61)根据实施方案1-47中任一项所述的抗体,该抗体用于治疗炎性肠病。
[0538]
62)根据实施方案1-47中任一项所述的抗体,该抗体根据实施方案56-61中的任一项用于与第二治疗剂联合使用。
[0539]
63)根据实施方案62所述的抗体,其中第二治疗剂是非甾体类抗炎药(nsaid)、水杨酸盐、羟氯喹、柳氮磺吡啶、皮质类固醇、细胞毒性药物、免疫抑制药物和/或抗体。
[0540]
本发明还提供了特异性地结合seq id no:1的人cd154的分离的抗体或其抗原结合部分,其包含seq id no:17(sygis)的重链互补决定区(hcdr)1、seq id no:23(wispifgntnyaqkfqg)的hcdr2、seq id no:30(sryygdldy)的hcdr3、seq id no:37(rasqsissyln)的轻链互补决定区(lcdr)1、seq id no:44(yanslqs)的lcdr2,以及seq id no:52(qqsdsipwt)的lcdr3。
[0541]
本发明还提供了特异性地结合seq id no:4的可溶性人cd154(shcd154)的分离的拮抗性抗体,其包含seq id no:17(sygis)的hcdr1、seq id no:23(wispifgntnyaqkfqg)的hcdr2、seq id no:30(sryygdldy)的hcdr3、seq id no:37(rasqsissyln)的lcdr1、seq id no:44(yanslqs)的lcdr2,以及seq id no:52(qqsdsipwt)的lcdr3。
[0542]
在一些实施方案中,该抗体包含seq id no:59的vh和seq id no:66的vl。
[0543]
在一些实施方案中,该抗体以如下解离常数kd结合至shcd154:约5
×
10-9
m或更小、约1
×
10-9
m或更小、约5
×
10-10
m或更小、约1
×
10-10
m或更小、约5
×
10-11
m或更小、或者约1
×
10-11
m或更小,该kd是利用proteon xpr36系统使用实施例1中描述的亲和力测量实验设计进行测量的。
[0544]
在一些实施方案中,该抗体以介于约7.0
×
10-11
m至约6
×
10-10
m之间的ic
50
值来抑制shcd154介导的人b细胞增殖。
[0545]
在一些实施方案中,该抗体在稳定地表达seap和人cd40的hek293细胞中以约2.1
×
10-8
m或更小的ic
50
值在nf-κb-诱导型干扰素-β(ifn-β)最小启动子下抑制shcd154介导的分泌型胚胎碱性磷酸酶(seap)的表达。
[0546]
在一些实施方案中,该抗体具有igg1同种型,当与野生型igg1比较时,任选地包含重链置换l234a、l235a、g237a、p238s、h268a、a330s和p331s。
[0547]
在一些实施方案中,该抗体包含seq id no:59的vh和seq id no:66的vl,并且具有igg1同种型,当与野生型igg1比较时,其任选地包含重链置换l234a、l235a、g237a、p238s、h268a、a330s和p331s。
[0548]
在一些实施方案中,该抗体包含seq id no:59的vh和seq id no:66的vl,并且具有igg1/κ同种型,当与野生型igg1比较时,其包含重链置换l234a、l235a、g237a、p238s、h268a、a330s和p331s。
[0549]
在一些实施方案中,该抗体具有igg2同种型,当与野生型igg2比较时,任选地包含重链置换v234a、g237a、p238s、h268a、v309l、a330s和p331s。
[0550]
在一些实施方案中,该抗体包含seq id no:59的vh和seq id no:66的vl,并且具有igg2/κ同种型,当与野生型igg2比较时,其包含重链置换v234a、g237a、p238s、h268a、v309l、a330s和p331s。
[0551]
在一些实施方案中,该抗体包含seq id no:80的重链(hc)和seq id no:81的轻链(lc)。
[0552]
在一些实施方案中,该抗体包含seq id no:80的重链(hc)和seq id no:81的轻链(lc)。
[0553]
在一些实施方案中,该抗体是双特异性抗体。
[0554]
该抗体适用于例如治疗自身免疫性疾病的疗法。
[0555]
该抗体适用于例如治疗免疫介导的炎性疾病的疗法。
[0556]
该抗体适用于例如治疗关节炎的疗法。
[0557]
该抗体适用于例如治疗系统性红斑狼疮的疗法。
[0558]
该抗体适用于例如治疗炎性肠病的疗法。
[0559]
该抗体适用于例如治疗移植的疗法。
[0560]
该抗体适用于例如治疗肾移植的疗法。
[0561]
该抗体适用于例如治疗皮肤移植的疗法。
[0562]
该抗体适用于例如治疗骨髓移植的疗法。
[0563]
该抗体适用于例如治疗移植物抗宿主病的疗法。
[0564]
该抗体适用于例如治疗免疫性血小板减少症的疗法。
[0565]
该抗体适用于例如治疗多发性硬化症的疗法。
[0566]
该抗体适用于例如治疗甲状腺炎的疗法。
[0567]
该抗体适用于例如治疗i型糖尿病的疗法。
[0568]
该抗体适用于例如治疗动脉粥样硬化的疗法。
[0569]
该抗体适用于例如治疗类风湿性关节炎的疗法。
[0570]
该抗体适用于例如治疗克罗恩氏病的疗法。
[0571]
该抗体适用于例如治疗溃疡性结肠炎的疗法。
[0572]
该抗体适用于例如联合第二治疗剂治疗炎性肠病的疗法。
[0573]
现结合以下具体的非限制性实施例描述本发明。
[0574]
实施例1:材料和方法
[0575]
生成所使用的蛋白质
[0576]
由于内源性cd154作为三聚体而发出信号,因此以多种方式表达重组cd154,以获得功能性重组三聚体。可溶性人cd154(shcd154;seq id no:4)、可溶性普通狨(普通狨猴,本文中称为狨猴)cd154(smcd154;seq id no:5)或可溶性食蟹猴(macaca fascicularis)(食蟹猴(cynomolgous),本文中称为猕猴)cd154(sccd154;seq id no:6)被克隆并表达为his6(seq id no:10)融合体(shcd154-his,seq id no:7;smcd154-his,seq id no:8;sccd154-his,seq id no:9),或者被克隆并表达为与亮氨酸拉链(ilz)的融合体(seq id no:11)(shcd154-ilz,seq id no:12;smcd154-ilz,seq id no:13;sccd154-ilz,seq id no:14)。使用标准方法进行克隆、表达和蛋白质纯化。his和ilz融合体两者主要是三聚体。使用ez-link
tm
sulfo-nhs-lc-生物素和标记试剂盒(thermo,目录号21327)对smcd154和smcd154-ilz进行生物素化,通过haba-抗生物素蛋白测定法(thermo,目录号46610)和octet对生物素化的成功与否进行分析。在一些测定中使用表达人cd40(seq id no:15)的细胞。在一些测定中使用内源性表达人cd154的d1.1 jurkat细胞(crl-10915
tm
)。
[0577]
人cd154;seq id no:1
[0578]
mietynqtsprsaatglpismkifmylltvflitqmigsalfavylhrrldkiedernlhedfvfmktiqrcntgerslsllnceeiksqfegfvkdimlnkeetkkensfemqkgdqnpqiaahviseasskttsvlqwaekgyytmsnnlvtlengkqltvkrqglyyiyaqvtfcsnreassqapfiaslclkspgrferillraanthssakpcgqqsihlggvfelqpgasvfvnvtdpsqvshgtgftsfgllkl
[0579]
狨猴cd154;seq id no:2
[0580]
mietynqpvprsaatgppvsmkifmylltvflitqmigsalfavylhrrldkiedernlhedfvfmktiqrcntgerslsllnceeiksqfegfvkdimlnkeekkkensfemqkgdqnpqiaahviseasskttsvlqwaekgyytmsnnlvtlengkqltvkrqglyyiyaqvtfcsnreassqapfiaslclkppnrferillraanthssakpcgqqsihlggifelqpgasvfvnvtdpsqvshgtgftsfgllkl
[0581]
食蟹猴cd154;seq id no:3
[0582]
mietynqpsprsaatglpvrmkifmylltiflitqmigsalfavylhrrldkiedernlhedfvfmktiqrcntgerslsllnceeiksqfegfvkdimlnkeekkkensfemqkgdqnpqiaahviseasskttsvlqwaekgyytmsnnlvtlengkqltvkrqglyyiyaqvtfcsnreassqapfiaslclkspgrferillraanthssakpcgqqsihlggvfelqpgasvfvnvtdpsqvshgtgftsfgllkl
[0583]
shcd154;seq id no:4
[0584]
mqkgdqnpqiaahviseasskttsvlqwaekgyytmsnnlvtlengkqltvkrqglyyiyaqvtfcsnreassqapfiaslclkspgrferillraanthssakpcgqqsihlggvfelqpgasvfvnvtdpsqvshgtgftsfgllkl
[0585]
smcd154;seq id no:5
[0586]
mqkgdqnpqiaahviseasskttsvlqwaekgyytmsnnlvtlengkqltvkrqglyyiyaqvtfcsnreassqapfiaslclkppnrferillraanthssakpcgqqsihlggifelqpgasvfvnvtdpsqvshgtgftsfgllkl
[0587]
sccd154;seq id no:6
[0588]
mqkgdqnpqiaahviseasskttsvlqwaekgyytmsnnlvtlengkqltvkrqglyyiyaqvtfcsnreassqapfiaslclkspgrferillraanthssakpcgqqsihlggvfelqpgasvfvnvtdpsqvshgtgftsfgllkl
[0589]
shcd154-his;seq id no:7
[0590]
gshhhhhhgggsmqkgdqnpqiaahviseasskttsvlqwaekgyytmsnnlvtlengkqltvkrqglyyiyaqvtfcsnreassqapfiaslclkspgrferillraanthssakpcgqqsihlggvfelqpgasvfvnvtdpsqvshgtgftsfgllkl
[0591]
smcd154-his;seq id no:8
[0592]
gshhhhhhgggsmqkgdqnpqiaahviseasskttsvlqwaekgyytmsnnlvtlengkqltvkrqglyyiyaqvtfcsnreassqapfiaslclkppnrferillraanthssakpcgqqsihlggifelqpgasvfvnvtdpsqvshgtgftsfgllkl
[0593]
sccd154-his;seq id no:9
[0594]
gshhhhhhgggsmqkgdqnpqiaahviseasskttsvlqwaekgyytmsnnlvtlengkqltvkrqglyyiyaqvtfcsnreassqapfiaslclkspgrferillraanthssakpcgqqsihlggvfelqpgasvfvnvtdpsqvshgtgftsfgllkl
[0595]
his6;seq id no:10
[0596]
hhhhhh
[0597]
ilz;seq id no:11
[0598]
rmkqiedkieeilskiyhieneiarikkliger
[0599]
shcd154-ilz;seq id no:12
[0600]
gshhhhhhgggsrmkqiedkieeilskiyhieneiarikkligergggsmqkgdqnpqiaahviseasskttsvlqwaekgyytmsnnlvtlengkqltvkrqglyyiyaqvtfcsnreassqapfiaslclkspgrferillraanthssakpcgqqsihlggvfelqpgasvfvnvtdpsqvshgtgftsfgllkl
[0601]
smcd154-ilz;seq id no:13
[0602]
gshhhhhhgggsrmkqiedkieeilskiyhieneiarikkligergggsmqkgdqnpqiaahviseasskttsvlqwaekgyytmsnnlvtlengkqltvkrqglyyiyaqvtfcsnreassqapfiaslclkppnrferillraanthssakpcgqqsihlggifelqpgasvfvnvtdpsqvshgtgftsfgllkl
[0603]
sccd154-ilz;seq id no:14
[0604]
gshhhhhhgggsrmkqiedkieeilskiyhieneiarikkligergggsmqkgdqnpqiaahviseasskttsvlqwaekgyytmsnnlvtlengkqltvkrqglyyiyaqvtfcsnreassqapfiaslclkspgrferillraanthssakpcgqqsihlggvfelqpgasvfvnvtdpsqvshgtgftsfgllkl
[0605]
人cd40;seq id no:15
[0606]
mvrlplqcvlwgclltavhpepptacrekqylinsqccslcqpgqklvsdctefteteclpcgesefldtwnrethchqhkycdpnlglrvqqkgtsetdtictceegwhctseacescvlhrscspgfgvkqiatgvsdticepc
pvgffsnvssafekchpwtscetkdlvvqqagtnktdvvcgpqdrlralvvipiifgilfaillvlvfikkvakkptnkaphpkqepqeinfpddlpgsntaapvqetlhgcqpvtqedgkesrisvqerq
[0607]
亲和力测量
[0608]
使用proteon xpr36系统(biorad),利用表面等离子体共振(spr)进行亲和力测量。按照用于胺偶联化学的制造商说明书,通过将抗人igg fc(jackson cat#109-005-098)偶联到glc芯片(biorad,cat#176-5011)的改性藻酸盐聚合物层表面,来制备生物传感器表面。将大约4700ru(应答单位)测试抗体固定。动力学实验在25℃下在运行缓冲液(dpbs 0.03%聚山梨醇酯p20 100μg/ml bsa)中执行。为了进行动力学实验,捕获100ru的抗体,接着以0.391nm至100nm范围内的浓度(以4倍连续稀释)注射分析物(shcd154-his和smcd154-his)。以50μl/min监测缔合阶段3分钟,接着使缓冲液流动15分钟(解离阶段)。通过两个18秒的脉冲以100μl/min注射100mm h3po4(sigma,目录号7961),使芯片表面再生。
[0609]
使用proteon manager软件对采集的数据进行处理。首先,使用中间点对数据进行背景校正。然后,通过使用用于分析物注射的缓冲注射,进行数据的双参考相减。使用langmuir 1:1结合模型进行数据的动力学分析。
[0610]
cd154诱导的ramos细胞活化
[0611]
使用cd54作为细胞活化的标记来评估抗cd154抗体抑制ramos细胞活化的能力。将根据供应商方案而保持的ramos细胞(伯基特氏淋巴瘤细胞,crl-1596
tm
)以2.0
×
105细胞/孔接种到96孔v形底板中的100μl/孔的完全生长培养基中。将浓度为0.2、2或20μg/ml的测试抗体与40ng/ml的smcd154-his在室温(rt)下预温育1小时,然后加入到细胞中。将板盖上并温育过夜(37℃,5%co-2
)。在第二天将测定板离心,除去用过的处理介质。用冷的pbs/2%fbs洗涤所得细胞沉淀,然后用pe标记的抗cd54(icam-1)抗体或合适的同种型对照在4℃下将细胞染色1小时。用冷的pbs/2%fbs洗涤细胞,将其重悬于100μl/孔的冷pbs/2%fbs中,并在流式细胞仪上测量荧光信号(黄色通道)。当抗体达到以下标准时,将其确定为拮抗剂:相对于5c8抗体的效能%》5%5c8效能,其中效能%是指在最高测试浓度下相对于5c8的归一化抑制百分比。
[0612]
nf-κb-seap报告基因测定
[0613]
使用hek-blue
tm
cd40l细胞(invivogen)来评估抗cd154抗体抑制cd154诱导的cd40下游信号传导途径的能力,该hek-blue
tm
cd40l细胞被工程化以表达人cd40,并且在nf-κb诱导型启动子(ifn-β最小启动子)的控制下用分泌型胚胎碱性磷酸酶(seap)报告基因转染。细胞用人或猕猴cd154或用jurkat细胞进行刺激。根据供应商方案来保持hek-blue
tm
cd40l细胞,并且在补充有10%热灭活的胎牛血清和1x glutamax的dmem中进行所有活性测定。将细胞以每孔2.5或5
×
104个细胞的细胞密度及100μl体积接种到96孔组织培养板中,并温育过夜(37℃,5%co2)。第二天,将4x的shcd154-his或shcd154-ilz或d1.1 jurkat细胞溶液与4x抗-cd154抗体溶液(以适当的浓度)以1:1的比率预温育,产生2x的cd154溶液:抗体预复合物混合物。将cd154:抗体混合物在室温下温育1小时,同时将d1.1 jurkat:mab混合物在37℃及5%co2下温育1小时。在预复合物温育期结束时,将100μl/孔的2x预复合物溶液加入到含有hek-blue
tm
cd40l细胞的96孔测定板中;最终测定体积为200μl/孔,最终cd154浓度为80ng/ml shcd154-his或40ng/ml shcd154-ilz或2.5
–
6.0
×
104个d1.1 jurkat细胞。处理16-24小时后(37℃,5%co-2
),通过测量40μl/孔的上清液的吸光度(650nm)来分析上清
液的磷酸酶(seap)活性,所述上清液与160μl/孔的quanti-blue
tm
(invivogen)在37℃下温育了30-60。
[0614]
jurkat细胞介导的树突细胞活化测定
[0615]
通过测量由dc降低产生的各种细胞因子来评估抗-cd154抗体抑制jurkat-细胞介导的dc活化的能力。用50ng/ml il-4和gm-csf培养人单核细胞(biologic specialties)六天。在第3天在细胞中补充新鲜培养基(含有il-4和gm-csf)。在第6天将未成熟的dc(idc)(cd1a
cd14
low cd83-)用于细胞测定。将2.5
×
105d1.1 jurkat细胞(以1000拉德辐照)与0.000064-25μg/ml抗cd154抗体温育15-20分钟,然后与2.5
×
104idc在96孔圆底板中以200μl/孔的终体积共同培养。温育48小时后,收集上清液进行细胞因子分析。
[0616]
jurkat细胞介导的b细胞活化测定
[0617]
通过评估抗体对b细胞增殖的影响,来评估抗cd154抗体抑制jurkat细胞介导的b细胞活化的能力。在存在il-21(100ng/ml)和0.0077ng/ml-15μg/ml的抗cd154抗体的情况下,以200μl/孔的终体积,将1
×
105个d1.1jurkat细胞(以5000拉德辐照)与1
×
105个人扁桃体b细胞共同培养在96孔圆底板中。温育2天后,将甲基(-3h)-胸腺嘧啶(0.5μci/孔)加入到培养物中,过夜温育后测定人b细胞增殖。
[0618]
cd154介导的b细胞活化测定
[0619]
在人或食蟹猴b细胞中评估了抗cd154抗体抑制重组cd154介导的b细胞活化的能力。用100ng/ml rhil-21、0.5μg/ml shcd154-ilz以及0.0077ng/ml-15μg/ml的抗cd154抗体,以200μl/孔的终体积,将1
×
105个人扁桃体b细胞或食蟹猴脾细胞培养在96孔圆底板中。温育2天后,将甲基(-3h)-胸腺嘧啶(0.5μci/孔)加入到培养物中,过夜温育后测定人b细胞增殖。
[0620]
实施例2.从噬菌体展示文库中分离抗cd154抗体
[0621]
cd154结合fab选自从头合成pix噬菌体展示文库,如以下参考文献中所述:shi等人,j mol biol,2010年第397期:第385-396页;国际专利公布no.wo2009/085462;美国专利公布no.us2010/0021477)。简而言之,通过多样化人支架而生成文库,其中种系vh基因ighv1-69*01、ighv3-23*01和ighv5-51*01与人ighj-4微小基因经由h3环重组,并且人种系vlkappa基因o12(igkv1-39*01)、l6(igkv3-11*01)、a27(igkv3-20*01)和b3(igkv4-1*01)与igkj-1微小基因重组以组装完整的vh结构域和vl结构域。选择在围绕h1、h2、l1、l2和l3环的重链和轻链可变区中的位置用于多样化,所述位置与被鉴定为经常与蛋白和肽抗原接触的位置相对应。在选定位置处的序列多样性限于在各个ighv或iglv基因的ighv或iglv种系基因家族中的每个位置处出现的残基。通过使用长度为7-14个氨基酸的短至中等大小的合成环,产生在h3环处的多样性。设计在h3处的氨基酸分布,以模仿在人抗体中观察到的氨基酸变异。文库设计在shi等人的j mol biol 397:385-96,2010中有详细描述。根据它们的人vh和vl种系基因起源,命名用于生成文库的支架。将三个重链文库与四个种系轻链或种系轻链文库组合,以产生12个独特的vh:vl组合,用于针对smcd154或细胞表达全长猕猴cd154的淘选实验。
[0622]
针对在cho-s细胞中稳定地表达的全长猕猴cd154(seq id no:3)或生物素化的和非生物素化的smcd154(seq id no:5)在该文库中进行淘选。经过几轮淘选,进行使用smcd154作为抗原的多克隆噬菌体elisa,以检测各个淘选实验的具体富集情况。用单克隆
fab elisa进一步筛选从某些淘选实验(对结合至smcd154的结合剂表现出富集)收集的噬菌体,其中由各fab克隆表达的fab蛋白被用作结合剂,从而将非生物素化的smcd154直接覆盖在板上。选择具有比阴性对照fab高四倍的结合信号的fab克隆以全igg格式进行筛选。所选fabs被克隆到igg2sigma/κappa主链中,并且进一步表征用于结合至d1.1 jurkat细胞。与野生型igg2相比,igg2sigma是沉默的fc,并具有置换v234a、g237a、p238s、h268a、v309l、a330s和p331s。igg2sigma在美国专利no.8,961,967中有所描述。
[0623]
实施例3.在大鼠体内生成抗cd154抗体
[0624]
使用表达人免疫球蛋白基因座的转基因大鼠生成抗cd154抗体,即(omt,inc.)该内源性免疫球蛋白基因座被人igκ和igλ基因座、以及具有连接至大鼠ch基因座的人源v、d和j片段的嵌合人/大鼠igh基因座替换。igh基因座含有22个人vhs、连接至大鼠ch基因座的天然构型的所有人类d和jh片段。的生成与表征在osborn等人的j immunol,2013年第190期,第1481-1490页;以及国际专利公布no.wo2014/093908中有所描述。
[0625]
通过多个位点(rimms)重复免疫方案用smcd154免疫在45天免疫方案后,从全部四只大鼠获取淋巴结并用于产生杂交瘤。通过结合elisa筛选96孔板中的杂交瘤上清液,以鉴定表现出结合至smcd154的mab,从中选择表现出大于阴性对照平均值3倍的测定信号的杂交瘤上清液。
[0626]
将所选抗体克隆为全长igg2sigma/λ。选择在cd154诱导的ramos细胞活化中展示出拮抗剂活性的抗体用于进一步表征。
[0627]
实施例4.抗体的表征
[0628]
从噬菌体展示或表达人免疫球蛋白基因座的转基因动物获得的几种抗cd154抗体(如实施例2和3所述那样,表现出拮抗活性)得到测序,并进一步表征其与人和猕猴树突细胞的结合情况,表征其抑制人和猕猴树突和b细胞功能的能力,并且表征其抗体效应子功能。使用标准方法对抗体的vh和vl区进行测序。
[0629]
表2示出了所选抗体的hcdr1氨基酸序列。
[0630]
表3示出了所选抗体的hcdr2氨基酸序列。
[0631]
表4示出了所选抗体的hcdr3氨基酸序列。
[0632]
表5示出了所选抗体的lcdr1氨基酸序列。
[0633]
表6示出了所选抗体的lcdr2氨基酸序列。
[0634]
表7示出了所选抗体的lcdr3氨基酸序列。
[0635]
表8示出了所选抗体的vh氨基酸序列。
[0636]
表9示出了所选抗体的vl氨基酸序列。
[0637]
表2.
[0638][0639]
表3.
[0640][0641][0642]
表4.
[0643][0644]
表5.
[0645][0646]
表6.
[0647][0648][0649]
表7.
[0650][0651]
表8.
[0652][0653][0654]
表9.
[0655][0656]
抗体抑制jurkat细胞(表10中的d1.1 jurkat细胞)上提供的内源性cd154的功能,并重组表达人cd154三聚体(表达为shcd154-ilz或shcd154-his),如使用nf-κb seap报告基因测定所测得的那样。抗体以0.08-21.15nm范围内的ic
50
值抑制信号传导。表10示出了测定中用于选择抗体的ic
50
值。表中每种抗体的ic
50
值范围代表从独立实验中获得的最低及最高的ic
50
值,而单个值表示抗体在一个实验中受到测试,或者仅有一个有效的ic
50
值可用。
[0657]
表10.
[0658][0659]
抗体抑制树突细胞活化的能力是使用il-12p40分泌作为dc活化的标记来评估的。
抗体以0.02到0.49nm范围内的ic
50
值来抑制由提供于jurkat细胞上的内源性cd154诱导的dc活化。表11示出了用于在测定中选择抗体的ic
50
值。表中的ic
50
范围代表在2-4个捐献者的1-6次重复的独立实验中获得的最低及最高的ic
50
值。
[0660]
表11.
[0661][0662][0663]
使用b细胞增殖情况作为读出示值来测量抗体抑制人或猕猴b细胞活化的能力。抗体以0.01-5.35nm范围内的ic
50
值同时抑制内源性cd154(d1.1 jurkat细胞)和重组人cd154三聚体(shcd154-ilz)所诱导的增殖。表12示出了在人或猕猴b细胞活化测定中获得的各种抗体的ic
50
值。表中的ic
50
范围代表在2-4个捐献者的1-6次重复的独立实验中获得的最低及最高的ic
50
值。表中的单个ic
50
值表示有一个有效ic
50
值是可用的。
[0664]
表12.
[0665][0666]
实施例5.对抗体进行工程改造以最小化翻译后修饰的风险
[0667]
抗体c4lb89的vl在lcdr2中含有假定的脱氨基位点(seq id no:66的轻链c4ll49中的n52-s53)。在vl中单独对每个位置(n52s和s53t)进行置换。突变的轻链与亲本重链c4lh165(seq id no:59)共表达,以产生抗体c4lb235和c4lb236作为igg2sigma/κ。在表13和表14中分别示出了c4lb235和c4lb236的lcdr2和vl的氨基酸序列。c4lb235包含seq id no:17、23和30的hcdr,seq id no:37、49和52的lcdr,seq id no:59的vh,以及seq id no:72的vl。c4lb236包含seq id no:17、23和30的hcdr,seq id no:37、50和52的lcdr,seq id no:59的vh,以及seq id no:73的vl。
[0668]
表13.
[0669][0670]
表14.
[0671][0672]
对两种抗体抑制猕猴b细胞增殖的能力进行了测试。c4lb235显示出与c4lb89类似的效力,而c4lb236显示出比c4lb89低的效力。
[0673]
实施例6.效应子沉默的抗cd154抗体不诱导血小板活化
[0674]
抗cd154抗体已在临床上有所发展,对自身免疫性疾病患者具有积极的效果,但是由于血栓栓塞(te)事故的出现,人们停止了该抗体的进一步临床开发。人源化5c8抗体(igg1/κ)是在临床上诱导te的抗cd154抗体(yazdany等人,lupus,2004年第13期:第377-380页)。人们假设,因形成高度有序的抗cd154/cd154免疫复合物(ic)而引起的血小板活化和聚集导致了由人源化5c8介导的血栓栓塞(te),该免疫复合物通过将fc结合至血小板fcγriia受体而使血小板交联。在体外,带有缺乏fcγriia受体结合的沉默fc(igg1中的d265a置换)的工程化5c8抗体不会活化血小板(xie等人,j immunol,2014年第192期:第4083-4092页)。
[0675]
至少与fcγriia取消结合、并且具有降低的效应子功能是抗cd154抗体因此可能更适合作为用于te的风险降低的疗法。
[0676]
为此,用各种fc置换产生效应子沉默的抗cd154抗体,并测试它们对血小板活化的影响。
[0677]
人源化5c8抗体的vh和vl(karpusas等人,structure,2001年第9期:第321-329页)被克隆为igg1sigma/κ、igg1sigmayte/κ、igg2sigma/κ或igg2sigmayte/κ,以评估fc对血小板活化的影响;所得抗体命名为5c8igg1sigma、5c8igg1sigmayte、5c8igg2sigma和5c8igg2sigmayte。与野生型igg1进行比较,igg1sigma包含置换l234a、l235a、g237a、p238s、h268a、a330s和p331s。igg1sigmayte包含l234a、l235a、g237a、p238s、m252y、s254t、t256e、h268a、a330s和p331s置换。igg2sigma包含v234a、g237a、p238s、h268a、v309l、a330s和p331s置换。igg2sigmayte包含v234a、g237a、p238s、m252y、s254t、t256e、h268a、v309l、a330s和p331s置换。根据eu index进行残基编号。具有igg2sigma主链的抗体缺乏效应子功能,并结合至fcγr,如美国专利no.8,961,967所述。yte置换(m252y、s254t、t256e)在在
dall'acqua等人,j biol chem,2006年第281期第23514-23524中有所描述。
[0678]
人源化5c8的vh和vl结构域分别示于seq id no:74和75中。
[0679]
seq id no:74
[0680]
qvqlvqsgaevvkpgasvklsckasgyiftsyymywvkqapgqglewigeinpsngdtnfnekfkskatltvdksastaymelsslrsedtavyyctrsdgrndmdswgqgtlvtvss
[0681]
seq id no:75
[0682]
divltqspatlsvspgeratiscrasqrvssstysymhwyqqkpgqppkllikyasnlesgvparfsgsgsgtdftltissvepedfatyycqhsweipptfgggtkleik
[0683]
测试了5c8igg1sigma、5c8igg1sigmayte、5c8igg2sigma和5c8igg2sigmayte对血小板活化的影响。
[0684]
使用经预先筛选的、对单独的shcd154反应较低的健康人供体的血液。使用经验证的血小板活化标记pac-1(活化的gpiib/iiia)和cd62p(p-选择素),通过流式细胞术评估血小板活化情况。简而言之,将全血(wb)加入到含有1mm cacl2的经修饰的tyrodes-hepes缓冲液中,并将具有或不具有fcγriia阻断抗体(克隆iv.3,stemcell technologies#60012)的抗pac1和抗cd62p抗体加入到混合物中,再温育25分钟。将预先形成的可溶性cd154免疫复合物(peprotech,目录号310-02;seq id no:4或tonbo biosciences,目录号21-7088)/抗体以cd154:抗cd154为3:1的摩尔比加入混合物中,并再温育20分钟;将血小板固定在1%福尔马林中,然后进行facs分析。以表达pac-1和cd62p的门控血小板%(cd61阳性事件)评估每种条件下的血小板活化情况;针对每个治疗条件,捕获5000个cd61表达事件(血小板)并进行分析。实验的结果示于图1中。cd154/5c8igg1(野生型igg1)ic活化血小板,而具有5c8-igg1sigma、5c8igg1sigmayte、5c8igg2sigma和5c8igg2sigma-yte的cd154 ic未活化血小板。带有adp的血小板活化不受免疫复合物的抑制(数据未显示)。所有抗体均无法单独活化血小板(数据未显示)。
[0685]
还在血小板活化测定中测试了抗cd154抗体c4lb5、c4lb89、c4lb94、c4lb150、c4lb189、c4lb191、c4lb199(所有igg2sigma效应子沉默的mab),以证实该抗体已经消除了与fcγriia的结合,并且没有活化血小板。图2示出了实验的结果,其证明cd154与c4lb5、c4lb89、c4lb150、c4lb189、c4lb191或c4lb199复合的免疫复合物不能活化血小板。cd154/c4lb94 ic在血小板上诱导了pac-1。结果证明,具有igg1sigma、igg1sigmayte、igg2sigma或igg2sigmayte同种型的抗cd154抗体通常可能不活化血小板,因此可能比野生型igg1上的抗体具有改善的安全性。
[0686]
实施例7.同种型转换对抗体特性的影响
[0687]
抗体c4lb89的可变区被克隆为igg1sigma/κ和igg1sigmayte同种型,以评估功能性和可开发性方面可能存在的差异。新的抗体被命名为c4lb231(igg1sigma)和c4lb232(igg1sigmayte)。
[0688]
将得到的igg1sigma和igg1sigmayte抗体与其亲本抗体的功能进行比较。c4lb231和c4lb232在功能上与亲本c4lb89相当。表15示出了表中所示的功能测定中每种抗体的ic
50
值或ic
50
值的范围。表中的ic
50
范围代表在2-4个捐献者的1-6次重复实验中获得的最低及最高的ic
50
值。表中的单个ic
50
值表示有一个有效ic
50
值是可用的。
[0689]
表15.
[0690][0691]
还测试了c4lb231和c4lb232对血小板的作用。shcd154:c4lb231和shcd154:c4lb232 ic都不能在基线以上活化血小板。cd154/5c8igg1ic将血小板活化,并且该活化在存在iv.3的情况下被阻断,表明血小板活化是由结合至fcγriia的ic所介导的。图3示出了实验结果。
[0692]
实施例8.抗cd154抗体以高亲和力结合人cd154
[0693]
如实施例1所述,使用proteon进行亲和力测定。结合速率、解离速率和亲和力示于表16中。该表中报道的参数是从用于所有样品的1:1langmuir结合模型获得的,除了符合双态结合模型的c4lb94和c4lb150之外。
[0694]
表16.
[0695][0696]
实施例9.狨猴cd154与c4lb89形成的复合物的晶体结构。
[0697]
使用x射线晶体学鉴定抗体c4lb89的表位。将c4lb89的his-标记的fab片段和狨猴cd40l的his-标记的可溶形式(smcd154-his)在hek293gnti细胞中表达,并使用亲和力及尺寸排阻色谱法进行纯化。将smcd154:c4lb89复合物在4℃下温育过夜,浓缩,并使用体积排阻色谱法分与未复合的物类分离。复合物通过蒸汽扩散方法从包含16%peg 3350、0.2m柠檬酸铵、0.1m mes的ph 6.5的溶液中结晶。该晶体属于立方空间群p213,晶胞尺寸为通过使用c4lb89 fab和cd40l(pdb条目1aly)的晶体结构作为搜索模型的分子置换方法来确定复合物的结构。
[0698]
smcd154:c4lb89复合物是在晶体3-折叠轴上对称的三聚体。c4lb89在位于细胞表
面远端表位的两个亚基之间的交界处结合mcd154。表位包括16个残基,两个cd154亚基中的每一者各提供8个残基。表位残基为第一cd154亚基中的e182、s185、q186、a187、p188、s214、a215和r207,以及第二cd154亚基中的t176、f177、c178、q220、s248、h249、g250和f253。表位残基根据seq id no:1的全长人cd154进行编号。互补位定义为来自cd154残基的在内的抗体残基。c4lb89互补位包含来自c4lb89重链的9个残基:来自hcdr1的s31和y32,来自hcdr2的s52、i54、f55和n57,以及来自hcdr3的r100、y101和y102。根据seq id no:59的c4lb89 vh对互补位残基进行编号。轻链不涉及与mcd154的接触。根据接触次数,hcdr2中的f55是关键的抗原识别要素。f55与cd154残基t176、f177、c178、q220、s248、h249、g250和f253接触。hcdr3残基y101和y102也有助于结合。图4示出了hcdr2和hcdr3接触残基以及缺乏lc与cd154的结合的情况。图5示出了表位和互补位残基的卡通图。
[0699]
人和狨猴的可溶性cd154蛋白仅相差8个氨基酸残基。所有mcd154c4lb89表位残基在人类中都是保守的。因此,预期该表位在狨猴和人cd154之间是保守的。全长的人和狨猴cd154蛋白的比对情况在图6中示出。
[0700]
实施例10.抗cd154抗体的血小板活化是表位依赖性的
[0701]
将c4lb89可变区(seq id no:59的vh以及seq id no:66的vl)克隆为igg1/κ,得到c4lb237抗体。确认c4lb237保留了结合的人cd154(表17),如使用proteon测量的,如实施例1中所述。c4lb237对人cd154的亲和力为23.6
±
5.4pm。将源自c4lb89的vh/vl同种型从igg2sigma转换成igg1看似改变了所得抗体的结合亲和力。
[0702]
正如所料,c4lb237分别以0.994μm和0.146μm的kd与人fcγriia和fcγriiia结合。在nf-κb seap报告基因测定中,当使用shcd154-his来诱导信号传导(表18)时,c4lb237表现出与c4lb231相当的效力,并且表现出高于c4lb89的效力。
[0703]
测试了c4lb237对血小板活化的影响。shcd154:c4lb237 ic不能在基线以上活化血小板,如图7所示。该结果表明,除fc之外,抗体的表位对于抗体是否能够活化血小板起到了作用。
[0704]
表17.
[0705]
样品ka(1/ms)106kd(1/s)10-05
kd(pm)c4lb231(n=8)2.53
±
0.157.81
±
0.6931.0
±
3.3c4lb232(n=8)2.54
±
0.158.89
±
0.9135.2
±
5.2c4lb237(n=4)2.59
±
0.206.05
±
0.9823.6
±
5.4
[0706]
表18.
[0707][0708]
实施例11.c4lb89的工程中性突变
[0709]
对与cd154复合的c4lb89的晶体结构进行分析,结果揭示了c4lb89的cdr中的这样的位置:其可以被突变而不影响复合物的整体结构,并且因此预期不影响c4lb89抗体的特性。轻链cdr上的这些中性突变列于表19中,并且重链cdrs中的这些中性突变列于表20中。
可经突变的残基的编号既显示在单独的cdr上,也显示在vl或vh上。例如,seq id no:37(rasqsissyln)的lcdr1上的残基q4可以突变为a、c、d、e、f、g、h、i、k、l、m、n、r、s、v、w或y,预期抗体的特征不会显著改变。seq id no:66的vl中的相应残基是q27。
[0710]
使用标准方法将表19或表20中所示的突变单独或一起结合到c4lb89上。表达所得的vh/vl对,并使用本文所述的方法分离和表征突变的抗体。
[0711]
表19.
[0712][0713]
表20.
[0714]
[0715][0716]
实施例12.评估血小板活化和高阶免疫复合物形成
[0717]
在评估带有sc-hplc和dls的早期实验中的用于c4lb231和5c8igg1的fab区域和shcd154复合物的晶体结构数据以及回顾了血小板活化数据之后,假设抗cd154抗体与shcd154三聚体结合的以下微小差异可有助于高阶免疫复合物的形成:1)c4lb231fab结合scd154三聚体的2个亚基,而5c8fab结合scd154的1亚基,2)与5c8 fab相比,c4lb231fab在构象上看起来更为刚性,3)抗-cd154抗体与scd154的结合角度。
[0718]
为了进一步评估介导血小板活化的抗体表位和利用shcd154形成高级免疫复合物的作用,将各种抗cd154抗体的vh和vl克隆并表达为fc沉默igg2sigma和igg1sigma同种型或作为igg1。所生成的抗体在表21中示出。按实施例6中所述完成血小板活化测定。对于通过尺寸排阻高效液相色谱法(se-hplc)和动态光散射(dls)而进行的高阶免疫复合物形成的评估,以1:1(亦做10:10)和10:1摩尔比将抗体与shcd154复合,以评估免疫复合作用中是否存在浓度依赖性差异。
[0719]
表21.
[0720]
[0721][0722]
seq id no:84c4lb119的vh
[0723]
qvqlvqsgaevkkpgssvkvsckasggtfssyyiswvrqapgqglewmgaidpyfgyanyaqkfqgrvtitadeststaymelsslrsedtavyycartglnyggfdywgqgtlvtvss
[0724]
seq id no:85c4lb119的vl
[0725]
eivltqspatlslspgeratlscrasqsvssylawyqqkpgqaprlliydasnratgiparfsgsgsgtdftltisslepedfavyycqqrsnwpltfgqgtkveik
[0726]
seq id no:86c4lb83的vh
[0727]
qvqlvqsgaevkkpgssvkvsckasggtfssyaiswvrqapgqglewmgwiipifgntnyaqkfqgrvtitadeststaymelsslrsedtavyycarekdfrgytkldywgqgtlvtvss
[0728]
seq id no:87c4lb83的vl
[0729]
diqmtqspsslsasvgdrvtitcrasqsinnwlnwyqqkpgkapklliyaasslqsgvpsrfsgsgsgtdftltisslqpedfatyycqqsfsfpytfgqgtkveik
[0730]
使用实施例1中描述的方案对c4lb83和c4lb119的结合特征和功能进行评估,并示于表22中。
[0731]
表22.
[0732][0733]
方法
[0734]
se-hplc
[0735]
抗体的免疫复合物示于表21中,以1:1和10:1的抗体:shcd154摩尔比在110μl的1xpbs中制备alexafluo-448标记的shcd154,并在37℃下温育30分钟。对于每次运行,将每个样品100μl注入到柱(agilent,1100/1200系统)中,样品中含有5μg af488标记的shcd154
和15μg(1:1比率)或150μg(10:1比率)的抗-cd154 mab。根据标准物(bio-rad)的保留时间计算分子量。蛋白质的分子量和保留时间之间的关系满足以下等式:
[0736]
log(m)=b-c t,
[0737]
其中m是分子量,t是保留时间,b和c是常数。log(m)和t的线性曲线由标准se-hplc色谱图通过最小二乘拟合获得,其中r2=0.9928。
[0738]
dls
[0739]
dls测量基于光散射原理和分子或布朗运动。布朗运动是分子在溶液中的一种典型行为,它使得光被散射成同相和异相,从而产生建设性的和破坏性的干扰。其结果是,散射光的强度随时间而波动。在dls或qels(准电光散射)分析过程中,散射光强度的时间依赖性波动由快速光子计数器捕获。波动与扩散速率成正比。使用斯托克斯-爱因斯坦方程求解相关数据产生流体动力学半径。不同于sec-mals或sec,其中样品分辨率可以区分单体和二聚体,而dls只能分辨尺寸因数为4的物质,因此将开始解出单体和四聚体;然而通过二聚体的单体不会得到求解,但会报告混合物的加权平均值。
[0740]
斯托克斯-爱因斯坦方程:rh=kt/6πηd;其中
[0741]
d=扩散系数,
[0742]
k=玻尔兹曼常数
[0743]
t=温度
[0744]
η=粘度
[0745]
在pbs中以10:1或10:10的抗体:shcd154的摩尔浓度(10μm抗体与1μm或10μm shcd154)制备表21中所示的10μm的单独抗体或抗体的免疫复合物以及shcd154。所有样品都是在带有小瓶插管的玻璃小瓶中制备的(250μl脱活玻璃,聚合物支脚,安捷伦目录号5181-8872),并按以下顺序添加样品:pbs、mab、shcd154。通过轻轻涡旋混合样品,然后在室温下,伴随摇动(旋转混合器(vwr)30转/分钟)温育约23小时。如果需要的话,首先使用标准方法浓缩抗体。
[0746]
在23℃下,在dynapro plate reader dls仪器(wyatt technologies corporation)上测定所有样品的粒度和物质分布。首先使用bsa验证dls一致性(数据未显示)。通过在3个孔的每一个中引入30μl样品进行测量(一式三份测量)。在dynapro平板读数器中获得dls测量结果。对每个样品进行二十次5秒的采集,激光功率由仪器自动调整。用于数据分析的参数包括对于1.019cp的pbs在23℃下的粘度,和对于1.333的pbs在589nm和23℃下的折射率值。该程序使用球状蛋白质模型。信号被分成多个峰,峰1为0.1-10nm,峰2为10-100nm,峰3为100-1000nm,并且峰4为1000-5000nm。注意到样品中产生可见的沉淀物(如果形成的话)。使用dynamics软件(wyatt technology inc.)进行数据分析。生成质量百分比与物质半径(rh)的图。计算并记录峰半径、多分散性、质量百分比和强度百分比。
[0747]
结果
[0748]
血小板活化
[0749]
评估了shcd154和表达为fc沉默的igg2sigma或igg1sigma的抗体,或表达为野生型igg1的抗体的免疫复合物活化血小板的能力。将克隆在各种igg支架上的5c8抗体用作对照。图3示出了5c8igg1:shcd154免疫复合物以fcγriia依赖性方式活化血小板,因为抗fcγriia抗体抑制5c8igg1介导的血小板活化。克隆在效应子沉默的fc上的5c8vh/vl区、
igg1sigma或igg2sigma丧失了活化血小板的能力(图1)。这些结果与之前描述的一致。然而,出人意料的是,实施例10中进行的实验表明,带有野生型igg1抗体的免疫复合物(c4lbb237:shcd154)未活化血小板(图7),促使进一步研究血小板活化可能的表位依赖性。
[0750]
4种不同抗体的vh/vl区被克隆为igg2sigma、igg1sigma或野生型igg1,以评估表位和/或fc对血小板活化以及对形成高阶免疫复合物的作用。与之前在文献中公开的内容相反,发现血小板活化在一些情况下由独立于fcγriia介导的交联的抗体表位所介导。
[0751]
图8a、图8b和图8c示出了分析的概要。fc沉默抗体c4lb119(图8a)和c4lb94(图8b)的免疫复合物以fcγriia非依赖性方式活化血小板,因为用抗-fcγriia抗体预阻断不能抑制血小板活化。c4lb83(也是fc沉默抗体)的ic适度地活化血小板(图8c)。在野生型igg1上克隆的具有相同vh/vl结构域的抗体的ic在每种情况下以fcγriia介导的方式活化血小板(图8a中的c4lb278,图8b中的c4lb289,和图8c中的c4lb288)。因此,鉴定了几种尽管具有沉默fc但会介导血小板活化的抗体。鉴定了出这样一个vh/vl结构域对,其无论在沉默(c4lb231)还是野生型igg1(c4lb237)上都不介导血小板活化。这些数据表明抗体表位在介导血小板聚集中起作用。
[0752]
高阶免疫复合物的形成
[0753]
使用e-hplc和dls来进一步评估高级免疫复合物形成的存在情况,表21中所示的抗cd154抗体与shcd154之间的这些免疫复合物的近似大小。由于shcd154是溶液中的三聚体,所以抗体:shcd154三聚体在溶液中的预期化学计量是3:1。对于se-hplc,较重并因此较大的免疫复合物将具有较短的保留时间,而较轻并因此较小的免疫复合物将具有较长的保留时间,无法从柱上洗脱而显示出较低回收率%的非常大的免疫复合物的情况除外。对于dls,半径(rh)值越大,免疫复合物越大。板dls技术不能解析igg单体、二聚体、三聚体和四聚体。因此获得的rh值将是单体-四聚体的加权平均值,因此接近6.5的rh值可以代表含有较高有序物质(通常为二聚体)的mab的溶液。当mab与shcd154结合是化学计量的时,可能存在两种物质:3:1复合物(约500kda)和未结合的抗体(约150kda),对于3:1的复合物和游离mab而言,其分别对应于~8.8nm和5-6.5nm的rh值。这两种技术都不能准确地解析免疫复合物的分子量,但可以允许比较大小。表23示出了保留时间和流体动力学半径与近似分子量之间的关系。
[0754]
表23.
[0755][0756]
dls
[0757]
在抗体:shcd154复合物形成于过量抗体(10:1摩尔比)和等效浓度(1:1摩尔比)的条件下,评估了在不存在cd154的情况下的mab和抗体:shcd154免疫复合物大小。在抗体过量的条件下,抗体通常使cd154位点饱和以形成免疫复合物,并且存在过量的未结合的抗
体。在相同的浓度下,不存在游离的抗体或游离的shcd154。在不存在sh cd154的情况下,以及在存在10:1和10:10摩尔比的sh cd154的情况下获得的每个mab的rh值示于表24中。
[0758]
标称mw为150kda的典型mab产生5.0-6.5nm的rh值。通常在尺寸排阻色谱法期间可见的igg二聚体不能通过平板dls技术解析。所获得的rh值将是单体-四聚体的加权平均值,因此接近6.5的rh值可以代表含有较高有序物质(通常为二聚体)的mab的溶液。
[0759]
对于不存在cd154的mab,对于除了c4lb287和c4lb234(其rh值分别为6.9和7.1nm)之外的所有mab均观察到5.5-6.3nm的预期rh值,表明这些抗体具有内在的聚集趋势。
[0760]
以10:1比率形成的抗体:shcd154复合物的rh值通常小于约8.8nm,说明存在3:1的化学计量的复合物,而未形成高阶免疫复合物(除了5c8igg2sigma(c4lb71)和c4lb234(rh值分别为8.9和9.3nm)之外,其表明形成了高阶免疫复合物)。
[0761]
与具有1μm cd154(10:1抗体:cd154比率)的复合物相比,将shcd154浓度增加至10μm会使抗体:shcd154免疫复合物具有升高的rh。一些抗体:shcd154复合物显示出异质性,其高分子量次要物质以总质量的7-25%的范围存在。c4lb71、5c8igg1、c4lb89、c4lb119、c4lb94、c4lb234和c4lb289 ic rh值分别为22.1、615、56.3、45.0、18.3、18.7和19.6nm。另外,c4lb89、c4lb119、c4lb83、c4lb228也形成900-4000nm的物质,并且c4lb89和c4lb119形成沉淀物,表明免疫复合物非常大。在12nm rh附近的物质典型地对应于~1000kda的质量,因此这些mab在这些条件下与cd154形成非常大的免疫复合物。
[0762]
表24.
[0763]
[0764][0765]
se-hplc
[0766]
表25示出了从se-hplc分析获得的单独的抗cd154抗体及其与shcd154的免疫复合物的保留时间、回收率和估计的分子量(mw)。典型的抗体具有约150kd的mw,并且shcd154三聚体具有约50kda的mw。因此,具有3:1化学计量的mab:shcd154三聚体复合物具有约500kda的预期分子量。
[0767]
表25.
[0768]
[0769][0770]
所有抗体与shcd154形成免疫复合物。c4lb231、c4lb237、c4lb290、c4lb287(均为igg1sigma)与scd154形成免疫复合物并在7.0min时洗脱,然而c4lb290和c4lb287在1:1条件下的回收率低于10:1的条件,而c4lb231和c4lb237具有更高%回收率(》80%)。早于6.2至6.5分钟洗脱的c4lb289(igg1)、c4lb234(igg1sigma)、5c8igg1sigma(c4lb71)和c4lbb94(igg2sigma)表明形成了比上述mab更大的复合物。5c8igg1在3:1的mab:shcd154三聚体免疫复合物的预期保留时间处具有宽峰,然而该宽峰和低回收率(在1:1条件下为56%)表明可能形成高阶免疫复合物,该复合物可能与柱相互作用或者没有进入柱。c4lb89和c4lb119(均为igg2sigma)与shcd154形成复合物,并且以宽峰和非常低的回收率(1:1条件下6-17%)洗脱,这可能是由于形成了没有进入柱的大复合物。通常,当与igg1sigma或igg1上的抗体相比时,igg2sigma同种型上的抗体形成更大的免疫复合物。
[0771]
表26示出了抗体特性的概要。总体而言,血小板活化数据、se-hplc和dls数据一起表明血小板活化不完全归因于活性fc。数据表明具有沉默fc的抗体(诸如igg1sigma和igg2sigma)能够形成比预期的3:1的mab与shcd154三聚体复合物大的更大尺寸的免疫复合物,并且沉默fc上的一些抗体能够活化血小板。数据支持这样的结论,即vh/vl结构域两者(例如抗体结合的表位)和高阶免疫复合物的形成都有助于血小板活化。
[0772]
表26.
[0773]
[0774]
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
