一种钯催化co参与的1,4-烯炔芳构化反应合成芳胺基酚类化合物的方法
技术领域
1.本技术属于有机合成方法学技术领域,具体涉及一种钯催化co参与的1,4-烯炔芳构化反应合成芳胺基酚类化合物的方法。
背景技术:
2.环状结构是天然产物和生物活性分子中普遍存在的结构基元,大多数的结构复杂分子都含有两个或多个环。在构筑环的方法中,过渡金属催化烯炔的环化反应是最为高效、便捷的方法之一,在药物合成、生物活性天然产物全合成以及新材料合成等方面有着重要的意义,因而一直是有机化学中重要的研究领域之一。过渡金属催化的烯炔环化反应作为有机合成中简洁、高效的构建碳-碳键新方法有以下几个特点:由简单易得的开链化合物出发可以高效的合成环状化合物;是环境友好、步骤和原子经济性的合成策略;具有高化学选择性、高区域选择性,在适当配合使用手性配体或试剂的条件下会有高对映选择性;可以方便地得到用经典方法难以合成的特殊分子骨架。
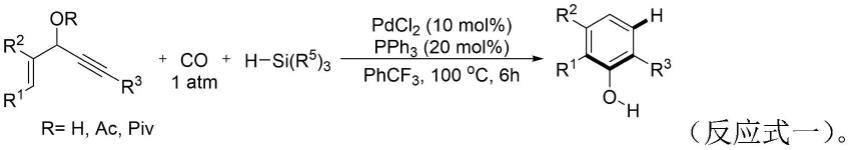
3.近年来,对过渡金属催化的烯炔环化反应研究越来越多,并取得了不错的成果。发明人课题组近来年对1,4-烯炔的环化反应进行了深入研究。2018年发明人课题组报道了钯催化1,4-烯炔与硅烷的羰基化[5 1]环化反应研究。反应由氢硅烷激活,可生成有价值的功能化苯酚。该方法采用氢硅烷作为外部试剂,以促进[5 1]羰基化苯基化。该反应在概念和机理上都是一种新的羰基环加成反应,通过形成四个新的化学键来构建取代苯酚,具有良好的官能团耐受性(反应式一,angewanted chemie international edition,2018,57(40):13308-13312.)。
[0004][0005]
2020年发明人课题组继续发展了钯/铜催化1,4-烯炔与硅硼试剂的双羰基化[5 1]环化反应。在钯/铜催化体系下高效合成了具有潜在生物活性的乙酰基硅基苯酚类衍生物,与以前报道的硅金属试剂合成此类化合物的方法相比,该策略条件更为温和,底物适用性更广(反应式二,chemical communications,2020,56(11),1669-1672.)。
[0006][0007]
在此基础上,为了丰富烯炔环化反应的多样性和为环状化合物的合成提供更多种便捷的途径,发明人设想能否在苯酚类化合物的芳环上引入含氮官能团,以实现氨基羰基
化反应合成含有芳胺基团的苯酚类化合物。进而在本发明中,提出了一种新颖的羰基化[5 1]环化反应合成芳胺类化合物的新方法,该方法在钯催化条件下,以芳胺为外部进攻试剂,在温和的条件下经1,4-烯炔[5 1]环化反应高效实现了对芳胺基酚类化合物的构建。
技术实现要素:
[0008]
本发明的目的在于丰富现有技术的构建芳胺基酚类化合物的合成策略,提出了一种新颖的羰基化[5 1]环化反应合成芳胺类化合物的新方法,该方法在钯催化条件下,以芳胺为外部进攻试剂,在温和的条件下经1,4-烯炔[5 1]环化反应高效实现了对芳胺基酚类化合物的构建。
[0009]
根据本发明提供的一种钯催化co参与的1,4-烯炔芳构化反应合成芳胺基酚类化合物的方法,包括如下步骤:
[0010]
向反应器中加入式1所示的芳胺类化合物、式2所示的1,4-烯炔类化合物、钯催化剂、氧化剂和有机溶剂,随后将混合物在co气氛下加热搅拌反应,反应完全后经后处理得到式3所示的芳胺基酚类化合物,反应式如下:
[0011][0012]
上述反应式中,ar1,ar2彼此独立地选自取代或未取代的c
6-20
芳基、取代或未取代的c
3-20
杂芳基。
[0013]
r1选自c
1-20
烷基、c
3-20
环烷基、取代或未取代的c
6-20
芳基、取代或未取代的c
3-20
杂芳基。
[0014]
r2选自氢、c
1-20
烷基。
[0015]
本发明的任意部分中,所述的c
6-20
芳基优选为c
6-14
芳基,更优选为苯基、萘基、蒽基、菲基、芴基、茚基等。
[0016]
本发明的任意部分中,所述的c
3-20
杂芳基优选为c
3-12
杂芳基,更优选地为呋喃基、吡啶基、噻吩基、苯并呋喃基、苯并噻吩基、咪唑基、苯并咪唑基、噻唑基、喹啉基、吲哚基、咔唑基、嘧啶基等。
[0017]
本发明的任意部分中,所述c
1-20
烷基优选为c
1-12
烷基,更优选为c
1-6
烷基,最优选地为甲基、乙基、丙基、正丙基、异丙基、正丁基、异丁基、叔丁基、正戊基、异戊基、新戊基、正己基、正庚基、正辛基等。
[0018]
本发明的任意部分中,所述c
3-20
环烷基优选为c
3-12
环烷基,优选地为环丙基、环丁基、环戊基、环已基、二环[2.2.2]辛烷基、二环[2,2,1]庚烷基、十氢化萘基、金刚烷基。
[0019]
本发明的任意部分中,所述“取代或未取代的”中的取代基选自卤素、c
1-6
烷基、c
1-6
烷氧基、c
1-6
烷硫基、c
1-6
卤代烷基、-cn、-no2。具体地可以选自氟、氯、溴、碘、甲基、乙基、正丙基、异丙基、正丁基、异丁基、叔丁基、正戊基、正己基、甲氧基、乙氧基、叔丁氧基、甲硫基、乙硫基、三氟甲基、-cn、-no2等。
[0020]
优选地,在前述反应式中,ar1,ar2彼此独立地选自取代或未取代的c
6-14
芳基、取代
或未取代的c
3-12
杂芳基。
[0021]
r1选自c
1-6
烷基、c
3-12
环烷基、取代或未取代的c
6-14
芳基、取代或未取代的c
3-12
杂芳基。
[0022]
r2选自氢、c
1-6
烷基。
[0023]
其中所述取代或未取代的中的取代基具有如本文前述所定义。
[0024]
进一步优选地,ar1,ar2彼此独立地选自取代或未取代的苯基、取代或未取代的萘基。
[0025]
r1选自甲基、乙基、正丙基、正丁基、正戊基、正己基、环丙基、环丁基、环戊基、环己基、取代或未取代的苯基、取代或未取代的萘基、噻吩基、呋喃基、吡啶基、苯并呋喃基、苯并噻吩基、喹啉基。
[0026]
r2选自氢、甲基、乙基、正丙基、正丁基、正戊基、正己基。
[0027]
其中所述取代或未取代的具有如本文前述所定义。
[0028]
最优选地,ar
1 ar2彼此独立地为苯基、氯代苯基、甲氧基苯基、甲基苯基。
[0029]
r1选自甲基、乙基、正丙基、正丁基、正戊基、正己基、环丙基、环丁基、环戊基、环己基、苯基、甲基苯基、氯代苯基、溴代苯基、甲氧基苯基、噻吩基。
[0030]
r2选自氢、甲基、乙基、正丙基、正丁基、正戊基、正己基。
[0031]
根据本发明前述的方法,其中,所述的钯催化剂选自pd(pph3)2cl2;所述的氧化剂选自agoac。
[0032]
根据本发明前述的方法,其中,所述的有机溶剂为非质子非极性有机溶剂;所述的非质子非极性有机溶剂选自苯、甲苯、二甲苯、均三甲苯、氯苯、二氯苯、三氟甲基苯、环己烷、二氯乙烷中的任意一种或几种的混合物;最优选为三氟甲基苯或氯苯。
[0033]
根据本发明前述的方法,其中,式1所示的芳胺类化合物、式2所示的1,4-烯炔类化合物、钯催化剂、氧化剂的投料摩尔比为1:(1~3):(0.05~0.2):(0.5~2);优选地,式1所示的芳胺类化合物、式2所示的1,4-烯炔类化合物、钯催化剂、氧化剂的投料摩尔比为1:2:0.1:1。
[0034]
根据本发明前述的方法,其中,所述co气氛压力为1atm。
[0035]
根据本发明前述的方法,其中,所述加热搅拌反应的反应温度为80-120℃,优选为100℃;反应时间为8~24小时,优选为12小时。
[0036]
根据本发明前述的方法,其中,所述的后处理操作如下:
[0037]
反应结束后,将反应混合物冷却至室温,经乙酸乙酯稀释,饱和氯化钠溶液洗涤,乙酸乙酯萃取,合并有机相用无水硫酸钠干燥,真空浓缩,用硅胶闪存柱层析法进行纯化,得到式3所示的目标产物。
[0038]
本发明的方法具有如下有益效果:
[0039]
(1)本发明实现了以芳胺为亲核试剂的钯催化羰基化[5 1]环化反应的策略,为芳胺基酚类化合物的构建提供了一种有效的新途径。
[0040]
(2)本发明通过一锅法构建c-c键、c-n键,原子经济性高,底物范围广,官能团兼容性好,产率中等到良好,同时反应仅需要一个大气压的co就可以高效反应生成芳胺基酚类化合物,是对过渡金属催化co参与的羰基化反应的一个进步。
具体实施方式
[0041]
以下结合具体实施例,对本发明作进一步详述。在下文中,如无特殊说明,所使用的方法均为本领域的常规方法,所使用的原料、试剂均可以由常规商业途径购买获得且未经进一步纯化处理,和/或通过本领域已知方法制备获得。
[0042]
实施例1-20反应条件优化试验
[0043]
以式1a所示的n-甲基苯胺、式2a所示的1,4-烯炔类化合物为模板进行条件筛选,结果如表1所示。
[0044]
反应式如下:
[0045][0046]
表1:
[0047]
[0048][0049]
以实施例9为例,本发明的典型试验操作如下:
[0050]
向10ml封管反应器中,加入n-甲基苯胺1a(0.1mmol)、1,4-烯炔2a(0.2mmol)、pd(pph3)2cl2(10mol%)、agoac(0.1mmol)、phcf3(2ml)。然后将混合物在1atm co气氛下在100℃(油浴温度)下搅拌12小时,直到通过薄层色谱和/或气相色谱-质谱分析监测的起始物质完全消耗完毕。反应结束后,将反应混合物冷却至室温,用乙酸乙酯(10ml)稀释,用饱和氯化钠溶液洗涤,用乙酸乙酯(3x5ml)提取。合并有机相用无水硫酸钠干燥,真空浓缩,用硅胶闪存柱层析法(正己烷/乙酸乙酯=20:1)进行纯化,得到产品3aa,产率80%。黄色油状液体,1h nmr(500mhz,cdcl3)δ7.61
–
7.59(m,2h),7.47-7.44(m,2h),7.37
–
7.29(m,7h),7.18
–
7.14(m,2h),6.95-6.93(m,1h),6.72-6.66(m,3h),5.30(s,1h),2.80(s,3h).
13
c nmr(125mhz,cdcl3)δ150.77,149.35,146.77,137.64,133.89,130.49,129.95,129.24,128.95,128.72,128.55,127.98,127.37,127.32,125.98,120.63,117.16,113.73,39.02。
[0051]
通过对反应条件进行探索获到最优反应条件之后,发明人进一步对1,4-烯炔和芳胺的钯催化羰基化环化反应进行了底物适应性范围的考察,即根据实施例9的最优反应条件,替换原料种类制备获得各种芳胺基酚类化合物,结果如表2所示,反应式如下:
[0052][0053]
表2:
[0054]
[0055]
[0056]
[0057][0058]
产物的结构表征:
[0059]
化合物3ba:1hnmr(500mhz,cdcl3)δ7.51
–
7.49(m,2h),7.36-7.32(m,2h),7.28
–
7.17(m,7h),6.88
–
6.86(m,2h),6.82-6.80(m,1h),6.53-6.50(m,2h),5.20(s,1h),2.67(s,3h),2.15(s,3h).
13
c nmr(125mhz,cdcl3)δ150.70,147.31,147.28,137.72,134.05,130.37,130.00,129.27,129.23,128.94,128.51,127.89,127.24,127.12,126.50,125.60,120.30,114.21,39.10,20.31。
[0060]
化合物3ca:1h nmr(500mhz,cdcl3)δ7.60-7.57(m,2h),7.42-7.38(m,2h),7.30
–
7.15(m,7h),6.85
–
6.83(m,2h),6.79-6.77(m,1h),6.73(t,j=7.5hz,1h),6.53-6.50(m,
1h),5.11(s,1h),3.55(s,3h),2.97(s,3h).
13
c nmr(125mhz,cdcl3)δ153.27,150.21,149.85,139.70,138.29,134.38,130.76,129.63,129.19,128.37,128.26,126.86,126.64,124.48,123.91,122.18,121.69,120.49,112.54,111.16,54.88,40.18。
[0061]
化合物3da:1h nmr(500mhz,cdcl3)δ7.61(t,j=7.0hz,2h),7.47-7.43(m,2h),7.36-7.29(m,7h),7.17-7.12(m,2h),6.92-6.90(m,1h),6.71-6.64(m,3h),5.26(s,1h),3.24-3.18(m,2h),0.97-0.94(m,3h).
13
c nmr(125mhz,cdcl3)δ150.94,148.74,145.67,137.78,134.05,130.35,130.10,129.30,128.93,128.81,128.80,128.54,128.00,127.86,127.32,126.11,121.98,117.02,114.41,45.31,11.98。
[0062]
化合物3ea:1h nmr(500mhz,cdcl3)δ7.56
–
7.53(m,4h),7.46
–
7.41(m,5h),7.32(t,j=7.5hz,1h),7.27-7.24(m,2h),7.21(d,j=8.5hz,1h),7.06(d,j=8.5hz,2h),7.02(d,j=8.5hz,1h),6.95(t,j=8.0hz,1h),5.34(s,1h),5.09(s,1h).
13
c nmr(125mhz,cdcl3)δ150.29,142.51,141.45,137.90,133.02,130.98,129.91,129.89,129.25,129.12,128.65,128.63,126.87,121.72,120.49,119.42,117.33,108.21。
[0063]
化合物3ab:1h nmr(500mhz,cdcl3)δ7.60-7.53(m,2h),7.47
–
7.42(m,2h),7.35
–
7.28(m,6h),7.16
–
7.10(m,2h),6.95
–
6.89(m,1h),6.68(dd,j=25.7,7.0hz,3h),5.29(s,1h),2.80(s,3h).
13
c nmr(125mhz,cdcl3)δ150.79,149.36,146.78,137.66,133.91,131.79,131.73,130.48,129.96,129.24,129.16,128.93,128.90,128.81,128.71,128.54,127.96,127.39,127.31,126.00,120.63,117.17,113.84,113.75,39.02。
[0064]
化合物3ac:1h nmr(500mhz,cdcl3)δ7.59(d,j=8.0hz,2h),7.43(d,j=7.5hz,2h),7.32(d,j=8.5hz,1h),7.26(d,j=8.0hz,1h),7.22(d,j=6.5hz,2h),7.16
–
7.13(m,2h),6.90(d,j=8.5hz,1h),6.87(d,j=8.5hz,2h),6.70(t,j=7.0hz,1h),6.66(d,j=8.0hz,2h),5.33(s,1h),3.74(s,3h),2.79(s,3h).
13
c nmr(125mhz,cdcl3)δ159.23,150.98,149.38,146.82,137.76,131.13,130.21,129.21,128.71,128.44,127.20,127.05,125.88,125.62,120.59,117.04,114.44,113.57,55.08,38.86。
[0065]
化合物3ad:1h nmr(500mhz,cdcl3)δ7.56(d,j=8.0hz,2h),7.47(t,j=7.5hz,2h),7.39
–
7.34(m,2h),7.30-7.28(m,1h),7.25
–
7.22(m,2h),7.18
–
7.14(m,3h),6.95-6.92(m,1h),6.72(t,j=7.5hz,1h),6.67
–
6.64(m,2h),5.25(s,1h),2.86(s,3h).
13
c nmr(125mhz,cdcl3)δ150.60,149.21,147.07,137.12,136.17,134.21,130.75,130.14,129.85,129.16,128.90,128.76,128.21,127.82,127.67,126.04,126.00,120.54,117.58,114.12,39.32。
[0066]
化合物3ae:1h nmr(500mhz,cdcl3)δ7.54-7.52(m,2h),7.38-7.35(m,2h),7.28
–
7.25(m,1h),7.22(d,j=8.0hz,1h),7.15(t,j=3.0hz,1h),7.09
–
7.06(m,2h),7.04
–
7.01(m,3h),6.85(d,j=8.0hz,1h),6.62(t,j=7.0hz,1h),6.58
–
6.56(m,2h),5.24(s,1h),2.74(s,3h),2.20(s,3h).
13
c nmr(125mhz,cdcl3)δ150.82,149.51,146.78,138.61,137.80,133.68,130.53,130.41,129.27,128.94,128.80,128.67,128.45,127.53,127.23,126.98,125.94,120.65,117.13,113.81,39.13,21.39。
[0067]
化合物3af:1h nmr(500mhz,cdcl3)δ7.60
–
7.59(m,2h),7.45(t,j=8.0hz,2h),7.36-7.33(m,3h),7.31
–
7.29(m,3h),7.16
–
7.13(m,2h),6.93(d,j=8.5hz,1h),6.70(t,j=7.0hz,1h),6.66
–
6.64(m,2h),5.27(s,1h),2.81(s,3h).
13
c nmr(125mhz,cdcl3)δ
150.86,149.45,146.86,137.73,133.99,130.52,130.02,129.28,128.94,128.73,128.56,127.98,127.49,127.34,126.09,120.65,117.23,113.84,39.08。
[0068]
化合物3ag:1h nmr(500mhz,cdcl3)δ7.61(d,j=7.0hz,2h),7.44(t,j=7.5hz,2h),7.35-7.32(m,2h),7.25-7.20(m,2h),7.15
–
7.11(m,4h),6.96(d,j=8.5hz,1h),6.70(t,j=7.5hz,1h),6.66(d,j=8.0hz,2h),5.02(s,1h),2.83(s,3h),2.20(s,3h).
13
c nmr(125mhz,cdcl3)δ150.86,149.42,147.21,137.81,137.56,133.03,131.01,130.54,130.40,129.26,128.61,128.50,128.41,127.23,126.65,126.30,125.48,120.23,117.57,114.48,39.17,19.75。
[0069]
化合物3ah:1h nmr(500mhz,cdcl3)δ7.59(d,j=8.0hz,2h),7.46(t,j=6.5hz,2h),7.38
–
7.35(m,2h),7.31-7.30(m,1h),7.18
–
7.14(m,3h),7.04-7.02(m,1h),6.93-6.91(m,1h),6.75
–
6.71(m,1h),6.68(d,j=7.5hz,2h),5.73(s,1h),2.96(s,3h).
13
c nmr(125mhz,cdcl3)δ151.35,149.18,147.45,137.47,134.07,131.19,129.24,128.73,128.56,128.18,127.59,127.43,127.04,126.07,120.62,120.00,117.52,114.07,39.21。
[0070]
化合物3ai:1h nmr(500mhz,cdcl3)δ7.53-7.48(m,4h),7.43-7.40(m,1h),7.19(t,j=8.5hz,2h),7.11(d,j=8.0hz,1h),6.76(d,j=8.0hz,1h),6.72(t,j=7.0hz,1h),6.61(d,j=8.0hz,2h),5.34(s,1h),3.24(s,3h),2.60
–
2.56(m,2h),1.54(t,j=7.0hz,2h),1.27(t,j=4.0hz,4h),0.83(t,j=6.5hz,3h).
13
c nmr(125mhz,cdcl3)δ151.65,149.71,147.69,137.24,129.41,129.17,128.94,128.80,128.37,127.90,126.13,120.43,116.79,113.10,40.00,32.25,29.01,25.93,22.41,13.97。
[0071]
化合物3aj:1h nmr(500mhz,cdcl3)δ7.55(d,j=8.5hz,2h),7.41-7.36(m,4h),7.33-7.27(m,4h),7.15(t,j=7.5hz,2h),6.94-6.93(m,1h),6.71(t,j=7.0hz,1h),6.65(d,j=8.0hz,2h),5.26(s,1h),2.80(s,3h).
13
c nmr(125mhz,cdcl3)δ150.75,149.27,147.01,136.25,133.45,133.08,130.60,130.44,129.94,129.24,128.74,128.50,128.27,127.42,124.71,120.71,117.35,113.88,39.06。
[0072]
化合物3ak:1h nmr(500mhz,cdcl3)δ7.53
–
7.51(m,2h),7.35
–
7.26(m,6h),7.15
–
7.12(m,2h),7.00
–
6.97(m,2h),6.91(d,j=8.0hz,1h),6.69(t,j=7.5hz,1h),6.64(d,j=7.5hz,2h),5.25(s,1h),3.83(s,3h),2.80(s,3h).
13
c nmr(125mhz,cdcl3)δ159.01,150.83,149.48,146.45,134.10,130.39,130.33,130.00,129.95,128.87,128.71,127.90,127.46,125.79,120.62,117.12,114.09,113.73,55.28,39.06。
[0073]
化合物3al:1h nmr(500mhz,cdcl3)δ7.64(t,j=2.0hz,1h),7.51-7.49(m,1h),7.40
–
7.29(m,8h),7.17
–
7.14(m,2h),6.94(d,j=8.5hz,1h),6.72(t,j=7.5hz,1h),6.67
–
6.65(m,2h),5.30(s,1h),2.81(s,3h).
13
c nmr(125mhz,cdcl3)δ150.80,149.26,147.22,139.64,134.15,133.40,130.51,129.95,129.54,129.46,129.26,128.75,128.30,127.42,127.38,127.19,124.51,120.70,117.40,113.94,39.08。
[0074]
化合物3am:1h nmr(500mhz,cdcl3)δ7.51(d,j=7.0hz,1h),7.44-7.42(m,1h),7.38-7.28(m,7h),7.20-7.15(m,3h),6.95-6.93(m,1h),6.72(t,j=7.5hz,1h),6.71
–
6.67(m,2h),5.13(s,1h),2.81(s,3h).
13
c nmr(125mhz,cdcl3)δ151.06,149.35,147.18,136.65,133.94,133.68,131.92,130.84,129.94,129.72,129.04,128.99,128.75,128.04,127.07,126.74,123.84,120.17,117.24,113.81,39.03。
[0075]
化合物3an:1hnmr(500mhz,cdcl3)δ7.39
–
7.28(m,6h),7.25-7.23(m,2h),7.17
–
7.13(m,2h),7.11-7.07(m,1h),7.01(d,j=8.0hz,1h),6.94(d,j=8.5hz,1h),6.71-6.68(m,3h),6.15(s,1h),3.85(s,3h),2.77(s,3h).
13
c nmr(125mhz,cdcl3)δ155.65,151.97,149.38,147.14,135.23,132.39,131.06,130.01,129.17,128.66,128.56,128.04,127.14,126.86,123.94,121.75,120.71,116.93,113.61,111.22,55.90,38.85。
[0076]
以上所述实施例仅为本发明的优选实施例,而并非本发明可行实施的穷举。对于本领域技术人员而言,在不背离本发明原理和精神的前提下,对其所作出的任何显而易见的改动,都应当被认为包含在本发明的权利要求保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。