用于减少特应性皮炎瘙痒的鲁索替尼制剂
1.相关申请的交叉引用
2.本技术要求2019年9月5日提交的美国临时申请号62/896,421、2019年9月6日提交的美国临时申请号62/897,059、2019年9月11日提交的美国临时申请号62/898,873、2020年2月28日提交的美国临时申请号62/983,252和2020年5月6日提交的美国临时申请号63/020,668的优先权,所述申请各自以引用的方式整体并入本文。
技术领域
3.本公开涉及通过每天两次施用局部鲁索替尼乳膏(包括0.75%或1.5%鲁索替尼乳膏)来减少特应性皮炎患者的瘙痒和治疗特应性皮炎患者的方法。
背景技术:
4.特应性皮炎影响大约10%的成年人(silverbergji,hanifinjm.jallergyclinimmunol2013;132:1132-1138),发病率正在增加,而且仅直接医疗费用每年就花费38亿美元(elliscn,等人jamacaddermatol2002;46:361-370)。根据最近的全球疾病负担项目(globalburdenofdiseaseproject),遍及世界的特应性皮炎(“ad”)是50种最流行的疾病之一,并且在所有非恶性皮肤病中,它的残疾等级第二高(hayrj,等人jinvestdermatol2014;134:1527-1534)。尽管对于银屑病的靶向治疗和众多生物治疗取得了进展,但目前对于ad仅有一种这样的疗法
5.ad的主要特征和诊断标准之一是痒(瘙痒)。瘙痒带来抓挠,继而进一步损伤ad皮肤,加重病情,并可能导致继发感染。此外,夜间瘙痒和搔抓会导致患者及其直系亲属(例如,患有ad的儿童的父母)的睡眠不足和生活质量受损。
6.ad的局部疗法仅限于局部类固醇、局部钙调神经磷酸酶抑制剂和最近的pde4抑制剂这些药物具有与其功效水平、安全性(特别是长期使用)或耐受性问题相关的所有限制。局部类固醇使用还可能与不可逆的副作用相关联,诸如皮肤萎缩或膨胀纹。全身性糖皮质激素和钙调神经磷酸酶抑制剂的使用也由于它们的不良事件(ae)特征而受到限制。如果目前的局部疗法失败,则偶尔会采用全身性免疫抑制剂(例如,环孢霉素、甲氨蝶呤),但功效差异很大和/或ae风险很高。
7.重要的是,目前可用的药物都没有对缓解瘙痒发挥直接作用。因此,需要新的方法来迅速且有效地控制ad患者的瘙痒。如所提及的,瘙痒是ad的主要特征,并且是在这种情况下直接导致高疾病(生活质量)负担的症状。本公开解决了这种需要和其他需要。
技术实现要素:
8.本公开尤其提供了使用鲁索替尼减少患有特应性皮炎的人类患者的瘙痒或治疗患有特应性皮炎的人类患者的方法。鲁索替尼是一种有效的jak1/jak2抑制剂,(r)-3-(4-(7h-吡咯并[2,3-d]嘧啶-4-基)-1h-吡唑-1-基)-3-环戊基丙腈(incb018424;鲁索替尼;
中的活性成分)及其药学上可接受的盐,先前已在美国专利号7,598,257中进行了描述,所述专利以引用的方式整体并入本文。磷酸鲁索替尼先前在美国专利公开号2008/0312259中有所描述,所述专利以引用的方式整体并入本文。
[0009][0010]
例如,提供了用于治疗人类患者的特应性皮炎的方法,所述方法包括向有需要的人类患者的皮肤施用包含鲁索替尼或其药学上可接受的盐的乳膏制剂。在其他实例中,提供了减少患有特应性皮炎的人类患者的瘙痒的方法,所述方法包括向有需要的人类患者的皮肤施用包含鲁索替尼或其药学上可接受的盐的乳膏制剂,其中所述患者达到瘙痒数值评定量表得分相对于基线降低。
[0011]
本公开还提供了减少患有特应性皮炎的人类患者的瘙痒的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂包含基于游离碱1.5%(重量/重量)的鲁索替尼或其药学上可接受的盐,
[0012]
其中所述患者达到瘙痒数值评定量表得分相对于基线降低。
[0013]
本公开还提供了减少患有特应性皮炎的人类患者的瘙痒的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂包含基于游离碱0.75%(重量/重量)的鲁索替尼或其药学上可接受的盐,
[0014]
其中所述患者达到瘙痒数值评定量表得分相对于基线降低。
[0015]
本公开还提供了减少患有特应性皮炎的人类患者的瘙痒的方法,其包括每天两次(bid)向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂包含基于游离碱1.5%(重量/重量)的磷酸鲁索替尼,
[0016]
其中所述患者达到瘙痒数值评定量表得分相对于基线降低。
[0017]
本公开还提供了减少患有特应性皮炎的人类患者的瘙痒的方法,其包括每天两次(bid)向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂包含基于游离碱0.75%(重量/重量)的磷酸鲁索替尼,
[0018]
其中所述患者达到瘙痒数值评定量表得分相对于基线降低。
[0019]
本公开还提供了减少患有特应性皮炎的人类患者的瘙痒的方法,其包括每天两次(bid)向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂包含基于游离碱0.75%(重量/重量)的磷酸鲁索替尼,
[0020]
其中所述患者达到瘙痒数值评定量表得分相对于基线降低。
[0021]
本公开还提供了治疗人类患者的特应性皮炎的方法,其包括每天两次向所述有需
要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂包含基于游离碱0.75%(重量/重量)的鲁索替尼或其药学上可接受的盐。
[0022]
本公开还提供了治疗人类患者的特应性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂包含基于游离碱0.75%(重量/重量)的磷酸鲁索替尼。本公开还提供了减少患有特应性皮炎的人类患者的瘙痒的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂是水包油乳剂,其包含基于游离碱1.5%(重量/重量)的磷酸鲁索替尼,
[0023]
其中所述施用维持至少8周(例如像12周),
[0024]
其中所述患者在施用的第8周达到瘙痒数值评定量表得分相对于基线降低至少4分。
[0025]
本公开还提供了减少患有特应性皮炎的人类患者的瘙痒的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂是水包油乳剂,其包含基于游离碱0.75%(重量/重量) 的磷酸鲁索替尼,
[0026]
其中所述施用维持至少8周(例如像12周),
[0027]
其中所述患者在施用的第8周达到瘙痒数值评定量表得分相对于基线降低至少4分。
[0028]
本公开还提供了减少患有特应性皮炎的人类患者的瘙痒的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂是水包油乳剂,其包含基于游离碱1.5%(重量/重量)的磷酸鲁索替尼,
[0029]
其中所述施用维持至少8周,
[0030]
其中所述患者在所述施用的第8周达到瘙痒数值评定量表得分相对于基线降低至少4分,并且
[0031]
其中所述患者:
[0032]
年龄在18至70岁之间,
[0033]
已被诊断患有特应性皮炎至少2年,
[0034]
在筛选和基线时的研究者总体评估得分为2至3,并且
[0035]
在基线时的特应性皮炎受累的体表面积(不包括面部和间擦区域) 为3%至20%。
[0036]
本公开还提供了减少患有特应性皮炎的人类患者的瘙痒的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂是水包油乳剂,其包含基于游离碱0.75%(重量/重量) 或1.5%(重量/重量)的磷酸鲁索替尼,
[0037]
其中所述施用维持至少8周,
[0038]
其中所述患者在所述施用的第8周达到瘙痒数值评定量表得分相对于基线降低至少4分,并且
[0039]
其中所述患者:
[0040]
是年龄≥12至17岁(含端值)的青少年,或年龄≥18岁的男性或女性;
[0041]
具有至少2年的ad病史;
[0042]
在基线时的研究者总体评估得分为2至3;并且
[0043]
在基线时的ad受累的%bsa(不包括头皮)为3%至20%。
[0044]
本公开还提供了减少患有特应性皮炎的人类患者的瘙痒的方法,其包括每天两次
向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂是水包油乳剂,其包含基于游离碱1.5%(重量/重量)的磷酸鲁索替尼,
[0045]
其中所述施用维持至少8周,
[0046]
其中所述患者在所述施用的第8周达到瘙痒数值评定量表得分相对于基线降低至少4分,并且
[0047]
其中所述患者在所述施用的第8周达到研究者总体评估得分为0 或1且相对于基线改善至少2分。
[0048]
本公开还提供了减少患有特应性皮炎的人类患者的瘙痒的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂是水包油乳剂,其包含基于游离碱0.75%(重量/重量) 的磷酸鲁索替尼,
[0049]
其中所述施用维持至少8周,
[0050]
其中所述患者在所述施用的第8周达到瘙痒数值评定量表得分相对于基线降低至少4分,并且
[0051]
其中所述患者在所述施用的第8周达到研究者总体评估得分为0 或1且相对于基线改善至少2分。
[0052]
本公开还提供了减少患有特应性皮炎的人类患者的瘙痒的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂是水包油乳剂,其包含基于游离碱1.5%(重量/重量)的磷酸鲁索替尼,
[0053]
其中所述施用维持至少8周,
[0054]
其中所述患者在所述施用的第8周达到瘙痒数值评定量表得分相对于基线降低至少4分,
[0055]
其中所述患者在所述施用的第8周达到研究者总体评估得分为0 或1且相对于基线改善至少2分,并且
[0056]
其中所述患者:
[0057]
年龄在18至70岁之间,
[0058]
已被诊断患有特应性皮炎至少2年,
[0059]
在筛选和基线时的研究者总体评估得分为2至3,并且
[0060]
在基线时的特应性皮炎受累的体表面积(不包括面部和间擦区域) 为3%至20%。
[0061]
本公开还提供了减少患有特应性皮炎的人类患者的瘙痒的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂是水包油乳剂,其包含基于游离碱0.75%(重量/重量) 或1.5%(重量/重量)的磷酸鲁索替尼,
[0062]
其中所述施用维持至少8周,
[0063]
其中所述患者在所述施用的第8周达到瘙痒数值评定量表得分相对于基线降低至少4分,
[0064]
其中所述患者在所述施用的第8周达到研究者总体评估得分为0 或1且相对于基线改善至少2分,并且
[0065]
其中所述患者:
[0066]
是年龄≥12至17岁(含端值)的青少年,或年龄≥18岁的男性或女性;
[0067]
具有至少2年的ad病史;
[0068]
在基线时的研究者总体评估得分为2至3;并且
[0069]
在基线时的ad受累的%bsa(不包括头皮)为3%至20%。
[0070]
本公开还提供了治疗人类患者的中度特应性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用局部制剂,其中所述局部制剂包含基于游离碱0.75%(重量/重量)或1.5%(重量/重量)的鲁索替尼或其药学上可接受的盐。
[0071]
本公开还提供了治疗人类患者的中度至重度特应性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用局部制剂,其中所述局部制剂包含基于游离碱0.75%(重量/重量)或1.5%(重量/重量) 的鲁索替尼或其药学上可接受的盐。
[0072]
本公开还提供了治疗人类患者的特应性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用局部制剂,其中所述局部制剂包含基于游离碱0.75%(重量/重量)或1.5%(重量/重量)的鲁索替尼或其药学上可接受的盐,
[0073]
其中所述患者:在基线时的湿疹面积和严重程度指数得分≥16;并且
[0074]
在基线时的特应性皮炎受累的体表面积≥10%。
[0075]
本公开还提供了一种局部制剂(例如,乳膏制剂),其包含基于游离碱0.75%(重量/重量)的鲁索替尼或其药学上可接受的盐,所述局部制剂用于本文所述的任一方法中。
[0076]
本公开还提供了一种局部制剂(例如,乳膏制剂),其包含基于游离碱1.5%(重量/重量)的鲁索替尼或其药学上可接受的盐,所述局部制剂用于本文所述的任一方法中。
[0077]
本公开还提供了局部制剂(例如,乳膏制剂)用于制造用于本文所述的任一方法中的药物的用途,所述局部制剂包含基于游离碱0.75% (重量/重量)的鲁索替尼或其药学上可接受的盐。
[0078]
本公开还提供了局部制剂(例如,乳膏制剂)用于制造用于本文所述的任一方法中的药物的用途,所述局部制剂包含基于游离碱1.5% (重量/重量)的鲁索替尼或其药学上可接受的盐。
附图说明
[0079]
附图中的“rux”是磷酸鲁索替尼。附图中的tac是曲安西龙 (triamcinolone)。
[0080]
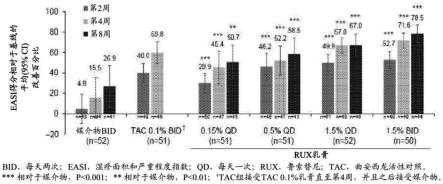
图1示出了媒介物(bid)、曲安西龙(0.1%bid)和鲁索替尼乳膏 (0.15%qd、0.5%qd、1.5%qd和1.5%bid)在第2周(每组的第一个图表条)、第4周(每组的第二个图表条)和第8周(每组的第三个图表条)的easi得分相对于基线改善的平均百分比的图。0.1%tac未示出条,因为tac仅施用4周。
[0081]
图2示出了媒介物(bid)、曲安西龙(0.1%bid)和鲁索替尼乳膏 (1.5%bid)在第2周(每组的第一个图表条)、第4周(每组的第二个图表条)和第8周(每组的第三个图表条)的easi得分相对于基线改善的平均百分比的图。0.1%tac未示出条,因为tac仅施用4周。
[0082]
图3示出了媒介物(bid)、曲安西龙(0.1%bid)和鲁索替尼乳膏 (0.15%qd、0.5%qd、1.5%qd和1.5%bid)在第2周(每组的第一个图表条)、第4周(每组的第二个图表条)和第8周(每组的第三个图表条)的easi-75应答者的百分比(easi相对于基线改善至少75%)的图。0.1%tac未示出条,因为tac仅施用4周。
[0083]
图4示出了媒介物(bid)、曲安西龙(0.1%bid)和鲁索替尼乳膏 (0.15%qd、0.5%qd、1.5%qd和1.5%bid)在第2周(每组的第一个图表条)、第4周(每组的第二个图表条)和
第8周(每组的第三个图表条)的iga应答的比例(应答者是达到iga得分为0-1且相对于基线改善≥2分的患者)的图。0.1%tac未示出条,因为tac仅施用4周。
[0084]
图5示出了媒介物、曲安西龙和鲁索替尼乳膏在12周内的easi 得分相对于基线改善的平均百分比的图。开放标签期为第8周至第 12周,其中施用1.5%鲁索替尼乳膏。
[0085]
图6示出了媒介物、曲安西龙和鲁索替尼乳膏在12周内的iga 应答的比例的图。开放标签期为第8周至第12周,其中施用1.5%鲁索替尼乳膏。
[0086]
图7示出了媒介物(bid)、曲安西龙(0.1%bid)和鲁索替尼乳膏(0.15%qd、0.5%qd、1.5%qd和1.5%bid)在28天内的每日瘙痒 nrs得分(nrs得分范围为0-10,其中0是没有瘙痒,并且10是最严重的瘙痒)相对于基线的平均变化的图。
[0087]
图8示出了媒介物(bid)、曲安西龙(0.1%bid)和鲁索替尼乳膏 (1.5%bid)在28天内的每日瘙痒nrs得分相对于基线的平均变化的图。
[0088]
图9示出了媒介物、曲安西龙和鲁索替尼乳膏在12周内的平均瘙痒nrs得分的图。开放标签期为第8周至第12周,其中施用1.5%鲁索替尼乳膏。
[0089]
图10示出了媒介物(bid)、曲安西龙(0.1%bid)和鲁索替尼乳膏 (0.15%qd、0.5%qd、1.5%qd和1.5%bid)在第2周(每组的第一个图表条)、第4周(每组的第二个图表条)和第8周(每组的第三个图表条)的skindex-16总体得分相对于基线改善的平均百分比的图。 0.1%tac未示出条,因为tac仅施用4周。**表示相对于媒介物 p《0.01;***表示相对于媒介物p《0.001。表示tac组接受0.1%tac 乳膏直至第4周并且之后接受媒介物。
[0090]
图11描绘了媒介物、0.75%bid鲁索替尼乳膏和1.5%bid鲁索替尼乳膏(每组的第一个条是媒介物;每组的第二个条是0.75%bid 鲁索替尼乳膏;并且每组的第三个条是1.5%鲁索替尼乳膏)的 true-ad1(研究303)(实心条)和true-ad2(研究304)(条纹条)在第 2周、第4周和第8周的媒介物对照期达到iga-ts的参与者的比例。
[0091]
图12描绘了媒介物、0.75%bid鲁索替尼乳膏和1.5%bid鲁索替尼乳膏(每组的第一个条是媒介物;每组的第二个条是0.75%bid 鲁索替尼乳膏;并且每组的第三个条是1.5%鲁索替尼乳膏)的 true-ad1(研究303)(实心条)和true-ad2(研究304)(条纹条)在第 2周、第4周和第8周的媒介物对照期达到easi75的参与者的比例。
[0092]
图13描绘了对于基线瘙痒nrs≥4的患者的媒介物、0.75%bid 鲁索替尼乳膏和1.5%bid鲁索替尼乳膏(每组的第一个条是媒介物;每组的第二个条是0.75%bid鲁索替尼乳膏;并且每组的第三个条是 1.5%鲁索替尼乳膏)的true-ad1(研究303)(实心条)和true-ad2 (研究304)(条纹条)在第2周、第4周和第8周的媒介物对照期达到瘙痒nrs得分改善≥4分的参与者的比例。
[0093]
图14描绘了对于基线瘙痒nrs≥4的患者的媒介物(上线)、 0.75%bid鲁索替尼乳膏(中线)和1.5%bid鲁索替尼乳膏(下线)的 true-ad1(研究303)从第1天至第28天的每日瘙痒nrs得分相对于基线的平均变化。
[0094]
图15描绘了对于基线瘙痒nrs≥4的患者的媒介物(上线)、 0.75%bid鲁索替尼乳膏(中线)和1.5%bid鲁索替尼乳膏(下线)的 true-ad2(研究304)从第1天至第28天的每日瘙痒nrs得分相对于基线的平均变化。
[0095]
图16描绘了媒介物、0.75%bid鲁索替尼乳膏和1.5%bid鲁索替尼乳膏(每组的第一个条是媒介物;每组的第二个条是0.75%bid 鲁索替尼乳膏;并且每组的第三个条是
1.5%鲁索替尼乳膏)的 true-ad1(研究303)(实心条)和true-ad2(研究304)(条纹条)在第 2周、第4周和第8周的媒介物对照期达到promis睡眠障碍得分(8b) 改善≥6分的参与者的比例。
[0096]
图17描绘了媒介物、0.75%bid鲁索替尼乳膏和1.5%bid鲁索替尼乳膏(每组的第一个条是媒介物;每组的第二个条是0.75%bid 鲁索替尼乳膏;并且每组的第三个条是1.5%鲁索替尼乳膏)的 true-ad1(研究303)(实心条)和true-ad2(研究304)(条纹条)在第 2周、第4周和第8周的媒介物对照期达到promis睡眠损害得分(8a) 改善≥6分的参与者的比例。
[0097]
图18示出了媒介物、0.75%bid鲁索替尼乳膏和1.5%bid鲁索替尼乳膏(每组的第一个条是媒介物;每组的第二个条是0.75%bid 鲁索替尼乳膏;并且每组的第三个条是1.5%鲁索替尼乳膏)的 true-ad1(研究303)在第2周、第4周和第8周的媒介物对照期中血红蛋白相对于基线的变化(g/l)的盒须图。
[0098]
图19示出了媒介物、0.75%bid鲁索替尼乳膏和1.5%bid鲁索替尼乳膏(每组的第一个条是媒介物;每组的第二个条是0.75%bid 鲁索替尼乳膏;并且每组的第三个条是1.5%鲁索替尼乳膏)的 true-ad1(研究303)在第2周、第4周和第8周的媒介物对照期中血小板相对于基线的变化(109/l)的盒须图。
[0099]
图20示出了媒介物、0.75%bid鲁索替尼乳膏和1.5%bid鲁索替尼乳膏(每组的第一个条是媒介物;每组的第二个条是0.75%bid 鲁索替尼乳膏;并且每组的第三个条是1.5%鲁索替尼乳膏)的 true-ad2(研究304)在第2周、第4周和第8周的媒介物对照期中血红蛋白相对于基线的变化(g/l)的盒须图。
[0100]
图21示出了媒介物、0.75%bid鲁索替尼乳膏和1.5%bid鲁索替尼乳膏(每组的第一个条是媒介物;每组的第二个条是0.75%bid 鲁索替尼乳膏;并且每组的第三个条是1.5%鲁索替尼乳膏)的 true-ad2(研究304)在第2周、第4周和第8周的媒介物对照期中血小板相对于基线的变化(109/l)的盒须图。
[0101]
图22描绘了对于基线时的特应性皮炎受累的体表面积≥10%且基线时的湿疹面积和严重程度指数得分≥16的患者的媒介物、0.75% bid鲁索替尼乳膏和1.5%bid鲁索替尼乳膏(每组的第一个条是媒介物;每组的第二个条是0.75%bid鲁索替尼乳膏;并且每组的第三个条是1.5%鲁索替尼乳膏)在true-ad1(研究303)和true-ad2(研究 304)两者中在第2周、第4周和第8周的媒介物对照期达到iga-ts 的参与者的比例。
[0102]
图23描绘了对于基线时的特应性皮炎受累的体表面积≥10%且基线时的湿疹面积和严重程度指数得分≥16的患者的媒介物、0.75% bid鲁索替尼乳膏和1.5%bid鲁索替尼乳膏(每组的第一个条是媒介物;每组的第二个条是0.75%bid鲁索替尼乳膏;并且每组的第三个条是1.5%鲁索替尼乳膏)在true-ad1(研究303)和true-ad2(研究304)两者中在第2周、第4周和第8周的媒介物对照期达到easi-75 的参与者的比例。
[0103]
图24描绘了对于基线时的特应性皮炎受累的体表面积≥10%、基线时的湿疹面积和严重程度指数得分≥16且基线时的瘙痒数值评定量表得分≥4的患者对于基线瘙痒nrs≥4的患者的媒介物、0.75% bid鲁索替尼乳膏和1.5%bid鲁索替尼乳膏(每组的第一个条是媒介物;每组的第二个条是0.75%bid鲁索替尼乳膏;并且每组的第三个条是1.5%鲁索替尼乳膏)在true-ad1(研究303)和true-ad2(研究 304)两者中在第2周、第4周和第8周的
媒介物对照期达到瘙痒nrs 得分改善≥4分的参与者的比例。
[0104]
图25描绘了合并的true-ad1(研究303)和true-ad2(研究304) 研究(上线(媒介物)、中线(0.75%bid鲁索替尼乳膏)和下线(1.5%bid 鲁索替尼乳膏))的从第1天至第28天(基线瘙痒nrs得分≥4的患者) 的每日瘙痒nrs得分相对于基线的平均变化。
[0105]
图26描绘了合并的true-ad1(研究303)和true-ad2(研究 304)研究(第一个条(媒介物)、第二个条(0.75%bid鲁索替尼乳膏)和第三个条(1.5%bid鲁索替尼乳膏)的从第1天至第7天(基线瘙痒 nrs得分≥4的患者)达到瘙痒nrs得分改善瘙痒nrs得分≥4分的患者的比例。
[0106]
图27描绘了媒介物、0.75%bid鲁索替尼乳膏和1.5%bid鲁索替尼乳膏(每组的第一个条是媒介物;每组的第二个条是0.75%bid 鲁索替尼乳膏;并且每组的第三个条是1.5%鲁索替尼乳膏)的合并的 true-ad1(研究303)和true-ad2(研究304)研究在第2周、第4周和第8周的媒介物对照期达到iga-ts的参与者的比例。
[0107]
图28描绘了媒介物、0.75%bid鲁索替尼乳膏和1.5%bid鲁索替尼乳膏(每组的第一个条是媒介物;每组的第二个条是0.75%bid 鲁索替尼乳膏;并且每组的第三个条是1.5%鲁索替尼乳膏)的合并的true-ad1(研究303)和true-ad2(研究304)在第2周、第4周和第 8周的媒介物对照期达到easi-75的参与者的比例。
[0108]
图29描绘了对于基线时的promis睡眠障碍得分(8b)≥6的患者的媒介物、0.75%bid鲁索替尼乳膏和1.5%bid鲁索替尼乳膏(每组的第一个条是媒介物;每组的第二个条是0.75%bid鲁索替尼乳膏;并且每组的第三个条是1.5%鲁索替尼乳膏)的合并的true-ad1(研究303)和true-ad2(研究304)在第2周、第4周和第8周的媒介物对照期达到promis睡眠障碍得分(8b)改善≥6分的参与者的比例。
[0109]
图30描绘了对于基线时的promis睡眠相关损害(8a)≥6的患者的媒介物、0.75%bid鲁索替尼乳膏和1.5%bid鲁索替尼乳膏(每组的第一个条是媒介物;每组的第二个条是0.75%bid鲁索替尼乳膏;并且每组的第三个条是1.5%鲁索替尼乳膏)的合并的true-ad1(研究303)和true-ad2(研究304)在第2周、第4周和第8周的媒介物对照期达到promis睡眠相关损害(8a)改善≥6分的参与者的比例。
[0110]
图31示出了合并的true-ad1(研究303)和true-ad2(研究304) (上线(媒介物)、中线(0.75%bid鲁索替尼乳膏)和下线(1.5%bid鲁索替尼乳膏))在基线、第2周、第4周和第8周的媒介物对照期的easi 得分的平均值的图。
[0111]
图32示出了合并的true-ad1(研究303)和true-ad2(研究304) (上线(媒介物)、中线(1.5%bid鲁索替尼乳膏)和下线(0.75%bid鲁索替尼乳膏))在基线、第2周、第4周和第8周的媒介物对照期的easi 得分相对于基线的平均得分变化的图。
[0112]
图33示出了合并的true-ad1(研究303)和true-ad2(研究304) (上线(媒介物)、中线(1.5%bid鲁索替尼乳膏)和下线(0.75%bid鲁索替尼乳膏))在基线、第2周、第4周和第8周的媒介物对照期的easi 得分相对于基线的平均变化百分比的图。
具体实施方式
[0113]
本公开尤其提供了一种减少患有特应性皮炎的人类患者的瘙痒的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂包含基于游离碱
1.5%(重量/重量)的鲁索替尼或其药学上可接受的盐,
[0114]
其中所述患者达到瘙痒数值评定量表得分相对于基线降低。
[0115]
本公开还提供了一种减少患有特应性皮炎的人类患者的瘙痒的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂包含基于游离碱0.75%(重量/重量)的鲁索替尼或其药学上可接受的盐,
[0116]
其中所述患者达到瘙痒数值评定量表得分相对于基线降低。
[0117]
本公开还提供了一种减少患有特应性皮炎的人类患者的瘙痒的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂包含基于游离碱1.5%(重量/重量)的磷酸鲁索替尼,
[0118]
其中所述患者达到瘙痒数值评定量表得分相对于基线降低。
[0119]
本公开还提供了一种减少患有特应性皮炎的人类患者的瘙痒的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂包含基于游离碱0.75%(重量/重量)的磷酸鲁索替尼,
[0120]
其中所述患者达到瘙痒数值评定量表得分相对于基线降低。
[0121]
在一些实施方案中,所述方法提供了患者的瘙痒迅速减少。
[0122]
本公开还提供了一种治疗人类患者的特应性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂包含基于游离碱0.75%(重量/重量)或1.5%(重量/重量)的鲁索替尼或其药学上可接受的盐。
[0123]
本公开还提供了治疗人类患者的特应性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂包含基于游离碱1.5%(重量/重量)的鲁索替尼或其药学上可接受的盐。
[0124]
本公开还提供了治疗人类患者的特应性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂包含基于游离碱1.5%(重量/重量)的磷酸鲁索替尼。
[0125]
本公开还提供了一种治疗人类患者的特应性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂包含基于游离碱0.75%(重量/重量)的鲁索替尼或其药学上可接受的盐。
[0126]
本公开还提供了一种治疗人类患者的特应性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂包含基于游离碱0.75%(重量/重量)的磷酸鲁索替尼。
[0127]
在一些实施方案中,鲁索替尼或其药学上可接受的盐是磷酸鲁索替尼。
[0128]
在一些实施方案中,患者达到研究者总体评估得分为0或1且相对于基线改善至少2分。
[0129]
在一些实施方案中,患者达到湿疹面积和严重程度指数得分相对于基线改善75%。
[0130]
本公开还提供了一种治疗人类患者的轻度至中度特应性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用局部制剂,其中所述局部制剂包含基于游离碱0.75%(重量/重量)或1.5%(重量/重量)的鲁索替尼或其药学上可接受的盐。
[0131]
本公开还提供了一种治疗人类患者的轻度至中度特应性皮炎的方法,其包括每天
两次向所述有需要的人类患者的皮肤施用局部制剂,其中所述局部制剂包含基于游离碱0.75%(重量/重量)的鲁索替尼或其药学上可接受的盐。
[0132]
本公开还提供了一种治疗人类患者的轻度至中度特应性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用局部制剂,其中所述局部制剂包含基于游离碱1.5%(重量/重量)的鲁索替尼或其药学上可接受的盐。
[0133]
本公开还提供了一种治疗人类患者的轻度至中度特应性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用局部制剂,其中所述局部制剂包含基于游离碱0.75%(重量/重量)的磷酸鲁索替尼。
[0134]
本公开还提供了一种治疗人类患者的轻度至中度特应性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用局部制剂,其中所述局部制剂包含基于游离碱1.5%(重量/重量)的磷酸鲁索替尼。
[0135]
本公开还提供了一种治疗人类患者的轻度至中度特应性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂包含基于游离碱0.75%(重量/重量)或1.5%(重量/重量)的鲁索替尼或其药学上可接受的盐。
[0136]
本公开还提供了一种治疗人类患者的轻度至中度特应性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂包含基于游离碱0.75%(重量/重量)的鲁索替尼或其药学上可接受的盐。
[0137]
本公开还提供了一种治疗人类患者的轻度至中度特应性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂包含基于游离碱1.5%(重量/重量)的鲁索替尼或其药学上可接受的盐。
[0138]
本公开还提供了一种治疗人类患者的轻度至中度特应性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂包含基于游离碱0.75%(重量/重量)的磷酸鲁索替尼。
[0139]
本公开还提供了一种治疗人类患者的轻度至中度特应性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂包含基于游离碱1.5%(重量/重量)的磷酸鲁索替尼。
[0140]
本公开还提供了一种治疗人类患者的中度特应性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用局部制剂,其中所述局部制剂包含基于游离碱0.75%(重量/重量)或1.5%(重量/重量)的鲁索替尼或其药学上可接受的盐。
[0141]
本公开还提供了一种治疗人类患者的中度特应性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用局部制剂,其中所述局部制剂包含基于游离碱0.75%(重量/重量)的鲁索替尼或其药学上可接受的盐。
[0142]
本公开还提供了一种治疗人类患者的中度特应性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用局部制剂,其中所述局部制剂包含基于游离碱1.5%(重量/重量)的鲁索替尼或其药学上可接受的盐。
[0143]
本公开还提供了一种治疗人类患者的中度特应性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用局部制剂,其中所述局部制剂包含基于游离碱0.75%(重量/重量)的磷酸鲁索替尼。
[0144]
本公开还提供了一种治疗人类患者的中度特应性皮炎的方法,其包括每天两次向
所述有需要的人类患者的皮肤施用局部制剂,其中所述局部制剂包含基于游离碱1.5%(重量/重量)的磷酸鲁索替尼。
[0145]
本公开还提供了一种治疗人类患者的中度特应性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂包含基于游离碱0.75%(重量/重量)或1.5%(重量/重量)的鲁索替尼或其药学上可接受的盐。
[0146]
本公开还提供了一种治疗人类患者的中度特应性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂包含基于游离碱0.75%(重量/重量)的鲁索替尼或其药学上可接受的盐。
[0147]
本公开还提供了一种治疗人类患者的中度特应性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂包含基于游离碱1.5%(重量/重量)的鲁索替尼或其药学上可接受的盐。
[0148]
本公开还提供了一种治疗人类患者的中度特应性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂包含基于游离碱0.75%(重量/重量)的磷酸鲁索替尼。
[0149]
本公开还提供了一种治疗人类患者的中度特应性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂包含基于游离碱1.5%(重量/重量)的磷酸鲁索替尼。
[0150]
本公开还提供了一种治疗人类患者的中度至重度特应性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用局部制剂,其中所述局部制剂包含基于游离碱0.75%(重量/重量)或1.5%(重量/重量)的鲁索替尼或其药学上可接受的盐。
[0151]
本公开还提供了一种治疗人类患者的中度至重度特应性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用局部制剂,其中所述局部制剂包含基于游离碱0.75%(重量/重量)的鲁索替尼或其药学上可接受的盐。
[0152]
本公开还提供了一种治疗人类患者的中度至重度特应性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用局部制剂,其中所述局部制剂包含基于游离碱1.5%(重量/重量)的鲁索替尼或其药学上可接受的盐。
[0153]
本公开还提供了一种治疗人类患者的中度至重度特应性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用局部制剂,其中所述局部制剂包含基于游离碱0.75%(重量/重量)的磷酸鲁索替尼。
[0154]
本公开还提供了一种治疗人类患者的中度至重度特应性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用局部制剂,其中所述局部制剂包含基于游离碱1.5%(重量/重量)的磷酸鲁索替尼。
[0155]
本公开还提供了一种治疗人类患者的中度至重度特应性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂包含基于游离碱0.75%(重量/重量)或1.5%(重量/重量)的鲁索替尼或其药学上可接受的盐。
[0156]
本公开还提供了一种治疗人类患者的中度至重度特应性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂包含基于游离碱0.75%(重量/重量)的鲁索替尼或其药学上可接受的盐。
[0157]
本公开还提供了一种治疗人类患者的中度至重度特应性皮炎的方法,其包括每天
两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂包含基于游离碱1.5%(重量/重量)的鲁索替尼或其药学上可接受的盐。
[0158]
本公开还提供了一种治疗人类患者的中度至重度特应性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂包含基于游离碱0.75%(重量/重量)的磷酸鲁索替尼。
[0159]
本公开还提供了一种治疗人类患者的中度至重度特应性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂包含基于游离碱1.5%(重量/重量)的磷酸鲁索替尼。
[0160]
在前面二十段中的实施方案的一些实施方案中,患者达到瘙痒数值评定量表得分相对于基线降低至少4分。在前面二十段中的实施方案的一些实施方案中,患者达到研究者总体评估得分为0或1且相对于基线改善至少2分。在前面二十段中的实施方案的一些实施方案中,患者达到湿疹面积和严重程度指数得分相对于基线统计学上显著地改善。在前面二十段中的实施方案的一些实施方案中,患者达到湿疹面积和严重程度指数得分相对于基线改善75%。在前面二十段中的实施方案的一些实施方案中,患者达到瘙痒数值评定量表得分相对于基线降低至少4分;并且患者达到研究者总体评估得分为0或1且相对于基线改善至少2分。
[0161]
在前面二十段中的实施方案的一些实施方案中,患者达到瘙痒数值评定量表得分相对于基线降低至少4分;并且患者达到湿疹面积和严重程度指数得分相对于基线改善75%。在前面二十段中的实施方案的一些实施方案中,患者达到研究者总体评估得分为0或1且相对于基线改善至少2分;并且患者达到湿疹面积和严重程度指数得分相对于基线改善75%。在前面二十段中的实施方案的一些实施方案中,患者达到瘙痒数值评定量表得分相对于基线降低至少4分;患者达到研究者总体评估得分为0或1且相对于基线改善至少2分;并且患者达到湿疹面积和严重程度指数得分相对于基线改善75%。在前面二十段中的实施方案的一些实施方案中,患者在所述施用的第4周达到瘙痒数值评定量表得分相对于基线降低至少4分。在前面二十段中的实施方案的一些实施方案中,患者在所述施用的第8周达到瘙痒数值评定量表得分相对于基线降低至少4分。在前面二十段中的实施方案的一些实施方案中,患者在所述施用的第4周达到研究者总体评估得分为 0或1且相对于基线改善至少2分。在前面二十段中的实施方案的一些实施方案中,患者在所述施用的第8周达到研究者总体评估得分为 0或1且相对于基线改善至少2分。在前面二十段中的实施方案的一些实施方案中,患者在所述施用的第4周达到湿疹面积和严重程度指数得分相对于基线改善75%。在前面二十段中的实施方案的一些实施方案中,患者在所述施用的第8周达到湿疹面积和严重程度指数得分相对于基线改善75%。在前面二十段中的实施方案的一些实施方案中,患者在所述施用的第4周达到瘙痒数值评定量表得分相对于基线降低至少4分;并且患者在所述施用的第4周达到研究者总体评估得分为0或1且相对于基线改善至少2分。在前面二十段中的实施方案的一些实施方案中,患者在所述施用的第8周达到瘙痒数值评定量表得分相对于基线降低至少4分;并且患者在所述施用的第8周达到研究者总体评估得分为0或1且相对于基线改善至少2分。在前面二十段中的实施方案的一些实施方案中,患者在所述施用的第4周达到瘙痒数值评定量表得分相对于基线降低至少4分;并且患者在所述施用的第4周达到湿疹面积和严重程度指数得分相对于基线改善75%。在前面二十段中的实施
方案的一些实施方案中,患者在所述施用的第8 周达到瘙痒数值评定量表得分相对于基线降低至少4分;并且患者在所述施用的第8周达到湿疹面积和严重程度指数得分相对于基线改善75%。在前面二十段中的实施方案的一些实施方案中,患者在所述施用的第4周达到研究者总体评估得分为0或1且相对于基线改善至少2分;并且患者在所述施用的第4周达到湿疹面积和严重程度指数得分相对于基线改善75%。在前面二十段中的实施方案的一些实施方案中,患者在所述施用的第8周达到研究者总体评估得分为0或1且相对于基线改善至少2分;并且患者在所述施用的第8周达到湿疹面积和严重程度指数得分相对于基线改善75%。在前面二十段中的实施方案的一些实施方案中,患者在所述施用的第4周达到瘙痒数值评定量表得分相对于基线降低至少4分;患者在所述施用的第4周达到研究者总体评估得分为0或1且相对于基线改善至少2分;并且患者在所述施用的第4周达到湿疹面积和严重程度指数得分相对于基线改善75%。在前面二十段中的实施方案的一些实施方案中,患者在所述施用的第8周达到瘙痒数值评定量表得分相对于基线降低至少4分;患者在所述施用的第8周达到研究者总体评估得分为0或1且相对于基线改善至少2分;并且患者在所述施用的第8周达到湿疹面积和严重程度指数得分相对于基线改善75%。在前面二十段中的实施方案的一些实施方案中,施用维持至少4周。在前面二十段中的实施方案的一些实施方案中,施用维持至少8周。
[0162]
一般来说,轻度至中度、中度和中度至重度特应性皮炎由fda 定义
–
即,根据基线时研究者总体评估得分来定义(参见上文iga的定义)。例如,患有轻度特应性皮炎的患者在基线时的研究者总体评估得分为2;患有中度特应性皮炎的患者在基线时的研究者总体评估得分为3;并且患有重度特应性皮炎的患者在基线时的研究者总体评估得分为4。患有轻度至中度特应性皮炎的患者在基线时的研究者总体评估得分为2至3,并且患有中度至重度特应性皮炎的患者在基线时的研究者总体评估得分为3至4。
[0163]
在一些实施方案中,患有轻度至中度特应性皮炎的患者在基线时的特应性皮炎受累的体表面积≥10%。在一些实施方案中,患有中度特应性皮炎的患者在基线时的特应性皮炎受累的体表面积≥10%。在一些实施方案中,患有中度至重度特应性皮炎的患者在基线时的特应性皮炎受累的体表面积≥10%。
[0164]
在一些实施方案中,患有轻度至中度特应性皮炎的患者在基线时的特应性皮炎受累的体表面积为10%至20%。在一些实施方案中,患有中度特应性皮炎的患者在基线时的特应性皮炎受累的体表面积为 10%至20%在一些实施方案中,患有中度至重度特应性皮炎的患者在基线时的特应性皮炎受累的体表面积为10%至20%。
[0165]
在一些实施方案中,患有中度特应性皮炎的患者在基线时的湿疹面积和严重程度指数≥16。在一些实施方案中,患有中度至重度特应性皮炎的患者在基线时的湿疹面积和严重程度指数≥16。
[0166]
在一些实施方案中,患有中度特应性皮炎的患者在基线时的研究者总体评估得分为3,并且在基线时的特应性皮炎受累的体表面积为 10%至20%。
[0167]
在一些实施方案中,患有中度至重度特应性皮炎的患者在基线时的湿疹面积和严重程度指数≥16,在基线时的特应性皮炎受累的体表面积≥10%,并且研究者总体评估得分为3至4。
[0168]
本公开还提供了治疗人类患者的特应性皮炎的方法,其包括每天两次向所述有需
要的人类患者的皮肤施用局部制剂,其中所述局部制剂包含基于游离碱0.75%(重量/重量)或1.5%(重量/重量)的鲁索替尼或其药学上可接受的盐,
[0169]
其中所述患者:
[0170]
在基线时的湿疹面积和严重程度指数得分≥16;并且
[0171]
在基线时的特应性皮炎受累的体表面积≥10%。
[0172]
本公开还提供了治疗人类患者的特应性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用局部制剂,其中所述局部制剂包含基于游离碱0.75%(重量/重量)的鲁索替尼或其药学上可接受的盐,
[0173]
其中所述患者:
[0174]
在基线时的湿疹面积和严重程度指数得分≥16;并且
[0175]
在基线时的特应性皮炎受累的体表面积≥10%。
[0176]
本公开还提供了治疗人类患者的特应性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用局部制剂,其中所述局部制剂包含基于游离碱1.5%(重量/重量)的鲁索替尼或其药学上可接受的盐,
[0177]
其中所述患者:
[0178]
在基线时的湿疹面积和严重程度指数得分≥16;并且
[0179]
在基线时的特应性皮炎受累的体表面积≥10%。
[0180]
本公开还提供了治疗人类患者的特应性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用局部制剂,其中所述局部制剂包含基于游离碱0.75%(重量/重量)的磷酸鲁索替尼,
[0181]
其中所述患者:
[0182]
在基线时的湿疹面积和严重程度指数得分≥16;并且
[0183]
在基线时的特应性皮炎受累的体表面积≥10%。
[0184]
本公开还提供了治疗人类患者的特应性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用局部制剂,其中所述局部制剂包含基于游离碱1.5%(重量/重量)的磷酸鲁索替尼,
[0185]
其中所述患者:
[0186]
在基线时的湿疹面积和严重程度指数得分≥16;并且
[0187]
在基线时的特应性皮炎受累的体表面积≥10%。
[0188]
本公开还提供了治疗人类患者的特应性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂包含基于游离碱0.75%(重量/重量)或1.5%(重量/重量)的鲁索替尼或其药学上可接受的盐,
[0189]
其中所述患者:
[0190]
在基线时的湿疹面积和严重程度指数得分≥16;并且
[0191]
在基线时的特应性皮炎受累的体表面积≥10%。
[0192]
本公开还提供了治疗人类患者的特应性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂包含基于游离碱0.75%(重量/重量)的鲁索替尼或其药学上可接受的盐,
[0193]
其中所述患者:
[0194]
在基线时的湿疹面积和严重程度指数得分≥16;并且
[0195]
在基线时的特应性皮炎受累的体表面积≥10%。
[0196]
本公开还提供了治疗人类患者的特应性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂包含基于游离碱1.5%(重量/重量)的鲁索替尼或其药学上可接受的盐,
[0197]
其中所述患者:
[0198]
在基线时的湿疹面积和严重程度指数得分≥16;并且
[0199]
在基线时的特应性皮炎受累的体表面积≥10%。
[0200]
本公开还提供了治疗人类患者的特应性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂包含基于游离碱0.75%(重量/重量)的磷酸鲁索替尼,
[0201]
其中所述患者:
[0202]
在基线时的湿疹面积和严重程度指数得分≥16;并且
[0203]
在基线时的特应性皮炎受累的体表面积≥10%。
[0204]
本公开还提供了治疗人类患者的特应性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂包含基于游离碱1.5%(重量/重量)的磷酸鲁索替尼,
[0205]
其中所述患者:
[0206]
在基线时的湿疹面积和严重程度指数得分≥16;并且
[0207]
在基线时的特应性皮炎受累的体表面积≥10%。
[0208]
在前面十段中的实施方案的一些实施方案中,患者在基线时的研究者总体评估得分为3。在前面十段中的实施方案的一些实施方案中,患者在基线时的研究者总体评估得分为3至4。在前面十段中的实施方案的一些实施方案中,患者在基线时的瘙痒数值评定量表得分≥4。在前十段中的实施方案的一些实施方案中,患者:在基线时的研究者总体评估得分为3;并且在基线时的瘙痒数值评定量表得分≥4。在前面十段中的实施方案的一些实施方案中,患者:在基线时的研究者总体评估得分为3至4;并且在基线时的瘙痒数值评定量表得分≥4。在前面十段中的实施方案的一些实施方案中,患者年龄≥12岁。在前面十段中的实施方案的一些实施方案中,患者具有至少2年的特应性皮炎病史。在前面十段中的实施方案的一些实施方案中,患者:在基线时的研究者总体评估得分为3;具有至少2年的特应性皮炎病史;并且年龄≥12岁。在前面十段中的实施方案的一些实施方案中,患者:在基线时的研究者总体评估得分为3至4;具有至少2年的特应性皮炎病史;并且年龄≥12岁。在前面十段中的实施方案的一些实施方案中,患者:在基线时的研究者总体评估得分为3;在基线时的瘙痒数值评定量表得分≥4;具有至少2年的特应性皮炎病史;并且年龄≥12 岁。在前面十段中的实施方案的一些实施方案中,患者:在基线时的研究者总体评估得分为3至4;在基线时的瘙痒数值评定量表得分≥4;具有至少2年的特应性皮炎病史;并且年龄≥12岁。在前面十段中的实施方案的一些实施方案中,患者具有以下特征中的一者或多者:在基线时的研究者总体评估得分为3;在基线时的瘙痒数值评定量表得分≥4;具有至少2年的特应性皮炎病史;并且年龄≥12岁。在前面十段中的实施方案的一些实施方案中,患者达到瘙痒数值评定量表得分相对于基线降低至少4分。在前面十段中的实施方案的一些实施方案中,患者
达到研究者总体评估得分为0或1且相对于基线改善至少 2分。在前面十段中的实施方案的一些实施方案中,患者达到湿疹面积和严重程度指数得分相对于基线统计学上显著地改善。在前面十段中的实施方案的一些实施方案中,患者达到湿疹面积和严重程度指数得分相对于基线改善75%。在前面十段中的实施方案的一些实施方案中,患者达到瘙痒数值评定量表得分相对于基线降低至少4分;并且患者达到研究者总体评估得分为0或1且相对于基线改善至少2 分。在前面十段中的实施方案的一些实施方案中,患者达到瘙痒数值评定量表得分相对于基线降低至少4分;并且患者达到湿疹面积和严重程度指数得分相对于基线改善75%。在前面十段中的实施方案的一些实施方案中,患者达到研究者总体评估得分为0或1且相对于基线改善至少2分;并且患者达到湿疹面积和严重程度指数得分相对于基线改善75%。在前面十段中的实施方案的一些实施方案中,患者达到瘙痒数值评定量表得分相对于基线降低至少4分;患者达到研究者总体评估得分为0或1且相对于基线改善至少2分;并且患者达到湿疹面积和严重程度指数得分相对于基线改善75%。在前面十段中的实施方案的一些实施方案中,患者在所述施用的第4周达到瘙痒数值评定量表得分相对于基线降低至少4分。在前面十段中的实施方案的一些实施方案中,患者在所述施用的第8周达到瘙痒数值评定量表得分相对于基线降低至少4分。在前面十段中的实施方案的一些实施方案中,患者在所述施用的第4周达到研究者总体评估得分为0或1且相对于基线改善至少2分。在前面十段中的实施方案的一些实施方案中,患者在所述施用的第8周达到研究者总体评估得分为0或1且相对于基线改善至少2分。在前面十段中的实施方案的一些实施方案中,患者在所述施用的第4周达到湿疹面积和严重程度指数得分相对于基线改善75%。在前面十段中的实施方案的一些实施方案中,患者在所述施用的第8周达到湿疹面积和严重程度指数得分相对于基线改善75%。在前面十段中的实施方案的一些实施方案中,患者在所述施用的第4周达到瘙痒数值评定量表得分相对于基线降低至少4分;并且患者在所述施用的第4周达到研究者总体评估得分为0或1且相对于基线改善至少2分。在前面十段中的实施方案的一些实施方案中,患者在所述施用的第8周达到瘙痒数值评定量表得分相对于基线降低至少4分;并且患者在所述施用的第8周达到研究者总体评估得分为0或1且相对于基线改善至少2分。在前面十段中的实施方案的一些实施方案中,患者在所述施用的第4周达到瘙痒数值评定量表得分相对于基线降低至少4分;并且患者在所述施用的第4周达到湿疹面积和严重程度指数得分相对于基线改善75%。在前面十段中的实施方案的一些实施方案中,患者在所述施用的第8周达到瘙痒数值评定量表得分相对于基线降低至少4分;并且患者在所述施用的第8周达到湿疹面积和严重程度指数得分相对于基线改善75%。在前面十段中的实施方案的一些实施方案中,患者在所述施用的第4周达到研究者总体评估得分为0或1且相对于基线改善至少2分;并且患者在所述施用的第4周达到湿疹面积和严重程度指数得分相对于基线改善 75%。在前面十段中的实施方案的一些实施方案中,患者在所述施用的第8周达到研究者总体评估得分为0或1且相对于基线改善至少2 分;并且患者在所述施用的第8周达到湿疹面积和严重程度指数得分相对于基线改善75%。在前面十段中的实施方案的一些实施方案中,患者在所述施用的第4周达到瘙痒数值评定量表得分相对于基线降低至少4分;患者在所述施用的第4周达到研究者总体评估得分为0 或1且相对于基线改善至少2分;并且患者在所述施用的第4周达到湿疹面积和严重程度指数得分相对于基线改善75%。在前面十段中的实施方案的一些实施方案中,患者在所述施用的第8周达到瘙痒数值
评定量表得分相对于基线降低至少4分;患者在所述施用的第8周达到研究者总体评估得分为0或1且相对于基线改善至少2分;并且患者在所述施用的第8周达到湿疹面积和严重程度指数得分相对于基线改善75%。在前面十段中的实施方案的一些实施方案中,施用维持至少4周。在前面十段中的实施方案的一些实施方案中,施用维持至少8周。
[0209]
在一些实施方案中,局部制剂是乳膏制剂。在一些实施方案中,鲁索替尼或其盐是磷酸鲁索替尼。在一些实施方案中,制剂包含基于游离碱0.75%(重量/重量)的鲁索替尼或其药学上可接受的盐。在一些实施方案中,制剂包含基于游离碱1.5%(重量/重量)的鲁索替尼或其药学上可接受的盐。在一些实施方案中,制剂包含基于游离碱0.75% (重量/重量)的磷酸鲁索替尼。在一些实施方案中,制剂包含基于游离碱1.5%(重量/重量)的磷酸鲁索替尼。
[0210]
在一些实施方案中,患者达到瘙痒数值评定量表得分相对于基线改善至少4分。在一些实施方案中,患者达到瘙痒数值评定量表得分相对于基线改善至少4分,其中患者的基线数值评定量表得分等于或大于4。在一些实施方案中,患者在所述施用的2周后达到瘙痒数值评定量表得分相对于基线改善至少4分,其中患者的基线数值评定量表得分等于或大于4。在一些实施方案中,患者在所述施用的4周后达到瘙痒数值评定量表得分相对于基线改善至少4分,其中患者的基线数值评定量表得分等于或大于4。在一些实施方案中,患者在所述施用的8周后达到瘙痒数值评定量表得分相对于基线改善至少4 分,其中患者的基线数值评定量表得分等于或大于4。
[0211]
在一些实施方案中,患者:
[0212]
年龄在18至70岁之间,
[0213]
已被诊断患有特应性皮炎至少2年,
[0214]
在筛选和基线时的研究者总体评估得分为2至3,并且
[0215]
在基线时的特应性皮炎受累的bsa(不包括面部和间擦区域)为3%至20%。
[0216]
在一些实施方案中,患者:
[0217]
是年龄≥12至17岁(含端值)的青少年,或年龄≥18岁的男性或女性;
[0218]
具有至少2年的ad病史;
[0219]
在基线时的研究者总体评估得分为2至3;并且
[0220]
在基线时的ad受累的%bsa(不包括头皮)为3%至20%。
[0221]
在一些实施方案中,患者:
[0222]
是年龄≥12至17岁(含端值)的青少年,或年龄≥18岁的男性或女性;
[0223]
具有至少2年的ad病史;
[0224]
在基线时的研究者总体评估得分为2至3;
[0225]
在基线时的ad受累的%bsa(不包括头皮)为3%至20%;并且
[0226]
具有至少有1个靶病变(其代表参与者的疾病状态,并且不存在于手、脚或生殖器上),其在基线时测量为约10cm2或更大。
[0227]
在一些实施方案中,患者被诊断患有如hanifin和rajika标准所定义的特应性皮炎。
[0228]
在一些实施方案中,患者在基线的2周内未使用除润肤剂外的特应性皮炎的局部治疗。
[0229]
在一些实施方案中,患者在基线的4周或5个半衰期(以较长者为准)内未使用全身性免疫抑制或免疫调节药物(例如,口服或注射皮质类固醇、甲氨蝶呤、环孢霉素、霉酚酸酯或硫唑嘌呤)。
[0230]
在一些实施方案中,患者在基线的2周内未使用除温和润肤剂外的特应性皮炎的局部治疗;并且在基线的4周内未使用全身性免疫抑制或全身性免疫调节药物。
[0231]
在一些实施方案中,患者未施用用于治疗特应性皮炎的其他治疗剂。
[0232]
在一些实施方案中,患者未施用除温和的润肤剂外的全身性免疫抑制或全身性免疫调节药物或特应性皮炎的局部治疗。
[0233]
在一些实施方案中,患者:
[0234]
(i)未显示活动性急性或慢性感染的迹象;(ii)在基线的2周内未使用特应性皮炎的局部治疗(除温和润肤剂外);(iii)在基线的4周或5 个半衰期(以较长者为准)内未使用全身性免疫抑制或免疫调节药物 (例如,口服或注射皮质类固醇、甲氨蝶呤、环孢霉素、霉酚酸酯或硫唑嘌呤);(iv)未诊断患有除特应性皮炎外的其他皮肤病,其存在或治疗可能使疾病评估复杂化;(v)可能使评估复杂化的除皮肤病外的需要治疗的其他疾病史;(vi)筛选时未显示血细胞减少,定义为白细胞《 3.0
×
109/l,中性粒细胞《正常下限,血红蛋白《10g/dl。淋巴细胞《0.8
ꢀ×
109/l、血小板《100
×
109/l;(vii)在透析时没有严重肝功能受损 (child-pugh c级)或终末期肾病,或以下的至少1项:血清肌酐》1.5 mg/dl、丙氨酸氨基转移酶或天冬氨酸氨基转移酶≥1.5
×
正常上限; (viii)在基线访视前的2周或5个半衰期(以较长者为准)内未服用除全身可用性有限的局部药剂外的强效全身性细胞色素p450 3a4抑制剂或氟康唑;和/或(ix)未全身性或局部施用janus激酶抑制剂。
[0235]
在一些实施方案中,患者:
[0236]
(i)是年龄≥12至17岁(含端值)的青少年,或年龄≥18岁的男性或女性;(ii)被诊断患有如hanifin和rajka标准所定义的ad;(iii)具有至少2年的ad病史;(iv)在基线时的研究者总体评估得分为2至3; (v)在基线时的ad受累的%bsa(不包括头皮)为3%至20%;(vi)同意在施用期间停用所有用于治疗ad的剂;和/或(vi)具有至少有1个靶病变(其代表参与者的疾病状态,并且不存在于手、脚或生殖器上),其在基线时测量为约10cm2或更大。
[0237]
在一些实施方案中,患者:
[0238]
(i)在基线前的4周内没有由医师确定的不稳定的ad病程(自发改善或迅速恶化);(ii)没有并发疾病和其他疾病史:(a)免疫受损(例如,淋巴瘤、获得性免疫缺陷综合征、wiskott-aldrich综合征);(b)在基线前2周内需要用全身性抗生素、抗病毒药、抗寄生虫药、抗原虫药或抗真菌药治疗的慢性或急性感染;(c)在基线前的1周内的活动性急性细菌、真菌或病毒性皮肤感染(例如,单纯疱疹、带状疱疹、水痘); (d)任何其他伴随的皮肤病(例如,全身性红皮病,诸如netherton综合征)、色素沉着或广泛的疤痕,在研究者看来,它们可能会干扰ad 病变的评价或损害参与者的安全性;(e)仅在手或脚上存在ad病变,而先前没有其他典型受累区域(诸如面部或褶皱)的受累史;(f)其他类型的湿疹;(iii)没有任何严重的疾病或医学、身体或精神病状,在研究者看来,它们会干扰全面参与研究,包括研究药物的施用和参加所需的研究访视;对参与者构成重大风险;或干扰研究数据的解释。例如:(a)临床上显著或不受控制的心脏病,包括不稳定型心绞痛、从研究药物施用的第1天起6个月内的急性心肌梗塞、纽约心脏协会iii 级或iv级充血性心力衰竭以及需要治疗的心律失
常或不受控制的高血压(血压》150/90mmhg),除非经医疗监护人/赞助商批准;(b)参加本研究前5年内有恶性肿瘤病史的参与者,经过充分治疗的非转移性恶性肿瘤除外;(c)低血红蛋白(《10g/dl);(d)透析时的严重肾病(血清肌酐》2mg/dl);(e)当前和/或肝病史,包括已知的乙型或丙型肝炎,伴有肝脏或胆道异常;(iv)在基线前的指定清除期内未接受以下治疗中的任一者:(a)5个半衰期或12周(以较长者为准)—生物剂(例如,杜匹鲁单抗(dupilumab));(b)4周—全身性皮质类固醇或促肾上腺皮质激素类似物、环孢菌素、甲氨蝶呤、硫唑嘌呤或其他全身性免疫抑制或免疫调节剂(例如,霉酚酸酯或他克莫司);(c)2周—免疫接种和镇静抗组胺药,除非长期稳定方案(允许使用非镇静抗组胺药); (d)1周—使用ad的其他局部治疗(除温和润肤剂外),诸如皮质类固醇、钙调神经磷酸酶抑制剂、煤焦油(洗发水)、抗生素、抗菌沐浴露/ 肥皂。允许使用稀释的次氯酸钠“漂白剂”浴,只要每周不超过2次并且在整个研究期间其频率保持不变即可;(v)先前未接受全身或局部的 jak抑制剂;(vi)在基线前的2周内没有接受紫外线疗法或长时间暴露于天然或人工uv辐射源(例如,阳光或仿晒机)和/或在研究期间未打算进行此类暴露,这被研究者认为潜在地影响参与者的ad;(vii) 在筛查hiv抗体时没有阳性血清学测试结果;(viii)没有以下结果的肝功能测试:ast或alt≥2
×
uln;碱性磷酸酶和/或胆红素》1.5
ꢀ×
uln(如果胆红素被分级并且直接胆红素《35%,则分离的胆红素》1.5
×
uln是可接受的);(ix)没有怀孕或哺乳,或考虑怀孕;(x) 在筛选前1年内没有酗酒或吸毒史,或目前没有饮酒或吸毒,在研究者看来,这会干扰参与者遵守施用计划和研究评估的能力;和/或(xi) 目前未接受治疗,或者在基线前的30天或5个半衰期(以较长者为准) 内接受过另一种研究药物治疗或目前参加另一种研究药物方案。
[0239]
在一些实施方案中,每天两次施用相隔至少8小时。
[0240]
在一些实施方案中,乳膏制剂是包含所述鲁索替尼或其药学上可接受的盐的水包油乳剂。
[0241]
在一些实施方案中,乳膏制剂是包含所述基于游离碱1.5%(重量 /重量)的磷酸鲁索替尼的水包油乳剂。
[0242]
在一些实施方案中,乳膏制剂是包含所述基于游离碱0.75%(重量/重量)的磷酸鲁索替尼的水包油乳剂。
[0243]
在一些实施方案中,乳膏制剂的ph为约2.8至约3.9。
[0244]
在一些实施方案中,乳膏制剂的ph为约2.8至约3.6。
[0245]
在一些实施方案中,乳膏制剂是增溶乳膏。
[0246]
在一些实施方案中,乳膏制剂的施用不会导致血红蛋白或血小板的统计学上显著的降低。在一些实施方案中,乳膏制剂的施用不会导致施用部位灼伤。在一些实施方案中,乳膏制剂的施用不会导致施用部位发痒。
[0247]
在一些实施方案中,患者达到了瘙痒迅速减少。
[0248]
在一些实施方案中,患者在所述施用的第1天(即,12小时内) 达到了统计学上显著的瘙痒减少。在一些实施方案中,患者在包含 1.5%(重量/重量)鲁索替尼或其药学上可接受的盐的乳膏制剂的所述施用的第1天(即,12小时内)达到了统计学上显著的瘙痒减少。
[0249]
在一些实施方案中,与在同一时期施用安慰剂的患者相比,所述患者在所述施用的第2天达到瘙痒数值评定量表得分相对于基线统计学上显著地降低。
[0250]
在一些实施方案中,与在同一时期施用安慰剂的患者相比,所述患者在所述施用的第1天达到瘙痒数值评定量表得分相对于基线统计学上显著地降低。
[0251]
在一些实施方案中,患者在所述施用的第1天达到瘙痒数值评定量表得分相对于基线降低至少1分。
[0252]
在一些实施方案中,患者在所述施用的第1天达到瘙痒数值评定量表得分相对于基线改善至少2分。
[0253]
在一些实施方案中,患者在所述施用的第1天达到瘙痒数值评定量表得分相对于基线降低至少1.5分。
[0254]
在一些实施方案中,患者在所述施用的第2天达到瘙痒数值评定量表得分相对于基线降低至少1分。
[0255]
在一些实施方案中,患者在所述施用的第2天达到瘙痒数值评定量表得分相对于基线降低至少1.5分。
[0256]
在一些实施方案中,患者在所述施用的第2天达到瘙痒数值评定量表得分相对于基线降低至少2分。
[0257]
在一些实施方案中,患者在所述施用的第4天达到瘙痒数值评定量表得分相对于基线降低至少2分。
[0258]
在一些实施方案中,患者到所述施用的第2天达到瘙痒数值评定量表得分降低至少1分。
[0259]
在一些实施方案中,患者在所述施用的36小时内达到瘙痒数值评定量表得分降低至少1分。
[0260]
在一些实施方案中,患者到所述施用的第6天达到瘙痒数值评定量表得分降低至少2分。
[0261]
在一些实施方案中,患者在所述施用的第1周达到瘙痒数值评定量表得分降低至少2分。
[0262]
在一些实施方案中,患者在所述施用的第3周达到瘙痒数值评定量表得分降低至少3分。
[0263]
在一些实施方案中,患者达到:到所述施用的第2天,瘙痒数值评定量表得分降低至少1分,到所述施用的第6天,瘙痒数值评定量表得分降低至少2分,以及在所述施用的第3周,瘙痒数值评定量表得分降低至少3分。
[0264]
在一些实施方案中,患者达到:在所述施用的36小时内,瘙痒数值评定量表得分降低至少1分,到所述施用的第6天,瘙痒数值评定量表得分降低至少2分,以及在所述施用的第3周,瘙痒数值评定量表得分降低至少3分。
[0265]
在一些实施方案中,患者达到:到所述施用的第2天,瘙痒数值评定量表得分降低至少1分,在所述施用的第1周,瘙痒数值评定量表得分降低至少2分,以及在所述施用的第3周,瘙痒数值评定量表得分降低至少3分。
[0266]
在一些实施方案中,患者达到:在所述施用的36小时内,瘙痒数值评定量表得分降低至少1分,在所述施用的第1周,瘙痒数值评定量表得分降低至少2分,以及在所述施用的第3周,瘙痒数值评定量表得分降低至少3分。
[0267]
一种减少患有特应性皮炎的人类患者的瘙痒的方法,其包括每天两次向所述有需
要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂包含基于游离碱1.5%(重量/重量)的鲁索替尼或其药学上可接受的盐,其中所述患者到所述施用的第2天达到瘙痒数值评定量表得分降低至少1分。
[0268]
一种减少患有特应性皮炎的人类患者的瘙痒的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂包含基于游离碱1.5%(重量/重量)的鲁索替尼或其药学上可接受的盐,其中所述患者在所述施用的36小时内达到瘙痒数值评定量表得分降低至少1分。
[0269]
一种减少患有特应性皮炎的人类患者的瘙痒的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂包含基于游离碱1.5%(重量/重量)的鲁索替尼或其药学上可接受的盐,其中所述患者到所述施用的第6天达到瘙痒数值评定量表得分降低至少2分。
[0270]
一种减少患有特应性皮炎的人类患者的瘙痒的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂包含基于游离碱1.5%(重量/重量)的鲁索替尼或其药学上可接受的盐,其中所述患者在所述施用的第1周达到瘙痒数值评定量表得分降低至少2分。
[0271]
一种减少患有特应性皮炎的人类患者的瘙痒的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂包含基于游离碱1.5%(重量/重量)的鲁索替尼或其药学上可接受的盐,其中所述患者在所述施用的第3周达到瘙痒数值评定量表得分降低至少3分。
[0272]
一种减少患有特应性皮炎的人类患者的瘙痒的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂包含基于游离碱1.5%(重量/重量)的鲁索替尼或其药学上可接受的盐,其中所述患者达到:到所述施用的第2天,瘙痒数值评定量表得分降低至少1分,到所述施用的第6天,瘙痒数值评定量表得分降低至少2分,以及在所述施用的第3周,瘙痒数值评定量表得分降低至少3分。
[0273]
一种减少患有特应性皮炎的人类患者的瘙痒的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂包含基于游离碱1.5%(重量/重量)的鲁索替尼或其药学上可接受的盐,其中所述患者达到:在所述施用的36小时内,瘙痒数值评定量表得分降低至少1分,到所述施用的第6天,瘙痒数值评定量表得分降低至少2分,以及在所述施用的第3周,瘙痒数值评定量表得分降低至少3分。
[0274]
一种减少患有特应性皮炎的人类患者的瘙痒的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂包含基于游离碱1.5%(重量/重量)的鲁索替尼或其药学上可接受的盐,其中所述患者达到:到所述施用的第2天,瘙痒数值评定量表得分降低至少1分,在所述施用的第1周,瘙痒数值评定量表得分降低至少2分,以及在所述施用的第3周,瘙痒数值评定量表得分降低至少3分。
[0275]
一种减少患有特应性皮炎的人类患者的瘙痒的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂包含基于游离碱1.5%(重量/重量)的鲁索替尼或其药学上可接受的盐,其中所述患者达到:在所述施用的36小时内,瘙痒数值评定量表得分降低至少1分,在所述施用的第1周,瘙痒数值评定量表得分降低至少2分,以及在所述施用的第3周,瘙痒数值评定量表得分降低至少3分。
[0276]
在一些实施方案中,患者在所述施用的第1天达到瘙痒数值评定量表得分的最小临床重要性差值。
[0277]
在一些实施方案中,患者在所述施用的第2天达到瘙痒数值评定量表得分的最小临床重要性差值。
[0278]
在一些实施方案中,患者在所述施用的第3天达到瘙痒数值评定量表得分的最小临床重要性差值。
[0279]
在一些实施方案中,患者在所述施用的第4天达到瘙痒数值评定量表得分的最小临床重要性差值。
[0280]
在一些实施方案中,患者在所述施用的第2天达到瘙痒数值评定量表得分的临床相关改善。
[0281]
在一些实施方案中,患者在所述施用的第3天达到瘙痒数值评定量表得分的临床相关改善。
[0282]
在一些实施方案中,患者在所述施用的第4天达到瘙痒数值评定量表得分的临床相关改善。
[0283]
在一些实施方案中,与在同一时期施用安慰剂的患者相比,所述患者在所述施用的第2周达到瘙痒数值评定量表得分相对于基线统计学上显著地降低。
[0284]
在一些实施方案中,患者在所述施用的第2周达到瘙痒数值评定量表得分相对于基线降低至少3分。
[0285]
在一些实施方案中,患者在所述施用的第2周达到瘙痒数值评定量表得分的临床相关改善。
[0286]
在一些实施方案中,与在同一时期施用安慰剂的患者相比,所述患者在所述施用的第4周达到瘙痒数值评定量表得分相对于基线统计学上显著地降低。
[0287]
在一些实施方案中,患者在所述施用的第4周达到瘙痒数值评定量表得分相对于基线降低至少3分。
[0288]
在一些实施方案中,患者在所述施用的第4周达到瘙痒数值评定量表得分的临床相关改善。
[0289]
在一些实施方案中,与在同一时期施用安慰剂的患者相比,所述患者在所述施用的第8周达到瘙痒数值评定量表得分相对于基线统计学上显著地降低。
[0290]
在一些实施方案中,患者在所述施用的第8周达到瘙痒数值评定量表得分相对于基线降低至少3分。
[0291]
在一些实施方案中,患者在所述施用的第8周达到瘙痒数值评定量表得分相对于基线降低至少4分。
[0292]
在一些实施方案中,患者在所述施用的第8周达到瘙痒数值评定量表得分的临床相关改善。
[0293]
在一些实施方案中,患者在所述施用的第12周达到瘙痒数值评定量表得分相对于基线降低至少4.5分。
[0294]
在一些实施方案中,所述施用逆转特应性皮炎的症候学。
[0295]
在一些实施方案中,与在同一时期施用安慰剂的患者相比,所述患者在所述施用的第4周达到湿疹面积和严重程度指数得分相对于基线统计学上显著地改善。
[0296]
在一些实施方案中,与在同一时期施用安慰剂的患者相比,所述患者在所述施用的第8周达到湿疹面积和严重程度指数得分相对于基线统计学上显著地改善。
[0297]
在一些实施方案中,患者在所述施用的第2周达到湿疹面积和严重程度指数得分相对于基线改善75%。
[0298]
在一些实施方案中,患者在所述施用的第4周达到湿疹面积和严重程度指数得分相对于基线改善75%。
[0299]
在一些实施方案中,患者在所述施用的第8周达到湿疹面积和严重程度指数得分相对于基线改善75%。
[0300]
在一些实施方案中,患者在所述施用的第12周达到湿疹面积和严重程度指数得分相对于基线改善75%。
[0301]
在一些实施方案中,患者在所述施用的第2周达到研究者总体评估得分为0或1且相对于基线改善至少2分。
[0302]
在一些实施方案中,患者在所述施用的第4周达到研究者总体评估得分为0或1且相对于基线改善至少2分。
[0303]
在一些实施方案中,患者在所述施用的第8周达到研究者总体评估得分为0或1且相对于基线改善至少2分。
[0304]
在一些实施方案中,患者在第8周达到promis简表
–
睡眠障碍(8b)24小时回忆得分的临床上有意义的改善。
[0305]
在一些实施方案中,患者在所述施用的第2周达到skindex-16 总体得分改善至少50%。
[0306]
在一些实施方案中,患者在所述施用的第2周达到skindex-16 总体得分改善至少60%。
[0307]
在一些实施方案中,患者在所述施用的第4周达到skindex-16 总体得分改善至少50%。
[0308]
在一些实施方案中,患者在所述施用的第4周达到skindex-16 总体得分改善至少60%。
[0309]
在一些实施方案中,患者在所述施用的第4周达到skindex-16 总体得分改善至少70%。
[0310]
在一些实施方案中,患者在所述施用的第8周达到skindex-16 总体得分改善至少50%。
[0311]
在一些实施方案中,患者在所述施用的第8周达到skindex-16 总体得分改善至少60%。
[0312]
在一些实施方案中,患者在所述施用的第8周达到skindex-16 总体得分改善至少70%。
[0313]
在一些实施方案中,患者罹患轻度至中度特应性皮炎。
[0314]
在一些实施方案中,施用维持至少2周。
[0315]
在一些实施方案中,施用维持至少4周。
[0316]
在一些实施方案中,施用维持至少8周。
[0317]
在一些实施方案中,施用维持至少12周。
[0318]
本公开还提供了一种减少患有特应性皮炎的人类患者的瘙痒的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂是水包油乳剂,其包含基于游离碱1.5%(重量 /重量)的磷酸鲁索替尼,
[0319]
其中所述施用维持至少8周,
[0320]
其中所述患者在施用的第8周达到瘙痒数值评定量表得分相对于基线降低至少4分。
[0321]
本公开还提供了一种减少患有特应性皮炎的人类患者的瘙痒的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂是水包油乳剂,其包含基于游离碱0.75%(重量/重量)的磷酸鲁索替尼,
[0322]
其中所述施用维持至少8周,
[0323]
其中所述患者在施用的第8周达到瘙痒数值评定量表得分相对于基线降低至少4分。
[0324]
本公开还提供了一种减少患有特应性皮炎的人类患者的瘙痒的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂是水包油乳剂,其包含基于游离碱1.5%(重量 /重量)的磷酸鲁索替尼,
[0325]
其中所述施用维持至少8周,
[0326]
其中所述患者在施用的第8周达到瘙痒数值评定量表得分相对于基线降低至少4分,并且
[0327]
其中所述患者:
[0328]
年龄在18至70岁之间,
[0329]
已被诊断患有特应性皮炎至少2年,
[0330]
在筛选和基线时的研究者总体评估得分为2至3,并且
[0331]
在基线时的特应性皮炎受累的体表面积(不包括面部和间擦区域) 为3%至20%。
[0332]
本公开还提供了一种减少患有特应性皮炎的人类患者的瘙痒的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂是水包油乳剂,其包含基于游离碱0.75%(重量/重量)或1.5%(重量/重量)的磷酸鲁索替尼,
[0333]
其中所述施用维持至少8周,
[0334]
其中所述患者在施用的第8周达到瘙痒数值评定量表得分相对于基线降低至少4分,并且
[0335]
其中所述患者:
[0336]
是年龄≥12至17岁(含端值)的青少年,或年龄≥18岁的男性或女性;
[0337]
具有至少2年的ad病史;
[0338]
在基线时的研究者总体评估得分为2至3;并且
[0339]
在基线时的ad受累的%bsa(不包括头皮)为3%至20%。
[0340]
本公开还提供了一种减少患有特应性皮炎的人类患者的瘙痒的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂是水包油乳剂,其包含基于游离碱1.5%(重量/重量)的磷酸鲁索替尼,
[0341]
其中所述施用维持至少8周,
[0342]
其中所述患者在所述施用的第8周达到瘙痒数值评定量表得分相对于基线降低至
少4分,并且
[0343]
其中所述患者在所述施用的第8周达到研究者总体评估得分为0 或1且相对于基线改善至少2分。
[0344]
本公开还提供了一种减少患有特应性皮炎的人类患者的瘙痒的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂是水包油乳剂,其包含基于游离碱0.75%(重量/重量)或1.5%(重量/重量)的磷酸鲁索替尼,
[0345]
其中所述施用维持至少8周,
[0346]
其中所述患者在所述施用的第8周达到瘙痒数值评定量表得分相对于基线降低至少4分,并且
[0347]
其中所述患者在所述施用的第8周达到研究者总体评估得分为0 或1且相对于基线改善至少2分。
[0348]
本公开还提供了一种减少患有特应性皮炎的人类患者的瘙痒的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂是水包油乳剂,其包含基于游离碱1.5%(重量 /重量)的磷酸鲁索替尼,
[0349]
其中所述施用维持至少8周,
[0350]
其中所述患者在所述施用的第8周达到瘙痒数值评定量表得分相对于基线降低至少4分,
[0351]
其中所述患者在所述施用的第8周达到研究者总体评估得分为0 或1且相对于基线改善至少2分,并且
[0352]
其中所述患者:
[0353]
年龄在18至70岁之间,
[0354]
已被诊断患有特应性皮炎至少2年,
[0355]
在筛选和基线时的研究者总体评估得分为2至3,并且
[0356]
在基线时的特应性皮炎受累的bsa(不包括面部和间擦区域)为 3%至20%。
[0357]
本公开还提供了一种减少患有特应性皮炎的人类患者的瘙痒的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂是水包油乳剂,其包含基于游离碱0.75%(重量/重量)或1.5%(重量/重量)的磷酸鲁索替尼,
[0358]
其中所述施用维持至少8周,
[0359]
其中所述患者在所述施用的第8周达到瘙痒数值评定量表得分相对于基线降低至少4分,
[0360]
其中所述患者在所述施用的第8周达到研究者总体评估得分为0 或1且相对于基线改善至少2分,并且
[0361]
其中所述患者:
[0362]
是年龄≥12至17岁(含端值)的青少年,或年龄≥18岁的男性或女性;
[0363]
具有至少2年的ad病史;
[0364]
在基线时的研究者总体评估得分为2至3;并且
[0365]
在基线时的ad受累的%bsa(不包括头皮)为3%至20%。
[0366]
在另一个实施方案中,本公开提供了一种减少患有特应性皮炎的人类患者的瘙痒的方法,其包括每天两次向所述有需要的人类患者的皮肤施用组合物,所述组合物包含:
[0367]
(1)基于游离碱1.5%(重量/重量)的磷酸鲁索替尼,和
[0368]
(2)用于实现所述磷酸鲁索替尼的剂量依赖性皮肤渗透的装置,其中所述患者达到瘙痒数值评定量表得分相对于基线降低。
[0369]
在另一个实施方案中,本公开提供了一种减少患有特应性皮炎的人类患者的瘙痒的方法,其包括每天两次向所述有需要的人类患者的皮肤施用组合物,所述组合物包含:
[0370]
(1)基于游离碱0.75%(重量/重量)的磷酸鲁索替尼,和
[0371]
(2)用于实现所述磷酸鲁索替尼的剂量依赖性皮肤渗透的装置,其中所述患者达到瘙痒数值评定量表得分相对于基线降低。
[0372]
本公开还提供了一种减少患有特应性皮炎的人类患者的瘙痒的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂包含基于游离碱1.5%(重量/重量)的鲁索替尼或其药学上可接受的盐,
[0373]
其中所述患者达到瘙痒数值评定量表得分相对于基线降低。
[0374]
本公开还提供了一种减少患有特应性皮炎的人类患者的瘙痒的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂包含基于游离碱0.75%(重量/重量)的鲁索替尼或其药学上可接受的盐,
[0375]
其中所述患者达到瘙痒数值评定量表得分相对于基线降低。
[0376]
本公开还提供了一种治疗人类患者的特应性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂包含基于游离碱0.75%(重量/重量)或1.5%(重量/重量)的鲁索替尼或其药学上可接受的盐;
[0377]
其中所述患者具有选自由以下组成的组的一种或多种特征:
[0378]
在基线时的湿疹面积和严重程度指数得分≥16;
[0379]
在基线时的特应性皮炎受累的体表面积≥10%;
[0380]
在基线时的瘙痒数值评定量表得分≥4;以及
[0381]
在基线时的研究者总体评估得分为至少3。
[0382]
本公开还提供了一种治疗人类患者的特应性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂包含基于游离碱0.75%(重量/重量)的鲁索替尼或其药学上可接受的盐;
[0383]
其中所述患者具有选自由以下组成的组的一种或多种特征:
[0384]
在基线时的湿疹面积和严重程度指数得分≥16;
[0385]
在基线时的特应性皮炎受累的体表面积≥10%;
[0386]
在基线时的瘙痒数值评定量表得分≥4;以及
[0387]
在基线时的研究者总体评估得分为至少3。
[0388]
本公开还提供了一种治疗人类患者的特应性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂包含基于游离碱1.5%(重量/重量)的鲁索替尼或其药学上可接受的盐;
[0389]
其中所述患者具有选自由以下组成的组的一种或多种特征:
[0390]
在基线时的湿疹面积和严重程度指数得分≥16;
[0391]
在基线时的特应性皮炎受累的体表面积≥10%;
[0392]
在基线时的瘙痒数值评定量表得分≥4;以及
[0393]
在基线时的研究者总体评估得分为至少3。
[0394]
本公开还提供了一种治疗人类患者的特应性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂包含基于游离碱0.75%(重量/重量)的磷酸鲁索替尼;
[0395]
其中所述患者具有选自由以下组成的组的一种或多种特征:
[0396]
在基线时的湿疹面积和严重程度指数得分≥16;
[0397]
在基线时的特应性皮炎受累的体表面积≥10%;
[0398]
在基线时的瘙痒数值评定量表得分≥4;以及
[0399]
在基线时的研究者总体评估得分为至少3。
[0400]
本公开还提供了一种治疗人类患者的特应性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂包含基于游离碱1.5%(重量/重量)的磷酸鲁索替尼;
[0401]
其中所述患者具有选自由以下组成的组的一种或多种特征:
[0402]
在基线时的湿疹面积和严重程度指数得分≥16;
[0403]
在基线时的特应性皮炎受累的体表面积≥10%;
[0404]
在基线时的瘙痒数值评定量表得分≥4;以及
[0405]
在基线时的研究者总体评估得分为至少3。
[0406]
在一些实施方案中,所述患者具有选自由以下组成的组的一种或多种特征:
[0407]
在基线时的湿疹面积和严重程度指数得分≥16;
[0408]
在基线时的特应性皮炎受累的体表面积≥10%;
[0409]
在基线时的瘙痒数值评定量表得分≥4;
[0410]
在基线时的研究者总体评估得分≥3;
[0411]
年龄在12至85岁之间;以及
[0412]
至少2年的特应性皮炎病史。
[0413]
在一些实施方案中,所述患者具有选自由以下组成的组的一种或多种特征:
[0414]
在基线时的湿疹面积和严重程度指数得分≥16;
[0415]
在基线时的特应性皮炎受累的体表面积≥10%;以及
[0416]
在基线时的研究者总体评估得分为3。
[0417]
在一些实施方案中,患者在基线时的湿疹面积和严重程度指数得分≥16。
[0418]
在一些实施方案中,患者在基线时的特应性皮炎受累的体表面积≥10%。
[0419]
在一些实施方案中,患者在基线时的特应性皮炎受累的体表面积为10%至20%。
[0420]
在一些实施方案中,患者在基线时的瘙痒数值评定量表得分≥4。
[0421]
在一些实施方案中,患者在基线时的研究者总体评估得分为3。
[0422]
在一些实施方案中,患者罹患中度特应性皮炎。
[0423]
在一些实施方案中,患者罹患中度至重度特应性皮炎。
[0424]
在一些实施方案中,患者在基线时的湿疹面积和严重程度指数≥ 16,并且在基线时的特应性皮炎受累的体表面积≥10%。在本段的实施方案的一些实施方案中,在基线时的特应性皮炎受累的体表面积可替代地为10%至20%。
[0425]
在一些实施方案中,患者在基线时的湿疹面积和严重程度指数得分≥16,在基线
时的特应性皮炎受累的体表面积≥10%,并且在基线时的瘙痒数值评定量表得分≥4。在本段的实施方案的一些实施方案中,在基线时的特应性皮炎受累的体表面积可替代地为10%至20%。
[0426]
在一些实施方案中,在基线时的湿疹面积和严重程度指数得分≥ 16并且在基线时的特应性皮炎受累的体表面积≥10%的患者,在所述施用的第2周达到湿疹面积和严重程度指数得分改善75%。在本段的实施方案的一些实施方案中,在基线时的特应性皮炎受累的体表面积可替代地为10%至20%。
[0427]
在一些实施方案中,在基线时的湿疹面积和严重程度指数得分≥ 16并且在基线时的特应性皮炎受累的体表面积≥10%的患者,在所述施用的第4周达到湿疹面积和严重程度指数得分改善75%。在本段的实施方案的一些实施方案中,在基线时的特应性皮炎受累的体表面积可替代地为10%至20%。
[0428]
在一些实施方案中,在基线时的湿疹面积和严重程度指数得分≥16并且在基线时的特应性皮炎受累的体表面积≥10%的患者,在所述施用的第8周达到湿疹面积和严重程度指数得分改善75%。在本段的实施方案的一些实施方案中,在基线时的特应性皮炎受累的体表面积可替代地为10%至20%。
[0429]
在一些实施方案中,在基线时的湿疹面积和严重程度指数得分≥ 16并且在基线时的特应性皮炎受累的体表面积≥10%的患者,在所述施用的第2周达到研究者总体评估得分为0或1且相对于基线改善至少2分。在本段的实施方案的一些实施方案中,在基线时的特应性皮炎受累的体表面积可替代地为10%至20%。
[0430]
在一些实施方案中,在基线时的湿疹面积和严重程度指数得分≥ 16并且在基线时的特应性皮炎受累的体表面积≥10%的患者,在所述施用的第4周达到研究者总体评估得分为0或1且相对于基线改善至少2分。在本段的实施方案的一些实施方案中,在基线时的特应性皮炎受累的体表面积可替代地为10%至20%。
[0431]
在一些实施方案中,在基线时的湿疹面积和严重程度指数得分≥ 16并且在基线时的特应性皮炎受累的体表面积≥10%的患者,在所述施用的第8周达到研究者总体评估得分为0或1且相对于基线改善至少2分。在本段的实施方案的一些实施方案中,在基线时的特应性皮炎受累的体表面积可替代地为10%至20%。
[0432]
在一些实施方案中,在基线时的湿疹面积和严重程度指数得分≥ 16并且在基线时的特应性皮炎受累的体表面积≥10%的患者,在所述施用的第2周达到瘙痒数值评定量表得分降低至少4分。在本段的实施方案的一些实施方案中,在基线时的特应性皮炎受累的体表面积可替代地为10%至20%。
[0433]
在一些实施方案中,在基线时的湿疹面积和严重程度指数得分≥ 16、在基线时的特应性皮炎受累的体表面积≥10%的患者,在所述施用的第4周达到瘙痒数值评定量表得分降低至少4分。在本段的实施方案的一些实施方案中,在基线时的特应性皮炎受累的体表面积可替代地为10%至20%。
[0434]
在一些实施方案中,在基线时的湿疹面积和严重程度指数得分≥ 16并且在基线时的特应性皮炎受累的体表面积≥10%的患者,在所述施用的第8周达到瘙痒数值评定量表得分降低至少4分。在本段的实施方案的一些实施方案中,在基线时的特应性皮炎受累的体表面积可替代地为10%至20%。
[0435]
在一些实施方案中,在基线时的湿疹面积和严重程度指数得分≥ 16、在基线时的特应性皮炎受累的体表面积≥10%并且在基线时瘙痒数值评定量表得分≥4的患者,在所述施用的第2周达到瘙痒数值评定量表得分降低至少4分。在本段的实施方案的一些实施方案中,在基线时的特应性皮炎受累的体表面积可替代地为10%至20%。
[0436]
在一些实施方案中,在基线时的湿疹面积和严重程度指数得分≥ 16、在基线时的特应性皮炎受累的体表面积≥10%并且在基线时瘙痒数值评定量表得分≥4的患者,在所述施用的第4周达到瘙痒数值评定量表得分降低至少4分。在本段的实施方案的一些实施方案中,在基线时的特应性皮炎受累的体表面积可替代地为10%至20%。
[0437]
在一些实施方案中,在基线时的湿疹面积和严重程度指数得分≥ 16,在基线时的特应性皮炎受累的体表面积≥10%并且在基线时瘙痒数值评定量表得分≥4的患者,在所述施用的第8周达到瘙痒数值评定量表得分降低至少4分。在本段的实施方案的一些实施方案中,在基线时的特应性皮炎受累的体表面积可替代地为10%至20%。
[0438]
在一些实施方案中,患者在基线时的湿疹面积和严重程度指数得分≥16,在基线时的特应性皮炎受累的体表面积≥10%,并且在筛选和基线访视时的研究者总体评估得分≥3。在本段的实施方案的一些实施方案中,在基线时的特应性皮炎受累的体表面积可替代地为10%至20%。
[0439]
在一些实施方案中,患者在基线时的湿疹面积和严重程度指数得分≥16,在基线时的特应性皮炎受累的体表面积≥10%,并且在筛选和基线访视时的研究者总体评估得分为3。在本段的实施方案的一些实施方案中,在基线时的特应性皮炎受累的体表面积可替代地为10%至20%。
[0440]
在一些实施方案中,患者具有包括以下的特征:在基线时的湿疹面积和严重程度指数≥16;在基线时的特应性皮炎受累的体表面积≥10%;年龄在12至85岁之间;以及至少2年的特应性皮炎病史。在一些实施方案中,所述特征还包括在筛选和基线访视时的研究者总体评估得分≥3。在一些实施方案中,所述特征还包括在筛选和基线访视时的研究者总体评估得分为3。在一些实施方案中,所述特征还包括在基线时的瘙痒数值评定量表得分≥4。在本段的实施方案的一些实施方案中,在基线时的特应性皮炎受累的体表面积可替代地为 10%至20%。
[0441]
本公开还提供了治疗人类患者的特应性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂包含基于游离碱0.75%(重量/重量)的磷酸鲁索替尼,
[0442]
其中所述施用维持至少8周,
[0443]
其中所述患者在所述施用的第8周达到瘙痒数值评定量表得分相对于基线降低至少4分,
[0444]
其中所述患者在所述施用的第8周达到研究者总体评估得分为0 或1且相对于基线改善至少2分,并且
[0445]
其中所述患者具有选自由以下组成的组的一种或多种特征:
[0446]
在基线时的湿疹面积和严重程度指数得分≥16;
[0447]
在基线时的特应性皮炎受累的体表面积≥10%;
[0448]
在基线时的瘙痒数值评定量表得分≥4;
[0449]
在基线时的研究者总体评估得分为至少3;
[0450]
年龄≥12岁;以及
[0451]
至少2年的特应性皮炎病史。
[0452]
本公开还提供了治疗人类患者的特应性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂包含基于游离碱0.75%(重量/重量)的磷酸鲁索替尼,
[0453]
其中所述施用维持至少8周,
[0454]
其中所述患者在所述施用的第8周达到瘙痒数值评定量表得分相对于基线降低至少4分,
[0455]
其中所述患者在所述施用的第8周达到研究者总体评估得分为0 或1且相对于基线改善至少2分,并且
[0456]
其中所述患者具有包括以下的特征:
[0457]
在基线时的湿疹面积和严重程度指数得分≥16;
[0458]
在基线时的特应性皮炎受累的体表面积≥10%;
[0459]
年龄≥12岁;以及
[0460]
至少2年的特应性皮炎病史。
[0461]
本公开还提供了治疗人类患者的特应性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂包含基于游离碱0.75%(重量/重量)的磷酸鲁索替尼,
[0462]
其中所述施用维持至少8周,
[0463]
其中所述患者在所述施用的第8周达到瘙痒数值评定量表得分相对于基线降低至少4分,
[0464]
其中所述患者在所述施用的第8周达到研究者总体评估得分为0 或1且相对于基线改善至少2分,并且
[0465]
其中所述患者具有包括以下的特征:
[0466]
在基线时的湿疹面积和严重程度指数得分≥16;
[0467]
在基线时的特应性皮炎受累的体表面积≥10%;
[0468]
在基线时的瘙痒数值评定量表得分≥4;
[0469]
年龄≥12岁;以及
[0470]
至少2年的特应性皮炎病史。
[0471]
本公开还提供了治疗人类患者的特应性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂包含基于游离碱0.75%(重量/重量)的磷酸鲁索替尼,
[0472]
其中所述施用维持至少8周,
[0473]
其中所述患者在所述施用的第8周达到瘙痒数值评定量表得分相对于基线降低至少4分,
[0474]
其中所述患者在所述施用的第8周达到研究者总体评估得分为0 或1且相对于基线改善至少2分,并且
[0475]
其中所述患者:
[0476]
在基线时的湿疹面积和严重程度指数得分≥16;
[0477]
在基线时的特应性皮炎受累的体表面积≥10%;
[0478]
在基线时的瘙痒数值评定量表得分≥4;
[0479]
在基线时的研究者总体评估得分为至少3;
[0480]
年龄≥12岁;并且
[0481]
具有至少2年的特应性皮炎病史。
[0482]
本公开还提供了治疗人类患者的特应性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂包含基于游离碱0.75%(重量/重量)的磷酸鲁索替尼,
[0483]
其中所述施用维持至少8周,
[0484]
其中所述患者在所述施用的第8周达到瘙痒数值评定量表得分相对于基线降低至少4分,
[0485]
其中所述患者在所述施用的第8周达到研究者总体评估得分为0 或1且相对于基线改善至少2分,并且
[0486]
其中所述患者:
[0487]
在基线时的湿疹面积和严重程度指数得分≥16;
[0488]
在基线时的特应性皮炎受累的体表面积≥10%;
[0489]
在基线时的瘙痒数值评定量表得分≥4;
[0490]
在筛选和基线访视时的研究者总体评估得分为3;
[0491]
年龄≥12岁;并且
[0492]
具有至少2年的特应性皮炎病史。
[0493]
在另一个实施方案中,本公开提供了一种治疗患有特应性皮炎的人类患者的特异性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用组合物,所述组合物包含:
[0494]
(1)基于游离碱0.75%(重量/重量)的磷酸鲁索替尼,和
[0495]
(2)用于实现所述磷酸鲁索替尼的剂量依赖性皮肤渗透的装置,其中所述患者达到iga治疗成功。
[0496]
在另一个实施方案中,本公开提供了一种治疗患有特应性皮炎的人类患者的特异性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用组合物,所述组合物包含:
[0497]
(1)基于游离碱0.75%(重量/重量)的磷酸鲁索替尼,和
[0498]
(2)用于实现所述磷酸鲁索替尼的剂量依赖性皮肤渗透的装置,其中所述患者达到easi-75。
[0499]
在另一个实施方案中,本公开提供了一种治疗患有特应性皮炎的人类患者的特异性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用组合物,所述组合物包含:
[0500]
(1)基于游离碱0.75%(重量/重量)的磷酸鲁索替尼,和
[0501]
(2)用于实现所述磷酸鲁索替尼的剂量依赖性皮肤渗透的装置,其中所述患者达到瘙痒数值评定量表得分相对于基线降低。
[0502]
在另一个实施方案中,本公开提供了一种治疗患有特应性皮炎的人类患者的特异性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用组合物,所述组合物包含:
[0503]
(1)基于游离碱0.75%(重量/重量)的磷酸鲁索替尼,和
[0504]
(2)用于实现所述磷酸鲁索替尼的剂量依赖性皮肤渗透的装置,其中所述患者达到瘙痒数值评定量表得分相对于基线改善至少4分。
[0505]
本公开还提供了治疗人类患者的特应性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂包含基于游离碱1.5%(重量/重量)的磷酸鲁索替尼,
[0506]
其中所述施用维持至少8周,
[0507]
其中所述患者在所述施用的第8周达到瘙痒数值评定量表得分相对于基线降低至少4分,
[0508]
其中所述患者在所述施用的第8周达到研究者总体评估得分为0 或1且相对于基线改善至少2分,并且
[0509]
其中所述患者具有选自由以下组成的组的一种或多种特征:
[0510]
在基线时的湿疹面积和严重程度指数得分≥16;
[0511]
在基线时的特应性皮炎受累的体表面积≥10%;
[0512]
在基线时的瘙痒数值评定量表得分≥4;
[0513]
在筛选和基线访视时的研究者总体评估得分≥3;
[0514]
年龄≥12岁;以及
[0515]
至少2年的特应性皮炎病史。
[0516]
本公开还提供了治疗人类患者的特应性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂包含基于游离碱1.5%(重量/重量)的磷酸鲁索替尼,
[0517]
其中所述施用维持至少8周,
[0518]
其中所述患者在所述施用的第8周达到瘙痒数值评定量表得分相对于基线降低至少4分,
[0519]
其中所述患者在所述施用的第8周达到研究者总体评估得分为0 或1且相对于基线改善至少2分,并且
[0520]
其中所述患者具有包括以下的特征:
[0521]
在基线时的湿疹面积和严重程度指数得分≥16;
[0522]
在基线时的特应性皮炎受累的体表面积≥10%;
[0523]
年龄≥12岁;以及
[0524]
至少2年的特应性皮炎病史。
[0525]
本公开还提供了治疗人类患者的特应性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂包含基于游离碱1.5%(重量/重量)的磷酸鲁索替尼,
[0526]
其中所述施用维持至少8周,
[0527]
其中所述患者在所述施用的第8周达到瘙痒数值评定量表得分相对于基线降低至
少4分,
[0528]
其中所述患者在所述施用的第8周达到研究者总体评估得分为0 或1且相对于基线改善至少2分,并且
[0529]
其中所述患者具有包括以下的特征:
[0530]
在基线时的湿疹面积和严重程度指数得分≥16;
[0531]
在基线时的特应性皮炎受累的体表面积≥10%;
[0532]
在基线时的瘙痒数值评定量表得分≥4;
[0533]
年龄≥12岁;以及
[0534]
至少2年的特应性皮炎病史。
[0535]
本公开还提供了治疗人类患者的特应性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂包含基于游离碱1.5%(重量/重量)的磷酸鲁索替尼,
[0536]
其中所述施用维持至少8周,
[0537]
其中所述患者在所述施用的第8周达到瘙痒数值评定量表得分相对于基线降低至少4分,
[0538]
其中所述患者在所述施用的第8周达到研究者总体评估得分为0 或1且相对于基线改善至少2分,并且
[0539]
其中所述患者:
[0540]
在基线时的湿疹面积和严重程度指数得分≥16;
[0541]
在基线时的特应性皮炎受累的体表面积≥10%;
[0542]
在基线时的瘙痒数值评定量表得分≥4;
[0543]
在筛选和基线访视时的研究者总体评估得分为至少3;
[0544]
年龄≥12岁;并且
[0545]
具有至少2年的特应性皮炎病史。
[0546]
本公开还提供了治疗人类患者的特应性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂包含基于游离碱1.5%(重量/重量)的磷酸鲁索替尼,
[0547]
其中所述施用维持至少8周,
[0548]
其中所述患者在所述施用的第8周达到瘙痒数值评定量表得分相对于基线降低至少4分,
[0549]
其中所述患者在所述施用的第8周达到研究者总体评估得分为0 或1且相对于基线改善至少2分,并且
[0550]
其中所述患者:
[0551]
在基线时的湿疹面积和严重程度指数得分≥16;
[0552]
在基线时的特应性皮炎受累的体表面积≥10%;
[0553]
在基线时的瘙痒数值评定量表得分≥4;
[0554]
在筛选和基线访视时的研究者总体评估得分为3;
[0555]
年龄≥12岁;并且
[0556]
具有至少2年的特应性皮炎病史。
[0557]
在另一个实施方案中,本公开提供了一种治疗患有特应性皮炎的人类患者的特异性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用组合物,所述组合物包含:
[0558]
(1)基于游离碱1.5%(重量/重量)的磷酸鲁索替尼,和
[0559]
(2)用于实现所述磷酸鲁索替尼的剂量依赖性皮肤渗透的装置,其中所述患者达到iga治疗成功。
[0560]
在另一个实施方案中,本公开提供了一种治疗患有特应性皮炎的人类患者的特异性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用组合物,所述组合物包含:
[0561]
(1)基于游离碱1.5%(重量/重量)的磷酸鲁索替尼,和
[0562]
(2)用于实现所述磷酸鲁索替尼的剂量依赖性皮肤渗透的装置,其中所述患者达到easi-75。
[0563]
在另一个实施方案中,本公开提供了一种治疗患有特应性皮炎的人类患者的特异性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用组合物,所述组合物包含:
[0564]
(1)基于游离碱1.5%(重量/重量)的磷酸鲁索替尼,和
[0565]
(2)用于实现所述磷酸鲁索替尼的剂量依赖性皮肤渗透的装置,其中所述患者达到瘙痒数值评定量表得分相对于基线降低。
[0566]
在另一个实施方案中,本公开提供了一种治疗患有特应性皮炎的人类患者的特异性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用组合物,所述组合物包含:
[0567]
(1)基于游离碱1.5%(重量/重量)的磷酸鲁索替尼,和
[0568]
(2)用于实现所述磷酸鲁索替尼的剂量依赖性皮肤渗透的装置,其中所述患者达到瘙痒数值评定量表得分相对于基线改善至少4分。
[0569]
定义
[0570]
如本文所用,“磷酸鲁索替尼”意指鲁索替尼的磷酸盐,其中鲁索替尼和磷酸的比例为1:1。
[0571]
在一些实施方案中,“乳膏”意指用于应用至皮肤的乳剂、半固体剂型。
[0572]
当方法提及“在第2天”、“在第4周”、“在第8周”、“在第12周”、“在36小时内”或“在12小时内”时,是指第一剂乳膏制剂之后的时间段,其中所述施用没有中断。例如,如果所述方法提及bid施用乳膏制剂的患者在第8周的瘙痒nrs得分相对于基线降低,这意指在未跳过任何日期的情况下在第一剂乳膏制剂之后的bid施用乳膏制剂的8周后评估瘙痒nrs得分。就瘙痒nrs而言,因为早晨应用鲁索替尼乳膏或媒介物且晚上测量瘙痒nrs(参见实施例中的2期和3 期研究),“在第1天”意指在施用的大约12小时后,“第2天”意指施用的大约36小时后,“第3天”意指施用的约2.5天后,等等。
[0573]
如本文所用,“瘙痒迅速减少”意指与媒介物相比,在第一次施用鲁索替尼乳膏的12小时内(或如本文所用“在第1天”),瘙痒nrs得分统计学上显著地降低。
[0574]“hanifin和rajika标准”在hanifin jm,rajka g.“diagnosticfeatures of atopic dermatitis,”acta derm venereol suppl(stockh)1980;92:44-47中有所描述,所
述文献以引用的方式整体并入本文。
[0575]
如本文所用,“%bsa”是指受ad影响的总体表面积的百分比。对于被确定为在基线时使用鲁索替尼乳膏治疗的区域(不包括面部和间擦区域;或者可替代地,不包括头皮),可以使用手掌作为指导,手指作为1%并且拇指作为0.1%,可以确定到最接近的0.1%(“手印”)。
[0576]
如本文所用,“瘙痒nrs得分”是指瘙痒数值评定量表。瘙痒nrs 是每日患者报告的瘙痒强度的衡量标准(24小时回忆)。将要求受试者通过选择从0(不痒)至10(可想象的最严重的瘙痒)之间的最能描述他们在过去24小时内最严重的瘙痒水平的数字来评定由于其ad引起的瘙痒严重程度。在一个非限制性实例中,可以向患者发放一个手持设备(ediary),在所述设备上记录瘙痒严重程度。可以指示患者每晚完成ediary。
[0577]
如本文所用,“easi”是指湿疹面积和严重程度指数。easi得分系统是经过验证的用于临床研究的疾病测量方法(hanifin jm,等人, exp dermatol 2001;10:11-18)。easi的严重程度分层如下:0=清除; 0.1至1.0=几乎清除;1.1至7.0=轻度;7.1至21.0=中度;21.1 至50.0=重度;50.1至72.0=非常重度。
[0578]
如本文所用,“easi-75”是指患者的湿疹面积和严重程度指数改善≥75%。
[0579]
如本文所用,“bid”是指每天两次。
[0580]
如本文所用,“qd”是指每天一次。
[0581]
如本文所用,“统计学上显著的”是指《0.05(优选《0.001,并且最优选《0.0001)的p值。
[0582]
如本文所用,“iga”是指研究者总体评估。iga的等级如下表所示:
[0583]
等级严重程度状态0清除没有ad的炎症体征1几乎清除仅可察觉的红斑和仅可察觉的丘疹/浸润2轻度疾病轻度红斑和轻度丘疹/浸润3中度疾病中度红斑和中度丘疹/浸润4重度疾病重度红斑和重度丘疹/浸润5非常重度疾病重度红斑和重度丘疹/浸润伴有渗出/结痂
[0584]
如本文所用,“iga-ts”意指研究者总体评估治疗成功,其是iga 得分为0或1且相对于基线改善≥2级。
[0585]
如本文所用,短语“药学上可接受的”意指在合理的医学判断范围内适用于与人和动物的组织接触的那些化合物、材料、组合物和/或剂型。在一些实施方案中,“药学上可接受的”意指由联邦或州政府的监管机构批准或在美国药典或其他公认的药典中列出用于动物,并且更具体地用于人类。
[0586]
本发明还包括本文所述化合物的药学上可接受的盐。如本文所用,“药学上可接受的盐”是指所公开化合物的衍生物,其中母体化合物通过将现有的酸或碱部分转化为其盐形式而被修饰。药学上可接受的盐的实例包括但不限于碱性残基诸如胺的无机或有机酸盐;酸性残基诸如羧酸的碱金属或有机盐;等等。本发明的药学上可接受的盐包括例如由无毒的无机或有机酸形成的母体化合物的无毒的盐。本发明的药学上可接受的盐可由含有碱或酸部分的母体化合物通过常规化学方法合成。一般来说,此类盐可通过使这些化合物的
游离酸或碱形式与水中或有机溶剂中或者二者的混合物中化学计算量的适当碱或酸反应来制备;一般来说优选非水性介质诸如醚、乙酸乙酯、乙醇、异丙醇或乙腈(mecn)。合适的盐的列表可在remington'spharmaceutical sciences,第17版,mack publishing company,easton, pa.,1985,第1418页和journal of pharmaceutical science,66,2 (1977),其各自均以引用的方式整体并入本文。在一些实施方案中,药学上可接受的盐是磷酸盐、硫酸盐或马来酸盐。
[0587]
如本文所用,“promis”是指患者报告的结果测量信息系统它是一组广泛使用和接受的患者报告的结果测量值,这些测量值已通过强大的临床结果评估开发方法进行开发并得到心理测量学的支持。选定的promis简表
–
睡眠相关损害(8a)和简表
–
睡眠障碍(8b)问卷已修改为使用24小时回忆每天用日记完成:简表
–
睡眠相关损害(8a)在媒介物对照期间的晚上收集,而简表
–
睡眠障碍(8b) 在早晨收集。
[0588]
如本文所用,“最小临床重要性差值”或“mcid”是指瘙痒nrs相对于基线降低2-3分。
[0589]
如本文所用,“临床相关改善”或“cri”是指瘙痒nrs相对于基线降低≥4分。
[0590]
如本文所用,术语“乳化剂组分”在一方面是指使元素或颗粒在流体介质内保持悬浮的物质或物质的混合物。在一些实施方案中,乳化剂组分允许油相在与水混合时形成乳剂。在一些实施方案中,乳化剂组分是指一种或多种非离子表面活性剂。
[0591]
如本文所用,术语“封闭剂组分”是指在皮肤上形成封闭膜的疏水剂或疏水剂的混合物,所述封闭膜通过防止水从角质层蒸发来减少经表皮水分丢失(tewl)。
[0592]
如本文所用,术语“硬化剂组分”是指增加乳膏的粘度和/或稠度或改善乳膏的流变性的物质或物质的混合物。
[0593]
如本文所用,术语“润肤剂组分”是指软化或舒缓皮肤或舒缓受刺激的内表面的剂。
[0594]
如本文所用,术语“稳定剂组分”是指改善乳膏的稳定性和/或乳膏中的组分的相容性的物质或物质的混合物。在一些实施方案中,稳定剂组分防止乳剂的附聚并稳定水包油乳胶中的液滴。
[0595]
如本文所用,术语“溶剂组分”是能够溶解乳膏中的鲁索替尼(或其盐)或其他物质的液体物质或液体物质的混合物。在一些实施方案中,溶剂组分是液体物质或液体物质的混合物,鲁索替尼或其药学上可接受的盐在其中具有合理的溶解度。例如,鲁索替尼(游离碱)或其磷酸盐(1:1盐)的溶解度报告在表1中。在一些实施方案中,溶剂是一种物质或其混合物,当如实施例2中所述测量时,鲁索替尼或其药学上可接受的盐(无论使用哪种)在其中具有至少约10mg/ml或更大、至少约15mg/ml或更大或至少约20mg/ml或更大的溶解度。
[0596]
如本文所用,短语“抗微生物防腐剂组分”是抑制乳膏中微生物生长的物质或物质的混合物。
[0597]
如本文所用,短语“螯合剂组分”是指具有与金属离子强烈结合的能力的化合物或化合物的混合物。
[0598]
如本文所用,“乳剂的重量%”意指乳剂中的组分基于重量/重量的浓度百分比。例如,组分a的1%重量/重量=[(组分a的质量)/(乳剂的总质量)]x 100。
[0599]
如本文所用,鲁索替尼或其药学上可接受的盐的“基于游离碱的乳剂的重量%”意
指基于总乳剂中鲁索替尼的重量来计算%重量/重量。例如,“基于游离碱1.5%重量/重量”的磷酸鲁索替尼意指对于100 克总制剂,乳剂中存在1.98克磷酸鲁索替尼(相当于1.5克游离碱鲁索替尼)。
[0600]
如本文所用,术语“组分”可以意指一种物质或物质的混合物。
[0601]
如本文所用,术语“脂肪酸”是指饱和或不饱和的脂族酸。在一些实施方案中,脂肪酸在不同脂肪酸的混合物中。在一些实施方案中,脂肪酸平均具有约八至约三十个碳。在一些实施方案中,脂肪酸平均具有约12至20、14-20或16-18个碳。合适的脂肪酸包括但不限于鲸蜡酸、硬脂酸、月桂酸、肉豆蔻酸、芥酸、棕榈酸、棕榈油酸、癸酸、辛酸、油酸、亚油酸、亚麻酸、羟基硬脂酸、12-羟基硬脂酸、鲸蜡硬脂酸、异硬脂酸、倍半油酸、倍半-9-十八烷酸、倍半异十八烷酸、山嵛酸、异山嵛酸和花生四烯酸或其混合物。
[0602]
如本文所用,术语“脂肪醇”是指饱和或不饱和的脂族醇。在一些实施方案中,脂肪醇在不同脂肪醇的混合物中。在一些实施方案中,脂肪醇平均具有约12至约20、约14至约20或约16至约18个碳。合适的脂肪醇包括但不限于硬脂醇、月桂醇、棕榈醇、鲸蜡醇、辛醇、辛酰醇、油醇、亚麻醇、花生四烯醇、山嵛醇、异山嵛醇、鲨油醇、鲛肝醇(chimyl alcohol)和亚油醇或其混合物。
[0603]
如本文所用,单独采用或与其他术语组合采用的术语“聚烯烃基二醇”是指含有氧化烯单体单元的聚合物,或不同氧化烯单体单元的共聚物,其中烯烃基具有2至6、2至4或2至3个碳原子。如本文所用,单独采用或与其他术语组合采用的术语“氧化烯”是指式-o-烯烃基-的基团。在一些实施方案中,聚烯烃基二醇是聚乙二醇。
[0604]
如本文所用,术语“山梨聚糖脂肪酸酯”包括衍生自山梨聚糖或山梨糖醇和脂肪酸以及任选的聚(乙二醇)单元的产物,包括山梨聚糖酯和聚乙氧基化山梨聚糖酯。在一些实施方案中,山梨聚糖脂肪酸酯是聚乙氧基化山梨聚糖酯。
[0605]
如本文所用,术语“山梨聚糖酯”是指衍生自山梨糖醇和至少一种脂肪酸的酯化的化合物或化合物的混合物。可用于衍生山梨聚糖酯的脂肪酸包括但不限于本文所述的那些。合适的山梨聚糖酯包括但不限于span
tm
系列(可从uniqema获得),其包括span 20(山梨聚糖单月桂酸酯)、40(山梨聚糖单棕榈酸酯)、60(山梨聚糖单硬脂酸酯)、65(山梨聚糖三硬脂酸酯)、80(山梨聚糖单油酸酯)和85(山梨聚糖三油酸酯)。其他合适的山梨聚糖酯包括列于r.c.rowe和p.j.shesky, handbook of pharmaceutical excipients,(2006),第5版中的那些,所述文献以引用的方式整体并入本文。
[0606]
如本文所用,术语“聚乙氧基化山梨聚糖酯”是指衍生自山梨聚糖酯的乙氧基化的化合物或其混合物。所述化合物的聚氧乙烯部分可以在脂肪酸酯与山梨聚糖部分之间。如本文所用,术语“山梨聚糖酯”是指衍生自山梨糖醇和至少一种脂肪酸的酯化的化合物或化合物的混合物。可用于衍生聚乙氧基化山梨聚糖酯的脂肪酸包括但不限于本文所述的那些。在一些实施方案中,所述化合物或混合物的聚氧乙烯部分具有约2至约200个氧乙烯单元。在一些实施方案中,所述化合物或混合物的聚氧乙烯部分具有约2至约100个氧乙烯单元。在一些实施方案中,所述化合物或混合物的聚氧乙烯部分具有约4至约80个氧乙烯单元。在一些实施方案中,所述化合物或混合物的聚氧乙烯部分具有约4至约40个氧乙烯单元。在一些实施方案中,所述化合物或混合物的聚氧乙烯部分具有约4至约20个氧乙烯单元。合适的聚乙氧基化山梨聚糖酯包括但不限于tween
tm
系列(可从uniqema获得),其包括
tween 20(poe(20)山梨聚糖单月桂酸酯)、21(poe(4)山梨聚糖单月桂酸酯)、40(poe(20)山梨聚糖单棕榈酸酯)、60(poe(20) 山梨聚糖单硬脂酸酯)、60k(poe(20)山梨聚糖单硬脂酸酯)、61 (poe(4)山梨聚糖单硬脂酸酯)、65(poe(20)山梨聚糖三硬脂酸酯)、 80(poe(20)山梨聚糖单油酸酯)、80k(poe(20)山梨聚糖单油酸酯)、 81(poe(5)山梨聚糖单油酸酯)和85(poe(20)山梨聚糖三油酸酯)。如本文所用,缩写“poe”是指聚氧乙烯。poe缩写之后的数字是指化合物中氧乙烯重复单元的数量。其他合适的聚乙氧基化山梨聚糖酯包括列于r.c.rowe和p.j.shesky,handbook of pharmaceuticalexcipients,(2006),第5版中的聚氧乙烯山梨聚糖脂肪酸酯,所述文献以引用的方式整体并入本文。在一些实施方案中,聚乙氧基化山梨聚糖酯是聚山梨醇酯。在一些实施方案中,聚乙氧基化山梨聚糖酯是聚山梨醇酯20。
[0607]
如本文所用,术语“甘油脂肪酸酯”是指脂肪酸的甘油单酯、甘油二酯或甘油三酯。甘油脂肪酸酯可以任选地被磺酸基团或其药学上可接受的盐取代。用于衍生脂肪酸的甘油酯的合适的脂肪酸包括但不限于本文所述的那些。在一些实施方案中,甘油脂肪酸酯是具有12至 18个碳原子的脂肪酸的甘油单酯。在一些实施方案中,甘油脂肪酸酯是甘油硬脂酸酯。
[0608]
如本文所用,术语“甘油三酯”是指脂肪酸的甘油三酯。在一些实施方案中,甘油三酯是中链甘油三酯。
[0609]
如本文所用,术语“烯烃基二醇”是指式-o-烯烃基-的基团,其中烯烃基具有2至6、2至4或2至3个碳原子。在一些实施方案中,烯烃基二醇是丙二醇(1,2-丙二醇)。
[0610]
如本文所用,术语“聚乙二醇”是指含有式-o-ch
2-ch
2-的乙二醇单体单元的聚合物。合适的聚乙二醇可以在聚合物分子的每一端具有游离羟基,或者可以具有一个或多个用低级烷基(例如甲基)醚化的羟基。同样合适的是具有可酯化羧基的聚乙二醇的衍生物。可用于本公开的聚乙二醇可以是任何链长或分子量的聚合物,并且可以包括支化。在一些实施方案中,聚乙二醇的平均分子量为约200至约9000。在一些实施方案中,聚乙二醇的平均分子量为约200至约5000。在一些实施方案中,聚乙二醇的平均分子量为约200至约900。在一些实施方案中,聚乙二醇的平均分子量为约400。合适的聚乙二醇包括但不限于聚乙二醇-200、聚乙二醇-300、聚乙二醇-400、聚乙二醇-600 和聚乙二醇-900。名称中破折号后面的数字是指聚合物的平均分子量。
[0611]
在一些实施方案中,“约”意指所述值的正负10%。
[0612]
乳膏制剂
[0613]
在一些实施方案中,乳膏制剂是水包油乳剂。在一些实施方案中,乳膏是增溶乳膏。在一些实施方案中,乳膏的ph为约2.8至约3.6。在ph的上下文中,“约”是指
±
0.3(优选
±
0.2或更优选
±
0.1)。
[0614]
在一些实施方案中,乳膏包括水包油乳剂,其包含基于游离碱 1.5%(重量/重量)的磷酸鲁索替尼。
[0615]
在一些实施方案中,乳膏是如us 2015/0250790中所述的水包油乳剂,所述专利以引用的方式整体并入本文。具体地,us2015/0250790的实施例3-6(并且特别是表3-5和随附文本)以引用的方式并入本文。
[0616]
在一些实施方案中,油组分以乳剂重量的约10%至约40%的量存在。
[0617]
在一些实施方案中,油组分以乳剂重量的约10%至约24%的量存在。
[0618]
在一些实施方案中,油组分以乳剂重量的约15%至约24%的量存在。
[0619]
在一些实施方案中,油组分以乳剂重量的约18%至约24%的量存在。
[0620]
在一些实施方案中,油组分包括一种或多种独立地选自凡士林、脂肪醇、矿物油、甘油三酯和硅油的物质。
[0621]
在一些实施方案中,油组分包括一种或多种独立地选自白凡士林、鲸蜡醇、硬脂醇、轻质矿物油、中链甘油三酯和聚二甲基硅氧烷的物质。
[0622]
在一些实施方案中,油组分包括封闭剂组分。
[0623]
在一些实施方案中,封闭剂组分以乳剂重量的约2%至约15%的量存在。
[0624]
在一些实施方案中,封闭剂组分以乳剂重量的约5%至约10%的量存在。
[0625]
在一些实施方案中,封闭剂组分包括一种或多种选自以下的物质:脂肪酸(例如羊毛脂酸)、脂肪醇(例如羊毛脂醇)、烃油和蜡(例如凡士林)、多元醇(例如丙二醇)、硅氧烷(例如聚二甲基硅氧烷)、固醇(例如胆固醇)、植物或动物脂肪(例如可可脂)、植物蜡(例如巴西棕榈蜡) 和蜡酯(例如蜂蜡)。
[0626]
在一些实施方案中,封闭剂组分包括一种或多种选自羊毛酸脂肪醇、羊毛脂醇、凡士林、丙二醇、聚二甲基硅氧烷、胆固醇、可可脂、巴西棕榈蜡和蜂蜡的物质。
[0627]
在一些实施方案中,封闭剂组分包括凡士林。
[0628]
在一些实施方案中,封闭剂组分包括白凡士林。
[0629]
在一些实施方案中,油组分包括硬化剂组分。
[0630]
在一些实施方案中,硬化剂组分以乳剂重量的约2%至约8%的量存在。
[0631]
在一些实施方案中,硬化剂组分以乳剂重量的约3%至约6%的量存在。
[0632]
在一些实施方案中,硬化剂组分以乳剂重量的约4%至约7%的量存在。
[0633]
在一些实施方案中,硬化剂组分包括一种或多种独立地选自脂肪醇的物质。
[0634]
在一些实施方案中,硬化剂组分包括一种或多种独立地选自 c
12-20
脂肪醇的物质。
[0635]
在一些实施方案中,硬化剂组分包括一种或多种独立地选自 c
16-18
脂肪醇的物质。
[0636]
在一些实施方案中,硬化剂组分包括一种或多种独立地选自鲸蜡醇和硬脂醇的物质。
[0637]
在一些实施方案中,油组分包括润肤剂组分。
[0638]
在一些实施方案中,润肤剂组分以乳剂重量的约5%至约15%的量存在。
[0639]
在一些实施方案中,润肤剂组分以乳剂重量的约7%至约13%的量存在。
[0640]
在一些实施方案中,润肤剂组分包括一种或多种独立地选自矿物油和甘油三酯的物质。
[0641]
在一些实施方案中,润肤剂组分包括一种或多种独立地选自轻质矿物油和中链甘油三酯的物质。
[0642]
在一些实施方案中,润肤剂组分包括一种或多种独立地选自轻质矿物油、中链甘油三酯和聚二甲基硅氧烷的物质。
[0643]
在一些实施方案中,水以乳剂重量的约35%至约65%的量存在。
[0644]
在一些实施方案中,水以乳剂重量的约40%至约60%的量存在。
[0645]
在一些实施方案中,水以乳剂重量的约45%至约55%的量存在。
[0646]
在一些实施方案中,乳化剂组分以乳剂重量的约1%至约9%的量存在。
[0647]
在一些实施方案中,乳化剂组分以乳剂重量的约2%至约6%的量存在。
[0648]
在一些实施方案中,乳化剂组分以乳剂重量的约3%至约5%的量存在。
[0649]
在一些实施方案中,乳化剂组分以乳剂重量的约4%至约7%的量存在。
[0650]
在一些实施方案中,乳剂包含乳化剂组分和硬化剂组分,其中乳化剂组分和硬化剂组分的组合量为乳剂重量的至少约8%。
[0651]
在一些实施方案中,乳化剂组分包括一种或多种独立地选自甘油脂肪酸酯和山梨聚糖脂肪酸酯的物质。
[0652]
在一些实施方案中,乳化剂组分包括一种或多种独立地选自甘油硬脂酸酯和聚山梨醇酯20的物质。
[0653]
在一些实施方案中,乳剂还包含稳定剂组分。
[0654]
在一些实施方案中,稳定剂组分以乳剂重量的约0.05%至约5%的量存在。
[0655]
在一些实施方案中,稳定剂组分以乳剂重量的约0.1%至约2%的量存在。
[0656]
在一些实施方案中,稳定剂组分以乳剂重量的约0.3%至约0.5%的量存在。
[0657]
在一些实施方案中,稳定剂组分包括一种或多种独立地选自多糖的物质。
[0658]
在一些实施方案中,稳定剂组分包括黄原胶。
[0659]
在一些实施方案中,乳剂还包含溶剂组分。
[0660]
在一些实施方案中,溶剂组分以乳剂重量的约10%至约35%的量存在。
[0661]
在一些实施方案中,溶剂组分以乳剂重量的约15%至约30%的量存在。
[0662]
在一些实施方案中,溶剂组分以乳剂重量的约20%至约25%的量存在。
[0663]
在一些实施方案中,溶剂组分包括一种或多种独立地选自烯烃基二醇和聚烯烃基二醇的物质。
[0664]
在一些实施方案中,溶剂组分包括一种或多种独立地选自丙二醇和聚乙二醇的物质。
[0665]
在一些实施方案中,乳剂包含:
[0666]
乳剂重量的约35%至约65%的水;
[0667]
乳剂重量的约10%至约40%的油组分;
[0668]
乳剂重量的约1%至约9%的乳化剂组分;
[0669]
乳剂重量的约10%至约35%的溶剂组分;
[0670]
乳剂重量的约0.05%至约5%的稳定剂组分;和
[0671]
乳剂重量的基于游离碱0.5%至1.5%的鲁索替尼或其药学上可接受的盐。
[0672]
在一些实施方案中,乳剂包含:
[0673]
乳剂重量的约35%至约65%的水;
[0674]
乳剂重量的约10%至约24%的油组分;
[0675]
乳剂重量的约1%至约9%的乳化剂组分;
[0676]
乳剂重量的约10%至约35%的溶剂组分;
[0677]
乳剂重量的约0.05%至约5%的稳定剂组分;和
[0678]
乳剂重量的基于游离碱0.5%至1.5%的鲁索替尼或其药学上可接受的盐。
[0679]
在一些实施方案中,乳剂包含:
[0680]
乳剂重量的约40%至约60%的水;
[0681]
乳剂重量的约15%至约30%的油组分;
[0682]
乳剂重量的约2%至约6%的乳化剂组分;
[0683]
乳剂重量的约15%至约30%的溶剂组分;
[0684]
乳剂重量的约0.1%至约2%的稳定剂组分;和
[0685]
乳剂重量的基于游离碱0.5%至1.5%的鲁索替尼或其药学上可接受的盐。
[0686]
在一些实施方案中,乳剂包含:
[0687]
乳剂重量的约40%至约60%的水;
[0688]
乳剂重量的约15%至约30%的油组分;
[0689]
乳剂重量的约2%至约6%的乳化剂组分;
[0690]
乳剂重量的约15%至约24%的溶剂组分;
[0691]
乳剂重量的约0.1%至约2%的稳定剂组分;和
[0692]
乳剂重量的基于游离碱0.5%至1.5%的鲁索替尼或其药学上可接受的盐。
[0693]
在一些实施方案中,乳剂包含:
[0694]
乳剂重量的约45%至约55%的水;
[0695]
乳剂重量的约15%至约24%的油组分;
[0696]
乳剂重量的约3%至约5%的乳化剂组分;
[0697]
乳剂重量的约20%至约25%的溶剂组分;
[0698]
乳剂重量的约0.3%至约0.5%的稳定剂组分;和
[0699]
乳剂重量的基于游离碱0.5%至1.5%的鲁索替尼或其药学上可接受的盐。
[0700]
在一些实施方案中,乳剂包含:
[0701]
乳剂重量的约45%至约55%的水;
[0702]
乳剂重量的约15%至约24%的油组分;
[0703]
乳剂重量的约4%至约7%的乳化剂组分;
[0704]
乳剂重量的约20%至约25%的溶剂组分;
[0705]
乳剂重量的约0.3%至约0.5%的稳定剂组分;和
[0706]
乳剂重量的基于游离碱0.5%至1.5%的鲁索替尼或其药学上可接受的盐。
[0707]
在一些实施方案中:
[0708]
油组分包括一种或多种独立地选自凡士林、脂肪醇、矿物油、甘油三酯和聚二甲基硅氧烷的物质;
[0709]
乳化剂组分包括一种或多种独立地选自甘油脂肪酸酯和山梨聚糖脂肪酸酯的物质;
[0710]
溶剂组分包括一种或多种独立地选自烯烃基二醇和聚烯烃基二醇的物质;并且
[0711]
稳定剂组分包括一种或多种独立地选自多糖的物质。
[0712]
在一些实施方案中:
[0713]
油组分包括一种或多种独立地选自白凡士林、鲸蜡醇、硬脂醇、轻质矿物油、中链甘油三酯和聚二甲基硅氧烷的物质;
[0714]
乳化剂组分包括一种或多种独立地选自甘油硬脂酸酯和聚山梨醇酯20的物质;
[0715]
溶剂组分包括一种或多种独立地选自丙二醇和聚乙二醇的物质;并且
[0716]
稳定剂组分包括黄原胶。
[0717]
在一些实施方案中,乳剂包含:
[0718]
乳剂重量的约35%至约65%的水;
[0719]
乳剂重量的约2%至约15%的封闭剂组分;
[0720]
乳剂重量的约2%至约8%的硬化剂组分;
[0721]
乳剂重量的约5%至约15%的润肤剂组分;
[0722]
乳剂重量的约1%至约9%的乳化剂组分;
[0723]
乳剂重量的约0.05%至约5%的稳定剂组分;
[0724]
乳剂重量的约10%至约35%的溶剂组分;和
[0725]
乳剂重量的基于游离碱0.5%至1.5%的鲁索替尼或其药学上可接受的盐。
[0726]
在一些实施方案中,乳剂包含:
[0727]
乳剂重量的约40%至约60%的水;
[0728]
乳剂重量的约5%至约10%的封闭剂组分;
[0729]
乳剂重量的约2%至约8%的硬化剂组分;
[0730]
乳剂重量的约7%至约12%的润肤剂组分;
[0731]
乳剂重量的约2%至约6%的乳化剂组分;
[0732]
乳剂重量的约0.1%至约2%的稳定剂;
[0733]
乳剂重量的约15%至约30%的溶剂组分;和
[0734]
乳剂重量的基于游离碱0.5%至1.5%的鲁索替尼或其药学上可接受的盐。
[0735]
在一些实施方案中,乳剂包含:
[0736]
乳剂重量的约45%至约55%的水;
[0737]
乳剂重量的约5%至约10%的封闭剂组分;
[0738]
乳剂重量的约3%至约6%的硬化剂组分;
[0739]
乳剂重量的约7%至约13%的润肤剂组分;
[0740]
乳剂重量的约3%至约5%的乳化剂组分;
[0741]
乳剂重量的约0.3%至约0.5%的稳定剂组分;
[0742]
乳剂重量的约20%至约25%的溶剂组分;和
[0743]
乳剂重量的基于游离碱0.5%至1.5%的鲁索替尼或其药学上可接受的盐。
[0744]
在一些实施方案中,乳剂包含:
[0745]
乳剂重量的约45%至约55%的水;
[0746]
乳剂重量的约5%至约10%的封闭剂组分;
[0747]
乳剂重量的约4%至约7%的硬化剂组分;
[0748]
乳剂重量的约7%至约13%的润肤剂组分;
[0749]
乳剂重量的约4%至约7%的乳化剂组分;
[0750]
乳剂重量的约0.3%至约0.5%的稳定剂组分;
[0751]
乳剂重量的约20%至约25%的溶剂组分;和
[0752]
乳剂重量的基于游离碱0.5%至1.5%的鲁索替尼或其药学上可接受的盐。
[0753]
在一些实施方案中,乳剂包含:
[0754]
乳剂重量的约45%至约55%的水;
[0755]
乳剂重量的约7%的封闭剂组分;
[0756]
乳剂重量的约4.5%至约5%的硬化剂组分;
[0757]
乳剂重量的约10%的润肤剂组分;
[0758]
乳剂重量的约4%至约4.5%的乳化剂组分;
[0759]
乳剂重量的约0.4%的稳定剂组分;
[0760]
乳剂重量的约22%的溶剂组分;和
[0761]
乳剂重量的基于游离碱0.5%至1.5%的鲁索替尼或其药学上可接受的盐。
[0762]
在一些实施方案中,鲁索替尼或其药学上可接受的盐以磷酸鲁索替尼形式存在。
[0763]
在一些实施方案中,乳剂包含乳剂重量的1.5%的鲁索替尼或其药学上可接受的盐。
[0764]
在一些实施方案中,乳剂包含乳剂重量的1.5%的磷酸鲁索替尼。
[0765]
在一些实施方案中,乳剂包含乳剂重量的0.75%的鲁索替尼或其药学上可接受的盐。
[0766]
在一些实施方案中,乳剂包含乳剂重量的0.75%的磷酸鲁索替尼。
[0767]
在一些实施方案中,硬化剂组分和乳化剂组分的组合量为乳剂重量的至少约8%。
[0768]
在一些实施方案中:
[0769]
封闭剂组分包括凡士林;
[0770]
硬化剂组分包括一种或多种独立地选自一种或多种脂肪醇的物质;
[0771]
润肤剂组分包括一种或多种独立地选自矿物油和甘油三酯的物质;
[0772]
乳化剂组分包括一种或多种独立地选自甘油脂肪酸酯和山梨聚糖脂肪酸酯的物质;
[0773]
稳定剂组分包括一种或多种独立地选自多糖的物质;并且
[0774]
溶剂组分包括一种或多种独立地选自烯烃基二醇和聚烯烃基二醇的物质。
[0775]
在一些实施方案中:
[0776]
封闭剂组分包括白凡士林;
[0777]
硬化剂组分包括一种或多种独立地选自鲸蜡醇和硬脂醇的物质;
[0778]
润肤剂组分包括一种或多种独立地选自轻质矿物油、中链甘油三酯和聚二甲基硅氧烷的物质;
[0779]
乳化剂组分包括一种或多种独立地选自甘油硬脂酸酯和聚山梨醇酯20的物质;
[0780]
稳定剂组分包括黄原胶;并且
[0781]
溶剂组分包括一种或多种独立地选自丙二醇和聚乙二醇的物质。
[0782]
在一些实施方案中,乳剂还包含抗微生物防腐剂组分。
[0783]
在一些实施方案中,抗微生物防腐剂组分以乳剂重量的约0.05%至约3%的量存在。
[0784]
在一些实施方案中,抗微生物防腐剂组分以乳剂重量的约0.1%至约1%的量存在。
[0785]
在一些实施方案中,抗微生物防腐剂组分包括一种或多种独立地选自对羟基苯甲酸烷基酯和苯氧乙醇的物质。
[0786]
在一些实施方案中,抗微生物防腐剂组分包括一种或多种独立地选自对羟基苯甲
酸甲酯、对羟基苯甲酸丙酯和苯氧乙醇的物质。
[0787]
在一些实施方案中,乳剂还包含螯合剂组分。
[0788]
在一些实施方案中,螯合剂组分包括依地酸二钠。
[0789]
鲁索替尼可以如美国专利7,598,257和美国专利公开号 2009/0181959中所述来制备,所述专利各自以引用的方式整体并入本文。鲁索替尼的1:1磷酸盐可以如美国专利公开号2008/0312259中所述来制备,所述专利以引用的方式整体并入本文。
[0790]
如将理解的,本文所述的乳膏(乳剂)的一些组分可以具有多种功能。例如,给定的物质既可以充当乳化剂组分,也可以充当稳定剂。在一些此类情况下,给定组分的功能可以被认为是单一的,即使它的特性可能允许多种功能性。在一些实施方案中,制剂的每种组分包含不同的物质或物质的混合物。
[0791]
还应理解,为了清楚起见而在单独实施方案的上下文中描述的本公开的某些特征也可以在单个实施方案中组合地提供。相反,为了简明起见而在单个实施方案的上下文中描述的本公开的各种特征还可分开提供或以任何合适的子组合形式提供。
[0792]
提供了以下实施方案:
[0793]
1.一种减少患有特应性皮炎的人类患者的瘙痒的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂包含基于游离碱1.5%(重量/重量)的磷酸鲁索替尼,
[0794]
其中所述患者达到瘙痒数值评定量表得分相对于基线降低。
[0795]
2.如实施方案1所述的方法,其中所述患者:
[0796]
年龄在18至70岁之间,
[0797]
已被诊断患有特应性皮炎至少2年,
[0798]
在筛选和基线时的iga得分为2至3,并且
[0799]
在基线时的特应性皮炎受累的bsa(不包括面部和间擦区域)为 3%至20%。
[0800]
3.如实施方案1或2所述的方法,其中所述患者被诊断患有如 hanifin和rajika标准所定义的特应性皮炎。
[0801]
4.如实施方案1-3中任一项所述的方法,其中所述每天两次施用相隔至少8小时。
[0802]
5.如实施方案1-4中任一项所述的方法,其中所述乳膏制剂是水包油乳剂,其包含所述基于游离碱1.5%(重量/重量)的磷酸鲁索替尼。
[0803]
6.如实施方案1-5中任一项所述的方法,其中所述乳膏制剂的 ph为约2.8至约3.6。
[0804]
7.如实施方案1-6中任一项所述的方法,其中所述乳膏制剂是增溶乳膏。
[0805]
8.如实施方案1-7中任一项所述的方法,其中与在同一时期施用安慰剂的患者相比,所述患者在所述施用的第2天达到瘙痒数值评定量表得分相对于基线统计学上显著地降低。
[0806]
9.如实施方案1-8中任一项所述的方法,其中所述患者在所述施用的第2天达到瘙痒数值评定量表得分相对于基线降低至少1.5分。
[0807]
10.如实施方案1-9中任一项所述的方法,其中与在同一时期施用安慰剂的患者相比,所述患者在所述施用的第2周达到瘙痒数值评定量表得分相对于基线统计学上显著地降低。
[0808]
11.如实施方案1-10中任一项所述的方法,其中所述患者在所述施用的第2周达到瘙痒数值评定量表得分相对于基线降低至少3分。
[0809]
12.如实施方案1-11中任一项所述的方法,其中与在同一时期施用安慰剂的患者相比,所述患者在所述施用的第4周达到瘙痒数值评定量表得分相对于基线统计学上显著地降低。
[0810]
13.如实施方案1-12中任一项所述的方法,其中所述患者在所述施用的第4周达到瘙痒数值评定量表得分相对于基线降低至少3分。
[0811]
14.如实施方案1-13中任一项所述的方法,其中与在同一时期施用安慰剂的患者相比,所述患者在所述施用的第8周达到瘙痒数值评定量表得分相对于基线统计学上显著地降低。
[0812]
15.如实施方案1-14中任一项所述的方法,其中所述患者在所述施用的第8周达到瘙痒数值评定量表得分相对于基线降低至少3分。
[0813]
16.如实施方案1-15中任一项所述的方法,其中所述患者在所述施用的第8周达到瘙痒数值评定量表得分相对于基线降低至少4分。
[0814]
17.如实施方案1-16中任一项所述的方法,其中所述患者在所述施用的第12周达到瘙痒数值评定量表得分相对于基线降低至少4.5 分。
[0815]
18.如实施方案1-17中任一项所述的方法,其中所述施用逆转特应性皮炎的症候学。
[0816]
19.如实施方案1-18中任一项所述的方法,其中与在同一时期施用安慰剂的患者相比,所述患者在所述施用的第4周达到湿疹面积和严重程度指数得分相对于基线统计学上显著地改善。
[0817]
20.如实施方案1-19中任一项所述的方法,其中与在同一时期施用安慰剂的患者相比,所述患者在所述施用的第8周达到湿疹面积和严重程度指数得分相对于基线统计学上显著地改善。
[0818]
21.如实施方案1-20中任一项所述的方法,其中所述患者在所述施用的第2周达到湿疹面积和严重程度指数得分相对于基线改善 75%。
[0819]
22.如实施方案1-21中任一项所述的方法,其中所述患者在所述施用的第4周达到湿疹面积和严重程度指数得分相对于基线改善75%。
[0820]
23.如实施方案1-22中任一项所述的方法,其中所述患者在所述施用的第8周达到湿疹面积和严重程度指数得分相对于基线改善 75%。
[0821]
24.如实施方案1-23中任一项所述的方法,其中所述患者在所述施用的第12周达到湿疹面积和严重程度指数得分相对于基线改善 75%。
[0822]
25.如实施方案1-24中任一项所述的方法,其中所述患者在所述施用的第2周达到研究者总体评估得分为0或1且相对于基线改善至少2分。
[0823]
26.如实施方案1-25中任一项所述的方法,其中所述患者在所述施用的第4周达到研究者总体评估得分为0或1且相对于基线改善至少2分。
[0824]
27.如实施方案1-26中任一项所述的方法,其中所述患者在所述施用的第8周达到研究者总体评估得分为0或1且相对于基线改善至少2分。
[0825]
28.如实施方案1-27中任一项所述的方法,其中所述患者在第8 周达到promis简
表
–
睡眠障碍(8b)24小时回忆得分的临床上有意义的改善。
[0826]
29.如实施方案1-28中任一项所述的方法,其中所述施用维持至少2周。
[0827]
30.如实施方案1-29中任一项所述的方法,其中所述施用维持至少4周。
[0828]
31.如实施方案1-30中任一项所述的方法,其中所述施用维持至少8周。
[0829]
32.如实施方案1-31中任一项所述的方法,其中所述施用维持至少12周。
[0830]
33.如实施方案1-32中任一项所述的方法,其中所述患者在基线的2周内未使用除温和润肤剂外的特应性皮炎的局部治疗;并且在基线的4周内未使用全身性免疫抑制或全身性免疫调节药物。
[0831]
34.如实施方案1-33中任一项所述的方法,其中所述患者未施用用于治疗特应性皮炎的其他治疗剂。
[0832]
35.一种减少患有特应性皮炎的人类患者的瘙痒的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂是水包油乳剂,其包含基于游离碱1.5%(重量/重量)的磷酸鲁索替尼,
[0833]
其中所述施用维持至少8周,
[0834]
其中所述患者在所述施用的第8周达到瘙痒nrs得分相对于基线降低至少4分,并且
[0835]
其中所述患者在所述施用的第8周达到研究者总体评估得分为0 或1且相对于基线改善至少2分。
[0836]
36.如实施方案35所述的方法,其中所述患者在所述施用的第8 周达到研究者总体评估得分为0或1且相对于基线改善至少2分。
[0837]
37.如实施方案35或36所述的方法,其中所述患者:
[0838]
年龄在18至70岁之间,
[0839]
已被诊断患有特应性皮炎至少2年,
[0840]
在筛选和基线时的iga得分为2至3,并且
[0841]
在基线时的特应性皮炎受累的bsa(不包括面部和间擦区域)为 3%至20%。
[0842]
38.一种减少患有特应性皮炎的人类患者的瘙痒的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂包含基于游离碱1.5%(重量/重量)的鲁索替尼或其药学上可接受的盐,
[0843]
其中所述患者达到瘙痒数值评定量表得分相对于基线降低。
[0844]
39.一种减少患有特应性皮炎的人类患者的瘙痒的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂包含基于游离碱0.75%(重量/重量)的鲁索替尼或其药学上可接受的盐,
[0845]
其中所述患者达到瘙痒数值评定量表得分相对于基线降低。
[0846]
40.如实施方案38或39所述的方法,其中所述鲁索替尼或其药学上可接受的盐是磷酸鲁索替尼。
[0847]
41.如实施方案38-40中任一项所述的方法,其中所述患者:
[0848]
年龄在18至70岁之间,
[0849]
已被诊断患有特应性皮炎至少2年,
[0850]
在筛选和基线时的研究者总体评估得分为2至3,并且
[0851]
在基线时的特应性皮炎受累的bsa(不包括面部和间擦区域)为 3%至20%。
[0852]
42.如实施方案38-41中任一项所述的方法,其中所述患者被诊断患有如hanifin和rajika标准所定义的特应性皮炎。
[0853]
43.如实施方案38-42中任一项所述的方法,其中所述患者达到瘙痒数值评定量表得分相对于基线改善至少4分。
[0854]
44.如实施方案38-43中任一项所述的方法,其中所述患者达到瘙痒数值评定量表得分相对于基线改善至少4分,其中所述患者的基线数值评定量表得分等于或大于4。
[0855]
45.如实施方案38-44中任一项所述的方法,其中所述患者在所述施用的2周后达到瘙痒数值评定量表得分相对于基线改善至少4 分,其中所述患者的基线数值评定量表得分等于或大于4。
[0856]
46.如实施方案38-45中任一项所述的方法,其中所述患者在所述施用的4周后达到瘙痒数值评定量表得分相对于基线改善至少4 分,其中所述患者的基线数值评定量表得分等于或大于4。
[0857]
47.如实施方案38-46中任一项所述的方法,其中所述患者在所述施用的8周后达到瘙痒数值评定量表得分相对于基线改善至少4 分,其中所述患者的基线数值评定量表得分等于或大于4。
[0858]
48.如实施方案38-47中任一项所述的方法,其中所述患者在所述施用的第2天达到瘙痒数值评定量表得分相对于基线改善至少2 分。
[0859]
49.如实施方案38-49中任一项所述的方法,其中所述患者达到瘙痒迅速减少。
[0860]
50.如实施方案38-49中任一项所述的方法,其中所述患者在所述施用的第1天达到了统计学上显著的瘙痒减少。
[0861]
51.如实施方案38-50中任一项所述的方法,其中与在同一时期施用安慰剂的患者相比,所述患者在所述施用的第1天达到瘙痒数值评定量表得分相对于基线统计学上显著地降低。
[0862]
52.如实施方案38-51中任一项所述的方法,其中所述患者在所述施用的第1天达到瘙痒数值评定量表得分相对于基线降低至少1 分。
[0863]
53.如实施方案38-52中任一项所述的方法,其中与在同一时期施用安慰剂的患者相比,所述患者在所述施用的第2天达到瘙痒数值评定量表得分相对于基线统计学上显著地降低。
[0864]
54.如实施方案38-53中任一项所述的方法,其中所述患者在所述施用的第2天达到瘙痒数值评定量表得分相对于基线降低至少2 分。
[0865]
55.如实施方案38-54中任一项所述的方法,其中所述患者在所述施用的第2周达到瘙痒数值评定量表得分相对于基线降低至少3 分。
[0866]
56.如实施方案38-55中任一项所述的方法,其中所述患者在所述施用的第4周达到瘙痒数值评定量表得分相对于基线降低至少3 分。
[0867]
57.如实施方案38-56中任一项所述的方法,其中所述患者在所述施用的第8周达到瘙痒数值评定量表得分相对于基线降低至少3 分。
[0868]
58.如实施方案38-57中任一项所述的方法,其中所述患者在所述施用的第2周达到瘙痒数值评定量表得分相对于基线降低至少4 分。
[0869]
59.如实施方案38-58中任一项所述的方法,其中所述患者在所述施用的第4周达到瘙痒数值评定量表得分相对于基线降低至少4 分。
[0870]
60.如实施方案38-59中任一项所述的方法,其中所述患者在所述施用的第8周达到瘙痒数值评定量表得分相对于基线降低至少4 分。
[0871]
61.如实施方案38-60中任一项所述的方法,其中所述施用逆转特应性皮炎的症候学。
[0872]
62.如实施方案38-61中任一项所述的方法,其中与在同一时期施用安慰剂的患者相比,所述患者在所述施用的第4周达到湿疹面积和严重程度指数得分相对于基线统计学上显著地改善。
[0873]
63.如实施方案38-62中任一项所述的方法,其中与在同一时期施用安慰剂的患者相比,所述患者在所述施用的第8周达到湿疹面积和严重程度指数得分相对于基线统计学上显著地改善。
[0874]
64.如实施方案38-63中任一项所述的方法,其中所述患者在所述施用的第2周达到湿疹面积和严重程度指数得分相对于基线改善 75%。
[0875]
65.如实施方案38-64中任一项所述的方法,其中所述患者在所述施用的第4周达到湿疹面积和严重程度指数得分相对于基线改善 75%。
[0876]
66.如实施方案38-65中任一项所述的方法,其中所述患者在所述施用的第8周达到湿疹面积和严重程度指数得分相对于基线改善 75%。
[0877]
67.如实施方案38-66中任一项所述的方法,其中所述患者在所述施用的第12周达到湿疹面积和严重程度指数得分相对于基线改善 75%。
[0878]
68.如实施方案38-67中任一项所述的方法,其中所述患者在所述施用的第2周达到研究者总体评估得分为0或1且相对于基线改善至少2分。
[0879]
69.如实施方案38-68中任一项所述的方法,其中所述患者在所述施用的第4周达到研究者总体评估得分为0或1且相对于基线改善至少2分。
[0880]
70.如实施方案38-69中任一项所述的方法,其中所述患者在所述施用的第8周达到研究者总体评估得分为0或1且相对于基线改善至少2分。
[0881]
71.如实施方案38-70中任一项所述的方法,其中所述患者在第 8周达到promis简表
–
睡眠障碍(8b)24小时回忆得分的临床上有意义的改善。
[0882]
72.如实施方案38-71中任一项所述的方法,其中所述施用维持至少2周。
[0883]
73.如实施方案38-72中任一项所述的方法,其中所述施用维持至少4周。
[0884]
74.如实施方案38-73中任一项所述的方法,其中所述施用维持至少8周。
[0885]
75.如实施方案38-74中任一项所述的方法,其中所述施用维持至少12周。
[0886]
76.如实施方案38-75中任一项所述的方法,其中所述患者在基线的2周内未使用除温和润肤剂外的特应性皮炎的局部治疗;并且在基线的4周内未使用全身性免疫抑制或全身性免疫调节药物。
[0887]
77.如实施方案38-76中任一项所述的方法,其中所述患者未施用用于治疗特应性皮炎的其他治疗剂。
[0888]
78.如实施方案38-77中任一项所述的方法,其中所述乳膏制剂的施用不会导致血红蛋白或血小板的统计学上显著的降低。
[0889]
79.如实施方案38-78中任一项所述的方法,其中所述乳膏制剂的施用不会导致施用部位灼伤。
[0890]
80.如实施方案38-79中任一项所述的方法,其中所述乳膏制剂是包含所述鲁索替尼或其药学上可接受的盐的水包油乳剂。
[0891]
81.如实施方案38-80中任一项所述的方法,其中所述乳膏制剂的ph为约2.8至约3.6。
[0892]
82.如实施方案38-81中任一项所述的方法,其中所述乳膏制剂是增溶乳膏。
[0893]
83.如实施方案38-82中任一项所述的方法,其中所述每天两次施用相隔至少8小时。
[0894]
84.一种减少患有特应性皮炎的人类患者的瘙痒的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂是水包油乳剂,其包含基于游离碱1.5%(重量/重量)的磷酸鲁索替尼,
[0895]
其中所述施用维持至少8周,
[0896]
其中所述患者在所述施用的第8周达到瘙痒nrs得分相对于基线降低至少4分,并且
[0897]
其中所述患者在所述施用的第8周达到研究者总体评估得分为0 或1且相对于基线改善至少2分。
[0898]
85.如实施方案84所述的方法,其中所述患者在所述施用的第8 周达到研究者总体评估得分为0或1且相对于基线改善至少2分。
[0899]
86.如实施方案84或85所述的方法,其中所述患者:
[0900]
年龄在18至70岁之间,
[0901]
已被诊断患有特应性皮炎至少2年,
[0902]
在筛选和基线时的研究者总体评估得分为2至3,并且
[0903]
在基线时的特应性皮炎受累的bsa(不包括面部和间擦区域)为 3%至20%。
[0904]
87.一种治疗人类患者的特应性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂包含基于游离碱0.75%(重量/重量)的鲁索替尼或其药学上可接受的盐。
[0905]
88.如实施方案87所述的方法,其中所述鲁索替尼或其药学上可接受的盐是磷酸鲁索替尼。
[0906]
89.如实施方案87-88中任一项所述的方法,其中所述患者达到研究者总体评估得分为0或1且相对于基线改善至少2分。
[0907]
90.如实施方案87-89中任一项所述的方法,其中所述患者在所述施用的第2周达到研究者总体评估得分为0或1且相对于基线改善至少2分。
[0908]
91.如实施方案87-90中任一项所述的方法,其中所述患者在所述施用的第4周达到研究者总体评估得分为0或1且相对于基线改善至少2分。
[0909]
92.如实施方案87-91中任一项所述的方法,其中所述患者在所述施用的第8周达到研究者总体评估得分为0或1且相对于基线改善至少2分。
[0910]
93.如实施方案87-92中任一项所述的方法,其中所述患者达到湿疹面积和严重程度指数得分相对于基线改善75%。
[0911]
94.如实施方案87-93中任一项所述的方法,其中与在同一时期施用安慰剂的患者相比,所述患者在所述施用的第4周达到湿疹面积和严重程度指数得分相对于基线统计学上显著地改善。
[0912]
95.如实施方案87-94中任一项所述的方法,其中与在同一时期施用安慰剂的患者相比,所述患者在所述施用的第8周达到湿疹面积和严重程度指数得分相对于基线统计学上显著地改善。
[0913]
96.如实施方案87-95中任一项所述的方法,其中所述患者在所述施用的第2周达到湿疹面积和严重程度指数得分相对于基线改善 75%。
[0914]
97.如实施方案87-96中任一项所述的方法,其中所述患者在所述施用的第4周达到湿疹面积和严重程度指数得分相对于基线改善 75%。
[0915]
98.如实施方案87-97中任一项所述的方法,其中所述患者在所述施用的第8周达到湿疹面积和严重程度指数得分相对于基线改善 75%。
[0916]
99.如实施方案87-98中任一项所述的方法,其中所述患者在所述施用的第12周达到湿疹面积和严重程度指数得分相对于基线改善 75%。
[0917]
100.如实施方案87-99中任一项所述的方法,其中所述患者达到 promis简表
–
睡眠障碍(8b)24小时回忆得分的临床上有意义的改善。
[0918]
101.如实施方案87-100中任一项所述的方法,其中所述患者在第8周达到promis简表
–
睡眠障碍(8b)24小时回忆得分的临床上有意义的改善。
[0919]
102.如实施方案87-101中任一项所述的方法,其中所述施用维持至少2周。
[0920]
103.如实施方案87-102中任一项所述的方法,其中所述施用维持至少4周。
[0921]
104.如实施方案87-103中任一项所述的方法,其中所述施用维持至少8周。
[0922]
105.如实施方案87-104中任一项所述的方法,其中所述施用维持至少12周。
[0923]
106.如实施方案87-105中任一项所述的方法,其中所述患者在基线的2周内未使用除温和润肤剂外的特应性皮炎的局部治疗;并且在基线的4周内未使用全身性免疫抑制或全身性免疫调节药物。
[0924]
107.如实施方案87-106中任一项所述的方法,其中所述患者未施用用于治疗特应性皮炎的其他治疗剂。
[0925]
108.如实施方案87-107中任一项所述的方法,其中所述每天两次施用相隔至少8小时。
[0926]
109.如实施方案87-108中任一项所述的方法,其中所述乳膏制剂是水包油乳剂,其包含所述基于游离碱0.75%(重量/重量)的磷酸鲁索替尼。
[0927]
110.如实施方案87-109中任一项所述的方法,其中所述乳膏制剂的ph为约2.8至约3.6。
[0928]
111.如实施方案87-110中任一项所述的方法,其中所述乳膏制剂是增溶乳膏。
[0929]
112.如实施方案87-111中任一项所述的方法,其中所述患者:
[0930]
年龄在18至70岁之间,
[0931]
已被诊断患有特应性皮炎至少2年,
[0932]
在筛选和基线时的研究者总体评估得分为2至3,并且
[0933]
在基线时的特应性皮炎受累的bsa(不包括面部和间擦区域)为 3%至20%。
[0934]
113.如实施方案87-112中任一项所述的方法,其中所述患者被诊断患有如hanifin和rajika标准所定义的特应性皮炎。
[0935]
114.如实施方案87-113中任一项所述的方法,其中所述患者达到瘙痒数值评定量表得分相对于基线改善至少4分。
[0936]
115.如实施方案87-114中任一项所述的方法,其中所述患者达到瘙痒数值评定量表得分相对于基线改善至少4分,其中所述患者的基线数值评定量表得分等于或大于4。
[0937]
116.如实施方案87-115中任一项所述的方法,其中所述患者在所述施用的2周后达到瘙痒数值评定量表得分相对于基线改善至少4 分,其中所述患者的基线数值评定量表得分等于或大于4。
[0938]
117.如实施方案87-116中任一项所述的方法,其中所述患者在所述施用的4周后达到瘙痒数值评定量表得分相对于基线改善至少4 分,其中所述患者的基线数值评定量表得分等于或大于4。
[0939]
118.如实施方案87-117中任一项所述的方法,其中所述患者在所述施用的8周后达到瘙痒数值评定量表得分相对于基线改善至少4 分,其中所述患者的基线数值评定量表得分等于或大于4。
[0940]
119.如实施方案87-118中任一项所述的方法,其中所述患者在所述施用的第2天达到瘙痒数值评定量表得分相对于基线改善至少2 分。
[0941]
120.如实施方案87-119中任一项所述的方法,其中所述乳膏制剂的施用不会导致血红蛋白或血小板的统计学上显著的降低。
[0942]
121.如实施方案87-120中任一项所述的方法,其中所述乳膏制剂的施用不会导致施用部位灼伤。
[0943]
122.一种治疗人类患者的中度特应性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用局部制剂,其中所述局部制剂包含基于游离碱0.75%(重量/重量)或1.5%(重量/重量)的鲁索替尼或其药学上可接受的盐。
[0944]
123.一种治疗人类患者的中度至重度特应性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用局部制剂,其中所述局部制剂包含基于游离碱0.75%(重量/重量)或1.5%(重量/重量)的鲁索替尼或其药学上可接受的盐。
[0945]
124.一种治疗人类患者的特应性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用局部制剂,其中所述局部制剂包含基于游离碱0.75%(重量/重量)或1.5%(重量/重量)的鲁索替尼或其药学上可接受的盐,
[0946]
其中所述患者:
[0947]
在基线时的湿疹面积和严重程度指数得分≥16;并且
[0948]
在基线时的特应性皮炎受累的体表面积≥10%。
[0949]
125.如实施方案122-124中任一项所述的方法,其中所述局部制剂是乳膏制剂。
[0950]
126.如实施方案122-125中任一项所述的方法,其中所述制剂包含基于游离碱0.75%(重量/重量)的鲁索替尼或其药学上可接受的盐。
[0951]
127.如实施方案122-125中任一项所述的方法,其中所述制剂包含基于游离碱1.5%(重量/重量)的鲁索替尼或其药学上可接受的盐。
[0952]
128.如实施方案122-125中任一项所述的方法,其中所述制剂包含基于游离碱
0.75%(重量/重量)的磷酸鲁索替尼。
[0953]
129.如实施方案122-125中任一项所述的方法,其中所述制剂包含基于游离碱1.5%(重量/重量)的磷酸鲁索替尼。
[0954]
130.如实施方案122-129中任一项所述的方法,其中所述患者在基线时的瘙痒数值评定量表得分≥4。
[0955]
131.如实施方案122-130中任一项所述的方法,其中所述患者在基线时的研究者总体评估得分为3。
[0956]
132.如实施方案122-130中任一项所述的方法,其中所述患者在基线时的研究者总体评估得分为3至4。
[0957]
133.如实施方案122-129中任一项所述的方法,其中所述患者:
[0958]
在基线时的研究者总体评估得分为3;并且
[0959]
在基线时的瘙痒数值评定量表得分≥4。
[0960]
134.如实施方案122-129中任一项所述的方法,其中所述患者:
[0961]
在基线时的研究者总体评估得分为3至4;并且
[0962]
在基线时的瘙痒数值评定量表得分≥4。
[0963]
135.如实施方案122-134中任一项所述的方法,其中所述患者年龄≥12岁。
[0964]
136.如实施方案122-135中任一项所述的方法,其中所述患者具有至少2年的特应性皮炎病史。
[0965]
137.如实施方案122-129中任一项所述的方法,其中所述患者:
[0966]
在基线时的研究者总体评估得分为3;
[0967]
具有至少2年的特应性皮炎病史;并且
[0968]
年龄≥12岁。
[0969]
138.如实施方案122-129中任一项所述的方法,其中所述患者:
[0970]
在基线时的研究者总体评估得分为3至4;
[0971]
具有至少2年的特应性皮炎病史;并且
[0972]
年龄≥12岁。
[0973]
139.如实施方案122-129中任一项所述的方法,其中所述患者:
[0974]
在基线时的研究者总体评估得分为3;
[0975]
在基线时的瘙痒数值评定量表得分≥4;
[0976]
具有至少2年的特应性皮炎病史;并且
[0977]
年龄≥12岁。
[0978]
140.如实施方案122-129中任一项所述的方法,其中所述患者:
[0979]
在基线时的研究者总体评估得分为3至4;
[0980]
在基线时的瘙痒数值评定量表得分≥4;
[0981]
具有至少2年的特应性皮炎病史;并且
[0982]
年龄≥12岁。
[0983]
141.如实施方案122-129中任一项所述的方法,其中所述患者具有以下特征中的一者或多者:
[0984]
在基线时的研究者总体评估得分为3;
[0985]
在基线时的瘙痒数值评定量表得分≥4;
[0986]
至少2年的特应性皮炎病史;以及
[0987]
年龄≥12岁。
[0988]
142.如实施方案122-129中任一项所述的方法,其中所述患者具有以下特征中的一者或多者:
[0989]
在基线时的研究者总体评估得分为3至4;
[0990]
在基线时的瘙痒数值评定量表得分≥4;
[0991]
至少2年的特应性皮炎病史;以及
[0992]
年龄≥12岁。
[0993]
143.如实施方案122-142中任一项所述的方法,其中所述患者被诊断患有如hanifin和rajika标准所定义的特应性皮炎。
[0994]
144.如实施方案122-143中任一项所述的方法,其中所述施用维持至少2周。
[0995]
145.如实施方案122-143中任一项所述的方法,其中所述施用维持至少4周。
[0996]
146.如实施方案122-143中任一项所述的方法,其中所述施用维持至少8周。
[0997]
147.如实施方案122-146中任一项所述的方法,其中所述患者达到研究者总体评估得分为0或1且相对于基线改善至少2分。
[0998]
148.如实施方案122-146中任一项所述的方法,其中所述患者在所述施用的第2周达到研究者总体评估得分为0或1且相对于基线改善至少2分。
[0999]
149.如实施方案122-146中任一项所述的方法,其中所述患者在所述施用的第4周达到研究者总体评估得分为0或1且相对于基线改善至少2分。
[1000]
150.如实施方案122-146中任一项所述的方法,其中所述患者在所述施用的第8周达到研究者总体评估得分为0或1且相对于基线改善至少2分。
[1001]
151.如实施方案122-150中任一项所述的方法,其中所述患者达到湿疹面积和严重程度指数得分相对于基线改善75%。
[1002]
152.如实施方案122-151中任一项所述的方法,其中与在同一时期施用安慰剂的患者相比,所述患者在所述施用的第4周达到湿疹面积和严重程度指数得分相对于基线统计学上显著地改善。
[1003]
153.如实施方案122-152中任一项所述的方法,其中与在同一时期施用安慰剂的患者相比,所述患者在所述施用的第8周达到湿疹面积和严重程度指数得分相对于基线统计学上显著地改善。
[1004]
154.如实施方案122-153中任一项所述的方法,其中所述患者在所述施用的第2周达到湿疹面积和严重程度指数得分相对于基线改善75%。
[1005]
155.如实施方案122-153中任一项所述的方法,其中所述患者在所述施用的第4周达到湿疹面积和严重程度指数得分相对于基线改善75%。
[1006]
156.如实施方案122-153中任一项所述的方法,其中所述患者在所述施用的第8周达到湿疹面积和严重程度指数得分相对于基线改善75%。
[1007]
157.如实施方案122-156中任一项所述的方法,其中所述患者达到瘙痒数值评定量表得分相对于基线改善至少4分,其中所述患者的基线数值评定量表得分等于或大于4。
[1008]
158.如实施方案122-156中任一项所述的方法,其中所述患者在所述施用的2周后
达到瘙痒数值评定量表得分相对于基线改善至少4 分,其中所述患者的基线数值评定量表得分等于或大于4。
[1009]
159.如实施方案122-156中任一项所述的方法,其中所述患者在所述施用的4周后达到瘙痒数值评定量表得分相对于基线改善至少4 分,其中所述患者的基线数值评定量表得分等于或大于4。
[1010]
160.如实施方案122-156中任一项所述的方法,其中所述患者在所述施用的8周后达到瘙痒数值评定量表得分相对于基线改善至少4 分,其中所述患者的基线数值评定量表得分等于或大于4。
[1011]
161.如实施方案122-160中任一项所述的方法,其中所述患者在所述施用的第2天达到瘙痒数值评定量表得分相对于基线改善至少2 分。
[1012]
162.如实施方案122-161中任一项所述的方法,其中所述患者达到promis简表
–
睡眠障碍(8b)24小时回忆得分的临床上有意义的改善。
[1013]
163.如实施方案122-162中任一项所述的方法,其中所述患者在第8周达到promis简表
–
睡眠障碍(8b)24小时回忆得分的临床上有意义的改善。
[1014]
164.如实施方案122-143中任一项所述的方法,其中:
[1015]
所述患者在所述施用的第4周达到瘙痒数值评定量表得分相对于基线降低至少4分;并且
[1016]
所述患者在所述施用的第4周达到研究者总体评估得分为0或1 且相对于基线改善至少2分。
[1017]
165.如实施方案122-143中任一项所述的方法,其中:
[1018]
所述患者在所述施用的第8周达到瘙痒数值评定量表得分相对于基线降低至少4分;并且
[1019]
所述患者在所述施用的第8周达到研究者总体评估得分为0或1 且相对于基线改善至少2分。
[1020]
166.如实施方案122-143中任一项所述的方法,其中:
[1021]
所述患者在所述施用的第4周达到瘙痒数值评定量表得分相对于基线降低至少4分;并且
[1022]
所述患者在所述施用的第4周达到湿疹面积和严重程度指数得分相对于基线改善75%。
[1023]
167.如实施方案122-143中任一项所述的方法,其中:
[1024]
所述患者在所述施用的第8周达到瘙痒数值评定量表得分相对于基线降低至少4分;并且
[1025]
所述患者在所述施用的第8周达到湿疹面积和严重程度指数得分相对于基线改善75%。
[1026]
168.如实施方案122-143中任一项所述的方法,其中:
[1027]
所述患者在所述施用的第4周达到研究者总体评估得分为0或1 且相对于基线改善至少2分;并且
[1028]
所述患者在所述施用的第4周达到湿疹面积和严重程度指数得分相对于基线改善75%。
[1029]
169.如实施方案122-143中任一项所述的方法,其中:
[1030]
所述患者在所述施用的第8周达到研究者总体评估得分为0或1 且相对于基线改善至少2分;并且
[1031]
所述患者在所述施用的第8周达到湿疹面积和严重程度指数得分相对于基线改善75%。
[1032]
170.如实施方案122-143中任一项所述的方法,其中:
[1033]
所述患者在所述施用的第4周达到瘙痒数值评定量表得分相对于基线降低至少4分,
[1034]
所述患者在所述施用的第4周达到研究者总体评估得分为0或1 且相对于基线改善至少2分;并且
[1035]
所述患者在所述施用的第4周达到湿疹面积和严重程度指数得分相对于基线改善75%。
[1036]
171.如实施方案122-143中任一项所述的方法,其中:
[1037]
所述患者在所述施用的第8周达到瘙痒数值评定量表得分相对于基线降低至少4分,
[1038]
所述患者在所述施用的第8周达到研究者总体评估得分为0或1 且相对于基线改善至少2分;并且
[1039]
所述患者在所述施用的第8周达到湿疹面积和严重程度指数得分相对于基线改善75%。
[1040]
172.如实施方案122-171中任一项所述的方法,其中所述患者在基线的2周内未使用除温和润肤剂外的特应性皮炎的局部治疗;并且在基线的4周内未使用全身性免疫抑制或全身性免疫调节药物。
[1041]
173.如实施方案122-172中任一项所述的方法,其中所述患者未施用用于治疗特应性皮炎的其他治疗剂。
[1042]
174.如实施方案122-173中任一项所述的方法,其中所述每天两次施用相隔至少8小时。
[1043]
175.如实施方案122-174中任一项所述的方法,其中所述制剂的 ph为约2.8至约3.9。
[1044]
176.如实施方案122-174中任一项所述的方法,其中所述制剂的 ph为约2.8至约3.6。
[1045]
177.如实施方案122-176中任一项所述的方法,其中所述制剂是增溶乳膏。
[1046]
178.如实施方案122-177中任一项所述的方法,其中所述制剂的施用不会导致血红蛋白或血小板的统计学上显著的降低。
[1047]
179.如实施方案122-178中任一项所述的方法,其中所述制剂的施用不会导致施用部位灼伤。
[1048]
180.一种治疗人类患者的中度特应性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用局部制剂,其中所述局部制剂包含基于游离碱1.5%(重量/重量)的鲁索替尼或其药学上可接受的盐。
[1049]
181.如实施方案180所述的方法,其中所述鲁索替尼或其药学上可接受的盐是磷
酸鲁索替尼。
[1050]
182.如实施方案180所述的方法,其中所述患者年龄≥12岁或更大。
[1051]
183.如实施方案180所述的方法,其中所述患者在基线时的特应性皮炎受累的体表面积为10%至20%。
[1052]
184.如实施方案180所述的方法,其中所述患者在基线时的湿疹面积和严重程度指数得分≥16。
[1053]
185.如实施方案180所述的方法,其中所述患者达到研究者总体评估得分为0或1且相对于基线改善至少2分。
[1054]
186.如实施方案180所述的方法,其中所述患者达到湿疹面积和严重程度指数得分相对于基线改善75%。
[1055]
187.如实施方案180所述的方法,其中所述患者达到瘙痒数值评定量表得分相对于基线改善至少4分,并且其中所述患者的基线数值评定量表得分等于或大于4。
[1056]
188.如实施方案180所述的方法,其中所述患者达到:
[1057]
研究者总体评估得分为0或1且相对于基线改善至少2分;
[1058]
瘙痒数值评定量表得分相对于基线改善4分,其中所述患者的基线数值评定量表得分等于或大于4;并且
[1059]
湿疹面积和严重程度指数得分相对于基线改善75%。
[1060]
189.如实施方案180所述的方法,其中所述患者达到:
[1061]
在第4周的研究者总体评估得分为0或1且相对于基线改善至少 2分;
[1062]
在第4周的瘙痒数值评定量表得分相对于基线改善4分,其中所述患者的基线数值评定量表得分等于或大于4;并且
[1063]
在第4周的湿疹面积和严重程度指数得分相对于基线改善75%。
[1064]
190.如实施方案180所述的方法,其中所述患者达到:
[1065]
在第8周的研究者总体评估得分为0或1且相对于基线改善至少 2分;
[1066]
在第8周的瘙痒数值评定量表得分相对于基线改善4分,其中所述患者的基线数值评定量表得分等于或大于4;并且
[1067]
在第8周的湿疹面积和严重程度指数得分相对于基线改善75%。
[1068]
191.如实施方案180所述的方法,其中所述患者在所述施用的第2天达到瘙痒数值评定量表得分相对于基线改善至少2分。
[1069]
192.如实施方案180所述的方法,其中所述患者在第8周达到 promis简表
–
睡眠障碍(8b)24小时回忆得分的临床上有意义的改善。
[1070]
193.如实施方案180所述的方法,其中所述制剂是乳膏制剂。
[1071]
194.如实施方案193所述的方法,其中所述乳膏制剂是水包油乳剂。
[1072]
195.如实施方案194所述的方法,其中所述乳膏制剂的ph为约 2.8至约3.9。
[1073]
196.如实施方案195所述的方法,其中所述制剂的施用不会导致血红蛋白或血小板的统计学上显著的降低。
[1074]
197.如实施方案196所述的方法,其中所述制剂的施用不会导致施用部位灼伤。
[1075]
198.一种治疗人类患者的特应性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用局部制剂,其中所述局部制剂包含基于游离碱1.5%(重量/重量)的磷酸
鲁索替尼,其中所述患者:
[1076]
年龄为12岁或更大;
[1077]
在基线时的特应性皮炎受累的体表面积为10%至20%;并且
[1078]
在基线时的研究者总体评估得分为3。
[1079]
199.如实施方案198所述的方法,其中所述患者达到研究者总体评估得分为0或1且相对于基线改善至少2分。
[1080]
200.如实施方案198所述的方法,其中所述患者达到湿疹面积和严重程度指数得分相对于基线改善75%。
[1081]
201.如实施方案198所述的方法,其中所述患者达到瘙痒数值评定量表得分相对于基线改善至少4分,并且其中所述患者的基线数值评定量表得分等于或大于4。
[1082]
202.如实施方案198所述的方法,其中所述患者达到:
[1083]
研究者总体评估得分为0或1且相对于基线改善至少2分;
[1084]
瘙痒数值评定量表得分相对于基线改善4分,其中所述患者的基线数值评定量表得分等于或大于4;并且
[1085]
湿疹面积和严重程度指数得分相对于基线改善75%。
[1086]
203.如实施方案198所述的方法,其中所述患者达到:
[1087]
在第4周的研究者总体评估得分为0或1且相对于基线改善至少 2分;
[1088]
在第4周的瘙痒数值评定量表得分相对于基线改善4分,其中所述患者的基线数值评定量表得分等于或大于4;并且
[1089]
在第4周的湿疹面积和严重程度指数得分相对于基线改善75%。
[1090]
204.如实施方案198所述的方法,其中所述患者达到:
[1091]
在第8周的研究者总体评估得分为0或1且相对于基线改善至少 2分;
[1092]
在第8周的瘙痒数值评定量表得分相对于基线改善4分,其中所述患者的基线数值评定量表得分等于或大于4;并且
[1093]
在第8周的湿疹面积和严重程度指数得分相对于基线改善75%。
[1094]
205.如实施方案198所述的方法,其中所述制剂是乳膏制剂。
[1095]
206.如实施方案205所述的方法,其中所述乳膏制剂是水包油乳剂。
[1096]
207.一种减少患有特应性皮炎的人类患者的瘙痒的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂包含基于游离碱1.5%(重量/重量)的鲁索替尼或其药学上可接受的盐;
[1097]
其中所述患者在所述施用的36小时内达到瘙痒数值评定量表得分相对于基线统计学上显著地降低。
[1098]
208.一种减少患有特应性皮炎的人类患者的瘙痒的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂包含基于游离碱1.5%(重量/重量)的鲁索替尼或其药学上可接受的盐,其中所述患者到所述施用的第2天达到瘙痒数值评定量表得分降低至少1分。
[1099]
209.如实施方案208所述的方法,其中所述鲁索替尼或其药学上可接受的盐是磷酸鲁索替尼。
[1100]
210.如实施方案208所述的方法,其中所述患者在所述施用的 12小时内达到瘙痒
数值评定量表得分相对于基线统计学上显著地降低。
[1101]
211.如实施方案208所述的方法,其中所述患者在所述施用的 12小时内达到瘙痒数值评定量表得分改善2分。
[1102]
212.如实施方案208所述的方法,其中所述患者在所述施用的36小时内达到瘙痒数值评定量表得分改善2分。
[1103]
213.如实施方案208所述的方法,其中所述患者在所述施用的 36小时内达到瘙痒数值评定量表得分改善4分。
[1104]
214.如实施方案208所述的方法,其中所述患者在所述施用的第1周达到瘙痒数值评定量表得分降低至少2分。
[1105]
215.如实施方案208所述的方法,其中所述患者在所述施用的第3周达到瘙痒数值评定量表得分降低至少3分。
[1106]
216.如实施方案208所述的方法,其中所述患者在所述施用的 36小时内达到瘙痒数值评定量表得分的最小临床重要性差值,其中所述瘙痒数值评定量表得分的最小临床重要性差值是瘙痒数值评定量表得分相对于基线降低2至3分,其中所述患者的基线数值评定量表得分等于或大于2。
[1107]
217.如实施方案208所述的方法,其中所述患者在所述施用的 36小时内达到瘙痒数值评定量表得分的临床相关改善,其中所述瘙痒数值评定量表得分的临床相关改善是瘙痒数值评定量表得分相对于基线降低≥4分,其中所述患者的基线数值评定量表得分等于或大于4。
[1108]
218.如实施方案208所述的方法,其中所述患者年龄为12岁或更大。
[1109]
219.如实施方案218所述的方法,其中所述患者在基线时的特应性皮炎受累的体表面积(bsa,不包括头皮)为3%至20%。
[1110]
220.如实施方案219所述的方法,其中所述患者在基线时的研究者总体评估得分为2至3。
[1111]
221.如实施方案220所述的方法,其中所述患者已被诊断患有特应性皮炎至少2年。
[1112]
222.如实施方案221所述的方法,其中所述患者被诊断患有如 hanifin和rajika标准所定义的特应性皮炎。
[1113]
223.如实施方案222所述的方法,其中所述患者在基线的2周内未使用除润肤剂外的特应性皮炎的局部治疗。
[1114]
224.如实施方案208所述的方法,其中所述患者在所述施用的第2周达到瘙痒数值评定量表得分相对于基线降低至少4分。
[1115]
225.如实施方案208所述的方法,其中所述患者在所述施用的第4周达到瘙痒数值评定量表得分相对于基线降低至少4分。
[1116]
226.如实施方案208所述的方法,其中所述患者在所述施用的第8周达到瘙痒数值评定量表得分相对于基线降低至少4分。
[1117]
227.如实施方案208所述的方法,其中所述患者在所述施用的第2周达到湿疹面积和严重程度指数得分相对于基线改善75%。
[1118]
228.如实施方案208所述的方法,其中所述患者在所述施用的第4周达到湿疹面积
和严重程度指数得分相对于基线改善75%。
[1119]
229.如实施方案208所述的方法,其中所述患者在所述施用的第8周达到湿疹面积和严重程度指数得分相对于基线改善75%。
[1120]
230.如实施方案208所述的方法,其中所述患者在所述施用的第2周达到研究者总体评估得分为0或1且相对于基线改善至少2分。
[1121]
231.如实施方案208所述的方法,其中所述患者在所述施用的第4周达到研究者总体评估得分为0或1且相对于基线改善至少2分。
[1122]
232.如实施方案208所述的方法,其中所述患者在所述施用的第8周达到研究者总体评估得分为0或1且相对于基线改善至少2分。
[1123]
233.如实施方案209所述的方法,其中所述乳膏制剂是水包油乳剂。
[1124]
234.如实施方案233所述的方法,其中所述乳膏制剂的ph为约 2.8至约3.6。
[1125]
235.一种减少患有特应性皮炎的人类患者的瘙痒的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂包含基于游离碱1.5%(重量/重量)的磷酸鲁索替尼;
[1126]
其中所述患者:
[1127]
年龄为12岁或更大;
[1128]
在基线时的研究者总体评估得分为2至3;
[1129]
在基线时的特应性皮炎受累的体表面积(不包括头皮)为3%至 20%;并且
[1130]
在所述施用的36小时内达到瘙痒数值评定量表得分的最小临床重要性差值,其中所述瘙痒数值评定量表得分的最小临床重要性差值是瘙痒数值评定量表得分相对于基线降低2至3分,其中所述患者的基线瘙痒数值评定量表得分≥2。
[1131]
236.一种减少患有特应性皮炎的人类患者的瘙痒的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂包含基于游离碱1.5%(重量/重量)的磷酸鲁索替尼;
[1132]
其中所述患者:
[1133]
年龄为12岁或更大;
[1134]
在基线时的研究者总体评估得分为2至3;
[1135]
在基线时的特应性皮炎受累的体表面积(不包括头皮)为3%至20%;并且
[1136]
在所述施用的36小时内达到瘙痒数值评定量表得分的临床相关改善,其中所述瘙痒数值评定量表得分的临床相关改善是瘙痒数值评定量表得分相对于基线降低≥4分,其中所述患者的基线数值评定量表得分≥4。
[1137]
237.一种治疗人类患者的特应性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂包含基于游离碱0.75%(重量/重量)的鲁索替尼或其药学上可接受的盐。
[1138]
238.如实施方案237所述的方法,其中所述鲁索替尼或其药学上可接受的盐是磷酸鲁索替尼。
[1139]
239.如实施方案237所述的方法,其中所述患者达到研究者总体评估得分为0或1且相对于基线改善至少2分。
[1140]
240.如实施方案237所述的方法,其中所述患者在所述施用的第2周达到研究者总
体评估得分为0或1且相对于基线改善至少2分。
[1141]
241.如实施方案237所述的方法,其中所述患者在所述施用的第4周达到研究者总体评估得分为0或1且相对于基线改善至少2分。
[1142]
242.如实施方案237所述的方法,其中所述患者在所述施用的第8周达到研究者总体评估得分为0或1且相对于基线改善至少2分。
[1143]
243.如实施方案237所述的方法,其中所述患者达到湿疹面积和严重程度指数得分相对于基线改善75%。
[1144]
244.如实施方案237所述的方法,其中所述患者在所述施用的第2周达到湿疹面积和严重程度指数得分相对于基线改善75%。
[1145]
245.如实施方案237所述的方法,其中所述患者在所述施用的第4周达到湿疹面积和严重程度指数得分相对于基线改善75%。
[1146]
246.如实施方案237所述的方法,其中所述患者在所述施用的第8周达到湿疹面积和严重程度指数得分相对于基线改善75%。
[1147]
247.如实施方案237所述的方法,其中所述患者达到瘙痒数值评定量表得分相对于基线改善至少4分。
[1148]
248.如实施方案237所述的方法,其中所述患者达到瘙痒数值评定量表得分相对于基线改善至少4分,并且其中所述患者的基线数值评定量表得分等于或大于4。
[1149]
249.如实施方案237所述的方法,其中所述患者在所述施用的第2周达到瘙痒数值评定量表得分相对于基线改善至少4分,并且其中所述患者的基线数值评定量表得分等于或大于4。
[1150]
250.如实施方案237所述的方法,其中所述患者在所述施用的第4周达到瘙痒数值评定量表得分相对于基线改善至少4分,并且其中所述患者的基线数值评定量表得分等于或大于4。
[1151]
251.如实施方案237所述的方法,其中所述患者在所述施用的第8周达到瘙痒数值评定量表得分相对于基线改善至少4分,并且其中所述患者的基线数值评定量表得分等于或大于4。
[1152]
252.如实施方案237所述的方法,其中所述患者在所述施用的 36小时内达到瘙痒数值评定量表得分的最小临床重要性差值,其中所述瘙痒数值评定量表得分的最小临床重要性差值是瘙痒数值评定量表得分相对于基线降低2至3分,其中所述患者的基线数值评定量表得分等于或大于2。
[1153]
253.如实施方案237所述的方法,其中所述患者在所述施用的 36小时内达到瘙痒数值评定量表得分的临床相关改善,其中所述瘙痒数值评定量表得分的临床相关改善是瘙痒数值评定量表得分相对于基线降低≥4分,其中所述患者的基线数值评定量表得分等于或大于4。
[1154]
254.如实施方案237所述的方法,其中所述施用维持至少2、4 或8周。
[1155]
255.如实施方案237所述的方法,其中所述患者年龄为12岁或更大。
[1156]
256.如实施方案255所述的方法,其中所述患者在基线时的特应性皮炎受累的体表面积(bsa,不包括头皮)为3%至20%。
[1157]
257.如实施方案256所述的方法,其中所述患者在基线时的研究者总体评估得分
为2至3。
[1158]
258.如实施方案257所述的方法,其中所述患者已被诊断患有特应性皮炎至少2年。
[1159]
259.如实施方案258所述的方法,其中所述患者被诊断患有如 hanifin和rajika标准所定义的特应性皮炎。
[1160]
260.如实施方案259所述的方法,其中所述患者在基线的2周内未使用除润肤剂外的特应性皮炎的局部治疗。
[1161]
261.如实施方案238所述的方法,其中所述乳膏制剂是水包油乳剂。
[1162]
262.如实施方案261所述的方法,其中所述乳膏制剂是增溶乳膏。
[1163]
263.如实施方案262所述的方法,其中所述乳膏制剂的ph为约 2.8至约3.6。
[1164]
264.一种治疗人类患者的特应性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂包含基于游离碱0.75%(重量/重量)的鲁索替尼或其药学上可接受的盐,其中所述患者:
[1165]
年龄为12岁或更大;
[1166]
在基线时的研究者总体评估得分为2至3;
[1167]
在基线时的特应性皮炎受累的体表面积(不包括头皮)为3%至 20%;并且
[1168]
在所述施用的第8周达到研究者总体评估得分为0或1且相对于基线改善至少2分。
[1169]
265.一种治疗人类患者的特应性皮炎的方法,其包括每天两次向所述有需要的人类患者的皮肤施用乳膏制剂,其中所述乳膏制剂包含基于游离碱0.75%(重量/重量)的鲁索替尼或其药学上可接受的盐,其中所述患者:
[1170]
年龄为12岁或更大;
[1171]
在基线时的研究者总体评估得分为2至3;
[1172]
在基线时的特应性皮炎受累的体表面积(不包括头皮)为3%至 20%;并且
[1173]
在所述施用的第8周达到湿疹面积和严重程度指数得分相对于基线改善75%。
[1174]
将通过特定实施例更详细地描述本发明。以下实施例针对示例目的而提供,并且不旨在以任何方式限制本发明。本领域的技术人员将容易地识别多种非关键性参数,所述参数可被改变或修改以产生基本上相同的结果。在一些实施方案中,本公开提供了包含示例性制剂(例如,实施例3)中指定的组分的药物制剂,其中所述组分以约表2-5中的量存在。
[1175]
实施例
[1176]
实施例1:磷酸鲁索替尼(incb018424)的水包油乳膏制剂的制备
[1177]
首先,为了确定鲁索替尼(游离碱)或其1:1磷酸盐的溶解度,在室温下向大约50mg api或其盐中加入大约5ml潜在溶剂。将混合物悬浮并在轮上旋转。如果混合物变成澄清溶液,则添加更多的固体物质。然后将悬浮液悬浮24小时。将样品通过0.2微米过滤器过滤。收集液体部分并用50/50水甲醇/水稀释。通过hplc分析稀释样品的浓度。当游离碱或盐相当不溶时,结果只是近似值。
[1178]
表1
[1179][1180]
对于1:1鲁索替尼磷酸盐以制剂重量的0.5%、1.0%和1.5%(游离碱当量)来制备水包油乳膏制剂。15克试管的组合物在下表2中提供。除了基于活性成分的量调整纯化水量之外,三种规格的配方相同。配方中使用的所有赋形剂均为药典级(即,usp/nf或bp)或已获准用于局部产品。
[1181]
表3、4和5中还分别提供了0.5%、1.0%和1.5%的乳膏制剂的代表性400kg批次的定量配方。
[1182]
根据以下程序以3.5kg或400kg的规模合成水包油乳膏制剂(当以3.5kg的批量生产时,表3-5中的量已适当按比例调整)。一些批次会因放大而发生细微变化,诸如混合容器和混合器的尺寸。一般来说,具有高剪切混合叶片和低剪切混合叶片的顶置混合器适用于所述工艺。
[1183]
程序
[1184]
1.通过将对羟基苯甲酸甲酯和对羟基苯甲酸丙酯与丙二醇的一部分混合来制备对羟基苯甲酸酯相(参见表2-5中的%)。
[1185]
2.接下来,通过将黄原胶与丙二醇混合来制备黄原胶相(参见表 2-5中的%)。
[1186]
3.然后通过混合轻质矿物油、甘油硬脂酸酯、聚山梨醇酯20、白凡士林、鲸蜡醇、硬
脂醇、聚二甲基硅氧烷和中链甘油三酯来制备油相。将所述相加热至70℃-80℃以熔化并形成均匀的混合物。
[1187]
4.接下来通过混合纯化水、聚乙二醇和edta二钠来制备水相。将所述相加热至70℃-80℃。
[1188]
5.将步骤4的水相、步骤1的对羟基苯甲酸酯相和实施例2(api 的磷酸盐)合并以形成混合物。
[1189]
6.然后将来自步骤2的黄原胶相添加到来自步骤5的混合物中。
[1190]
7.然后将来自步骤3的油相在高剪切混合下与来自步骤6的混合物合并以形成乳剂。
[1191]
8.然后将苯氧乙醇添加到来自步骤7的乳剂中。继续混合,然后将产物在低剪切混合下冷却。
[1192]
表2
[1193][1194][1195]
表3
[1196][1197]
表4
[1198]
[1199][1200]
表5
[1201][1202]
通过将磷酸鲁索替尼逐渐添加到水相中,然后与其他相合并,可以获得更大规模(例如,140kg)的更一致的批次。类似地,通过较慢的冷却(例如,通过在反应器的外夹套中使用室温水而不是较低温度的水)可以获得更一致的批次。
[1203]
表5a示出了实施例3中使用的0.75%和1.5%鲁索替尼乳膏制剂。
[1204]
表5a
[1205][1206]
测试批次在25℃下的稳定性,并且发现其稳定长达24个月,其 ph与上述ph范围一致(参见美国专利公开号2015/0250790的表7、9、 11、12、13、15、17和19,所述专利以引用的方式整体并入本文)。乳膏制剂的粘度(例如,含有基于游离碱0.75%或1.5%磷酸鲁索替尼) 在释放时的粘度≥17,000cps,并且在贮藏期的粘度≥10,000cps。
[1207]
实施例2:2期、随机的、剂量范围的、媒介物对照的和曲安西龙0.1%乳膏对照的研究,用于评估局部应用于患有特应性皮炎的成人的磷酸鲁索替尼(incb018424)乳膏的安全性和功效
[1208]
这是对于患有轻度至中度特应性皮炎(ad)的受试者的随机的、媒介物对照的和活性剂(曲安西龙0.1%乳膏)对照的研究。所述研究对媒介物、鲁索替尼乳膏剂量和活性对照是双盲的。将307名受试者按 1:1:1:1:1:1随机分配至1.5%鲁索替尼乳膏bid、1.5%鲁索替尼乳膏 qd、0.5%鲁索替尼乳膏qd、0.15%鲁索替尼乳膏qd、媒介物bid 和活性对照(曲安西龙0.1%乳膏bid)并按easi得分(≤7和》7)分层。鲁索替尼乳膏中的鲁索替尼以磷酸鲁索替尼的形式存在,百分比为基于游离碱的%重量/重量。鲁索替尼乳膏制剂是如实施例1中所述制备的水包油乳膏制剂(还参见美国专利公开号2015/0250790),其以引用的方式整体并入本文。
[1209]
接受qd方案的受试者在晚上应用媒介物。受试者接受盲法研究药物8周。将受试者随机分配到曲安西龙应用的曲安西龙0.1%乳膏 bid持续4周和媒介物乳膏持续4周,以不超过可允许的曲安西龙应用持续时间。
[1210]
在早晨和晚上睡前至少1小时,供应1.5%鲁索替尼乳膏、0.5%鲁索替尼乳膏和0.15%鲁索替尼乳膏并作为薄膜局部应用至受影响的区域。对于要用研究药物治疗的每1%的bsa(有手指的手掌),使用大约2英寸(5cm)的研究药物。建议受试者限制使用每次应用不超过1管。如果要在要治疗的区域涂抹防晒霜、化妆品或其他乳膏,则指示受试者在应用研究药物之前用温和的肥皂和水清洗治疗区域并拍干。如果使用,在将研究药物应用于某个区域之前和之后至少1小时内应避免使用局部抗感染剂或其他局部治疗。应告诫受试者避免过度暴露在自然或人造阳光下(包括仿晒机、太阳灯等),并且在户外时,应建议穿宽松的衣服以保护治疗区域免受阳光照射。
[1211]
媒介物乳膏在外观上与鲁索替尼乳膏相匹配,只是它不含活性药物。媒介物乳膏和曲安西龙0.1%乳膏以与鲁索替尼乳膏相同的方式应用。曲安西龙0.1%乳膏治疗4周,然后是媒介物治疗4周。接受鲁索替尼乳膏qd方案的受试者在晚上应用时接受媒介物乳膏。
[1212]
在第8周,符合标准的受试者接受1.5%鲁索替尼乳膏bid持续 4周的开放标签治疗。
[1213]
在治疗开始后出现额外ad区域的受试者被允许治疗这些额外区域(面部和间擦区域除外),前提是总治疗的bsa不超过20%,并且没有关于额外应用研究药物的安全性问题。
[1214]
研究群体为男性或女性,年龄在18至70岁,已被诊断患有特应性皮炎(ad)至少2年,研究者总体评估(iga)得分为2至3,并且受累的体表面积(bsa,不包括面部和间擦区域)为3%至20%。
[1215]
符合全部以下关键纳入标准的受试者可纳入研究:(i)18至70 岁(包括端值)的男性和女性;(ii)被诊断患有如hanifin和rajka标准所定义的ad;(iii)至少2年的ad病史;(iv)在筛选和基线时的iga 得分为2至3;(v)在筛选和基线时的ad受累的bsa(不包括面部和间擦区域)为3%至20%;(vi)同意从筛选开始到最终随访期间停用所有用于治疗ad的剂。
[1216]
符合以下关键排除标准中的任一项的受试者被排除在研究之外: (i)活动性急性或慢性感染的迹象;(ii)在基线的2周内使用特应性皮炎的ad的局部治疗(除温和润肤剂外);(iii)在基线的4周或5个半衰期 (以较长者为准)内使用全身性免疫抑制或免疫调节药物(例如,口服或注射皮质类固醇、甲氨蝶呤、环孢霉素、霉酚酸酯、硫唑嘌呤);(iv) 患有除ad外的其他皮肤病的受试者,其他皮肤病的存在或治疗可能使疾病评估复杂化;(v)可能使评估复杂化的除皮肤病外的需要治疗的其他疾病(例如,其他自身免疫疾病)史;(vi)筛选时血细胞减少的受试者,定义为白细胞《3.0
×
109/l,中性粒细胞《正常下限,血红蛋白《10 g/dl。淋巴细胞《0.8
×
109/l、血小板《100
×
109/l;(vii)在透析时具有严重肝功能受损(child-pugh c级)或终末期肾病或以下的至少1 项的受试者:血清肌酐》1.5mg/dl、丙氨酸氨基转移酶或天冬氨酸氨基转移酶≥1.5
×
正常上限;(viii)在基线访视前的2周或5个半衰期(以较长者为准)内服用强效全身性细胞色素p450 3a4抑制剂或氟康唑的受试者(允许全身可用性有限的局部药剂);和/或(ix)先前已全身性或局部接受janus激酶抑制剂的受试者(例如,鲁索替尼、托法替尼、巴瑞替尼、丝氨酸替尼(filgotinib)、来司他替尼(lestaurtinib)或帕克替尼(pacritinib))。
[1217]
所述研究的主要终点是与用媒介物乳膏bid治疗的受试者相比,用1.5%鲁索替尼乳膏bid治疗的受试者在第4周的easi得分相对于基线的变化百分比。
[1218]
次要终点包括与用媒介物乳膏bid治疗的受试者相比,用鲁索替尼乳膏治疗的受试者在第4周的easi得分相对于基线的平均变化百分比;与使用曲安西龙0.1%乳膏bid治疗的受试者相比,用鲁索替尼乳膏治疗的受试者在第4周的easi得分相对于基线的平均变化百分比;在第2周和第8周easi得分相对于基线的平均变化百分比;在第2、4和8周达到easi(easi-50)相对于基线改善≥50%的受试者的比例;基于在第4周easi得分相对于基线的变化百分比评估剂量应答;达到easi-50的时间;在第2、4和8周达到iga得分为0至 1且相对于基线改善≥2分的受试者的比例;在第2、4和8周瘙痒数值评定量表(nrs)得分相对于基线的平均变化;以及通过监测不良事件(ae)的频率、持续时间和严重程度;执行身体检查;收集生命体征;以及收集血液学、血清化学和尿液分析的实验室数据来评估安全性和耐受性。
[1219]
其他次要终点包括在第2、4、8、10和12周基于skindex-16(总体、每个问题和指定分组)的生活质量相对于基线的变化。skindex-16 (atherton pj,等人,support care cancer.2012 aug;20(8):1729
–
1735) 是一项16个问题的生活质量评估,其询问受试者在过去一周受到其皮肤病状的各个方面的困扰程度。患者回答了关于过去一周内各种 ad症状的影响的问题,得分为0(不困扰)至6(一直困扰)。在基线和第2、4、8、10和12周对患者进行评估。
[1220]
结果
[1221]
患者人口统计数据在表6中示出。基线临床特征在表7中示出。 skindex-16总体得分在基线时为3.7
±
1.3。
[1222]
表6
[1223]
人口统计数据总计(n=307)年龄,中位数(范围),岁35.0(18.0-70.0)女性,n(%)168(54.7)种族,n(%) 白人172(56.0)黑人85(27.7)亚洲人41(13.4)其他9(2.9)
[1224]
表7
[1225]
临床特征总计(n=307)bsa,平均值
±
sd,%9.6
±
5.4基线easi,平均值
±
sd8.4
±
4.7≤7,n(%)147(47.9)≤7,n(%)159(51.8)缺失,n(%)1(0.3)基线iga,n(%) 295(31)3210(69)瘙痒nrs得分,*平均值
±
sd6.0
±
2.1
疾病持续时间,中位数(范围),年20.8(0.1-66.1)过去12个月的发作次数,平均值
±
sd7.3
±
23.3
[1226]
在示出曲安西龙结果的图中,曲安西龙(tac)组接受0.1%曲安西龙乳膏直至第4周并且之后接受媒介物。
[1227]
如图1所示,与媒介物对照相比,鲁索替尼乳膏在所有浓度下均以剂量和时间依赖性方式显示出easi得分的显著改善。如图2所示, 1.5%鲁索替尼乳膏在所有治疗组中均显示最高的功效(跨越所有功效终点),而1.5%鲁索替尼乳膏bid在easi得分(第2周和第4周)方面表现不劣于曲安西龙(tac),并且在数值上具有更大的改善率。
[1228]
此外,越来越多的患者以剂量和时间依赖性方式达到easi-75 (easi相对于基线改善至少75%)(参见图3),在第4周使用1.5%鲁索替尼乳膏bid达到easi-75的患者比使用0.1%tac达到easi-75 的患者更多。
[1229]
如图4所示,鲁索替尼乳膏以剂量和时间依赖性方式表现出iga 应答的显著改善(iga应答者是达到iga得分为0-1且相对于基线改善≥2分的患者)。此外,1.5%鲁索替尼乳膏bid在第4周和第8周显示出比媒介物显著更多的iga应答者(图4),并且在第4周显示出比0.1%tac显著更大的应答。
[1230]
如图5所示,在第8周过渡到1.5%鲁索替尼乳膏bid与easi 得分的明显改善相关联。类似地,在第8周改用1.5%鲁索替尼乳膏bid与所有治疗组的iga应答的明显改善相关联(参见图6)。
[1231]
此外,如图7所示,鲁索替尼乳膏与瘙痒nrs得分的快速和持续降低相关联(nrs得分范围为0-10,0为无瘙痒,并且10为最严重的瘙痒)。特别是,如图8和表8所示,在第一次应用的36小时内(即, 2天后)1.5%鲁索替尼乳膏bid相对于媒介物观察到瘙痒nrs得分显著降低(-1.8相对于0.2;p《0.0001)。如图9和表8所示,在第8周过渡到1.5%鲁索替尼乳膏bid与瘙痒的另外和持续改善相关联。
[1232]
在第一次应用后的36小时内1.5%鲁索替尼乳膏bid相对于媒介物观察到瘙痒nrs得分的临床上有意义的降低(
–
1.8相对于
–
0.2; p《0.0001)。所有鲁索替尼乳膏方案在治疗的前2周内注意到的瘙痒 nrs得分减小在整个双盲期持续。在第4周,与曲安西龙(
–
50.3)相比,两种1.5%鲁索替尼乳膏方案均能产生更明显的瘙痒缓解(相对于基线的平均变化百分比,1.5%bid为
–
64.6,并且1.5%qd为
–
54.0);对于1.5%鲁索替尼bid相对于曲安西龙而言,相对于基线的平均变化的差异是统计学上显著的(分别为
–
4.0相对于
–
2.5;p=0.003)。瘙痒 nrs得分相对于基线的改善是治疗方案依赖性的,在第8周用1.5%鲁索替尼乳膏bid治疗的患者平均改善68.5%,着显著优于媒介物 (17.6%;p《0.0001)。
[1233]
在符合cri分析条件的患者中(基线瘙痒nrs≥4;n=232),使用鲁索替尼乳膏的患者在仅一天的治疗后达到cri应答的比例比使用媒介物的患者的比例要高得多(1.5%鲁索替尼乳膏bid相对于载体的第2天的应答率为10.5%相对于2.9%);1.5%鲁索替尼乳膏bid和媒介物的第4天应答率分别为26.3%和2.9(p《0.05)。在第2周,1.5%鲁索替尼bid(47.5%;p《0.001)、1.5%鲁索替尼qd(32.4%;p《0.01) 和0.5%鲁索替尼qd(25.0%;p《0.05)达到cri的患者相对于媒介物 (5.4%;图1)显著更多。与曲安西龙相比,在第2周观察到1.5%鲁索替尼乳膏bid的应答率也显著更高(19.4%,p《0.05)。所有鲁索替尼乳膏组(对数秩p《0.001)的第一次cri应答时间的累积发生率相对于媒介物显著更高。在1.5%鲁索替
尼乳膏bid和qd治疗组注意到的第一次应答的中位数时间(分别为8天和12.5天)相对于媒介物(未达到应答)更短。
[1234]
类似地,在符合mcid分析条件的患者中(基线瘙痒nrs≥2; n=272),早在第2天(治疗开始的36小时内)观察到的1.5%鲁索替尼乳膏bid(42.5%;p《0.01)和qd(37.2%;p《0.05)的mcid率相对于媒介物(13.6%)更高;与曲安西龙相比,在第2天观察到的1.5%鲁索替尼乳膏bid的mcid率也显著更高(20.5%;p《0.05)。
[1235]
引人注目的是,在研究中通过间接比较,鲁索替尼乳膏对瘙痒的减少似乎比在3期试验中用杜匹鲁单抗治疗的患者的报告的改善要大,尽管在杜匹鲁单抗研究中基线瘙痒nrs得分略高(simpson el, 等人“two phase 3trials of dupilumab versus placebo in atopicdermatitis,”n engl j med 2016;375:2335-48)。
[1236]
瘙痒nrs得分和skindex-16得分在基线时相关。瘙痒减少与qol 负担减小呈正相关(pearson相关性,0.67;p《0.001)。
[1237]
表8
[1238][1239]
注意到所有鲁索替尼乳膏方案的qol均显著改善。所述改善是治疗方案依赖性的(图10)。用1.5%鲁索替尼乳膏bid治疗的患者 skindex-16总体得分相对于基线的平均改善百分比在第2周为63.5% (媒介物,10.5%;p《0.001),并且在第8周为73.2%(媒介物,19.7%; p《0.001)。在第4周,与曲安西龙(59.7%)相比,1.5%鲁索替尼乳膏 bid的总体得分平均改善百分比显著更大(73.7%;p=0.02)。瘙痒nrs 得分和skindex-16得分在基线时相关。瘙痒减少与qol负担减小呈正相关(pearson相关性,0.67;p《0.001)。
[1240]
如表9(双盲期)所示,鲁索替尼乳膏耐受性良好,并且在双盲期和开放标签期均与临床上显著的部位反应无关。在开放标签期间,没有严重的治疗紧急不良事件(teae)或因teae导致的停药。所有治疗相关的不良事件的严重程度均为轻度或中度。
[1241]
表9
[1242][1243]
teae,治疗出现的不良事件。
[1244]
*:发生在>1%的总患者群体中。
[1245]
总之,鲁索替尼乳膏在easi得分、iga应答和瘙痒nrs得分方面以剂量和时间依赖性方式表现出改善。双盲期对1.5%鲁索替尼乳膏bid的应答在开放标签期持续(在第12周:easi得分相对于基线平均改善84.9%;iga应答者58.5%)。在开放标签期中转至1.5%鲁索替尼乳膏bid的患者经历了明显改善。1.5%鲁索替尼乳膏bid 方案在第4周带来了比曲安西龙显著更大的瘙痒的迅速和持续缓解。最后,鲁索替尼乳膏耐受性良好,没有与研究药物相关的严重teae,并且没有患者因teae停药。
[1246]
实施例3.在患有特应性皮炎的青少年和成人中进行的鲁索替尼乳膏的两项3期、双盲的、随机的、8周的、媒介物对照的功效和安全性研究,随后是长期安全性延长期
[1247]
在符合局部疗法条件的患有ad的青少年和成人(≥12岁)参与者中进行了两项随机的、媒介物对照的(vc)研究。在每项研究中,大约 600名参与者以2:2:1随机分配至鲁索替尼0.75%乳膏bid、鲁索替尼 1.5%乳膏bid或媒介物乳膏。此外,大约20%的总体研究群体由青少年组成。基线iga得分为2的参与者大约占整个研究群体的25%。ad受累为3%至20%bsa且iga得分为2至3的参与者接受了持续 8周的盲法研究治疗。
[1248]
乳膏中的鲁索替尼以磷酸鲁索替尼的形式存在,并且百分比为基于游离碱的%(重量/重量)。鲁索替尼乳膏制剂是如实施例1中所述制备的水包油乳膏制剂(参见美国专利公开号2015/0250790的表5; 0.75%鲁索替尼乳膏是通过实施例1中的方法通过用水调整制剂中 api的质量而制备的),所述专利以引用的方式整体并入本文。
[1249]
对于满足所有研究纳入标准且没有任何排除标准的参与者,获得研究药物分配。符合8周vc治疗期标准的参与者的关键入选标准是诊断为ad(如hanifin和rajka标准所定义),疾病持续时间至少2年, iga得分为2至3,以及在筛查和基线时的%bsa受累为3%至20%(不包括头皮)。
[1250]
出现额外ad区域的参与者在研究者批准的情况下被允许治疗这些额外区域,只要总治疗的bsa不超过20%,并且没有关于额外应用研究药物的安全性问题即可。在vc期间通过电话批准治疗额外区域,但研究者可以自行决定要求参与者返回进行计划外访视。直至
第8周,参与者继续治疗在基线时确定的治疗区域,即使这些区域开始改善。
[1251]
在第8周,所述研究的主要终点,评估参与者的功效,其中一定比例的参与者在iga得分方面达到治疗应答。还通过监测ae的频率、持续时间和严重程度;执行身体检查;以及在研究期间的不同时间点收集生命体征和临床/实验室评估来评估参与者的安全性和耐受性。
[1252]
完成第8周评估且没有额外的安全性问题的参与者将被提供以相同的治疗方案继续进入长期安全性(lts)期,但最初使用媒介物的参与者除外,他们将在第8周平均分配至2个积极治疗组中的1个中。当时,参与者进入lts期所需的iga得分为0至4。关于%bsa,没有要求的下限;参与者的bsa可能在0%至20%的范围内。
[1253]
在lts期间,参与者将每4周进行一次研究访视,直至研究结束(总计52周)。在这些访视时,研究者将评价ad病变,以确认参与者是否仍需要继续疗法(iga≥1)或是否可以(重新)进入观察/无治疗周期(iga=0)。
[1254]
在lts期间(即,第8周访视之后),参与者将自我评价ad的复发,并将治疗具有活动性ad变化的皮肤区域(不超过20%bsa)。如果在研究访视之间病变清除,参与者将在所述病变消失后3天停止治疗应用。参与者将在第一个复发体征时重新开始治疗他们的ad。在新病变位于通常位置之外和/或比基线时的分布更广泛的情况下,参与者需要联系站点以获得批准。
[1255]
参与者将进行持续时间长达60周的研究(28天筛选,8周的vc 期治疗,44周的lts期治疗,以及30( 7)天的安全性随访。
[1256]
所述研究的主要终点是在第8周达到iga-ts的患者的比例。所述研究的关键次要终点是:(i)在第8周达到easi-75的参与者比例; (ii)在第8周的瘙痒nrs得分相对于基线改善≥4分的参与者的比例;以及(iii)在第8周具有promis简表
–
睡眠障碍(8b)24小时回忆得分的临床上有意义改善的参与者的比例。
[1257]
其他次要终点包括:(i)不良事件的频率、持续时间和严重程度;执行身体检查;收集生命体征;以及收集血液学、血清化学和尿液分析的实验室数据;(ii)在第2和4周达到iga-ts的参与者的比例;(iii) 在每次访视时达到iga为0或1的参与者的比例;(iv)到第2和4周瘙痒nrs得分相对于基线改善≥4分的参与者的比例;(v)在vc期间在每次访视时达到easi50的参与者的比例;(vi)在第2和4周达到 easi75的参与者的比例;(vii)在vc期间在每次访视时达到easi90 的参与者的比例;(viii)在vc期间在每次访视时easi得分相对于基线的平均变化百分比;(ix)在vc期间在每次访视时scorad得分相对于基线的平均变化百分比;(x)在vc期间在每次访视时时瘙痒nrs 得分相对于基线的变化;(xi)达到瘙痒nrs得分改善至少2、3或4 分的时间;(xii)在vc期间在每次访视时皮肤疼痛nrs得分相对于基线的变化;(xiii)在第2、4和8周时具有promis简表
–
睡眠相关损害(8a)24小时回忆得分的临床上有意义的改善的参与者的比例;(xiv) 在第2、4和8周promis简表
–
睡眠相关损害(8a)24小时回忆和简表
–
睡眠障碍(8b)24小时回忆得分相对于基线的变化;(xv)在第8、12、 24和52周promis简表
–
睡眠相关损害(8a)7天回忆和简表
–
睡眠障碍(8b)7天回忆得分;(xvi)在每次访视时ad影响的%bsa相对于基线的变化;(xvii)在每次访视时poem得分相对于基线的变化;(xviii) 在第2、4、8、12、24和52周以及在计划外访视时dlqi得分相对于基线的变化;(xix)在第2、4和8周的平均pgic得分;(xx)在第2、 4和8周pgic的每个得分的参与者
的比例;(xxi)在第2、4和8周 pgic得分为1或2的参与者的比例;(xxii)在vc期间eq-5d-5l得分相对于基线的变化;(xxiii)在第2、4、8、12、24、36和52周wpai-shpv2.0相对于基线的变化;(xxiv)在所有研究访视时鲁索替尼的谷血浆浓度。
[1258]
符合全部以下关键纳入标准的受试者有资格被纳入研究:(i)年龄≥12至17岁(含端值)的青少年,以及年龄≥18岁的男性和女性;(ii) 被诊断患有如hanifin和rajka标准所定义的ad;(iii)至少2年的ad 病史;(iv)对于媒介物对照期,在筛选和基线时的iga得分为2至3;对于长期安全性期,iga得分为0至4;(v)对于媒介物对照期,在筛选和基线时,ad受累的%bsa(不包括头皮)为3%至20%;对于长期安全性期,ad受累的%bsa(不包括头皮)为0%至20%;(vi)同意从筛选开始直至最终随访停用所有用于治疗ad的药物;(vi)具有至少 1个靶病变(代表参与者的疾病状态,并且不存在于手、脚或生殖器上),其在筛选和基线时测量为约10cm2或更大;(vii)基于特定标准避免怀孕或生育孩子的意愿;以及(viii)理解并愿意签署知情同意书或父母或法定监护人的书面知情同意书,并在可能的情况下获得参与者的书面同意。
[1259]
符合以下关键排除标准中的任一项的受试者被排除在研究之外: (i)在基线前的4周内具有由研究者确定的不稳定的ad病程(自发改善或迅速恶化)的参与者;(ii)具有并发疾病和其他疾病史的参与者: (a)免疫受损(例如,淋巴瘤、获得性免疫缺陷综合征、wiskott-aldrich 综合征);(b)在基线前2周内需要用全身性抗生素、抗病毒药、抗寄生虫药、抗原虫药或抗真菌药治疗的慢性或急性感染;(c)在基线前的 1周内的活动性急性细菌、真菌或病毒性皮肤感染(例如,单纯疱疹、带状疱疹、水痘);(d)任何其他伴随的皮肤病(例如,全身性红皮病,诸如netherton综合征)、色素沉着或广泛的疤痕,在研究者看来,它们可能会干扰ad病变的评价或损害参与者的安全性;(e)仅在手或脚上存在ad病变,而先前没有其他典型受累区域(诸如面部或褶皱)的受累史;(f)其他类型的湿疹;(iii)具有任何严重的疾病或医学、身体或精神病状,在研究者看来,它们会干扰全面参与研究,包括研究药物的施用和参加所需的研究访视;对参与者构成重大风险;或干扰研究数据的解释。例如:(a)临床上显著或不受控制的心脏病,包括不稳定型心绞痛、从研究药物施用的第1天起6个月内的急性心肌梗塞、纽约心脏协会iii级或iv级充血性心力衰竭以及需要治疗的心律失常或不受控制的高血压(血压》150/90mmhg),除非经医疗监护人/赞助商批准;(b)参加本研究前5年内有恶性肿瘤病史的参与者,经过充分治疗的非转移性恶性肿瘤除外;(c)低血红蛋白(《10g/dl);(d)透析时的严重肾病(血清肌酐》2mg/dl);(e)当前和/或肝病史,包括已知的乙型或丙型肝炎,伴有肝脏或胆道异常;(iv)在基线前的指定清除期内使用以下治疗中的任一者的参与者:(a)5个半衰期或12周(以较长者为准)—生物剂(例如,杜匹鲁单抗);(b)4周—全身性皮质类固醇或促肾上腺皮质激素类似物、环孢菌素、甲氨蝶呤、硫唑嘌呤或其他全身性免疫抑制或免疫调节剂(例如,霉酚酸酯或他克莫司);(c)2周—免疫接种和镇静抗组胺药,除非长期稳定方案(允许使用非镇静抗组胺药);(d)1周—使用ad的其他局部治疗(除温和润肤剂外),诸如皮质类固醇、钙调神经磷酸酶抑制剂、煤焦油(洗发水)、抗生素、抗菌沐浴露/肥皂。允许使用稀释的次氯酸钠“漂白剂”浴,只要每周不超过2次并且在整个研究期间其频率保持不变即可;(v)先前已接受全身或局部的jak抑制剂的参与者;(vi)在基线前的2周内的紫外线疗法或长时间暴露于天然或人工uv辐射源(例如,阳光或仿晒机)和/或在研究期间打算进行此类暴露,这被研究者认为潜在地影响参与者的 ad;
(vii)在筛查hiv抗体时的阳性血清学测试结果;(viii)肝功能测试:ast或alt≥2
×
uln;碱性磷酸酶和/或胆红素》1.5
×
uln (如果胆红素被分级并且直接胆红素《35%,则分离的胆红素》1.5
×ꢀ
uln是可接受的);(ix)怀孕或哺乳的参与者,或考虑怀孕的参与者; (x)在筛选前1年内的酗酒或吸毒史,或目前饮酒或吸毒,在研究者看来,这会干扰参与者遵守施用计划和研究评估的能力;(xi)目前的治疗,或者在基线前的30天或5个半衰期(以较长者为准)内用另一种研究药物治疗或目前参加另一种研究药物方案;(xii)在研究者看来不能或不可能遵守施用计划和研究评价的参与者;(xiii)根据司法或行政当局发布的命令被送入精神卫生机构的参与者;(xiv)赞助商的雇员或研究者,或以其他方式依赖他们的参与者。
[1260]
scorad是一种评估湿疹程度和严重程度(即强度)的工具,并且将在治疗开始之前、期间和之后完成,以确定治疗是否有效(oakley, 2009.https://www.dermnetnz.org/topics/scorad/.accessed november 1, 2018.)。这是在所有vc研究访视期间执行的,以基线开始。为了确定程度,使用规则9或手印法计算湿疹影响面积(a)占全身的百分比。将得分相加以给出可能的最大值100%。为了确定强度,选择了一个有代表性的湿疹区域(参见下文靶病变)。以下发红、肿胀、渗出/结痂、划痕、皮肤增厚(苔藓化)、干燥(这是在没有炎症的区域评估的)的每个体征的强度评估如下:无(0);轻度(1);中度(2);重度(3)。强度得分相加在一起以给出“b”(最高得分为18)。主观症状,即瘙痒和失眠,由参与者使用视觉模拟量表进行评分,其中“0”是不痒(或不失眠),并且“10”是可想象的最严重的瘙痒(或失眠)。这些得分相加以给出“c
”ꢀ
(最高得分为20)。总分给予强度大约60%的权重,并且给予参与者的程度和主观体征(即失眠等)各自大约20%的权重,并且计算如下:a/5 7b/2 c。
[1261]
靶病变评估如下执行。在基线时,选择代表参与者的总体疾病并将用研究药物治疗的病变作为靶病变。在vc期间的每次后续访视时,此病变被确定、测量并记录在参与者的医疗记录中。应该在他们的医疗记录中做一个注释,并且基线照片可以标出靶病变的位置。靶病变不应在手、脚或生殖器上。靶病变的大小应为大约10cm2或更大。最长直径和垂直于最长直径的测量值以毫米为单位测量。在拍摄照片之后和应用研究治疗之前,从靶病变处进行皮肤剥离(使用胶带)、病变皮肤金黄色葡萄球菌(s.aureus)拭子和tewl评估。
[1262]
在vc期间的每次访视时估计ad影响的总%bsa。使用palmar 方法作为指导,手掌加5个手指,手指并拢在一起并且拇指向侧面(手印),作为1%bsa,并且拇指作为0.1%bsa,体表面积评估近似为最接近的0.1%。
[1263]
使用以下工具评估了各种患者报告的结果,包括生活质量(qol): dqli(皮肤病学生活质量指数)、pgic(患者对变化的总体印象)、 poem(以患者为导向的湿疹测量)、eq-5d-5l(eq-5d是经验证的、自我管理的、通用的、实用性问卷,其中参与者将基于以下标准评定他们当前的健康状态:活动能力、自我保健、日常活动、疼痛/不适和焦虑/抑郁)、wpai:shp(工作效率和活动损害问卷:特定健康问题2.0版)、瘙痒nrs、皮肤疼痛nrs(皮肤疼痛数值评定量表)、 promis简表
–
睡眠相关损害(8a)和promis简表
–
睡眠障碍(8b)。为了避免参与者对问卷的回答存在偏见,所有这些评估均在研究访视当天的任何其他评价或研究程序之前以及与研究者或研究站点工作人员讨论之前完成。在基线访视时,所有患者报告的结果均在参与者第一次应用研究药物之前完成。
[1264]
向参与者发放一份纸质问卷或手持设备(ediary)进行每日评估。参与者被指示在从筛选当天开始直至第8周或治疗停止的每个评估所需的特定时间点来完成日记。参与者
通过日记从筛选访视和vc期间的所有访视开始执行每日评估:参与者对以下(在过去24小时期间)进行评定:瘙痒nrs
–
将在晚上记录最严重的瘙痒水平;皮肤疼痛nrs
–
将在晚上记录最严重的疼痛水平;promis问卷;简表
–
睡眠相关损害(8a)将在晚上完成;简表
–
睡眠障碍(8b)将在早晨进行评估。
[1265]
在所有vc现场访视期间,评估了以下各项:eq-5d-5l
–
从筛选开始;wpai:shp
–
从筛选开始;dlqi/cdlqi
–
从第1天开始;poem—从第1天开始;pgic
–
从第2周开始。
[1266]
在lts期间,将评估以下各项:eq-5d-5l;wpai:shp;dlqi/cdlqi;poem;promis简表
–
睡眠相关损害(8a)和简表
–
睡眠障碍(8b):
[1267]
dlqi是一个简单的10个问题的经过验证的问卷,用于测量皮肤问题在之前7天对参与者的影响程度,如soa中所述(finlayay,khangk,“dermatologylifequalityindex(dlqi)-asimplepracticalmeasureforroutineclinicaluse,”clinexpdermatol1994;19:210-216.)。参与者,年龄≥16岁或更大,以(1)非常,(2)很多,(3)很少或(4)根本没有来回答问卷。问卷在如下6个标题下进行分析:症状和感受(问题1和2);日常活动(问题3和4);休闲(问题5和6);工作和学校(问题7);个人关系(问题8和9);治疗(问题10)。
[1268]
cdlqi是dlqi的青少年/儿童版本,并且由年龄≥12岁至《16岁的青少年完成。它是不言自明的,并且可以简单地交给被要求填写并可以请求父母或监护人帮助的参与者。问卷在如下6个标题下进行分析:症状和感受(问题1和2);休闲(问题4、5和6);工作和学校(问题7);个人关系(问题3和8);睡眠(问题9);治疗(问题10);患者的总体变化印象
[1269]
pgic是参与者的自我报告的衡量标准,其反映了他们对治疗功效的信念。pgic是一个7分量表,描绘了参与者对总体改善的评定,并将在vc期间的现场访视期间获得(hursth,boltonj.“assessingtheclinicalsignificanceofchangescoresrecordedonsubjectiveoutcomemeasures,”jmanipulativephysiolther2004;27:26-35)。参与者将回答以下问题:“自从您在本研究中开始接受治疗以来,您在接受研究药物治疗的区域的特应性皮炎:(1)极大改善,(2)很大改善,(3)最小改善,(4)没有变化,(5)最小恶化,(6)很大恶化,以及(7)极大恶化。”[1270]
poem是一项7个问题的生活质量评估,其询问参与者在过去7天内被其皮肤病状的各个方面所困扰的天数,如soa中所述(charmancr,等人,archdermatol2004,140:1513-1519)。
[1271]
eq-5d-5l:eq-5d是经过验证的、自我施用的、通用实用性问卷,其中参与者(青少年和成人)基于以下标准(维度)对他们当前的健康状态进行评定:活动能力、自我保健、日常活动、疼痛/不适和焦虑/抑郁。5l表示每个维度有5个等级,如下:没有问题、轻微问题、中度问题、重度问题、极端问题。在所有vc期研究访视期间(从筛选开始)和特定lts访视(第12、24、36、52周和随访)时,要求参与者通过勾选5个维度中的每一个中最适当的陈述旁边的框说明他/她在过去7天的健康状态。5个维度的数字可以组合成一个描述参与者健康状态的5位数字(euroqolresearchfoundation.eq-5d-5l.2017.https://euroqol.org/eq-5d-instruments/eq-5d-5l-about/.2018年7月17日访问)。
[1272]
wpai:shpv2.0问卷是经过验证的6项工具,在从筛选开始的所有现场访视期间、vc期间和特定lts访视时(第12、24、36、52周和随访)完成,其衡量过去7天内总体健康和特
定症状对工作效率和除此之外的常规活动的影响(reilly mc,zbrozek as,dukes em,“thevalidity and reproducibility of a work productivity and activityimpairment instrument,”pharmacoeconomics 1993;4:353-365)。
[1273]
瘙痒nrs是每日患者报告的瘙痒强度的最严重水平的衡量标准(24小时回忆)。要求参与者通过选择从0(不痒)至10(可想象的最严重的瘙痒)之间的最能描述他们在过去24小时内最严重的瘙痒水平的数字来评定由于其ad引起的瘙痒严重程度。向参与者发给记录瘙痒严重程度的日记。参与者被指示在从筛选当天开始直至vc期间最后一次应用研究药物每天晚上完成日记。
[1274]
皮肤疼痛nrs是每日患者报告的最严重的疼痛强度水平的衡量标准(24小时回忆),从0(不疼)至10(可想象的最严重的疼痛)。参与者被要求“通过选择一个最能描述您在过去24小时内最严重的疼痛水平的数字来评定您的特应性皮炎皮肤变化的疼痛严重程度”,如 soa中所述。
[1275]
每天晚上向参与者发放一份日记,以记录皮肤疼痛严重程度,从而评定过去24小时内最严重的疼痛。参与者被指示在从筛选当天开始直至vc期间最后一次应用研究药物每天晚上完成日记。
[1276]
(患者报告的结果测量信息系统)是一组广泛使用和接受的患者报告的结果测量值,这些测量值已通过强大的临床结果评估开发方法进行开发并得到心理测量学的支持。选定的promis简表
–
睡眠相关损害(8a)和简表
–
睡眠障碍(8b)问卷已修改为使用24小时回忆每天用日记完成:简表
–
睡眠相关损害(8a)在vc期间的晚上收集,而简表
–
睡眠障碍(8b)在早晨收集。从第8周开始和lts期间,这些在/将在7天回忆期内完成,并在研究访视期间在现场完成。
[1277]
promis简表
–
睡眠相关损害(8a)问卷在vc期间的晚上完成。此评估侧重于自我报告的对正常清醒时间期间的警觉性、嗜睡和疲倦感的感知,以及与睡眠问题或警觉性受损相关联的清醒期间的感知的功能损害(buysse,sleep 2010;33:781-792)。所述问卷具有8个简单的问题,采用5分量表,得分范围从8至40,得分越高表明睡眠相关损害的严重程度越高。每个项目都要求参与者评定参与者睡眠损害的严重程度。回忆期是vc期的过去24小时和lts期的过去7天。
[1278]
promis简表
–
睡眠障碍(8b)问卷在vc期间的早晨完成。此评估是自我报告的对睡眠质量、睡眠深度和与睡眠相关联的恢复的感知。睡眠障碍不侧重于特定睡眠病症的症状,并且也不提供睡眠量的主观估计(例如,睡眠总量、入睡时间、睡眠期间的清醒量;buysse等人 2010)。睡眠障碍简表是通用的,而不是疾病特定的。所述问卷也是5 分量表,得分范围从8至40,得分越高表明睡眠障碍的严重程度越高。每个项目都要求参与者评定参与者睡眠障碍的严重程度。回忆期是vc期的过去24小时和lts期的过去7天。
[1279]
vc期的结果
[1280]
在true-ad1(研究303)中,631名患者被随机分配(媒介物, n=126;0.75%bid,n=252;1.5%bid,n=253);中位数(范围)年龄为32.0(12-85)岁,并且62.0%的患者是女性。七十三名患者(11.6%) 退出研究。在true-ad2(研究304)中,618名患者被随机分配(媒介物,n=124;0.75%bid,n=248;1.5%bid,n=246);中位数(范围) 年龄为33.0(12-85)岁,并且61.5%是女性。五十七名患者(9.2%)退出研究。true-ad1和true-ad2的完整人口
统计数据分别在表10和表11中示出。媒介物、0.75%bid和1.5%bid群体的合并true-ad1 和true-ad2群体的平均基线瘙痒nrs得分分别为5.15、5.14和 5.09。
[1281]
表10
[1282][1283][1284]
表11
[1285][1286]
功效群体由631名true-ad1患者(所有随机分配的患者)和577 名true-ad2患者(媒介物,n=118;0.75%bid,n=231;1.5%bid,n=228)组成。在两项研究中,所有接受≥1剂治疗的患者(所有随机分配的患者)均被纳入安全性群体。
[1287]
true-ad1(研究303)和true-ad2(研究304)的主要功效终点和主要次要功效终点的总结在表12和表13中示出。
[1288]
表12
[1289] 媒介物0.75%bid1.5%bidn126252253iga-ts15.1%50%**53.8%**easi7524.6%56.0%**62.1%**itch415.4%40.4%**52.2%**^promis6 8b9.5%21%*22.3%*promis6 8a13.2%20.2%21.6%
[1290] **p《0.0001,鲁索替尼相对于媒介物;*p《0.01鲁索替尼相对于媒介物;^p=0.04,1.5%bid相对于0.75%bid
[1291]
表13
[1292] 媒介物0.75%bid1.5%bidn118231228iga-ts7.6%39.0%**51.3%**^^easi7514.4%51.5%**61.8%**^itch416.3%42.7%**50.7%**promis6 8b19.1%20.7%25.6%promis6 8a13.5%20.0%23.1%
[1293]
**p《0.0001,鲁索替尼相对于媒介物;*p《0.01鲁索替尼相对于媒介物;^p=0.04,1.5%bid相对于0.75%bid
[1294]
在true-ad1和true-ad2中,相对于媒介物(15.1%和7.6%),显著更多的用鲁索替尼乳膏治疗的患者达到iga治疗成功(0.75% bid,50.0%和39.0%;1.5%bid,53.8%和51.3%,所有p《0.0001)(图 11)。
[1295]
在true-ad1和true-ad2中,分别56.0%和51.5%的应用鲁索替尼乳膏0.75%bid的患者达到easi-75,以及62.1%和61.8%的应用1.5%bid的患者达到easi-75,而24.6%和14.4%的应用媒介物的患者达到easi-75(所有p《0.0001)(图12)。在true-ad1(研究303) 中,湿疹面积和严重程度指数得分随着时间的推移而减小,到第2周,两个积极治疗组与媒介物治疗组明显分离。在合并的true-ad1(研究303)和true-ad2(研究304)研究中,湿疹面积和严重程度指数得分随着时间的推移而减小,到第2周,两个积极治疗组与媒介物治疗组明显分离(参见图31、图32和图33)。
[1296]
在这两项研究中,与媒介物相比,应用鲁索替尼乳膏(0.75%bid 或1.5%bid)的患者在第8周时达到统计学上显著的瘙痒减少(nrs4) (图13;数字是对于基线瘙痒nrs得分≥4的患者的)。除了在第8周获得持续的瘙痒减少外,应用鲁索替尼乳膏(0.75%bid或1.5%bid) 的患者也在1-2天内经历了瘙痒的快速减少(图14和图15;表14 (true-ad1;媒介物、0.75%bid和1.5%bid的平均基线瘙痒nrs 得分分别为6.39、6.44和6.45);表15(true-ad2;媒介物、0.75% bid和1.5%bid的平均基线瘙痒nrs得分分别为6.42、6.38和6.38);数字是对于基线瘙痒nrs得分≥4的患者的)。
[1297]
表14
[1298][1299]
*鲁索替尼乳膏组和媒介物之间的p-值
[1300]
表15
[1301][1302][1303]
*鲁索替尼乳膏组和媒介物之间的p-值
[1304]
在true-ad1和true-ad2中,对于接受1.5%鲁索替尼乳膏bid 的患者,与媒介物相比,到第2天(第一次应用鲁索替尼乳膏的12小时内)观察到显著更大的瘙痒减少(表16(true-ad1)和表17 (true-ad2),对于整个患者群体测量)。表16的媒介物、0.75%bid 和1.5%bid的平均基线瘙痒nrs得分分别为5.06、5.13和5.15。表 17的媒介物、0.75%bid和1.5%bid的平均基线瘙痒nrs得分分别为5.25、5.15和5.02。到第2天(第一次应用鲁索替尼乳膏的36小时内),在两项研究中,0.75%bid鲁索替尼乳膏的患者达到显著更大的瘙痒减
少。
[1305]
表16
[1306][1307]
*鲁索替尼乳膏组和媒介物之间的p-值
[1308]
表17
[1309][1310]
*鲁索替尼乳膏组和媒介物之间的p-值
[1311]
true-ad1和true-ad2研究的每日瘙痒nrs得分相对于基线的平均变化的合并数据在表18和图25中示出。p-值示出0.75%和 1.5%鲁索替尼乳膏的差异到第1天(12小时内)变得显著。0.75%和 1.5%鲁索替尼乳膏在第1天(12小时内)的每日瘙痒nrs得分相对于基线的平均变化分别为-0.38和-0.48。0.75%和1.5%鲁索替尼乳膏在第2天(36小时内)的每日瘙痒nrs得分相对于基线的平均变化分别为-1.12和-1.24。
[1312]
表18
[1313][1314][1315]
在基线瘙痒nrs得分≥2的患者中,对于接受0.75%和1.5%bid 鲁索替尼乳膏的患者,到第2天(第一次应用鲁索替尼乳膏的36小时内)达到瘙痒nrs得分改善≥2分的应答者的数量变得在统计学上显著(表19(true-ad1)和表20(true-ad2))。
[1316]
表19
[1317][1318][1319]
表20
[1320][1321][1322]
在基线瘙痒nrs得分≥2的患者中,对于接受0.75%和1.5%bid 鲁索替尼乳膏的患者,到第2天(第一次应用鲁索替尼乳膏的36小时内)达到瘙痒nrs得分改善≥2分的应答者的数量变得在统计学上显著(表21(true-ad1和true-ad2))。0.75%和1.5%鲁索替尼乳膏与媒介物之间的差异在第1天(12小时内)变得在统计学上显著。
[1323]
表21
[1324][1325]
在基线瘙痒nrs得分≥4的患者中,对于接受0.75%bid鲁索替尼乳膏的患者,到第一次应用鲁索替尼乳膏的第4天,并且对于接受1.5%bid鲁索替尼乳膏的患者,到第一次应用鲁索替尼乳膏的第 3天,达到瘙痒nrs得分改善≥4分的应答者的数量变得在统计学上显著(表22(true-ad1和true-ad2和图26))。
[1326]
表22
[1327][1328][1329]
对于在true-ad1研究中接受0.75%和1.5%bid鲁索替尼乳膏的患者,到第2周达到iga得分为0或1(表23)。对于在true-ad2 研究中接受1.5%bid鲁索替尼乳膏的患者,到第2周,并且对于接受0.75%bid鲁索替尼乳膏的患者,到第4周,达到iga得分为0 或1(表24)。
[1330]
表23
[1331][1332]
表24
[1333][1334][1335]
对于接受0.75%和1.5%bid鲁索替尼乳膏的患者,患者达到 easi90(表25(true-ad1)和表26(true-ad2)。0.75%和1.5%鲁索替尼乳膏与媒介物之间的差异到第2周在统计学上显著。
[1336]
表25
[1337][1338]
表26
[1339]
[1340]
对于true-ad1和true-ad2,在第8周,分别21.0%和20.7%的应用0.75%bid的患者以及22.3%和25.6%的应用鲁索替尼乳膏1.5%bid的患者达到promis睡眠损害得分(8a)改善≥6分(图16)。对于合并的true-ad1(研究303)和true-ad2,在第8周,20.1%的应用鲁索替尼乳膏0.75%bid的患者和22.3%的应用鲁索替尼乳膏 1.5%bid的患者达到promis睡眠损害得分(8a)改善≥6分(图30)。对于true-ad1和true-ad2,在第8周,分别20.2%和20.0%的应用鲁索替尼乳膏0.75%bid的患者以及21.6%和23.1%的应用鲁索替尼乳膏1.5%bid的患者达到promis睡眠障碍得分(8a)改善≥6分(图17)。对于合并的true-ad1(研究303)和true-ad2(研究304),在第8周,20.9%的应用鲁索替尼乳膏0.75%bid的患者和23.8%的应用鲁索替尼乳膏1.5%bid的患者达到promis睡眠障碍得分(8a)改善≥6分(图29)。
[1341]
关于0.75%bid鲁索替尼乳膏,与1.5%qd鲁索替尼乳膏(来自 2期)相比,iga-ts和easi75的患者应答在第2、4和8周出乎意料地改善(参见表27和表28)。
[1342]
表27
[1343][1344]
a)参见图22(3期结果)
[1345]
b)参见图4(2期结果)
[1346]
表28
[1347][1348]
a)参见图23(3期结果)
[1349]
b)参见图3(2期结果)
[1350]
在治疗8周后,两项研究中治疗出现的不良事件的总体发生率在鲁索替尼乳膏方案用途媒介物之间是相当的(在true-ad1中,0.75% bid,29.4%;1.5%bid,28.9%;媒介物,34.9%;并且在true-ad2 中,0.75%bid,29.4%;1.5%bid,23.6%;媒介物,32.3%)。所有治疗组中的重度不良事件发生率是相当的(0.75%bid,0.8%;1.5% bid,0.6%;媒介物,0.8%)。没有观察到临床上显著的应用部位反应,包括敏感皮肤区域。例如,应用部位灼伤的发生率与媒介物相当或更低(在true-ad1中,0.75%bid,0.0%;1.5%bid,0.8%;媒介物,1.6%;并且在true-ad2中,0.75%bid,0.8%;1.5%bid, 0.8%;媒介物,6.5%)。应用部位发痒的发生率与媒介物相当或更低 (0.75%bid,1.2%;1.5%bid,0.0%;媒介物,1.6%)。8周内血红蛋白(g/l)和血小板(109/l)的变化在治疗组(0.75%bid和1.5%bid)与媒介物之间是相当的(图18至图21)。
[1351]
体表受累更高的患有更重度的特应性皮炎的患者
[1352]
引人注目的是,在true-ad1和true-ad2研究中发现,体表受累更高的患有更严重的特应性皮炎的患者似乎对局部鲁索替尼乳膏应答良好。这些患者一般来说在基线时的特应性皮炎受累的体表面积≥10%,并且在基线时的湿疹面积和严重程度指数得分≥16。
[1353]
对true-ad1和true-ad2患者进行了分析,这些患者在基线时的特应性皮炎受累的体表面积≥10%,并且在基线时的湿疹面积和严重程度指数得分≥16。在亚组的81名患者中,有13名患者接受凝聚物,36名患者接受0.75%bid鲁索替尼乳膏,以及32名患者接受 1.5%bid乳膏。100%的接受赋形剂和1.5%bid鲁索替尼乳膏的患者在基线时的iga得分为3,而接受0.75%bid鲁索替尼乳膏的36 名患者中的33名在基线时的iga得分为3,而其余患者在基线时的 iga得分为2。
[1354]
在true-ad1和true-ad2两者中,对于在基线时的特应性皮炎受累的体表面积≥10%并且在基线时的湿疹面积和严重程度指数得分≥16的患者,相对于媒介物(0.0%),更多用鲁索替尼乳膏治疗的患者在第2周、第4周和第8周的媒介物对照期中达到iga治疗成功 (0.75%bid,30.6%、38.9%和50.0%;1.5%bid,25.0%、46.9%和59.4%)(图22)。
[1355]
在true-ad1和true-ad2两者中,相对于媒介物(3.7%、6.1%和11.5%),更多用鲁索替尼乳膏治疗的患者在第2周、第4周和第8 周的媒介物对照期期达到获iga治疗成功(0.75%bid,19.9%、39.1%和44.7%;1.5%bid,26.2%、45.1%和52.6%)(图27)。
[1356]
在true-ad1中,对于在基线时的iga得分为3并且在基线时的特应性皮炎受累的体表面积≥10%的患者,相对于媒介物(0.0%、 4.8%和14.3%),更多用鲁索替尼乳膏治疗的患者在第2周、第4周和第8周的媒介物对照期达到iga治疗成功(0.75%bid,21.0%、 42.0%和53.0%;1.5%bid,25.3%、50.6%和60.9%)。
[1357]
在true-ad1和true-ad2两者中,对于在基线时的特应性皮炎受累的体表面积≥10%并且在基线时的湿疹面积和严重程度指数得分≥16的患者,与媒介物(在第2周、第4周和第8周时分别为0%、 7.7%和7.7%)相比,更多应用鲁索替尼乳膏0.75%bid(在第2周、第4周和第8周时分别为36.1%、63.9%和75.0%)和鲁索替尼乳膏1.5% bid(在第2周、第4周和第8周时分别为37.5%、56.3%和71.9%) 的患者达到easi-75(图23)。
[1358]
在true-ad1和true-ad2两者中,与媒介物(在第2周、第4 周和第8周时分别为4.9%、12.3%和19.7%)相比,更多应用鲁索替尼乳膏0.75%bid(在第2周、第4周和第8周时分别为28.0%、47.0%和53.8%%)和鲁索替尼乳膏1.5%bid(在第2周、第4周和第8周时分别为33.9%、54.7%和62.0%)的患者达到easi-75(图28)。
[1359]
在true-ad1和true-ad2两者中,对于在基线时的特应性皮炎受累的体表面积≥10%、在基线时的湿疹面积和严重程度指数得分≥ 16并且在基线时的瘙痒数值评定量表得分≥4的患者,与媒介物(在第 2周、第4周和第8周时分别为0%、27.3%和27.3%)相比,更多应用鲁索替尼乳膏0.75%bid(在第2周、第4周和第8周时分别为23.1%、42.3%和50%)和以1.5%bid应用鲁索替尼乳膏1.5%bid(在第2周、第4周和第8周时分别为33.3%、66.7%和61.1%)的患者达到瘙痒减少(瘙痒nrs得分改善≥4分)(图24)。
[1360]
令人惊讶的是,这些结果表明,与用全身性生物剂(像杜匹鲁单抗)治疗的患者相比,体表受累更高的患有更重度特应性皮炎的患者似乎对0.75%或1.5%bid的局部鲁索替尼乳膏的应答相当或更好(参见表29中的比较;和图22至图24)。这些结果特别令人惊讶,因为与16周的杜匹鲁单抗相比,对鲁索替尼乳膏的应答早在4至8周就可以看到。
[1361]
表29
[1362][1363]a患者在基线时的瘙痒nrs得分≥4。
[1364]b皮下(solo1和solo2试验)。
[1365]csimpson el,等人“two phase 3 trials of dupilumab versusplacebo in atopic dermatitis,”n engl j med 2016;375:2335-48,表1。
[1366]
根据前述描述,除本文所述的内容外,本发明的各种修改对于本领域技术人员而言将是显而易见的。这些修改也意欲落入所附权利要求的范围内。本技术中引用的每个参考文献以引用的方式整体并入本文。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。