1.本发明涉及免疫检测技术领域,具体而言,涉及一种筛选不受补体干扰的单克隆抗体对的方法。
背景技术:
2.免疫诊断特别是基于双抗体夹心的诊断技术,由于其灵敏度高、特异性强的特点,近年来飞速发展,如酶联免疫、免疫层析、化学发光检测技术等。尤其是免疫化学发光检测技术,由于其灵敏度高、速度快、自动化等优势,逐渐成为主要的临床诊断技术。但在临床应用中,免疫诊断常常受到样本中干扰物的影响。
3.样本中干扰物有类风湿因子(rf)、异嗜性抗体、自身抗体、补体、生物素、血脂、胆红素等,其中,补体是非常重要的一类干扰物。
4.目前还没有易行的、可以通用的解决补体干扰的方法。常见的,如53℃,10min加热样本灭活补体在临床上较难施行,用金属螯合剂乙二胺四乙酸(edta)、氨基三乙酸(nta)等阻断补体激活级联反应则由于本身干扰抗原抗体反应或环保问题受限制。也有推荐使用禽类如鸡igy抗体替代鼠、兔等来源的抗体可不受补体干扰,但禽类抗体目前使用非常少,也无法解决大量的免疫诊断需求所面临的补体干扰问题。
技术实现要素:
5.本发明解决了免疫诊断常常受到补体干扰,影响免疫检测的准确性的技术问题,从诊断原料选择上减少受补体干扰的概率,实现了免疫诊断不易受补体干扰,提高免疫诊断准确性的技术效果。
6.为解决上述问题,本发明提供一种筛选不受补体干扰的单克隆抗体对的方法,包括以下步骤:s10:获得阴性样本混合物;s20:在阴性样本混合物中加入抗原,获得检测样本一;s30:对阴性样本混合物进行加热,并加入抗原,获得检测样本二;s40:在检测样本二中加入补体c1q,获得检测样本三;s50:用待选单克隆抗体对制备的化学发光试剂,对检测样本一、检测样本二和检测样本三分别进行免疫化学发光检测,获得检测结果一、检测结果二、检测结果三;s60:根据检测结果一、检测结果二、检测结果三,获得不受补体干扰的单克隆抗体对。
7.与现有技术相比,采用该技术方案所达到的技术效果:本发明提供的一种筛选不受补体干扰的单克隆抗体对的方法,通过对阴性样本混合物进行加热,能够对其补体进行灭活,进而检测样本一为非灭活样本,检测样本二为灭活样本,向灭活及非灭活样本中加入等量的待测物,用待选抗体对同时测试上述样本,计算补体灭活后测试结果变化,再向灭活及添加待测物的样本二中添加人c1q,即为检测样本三,再次测试c1q对测试结果的影响,从而确认易受补体干扰抗体对,同时筛选出不易受补体干扰的抗体对。本方法可以在免疫诊断的原料选择阶段筛选出不易受补体干扰的抗体对,在免疫诊断产品开发阶段减少受补体干扰的概率。
8.在本发明的一个实例中,s10包括以下步骤:s11:获取阴性样本;s12:测定阴性样本的c1q含量,获得检测结果;s13:根据检测结果,将阴性样本进行分类,并获得阴性样本混合物。
9.与现有技术相比,采用该技术方案所达到的技术效果:通过将阴性样本根据其c1q含量进行精细化分类,进而能够获得补体含量不同的阴性样本混合物,使得筛选结果更加准确,更具参考意义。
10.在本发明的一个实例中,将阴性样本进行分类,并获得阴性样本混合物包括以下步骤:s14:将c1q含量大于220μg/ml的阴性样本混合标记为高补体阴性样本混合物,c1q大于170μg/ml且小于220μg/ml的阴性样本混合标记为中补体阴性样本混合物,c1q小于170μg/ml的阴性样本混合标记为低补体阴性样本混合物。
11.与现有技术相比,采用该技术方案所达到的技术效果:对高补体阴性样本混合物、中补体阴性样本混合物、低补体阴性样本混合物各取一部分进行实验操作,使得本发明的筛选方法准确度更高,对比性更强,能够得到不同补体含量下的各个样本的检测结果,进而从待选单克隆抗体对中筛选出不受补体干扰的抗体对,以用于后续的免疫检测。
12.在本发明的一个实例中,对阴性样本混合物进行加热,加热温度为50-55℃,加热时间为10-15min。
13.与现有技术相比,采用该技术方案所达到的技术效果:通过对阴性样本混合物进行加热,能够对其补体进行灭活,进而灭活样本与未灭活样本能够作为对照组,确定出易受补体干扰抗体对。
14.在本发明的一个实例中,s60包括以下步骤:s61:根据检测结果一、检测结果二、检测结果三,计算变化比例,在检测结果一和检测结果二的变化比例的差值小于10%,且检测结果二和检测结果三的变化比例的差值小于10%的情况下,待选单克隆抗体对不受补体影响;s62:获得不受补体干扰的单克隆抗体对。
15.与现有技术相比,采用该技术方案所达到的技术效果:通过比对测值,在检测结果一和检测结果二的变化比例的差值小于10%的情况下,能够确认易受补体干扰的单克隆抗体对,在检测结果二和检测结果三的变化比例的差值小于10%的情况下,能够进一步筛选出不易受补体干扰的单克隆抗体对,该方法简明有效,准确度高。
16.在本发明的一个实例中,检测样本一和检测样本二中的阴性样本混合物、抗原的添加量相同。
17.与现有技术相比,采用该技术方案所达到的技术效果:检测样本一为检测样本二的对照组,为保证实验数据的可靠性,根据控制变量法,二者只有是否进行加热的区别,控制阴性样本混合物、抗原的添加量相同,亦或是检测样本一和检测样本二按相同比例添加抗原。
18.在本发明的一个实例中,s40之前包括以下步骤:s31:收集血清;s32:纯化血清中的c1q,获得粗纯品;s33:进一步纯化粗纯品,获得补体c1q。
19.与现有技术相比,采用该技术方案所达到的技术效果:酶联免疫检测中捕获抗体的包被,化学发光检测中捕获抗体偶联磁珠,抗体标记如生物素标记、吖啶酯标记、荧光微球标记,以及抗原抗体结合均能引起抗体构象改变,从而暴露出fc段补体c1q的结合位点,当c1q与两个以上抗体fc上的位点结合即可激活样本中的补体系统。c1q是一个18聚体的复
合物,具有6个抗体结合位点,当c1q分子同时结合捕获抗体与检测抗体则导致假阳性或假性升高;补体系统激活后形成的c3b、c4b均结合于抗体的fab,从而影响捕获抗体或检测抗体与抗原的结合,则导致假阴性或假性降低,均会影响免疫检测的准确性。因此对人血清c1q进行纯化,便于后续添加至灭活及添加待测物的阴性样本混合物中,进行检测,以验证待选单克隆抗体是否会受到补体的干扰。
20.在本发明的一个实例中,s40包括以下步骤:s41:在检测样本二中加入补体c1q,获得检测样本三。
21.与现有技术相比,采用该技术方案所达到的技术效果:通过在灭活及添加待测物的样本中添加人c1q,再次测试c1q对测试结果的影响,能够进一步筛选出不易受补体干扰的抗体对,提高筛选结果的准确性。
22.在本发明的一个实例中,免疫化学发光检测包括以下步骤:s44:制备发光试剂;s45;制备固相试剂;s46:将发光试剂、固相试剂分别与检测样本一、检测样本二、检测样本三进行混合,利用化学发光免疫分析仪进行检测。
23.与现有技术相比,采用该技术方案所达到的技术效果:利用免疫化学发光检测检测样本一、检测样本二、检测样本三,记录其光亮值并计算变化比例,若测值改变不显著,则该单克隆抗体对不易受补体干扰,通过数据的比对,筛选出不易受补体干扰的单克隆抗体对,准确度更高,且操作过程简单,容易实现。
24.在本发明的一个实例中,测定阴性样本的c1q含量采用补体c1q诊断试剂盒。
25.与现有技术相比,采用该技术方案所达到的技术效果:采用补体c1q诊断试剂盒,具有定量方法敏感、快速简便的优势,且提高筛选效率。
附图说明
26.图1为本发明实施例提供的第二轮纯化人血清c1q的电泳条带图,其中lane1为10ul上样;lane2为5ul上样;lane3为marker。
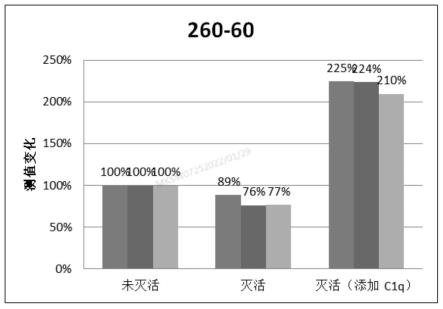
27.图2为本发明实施例提供的抗体对260-60的检测结果对比图。
28.图3为本发明实施例提供的抗体对260-72的检测结果对比图。
具体实施方式
29.为使本发明的上述目的、特征和优点能够更为明显易懂,下面结合附图对本发明的具体实施例做详细的说明。
30.【实施例一】
31.本实施例以筛选不受补体干扰的抗缪勒氏管激素(amh)单克隆抗体对为例,在诊断原料上减少补体干扰,使得抗体对更加适用于化学发光免疫检测。
32.因此,本发明提供一种筛选不受补体干扰的单克隆抗体对的方法,包括以下步骤:
33.s10:获得阴性样本混合物;
34.s20:在阴性样本混合物中加入抗原,获得检测样本一;
35.s30:对阴性样本混合物进行加热,并加入抗原,获得检测样本二;
36.s40:在检测样本二中加入补体c1q,获得检测样本三;
37.s50:用待选单克隆抗体对制备的化学发光试剂,对检测样本一、检测样本二和检
测样本三分别进行免疫化学发光检测,获得检测结果一、检测结果二、检测结果三;
38.s60:根据检测结果一、检测结果二、检测结果三,获得不受补体干扰的单克隆抗体对。
39.具体的,抗原为amh抗原,制备amh抗原包括以下步骤:合成amh全长(1-560aa)基因序列,c末端添加8
×
his标签,用5'nhei、3'ecori酶切位点插入pcdna3.3质粒构建表达载体。采用常规技术方法顺转293t细胞,用镍柱亲和纯化获得amh全长抗原,并以罗氏amh电化学发光检测试剂盒测定浓度。
40.本发明提供的一种筛选不受补体干扰的单克隆抗体对的方法,通过对阴性样本混合物进行加热,能够对其补体进行灭活,进而检测样本一为非灭活样本,检测样本二为灭活样本,向灭活及非灭活样本中加入等量的待测物,用待选抗体对同时测试上述样本,计算补体灭活后测试结果变化,再向灭活及添加待测物的样本中添加人c1q,即为检测样本三,再次测试c1q对测试结果的影响,从而确认易受补体干扰抗体对,同时筛选出不易受补体干扰的抗体对。本方法可以在免疫诊断的原料选择阶段筛选出不易受补体干扰的抗体对,在免疫诊断产品开发阶段减少受补体干扰的概率。
41.进一步的,s10包括以下步骤:
42.s11:获取阴性样本;
43.s12:测定阴性样本的c1q含量,获得检测结果;
44.s13:根据检测结果,将阴性样本进行分类,并获得阴性样本混合物。
45.具体的,收集抗缪勒氏管激素阴性(大于55岁女性)样本,用美康生物科技股份有限公司在售的补体c1q诊断试剂盒(免疫增强比浊法)测定c1q含量。
46.通过将阴性样本根据其c1q含量进行精细化分类,进而能够获得补体含量不同的阴性样本混合物,使得筛选结果更加准确,更具参考意义。
47.进一步的,将阴性样本进行分类,并获得阴性样本混合物包括以下步骤:
48.s14:将c1q含量大于220μg/ml的阴性样本混合标记为高补体阴性样本混合物,c1q大于170μg/ml且小于220μg/ml的阴性样本混合标记为中补体阴性样本混合物,c1q小于170μg/ml的阴性样本混合标记为低补体阴性样本混合物。
49.对高补体阴性样本混合物、中补体阴性样本混合物、低补体阴性样本混合物各取一部分进行实验操作,使得本发明的筛选方法准确度更高,对比性更强,能够得到不同补体含量下的各个样本的检测结果,进而从待选单克隆抗体对中筛选出不受补体干扰的抗体对,以用于后续的免疫检测。
50.进一步的,对阴性样本混合物进行加热,加热温度为50-55℃,加热时间为10-15min。
51.通过对阴性样本混合物进行加热,能够对其补体进行灭活,进而灭活样本与未灭活样本能够作为对照组,确定出易受补体干扰抗体对。
52.具体的,高补体阴性样本混合物、中补体阴性样本混合物、低补体阴性样本混合物各取一半于53℃,10min加热灭活补体,即检测样本一中含未灭活样本,检测样本二含灭活样本,未灭活样本与灭活样本重新测定c1q含量,结果见表1,补体灭活比例大于90%。
53.表1
[0054][0055]
进一步的,s60包括以下步骤:
[0056]
s61:根据检测结果一、检测结果二、检测结果三,计算变化比例,在检测结果一和检测结果二的变化比例的差值小于10%,且检测结果二和检测结果三的变化比例的差值小于10%的情况下,待选单克隆抗体对不受补体影响;
[0057]
s62:获得不受补体干扰的单克隆抗体对。
[0058]
通过比对测值,在检测结果一和检测结果二的变化比例的差值小于10%的情况下,能够确认易受补体干扰的单克隆抗体对,在检测结果二和检测结果三的变化比例的差值小于10%的情况下,能够进一步筛选出不易受补体干扰的单克隆抗体对,该方法简明有效,准确度高。
[0059]
进一步的,检测样本一和检测样本二中的阴性样本混合物、抗原的添加量相同。
[0060]
具体的,检测样本一和检测样本二按相同比例添加终浓度10ng/ml制备的amh抗原(稀释约60000倍)。
[0061]
检测样本一为检测样本二的对照组,为保证实验数据的可靠性,根据控制变量法,二者只有是否进行加热的区别,控制阴性样本混合物、抗原的添加量相同,亦或是检测样本一和检测样本二按相同比例添加抗原。
[0062]
进一步的,s40之前包括以下步骤:
[0063]
s31:收集血清;
[0064]
s32:纯化血清中的c1q,获得粗纯品;
[0065]
s33:进一步纯化粗纯品,获得补体c1q。
[0066]
具体的,本实施例添加的补体来源于人血清。第一轮纯化人血清c1q包括以下步骤:收集1l人血清,加入0.3%tnbp 1%曲拉通x-100,24℃-30℃4-6小时灭活;以偶联比例5mg/ml制备40ml cys-c亲和填料,用20mm pb(ph=7.4),1m nacl溶液平衡;以纯化(硫酸铵沉淀及deae柱(ph=6.5,收集穿流液)纯化)的兔抗cys-c多抗200mg上样,以20mm pb(ph=7.4),1m nacl的溶液平衡;20mm tris(ph=7.4)缓冲液再次平衡;将灭活人血清与20mm tris(ph=7.4),20mm edta以1:1混匀,上样,用20mm tris(ph=7.4),5mm edta缓冲液平衡;20mm tris(ph=7.4),1m nacl洗脱;洗脱液以20mm tris(ph:7.4),20mm edta透析3-5次。透析后12000rpm,40min离心,弃上清,沉淀溶于20mm tris(ph:7.4),1m nacl;溶解物16000rpm,40min离心,收集上清,uv280检测吸光度,以公式c=uv280/0.6727计算浓度。
[0067]
具体的,第二轮纯化人血清c1q包括以下步骤:取protein a填料10ml,纯净水平衡5-10柱体积,20mm tris(ph:7.4),2m nacl平衡3-5个柱体积,将第一轮纯化产物添加nacl
至终浓度2m,上样,收集流穿液;取protein g填料10ml,纯净水平衡5-10柱体积,20mm tris(ph:7.4),2m nacl平衡3-5个柱体积,将protein a柱搜集的流穿液与羊抗人igm抗体以7:3质量浓度混匀室温结合1h,混合液上样,收集流穿液,uv280检测吸光度,以公式c=uv280/0.6727计算浓度并跑sds胶检测纯度,结果见图1。
[0068]
酶联免疫检测中捕获抗体的包被,化学发光检测中捕获抗体偶联磁珠,抗体标记如生物素标记、吖啶酯标记、荧光微球标记,以及抗原抗体结合均能引起抗体构象改变,从而暴露出fc段补体c1q的结合位点,当c1q与两个以上抗体fc上的位点结合即可激活样本中的补体系统。c1q是一个18聚体的复合物,具有6个抗体结合位点,当c1q分子同时结合捕获抗体与检测抗体则导致假阳性或假性升高;补体系统激活后形成的c3b、c4b均结合于抗体的fab,从而影响捕获抗体或检测抗体与抗原的结合,则导致假阴性或假性降低,均会影响免疫检测的准确性。因此对人血清c1q进行纯化,便于后续添加至灭活及添加待测物的阴性样本混合物中,进行检测,以验证待选单克隆抗体是否会受到补体的干扰。
[0069]
进一步的,s40包括以下步骤:
[0070]
s41:在检测样本二中加入补体c1q,获得检测样本三。
[0071]
通过在灭活及添加待测物的样本中添加人c1q,再次测试c1q对测试结果的影响,能够进一步筛选出不易受补体干扰的抗体对,提高筛选结果的准确性。
[0072]
进一步的,免疫化学发光检测包括以下步骤:
[0073]
s44:制备发光试剂;
[0074]
s45;制备固相试剂;
[0075]
s46:将发光试剂、固相试剂分别与检测样本一、检测样本二、检测样本三进行混合,利用化学发光免疫分析仪进行检测。
[0076]
利用免疫化学发光检测检测样本一、检测样本二、检测样本三,记录其光亮值并计算变化比例,若测值改变不显著,则该单克隆抗体对不易受补体干扰,通过数据的比对,筛选出不易受补体干扰的单克隆抗体对,准确度更高,且操作过程简单,容易实现。
[0077]
具体的,制备发光试剂包括以下步骤:取0.1mg检测抗体,以摩尔比1:5-1:15加入吖啶酯标记,室温下避光混匀反应2h,pb缓冲液避光透析脱盐,透析液体积大于标记体积20倍,每4小时换液1次,至少换液3次,测浓度后用pbs-bsa稀释至1-10μg/ml备用。
[0078]
具体的,制备固相试剂包括以下步骤:取0.1mg捕获抗体,摩尔比1:5-1:15加入生物素标记,室温下混匀反应2h,20mm pb缓冲液透析脱盐,透析液体积大于标记体积20倍,每4小时换液1次,至少换液3次,测浓度后用pbs-bsa稀释至0.1-1mg/ml备用。取约0.5ml磁珠,pb清洗三次后,稀释至1-10mg/ml,等体积加入生物素标记抗体,室温下混匀反应2h,用pbs-bsa清洗3次,稀释至0.1-1mg/ml备用。
[0079]
具体的,选择已配对amh抗体对,配置化学发光检测试剂,用于检测检测样本一和检测样本二。
[0080]
综上所述,进一步的,选择美康生物产化学发光免疫分析仪ms120,一步法,将100μl发光试剂和50μl固相试剂与30μl检测样本一进行混合,将100μl发光试剂和50μl固相试剂与30μl检测样本二进行混合,37℃孵育15min。记录光亮值并计算变化比例(以检测样本一为参照,测值为100%),获得检测结果一和检测结果二,结果如表2所示。抗体对260-60(见图2)、260-67、260-66、260-49测值显著下降(>10%),最大下降近30%,说明补体干扰导致
4对抗体测值假性上升;抗体对260-72(见图3)、260-295、260-71、260-73、260-346测值改变不显著(<10%)。
[0081]
进一步的,在检测样本二中加入终浓度300μg/ml c1q,获得检测样本三,相同条件再次对检测样本三测试,获得检测结果三,结果如表2所示。与检测样本二的检测结果比较,抗体对260-60、260-67、260-66、260-49测值上升均达到150%以上,而抗体对260-72、260-295、260-71、260-73、260-346测值改变不显著(<10%)。因此,可以确定抗体对260-60、260-67、260-66、260-49用于amh免疫检测受补体干扰,而抗体对260-72、260-295、260-71、260-73、260-346受补体干扰不明显。
[0082]
表2
[0083]
[0084][0085]
注:表2为抗体对筛选a:检测样本二测值/检测样本一测值;b:检测样本三测值/检测样本二测值。
[0086]
进一步的,测定阴性样本的c1q含量采用补体c1q诊断试剂盒。
[0087]
具体的,用美康生物科技股份有限公司在售的补体c1q诊断试剂盒(免疫增强比浊法)测定c1q含量,具有定量方法敏感、快速简便的优势,且提高筛选效率。
[0088]
虽然本发明披露如上,但本发明并非限定于此。任何本领域技术人员,在不脱离本发明的精神和范围内,均可作各种更动与修改,因此本发明的保护范围应当以权利要求所限定的范围为准。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。