1.本发明涉及生物技术领域中,一种高效诱导愈伤及再生的饲用狗牙根种质的筛选。
背景技术:
2.狗牙根(cynodon dactylon(l.)pers.)为禾本科、狗牙根属多年生草本植物,秆细而坚韧,具有发达的根和匍匐茎,繁殖力强,可作优良的草坪草和牧草,是最重要、应用前景最广泛的暖季型草种之一。随着生物技术的成熟,利用植物组织培养技术建立狗牙根的愈伤诱导及再生体系,并基于此,利用转基因技术建立狗牙根的遗传转化体系,为狗牙根引入抗除草剂、耐干旱、耐盐碱等外源基因培育狗牙根优良新种质,已成为狗牙根研究的必然趋势。目前,通过筛选狗牙根种质(如
‘
tifgreen’、
‘
tifeagle’、
‘
savannah’、
‘
j1224’、
‘
suncity’等品种)、调节激素配比(如添加6-ba、aba、ga3)等方法在坪用狗牙根组织培养的研究中取得了一些进展。然而,狗牙根遗传背景复杂、自交不亲和,其同一品种不同种粒之间的基因型也不尽相同,形成的愈伤组织类型与分化再生能力也存在差异,致使其胚性细胞增殖及再生能力的保持依然很困难,这是狗牙根遗传转化的巨大障碍。因此,从中筛选具有高效诱导愈伤及再生的狗牙根核心组培种质具有非常重要的现实意义。
3.总之,狗牙根至今仍然是一种很难利用植物组织培养技术获得优质愈伤并高效再生的物种。目前国内外专家学者建立的都是坪用狗牙根的组织培养体系,针对饲用狗牙根的组织培养及再生体系尚未建立。
技术实现要素:
4.本发明所要解决的技术问题是如何筛选高效诱导愈伤及再生的饲用狗牙根种质。
5.为解决上述技术问题,本发明首先提供了一种饲用狗牙根胚性愈伤组织的诱导方法,所述饲用狗牙根为
‘
wrangler’,所述方法包括:以所述饲用狗牙根的种子为外植体,将所述外植体于37℃下利用次氯酸钠溶液和/或过氧化氢水溶液和/或乙醇水溶液进行灭菌,得到灭菌狗牙根种子;将所述灭菌狗牙根种子于狗牙根愈伤诱导培养基上进行愈伤组织的诱导,得到的黄色或淡黄色、形态为硬质颗粒状、致密又健康的胚性愈伤组织即得到饲用狗牙根胚性愈伤组织。
6.所选择胚性愈伤组织无分泌物、粘连物质,表现为偏干,黄色或淡黄色颗粒状,致密又健康。
7.上述方法中,所述狗牙根愈伤诱导培养基可为向ms培养基中添加2,4-d、蔗糖得到的培养基,其中,2,4-d、蔗糖的添加量分别为3mg/l、30g/l,ph为5.8。
8.上述方法中,所述愈伤组织的诱导可在25℃下进行。
9.上述方法中,所述愈伤组织的诱导可在黑暗下进行。
10.上述方法中,所述愈伤组织的诱导可为1个月。
11.上述方法还包括对饲用狗牙根胚性愈伤组织进行继代培养,所述继代培养在狗牙
型愈伤分化能力极强,15天左右分化出绿色芽点,30天左右分化出小苗,分化率平均为95%。
附图说明
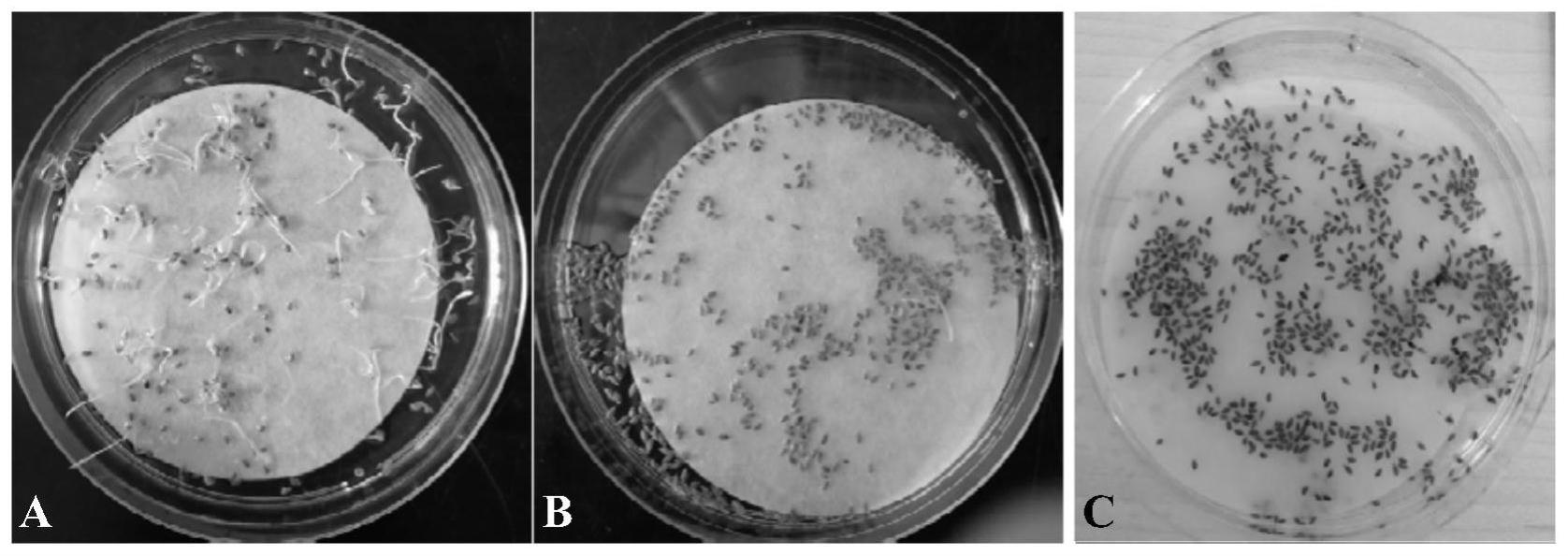
31.图1为不同温度条件对狗牙根种子萌发的影响。(a)37℃培养箱;(b)22℃组培室;(c)25℃室温条件。
32.图2为7种不同类型的狗牙根愈伤组织。
33.图3为不同类型狗牙根愈伤组织置于分化培养基的培养情况。
34.图4为43号优质ⅶ型愈伤组织分化成苗。
35.图5为编号43号的ⅶ型愈伤分化的苗茎节诱导愈伤。
36.图6为载体panic 6b部分结构示意图。
37.图7为饲用狗牙根诱导的愈伤组织。
38.图8为农杆菌介导的遗传转化。
39.图9为gus组织化学染色检测狗牙根转基因苗。
40.图10为pcr检测狗牙根转基因苗。泳道1-4为gus染色阳性苗的pcr产物,含有目的条带;泳道5-8为gus染色阴性苗的pcr产物,不含有目的条带。
具体实施方式
41.下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
42.下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂、仪器等,如无特殊说明,均可从商业途径得到。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。
43.狗牙根愈伤诱导培养基为向ms培养基中添加2,4-d、蔗糖和agar得到的无菌培养基,其中,2,4-d、蔗糖和agar的添加量分别为3mg/l、30g/l和7.8g/l,ph为5.8。
44.狗牙根愈伤继代培养基为向ms培养基中添加2,4-d、6-ba、蔗糖和agar得到的无菌培养基,其中,2,4-d、6-ba、蔗糖和agar的添加量分别为3mg/l、0.15mg/l、30g/l和7.8g/l,ph为5.8。
45.狗牙根愈伤分化培养基为向ms培养基中添加6-ba、kt(激动素)、脯氨酸、酶水解干酪素、蔗糖和agar得到的无菌培养基,其中,6-ba、kt、脯氨酸、酶水解干酪素、蔗糖和agar的添加量分别为0.5mg/l、2mg/l、0.5g/l、0.5g/l、30g/l和7.8g/l,ph为5.8。酶水解干酪素(即酶水解酪蛋白)为solarbio公司产品,货号为cas:91079-40-2。
46.狗牙根生根壮苗培养基为向1/2ms培养基中添加naa、蔗糖和agar得到的无菌培养基,其中,naa、蔗糖和agar的添加量分别为0.2mg/l、8g/l和7.5g/l,ph为5.8。1/2ms培养基为将ms培养基中各溶质的浓度均减半得到的培养基。
47.实施例1、愈伤组织的诱导
48.1、实验材料
49.本实施例选用优质饲用狗牙根
‘
wrangler’(yinkun zhang et al.,different mowing frequencies affect nutritive value and recovery potential of forage bermudagrass,crop&pasture science,2020,71,610
–
619)的成熟种子为外植体材料。
50.2、实验方法
51.2.1狗牙根种子的预处理
52.狗牙根种子的预处理影响到后期愈伤的出愈率。通过将同一批消毒处理后的种子同时放置在37℃培养箱、22℃组培室、25℃室温条件下,7天后对发芽率进行统计,发现只有在37℃培养箱中的种子有大量发芽,发芽率平均为26.5%;22℃组培室和25℃室温条件下的种子仅有1-2粒种子出现萌发(图1)。因此,在狗牙根种子消毒处理过程中添加37℃培养箱过夜,对狗牙根种子进行高温预处理,以增加愈伤诱导率。
53.2.2种子材料的消毒处理
54.将饲用狗牙根成熟种子加入到100ml次氯酸钠溶液(该溶液通过将有效氯浓度为5.6%的次氯酸钠水溶液与水按照3:97的体积比混合得到)中,向其中加入20μl吐温-20(麦克林macklin,cas:9005-64-5),放置于37℃摇床,以转速200rpm摇2.5个小时。而后用无菌水冲洗种子3次,去除掉残留次氯酸钠。随后向种子中添加1.5%(体积百分比)的过氧化氢水溶液置37℃摇床浸泡过夜(12小时)。第二天,再次添加上述次氯酸钠溶液100ml,并加入20μl吐温-20,放置于37℃摇床,以转速200rpm摇1个小时。然后用无菌水冲洗种子5次,去除掉残留次氯酸钠。最后再加入70%(该溶液通过将无水乙醇与水按照70:30的体积比混合得到)乙醇水溶液浸泡1分钟,种子取出置于灭菌滤纸上吹干,即得到37℃灭菌狗牙根种子。
55.2.3狗牙根愈伤诱导
56.将步骤2.2得到的灭菌后的狗牙根种子接种于狗牙根愈伤诱导培养基上,置于25℃组培间黑暗培养1个月,得到狗牙根愈伤组织。
57.2.4狗牙根愈伤组织的继代
58.剥取步骤2.3所得愈伤组织接种于狗牙根愈伤继代培养基上,置于25℃组培间黑暗培养,每4周继代1次。
59.狗牙根愈伤组织生长1个月后,转移到继代培养基继续培养,显微观察狗牙根愈伤组织有ⅰ、ⅱ、ⅲ、ⅳ、
ⅴ
、ⅵ、ⅶ7种类型(图2),ⅰ型愈伤颜色为白色,形态为沙性、水渍状、无核;ⅱ型愈伤颜色为白色,形态为絮状、水渍状、无核;ⅲ型愈伤颜色为淡黄色,形态为粘性、有大量白色透明分泌物、有核;ⅳ型愈伤颜色为深黄色,形态为小颗粒状、有白色脓状分泌物、有核;
ⅴ
型愈伤颜色为淡黄色,形态为小颗粒状、干性稍粘、有核;ⅵ型愈伤颜色为淡黄色,形态为颗粒状、湿软有核;ⅶ型愈伤颜色为黄色或淡黄色,形态为硬质颗粒状、致密又健康。其中ⅰ、ⅱ型愈伤无核,是非胚性愈伤组织;ⅲ、ⅳ愈伤为胚性愈伤组织,但有大量未知分泌物包裹,非优质愈伤组织;
ⅴ
、ⅵ型愈伤为胚性愈伤组织,但愈伤状态偏湿,用镊子夹取时出现少量粘连物质;ⅶ型愈伤为优质胚性愈伤组织,其表现为黄色颗粒状,致密又健康。ⅶ型愈伤的诱导率为0.1%,诱导率=产生愈伤组织的种子数/接种的种子数
×
100%。
60.其中,ⅶ型愈伤所用愈伤诱导培养基与继代培养基中2,4-d的浓度均为3mg/l,该2,4-d浓度下的愈伤总诱导率达98%,当愈伤诱导培养基与继代培养基中2,4-d的浓度为4-5mg/l时,非胚性愈伤组织明显更多,所得愈伤为
ⅰ‑ⅵ
型愈伤,无ⅶ型愈伤。
61.2.5狗牙根愈伤组织的分化
62.将以上7种不同类型的狗牙根愈伤组织接种于狗牙根愈伤分化培养基上,置于25℃组培间,16小时光照/8小时黑暗培养,每4周继代1次。
63.结果发现分化30天后,除ⅶ型愈伤能够分化出苗外,其他愈伤都出现明显褐化死亡(图3)。其中,编号43号的ⅶ型愈伤分化能力极强,15天左右分化出绿色芽点,30天左右分化出小苗,分化率平均为95%,分化率=分化的愈伤数/接种的愈伤数
×
100%。
64.将ⅶ型愈伤接种于分化培养基甲上,置于25℃组培间,16小时光照/8小时黑暗培养,每4周继代1次。结果发现,20天左右分化出绿色芽点,40天左右才能分化出小苗。其中,分化培养基甲为向ms培养基中添加6-ba蔗糖和agar得到的无菌培养基,其中,6-ba、蔗糖和agar的添加量分别为3mg/l、30g/l和7.8g/l,ph为5.8。
65.2.6狗牙根植株的生根及壮苗
66.将步骤2.5的编号43号的ⅶ型愈伤分化的苗置于狗牙根生根壮苗培养基中,置于25℃组培间,16小时光照/8小时黑暗培养,结果显示可以正常成苗(图4)。
67.2.7狗牙根再生苗再次脱分化形成愈伤
68.取步骤2.6所得狗牙根组培苗的茎节作为外植体,按照步骤2.3-2.6的方法,将狗牙根种子替换为步骤2.6所得分化苗的茎节,进行愈伤诱导,2个月后诱导出ⅶ型胚性愈伤组织,颜色呈淡黄色,致密又健康(图5),其胚性愈伤组织诱导率为36.3%。该胚性愈伤组织作为后续饲用狗牙根遗传转化研究的优良材料。
69.实施例2、饲用狗牙根的遗传转化
70.1、菌液制备
71.将带有目的基因(gus基因)的双元载体panic 6b(图6)(david g.j.mann et al.,gateway-compatible vectors for high-throughput gene functional analysis in switchgrass(panicum virgatum l.)and other monocot species,plant biotechnology journal(2012)10,pp.226
–
236)导入农杆菌菌种eha105中,得到重组菌;将重组菌接种至100ml yep培养基中,过夜培养至od
600
=0.8-1.0,3500rpm离心15min,弃液体,用侵染液重悬菌体沉淀,并加入as(乙酰丁香酮),得到od
600
=0.6且as浓度为100μm的菌体重悬液,用于侵染。侵染液为向ms培养基中添加2,4-d和蔗糖得到的无菌液体,其中2,4-d和蔗糖的添加量分别为3mg/l和30g/l,ph=5.2。
72.2、侵染
73.将实施例1步骤2.7所得愈伤组织(图7)置于步骤1所得菌体重悬液中,28℃摇床晃动培养20min,真空浓缩仪(300r/min,30℃)抽真空10min,超声仪(28℃)超声15min,共计45mim。倒掉菌液,将愈伤组织取出放置于灭菌滤纸上,吹干,得到侵染后的愈伤组织。
74.3、共培养
75.将步骤2得到的侵染后的愈伤组织转移到共培养培养基上,置于25℃组培间,黑暗培养3天,随后将愈伤从共培养培养基转移到垫有一层干滤纸的无菌空培养皿,干燥培养1天,共4天,得到共培养后的愈伤组织(图8中a)。共培养培养基为向ms培养基中添加2,4-d、蔗糖、agar和as得到的无菌培养基,其中,2,4-d、蔗糖、agar和as的添加量分别为3mg/l、30g/l、7.8g/l和100μm,ph=5.2。
76.共培养结束后进行gus组织化学染色(图8中b),统计侵染率,侵染率平均为30%。侵染率=蓝色愈伤数/染色愈伤总数
×
100%。
77.4、筛选培养
78.将步骤3所得共培养后的愈伤转移至筛选培养基上,置于25℃组培间,黑暗培养,3周左右继代一次,大约继代2-3次,得到筛选后的愈伤组织。筛选培养基为向ms培养基中添加2,4-d、蔗糖、agar、潮霉素b、特美汀得到的无菌培养基,其中,2,4-d、蔗糖、agar、潮霉素b、特美汀的添加量分别为3mg/l、30g/l、7.8g/l、30mg/l、300mg/l,ph=5.8。
79.5、分化培养
80.将步骤4中筛选培养45天后经过筛选活下来的愈伤组织转移至分化培养基a中,置于25℃组培间,16h光照/8h黑暗下光周期培养,约生长1个月后,愈伤逐渐变绿并分化出幼苗(图8中c),得到分化苗。分化培养基a为向ms培养基中添加6-ba、kt、脯氨酸、酶水解干酪素、蔗糖、agar、潮霉素b、特美汀得到的无菌培养基,其中,6-ba、kt、脯氨酸、酶水解干酪素、蔗糖、agar、潮霉素b、特美汀的添加量分别为0.5mg/l、2mg/l、0.5g/l、0.5g/l、30g/l、7.8g/l、30mg/l、300mg/l,ph=5.8。
81.6、生根壮苗培养
82.将步骤5所得分化苗转移至生根培养基中,置于25℃组培间,16h光照/8h黑暗下光周期培养,得到狗牙根再生苗(图8中d)。生根培养基为向1/2ms培养基中添加naa、蔗糖、agar、潮霉素b、特美汀得到的无菌培养基,其中,naa、蔗糖、agar、潮霉素b、特美汀的添加量分别为0.2mg/l、8g/l、7.5g/l、5mg/l、200mg/l,ph=5.8。
83.7、炼苗移栽
84.将步骤6所得生长正常根系健康的再生苗移栽至装有营养土和蛭石(1:1)的花盆中,花盆上方使用保鲜膜覆盖,保持水分,置于生长箱中(16小时光照/8小时黑暗,温度保持25℃),1周后揭去保鲜膜,得到狗牙根转基因苗。
85.8、检测
86.狗牙根转基因苗在生长箱生长约1个月后,剪取叶片进行gus组织化学染色及目的基因的pcr检测,验证遗传转化情况。叶片经gus染色后,用75%(体积百分比)乙醇水溶液脱色,统计染色情况。对转基因苗叶片进行gus染色,阳性狗牙根植株叶片脱色后颜色为蓝色,非阳性苗叶片脱色后变白(图9)。
87.提取狗牙根转基因苗叶片基因组dna,进行目的基因的pcr检测,筛选阳性苗(图10)。gus染色阳性苗经pcr验证仍为阳性,gus染色非阳性苗经pcr验证仍为阴性。所用引物为:zmubq-f:tgtcgatgctcaccctgttg;gene-r:gctgggtctagagacttcaggcaaaacagaacacctatcta。pcr扩增条件为98℃,5min预变性;98℃变性15s,58℃退火30s,72℃延伸1kb/min,35个循环后72℃再延伸10min。
88.计算转化率,转化率为8%,转化率=阳性苗个数/侵染愈伤数
×
100%,其中侵染愈伤数为步骤2中的侵染的愈伤个数。
89.按照上述步骤1-8的方法,将步骤2“28℃摇床晃动培养20min,真空浓缩仪(300r/min,30℃)抽真空10min,超声仪(28℃)超声15min,共计45mim”替换为“28℃摇床晃动培养45min”,其他步骤均不变,计算侵染率,其侵染率为10%。计算其转化率,转化率为1%。
90.按照上述步骤1-8的方法,将步骤2“28℃摇床晃动培养20min,真空浓缩仪(300r/min,30℃)抽真空10min,超声仪(28℃)超声15min,共计45mim”替换为“真空浓缩仪(300r/min,30℃)抽真空10min”,其他步骤均不变,计算侵染率,其侵染率为5%。计算其转化率,转
化率为1%。
91.按照上述步骤1-8的方法,将步骤2“28℃摇床晃动培养20min,真空浓缩仪(300r/min,30℃)抽真空10min,超声仪(28℃)超声15min,共计45mim”替换为“超声仪(28℃)超声15min”,其他步骤均不变,计算侵染率,其侵染率为1%。计算其转化率,转化率为0%。
92.说明,步骤2中的侵染方法更适于狗牙根的遗传转化。
93.以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本技术欲包括任何变更、用途或对本发明的改进,包括脱离了本技术中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。