osrep3基因在控制水稻抗旱性中的应用
技术领域
1.本发明涉及水稻基因工程领域。具体涉及分离、克隆和通过功能验证得到一种能够调控干旱耐受能力的水稻osrep3基因及其在水稻抗旱性遗传改良中的应用。所述osrep3基因的核苷酸序列如seq id no:1所示,其编码的蛋白质的序列如seq id no:2所示。
背景技术:
2.近一个世纪以来,气候变化剧烈,耕地流失加剧,但随着全球人口快速增长,粮食短缺相关问题叵待解决(godfray et al 2010)。水稻作为三大粮食作物之一,养活了全球近三分之一的人口。提高水稻产量的任务迫在眉睫。然而目前单位耕地面积内水稻的最大产量潜力已经达到一定的瓶颈,而且随着环境的恶化,沙漠化土地、盐碱地逐渐吞噬着农田,适合水稻正常生长的土地正在逐年减少,低氮、干旱、高盐、重金属污染等非生物逆境造成了世界范围内的作物减产(witcombe et al 2008)。在这种严峻的形势之下,培育出能在旱地和盐碱地等逆境条件下生长且保持部分产量的水稻品种,是提高全世界水稻产量的另一条出路。
3.根作为植物唯一位于地下的器官,除了帮植物锚定,也是植物响应地下各种刺激,吸收无机盐和矿质元素等作用(petricka et al 2012)。土壤环境直接作用于植物根系,其影响不言而喻,因此,在水稻适应相应环境的过程中,根系起到了决定性的作用。
4.作物抗旱机制主要为逃旱性,避旱性,耐旱性和复水后恢复。其中根系主要在避旱性的机制中起作用,植物可以通过增加根系长度和密度来增加更多面积的水分吸收。但是由于根系深埋于土壤,导致根系对避旱性的贡献一直难以研究。近年来,通过调控根系性状来提高作物抗旱性的报道并不多见。deep rooting 1是水稻中首次通过正向遗传学克隆到的控制根系性状的基因,该基因通过调控根系生长角度来影响水稻的深根率,并且显著提高水稻在干旱胁迫下的产量(uga等,control of root system architecture by deeper rooting 1i ncreases rice yield under drought conditions.nat genet,2013)。超量表达oserf48的转基因植株,通过调控钙调蛋白oscml16,显著提高转基因植株的根系长度和密度,从而提高水稻抗旱性(jung等,overexpression of oserf48 causes regulation of oscml16,a calmod ulin-like protein gene that enhances root growth and drought tolerance.plantbiotechnol j,2017)。在水稻根中超量表达oserf71基因,能够促进根系的径向生长,使转基因植株根系中的通气组织增大,从而提高水稻的抗旱性(lee等,rice oserf71-mediated root modificat ion affects shoot drought tolerance.plant signal behav,2017)。也有报道说拟南芥cle25小肽,是在组织间传递干旱信号的分子,过量表达能使得相关抗旱通路的基因如nced3表达上升,从而提高拟南芥抗旱性(fuminoritakahashi等,a small peptide modulates stomatal c ontrol viaabscisic acid in long-distance signalling)。
5.本发明从水稻中分离出一个新颖的根特异性表达基因,并鉴定它的crispr敲除材料在提高水稻抗逆性方面所发挥的功能,对于培育抗逆水稻新品种将具有非常重要的意
义。
技术实现要素:
6.本发明的目的在于提供了osrep3基因在控制水稻抗旱性中的应用,所述的osrep3基因编码的蛋白为seq id no.2所示。
7.本发明的另一个目的在于提供osrep3基因在控制水稻根系长度中的应用,所述的os rep3基因编码的蛋白为seq id no.2所示。
8.为了达到上述目的,本发明采取以下技术措施:
9.本发明通过对水稻种质资源材料进行成熟期根系性状的全基因组关联分析,定位到一个调控根系长度的候选基因osrep3,发现其是一个根系特异性表达的多肽激素,其基因敲除材料可以显著提高转基因水稻的根长和抗旱能力,证明了该基因的功能及其在作物抗旱遗传改良中的应用途径。
10.osrep3基因在控制水稻抗旱性中的应用,所述的应用过程包括利用本发明的常规方案,通过控制osrep3基因的表达,以控制水稻的抗旱性,所述的osrep3基因的序列为seq id no.1所示,编码的蛋白质序列为seq id no.2所示;
11.以上所述的应用中,优选的是通过crispr/cas9的方法,在osrep3基因内选取靶位点将该基因敲除,获得的水稻突变体为抗旱型水稻;
12.以上所述的应用中,优选的所述的抗旱型水稻包含seq id no.3或seq id no.4所示的核苷酸序列。
13.osrep3基因在控制水稻根系长度中的应用,所述的应用过程包括利用本发明的常规方案,通过控制osrep3基因的表达,以控制水稻的根系长度,所述的osrep3基因的序列为s eq id no.1所示,编码的蛋白质序列为seq id no.2所示;
14.以上所述的应用中,优选的是通过crispr/cas9的方法,在osrep3基因内选取靶位点将该基因敲除,获得的水稻突变体为根系增长的水稻;
15.以上所述的应用中,优选的所述的根系增长的水稻包含seq id no.3或seq id no.4所示的核苷酸序列。
16.与现有技术相比,本发明具有以下优点:
17.本发明首次提出编码seq id no.2所示蛋白的基因可控制水稻的抗旱性,通过苗期及成株期干旱胁迫表型鉴定表明,缺失该基因片段时,水稻耐干旱胁迫能力增强,同时根系增长,证实了该基因的功能及应用途径。
附图说明
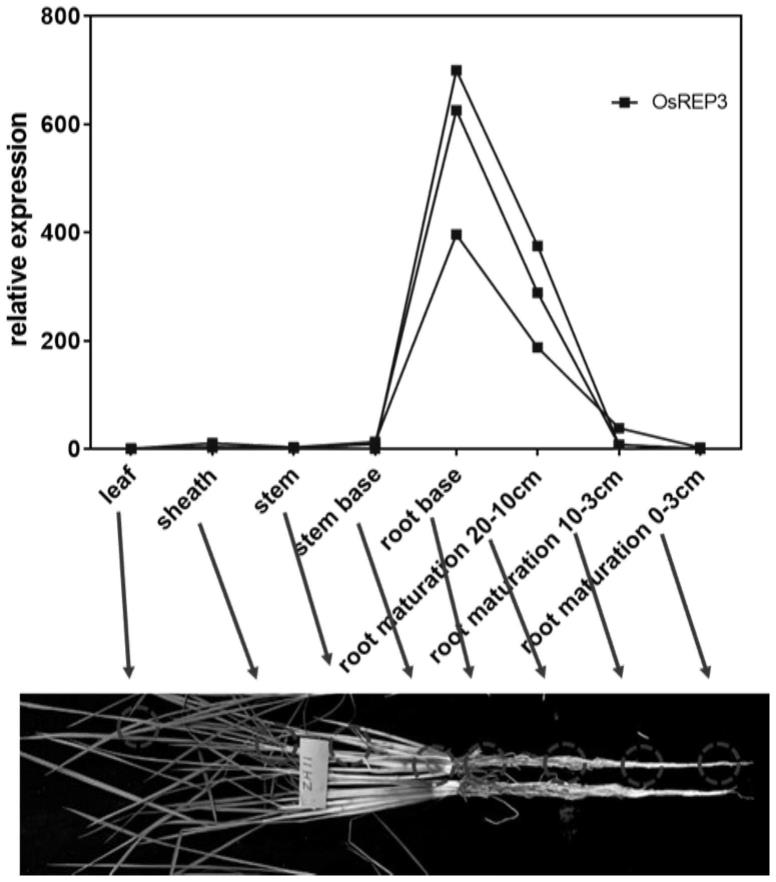
18.图1为osrep3基因的组织表达谱。
19.图2为osrep3基因敲除家系t0代相关基因型检测。
20.图3为水稻osrep3敲除家系苗期表型。
21.图4为水稻osrep3敲除家系成熟期正常条件下根长表型。
22.图5为水稻osrep3敲除家系成熟期干旱条件下根长表型。
23.图6为osrep3基因grna靶点设计。
具体实施方式
24.以下实施例定义了本发明,并描述了本发明在克隆包含有osrep3基因完整编码区段的dna片段,以及验证osrep3基因功能的方法。根据以下的描述和这些实施例,本领域技术人员可以确定本发明的基本特征,并且在不偏离本发明精神和范围的情况下,可以对本发明做出各种改变和修改,以使其适用不同的用途和条件。
25.实施例1:目的基因osrep3的获得
26.申请人对529份核心种质材料进行了成熟期的正常条件及干旱胁迫后的根系性状的全基因组关联分析,在第4染色体上定位到一个控制成熟期正常条件下最大根长(mrln)的位点,在该位点的200kb范围内,大多数基因在水稻基因组注释网站tigr(http://rice.plantbi ology.msu.edu/)中都被注释为转座子和反转座子,仅有少数几个基因被注释为假定蛋白或者表达蛋白。将这几个表达蛋白在表达谱数据库ricexpro(http://ricexpro.dna.affrc.go.jp/)中进行分析,发现有一个基因具有很强的根系特异性表达特征。因此我们把这个基因作为我们的候选基因进行候选的研究,该基因命名为osrep3。osrep3在水稻基因组注释网站tig r上功能注释为expressionprotein,注释号为loc_os04g11030,该基因的cds序列为seq id no:1所示,其编码区核苷酸长度为246bp;该核苷酸序列对应的蛋白质长度为81个氨基酸,序列见seq id no:2所示。
27.实施例2:检测水稻内源osrep4基因的表达水平
28.用实时荧光定量pcr检测osrep3的组织表达谱(图1)。具体为:申请人选用粳稻品种“中花11”(简称zh11,来自中国农业科学院作物研究所商业品种)作为表达谱分析的材料。取分蘖期中有代表性的组织材料的rna样品,总rna的提取采用trizol试剂(购自invitrogen公司)提取,提取方法按照trizol试剂说明书,利用反转录酶mlv(购自invitrogen公司)将其反转录合成cdna(方法根据invitrogen公司反转录酶试剂说明书),反应条件为:65℃5min,50℃60min,70℃10min。以上述反转录合成的cdna为模板,用引物(osrep3realt-f:5
’-
ccatgacattgggagcgaac-3’和osrep3realt-r:5
’-
aggacatgggtagagctggg-3’)对osrep3基因进行特异的pcr扩增(扩增产物长71bp)。
29.同时用引物(ubi-qrt-f:5
’-
gcccaagaagaagatcaagaac-3’和ubi-qrt-r:5
’-
acgattgatttaaccagtccatga-3’)对水稻ubiquitin基因做特异扩增(扩增产物长66bp),以作为内对照进行定量分析。反应条件为:50℃2min;95℃2min;95℃3sec,60℃30sec,40个循环。
30.反应过程中进行荧光检测实时定量分析。检测结果显示,osrep3在根系中的表达量较高,而其他组织表达量很低甚至完全没有表达(图1)。
31.实施例3:构建osrep3基因敲除载体
32.crispr敲除载体的构建:
33.申请人将osrep3基因在水稻中做敲除。相关crispr敲除载体构建方法如下:
34.所用的crispr敲除载体是prgeb32(xie,2015,boosting crispr/cas9 multiplex edit ing capability with the endogenous trna-processing system),根据文献所用方法设计grn a并且在相应网站上预测其二级结构,在osrep3基因的cds区域设计了2个靶点(图6),在crispr-p v2.0网站中选取的靶位点如下:
35.靶位点1:tctcatcctcgcaatggtca
36.靶位点2:ccggggagtggccatgacat。
37.将两个grna通过t7连接酶过夜连接到一起,取连接产物1ul,用两端的通用引物(s5a d5-f:5
’-
cgggtctcaggcaggatgggcagtctgggca-3’和s5ad5-r:5
’-
taggtctccaaacggatgagcgacagcaaac-3’)进行扩增,pcr反应体系的总体积为50μl,pgtr质粒模板0.5μl(约30ng)、10
×
pcr buffer反应缓冲液、10mm dntp 0.5μl、10μm引物各0.5ul、2单位lataq酶,加双蒸水至50μl。反应程序为:95℃变性5min,95℃30s、55℃30s、72℃30s、33个循环,72℃延伸7min。
38.pcr完成后片段纯化回收,回收好片段用foki进行单酶切,载体prgeb32用bsai进行单酶切,最后用t4连接酶将片段和载体连接,转化入e.coli,筛选阳性质粒并测序,得到序列正确的osrep3-prgeb32载体。
39.遗传转化步骤:
40.通过农杆菌介导的水稻遗传转化方法(其具体步骤如下所述)将上述crispr敲除载体osrep3-prgeb32转入到水稻品种“中花11”(来源中国农业科学院作物科学研究所)中,经过预培养、侵染、共培养、筛选具有潮霉素抗性的愈伤、分化、生根、练苗、移栽,得到转基因植株。上述农杆菌介导的水稻(中花11)遗传转化方法(体系)在hiei等人报道的方法(hiei等,efficient transformation of rice,oryza sativa l.,mediated by agrobacterium and sequence analysis of the boundaries of the t-dna,plant j,6:271-282,1994)基础上进行。本实施例的具体遗传转化步骤如下:
41.(1)电转化:用1800v电压,将最终超表达目标载体osrep3-prgeb32电转化入农杆菌eha105菌株,涂到带有对应抗性选择的la培养基上,筛选出阳性克隆,用于下述转化愈伤。
42.(2)愈伤组织诱导:将成熟的水稻种子中花11去壳,然后依次用70%的乙醇处理1分钟;0.15%氯化汞(hgcl2)表面消毒15分钟;用灭菌水洗种子4-5次;将该消过毒的种子放在诱导培养基上;将接种后的诱导培养基置于黑暗处培养4周,温度25
±
1℃。
43.(3)愈伤继代:挑选亮黄色、紧实且相对干燥的胚性愈伤,放于继代培养基上黑暗下培养2周,温度25
±
1℃。
44.(4)预培养:挑选紧实且相对干燥的胚性愈伤,放于预培养基上黑暗下培养2周,温度25
±
1℃。
45.(5)农杆菌培养:在带有对应抗性选择的la培养基上预培养农杆菌eha105(来源于cambia,商用菌株,携带有本发明的超表达载体osrep3-prgeb32)两天,培养温度28℃;将所述的农杆菌转移至悬浮培养基,28℃摇床上培养2-3小时。
46.(6)农杆菌侵染:将预培养的愈伤转移至灭菌好的瓶子内;调节农杆菌的悬浮液至od
600 0.8-1.0;将愈伤在农杆菌悬浮液中浸泡30分钟;转移愈伤至灭菌好的滤纸上吸干;然后放置在共培养基上培养3天,培养温度19-20℃。
47.(7)愈伤洗涤和选择培养:灭菌水洗涤愈伤至看不见农杆菌;浸泡在含400ppm羧苄青霉素(cn)的灭菌水中30分钟;转移愈伤至灭菌好的滤纸上吸干;转移愈伤至选择培养基上选择2-3次,每次2周(第一次筛选羧苄青霉素浓度为400ppm,第二次以后为250ppm,潮霉素浓度250ppm)。
48.(8)分化:将抗性愈伤转移至预分化培养基上黑暗处培养5-7天;转移预分化培养
的愈伤至分化培养基上,光照(3500lux)下培养,温度26℃。
49.(9)生根:剪掉分化时产生的根;然后将其转移至生根培养基中光照下培养2-3周,温度26℃。
50.(10)移栽:洗掉根上的残留培养基,将具有良好根系的幼苗转入温室,同时在最初的几天保持水分湿润。
51.osrep3 crispr敲除材料基因型的鉴定:
52.本发明采用pcr方法对上述获得的转基因水稻t0代植株进行osrep3基因型检测,检测引物为osrep3dectect-f:5
’-
tgcgcactgacaaatggaaa-3’和osrep3dectect-r:5
’-
ggcgcaaatcagtagatgct-3’。原始大小为1kb,成功剪切之后dna胶图中条带大小会变小,基因型检测结果显示,有一些转基因植株中osrep3基因被剪切(图2)
53.实施例4:鉴定crispr敲除材料的苗期以及成熟期根系及抗旱表型
54.根据t0代基因型检测的结果,我们选取了2个单拷贝插入的有剪切的独立t1代家系(30cri3,30cri12),再将这2个家系进行繁种,从后代中选出纯合剪切并且cas9-free的单株,将2个crispr敲除家系(命名为30c3株和30c12株,分别含有seq id no.3和seq id no.4所示的突变序列)和野生型zh11的种子进行去壳消毒,在1/2ms培养基上发芽。发芽一周后挑选长势一致的crispr敲除材料和野生型zh11的对照材料移栽到面包盆中。待面包盆中的苗子长至四叶期左右,挑选长势一致的苗子移栽到pvc管中,每个pvc管中种植两棵水稻苗,一棵为crispr敲除材料,另一棵为野生型对照zh11。每个crispr敲除家系种植18根pvc管,其中6根用于正常生长考察正常条件下的最大根长表型,待水稻生长到种子成熟期时,收获之后洗根考察crispr敲除材料与对照材料的根长表型。另外12根用于干旱胁迫,在水稻生长至孕穗初期时,断水开始干旱胁迫,考察干旱表型,之后复水恢复生长直至种子成熟期,收获之后洗根,考察干旱条件下crispr敲除家系材料与对照材料的最大根长表型。将2个crispr敲除家系和野生型zh11的种子进行浸种催芽,选取长势一致的12颗播入小蓝桶中,在四叶期左右进行相关苗期干旱胁迫。实验结果显示,在成熟期下,osrep3的crispr敲除家系材料在正常条件及干旱条件下的最大根长均显著大于野生型对照材料(图4和图5),而且相比于野生型材料,crispr敲除材料的抗旱有所增强。苗期实验显示敲除材料的抗旱相比野生型zh11来说显著提高(图3)。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。