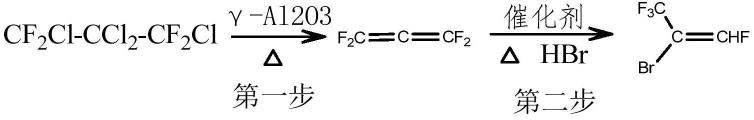
1.本发明涉及一种植物对人工湿地基质微生物影响的检测方法,特别涉及一种风车草对于人工湿地基质微生物的多样性影响的检测方法及应用。
背景技术:
2.湿地是一种过渡性地带,处于陆生生态和水生生态两种系统之间。而人工湿地则是指通过人为手段建造的、可以调节的工程化湿地系统,因其具有调节生态,效果可靠,环境友好等优点,被广泛应用于水质净化领域。
3.人工湿地根据运行中不同的水力方式,分为表面流人工湿地、垂直潜流人工湿地和水平潜流人工湿地。表面流人工湿地存在占地面积大、水力负荷小、处理能力弱、夏季易滋生蚊虫等缺点。垂直潜流人工湿地的水质净化能力在这三种类型的人工湿地中是最强的,但是污水的水力流程较短,反硝化作用较弱,且建造成本高、运行管理复杂。水平潜流人工湿地则拥有水力和污染物负荷大,处理效果好,造价及管理难度适中等优点。
4.湿地里的植物主要起固定基质表面、提供良好过滤条件、防止湿地堵塞和为微生物提供良好根部环境等功能。在我国南方地区,湿地植物选择范围大,美人蕉、再力花等很多常见植物在富营养化治理生态工程中都有被应用,张韵通过黄菖蒲、石菖蒲、梭鱼草、再力花、美人蕉和风车草这6种湿地植物对受污染水体净化能力的对比研究发现,风车草生长快速、耐寒性好且去除率最高,更适合用于水污染治理。在分车草用于水污染的治理过程中,其所处环境不同,各区块形成的微生物种类和组成会存在部分差异。微生物群落的不同也许会影响微生物的净化过程,从而导致不同的净化表现。如何提供一种行之有效的风车草对于人工湿地基质微生物的多样性影响的检测方法是目前需要解决的问题。
技术实现要素:
5.为了解决上述技术问题,本发明提供了一种风车草对于人工湿地基质微生物的多样性影响的检测方法,
6.本发明的风车草对于人工湿地基质微生物的多样性影响的检测方法,其包括如下步骤:
7.(1)样品的制备及采集;
8.(2)样品dna的提取并检测dna的浓度和纯度,然后检测dna样品的完整性;
9.(3)pcr扩增;
10.(4)高通量测序;
11.(5)进行质控,过滤、拼接和去除嵌合体;对otu代表序列进行分类学分析,然后根据otu数据计算α多样性获得相关指数;
12.(6)数据分析。
13.优选所述步骤(1)具体包括如下步骤:
14.由pvc板搭建成人工水平潜流湿地,内部填充有直径4~6mm的砾石构成填料基质,在设备侧面安装有穿孔管,采集样品为砾石表面基质;风车草的种植密度为25株每平方米,水体流向为从左至右;选择不同区域做为采样位点,同时依据是否种植风车草分别建组。
15.优选所述步骤(2)具体包括如下步骤:取1g样品,采用dna提取试剂盒根据使用说明进行dna提取,同时利用微型荧光计结合dna检测试剂盒检测提取dna的浓度和纯度;然后根据浓度检测结果,采用0.8%琼脂糖凝胶电泳检测dna样品的完整性。
16.优选所述步骤(3)具体包括如下步骤:选用16s rrnav4可变区的通用引物进行扩增,引物分别为563f(5
’‑
aytgggydtaaagng-3’)和引物802r(5
’‑
tacnvgggtatctaatcc-3’),94℃预变性4min;变性30s,50℃退火30s,循环“变性-退火”步骤25次,72℃延伸30s,72℃最终延伸5min,10℃终止保存;扩增结果用凝胶回收试剂盒来回收片段。
17.优选所述步骤(5)具体包括如下步骤:在派森诺平台上用flash软件进行质控,利用qiime2软件过滤、拼接和去除嵌合体;利用rdp-classifier贝叶斯算法对0.97相似水平的otu代表序列进行分类学分析;最后根据样品otu数据计算α多样性获得相关指数。
18.优选所述步骤(6)具体包括如下步骤:利用stamp软件采用welch’s t-test进行组别间的统计检验,并绘制extended error bar误差线图,分析各分类水平下组间的差异显著性;用excel软件对各组的多样性指数进行单因素方差分析;用past软件在otu水平利用upgma算法采用bray-curtis作为相似性测度进行聚类分析,并通过anosim分析检测各组的相似性。
19.本发明还提供了风车草在对于人工湿地基质微生物的多样性影响中的应用。
20.有益效果
21.人工湿地是城市内进行水质净化的新兴力量,人工湿地基质微生物的群落结构与多种因素有关。本发明通过对比有无种植风车草情况下砾石表面基质生物膜的群落构成差异,运用高通量测序技术对细菌16s rdna基因进行扩增并测序,比对不同人工湿地环境下微生物的多样性,可以研究出它们的菌群结构和优势菌种,挑选出合适的人工湿地类型,可为最终设计出更科学的人工湿地方案提供帮助。
附图说明
22.图1 结构示意图
23.图2 琼脂糖凝胶电泳检测结果
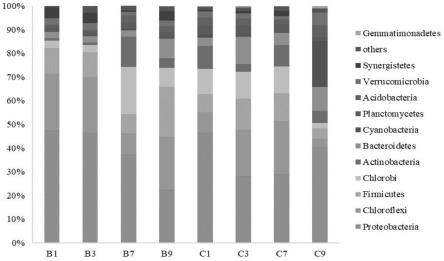
24.图3 门水平相对丰度图
25.图4 门水平丰度差异性分析
26.图5 属水平丰度差异性分析
27.图6 otu分布韦恩图
28.图7 otu水平聚类分析图
具体实施方式
29.下面结合说明书附图介绍本发明的较佳实施例,举例证明本发明可以实施,通过向本领域中的技术人员完整介绍本发明,使其技术内容更加清楚和便于理解。本发明可以通过许多不同形式的实施例来得以体现,其保护范围并非仅限于文中提到的实施例,本文
的附图和说明本质上是举例说明而不是限制本发明。
30.下述实施例中的实验方法,如无特殊说明,均为常规方法。
31.下述实施例中所用的原材料、试剂和设备等,如无特殊说明,均可从商业途径得到或已公开。
32.实施例1
33.1材料与方法
34.1.1样品制备和采集
35.人工水平潜流湿地,由pvc板搭建而成,内部填充有砾石(直径4~6mm)构成填料基质,尺寸大小如图1所示。在设备侧面安装有穿孔管方便采样,采集样品为砾石表面基质。风车草的种植密度约为25株每平方米,水体流向为从左至右。选择1、3、7、9四个区域做为本实验的采样位点,同时依据是否种植风车草分别建组,将未种植风车草组命名为b组:b1、b3、b7、b9,将种植风车草组命名为c组:c1、c3、c7、c9。
36.1.2检测过程
37.取1g样本,采用dna提取试剂盒(omegasoil dna kit)根据使用说明进行dna提取,同时利用微型荧光计(turner biosystems,tbs380)结合dna检测试剂盒(solarbio,picogreen)检测提取dna的浓度和纯度。然后根据浓度检测结果,采用0.8%琼脂糖凝胶电泳检测dna样品的完整性(结果见图2),电压为120v,电泳时间约为20min。
38.其中检测提取dna浓度和纯度步骤如下:
39.1)、标准品工作液的配制:sigma小牛胸腺嘧啶dna干粉1mg(tris,nacl等浓度已成标准体系),加入1ml双蒸水,配制成1mg/ml的标准品工作液。
40.2)、染料工作液的配置:5μl picogreen加入1ml te buffer。
41.3)、标准品工作液稀释:1、母液稀释:取10μl(1mg/ml)标准品工作液加入到990μl te buffer溶液中,浓度稀释成10μg/ml,取10μl(10μg/ml)标准品工作液加入到990μl te buffer溶液中,浓度稀释成100ng/ml;2、倍比稀释:取800μl(100ng/ml)的标准品工作液加入到200μl te buffer溶液中,浓度达到80ng/ml,取500μl(80ng/ml)的标准品工作液加入到500μl te buffer溶液中,浓度稀释到40ng/ml;依次倍比稀释,配成20ng/ml、10ng/ml、5.0ng/ml、2.5ng/ml、1.25ng/ml、0.625ng/ml的标准品溶液。
42.4)、标准曲线的制备:倍比稀释后的各梯度标准品溶液和染料工作液各取100ul混匀,避光室温放置5min。使用荧光仪检测样品的荧光值:将混合后的溶液加入微量比色皿。以te buffer缓冲液为blank,激发波长488nm,发射波长520nm,测定样品和空白对照的荧光值;用标准品溶液的浓度(ng/ml)对应的荧光强度作直线回归,制备标准曲线,如表1。
43.表1标准曲线
44.待测dna最终浓度(ng/ml)100504020105420.50荧光读值6210320025471265623299259151440.75
45.5)、测量样品的荧光值。荧光计将给出一个直接的浓度读数,如表2。
46.表2 tbs380检测结果
[0047][0048]
选用16s rrna v4可变区的通用引物进行扩增,引物分别为563f(5
’‑
aytgggydtaaagng-3’)和引物802r(5
’‑
tacnvgggtatctaatcc-3’);94℃预变性4min;变性30s,50℃退火30s,循环“变性—退火”步骤25次,72℃延伸30s,72℃最终延伸5min,10℃终止保存。扩增结果用凝胶回收试剂盒来回收片段,委托上海派森诺生物科技有限公司进行illumina高通量测序。
[0049]
在派森诺平台上用flash软件进行质控:用软件flash连接通过质量控制的序列对应的两端序列进行。对连接上的序列通过index完全匹配得到每个样品的有效序列,进行过滤(序列长度》200bp,index序列完全匹配,前引物最多允许一个错配,无模糊碱基),应用uchime_denovo的方法对序列进行鉴别杂合序列(chimera)并去除,获得最终用于分析的优质序列。利用qiime2软件过滤、拼接和去除嵌合体:qiime调用uclust对优质序列按相似度0.97进行聚类,选取每个类最长的序列为代表序列。利用rdp-classifier贝叶斯算法以rdp数据库的序列为训练集,对otu代表序列进行注释,得到每个otu的分类学信息。将原始otu列表精简去约少量的低可信度的序列。最后根据样品otu数据计算α多样性获得相关指数。
[0050]
1.3数据分析
[0051]
利用stamp软件采用welch’s t-test进行两个组别间的统计检验,并绘制extended error bar误差线图,分析各分类水平下组间的差异显著性;用excel软件对b组和c组的多样性指数进行单因素方差分析;用past软件在otu水平利用upgma算法采用bray-curtis作为相似性测度进行聚类分析,并通过anosim分析检测b组和c组的相似性。
[0052]
2结果与分析
[0053]
2.1α多样性分析
[0054]
在0.97分类水平上,基质样品的α-多样性指数如表3所示。所采集的全部样品的微生物coverage指数均大于94%,表明样本内基因序列被检出的概率很高,测序结果可靠,可以用来准确地反映样品的情况。
[0055]
表3多样性指数表
[0056][0057]
序列数据质控后,共获得304277条序列长度大于200bp的有效序列,其中b组含优质序列153952条,c组含优质序列150326条,样品的优质序列长度主要分布在223~230bp。
[0058]
从表1中8个样品中的多样性分析结果看,不同样品的微生物多样性存在差异。ace和chao是用于描述样品的细菌群落多样性,两者指数越大,表明其群落丰富度越高。由表可知,细菌的多样性和丰度指数基本与otu数据变化相一致,c组样品中微生物的chao指数、ace指数和shannon指数皆高于b组,且otu数量也更多,表明c组样品中的菌群物种较多,丰富度较高。在方差分析的结果中,虽然p值皆大于0.05,结果并非显著,但c组整体数值较高,其中ace指数的p值也已接近0.05。在b组内部,b7和b9所处的湿地下层在otu、chao、ace、shannon指数上总体都高于b1和b3所处的上层;c组内则正相反,c1和c3所处的湿地上层在otu、chao、shannon指数上总体高于c7和c9所处的下层。
[0059]
2.2群落结构分析
[0060]
图3展示了不同组别丰度占比排列前13位的微生物群落门水平分布情况。将门水平相对丰度小于0.5%的菌门归类为others。其中proteobacteria(变形菌门)、chloroflexi(绿弯菌门)、firmicutes(后壁菌门)、chlorobi(绿菌门)等相对丰度较高,为优势菌群,相对丰度占比分别是37.33%、16.66%、10.96%、8.68%,占总量的92.04%。但在各样品中优势菌群所占相对丰丰度大小存在差异,例如proteobacteria,在b1中相对丰度最高,在b9中相对丰度最低;chloroflexi在b1中相对丰度最高。除上述优势群外,actinobacteria(放线菌门)在b组较占优势,bacteroidetes(拟杆菌门)在c组较占优势。另外在各组内的四个样品间也存在菌落丰度差异,b组内,人工湿地上下层之间菌落丰度差异较大,c组内,c9的差异较其他三个样品大,主要在于chloroflexi(绿弯菌门)和cyanobacteria(蓝菌门)两个菌群。
[0061]
在门和属水平层次上对b组和c组的同类otu聚类,进行组间显著性差异分析并绘图,p值小于0.05的认定为存在显著差异,其中前15个优势属及优势门详见图4及图5。由图可知,在门水平上,proteobacteria(变形菌门)的相对丰度最高,actinobacteria(放线菌门)和chlamydiae(衣原体门)具有显著差异性;在属水平上,chlorobium(绿菌属)的相对丰度最高,rhodoplanes(红游动菌属)具有显著差异性。
[0062]
2.3聚类分析
[0063]
基于otu的韦恩图可表示多个样品的otu独有和共有物种情况,对所有样品进行处理之后绘制的花瓣图中(见图6),b组样品中b9特有otu数量最高,为1028个,b1特有otu数量
最低,仅有418个。c组样品中c3特有otu数量最高,为1101个,c9特有otu数量最低,仅有599个。
[0064]
同时根据组内两两样品otu关系,分析出共有otu数和共有otu占比。数据表明b组中,b7-b9共有otu数量2370是最多的,占比也最高,达57.7%;c组中c1-c3共有otu数量最多,达2267,c7-c9共有otu占比最高,达56.9%。即b7-b9,c7-c9最相似。
[0065]
基于otu数据,将8个样品进行聚类分析后作出图7。树枝的长度以及宽度分别表示不同样品之间的距离和远近,在相似度接近的情况下,距离会越小。如图7所示,通过样品的聚集树可以了解样品间分支的距离和远近,其中在b组,下层的b7和b9,上层的b1和b3分别两两聚集成组,并构成一个大组;在c组,下层的c9与c7,上层的c1和c3也分别两两聚集成组,并构成一个大组。b组与c组out经相似性分析得出r值为0.4583,p值为0.033。总体上看,种植风车草组和未种植风车草组存在差异,聚集成了两个互相独立的大组。同时在组内,样品的otu数据间也存在差异,皆按照人工湿地内的深度位置形成了上下层的区分,与韦恩图所展示的数据基本一致。
[0066]
3.结果分析
[0067]
3.1风车草对人工湿地微生物多样性的影响
[0068]
上述检测结果表明,种植风车草组微生物丰富度和多样性高于未种植风车草组。湿地是碳氮循环的重要发生场所。湿地基质表面微生物的群落结构差异除与基质有关,还会受植物理化性质的影响。植物作为影响人工湿地中微生物群落结构的因素之一,除根际碳沉积作用外,根系泌氧也会对微生物碳源代谢活性产生影响。植物通过将光合作用产生的氧气输送至根区,可在根际土壤中创造好氧环境,为微生物提供氧气,促进微生物生长繁殖。另外植物根系及其分泌物可以支持微生物的生长。相关资料表明,植物根系能释放多种化合物,这些物质包含高分子量的多聚糖和低分子量的有机物,而这些有机物正是微生物生长繁殖所需的。因此,人工湿地微生物的多样性与植物存在密切关联,从而形成了不同的微生物群落特性。
[0069]
3.2风车草对人工湿地微生物群落结构的影响
[0070]
2种人工湿地基质优势菌群皆为proteobacteria(变形菌门)、chloroflexi(绿弯菌门)、firmicutes(后壁菌门)等,从上述数据可以看出,8个样品的proteobacteria(变形菌门)相对丰度平均都在30%以上且不同样品间差异不明显,表明变形菌门的菌类在人工湿地生态环境构筑和物质循环里发挥了重要功能。另外在群落结构中进行丰度差异分析时,在门水平上,actinobacteria(放线菌门)和chlamydiae(衣原体门)的丰度在两组间具有显著差异性。放线菌属于革兰氏阳性菌且具有分解纤维素的能力,而植物在生长过程中会产生正常的植株枯死叶片凋落现象,为放线菌提供底物条件,这或是使其相对丰度显著高于无植物组的原因。衣原体是一类专性真核细胞内寄生、可以在多种真核生物宿主(包括人、动物、原虫等)中繁殖的无运动能力的细菌。而根际内聚集的大量真菌为土壤动物提供了丰富的食物来源,也因此吸引了众多的土壤动物成为衣原体的宿主,使得chlamydiae(衣原体门)相对丰度得以提高。在属水平上,两组间rhodoplanes(红游动菌属)的丰度具有显著差异。
[0071]
3.3风车草对人工湿地聚类分析的影响
[0072]
通过聚类分析,可得知样品表现不仅在组间具有差异性,在组内也会根据采样深
度而产生差异性,即处于同一深度的样品间相似性更高。经过相似性分析验证,组间差异大于组内差异,即说明风车草对人工湿地的影响大于湿地深度的影响。因此在种植风车草组,形成了上层微生物多样性高于下层的现象。未种植风车草的情况下,在人工湿地设备的下层中,随着水体流动,填料基质截留和吸附了部分的胶体以及碎屑污染物,长时间后在下层产生部分沉降积累代谢物和淤泥等沉积物质,导致底层环境更复杂。通过分析深度可以发现,菌落种类的多样性和丰富度情况在一定程度上取决于环境情况,即微生物所处环境造就了其不同的物种多样性及丰富度。
[0073]
由以上可以看出:1.种植风车草可提高人工湿地基质表面微生物群落的α多样性。2.种植风车草使得人工湿地基质微生物群落组成与无种植风车草情况相比差异显著,群落组成差异比较分析显示:门水平actinobacteria(放线菌门)和chlamydiae(衣原体门),属水平rhodoplanes(红游动菌属)在有无种植风车草情况下差异显著。3.风车草会影响人工湿地基质微生物的空间分布,在种植风车草情况下人工湿地上层的微生物多样性高于下层,无种植风车草情况则相反,下层的微生物多样性高于上层。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。