1.本发明涉及纳米药物载体材料技术领域,尤其涉及一种纳米药物及其制备方法和应用。
背景技术:
2.骨质疏松是一种在全球范围内普发的疾病,其间接或直接引发的各部位骨折会极大地降低患者生活质量。目前,临床上的主流治疗药物,如双膦酸盐、甲状旁腺激素等都有各自的缺陷,因此利用纳米药物提高治疗效果,降低副作用是极具前景的方案之一。
3.磷酸钙作为骨骼和牙齿的主要成分之一,由于其固有的生物相容性和生物可降解性,细胞毒性小,是一种良好的药物载体。此外,磷酸钙降解后产生的钙离子本身就有辅助治疗骨质疏松的效果,因此磷酸钙是极佳的抗骨质疏松类药物载体。
4.辛伐他汀是一种hmg-coa还原酶抑制剂,目前临床上常用于降低血脂,治疗高胆固醇血症。但有研究发现其具备治疗骨质疏松的能力,辛伐他汀能够促进骨形态发生蛋白bmp2的基因表达,而bmp2可以介导一系列骨形成相关基因转录,最终加快骨形成与修复。然而,在辛伐他汀治疗骨质疏松的实际应用过程中,仍有以下几个尚待解决的问题:无法特异性的在骨骼处聚集、多种副作用和易被代谢降解。
5.cn106999630a公开了一种将非晶形聚磷酸钙微粒修饰在钛合金表面实现生物功能化的方法;在使用非晶形聚磷酸钙微粒进行表面改性后,肽支架更能够支持骨细胞的生长并增强了骨细胞的功能活性,因此该方案中的非晶形聚磷酸钙微粒具有用于骨植入物的潜力。cn103480039a公开了一种高强度的磷酸钙复合纳米材料骨水泥,通过掺入氧化铝纳米管,该骨水泥材料综合性能好,抗压强度高,并具有良好的注射型,适用于硬组织骨的缺损修复、骨质疏松的治疗以及骨折的固定和治疗。目前,磷酸钙材料在骨骼疾病上主要作为患者体内的植入物,例如上述cn106999630a和cn103480039a,而并非作为静脉注射的纳米药物载体。
6.因此,提供一种基于磷酸钙的纳米药物,将抗骨质疏松药物特异性的递送至骨骼,同时起到增加疗效和减少副作用的效果,在骨质疏松治疗领域具有重要意义。
7.鉴于此,特提出本发明。
技术实现要素:
8.本发明的目的在于提供一种纳米药物,该纳米药物在治疗骨质疏松方面具备更好的效果;本发明的另一目的在于,提供该纳米药物的制备方法和应用。
9.具体地,本发明提供以下技术方案:
10.本发明提供一种纳米药物,包括:
11.磷酸钙基质;以及
12.辛伐他汀,所述辛伐他汀包裹于所述磷酸钙基质的内部,
13.骨靶向材料,所述骨靶向材料由羧甲基葡聚糖与多肽连接而成,所述骨靶向材料
通过所述羧甲基葡聚糖修饰于所述磷酸钙基质的至少部分外表面上,
14.其中,
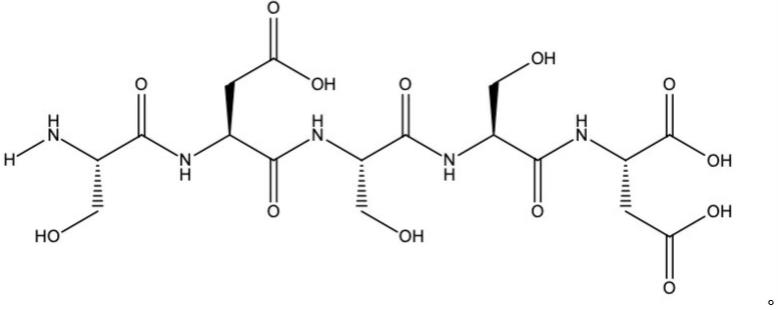
15.所述多肽的结构式如下:
[0016][0017]
本发明发现,通过上述方案,有利于提升纳米药物在治疗骨质疏松方面的效果。
[0018]
具体而言,该纳米药物以具有丰富空腔结构的磷酸钙为刚性基质,将促骨形成药物辛伐他汀包裹于磷酸钙基质中,同时利用羧甲基葡聚糖表面丰富的官能团在磷酸钙基质外表面修饰骨靶向材料,可以实现辛伐他汀的靶向递送,并且,该纳米药物可以有效提高药物体内循环时间和骨骼处聚集效果,同时降低脱靶效应,进而提升药物对骨质疏松的治疗效果,降低药物副作用。
[0019]
为了更进一步地提高该纳米药物的疗效,本发明对其进行了优化,具体如下:
[0020]
作为优选,所述羧甲基葡聚糖的平均分子量为5000-80000da;例如:5000da、8000da、10000da、20000da、30000da、40000da、60000da、70000da或80000da。
[0021]
作为优选,所述羧甲基葡聚糖的羧甲基取代度为0.3-0.75;例如:0.3、0.4、0.5、0.6或0.75。
[0022]
作为优选,所述辛伐他汀为疏水性辛伐他汀;针对本发明的药物体系,选用疏水性辛伐他汀,治疗效果更佳。
[0023]
作为优选,按质量比计,磷酸钙基质:辛伐他汀:骨靶向材料=(30-150):(0.2-2):(5~40)。
[0024]
作为优选,所述纳米药物的粒径为167.6-196.8nm;例如:167.6nm、169.1nm、169.9nm、170.3nm、170.7nm、173.2nm、173.6nm、175.2nm、175.7nm、176.4nm、177.1nm、178.1nm、178.2nm、179.8nm、182.7nm、183.1nm、185.3nm、185.5nm、192.1nm、195.7nm或196.8nm,优选为175.7-183.1nm。
[0025]
作为优选,所述纳米药物的分散度为0.176-0.246;例如:0.176、0.181、0.181、0.193、0.196、0.198、0.199、0.204、0.204、0.206、0.207、0.215、0.219、0.22、0.221、0.225、0.233、0.233、0.235或0.243。
[0026]
本发明中,分散度是指纳米颗粒在水中的分散程度,通常与1作比较,越接近1表示分散性越不好,越接近0表示分散性越好;本发明的纳米药物的分散度为0.176~0.246,具有良好的分散性。
[0027]
作为优选,所述纳米药物中,磷酸钙基质对辛伐他汀的包裹率为7.3-31.0%;例如:7.3%、13.2%、24.8%、28.7%、30.3%、30.9%或31.0%,优选为30.3%。
[0028]
本发明同时提供以上所述的纳米药物的制备方法,包括:
[0029]
s1、将辛伐他汀和有机溶剂混合得辛伐他汀溶液,将氯化钙和乙二醇混合得氯化钙溶液,将所述辛伐他汀溶液和所述氯化钙溶液混合,得第一混合液;将所述第一混合液与多聚磷酸钠溶液混合均匀后离心,而后进行超声复溶,得第一分散液,所述第一分散液中含有包覆有辛伐他汀的磷酸钙基质;
[0030]
将羧甲基葡聚糖溶于去离子水得羧甲基葡聚糖溶液,而后将所述羧甲基葡聚糖溶液与edc溶液和nhs溶液混合,得第二混合液;将多肽的水溶液与所述第二混合液混合均匀后透析,冻干后得骨靶向材料;
[0031]
s2、将所述骨靶向材料溶于去离子水,得第一溶液;将所述第一分散液与所述第一溶液混合均匀后离心,而后进行超声复溶,得第二分散液,所述第二分散液中含有纳米药物;
[0032]
本发明还发现,通过上述方式,可制得效果更佳的纳米药物。
[0033]
其中,采用多聚磷酸钠和氯化钙共沉淀法制备得到磷酸钙纳米颗粒,疏水性促骨形成药物辛伐他汀通过与多聚磷酸钠和氯化钙共沉淀,封装在磷酸钙基质中;具有靶向到成骨细胞能力的多肽(sdssd)经过与羧甲基葡聚糖的简单连接后修饰在磷酸钙基质表面。
[0034]
作为优选,在制备第一分散液的方法中,所述辛伐他汀溶液的浓度为20-200mg/ml;例如:50mg/ml、100mg/ml或200mg/ml,优选为50-200mg/ml。
[0035]
作为优选,在制备第一分散液的方法中,所述有机溶剂选自甲醇、乙醇、二甲基亚砜中的一种或几种。
[0036]
作为优选,在制备第一分散液的方法中,所述氯化钙溶液的浓度为20-200mg/ml;例如:20mg/ml、30mg/ml、40mg/ml、50mg/ml、60mg/ml、80mg/ml或100mg/ml,优选为50-100mg/ml。
[0037]
作为优选,在制备第一分散液的方法中,所述多聚磷酸钠溶液的浓度为10-30mg/ml;例如:10mg/ml、15mg/ml、20mg/ml、25mg/ml或30mg/ml,优选为20-25mg/ml。
[0038]
作为优选,在制备第一分散液的方法中,将所述第一混合液与多聚磷酸钠溶液在室温下磁力搅拌10-30min后离心;例如:搅拌时间可以是10min、15min、20min、25min或30min。
[0039]
作为优选,在制备骨靶向材料的方法中,所述羧甲基葡聚糖溶液的浓度为20-100mg/ml;优选为40-60mg/ml。
[0040]
作为优选,在制备骨靶向材料的方法中,所述edc溶液的浓度为40-500mg/ml;例如:40mg/ml、60mg/ml、80mg/ml、100mg/ml、150mg/ml、200mg/ml、300mg/ml、400mg/ml或500mg/ml,优选为80-200mg/ml。
[0041]
作为优选,在制备骨靶向材料的方法中,所述nhs溶液的浓度为20-300mg/ml;例如:20mg/ml、32mg/ml、48mg/ml、60mg/ml、75mg/ml、100mg/ml、120mg/ml、150mg/ml、200mg/ml、250mg/ml或300mg/ml,优选为48-120mg/ml。
[0042]
作为优选,在制备骨靶向材料的方法中,所述多肽的水溶液的浓度为1-5mg/ml;例如:1mg/ml、1.5mg/ml、2mg/ml、2.5mg/ml、3mg/ml、3.5mg/ml、4mg/ml、4.5mg/ml或5mg/ml,优选为1-3mg/ml。
[0043]
作为优选,在制备骨靶向材料的方法中,将多肽的水溶液与所述第二混合液在室
温下磁力搅拌6-12h后透析;例如:搅拌时间可以是6h、7h、8h、9h、10h、11h或12h。
[0044]
作为优选,在制备骨靶向材料的方法中,所述透析为:采用3400-3600kda透析袋,在室温条件下进行40-50h。
[0045]
作为优选,步骤s2中,所述第一溶液的浓度为5-40mg/ml;例如:5mg/ml、10mg/ml、20mg/ml、30mg/ml或40mg/ml,优选为5-10mg/ml。
[0046]
作为优选,步骤s2中,所述第一分散液的浓度为1-20mg/ml;例如:1mg/ml、2mg/ml、4mg/ml、6mg/ml、10mg/ml、15mg/ml或20mg/ml,优选为5-10mg/ml。
[0047]
作为优选,步骤s2中,所述混合为:在室温下磁力搅拌1-2h;例如:搅拌时间可以是1h或2h。
[0048]
作为较佳的技术方案,所述制备方法包括如下步骤:
[0049]
(1)将疏水性辛伐他汀和有机溶剂混合,得浓度为50~200mg/ml的辛伐他汀溶液;将氯化钙和乙二醇混合,得浓度为50~100mg/ml的氯化钙溶液;将所述辛伐他汀溶液和所述氯化钙溶液混合,得第一混合液;将所述第一混合液与浓度为20-25mg/ml的多聚磷酸钠溶液在室温下磁力搅拌10-30min后离心,而后进行超声复溶,得第一分散液,所述第一分散液中含有包覆有辛伐他汀的磷酸钙基质;
[0050]
将羧甲基葡聚糖溶于去离子水,得浓度为40-60mg/ml的羧甲基葡聚糖溶液,而后将所述羧甲基葡聚糖溶液与浓度为80-200mg/ml的edc溶液和浓度为48-120mg/ml的nhs溶液混合,得第二混合液;将浓度为1-3mg/ml的多肽的水溶液与所述第二混合液在室温下磁力搅拌6-12h后,使用3400-3600kda透析袋,在室温条件下,透析40-50h,冻干后得骨靶向材料;
[0051]
(2)将所述骨靶向材料溶于去离子水,得浓度为5-10mg/ml的第一溶液;将所述第一分散液与所述第一溶液在室温下磁力搅拌1-2h后离心,而后进行超声复溶,得第二分散液,所述第二分散液中含有纳米药物。
[0052]
在上述技术方案中,所述室温在25
±
5℃之间。
[0053]
本发明还提供以上所述的纳米药物在制备药品添加剂或药品中的应用,所述药品添加剂或药品具备治疗骨质疏松的作用。
[0054]
本发明中,所述骨质疏松的病症包括绝经后骨质疏松症(i型)、老年性骨质疏松症(ii型)和特发性骨质疏松(包括青少年型)。
[0055]
与现有技术相比,本发明具有如下有益效果:
[0056]
(1)本发明通过共沉淀的方式将疏水性促骨形成药物辛伐他汀封装于磷酸钙刚性基质内部,并在磷酸钙刚性基质外表面修饰具有靶向到成骨细胞功能的骨靶向材料,所得纳米药物将促骨形成药物辛伐他汀和磷酸钙刚体基质递送到骨骼部位,提高骨质疏松治疗效果的同时,显著降低了药物副作用。
[0057]
(2)本发明的纳米药物,除促骨形成药物辛伐他汀具备良好的治疗骨质疏松的效果之外,磷酸钙刚体基质也能起到一定的治疗效果。
[0058]
(3)本发明的纳米药物的制备方法简单易行,具有广泛的应用前景。
附图说明
[0059]
图1为实施例1的纳米药物的透射电镜图;
[0060]
图2为实施例1的纳米药物的粒径分布图;
[0061]
图3为连续一周测量实施例1的纳米药物的粒径柱状图;
[0062]
图4为实施例1的纳米药物的药物释放曲线;
[0063]
图5为实施例1的纳米药物在细胞水平上的累积分布图;
[0064]
图6为试验例2中各纳米药物在动物层面上的促骨形成效果。
具体实施方式
[0065]
以下实施例用于说明本发明,但不用来限制本发明的范围。
[0066]
以下实例中所涉及的多肽的结构式如下:
[0067][0068]
实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件,或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可通过正规渠道商购买得到的常规产品。
[0069]
实施例1
[0070]
本实施例提供一种纳米药物,包括:
[0071]
磷酸钙基质;以及
[0072]
疏水性辛伐他汀,所述疏水性辛伐他汀包裹于所述磷酸钙基质的内部,
[0073]
骨靶向材料,所述骨靶向材料由羧甲基葡聚糖与多肽连接而成,所述骨靶向材料通过所述羧甲基葡聚糖修饰于所述磷酸钙基质的至少部分外表面上。
[0074]
本实施例同时提供上述纳米药物的制备方法,包括如下步骤:
[0075]
(1)将疏水性辛伐他汀和乙醇混合,得浓度为100mg/ml的辛伐他汀溶液;将氯化钙和乙二醇混合,得浓度为100mg/ml的氯化钙溶液;将10μl所述辛伐他汀溶液和100μl所述氯化钙溶液混合,得第一混合液;将所述第一混合液与1ml浓度为20mg/ml的多聚磷酸钠溶液在室温下磁力搅拌20min后离心,而后进行超声复溶,得第一分散液,所述第一分散液中含有包覆有辛伐他汀的磷酸钙基质;
[0076]
将羧甲基葡聚糖溶于去离子水,得浓度为50mg/ml的羧甲基葡聚糖溶液,而后将5ml所述羧甲基葡聚糖溶液与5ml浓度为100mg/ml的edc溶液和浓度为60mg/ml的nhs溶液混合,得第二混合液;将1ml浓度为2mg/ml的多肽的水溶液与所述第二混合液在室温下磁力搅拌10h后,使用3500kda透析袋,在室温条件下,透析48h,冻干后得骨靶向材料;
[0077]
(2)将所述骨靶向材料溶于去离子水,得浓度为10mg/ml的第一溶液;将所述第一分散液与1ml所述第一溶液在室温下磁力搅拌2h后离心,而后进行超声复溶,得第二分散
液,所述第二分散液中含有纳米药物。
[0078]
本实施例的纳米药物的透射电镜图见图1,由图1可知,在透射电镜下,该纳米药物颗粒呈典型的圆球形,粒径约170nm。
[0079]
利用激光粒度仪对本实施例的纳米药物进行粒径测量,结果见图2,由图2可知,该纳米药物的粒径为179.0nm。
[0080]
利用激光粒度仪连续一周对本实施例的纳米药物进行粒径测量,结果见图3,由图3可知,该纳米药物的稳定性良好,粒径基本保持不变。
[0081]
通过紫外-可见光分光光度计检测本实施例的纳米药物降解后的辛伐他汀特征峰强度,根据公式ee%=esim/tsim
×
100%,考察包覆辛伐他汀的磷酸钙基质的包覆率,其中,tsim是总辛伐他汀质量,esim是包覆入磷酸钙基质的辛伐他汀质量,经计算包封率为30.3%。
[0082]
体外模拟实施例1的纳米药物的释放过程,将该纳米药物装入截留分子量3500da的透析袋中,透析袋浸于40ml 1%sds溶液中,整个系统在37℃避光并以110rpm速度在振荡器上振动,在指定时间取1ml透析袋外溶液,并补充同样体积1%sds溶液,通过紫外-可见光分光光度计检测辛伐他汀浓度,通过下述计算公式画出药物动力学曲线:
[0083][0084]
其中,er:药物累计释放量;ve:1%sds的置换体积,1ml;v0:释放介质总体积,40ml;ci:第i次置换取样时释放液的浓度,mg/ml;m
drug
:纳米粒子所载药物总质量,mg;n:置换pbs的次数。结果见图4,由图4可知,该纳米药物具有一定的缓释作用,有利于对骨质疏松的持续性治疗。
[0085]
实施例2
[0086]
本实施例提供一种纳米药物,包括:
[0087]
磷酸钙基质;以及
[0088]
疏水性辛伐他汀,所述疏水性辛伐他汀包裹于所述磷酸钙基质的内部,
[0089]
骨靶向材料,所述骨靶向材料由羧甲基葡聚糖与多肽连接而成,所述骨靶向材料通过所述羧甲基葡聚糖修饰于所述磷酸钙基质的至少部分外表面上。
[0090]
本实施例同时提供上述纳米药物的制备方法,包括如下步骤:
[0091]
(1)将疏水性辛伐他汀和乙醇混合,得浓度为200mg/ml的辛伐他汀溶液;将氯化钙和乙二醇混合,得浓度为100mg/ml的氯化钙溶液;将10μl所述辛伐他汀溶液和100μl所述氯化钙溶液混合,得第一混合液;将所述第一混合液与1ml浓度为20mg/ml的多聚磷酸钠溶液在室温下磁力搅拌10min后离心,而后进行超声复溶,得第一分散液,所述第一分散液中含有包覆有辛伐他汀的磷酸钙基质;
[0092]
将羧甲基葡聚糖溶于去离子水,得浓度为50mg/ml的羧甲基葡聚糖溶液,而后将5ml所述羧甲基葡聚糖溶液与5ml浓度为100mg/ml的edc溶液和浓度为60mg/ml的nhs溶液混合,得第二混合液;将1ml浓度为2mg/ml的多肽的水溶液与所述第二混合液在室温下磁力搅拌10h后,使用3500kda透析袋,在室温条件下,透析48h,冻干后得骨靶向材料;
[0093]
(2)将所述骨靶向材料溶于去离子水,得浓度为10mg/ml的第一溶液;将所述第一分散液与1ml所述第一溶液在室温下磁力搅拌2h后离心,而后进行超声复溶,得第二分散液,所述第二分散液中含有纳米药物。
[0094]
通过与实施例1相同的测试可知,本实施例的纳米药物具有规整的圆球形结构,纳米粒子的平均粒径为187.7nm,经计算包覆率为34.3%。
[0095]
实施例3
[0096]
本实施例提供一种纳米药物,包括:
[0097]
磷酸钙基质;以及
[0098]
疏水性辛伐他汀,所述疏水性辛伐他汀包裹于所述磷酸钙基质的内部,
[0099]
骨靶向材料,所述骨靶向材料由羧甲基葡聚糖与多肽连接而成,所述骨靶向材料通过所述羧甲基葡聚糖修饰于所述磷酸钙基质的至少部分外表面上。
[0100]
本实施例同时提供上述纳米药物的制备方法,包括如下步骤:
[0101]
(1)将疏水性辛伐他汀和乙醇混合,得浓度为100mg/ml的辛伐他汀溶液;将氯化钙和乙二醇混合,得浓度为100mg/ml的氯化钙溶液;将10μl所述辛伐他汀溶液和100μl所述氯化钙溶液混合,得第一混合液;将所述第一混合液与1ml浓度为20mg/ml的多聚磷酸钠溶液在室温下磁力搅拌30min后离心,而后进行超声复溶,得第一分散液,所述第一分散液中含有包覆有辛伐他汀的磷酸钙基质;
[0102]
将羧甲基葡聚糖溶于去离子水,得浓度为50mg/ml的羧甲基葡聚糖溶液,而后将5ml所述羧甲基葡聚糖溶液与5ml浓度为100mg/ml的edc溶液和浓度为60mg/ml的nhs溶液混合,得第二混合液;将1ml浓度为1mg/ml的多肽的水溶液与所述第二混合液在室温下磁力搅拌12h后,使用3500kda透析袋,在室温条件下,透析48h,冻干后得骨靶向材料;
[0103]
(2)将所述骨靶向材料溶于去离子水,得浓度为5mg/ml的第一溶液;将所述第一分散液与1ml所述第一溶液在室温下磁力搅拌2h后离心,而后进行超声复溶,得第二分散液,所述第二分散液中含有纳米药物。
[0104]
通过与实施例1相同的测试可知,本实施例的纳米药物具有规整的圆球形结构,纳米粒子的平均粒径为194.9nm,经计算包覆率为24.8%。
[0105]
实施例4
[0106]
本实施例提供一种纳米药物,包括:
[0107]
磷酸钙基质;以及
[0108]
疏水性辛伐他汀,所述疏水性辛伐他汀包裹于所述磷酸钙基质的内部,
[0109]
骨靶向材料,所述骨靶向材料由羧甲基葡聚糖与多肽连接而成,所述骨靶向材料通过所述羧甲基葡聚糖修饰于所述磷酸钙基质的至少部分外表面上。
[0110]
本实施例同时提供上述纳米药物的制备方法,包括如下步骤:
[0111]
(1)将疏水性辛伐他汀和乙醇混合,得浓度为50mg/ml的辛伐他汀溶液;将氯化钙和乙二醇混合,得浓度为100mg/ml的氯化钙溶液;将10μl所述辛伐他汀溶液和100μl所述氯化钙溶液混合,得第一混合液;将所述第一混合液与1ml浓度为20mg/ml的多聚磷酸钠溶液在室温下磁力搅拌20min后离心,而后进行超声复溶,得第一分散液,所述第一分散液中含有包覆有辛伐他汀的磷酸钙基质;
[0112]
将羧甲基葡聚糖溶于去离子水,得浓度为50mg/ml的羧甲基葡聚糖溶液,而后将
5ml所述羧甲基葡聚糖溶液与5ml浓度为100mg/ml的edc溶液和浓度为60mg/ml的nhs溶液混合,得第二混合液;将1ml浓度为3mg/ml的多肽的水溶液与所述第二混合液在室温下磁力搅拌10h后,使用3500kda透析袋,在室温条件下,透析48h,冻干后得骨靶向材料;
[0113]
(2)将所述骨靶向材料溶于去离子水,得浓度为10mg/ml的第一溶液;将所述第一分散液与1ml所述第一溶液在室温下磁力搅拌2h后离心,而后进行超声复溶,得第二分散液,所述第二分散液中含有纳米药物。
[0114]
通过与实施例1相同的测试可知,本实施例的纳米药物具有规整的圆球形结构,纳米粒子的平均粒径为182.5nm,经计算包覆率为22.9%。
[0115]
对比例1
[0116]
本对比例提供一种纳米药物,包括:
[0117]
磷酸钙基质;以及
[0118]
骨靶向材料,所述骨靶向材料由羧甲基葡聚糖与多肽连接而成,所述骨靶向材料通过所述羧甲基葡聚糖修饰于所述磷酸钙基质的至少部分外表面上。
[0119]
本对比例同时提供上述纳米药物的制备方法,包括如下步骤:
[0120]
(1)将氯化钙和乙二醇混合,得浓度为100mg/ml的氯化钙溶液;将100μl所述氯化钙溶液与1ml浓度为20mg/ml的多聚磷酸钠溶液在室温下磁力搅拌20min,得第一分散液;
[0121]
将羧甲基葡聚糖溶于去离子水,得浓度为50mg/ml的羧甲基葡聚糖溶液,而后将5ml所述羧甲基葡聚糖溶液与5ml浓度为100mg/ml的edc溶液和浓度为60mg/ml的nhs溶液混合,得第二混合液;将1ml浓度为2mg/ml的多肽的水溶液与所述第二混合液在室温下磁力搅拌10h后,使用3500kda透析袋,在室温条件下,透析48h,冻干后得骨靶向材料;
[0122]
(2)将所述骨靶向材料溶于去离子水,得浓度为10mg/ml的第一溶液;将所述第一分散液与1ml所述第一溶液在室温下磁力搅拌2h后离心,而后进行超声复溶,得第二分散液,所述第二分散液中含有纳米药物。
[0123]
对比例2
[0124]
本对比例提供一种纳米药物,包括:
[0125]
磷酸钙基质;以及
[0126]
疏水性辛伐他汀,所述疏水性辛伐他汀包裹于所述磷酸钙基质的内部。
[0127]
本对比例同时提供上述纳米药物的制备方法,包括如下步骤:
[0128]
将疏水性辛伐他汀和乙醇混合,得浓度为100mg/ml的辛伐他汀溶液;将氯化钙和乙二醇混合,得浓度为100mg/ml的氯化钙溶液;将10μl所述辛伐他汀溶液和100μl所述氯化钙溶液混合,得第一混合液;将所述第一混合液与1ml浓度为20mg/ml的多聚磷酸钠溶液在室温下磁力搅拌20min后离心,而后进行超声复溶,得第一分散液,所述第一分散液中含有纳米药物。
[0129]
试验例1
[0130]
对实施例1的纳米药物在细胞水平上的成骨细胞靶向效果进行验证,具体如下:
[0131]
将mc3t3-e1细胞接种于激光共聚焦培养皿内,培养24h后分为成骨细胞分化组和阴性对照组。在使用成骨诱导分化培养基和普通完全培养基培养21d后,加入包载荧光染料ir780的纳米药物,孵育1小时,通过荧光染料定位细胞核,使用共聚焦显微镜观察载药纳米粒子的分布情况。其中,浅灰色雾状或不规则状结构为包载荧光染料ir780的纳米药物,浅
灰色圆形、椭圆形或网状斑点结构为细胞核。
[0132]
结果见图5,由图5可知,成骨细胞分化组中纳米药物在细胞内的累积明显高于阴性对照组,由此可以看出在细胞水平上,纳米药物对成骨细胞具有一定的靶向能力。
[0133]
试验例2
[0134]
对实施例1、对比例1和2的纳米药物在蛋白质印迹水平上的促骨形成效果进行验证,具体如下:
[0135]
将6-8周的c57bl/6雌性小鼠设置为假手术组(sham)、骨质疏松模型组(ovx)、辛伐他汀裸药治疗组(sim)、对比例1的纳米药物治疗组(cap)、对比例2的纳米药物治疗组(cap/sim)和实施例1的纳米药物治疗组(sdssd/cap/sim);
[0136]
对除假手术组外的小鼠进行去卵巢手术,假手术组仅剖开背部,不进行卵巢切除。小鼠术后恢复30天,去势小鼠由于缺乏卵巢分泌的雌激素出现骨质疏松,开始对其按组别分别进行为期2个月的药物治疗;
[0137]
治疗结束后,处死小鼠,摘除其右侧股骨,对摘取的股骨进行电子计算机断层扫描;
[0138]
对扫描数据进行3维骨骼重构,计算分析其骨密度。
[0139]
如图6所示,相较骨质疏松模型组(ovx),辛伐他汀裸药治疗组(sim)、对比例1的纳米药物治疗组(cap)、对比例2的纳米药物治疗组(cap/sim)和实施例1的纳米药物治疗组(sdssd/cap/sim)的小鼠股骨骨密度明显更高,其中,对比例2的纳米药物治疗组(cap/sim)和实施例1的纳米药物治疗组(sdssd/cap/sim)的骨密度最接近假手术组(sham),并且,实施例1的纳米药物治疗组(sdssd/cap/sim)效果最佳。
[0140]
骨密度全称骨骼矿物质密度,是判断骨骼强度和诊断骨质疏松程度的重要指标。与ovx组相比,cap/sim组和sdssd/cap/sim组的骨密度明显更高,甚至接近sham组,并且,sdssd/cap/sim组效果最佳;因此,本发明的纳米药物在动物水平上取得了良好的骨质疏松治疗效果。
[0141]
此外,实施例2-4的纳米药物能够实现与上述实施例1相同的治疗效果。
[0142]
综上所述,本发明通过共沉淀的方式将疏水性药物辛伐他汀封装于磷酸钙刚性基质内部,并在磷酸钙刚性基质外表面修饰具有靶向到成骨细胞功能的骨靶向材料,可以实现通过抗骨质疏松药物的靶向递送,进一步提高对骨质疏松的治疗疗效,降低药物副作用;所得纳米药物可以促进骨形成相关蛋白bmp2的表达,诱导未分化的间充质干细胞向成骨细胞和软骨细胞定向分化和增殖,促进成骨细胞分化成熟,实现了对骨质疏松的治疗;制备方法简单易行,具有广泛的应用前景。
[0143]
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。