用于治疗癫痫症的包含大麻二酚(cbd)的透皮组合物
1.相关申请的交叉引用
2.本技术要求于2019年10月11日提交的美国第62/913,874号的优先权,其全部内容在此引入作为参考。
背景技术:
3.本公开涉及大麻二酚(cbd)的透皮给药,用于减少例如“难治性癫痫”(tre)的治疗中的癫痫发作频率,包括难治性小儿癫痫或结节性硬化症(tsc)、dravet综合征和林-戈综合征综合征。在一个实施方案中,患有tre的患者是儿童和年轻人。当tre是dravet综合征、肌阵挛失神或热性感染相关性癫痫综合征(fires)时,cbd似乎特别有效。在这些适应症中,在相当数量的患者中,总惊厥频率的降低令人惊讶地显示大于50%,从70%到大于90%。事实上,相当数量的患者在三个月的治疗结束时已经没有癫痫发作。
4.优选使用的cbd是高纯度大麻提取物的形式,使得cbd的存在量大于,例如,总提取物(w/w)的98%,并且提取物的其它组分具有特征。特别是四氢大麻酚(thc)已经基本上被除去到不超过例如0.15%(w/w)的水平。可选地,它是合成生产的cbd(参见美国专利no.10,195,159)。
5.cbd可与一种或多种其它抗癫痫药(aed)一起使用。可选地,cbd可以被配制用于与一种或多种aed单独、顺序或同时给药,或者该组合可以以单一剂型提供。当cbd被配制用于单独、顺序或同时给药时,它可以作为试剂盒提供,或者与以这种方式给药一种或多种组分的说明一起提供。
6.大麻(marijuana)是美国的一览表-i类药物。火麻仁是一种含有超过400种植物营养素(微量营养素)的开花植物。已经从植物中提取了超过100种不同类型的萜类化合物,精油,抗氧化剂和大麻素。从所有的植物化学物质中,只有四氢大麻酚(thc)显示出显著的精神活性作用。由于thc的精神活性和治疗作用,关于thc的许多研究文献已经发表。除thc外,其它几种组分已被研究,其也显示出一些没有精神活性作用的治疗作用,例如大麻二酚(cbd),大麻酚(cbn),大麻环萜酚(cbc),大麻萜酚(cbg),四氢次大麻酚(thcv),δ9-四氢大麻酚(δ9thc)等。已经表明大麻及其衍生物可用于治疗疼痛、抗菌剂、与2型相关的代谢紊乱、降低眼内压、dravet综合征、林-戈综合征(lgs)、癫痫、恶心、与aids相关的疼痛和消耗病、关节炎和风湿病、偏头痛、与多发性硬化和瘫痪相关的肌肉痉挛、酒精和麻醉剂戒断、压力和抑郁、哮喘、纤维肌痛、炎性疼痛和与化疗相关的疼痛和/或炎症。fda批准的屈大麻酚和syndros含有δ9-thc,其目前用于与化疗治疗相关的疼痛和/或炎症。此外,于2016年4月份,fda授予大麻二酚用于治疗结节性硬化症(tsc)、dravet综合征和林-戈综合征的指定孤儿药。
7.林-戈综合征(lgs)是一种严重形式的癫痫,典型地在婴儿或儿童早期变得明显。lgs的发作通常在2-7年之间,在3到5年之间达到高峰。受影响的儿童会经历几种不同类型的癫痫发作,最常见的是失张力、强直和非典型失神发作。
8.2018年,吉瓦制药的快速通道指定药物“epidiolex”(大麻二酚)获得fda批准,用
[0016][0017][0018]
这些副作用与剂量有关,因此需要监视患者,如果需要,减少剂量。然而,tdds系统以确定的输入速率恒定地输送药物分子。与口服给药时血浆浓度的峰值和谷值不同,tdds将平均血浆浓度保持在预定的恒定输入速率。
[0019]
虽然有关于大麻二酚的专利可用,但是这些公开的缺点可通过本文的公开来克服。例如,us9375417不能提供任何体外或体内数据。us6328992公开了储库和粘合剂基质贴片,然而,这些实施例包含大麻素(例如δ-8-thc、δ-9-thc、大麻二酚和大麻酚)的混合物,而不仅仅是大麻二酚。thc是一种精神活性剂和成瘾物质,因此效用存在问题。
[0020]
另外,us8449908公开了48小时内通过人尸体皮肤的递送60600ng的累积量。该量表示1925ng/cm2/hr的通量。贴剂面积可以使用下面的等式来计算。
[0021]
体外通量(ug/cm2/hr)=(css(ug/l)
×
cl(l/hr)/贴剂面积(cm2)
[0022]
贴剂面积(cm2)=(css(ug/1)
×
cl(l/hr)/体外通量(ug/cm2/hr)
[0023]
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
=(10
×
74.4)/1.925
[0024]
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
=386cm2[0025]
为了递送5mg/kg/天的大麻二酚,患者必须在386cm2的表面积上施用制剂。这对于任何透皮给药系统(tdds)都是不实际的贴剂尺寸。此外,'908专利公开了使用接收介质pbs:peg-400(60:40)。众所周知,peg-400是渗透性增强剂,通过将其加入到接收介质中,皮肤会从真皮侧受损,这也会因皮肤样本无法存活而增加渗透量。
[0026]
需要一种能够克服与口服和静脉途径有关的缺点的改进的大麻二酚的药物传递系统。高纯度大麻二酚的透皮递送可以解决与口服和静脉药物递送相关的挑战。本发明解决了上述所有缺点,并提供了真实世界的效用。此外,本文公开的是合成形式的大麻二酚的用途,其在比植物来源更受控的环境中制造。合成形式的大麻二酚与掺杂形式的大麻二酚相比提供了更多的渗透性。此外,本发明涉及例如透皮基质贴剂,其可递送合成大麻二酚达1天,和/或2天,和/或3天,和/或4天,和/或5天,和/或6天,和/或7天,和/或高达15天。
[0027]
本文引用的所有参考文献在此全部引入作为参考。
技术实现要素:
[0028]
本公开提供了使用透皮给药治疗和/或预防和/或控制癫痫症的组合物和方法。在透皮给药中,将透皮贴剂或透皮组合物局部应用于皮肤表面。在局部应用透皮贴剂或透皮组合药物的整个过程中,药物通过完整的皮肤(通过跨细胞、细胞间和跨附件途径)持续释放和递送,以实现全身作用。因此,一旦施用透皮组合物或透皮贴剂,可以全天或甚至超过一天将药物输送到全身循环,这取决于其施用的持续时间,甚至可以长达一周。
[0029]
透皮给药可以减少目前每天多次施用的cbd的给药频率。通过透皮传递,可将高纯度cbd的透皮组合物或透皮制剂或透皮贴剂局部施用到皮肤上,从而在整个局部施用期间传递药物。根据需要,局部施用的持续时间可以是一天一次,两天一次,三天一次,四天一次,五天一次,一周一次。因此,透皮传递可以通过减少给药频率来克服口服递送的多给药方案。
[0030]
而且,在透皮给药中,药物在整个局部施用期间缓慢地和连续地给药,因此,没有与一天内多剂量给药相关的药物血浆浓度中的峰和谷。因此,通过透皮递送高纯度cbd,患者可以在没有药物血浆浓度急剧变化的情况下具有药物的长时间治疗效果。
[0031]
在透皮给药中,药物通过皮肤进入全身循环,它避开了肝脏代谢的首过效应,因此达到所需的治疗活性所需的药物较少,从而减少不良反应或副作用。大麻酚脂溶性高,口服后经肝脏首过代谢,因此给药剂量中只有10%~20%到达全身循环,因此与口服相比,透皮
给药小剂量的大麻二酚可以以低于口服的剂量产生所需的治疗效果。
[0032]
而且透皮给药简单、无创、方便。透皮贴剂或透皮组合物的给药不需要医学监督,因为患者可以自己局部施用透皮贴剂或透皮组合物。因此,透皮给药可以克服注射的缺点,所述注射通常是疼痛的并且需要医学监督。
[0033]
关于大麻二酚,预计通过透皮给药的患者间药理学反应的变异性会更小,因为药物血浆浓度可以通过控制透皮组合物或透皮贴剂的给药速率来控制。通过透皮给药,少量的大麻二酚可以比口服给药持续更长的时间。与立即释放剂型相比,大麻二酚的透皮制剂还提供更多的滥用阻止作用。
[0034]
此外,在任何不良反应、副作用或紧急透皮给药的情况下,通过从皮肤上取下透皮贴剂或透皮组合物,可以随时终止治疗。
[0035]
根据上述治疗和/或预防和/或控制癫痫症的原因,透皮给药可以提供比传统给药系统更友好、简化和方便的治疗方案。透皮传递可以减少高纯度cbd的给药频率。根据需要,给药频率可以是每天一次,两天一次,三天一次,四天一次,五天一次,六天一次,每周一次。
[0036]
通过药物组合的透皮给药,可以同时递送两种或更多种药物。根据需要,含有药物组合的透皮贴剂或透皮组合物的给药频率可以是每天一次,两天一次,三天一次,四天一次,五天一次,六天一次,每周一次。这将极大地增加患者的依从性。
[0037]
本公开提供了一种药物组合物,该药物组合物在用于透皮递送的剂型中包含至少约90%(w/w)的大麻二酚(cbd)。本公开提供了一种药物组合物,其包含至少约95%的cbd。本公开提供了一种药物组合物,其包含至少约98%的cbd。本公开提供了一种药物组合物,其包含至少约99%的cbd。本公开提供了配制成透皮液体制剂、透皮半固体制剂或透皮聚合物基质制剂的药物组合物。本公开提供了一种药物组合物,其进一步包含有效量的载体或成分,该载体或成分选自溶剂、胶凝剂、聚合物、渗透促进剂、润肤剂、皮肤刺激减少剂、缓冲剂、ph稳定剂、增溶剂、悬浮剂、分散剂、稳定剂、增塑剂、表面活性剂、抗氧化剂、氧化剂及其组合。本公开提供了一种药物组合物,其进一步包含有效量的载体或成分,该载体或成分选自溶剂、胶凝剂、聚合物、渗透促进剂、润肤剂、皮肤刺激减少剂、缓冲剂、ph稳定剂、增溶剂、悬浮剂、分散剂、稳定剂、增塑剂、表面活性剂、抗氧化剂、氧化剂及其组合,范围为0.01%-95%w/w或w/v。本公开提供了一种药物组合物,其中载体以0.01%-99.8%w/w或w/v的范围存在。本公开提供了一种配制成透皮贴剂的药物组合物。本公开提供了配制成透皮贴剂的药物组合物,其中该透皮贴剂选自例如储库型贴剂、微储库型贴剂、基质贴剂、压敏胶贴剂、缓释透皮膜储液系统、微储库型贴剂、基质贴剂、压敏胶贴剂、粘膜粘合剂贴剂及其组合。本公开提供了一种药物组合物,用于治疗和/或预防和/或控制患者的癫痫症,其中癫痫症包括例如复杂部分性癫痫、简单部分性癫痫、继发性泛化部分性癫痫、全身性癫痫(包括失神、大发作(强直阵挛)、癫痫持续状态、强直、失张力、肌阵挛),新生儿和小儿痉挛、药物引起的癫痫发作、创伤引起的癫痫发作和热性惊厥,以及其他特定的癫痫综合征,如青少年肌阵挛性癫痫、林-戈综合征、dravet综合征、颞叶内侧癫痫、夜间额叶癫痫、进行性癫痫伴智力低下和进行性肌阵挛性癫痫,以及与cns肿块病变相关的癫痫发作。本公开提供了一种药物组合物,其配制成透皮制剂,其可以以选自由以下组成的组中的给药方案给药:每天一次、每天两次、每天三次、每1-8小时一次、每1-24小时一次、两天一次、三天一次、四天一次、五天一次、六天一次、一周一次、8到约13天一次、两周一次、15天到约约30天一次。本公开提供了
一种可配制成微针的药物组合物。本公开提供了一种药物组合物,其中所述cbd或其衍生物通过合成途径产生。本公开提供了与至少一种另外的选自下组的抗癫痫剂共同施用的药物组合物:氯巴占;左乙拉西坦;托吡酯;司替戊醇;苯巴比妥;拉科酰胺;丙戊酸;唑尼沙胺;吡仑帕奈;和磷苯妥英。本公开提供了一种药物组合物,其还包含至少一种另外的选自下组的抗癫痫剂:氯巴占;左乙拉西坦;托吡酯;司替戊醇;苯巴比妥;拉科酰胺;丙戊酸;唑尼沙胺;吡仑帕奈;和磷苯妥英。
[0038]
本公开提供了一种用于治疗和/或预防和/或控制患者的癫痫症的方法,包括:选择需要治疗和/或预防和/或控制癫痫症的患者;局部施用如本文公开的药物组合物。本公开提供了一种用于治疗和/或预防和/或控制患者的癫痫症的方法,其中癫痫症包括复杂部分性癫痫、简单部分性癫痫、继发性泛化的部分性癫痫、全身性癫痫(包括失神、大发作(强直阵挛)、癫痫持续状态、强直、失张力、肌阵挛)、新生儿和小儿痉挛、药物引起的癫痫发作、创伤引起的癫痫发作和热性惊厥,以及其他特定的癫痫综合征,如青少年肌阵挛性癫痫、林-戈综合征、dravet综合征、颞叶内侧癫痫、夜间额叶癫痫、进行性癫痫伴智力低下和进行性肌阵挛性癫痫,以及与cns肿块病变相关的癫痫发作。本公开提供了一种用于治疗和/或预防和/或控制患者癫痫症的方法,其中局部施用透皮贴剂用于治疗和/或预防和/或控制患者的癫痫症,其中癫痫症包括复杂部分性癫痫、简单部分性癫痫、继发性泛化的部分性癫痫、全身性癫痫(包括失神、大发作(强直阵挛)、癫痫持续状态、强直、失张力、肌阵挛)、新生儿和小儿痉挛、药物引起的癫痫发作、创伤引起的癫痫发作和热性惊厥,以及其他特定的癫痫综合征,如青少年肌阵挛性癫痫、林-戈综合征、dravet综合征、颞叶内侧癫痫、夜间额叶癫痫、进行性癫痫伴智力低下和进行性肌阵挛性癫痫,以及与cns肿块病变相关的癫痫发作,给药方案如下:一天一次,两天一次,三天一次,四天一次,五天一次,六天一次,一周一次,十天一次。本公开提供了一种用于治疗和/或预防和/或控制患者癫痫症的方法,进一步提供透皮贴剂的活性成分在一段时间内的恒定递送速率。本公开提供了一种用于治疗和/或预防和/或控制患者癫痫症的方法,进一步提供透皮贴剂的活性成分在一段时间内的稳定吸收率。本公开提供了一种用于治疗和/或预防和/或控制患者癫痫症的方法,进一步在一段时间内实现透皮贴剂的活性成分的恒定血清水平。本公开提供了一种用于治疗和/或预防和/或控制患者癫痫症的方法,进一步实现在一段时间内透皮贴剂的活性成分的剂量变化减少。本公开提供了一种用于治疗和/或预防和/或控制患者的癫痫症的方法,进一步提供了在一段时间内在治疗范围内的透皮贴剂的活性成分的血浆浓度。
[0039]
本公开提供了一种药物组合物,其包含高纯度大麻提取物,该提取物包含至少约90%(w/w)的大麻二酚(cbd),呈用于透皮递送的剂型。本公开提供了一种药物组合物,其中高纯度大麻提取物包含至少约95%的cbd。本公开提供了一种药物组合物,其中高纯度大麻提取物包含至少约98%的cbd。本公开提供了一种药物组合物,其中高纯度大麻提取物包含至少约99%的cbd。本公开提供了配制成透皮液体制剂、透皮半固体制剂或透皮聚合物基质制剂的药物组合物。本公开提供了一种药物组合物,其进一步包含有效量的载体或成分,该载体或成分选自溶剂、胶凝剂、聚合物、渗透促进剂、润肤剂、皮肤刺激减少剂、缓冲剂、ph稳定剂、增溶剂、助悬剂、分散剂、稳定剂、增塑剂、表面活性剂、抗氧化剂、氧化剂及其组合。本公开提供了一种药物组合物,其进一步包含有效量的载体或成分,该载体或成分选自溶剂、胶凝剂、聚合物、渗透促进剂、润肤剂、皮肤刺激减少剂、缓冲剂、ph稳定剂、增溶剂、悬浮剂、
分散剂、稳定剂、增塑剂、表面活性剂、抗氧化剂、氧化剂及其组合,范围为0.01%-95%w/w或w/v。本公开提供了一种药物组合物,其中载体以0.01%-99.8%w/w或w/v的范围存在。本公开提供了一种配制成透皮贴剂的药物组合物。本公开提供了配制成透皮贴剂的药物组合物,其中所述透皮贴剂选自例如储库型贴剂、微储库型贴剂、基质贴剂、压敏胶贴剂、缓释透皮膜、液体储库系统、微储库型贴剂、基质贴剂、压敏胶贴剂、粘膜粘合剂贴剂及其组合。本公开提供了一种药物组合物,用于治疗和/或预防和/或控制患者的癫痫症,其中癫痫症包括例如复杂部分性癫痫、简单部分性癫痫、继发性泛化的部分性癫痫、全身性癫痫(包括失神、大发作(强直阵挛)、癫痫持续状态、强直、失张力、肌阵挛)、新生儿和小儿痉挛、药物引起的癫痫发作、创伤引起的癫痫发作和热性惊厥,以及其他特定的癫痫综合征,如青少年肌阵挛性癫痫、林-戈综合征、dravet综合征、结节性硬化症(tsc)、难治性癫痫、难治性小儿癫痫、颞叶内侧癫痫、夜间额叶癫痫、进行性癫痫伴智力低下和进行性肌阵挛性癫痫,以及与cns肿块病变相关的癫痫发作。本公开提供了一种药物组合物,其配制成透皮制剂,其可以以选自由以下组成的组中的给药方案给药:每天一次、每天两次、每天三次、每1-8小时一次、每1-24小时一次、两天一次、三天一次、四天一次、五天一次、六天一次、一周一次、8到约13天一次、两周一次、15天到约约30天一次。本公开提供了一种可配制成微针的药物组合物。本公开提供了一种药物组合物,其中所述cbd或其衍生物通过合成途径产生。本公开提供了与至少一种另外的选自下组的抗癫痫剂共同施用的药物组合物:氯巴占;左乙拉西坦;托吡酯;司替戊醇;苯巴比妥;拉科酰胺;丙戊酸;唑尼沙胺;吡仑帕奈;和磷苯妥英。本公开提供了一种药物组合物,其还包含至少一种另外的选自下组的抗癫痫剂:氯巴占;左乙拉西坦;托吡酯;司替戊醇;苯巴比妥;拉科酰胺;丙戊酸;唑尼沙胺;吡仑帕奈;和磷苯妥英。
[0040]
本公开提供了一种药物组合物,其包含高纯度大麻提取物,其包含至少约90%(w/w)大麻二酚(cbd),以用于透皮递送的剂型,其中该药物组合物包含:约9%至约12%w/w高纯度cbd;任选地,约30%至约99%的溶剂;任选地,约1%至约20%的渗透促进剂,其中组合物的ph保持在约4.0至8.0。本公开提供了配制成透皮液体制剂、透皮半固体制剂或透皮聚合物基质制剂的药物组合物。本公开提供了一种药物组合物,其进一步包含有效量的载体或成分,该载体或成分选自胶凝剂、聚合物、润肤剂、皮肤刺激减少剂、缓冲剂、ph稳定剂、增溶剂、助悬剂、分散剂、稳定剂、增塑剂、表面活性剂、抗氧化剂、氧化剂及其组合。本公开提供了一种药物组合物,其进一步包含有效量的载体或成分,该载体或成分其选自胶凝剂、聚合物、润肤剂、皮肤刺激减少剂、缓冲剂、ph稳定剂、增溶剂、助悬剂、分散剂、稳定剂、增塑剂、表面活性剂、抗氧化剂、氧化剂及其组合,其在0.01%-95%w/w或w/v范围内。本公开提供了一种配制成透皮贴剂的药物组合物。本公开提供了配制成透皮贴剂的药物组合物,其中该透皮贴剂选自例如储库型贴剂、微储库型贴剂、基质贴剂、压敏胶贴剂、缓释透皮膜、液体储库系统、微储库型贴剂、基质贴剂、压敏胶贴剂、粘膜粘合剂贴剂及其组合。本公开提供了一种药物组合物,用于治疗和/或预防和/或控制患者的癫痫症,其中癫痫症包括例如复杂部分性癫痫、简单部分性癫痫、继发性泛化的部分性癫痫、全身性癫痫(包括失神、大发作(强直阵挛)、癫痫持续状态、强直、失张力、肌阵挛)、新生儿和小儿痉挛、药物引起的癫痫发作、创伤引起的癫痫发作和热性惊厥,以及其他特定的癫痫综合征,如青少年肌阵挛性癫痫、林-戈综合征、dravet综合征、结节性硬化症(tsc)、难治性癫痫、难治性小儿癫痫、颞叶内侧癫痫、夜间额叶癫痫、进行性癫痫伴智力低下和进行性肌阵挛性癫痫,以及与cns肿块
病变相关的癫痫发作。本公开提供了一种药物组合物,其配制成透皮制剂,其可以以选自由以下组成的组中的给药方案给药:每天一次、每天两次、每天三次、每1-8小时一次、每1-24小时一次、两天一次、三天一次、四天一次、五天一次、六天一次、一周一次、8到约13天一次、两周一次、15天到约约30天一次。本公开提供了一种可配制成微针的药物组合物。本公开提供了一种药物组合物,其中所述cbd或其衍生物通过合成途径产生。本公开提供了与至少一种另外的选自下组的抗癫痫剂共同施用的药物组合物:氯巴占;左乙拉西坦;托吡酯;司替戊醇;苯巴比妥;拉科酰胺;丙戊酸;唑尼沙胺;吡仑帕奈;和磷苯妥英。本公开提供了一种药物组合物,其还包含至少一种另外的选自下组的抗癫痫剂:氯巴占;左乙拉西坦;托吡酯;司替戊醇;苯巴比妥;拉科酰胺;丙戊酸;唑尼沙胺;吡仑帕奈;和磷苯妥英。
[0041]
本公开提供了一种用于治疗和/或预防和/或控制患者的癫痫症的方法,包括:选择需要治疗和/或预防和/或控制癫痫症的患者;局部施用如本文公开的药物组合物。本公开提供了一种方法,其中癫痫症包括例如复杂部分性癫痫、简单部分性癫痫、继发性泛化的部分性癫痫、全身性癫痫(包括失神、大发作(强直阵挛)、癫痫持续状态、强直、失张力、肌阵挛)、新生儿和小儿痉挛、药物引起的癫痫发作、创伤引起的癫痫发作和热性惊厥,以及其他特定的癫痫综合征,如青少年肌阵挛性癫痫、林-戈综合征、dravet综合征、结节性硬化症(tsc)、难治性癫痫、难治性小儿癫痫、颞叶内侧癫痫、夜间额叶癫痫、进行性癫痫伴智力低下和进行性肌阵挛性癫痫,以及与cns肿块病变相关的癫痫发作。本公开提供了一种方法,其中局部施用透皮贴剂用于治疗和/或预防和/或控制患者的癫痫发作,其中癫痫症包括例如复杂部分性癫痫、简单部分性癫痫、继发性泛化的部分性癫痫、全身性癫痫(包括失神、大发作(强直阵挛)、癫痫持续状态、强直、失张力、肌阵挛)、新生儿和小儿痉挛、药物引起的癫痫发作、创伤引起的癫痫发作和热性惊厥,以及其他特定的癫痫综合征,如青少年肌阵挛性癫痫、林-戈综合征、dravet综合征、结节性硬化症(tsc)、难治性癫痫、难治性小儿癫痫、颞叶内侧癫痫、夜间额叶癫痫、进行性癫痫伴智力低下和进行性肌阵挛性癫痫,以及与cns肿块病变相关的癫痫发作,其给药方案为每天一次、两天一次、三天一次、四天一次、五天一次、六天一次、一周一次、十天一次。本公开提供了一种方法,该方法进一步提供了透皮贴剂的活性成分在一段时间内的恒定递送速率。本公开提供了一种方法,该方法进一步提供了透皮贴剂的活性成分在一段时间内的稳定吸收率。本公开提供了一种方法,该方法进一步在一段时间内实现透皮贴剂的活性成分的恒定血清水平。本公开提供了一种方法,该方法进一步实现了在一段时间内透皮贴剂的活性成分的剂量变化减少。本公开提供了一种方法,该方法进一步提供在一段时间内在治疗范围内的透皮贴剂的活性成分的血浆浓度。
[0042]
本公开提供了本公开的组合物在制备用于治疗本文所述适应症的药物中的用途。
[0043]
根据另一个实施方案,本公开提供了上述药物组合物的用途、用于药物的有效量,最优选用作治疗受试者的疾病或病症的药物,例如本文所公开的。
[0044]
根据又一个实施方案,本公开提供了上述药物组合物和至少一种另外的治疗剂以有效量用于药物中的用途,并且最优选用作治疗受试者的疾病或病症的药物,例如本文所公开的。
具体实施方式
[0045]
大麻素是由大麻物种产生的一组含21个碳的萜酚化合物。大麻素也可以合成生
产。术语“大麻素”在下文是指一类不同的化合物,它们作用于细胞上的大麻素受体,抑制大脑中神经递质的释放。这些受体蛋白包括内源性大麻素(人类和动物在体内自然产生)、植物大麻素(存在于大麻和其他一些植物中)和合成大麻素。亲脂性大麻素通常归类为内源性大麻素(最典型的是哺乳动物内源性大麻素);植物来源的植物大麻素;和合成大麻素。此类大麻素通常也分为以下子类:大麻萜酚(cbg);大麻环萜酚(cbc);大麻二酚(cbd);四氢大麻酚(thc);大麻酚(cbn);大麻二酚(cbdl);大麻环酚(cbl);大麻素(cbe);和大麻三酚(cbt)。
[0046]
大麻二酚iupac名称2-[(1r,6r)-6-异丙烯基-3-甲基环己-2-烯-1-基]-5-戊基苯-1,3-二醇,化学式:c
21h30
o2,分子量:314.46道尔顿,化学结构如下式i所示:
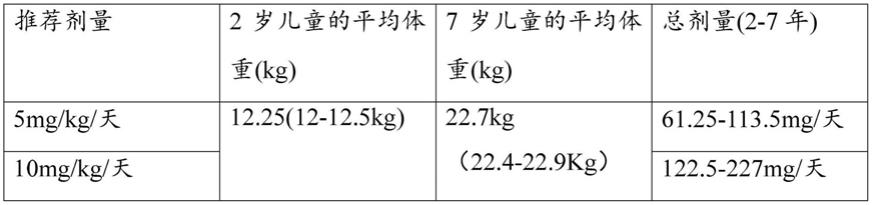
[0047][0048]
四氢大麻酚(thc)iupa名称(-)-(6ar,10ar)-6,6,9-三甲基-3-戊基-6a,7,8,10a-四氢-6h-苯并[c]苯并吡喃-1-醇,化学式:c
21h30
o2,分子量:314.47道尔顿。
[0049]
化学结构如下式ii所示:
[0050][0051]
如本文所用,术语大麻是指大麻及其衍生物的所有药学上可接受的形式,可以是单独的,也可以是它们的组合,例如,以下列形式,但不限于,例如游离碱或盐或异构体或无定形或晶体或共晶体或固溶体或前药或类似物或衍生物或代谢物。例如,大麻二酚的游离碱或其盐或其异构体或其无定形形式或其晶体形式或其共晶体形式或其固溶体或其前药或其类似物或其衍生物或合成形式。该化合物可以是例如药学上可接受的盐的形式,例如酸加成盐或碱盐,或其溶剂化物的形式,包括其水合物。合适的酸加成盐由形成无毒盐的酸形成,并且实例是盐酸盐,氢溴酸盐,氢碘化物,硫酸盐,硫酸氢盐,硝酸盐,磷酸盐,磷酸氢盐,乙酸盐,马来酸盐,延胡索酸盐,乳酸盐,酒石酸盐,柠檬酸盐,葡糖酸盐,琥珀酸盐,糖酸盐,苯甲酸盐,甲磺酸盐,乙磺酸盐,苯磺酸盐,对甲苯磺酸盐和双羟萘酸盐。合适的碱盐由形成无毒盐的碱形成,实例是钠,钾,铝,钙,镁,锌和二乙醇胺盐。
[0052]
本文所用术语“大麻二酚”包括其游离碱,其盐,其异构体,其无定形形式,其晶形,
其共晶形,其前药,其类似物,其衍生物和其合成形式,单独或其组合。在某些实施方案中,cbd是高纯度。在某些实施方案中,cbd以高纯度大麻提取物的形式存在,该提取物包含至少90%,91%,92%,93%,94%,95%,96%,97%,98%,99%,99.5%或99.75%(w/w)cbd。在示例性实施方案中,本公开的制剂可以包含此处公开的浓度为制剂的约0.01%,约0.02%,约0.05%,约0.1%,约0.2%,约0.3%,约0.4%,约0.5%,约0.6%,约0.7%,约0.8%,约0.9%,约1%,约2%,约3%,约4%,约5%,约6%,约7%,约8%,约9%,约9.1%,约9.2%,约9.3%,约9.4%,约9.5%,约9.6%,约9.7%,约9.8%,约9.9%,约9.25%,约9.5%,约9.75%,约10%,约11%,约12%,约13%,约14%,约15%,约16%,约17%,约18%,约19%,约20%,约21%,约22%,约23%,约24%,约25%,约26%,约27%,约28%,约29%,约30%,约35%,约40%,约45%,约50%,约55%,约60%,约61%,约62%,约63%,约64%,约65%,约66%,约67%,约68%,约69%,约70%,约75%,约75%和约80%的cbd。在示例性实施方案中,本发明的制剂可包含制剂的w/w浓度为约1-25%,约5-20%,约8-15%,或约9-14%,约9-13%,约9-12%的cbd。
[0053]
在某些实施方案中,cbd的剂量大于例如约1,2,3,4,5,6,7,8,9,10,15,20,25,30,35,40或45mg/kg/天。在某些实施方案中,cbd的剂量大于例如约1,2,3,4,5,6,7,8,9,10,15,20,25,30,35,40,45,50,55,60,65,70,75,80,85,90,95,100,125,150,175,200,225,250或275mg/天。
[0054]
本文所用术语“药学上可接受的盐”包括游离碱的酸加成盐或加成盐。
[0055]
大麻二酚在其范围内的术语“药学上可接受的盐”包括所有可能的异构体及其混合物,以及任何药学上可接受的代谢物、生物前体和/或前体药物,例如结构式不同于本公开的化合物之一,并且在施用给受试者,例如哺乳动物,特别是人类后,在体内直接或间接地转化为本公开化合物的化合物。
[0056]
本文所用术语“受试者”和“患者”可互换使用。本文所用术语“患者”指动物,优选哺乳动物,例如非灵长类动物(例如,牛、猪、马、猫、狗、老鼠等)和灵长类动物(例如,猴和人),最优选人。在一些实施方案中,受试者是非人类动物,例如农场动物(例如,马、猪或牛)或宠物(例如,狗或猫)。在一个具体实施方案中,受试者是人。如本文所用,术语“药剂”是指用于预防、治疗、管理和/或诊断疾病或病症的任何分子、化合物、方法学和/或物质。如本文所用,术语“有效量”是指足以导致预防疾病或病症及其一种或多种症状的发展、复发或发作的治疗量,以增强或改善另一种疗法的预防效果,降低疾病或病症的严重程度和持续时间,改善疾病或病症的一个或多个症状,防止疾病或病症的进展,导致疾病或病症的消退,和/或增强或改善另一种疗法的治疗效果。
[0057]
如本文所用,术语“药学上可接受的”是指由联邦或州政府的监管机构批准,或列于美国药典、欧洲药典或其他公认的用于动物,更具体地用于人类的药典中。
[0058]
如本文所用,术语“治疗剂”是指用于治疗和/或控制疾病或病症的任何分子、化合物和/或物质。
[0059]
如本文所用,术语“多种疗法”和“疗法”可指可用于预防、治疗和/或管理疾病或病症或其一种或多种症状的任何方法、组合物和/或药剂。在某些实施方案中,术语“疗法”和“多种疗法”是指小分子疗法。
[0060]
如本文所用,术语“衍生物”或“衍生的”包括例如本公开的化合物的化学修饰,或
从植物来源中提取的化合物或或其药学上可接受的盐或其混合物。即,“衍生物”可以是本公开化合物的功能等效物,其能够在给定受试者中诱导改善的药理学功能活性。
[0061]
如本文所用,术语“组合物”和“制剂”可互换使用。
[0062]
如本文所用,术语“透皮递送”是指通过皮肤将药物递送到全身循环中。
[0063]
根据某些实施方案,本文所述的透皮组合物用于治疗和/或预防和/或控制患者的癫痫发作,其中癫痫发作疾病包括例如复杂部分性癫痫、简单部分性癫痫、继发性泛化部分性癫痫、全身性癫痫(包括失神、大发作(强直阵挛)、癫痫持续状态、强直、失张力、肌阵挛)、新生儿和小儿痉挛、药物引起的癫痫发作、创伤引起的癫痫发作和热性惊厥,以及其他特定的癫痫综合征,如青少年肌阵挛性癫痫、林-戈综合征、dravet综合征、颞叶内侧癫痫、夜间额叶癫痫、进行性癫痫伴智力低下和进行性肌阵挛性癫痫,以及与cns肿块病变相关的癫痫发作。
[0064]
癫痫
[0065]
癫痫是一种大脑疾病,其特征是随着时间的推移反复发作。癫痫的类型可以包括但不限于全身性癫痫,例如儿童失神性癫痫、青少年肌阵挛性癫痫、觉醒时癫痫大发作、west综合征、林-戈综合征、dravet综合征、结节性硬化症(tsc)、难治性癫痫、难治性小儿癫痫、部分性癫痫,如颞叶癫痫、额叶癫痫、儿童良性局灶性癫痫。
[0066]
癫痫持续状态(se)可以包括例如惊厥性癫痫持续状态,例如早期癫痫持续状态、确定性癫痫持续状态、难治性癫痫持续状态、超难治性癫痫持续状态;非惊厥性癫痫持续状态,例如全身性癫痫持续状态、复杂部分性癫痫持续状态;全身周期性癫痫样放电;和周期性偏侧癫痫样放电。惊厥性癫痫持续状态的特征是存在惊厥状态癫痫发作,可以包括早期癫痫持续状态、确定性癫痫持续状态、难治性癫痫持续状态、超难治性癫痫持续状态。早期癫痫持续状态采用一线疗法治疗。确定性癫痫持续状态的特征在于,尽管使用一线疗法进行治疗,但仍持续存在癫痫发作状态,并且给予二线疗法。难治性癫痫持续状态的特征在于尽管使用一线和二线疗法治疗仍持续存在癫痫发作状态,并且通常施用全身麻醉剂。超难治性癫痫持续状态的特征是尽管使用一线疗法、二线疗法和全身麻醉剂治疗24小时或更长时间,但仍持续存在癫痫发作状态。
[0067]
非惊厥性癫痫持续状态可包括例如局灶性非惊厥性癫痫持续状态,例如复杂部分非惊厥性癫痫持续状态、简单部分非惊厥性癫痫持续状态、轻微非惊厥性癫痫持续状态;全身性非惊厥性癫痫持续状态,例如迟发性失神非惊厥性癫痫持续状态、非典型失神非惊厥性癫痫持续状态或典型失神非惊厥性癫痫持续状态。
[0068]
本文所述的组合物还可以作为预防剂施用于患有cns病症的受试者,例如创伤性脑损伤、癫痫持续状态,例如惊厥性癫痫持续状态,例如早期癫痫持续状态、确定性癫痫持续状态、难治性癫痫持续状态、超难治性癫痫持续状态;非惊厥性癫痫持续状态,例如全身性癫痫持续状态、复杂部分性癫痫持续状态;全身周期性癫痫样放电;和周期性偏侧癫痫样放电;在癫痫发作之前。
[0069]
癫痫发作
[0070]
癫痫发作是大脑异常电活动发作后发生的物理发现或行为变化。术语“癫痫发作”通常与“抽搐”互换使用。抽搐是指一个人的身体快速而无法控制地摇晃。在抽搐期间,人的肌肉反复收缩和放松。
[0071]
根据行为和大脑活动的类型,癫痫发作分为两大类:全身性和部分性(也称为局部或局灶性)。对癫痫发作类型进行分类有助于医生诊断患者是否患有癫痫症。
[0072]
全身性癫痫发作是由来自整个大脑的电脉冲产生的,而部分性癫痫发作是由大脑相对较小部分的电脉冲产生的(至少在最初)。产生癫痫发作的大脑部分有时被称为焦点。
[0073]
有六种类型的全身性癫痫发作。最常见、最剧烈,因此也是最知名的,是全身性惊厥,也称为大发作。在这种类型的癫痫发作中,患者会失去意识并且通常会昏倒。意识丧失之后是全身僵硬(称为癫痫发作的“强直”阶段)持续30到60秒,然后是剧烈抽搐(“阵挛”阶段)持续30到60秒,之后患者进入深度睡眠(“发作后”或癫痫发作后阶段)。在大发作期间,可能会发生伤害和事故,例如咬舌和尿失禁。
[0074]
失神发作会导致短暂的意识丧失(仅几秒钟),几乎没有或没有症状。患者,通常是儿童,通常会中断活动并茫然地凝视。这些癫痫发作突然开始和结束,每天可能发生数次。患者通常不知道他们正在癫痫发作,除了他们可能知道“失去时间”。
[0075]
肌阵挛发作由零星的抽搐组成,通常发生在身体的两侧。患者有时将抽搐描述为短暂的电击。当剧烈时,这些癫痫发作可能导致物体掉落或不由自主地投掷。
[0076]
阵挛性癫痫发作是同时涉及身体两侧的重复性、有节奏的抽搐。
[0077]
强直性癫痫发作的特征是肌肉僵硬。
[0078]
失张力发作包括肌肉张力的突然和普遍丧失,特别是在手臂和腿部,这通常会导致跌倒。
[0079]
本文所述的癫痫发作可包括癫痫性发作;急性重复性癫痫发作;丛集性癫痫发作;连续癫痫发作;无休止的癫痫发作;长时间癫痫发作;反复癫痫发作;癫痫持续状态发作,例如,难治性惊厥性癫痫持续状态、非惊厥性癫痫持续状态发作;难治性癫痫发作;肌阵挛性癫痫发作;强直性癫痫发作;强直阵挛癫痫发作;简单部分性癫痫发作;复杂部分性癫痫发作;继发性全身性癫痫发作;非典型失神发作;失神发作;失张力发作;良性中央癫痫发作;高热惊厥;情绪发作;局灶性癫痫发作;痴笑样癫痫;全身性癫痫发作;婴儿痉挛;杰克逊式癫痫发作;大量双侧肌阵挛发作;多灶性癫痫发作;新生儿癫痫发作;夜间癫痫发作;枕叶癫痫发作;创伤后癫痫发作;微小癫痫发作;sylvan癫痫发作;视觉反射性癫痫;或撤退性癫痫发作。
[0080]
纯化的cbd
[0081]
本公开提供了相对于在伴随的抗癫痫药物(aed)上实现的癫痫发作频率,cbd以使总癫痫发作频率降低大于70%的量存在。更优选地,相对于在伴随的抗癫痫药物(aed)上实现的癫痫发作频率,cbd以使总癫痫发作频率降低大于90%的量存在。更优选地,相对于在伴随的抗癫痫药物(aed)上实现的癫痫发作频率,cbd以将总癫痫发作频率降低100%的量存在。
[0082]
在一个实施方案中,cbd作为高纯度大麻提取物存在,其包含至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、99.5%或99.75%(w/w)cbd。
[0083]
一种或多种aed优选选自:氯巴占;左乙拉西坦;托吡酯;司替戊醇;苯巴比妥;拉科酰胺;丙戊酸;唑尼沙胺;吡仑帕奈;和磷苯妥英。在某些实施方案中,cbd与氯巴占组合使用。优选地,减少与cbd联合使用的不同抗癫痫药物的数量或aed的剂量。更优选地,减少的aed剂量是氯巴占。
[0084]
在某些实施方案中,cbd的剂量大于例如约1、2、3、4、5、6、7、8、9、10、15、20、25、30、35、40或45mg/kg/天。例如,对于15kg的患者,每天将提供大于75mg的cbd剂量。本公开提供cbd以大于5mg/kg/天的剂量存在,例如大于10/mg/kg/天、大于15mg/kg/天、大于20mg/kg/天并且大于25mg/kg/day也被认为是有效的。在某些实施方案中,cbd的剂量大于例如约1、2、3、4、5、6、7、8、9、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175、200、225、250或275mg/天。
[0085]
本公开提供了一种治疗难治性癫痫的方法,包括向受试者施用大麻二酚(cbd),其中癫痫是热性感染相关癫痫综合征(fires)。
[0086]
本公开提供了一种治疗难治性癫痫的方法,包括向受试者施用足以将总癫痫发作频率相对于一种或多种伴随的抗癫痫药物(aed)所实现的癫痫发作频率降低50%以上的量的大麻二酚(cbd)。
[0087]
药物组合物
[0088]
根据本文所述的某些实施方案,药物组合物或透皮制剂含有高纯度cbd。更优选透皮制剂可以包括高纯度cbd。
[0089]
本公开的一个实施方案可以是透皮药物递送系统,其可以包括但不限于透皮制剂、透皮贴剂、局部制剂、微针、离子电渗疗法、定量透皮喷雾。
[0090]
包括液体的透皮制剂,例如但不限于溶液、悬浮液、分散体、乳液。透皮制剂包括半固体,例如但不限于,凝胶、软膏、乳剂、乳膏、悬浮液、糊剂、洗剂、芳香制剂。优选掺入透皮贴剂中的液体制剂和/或凝胶制剂。包含聚合物基质的透皮制剂,不受粘合剂基质、非粘合剂基质等任何限制。
[0091]
没有任何限制,透皮贴剂可包括本领域所述的所有透皮药物递送系统,优选但不限于储库型贴剂、基质贴剂、双层基质贴剂、多层基质贴剂、微储库型贴剂、粘合剂系统、可透皮应用的胶带等。
[0092]
在本公开的某些实施方案中,透皮贴剂包含含有高纯度cbd的透皮制剂,该高纯度cbd包含在允许透皮贴剂粘附到皮肤上的储库或基质以及粘合剂中,允许来自透皮贴剂的高纯度cbd通过患者的皮肤。透皮递送系统可以是封闭的、半封闭的或非封闭的,并且可以是粘性的或非粘性的。
[0093]
可以将包含高纯度cbd的透皮制剂掺入贴剂中,并且可以将贴剂局部施用于皮肤表面。贴片可以留在受试者上任何合适的时间段。
[0094]
在一些实施方案中,透皮贴剂在预定时间段内提供透皮贴剂的活性成分的恒定递送速率。在一些实施例中,预定时间段是24小时、48小时、72小时、96小时、120小时、144小时、7天、8至13天、两周或15天。
[0095]
在更进一步的实施方案中,本文所述的透皮贴剂提供患者在预定时间内对透皮贴剂的活性成分的稳定吸收率。在一些实施例中,预定时间段是24小时、48小时、72小时、96小时、120小时、144小时、7天、8至13天、两周或15天。
[0096]
在更进一步的实施方案中,本文所述的透皮贴剂在预定时间段内在患者体内提供透皮贴剂的活性成分的恒定的血清水平。在一些实施例中,预定时间段是24小时、48小时、72小时、96小时、120小时、144小时、7天、8至13天、两周或15天。
[0097]
在更进一步的实施方案中,本文所述的透皮贴剂在预定时间段内在患者体内提供
治疗范围内的透皮贴剂的活性成分的血浆浓度。在一些实施例中,预定时间段是24小时、48小时、72小时、96小时、120小时、144小时、7天、8至13天、两周或15天。
[0098]
在更进一步的实施方案中,本文所述的透皮贴剂允许在预定时间段内降低患者体内活性成分剂量的变化性。在一些实施例中,预定时间段是24小时、48小时、72小时、96小时、120小时、144小时、7天、8至13天、两周或15天。
[0099]
本领域所述的局部制剂包括,例如但不限于,半固体例如软膏、乳膏、乳剂、微乳剂、纳米乳剂、糊剂、香膏、凝胶、洗剂、摩丝。液体,例如溶液、悬浮液、微悬浮液、纳米悬浮液、分散体、纳米分散体等。喷雾剂、气雾剂、乳浆剂等。包含高纯度cbd的局部制剂可局部施用于皮肤表面,用于透皮递送大麻二酚。
[0100]
本公开的一些实施方案的透皮制剂和/或局部制剂可以单独或组合包括有效量的载体或成分,而不限于以下载体或成分,例如溶剂、胶凝剂、聚合物、可生物降解的聚合物、渗透促进剂、润肤剂、皮肤刺激减少剂、缓冲剂、ph稳定剂、增溶剂、助悬剂、分散剂、稳定剂、增塑剂、增粘剂、表面活性剂、挥发性化学品、抗氧化剂、氧化剂、螯合剂、络合剂、稀释剂、赋形剂、制备贴剂的材料、制备基质贴剂的材料、制备储库型贴剂的材料等。
[0101]
大麻二酚可以溶解、悬浮、分散或均匀混合在上述单一载体、载体混合物和载体的组合中。两种或多种药物(如大麻二酚)的任意组合可以溶解、悬浮、分散或均匀混合在上述单一载体、载体混合物和载体的组合中。
[0102]
大麻二酚单独或其组合的所需最佳透皮和/或局部制剂可包括但不限于实施例1至实施例11所述的单独或组合的下列载体。
[0103]
将参考以下实例更详细地说明本发明,但应理解本发明不限于此。
[0104]
实例
[0105]
实例1
[0106]
本公开的透皮制剂和/或局部制剂可以单独或以其组合包含本领域技术人员已知的溶剂,但不限于例如以下醇类c
1-c
20
,例如但不限于(甲醇、乙醇、异丙醇、丁醇、丙醇等)、多元醇、二醇类例如但不限于(丙二醇、聚乙二醇、二丙二醇、己二醇、丁二醇、甘油等)、二醇衍生物、吡咯烷酮衍生物例如但不限于(n甲基2-吡咯烷酮、2-吡咯烷酮等)、亚砜例如但不限于(二甲基亚砜、癸甲基亚砜等)、二甲基异山梨醇、矿物油、植物油、水、极性溶剂、半极性溶剂、非极性溶剂、可用于制造基质贴剂的挥发性化学品例如但不限于(乙醇、丙醇、乙酸乙酯、丙酮、甲醇、二氯甲烷、氯仿、甲苯、ip a)、酸,例如但不限于醋酸、乳酸、乙酰丙酸、碱等。更优选地在0.01%-95%w/w或w/v的范围内。在示例性实施方案中,本公开的制剂可包含浓度为制剂的约0.01%、约0.02%、约0.05%、约0.1%、约0.2%、约0.3%、约0.4%、约0.5%、约0.6%、约0.7%、约0.8%、约0.9%、约1%、约2%、约3%、约4%、约5%、约6%、约7%、约8%、约9%、约10%、约11%、约12%、约13%、约14%、约15%、约16%、约17%、约18%、约19%、约20%、约21%、约22%、约23%、约24%、约25%、约26%、约27%、约28%、约29%、约30%、约35%、约40%、约45%、约50%、约55%、约60%、约61%、约62%、约63%、约64%、约65%、约66%、约67%、约68%、约69%、约70%,约75%、约75%和约80%的溶剂。在示例性实施方案中,本公开的制剂可包含浓度为约30%至99%、约35%至95%、约40%至约90%w/w的溶剂。在本公开的示例性制剂中,溶剂将占制剂的约1wt%至75wt%,优选2wt%至30wt%,更优选5wt%至20wt%。
[0107]
实例2
[0108]
本公开的透皮制剂和/或局部制剂可以单独或以其组合包含本领域技术人员已知的胶凝剂和/或增稠剂和/或悬浮剂,而不限于以下例如天然聚合物、多糖及其衍生物例如但不限于(琼脂、海藻酸及其衍生物、决明、胶原蛋白、明胶、结冷胶、瓜尔胶、果胶、角叉菜胶、角叉菜胶钾或钠、黄蓍胶、黄原胶、柯帕树脂、壳聚糖、树脂等)、半合成的聚合物及其衍生物,例如但不限于纤维素及其衍生物(甲基纤维素、乙基纤维素、羧甲基纤维素、羟丙基纤维素、羟丙基甲基纤维素等)、合成聚合物及其衍生物,例如但不限于聚羧乙烯或卡波姆(卡波姆940,卡波姆934,卡波姆97lp nf)、聚乙烯及其共聚物等,粘土例如但不限于(硅酸盐,膨润土)、二氧化硅、聚乙烯醇,丙烯酸聚合物(eudragit)、丙烯酸酯、聚丙烯酸酯共聚物、聚丙烯酰胺、聚乙烯吡咯烷酮均聚物和聚乙烯吡咯烷酮共聚物,例如但不限于(pvp、kollidon 30,泊洛沙姆)、异丁烯、乙基醋酸乙烯酯共聚物、天然橡胶、合成橡胶、压敏胶如有机硅聚合物例如但不限于(bio psa 4302,bio-psa 4202等)、丙烯酸压敏胶如但不限于(duro-tak 87-2156、duro-tak 387-2287等)、聚异丁烯例如但不限于(低分子量聚异丁烯、中分子量聚异丁烯、聚异丁烯35000mw等)、丙烯酸共聚物、橡胶基粘合剂、热熔粘合剂、苯乙烯-丁二烯共聚物、膨润土、所有的水和/或有机溶剂可溶胀的聚合物等。更优选在0.1%至70%w/w或w/v的范围内。在示例性实施方案中,本公开的制剂可以包含浓度为制剂的约0.01%、约0.02%、约0.05%、约0.1%、约0.2%、约0.3%、约0.4%、约0.5%、约0.6%、约0.7%、约0.8%、约0.9%、约1%、约2%、约3%、约4%、约5%、约6%、约7%,约8%,约9%,约10%,约11%,约12%,约13%,约14%,约15%,约16%,约17%,约18%,约19%,约20%、约21%、约22%、约23%、约24%、约25%、约26%、约27%、约28%、约29%、约30%、约35%、约40%、约45%,约50%、约55%、约60%、约61%、约62%、约63%、约64%、约65%、约66%、约67%、约68%、约69%、约70%、约75%、约75%和约80%的胶凝剂和增稠剂和/或悬浮剂。在示例性实施方案中,本公开的制剂可以包含浓度为约1至20%、约5%至25%、约10%至约20%或约15%至约18%、约30%至约70%、约35%至约65%和约40%至约64%w/w的胶凝剂和/或增稠剂和/或悬浮剂。在本公开的示例性制剂中,胶凝剂和/或增稠剂和/或悬浮剂将占制剂的约1wt%至75wt%,优选2wt%至30wt%,更优选5wt%至20wt%。
[0109]
实例3
[0110]
本公开的透皮制剂和/或局部制剂可包含本领域技术人员已知的单独或组合的渗透或渗透促进剂,但不限于以下物质,例如亚砜和类似化学品,例如但不限于(二甲基亚砜、二甲基乙酰胺、二甲基甲酰胺、癸甲基亚砜、二甲基异山梨醇等)、1,3-丁二醇、氮酮、吡咯烷酮,例如但不限于(n-甲基-2-吡咯烷酮、2-吡咯烷酮等)、酯、脂肪酸酯例如但不限于(丙二醇单月桂酸酯、乙酸丁酯、乙酸乙酯、肉豆蔻酸异丙酯、棕榈酸异丙酯、乙酸甲酯、油酸癸酯、甘油单油酸酯、甘油单月桂酸酯、月桂酸甲酯、月桂酸酯等)、脂肪酸例如但不限于(癸酸、辛酸、月桂酸、油酸、肉豆蔻酸、亚油酸、硬脂酸、棕榈酸等)、醇、脂肪醇和二醇例如但不限于(油醇、萘醇、十二烷醇、丙二醇、甘油等)、醚醇例如但不限于(二甘醇单乙醚)、尿素、甘油三酯例如但不限于甘油三乙酸酯、聚氧乙烯脂肪醇醚、聚氧乙烯脂肪酸酯、脂肪醇酯、精油、表面活性剂类型增强剂,例如但不限于(brij、十二烷基硫酸钠、吐温、聚山梨醇酯)、萜烯、萜类化合物和在“透皮穿透增强剂”一书中所有提到的渗透或渗透促进剂(eric w.smith,howard i.maibach,2005.nov,crc press)。更优选地在0.01%-95%w/w或w/v的范围内。在
示例性实施方案中,本公开的制剂可以包含浓度为制剂的约0.01%、约0.02%、约0.05%、约0.1%、约0.2%、约0.3%、约0.4%、约0.5%、约0.6%、约0.7%、约0.8%、约0.9%、约1%、约2%、约3%、约4%、约5%、约6%、约7%、约8%、约9%、约10%、约11%、约12%、约13%、约14%、约15%、约16%、约17%、约18%、约19%、约20%、约21%、约22%、约23%、约24%、约25%、约26%、约27%、约28%、约29%、约30%、约35%、约40%、约45%、约50%、约55%、约60%、约61%、约62%、约63%、约64%、约65%、约66%、约67%、约68%、约69%、约70%、约75%、约75%和约80%的渗透促进剂。在示例性实施方案中,本公开的制剂可以包含浓度为约1%至20%、约5%至25%、约10%至约20%、或约15%至约18%、约30%至约70%、约35%至约65%和约40%至约64%w/w的渗透或渗透促进剂。在本公开的示例性制剂中,渗透促进剂将占制剂的约1wt%至75wt%,优选2wt%至30wt%,更优选5wt%至20wt%。
[0111]
实例4
[0112]
本公开的透皮制剂和/或局部制剂可以单独或组合包含本领域技术人员已知的增塑剂,而不限于例如甘油及其酯、磷酸酯、二醇衍生物、糖醇、癸二酸酯、柠檬酸酯、酒石酸酯、己二酸酯、邻苯二甲酸酯、甘油三乙酸酯、油酸酯和“增塑剂手册”(george wypych,2004,化学技术出版社)一书中提及的所有可用于透皮药物输送系统的增塑剂。更优选地在0.01%-95%w/w或w/v的范围内。在示例性实施方案中,本公开的制剂可以包含浓度为制剂的约0.01%、约0.02%、约0.05%、约0.1%、约0.2%、约0.3%、约0.4%、约0.5%、约0.6%、约0.7%、约0.8%、约0.9%、约1%、约2%、约3%、约4%、约5%、约6%、约7%、约8%、约9%、约10%、约11%、约12%、约13%、约14%、约15%、约16%、约17%、约18%、约19%、约20%、约21%、约22%、约23%、约24%、约25%、约26%、约27%、约28%、约29%、约30%、约35%、约40%、约45%、约50%、约55%、约60%、约61%、约62%、约63%、约64%、约65%、约66%、约67%、约68%、约69%、约70%,约75%、约75%和约80%的增塑剂。在示例性实施方案中,本公开的制剂可以包含浓度为约1至20%、约5%至25%、约10%至约20%、或约15%至约18%、约30%至约70%、约35%至约65%和约40%至约64%w/w的增塑剂。在本公开的示例性制剂中,增塑剂将占制剂的约1wt%至75wt%,优选2wt%至30wt%,更优选5wt%至20wt%。
[0113]
实例5
[0114]
本公开的透皮制剂和/或局部制剂可以单独或组合地包含润肤剂、保湿剂、皮肤刺激减少剂和本领域技术人员已知的类似化合物或化学品,但不限于以下如凡士林、羊毛脂、矿物油、聚二甲基硅氧烷、氧化锌、甘油、丙二醇等。更优选地在0.01%-95%w/w或w/v的范围内。在示例性实施方案中,本公开的制剂可以包括制剂的浓度为约0.01%、约0.02%、约0.05%、约0.1%、约0.2%、约0.3%%、约0.4%、约0.5%、约0.6%、约0.7%、约0.8%、约0.9%、约1%、约2%、约3%、约4%、约5%、约6%、约7%、约8%、约9%、约10%、约11%、约12%、约13%、约14%、约15%、约16%、约17%、约18%、约19%、约20%、约21%、约22%、约23%、约24%、约25%、约26%、约27%、约28%、约29%,约30%、约35%、约40%、约45%、约50%、约55%、约60%、约61%、约62%、约63%、约64%、约65%、约66%、约67%、约68%、约69%、约70%、约75%、约75%和约80%的润肤剂、保湿剂、皮肤刺激减少剂和类似的化合物或化学品。在示例性实施方案中,本公开的制剂可包含浓度为约1%至20%、约5%至25%、约10%至约20%、或约15%至约18%、约30%至约70%、约35%至约65%和约40%至约64%
w/w的润肤剂、保湿剂、皮肤刺激减少剂和类似的化合物或化学品。在本公开的示例性制剂中,润肤剂、保湿剂、皮肤刺激减少剂和类似的化合物或化学品将占制剂的约1wt%至75wt%,优选2wt%至30wt%,更优选5wt%至20wt%。
[0115]
实例6
[0116]
本公开的透皮制剂和/或局部制剂可以单独或组合地包含增溶剂、表面活性剂、乳化剂、分散剂和本领域技术人员已知的类似化合物或化学品,而不限于以下如聚山梨醇酯(例如,)例如但不限于(聚山梨醇酯20、聚山梨醇酯40、聚山梨醇酯60、聚山梨醇酯80等)、司盘例如但不限于(司盘80、司盘20等)、表面活性剂例如(阴离子、阳离子、非离子型和两性)、丙二醇单辛酸酯i型、丙二醇单辛酸酯ii型、丙二醇二辛酸酯、中链甘油三酯、丙二醇单月桂酸酯ii型、亚油酰聚氧基-6甘油酯、油酰-聚氧基-6-甘油酯,月桂酰聚氧基-6-甘油酯、油酸乙酯、聚甘油-3-二油酸酯、二甘醇单乙醚、丙二醇单月桂酸酯i型、聚甘油-3-二油酸酯、辛基己酰聚氧基-8甘油酯等、环糊精、(辛基己酰基聚乙二醇甘油酯、辛基己酰基聚乙二醇-8甘油酯ep、辛基己酰基聚氧基-8甘油酯nf)等。更优选在0.01%95%w/w或w/v的范围内。在示例性实施方案中,本公开的制剂可包含浓度为制剂的约0.01%、约0.02%、约0.05%、约0.1%、约0.2%、约0.3%、约0.4%、约0.5%、约0.6%、约0.7%、约0.8%、约0.9%、约1%、约2%、约3%、约4%、约5%、约6%、约7%、约8%、约9%、约10%、约11%、约12%、约13%、约14%、约15%、约16%、约17%、约18%、约19%、约20%、约21%、约22%、约23%、约24%、约25%、约26%、约27%、约28%、约29%、约30%、约35%、约40%、约45%、约50%、约55%、约60%、约61%、约62%、约63%、约64%、约65%、约66%、约67%、约68%、约69%、约70%、约75%、约75%和约80%的增溶剂、表面活性剂、乳化剂、分散剂和类似化合物或化学品。在示例性实施方案中,本公开的制剂可以包含浓度为约1至20%、约5%至25%、约10%至约20%、或约15%至约18%、约30%至约70%、约35%至约65%和约40%至约64%w/w的增溶剂、表面活性剂、乳化剂、分散剂和类似化合物或化学品。在本公开的示例性制剂中,增溶剂、表面活性剂、乳化剂、分散剂和类似的化合物或化学品将占制剂的约1wt%至75wt%,优选2wt%至30wt%,更优选5wt%至20wt%。
[0117]
实例7
[0118]
不同的技术和成分可用于增加高纯度cbd在制剂中的稳定性和/或溶解度,例如但不限于包衣、包封、微包封、纳米包封、冷冻干燥、螯合剂、络合剂等。
[0119]
实例8
[0120]
本公开的透皮制剂和/或局部制剂可以单独或组合地包含辅助ph缓冲剂和ph稳定剂以及本领域技术人员已知的有助于保持制剂的适当ph在4.0-8.0范围内的类似化合物,不限于以下如磷酸盐缓冲液、乙酸盐缓冲液、柠檬酸盐缓冲液等,酸如但不限于(羧酸、无机酸、磺酸、乙烯基羧酸等)、碱例如但不限于(氢氧化钠、氢氧化钾、氢氧化铵、三乙胺、碳酸钠、碳酸氢钠)等。更优选在0.01%-30%w/w或w/v的范围内。在示例性实施方案中,本公开的制剂可包含制剂的浓度为约0.01%、约0.02%、约0.05%、约0.1%、约0.2%、约0.3%、约0.4%、约0.5%、约0.6%、约0.7%、约0.8%、约0.9%、约1%、约2%、约3%、约4%、约5%、约6%、约7%、约8%、约9%、约10%、约11%、约12%、约13%、约14%、约15%、约16%、约17%、约18%、约19%、约20%、约21%、约22%、约23%、约24%、约25%、约26%、约27%、约28%、约29%、约30%,约35%、约40%、约45%、约50%、约55%、约60%、约61%、约62%、约
63%、约64%、约65%、约66%、约67%、约68%、约69%、约70%、约75%、约75%和约80%的辅助ph缓冲剂和ph稳定剂和类似化合物。在示例性实施方案中,本公开的制剂可包含浓度为约1至20%、约5%至25%、约10%至约20%或约15%至约18%、约30%至约70%、约35%至约65%和约40%至约64%w/w的辅助ph缓冲剂和ph稳定剂和类似化合物。在本公开的示例性制剂中,辅助ph缓冲剂和ph稳定剂和类似化合物将占制剂的约1wt%至75wt%,优选2wt%至30wt%,更优选5wt%至20wt%。在某些实施方案中,制剂的ph保持在约4.0、约4.5、约5.0、约5.5、约6.0、约6.5、约7.0、约7.5或约8.0。在某些实施方案中,制剂的ph保持在约4.0至约8.0、约4.5至约7.5、或约5.0至约7.0的范围内。
[0121]
实例9
[0122]
本公开的透皮制剂和/或局部制剂可以包含抗氧化剂,例如但不限于(焦亚硫酸钠、柠檬酸、抗坏血酸、bha、bht)、氧化剂、稳定剂、脱色剂、防腐剂和本领域技术人员已知的类似化合物或化学品,有助于获得稳定制剂,其可以单独或组合地使用,但不限制与此。更优选在0.01%-50%w/w或w/v的范围内。在示例性实施方案中,本公开的制剂可包含制剂的浓度为约0.01%、约0.02%、约0.05%、约0.1%、约0.2%、约0.3%、约0.4%、约0.5%、约0.6%、约0.7%、约0.8%、约0.9%、约1%、约2%、约3%、约4%、约5%、约6%、约7%、约8%、约9%、约10%、约11%、约12%、约13%、约14%、约15%、约16%、约17%、约18%、约19%、约20%、约21%、约22%,约23%、约24%、约25%、约26%、约27%、约28%、约29%、约30%、约35%、约40%、约45%、约50%、约55%、约60%、约61%、约62%、约63%、约64%、约65%、约66%、约67%、约68%、约69%、约70%、约75%、约75%和约80%的抗氧化剂。在示例性实施方案中,本公开的制剂可以包含浓度为约1至20%、约5%至25%、约10%至约20%、或约15%至约18%、约30%至约70%、约35%至约65%和约40%至约64%w/w的抗氧化剂。在本公开的示例性制剂中,抗氧化剂将占制剂的约1wt%至75wt%,优选2wt%至30wt%,更优选5wt%至20wt%。
[0123]
实例10
[0124]
本公开的透皮制剂和/或局部制剂可以配制成本领域技术人员已知的软膏和/或乳膏基质。
[0125]
实例11
[0126]
以本领域技术人员已知的贴剂形式制造本公开的透皮递送系统的材料,例如但不限于储库型贴剂、基质贴剂、粘合剂中的药物、透皮膜,并且可以包括例如但不限于单独使用或组合使用的聚合物、共聚物、衍生物、背衬膜、释放膜、离型膜等。压敏粘着剂(例如但不限于有机硅聚合物、橡胶基粘合剂、丙烯酸聚合物、丙烯酸共聚物、聚异丁烯、丙烯酸-丙烯酸异辛酯共聚物、热熔粘合剂、聚丁烯等)、背衬膜(例如但不限于乙烯醋酸乙烯共聚物、醋酸乙烯树脂、聚氨酯、聚氯乙烯、金属箔、聚酯、镀铝膜、聚乙烯等)、释放膜(例如但不限于微孔聚乙烯膜、微孔聚丙烯膜、速率控制乙烯醋酸乙烯共聚物膜等等)、离型膜(例如但不限于硅化聚酯薄膜、氟聚合物涂层聚酯薄膜、聚酯薄膜、硅化聚对苯二甲酸乙二醇酯薄膜等)、胶带等。
[0127]
本公开的透皮制剂和/或局部制剂和/或透皮递送系统可以递送至少治疗有效剂量的高纯度cbd。治疗和/或预防疼痛和/或炎症所需的人血浆中单独或组合的治疗有效的高纯度cbd。高纯度cbd的有效治疗剂量是指治疗和/或预防疼痛和/或炎症所需的人血浆中
的治疗浓度。此外,本领域技术人员可以根据但不限于患者的病情等因素确定透皮制剂或局部制剂或透皮递送系统中高纯度cbd的精确有效治疗剂量。透皮制剂或局部制剂或透皮递送系统将提供不同的剂量强度和贴剂尺寸,以根据患者的要求实现最佳治疗效果。
[0128]
在又一个实施方案中,本公开的透皮制剂和/或局部制剂和/或透皮递送系统可以递送至少有效治疗剂量的高纯度cbd。有效治疗的高纯度cbd是指治疗和/或预防和/或控制患者癫痫症所需的高纯度cbd在人血浆中的治疗浓度,其中癫痫症疾病包括例如复杂部分性癫痫、简单部分性癫痫、继发性泛化的部分性癫痫、全身性癫痫(包括失神、大发作(强直阵挛)、癫痫持续状态、强直、失张力、肌阵挛)、新生儿和小儿痉挛、药物引起的癫痫发作、创伤引起的癫痫发作和热性惊厥,以及其他特定的癫痫综合征,如青少年肌阵挛性癫痫、林-戈综合征、dravet综合征、颞叶内侧癫痫、夜间额叶癫痫、进行性癫痫伴智力低下和进行性肌阵挛性癫痫,以及与cns肿块病变相关的癫痫发作。
[0129]
高纯度cbd的透皮制剂或透皮贴剂优选但不限于可以以下任何给药方案施用于皮肤表面,如一天一次、两天一次、三天一次、四天一次、五天一次,六天一次、一周一次、8到约13天一次、两周一次、十五天一次。
[0130]
实例12
[0131]
大麻二酚的理论通量计算:
[0132]
cbd的口服生物利用度仅为13-19%。出于我们的计算目的,trpl采用15%2的平均生物利用度。因此,表3中描述了口服给药时向患者递送的实际剂量
[0133]
表3:透皮剂型所需的理论剂量
[0134][0135]
所需通量=剂量/表面积
[0136]
ꢀꢀꢀꢀꢀꢀꢀꢀ
=9mg/天/表面积
[0137]
ꢀꢀꢀꢀꢀꢀꢀꢀ
=9000ug/24小时/50平方厘米
[0138]
ꢀꢀꢀꢀꢀꢀꢀꢀ
=7.5ug/平方厘米/小时
[0139]
因此,具有7.5微克/平方厘米/小时的通量的50平方厘米贴剂将在一天内递送9毫克药物。100平方厘米的贴剂将递送具有相同通量分布的18毫克药物。一些研究文章显示cbd的口服生物利用度在5-6%的范围内
2,8
。
[0140]
实例13
[0141]
用于透皮递送的合成大麻二酚(cbd)制剂((制剂编号001、002、003、004和005)通过混合如表4中所示的成分制备:
[0142]
表4:透皮合成大麻二酚制剂
[0143][0144]
缩写:pg=丙二醇;cbd=大麻二酚;peg-400:聚乙二醇-400。
[0145]
除cbd外,表2中的所有组分在搅拌下混合在一起18小时。接下来,将cbd添加到赋形剂混合物中以制备最终的透皮制剂。
[0146]
然后对制备的透皮制剂进行如下通量测量测试。在-80℃下储存的人类尸体皮肤在室温下在磷酸盐缓冲盐水(pbs)中解冻,并在用于研究之前目视检查是否存在缺陷。然后使用标准franz扩散池测量透皮通量,该扩散池由圆柱形供体隔室和单独的水夹套圆柱形受体隔室组成,体积为13毫升。人尸体皮肤夹在两个隔室之间,真皮侧朝向受体隔室。供体隔室填充有如上所述制备的透皮cbd制剂。受体隔室充满受体介质,保持在恒定温度,并不断搅拌以收集cbd,因为它通过皮肤扩散并进入受体隔室。确认受体流体始终与皮肤接触很重要。受体隔室每隔24小时清空一次,用于测定cbd并用新鲜的受体溶液代替。为了维持受体隔室的漏槽条件,重要的是保持受体隔室中的cbd浓度低于其溶解度的10%。实验条件见表3:
[0147]
[0148]
在至少为96小时(4天)的时间内测量通过人体尸体皮肤的cbd通量,通量测量结果见表4。
[0149]
表6cbd通量结果
[0150][0151]
实例14
[0152]
用于透皮递送的其他合成大麻二酚(cbd)制剂(制剂编号006至014)通过混合如表7中所示的成分制备:
[0153]
表7:透皮合成大麻二酚制剂编号006到014
[0154][0155]
缩写:cbd=大麻二酚;pgml:丙二醇单月桂酸酯;pg=丙二醇;oa=油醇;ml=月桂酸甲酯;eo=油酸乙酯;ipm=肉豆蔻酸异丙酯;ipp:棕榈酸异丙酯
[0156]
用于透皮递送的合成大麻二酚制剂(006-014)通过与实例2中所述相同的方法制备。通量测量也如实例2中所述进行。实验条件与实例2的表5中提供的相同。
[0157]
通过人体尸体皮肤的cbd通量测量至少48小时,通量测量实验的结果在表8中提供。
[0158]
表8cbd通量结果
[0159][0160]
实例15
[0161]
通过混合如表9中所示的成分制备用于透皮给药贴剂(制剂编号015至018)的其他合成大麻二酚(cbd)制剂:
[0162]
表9:透皮合成大麻二酚制剂编号015至018
[0163][0164]
为了制备含有合成大麻二酚的透皮贴剂,将表9中的所有成分(cbd除外)混合在一起并搅拌18小时。接下来,在铺展制剂前30分钟添加cbd。使用商业台式撒布机将制剂铺展。具体来说,将制剂基质均匀地铺展到8x14英寸的离型膜(例如3m 9744)片材上,至厚度为0.5mm。然后将该片材置于100
°
f的烘箱中一小时以蒸发掉乙酸乙酯和乙醇粘合剂溶剂。然后用手小心地将用于抑制光降解和氧化降解的具有低透氧性的不透明背膜(例如3m 9730nr膜)施加在片材上,以避免形成气泡和空隙。圆形模具(直径1.5英寸)用于切割贴剂(7cm2)以供后续研究。
[0165]
上述实施例中透皮制剂通量测量的一般方法如下。将保存在-80℃的人体尸体皮肤在室温下在pbs中解冻,并在使用前目视检查是否有缺陷。使用由圆柱形供体隔室和单独的水夹套圆柱形受体隔室组成的标准franz扩散池测量透皮通量,体积为13ml。人体尸体皮肤夹在两个隔室之间,真皮侧朝向受体隔室。透皮粘合贴剂通量测量的一般方法如下。离型膜从贴剂上剥离,并将粘合表面施加到一块人尸体皮肤上(仅实施例15,表9)。将透皮贴剂
粘附到皮肤上,其中贴剂位于与供体隔室接触的皮肤的一侧。受体隔室充满受体介质,保持在恒定温度,并不断搅拌以收集cbd,因为它从粘附的贴剂扩散,通过皮肤并进入受体隔室。已确认受体流体始终与皮肤接触。受体隔室每隔24小时清空一次,用于cbd的测定,并用新鲜的受体溶液代替。为了维持受体隔室中的漏槽条件,受体隔室中的cbd浓度保持在其溶解度的10%以下。实验条件与实施例13的表5中提供的相同。
[0166]
参考文献:
[0167]
1.www.accessdata.fda.gov/drugsatfda docs/label/2018/2103651bl.pdf
[0168]
2.doi.org/10.1002/cpdd.408
[0169]
3.devinsky et.al.,“randomized dose-ranging safety trial of cannabidiol in dravet syndrome”,neurology,90(14),2018
[0170]
4.www.nchi.nlm.nih.gov/pmc/articles/pmc3763649/
[0171]
尽管已经参考其具体实例详细描述了本公开,但是对于本领域技术人员显而易见的是,在不背离其精神和范围的情况下可以对其进行各种改变和修改。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。