1.本发明涉及一种计算机实施的用于自动分析在解剖结构的医学图像上执行的测量中的用户特定偏差的方法、计算机程序以及被配置成执行该方法的自动测量工具。
背景技术:
2.医学超声测量被用于广泛的医学治疗领域。例如,超声心动图测量通常作为一种间接方法来评估人类或动物的解剖结构的尺寸和功能,特别是人类的心脏。然而,测量结果会受到观察者之间和观察者内部差异的影响。布兰德-阿尔曼分析是现有技术中使用的常用方法,用于确定两个不同观察者(如用户或医师)之间的差异性和偏差。出于认证的目的,执行测量的实验室(特别是超声心动图实验室)必须经过一个标准化程序,以符合质量准则。此外,这种认证还包括:解释性质量审查(医生解释差异性)。机构必须基于获得的图像来评估解释的质量和准确性。每季度每种模态至少有两个案例必须针对所获得的图像的解释质量和准确性进行评估。这些案例必须代表尽可能多的医师。解释中的差异必须被调和,以达到统一的检查解释。在日常临床工作中,这将转化为额外的人工和组织工作负荷。如果是长期的临床研究,情况更为糟糕,因为在研究的实现过程中,测量观察者经常会改变。因此,存在着观察者之间的差异性和共识培训的问题。
3.因此,期望能有一个独立的检测和测量系统,其具有标准化的性能和统一的偏差,从而简化对质量准则的遵守,并可用于校准和/或使不同用户的测量结果标准化。
4.christian knackstedt在“fully automated versus standard tracking of left ventricular ejection fractio(左心室射血分数的全自动化与标准追踪)”(journal of the american college of cardiology;vol.66,no.13,2015)中对人做出的测量结果与机器做出的测量结果进行了比较,其中评估了左心室容积和纵向应变测量。
5.us 2018150598 a1公开了将使用机器学习获得的解剖结构测量结果与预定阈值进行比较,并产生咨询信息以调整测量结果。
6.vikram chalana在“a methodology for evaluation of boundary detection algorithms on medical images(医学图像上边界检测算法的评估方法)”(ieee transactions on medical imaging,vol.16,no.5,october 1997)中对轮廓的差异进行了比较。也就是说,它将计算机生成的边界与多个观察者创建的边界进行比较,并计算出两个观察者之间一致性的cohen kappa系数。
7.us 2014341449 a1公开了通过使用机器学习生成的共识轮廓验证一致性,以减少观察者之间和观察者内部在轮廓图像上的变化性。此外,根据us 2014341449a1,对用户创建的轮廓与共识轮廓的偏差程度进行了评估。
8.harold l.kunde在“measurement of observer agreement(观察者一致性的测量)”(radiology 2003;228:303-308)中公开了利用cohen kappa测量两个审阅者之间的一致性的统计学措施,该措施被用于测量绝对答案(正与负)。
9.在匿名文章“man against machine:ai is better than dermatologists at diagnosing skin cancer(人对抗机器:ai在诊断皮肤癌方面比皮肤科医生更好)”中描述了一项研究,其中审查了皮肤科医生和人工智能的表现。作为人工智能,卷积神经网络被实施。因此,人类皮肤的多个部分被评估,以通过皮肤科医生和人工智能确定病变是恶性的还是非恶性的。将皮肤科医生和人工智能的结果与正确的结果进行比较。结果发现,与皮肤科医生相比,人工智能漏掉的黑色素瘤更少,将良性痣误诊为恶性的情况更少。
10.如上所概述的,超声心动图测量是评估人类心脏的尺寸和功能的间接方法的一个示例。在两个观察者的测量之间(观察者之间)或者甚至同一观察者的两个测量实例之间(观察者内部),其结果必然会有变化。分析变化性(即两个观察者之间差值的误差范围,或95%的置信区间)和偏差(即系统误差,或两个观察者之间的平均差值)的常用方法是布兰德-阿尔曼分析法。布兰德-阿尔曼方法可用于评估两个系列的测量值之间的一致性。特别是,它提供了关于测量值的高度对偏差/差值大小的影响的信息。为此,在散布图(布兰德-阿尔曼图)中,差值(测量差值)被表示为平均数(测量值高度)的函数。
11.除了带有置信区间的回归线外,通常还显示零线(差值=0)以及平均差值(也带有置信区间),有时还显示一致性的限值。这些信息可用于评估冗余尺寸的程度。
技术实现要素:
12.因此,本发明的目的是提供一种计算机实施的用于自动分析在解剖结构的医学图像上执行的测量中的偏差的方法,在这种方法中,质量指南得到满足,同时减轻了人工和组织的工作负荷。本发明的另一目的是提供一种相应的计算机程序,以及用于执行该方法的自动测量工具。
13.为了更好地解决上述确定的一个或多个问题,在本发明的第一方面中,权利要求1中给出了一种计算机实施的用于自动分析在解剖结构的医学图像上执行的测量中的偏差的方法。在从属权利要求中列出了有用的实施例。
14.根据该第一方面,一种计算机实施的用于自动分析在解剖结构的医学图像上执行的测量中的偏差的方法包括以下步骤:
15.接收多个医学图像,其中多个医学图像至少包括第一批多个医学图像和第二批多个医学图像,并且每批多个医学图像包括相同或不同患者的相同解剖结构,
16.针对第一批多个医学图像,接收解剖结构的特征的第一测量数据,其中第一测量数据是由第一用户获得,
17.针对第一批多个医学图像,通过自动测量工具确定解剖结构的特征的第一基线测量数据,
18.基于第一测量数据和第一基线测量数据,确定第一用户的第一测量偏差,
19.针对第二批多个医学图像,接收解剖结构的特征的第二测量数据,其中第二测量数据由第二用户获得,第二用户与第一用户不同,
20.针对第二批多个医学图像,通过自动测量工具确定解剖结构的特征的第二基线测量数据,
21.基于第二测量数据和第二基线测量数据确定第二用户的第二测量偏差,以及
22.将第一测量偏差与第二测量偏差进行比较。
23.因此,在一个实施例中,本发明提供了一种方法,其中相同的医学图像由人类用户和自动测量工具进行分析,并将结果相互比较,以获得人类用户的测量偏差。因此,两个不同的测量实例或观察者(人类和机器)可用于相同的医学图像,并在它们之间确定偏差。然后,该偏差可用于估计不同人类之间的偏差,如第一用户和第二用户。
24.一般来说,偏差可以衡量测量数据与被估计的真正的基本定量参数有多大的差异。例如,如果测量值被按照与被估计的群体参数在系统上不同的方式来确定,则这个测量值是有偏差的。此外,偏差可以是差异度量(即偏差度量)或误差范围,换句话说,系统误差或两个用户(即观察者)之间的平均差值。
25.尤其是,系统误差可能在实验过程中变化(即漂移)。也就是说,测量结果可能指示出随时间变化的趋势,而不是围绕一个平均值随机变化。如果一个恒定量的测量被重复多次,并且测量结果在实验过程中发生了单向漂移,那么漂移就很明显。如果下一次的测量值比上一次的测量值高,例如在实验过程中仪器变热可能会出现这种情况,那么被测量的量是可变的,且通过检查实验过程中和实验开始时的零点读数就有可能检测出漂移。另一方面,在一系列重复测量中没有模式的情况下,只有通过测量已知的量或通过将读数(即测量结果)与使用不同设备做出的读数进行比较,才能发现固定的系统误差的存在,该不同设备已知更加稳定(即提供没有漂移的测量结果)。具体来说,本发明在后一种情况下特别有用。也就是说,根据本发明,基线测量数据(将在下文中描述)是由自动测量工具(可被视为所述的不同设备)获得的。此外,自动测量工具也可被称为基线机器。换句话说,本发明提供了一种校准/标准化工具,其中给定用户的测量偏差可与所述用户在对包括在多个医学图像中的解剖结构做预定测量时产生的系统(和主观)差值相关联。
26.一般来说,第一测量偏差和第二测量偏差可以是绝对测量偏差或相对测量偏差。更详细地说,第一用户的第一绝对测量偏差和第二用户的第二绝对测量偏差优选地是通过计算第一测量数据/第二测量数据和第一基线测量数据/第二基线测量数据之间的差值来确定的,即通过从一个减去另一个。另一方面,相对测量偏差可以通过相对于测量数据(即相对于测量种类)的标准化来定义。换句话说,相对测量偏差可以基于测量数据和基线测量数据的相对差值而不是测量数据和基线测量数据的差值来确定(即与绝对测量偏差相比)。具体来说,相对测量偏差可以通过以下公式确定:
[0027][0028]
其中,b
x,rel
代表相对测量偏差,
[0029]
rx代表测量数据,
[0030]
cx代表基线测量数据。
[0031]
因此,绝对偏差可与它所基于的测量数据的数据和/或物理特性有函数关系。具体来说,绝对偏差可与用于创建医学图像的模态的特性、用于创建测量数据的测量工具的特性、测量期间和/或创建医学图像期间的情况和/或测量数据的绝对值有函数关系。因此,绝对测量偏差可能不容易与基于不同的测量数据(例如,基于包括解剖结构的不同特征的测量数据)获得的其他绝对测量偏差进行比较。相对偏差可以独立于这种函数关系。因此,相对测量偏差可以与基于不同测量数据的其他相对测量偏差进行比较。
[0032]
因此,根据本发明的另一实施例,对于测量偏差,可以确定测量数据和基线测量数据之间的相对差值。也就是说,通过确定测量数据和基线测量数据之间的相对差值,可以确定相对偏差(例如如上所概述的)。相对偏差在以下情况中特别有用:如果测量的是相对较小的尺寸(例如心脏隔膜的厚度),与基线测量数据有10%的偏差会导致相对较小的绝对偏差。另一方面,如果测量的是相对较大的尺寸(例如心脏左心室的直径),10%的偏差会导致相对较高的绝对偏差。因此,尽管两个测量值有相同的百分比偏差,但每个测量值的绝对偏差是不同的。因此,为了补救绝对偏差的这种偏差,可以确定相对偏差。因此,相对测量偏差可以相互比较,而不依赖于测量偏差所基于的测量数据。换句话说,例如,与被测量的解剖结构的特征无关。
[0033]
在下面的描述中,为了方便解释,绝对偏差和相对偏差被简称为偏差。然而,术语“偏差”总是指绝对偏差和相对偏差两者。
[0034]
此外,可以确定每个用户的偏差。每个用户的偏差可以用特定用户的所有测量偏差的平均值来表示。
[0035]
医学图像可由任何医学成像模态产生,如超声,尤其是超声心动图,或mri(磁共振成像)、x射线成像、ct(计算机断层成像)、pet(正电子发射断层成像)等。当使用超声时,图像也可以通过彩色多普勒、组织多普勒、连续波多普勒、脉冲波多普勒或m-模式获得,即有多种获取模式,可作为手动或自动测量的基础。医学图像可以是二维图像或三维图像。医学图像(或一组医学图像)可以是构成4d图像的2d或3d图像序列中的一帧或几帧或全部,其中时间是第四维。
[0036]
解剖结构可以是人类或动物身体的任何解剖结构,如肢体、器官或血管,例如心脏、肝脏或胎儿。相同的结构是指,如果第一批多个医学图像包括心脏作为解剖结构,则第二批多个医学图像也包括心脏作为解剖结构。
[0037]
医学图像可以来自同一个患者或不同的患者,也就是说,医学图像也可以来自同一个患者,但在不同的时间点。此外,用于获得医学图像的方法或模态可以从一个图像到另一个图像不同。例如,第一批多个医学图像可以使用超声心动图系统获得,其中,例如,第二批多个医学图像可以使用mr系统获得。此外,第一批多个医学图像和第二批多个医学图像不必在同一地点接收。也就是说,本发明的方法可以部分地在不同地点执行,即分布在几个地点。优选的是,只有比较第一测量偏差和第二测量偏差的步骤可以是集中的(即可以在一个地点执行),而其他前面的方法步骤可以在其他地方执行。具体而言,针对第一批多个医学图像接收解剖结构的特征的第一测量数据,其中第一测量数据由第一用户获得;针对第一批多个医学图像通过自动测量工具确定解剖结构的特征的第一基线测量数据;以及基于第一测量数据和第一基线测量数据确定第一用户的第一测量偏差的方法步骤可以在一个地方执行。类似地,与第二批多个医学图像相关的相应方法步骤可以在不同的地点执行。因此,只有第一测量偏差和第二测量偏差必须被传送以进行相互比较。换句话说,第一医学图像可以在欧洲的核心实验室接收和处理(即接收第一测量数据和确定第一基线测量数据),而第二医学图像可以在美国的核心实验室接收和处理(即接收第二测量数据和确定第二基线测量数据)。此外,第一测量偏差和第二测量偏差的比较可以在不同的地点或在上述任何地点进行。也就是说,只有第一测量偏差和第二测量偏差可能必须被传送以对其进行比较。例如,传输可以通过互联网执行。
[0038]
当然,本发明可以扩展到第三批多个医学图像和更多批的医学图像,以及相关的第三和更多的测量数据和基线测量数据,以确定第三和更多的用户的第三和更多的测量偏差。
[0039]
测量数据代表要分析的解剖结构的物理参数,例如尺度,尤其是长度、面积或体积。它也可以是流速、时间段或其他可以从医学图像中测量的物理参数。更详细地说,测量数据可以包括心脏瓣膜的直径和/或周长,如二尖瓣和/或主动脉瓣。测量数据可以由至少一个用户手动采集。更详细地说,例如,测量数据可以由用户通过追踪医学图像中的结构来获得。此外,测量数据可由用户通过在三维数据集中绘制三维自由手线来附加地或替代性地生成。此外,测量数据可以包括解剖结构的轮廓。
[0040]
医学图像的获取可以由同一个用户执行,他也将进行(手动)测量以获得测量数据。检查也可以由其他临床人员进行,就像通常在mr检查中的情况一样。
[0041]
在一个实施例中,每批多个医学图像包括一组或几组医学图像,其中每组医学图像是在一个患者的一个检查期间获得的。优选地,从每组医学图像中获得解剖结构的特征的一个测量数据和解剖结构的特征的一个基线测量数据,并且优选地每批多个医学图像包括几组。通常情况下,每批多个医学图像将因此包括来自多个患者的多组医学图像。然而,多个医学图像也可以包括在同一患者的不同检查期间获得的两组或更多组医学图像,如纵向研究中的情况一样。例如,一组医学图像可以包括在一次检查期间从患者的心脏获得的所有超声图像,从而包括从不同观察角度和利用不同视场获得的一些二维和/或三维图像。
[0042]
用户可以是任何在医学图像分析领域工作的人,如医生、护士、测量实验室的雇员等等。第一用户和第二用户通常是不同的人。可能的是,第一用户和第二用户可以是同一个人,其在不同的时间或用不同的测量技术创建测量数据。
[0043]
在一个实施例中,解剖结构的特征的第一(第二)测量数据是由第一(第二)用户对第一批(第二批)多个图像中的一个或几个进行手动测量而创建的,例如通过测量物理参数,如长度或面积。这种测量通常是手动进行的,即需要用户干预,但借助于计算机,例如,用户点击在计算机屏幕上显示的医学图像中的特定地标,而地标之间的距离则由计算机自动计算出。一般来说,测量数据可以使用需要用户干预的计算机实施的测量技术获得,例如,使得用户对测量数据的正确性负责。
[0044]
接收可能意味着实时接收测量数据,即在获得测量数据后直接接收。替代性地,测量数据可以从存储装置中接收,也就是说,以前生成和存储的测量数据可以在事后分析。因此,过去进行的较早的研究,可以用本发明的方法进行新的分析,从而进一步处理。此外,测量数据可由自动测量工具接收。此外,第一测量数据可由第一自动测量工具接收,第二测量数据可由第二自动测量工具接收,其中,第一自动测量工具和第二自动测量工具可以是分离的工具。
[0045]
解剖结构的特征的第一基线测量数据和第二基线测量数据由自动测量工具自动获得,即无需用户干预。可选择的是,用户可以选择一个特定的医学图像,在该图像上进行基线测量,例如,从一个检查期间获得的一组医学图像中选择一个医学图像。优选的是,基线测量数据是通过计算机实施的算法获得的。这种算法可以是经典的算法,例如使用诸如特征跟踪、分割技术(例如阈值处理、区域增长、像素直方图分析等)的算法。替代性地,它可以是机器学习算法,尤其是基于深度学习技术的算法,包括一个或几个人工神经网络。这种
人工神经网络可以关于来自参考数据库的图像和由专家用户获得(可选地,由第二用户验证,以尽量减少任何误差)的测量数据进行训练。
[0046]
基线测量数据是通过自动测量工具确定的,它可以包括所有的标准测量,这些测量通常在解剖结构上进行。此外,自动测量工具可以通过包括基于参考数据库的规则的算法(包括在自动测量工具中)确定基线测量数据。更详细地说,参考数据库可由至少一位专家(人类)创建,并且该算法可被配置成在相对于所述参考数据库无偏差和/或具有恒定偏差的情况下测量。此外,自动测量工具的结果是可再现的,也就是说,在相同的测量数据可用的情况下,通过自动测量工具获得相同的结果(即基线测量数据)。如上所述关于接收测量数据的步骤,第一基线测量数据和第二基线测量数据可由第一自动测量工具和第二自动测量工具确定。
[0047]
自动测量工具可以在当前执行的应用程序的背景下运行,以便确定对用户来说隐藏的基线测量数据。也就是说,用户不一定注意到当前正在确定基线测量数据。自动测量工具优选地在其结果中是一致的,也就是说,对于相同的图像或图像序列(输入),它产生相同的结果(输出)。尤其是,标准测量可以包括对特定解剖结构进行的所有重要测量。在解剖结构是心脏的情况下,例如,重要的测量包括心脏瓣膜的直径、心室的轮廓的测量。例如,自动测量工具可以连接到诊所或实验室的pacs(图片存档和通信系统)。因此,自动测量工具可以考虑在这种pacs中引入的所有医学图像。因此,多个测量偏差可由自动化测量工具自动确定。此外,自动测量工具可以被包括在用于创建医学图像和/或用于执行医学图像的测量的模态中。更详细地说,测量偏差可以直接在相应的模态中确定(即在原地)。因此,为了将其与另外的测量偏差进行比较,可能只需要传输测量偏差。此外,甚至是将两个测量偏差相互比较的步骤也可以在模态内执行,并且这种比较的结果可以被输出。
[0048]
在接收到由第一用户测量的解剖结构的几个测量数据(如左心室的直径)的情况下,可由自动测量工具针对每个测量数据确定基线测量数据。然后可以确定每个测量数据与基线测量数据之间的差值,因此每个测量数据都有基线测量数据。然后,第一测量偏差可被确定为针对第一用户的每个基线测量数据的平均数或平均值。因此,第一测量偏差可以表示与获得的基线测量数据相比由第一用户执行的测量之间的系统差值。同样适用于第二测量偏差。
[0049]
最后,将第一测量偏差与第二测量偏差进行比较,例如通过从一个减去另一个,或简单地审查每个用户的测量偏差。本发明的方法可以扩展到更多的用户,例如通过对第三、第四和更多的用户重复这些步骤。
[0050]
在纵向研究和多中心研究的情况下,偏差比较结果可用于对用户之间测量值进行标准化/校准。
[0051]
根据本发明的上述实施例,可以对两个或更多个观察者(甚至对不同的患者)执行自动分析。通过对每个用户(更详细地说,每个用户的测量数据)与自动测量工具进行偏差比较,可以针对所有患者计算出两个用户之间的平均偏差。这一结果可用于向进行常规临床操作和/或临床长期研究的所有参与的医师(用户)反馈,而不需要测量相同的研究。为了这一功能,用户测量的医学图像可用于使用自动测量工具进行分析,以尽量减少用户和自动测量工具之间的误差源。在临床长期研究的情况下(纵向和多中心研究两者),偏差比较结果可用于对处于临床研究情景中的观察者之间的测量值进行标准化。通过在所有可用的
视图上应用测量值,可产生比人工情况下更多的测量值,从而导致更稳定的系统,且分析中的统计噪音更少。因此,可以确保减轻人工和组织的工作负荷,以保证高质量。使用上述方法,用户的测量结果可以被标准化和/或校准。该方法适用于全世界,也就是说,它没有被限于本体。此外,不同的用户不一定要在同一地点。因此,该方法在其应用中提供了更大的灵活性。
[0052]
根据本发明的另一实施例,该方法还可包括以下步骤:确定由所有可用的测量偏差的平均值表示的全局偏差,并将全局偏差与测量偏差中的一个进行比较。
[0053]
全局偏差可以通过将本地确定的测量偏差传送到集中式机构来获得。在集中式机构处,全局偏差可以通过计算所有本地确定的测量偏差的平均值或均值来确定。例如,测量偏差可以从pacs和/或包括自动测量工具的模态传送到集中式机构。此外,为了确定全局偏差,可以使用已经是多个偏差的平均值的偏差。此外,自动测量工具可以对所有人类观察者(即所有用户)有系统性偏差。通过确定全局偏差,可以确定这种系统性偏差。此外,每个用户可以将他/她自己的偏差与全局偏差进行比较,以评估他自己的偏差。此外,可以确定针对解剖结构的具体测量的标准值(例如在一些指南中公布的)的测量偏差,并与全局偏差进行比较。此外,用户可以将他/她自己的偏差与全局偏差进行比较。最后,用户可以比较这两个比较结果,以便相对于标准值评估他自己/她自己。因此,每个用户可以验证他自己/她自己。
[0054]
根据本发明的另一优选实施例,第一测量数据可基于第一批多个医学图像中的一个特定医学图像来确定,而第一基线测量数据可基于相同特定医学图像来确定。此外,第二测量数据可基于第二批多个医学图像中的一个特定医学图像来确定,而第二基线测量数据可基于相同特定医学图像来确定。
[0055]
一般来说,为了获得测量数据而对解剖结构进行测量的用户可以选择特定图像(即解剖结构的特定视图),该特定图像保证在一组医学图像中的最准确的测量。此外,所选择的图像可随后被用来进行测量。为了尽量减少人(即用户)和机器(即自动测量工具)之间的误差源,用户选择的图像也可用于由自动测量工具进行分析。据此,过程效率较高,且需要较少的计算资源和时间。然而,多个或每组医学图像的所有可用图像都可以由自动测量工具进行分析。因此,可产生比人工情况下更多的测量结果,从而导致更稳定的系统,且分析中的统计噪音更少。
[0056]
在一个实施例中,每个测量数据和基线测量数据都是基于在患者的一个检查期间获得的每组医学图像中的相同特定医学图像来确定的。
[0057]
根据本发明的一优选实施例,一旦新的测量数据可用,就可以持续地更新测量偏差,其中所有可用的测量数据被用来更新测量偏差,或者在预先确定的过去时间段期间获得的所有可用的测量数据被用来更新测量偏差。
[0058]
换句话说,更新可指基于新的可用测量数据来新确定偏差。此外,连续可指测量偏差经常被更新。此外,更新可指旧的测量偏差被新确定的测量偏差所取代。该更新程序可以自动执行,而不需要用户的任何具体动作。此外,更新可以被执行,使得用户不会注意到有更新正在进行。更新可以通过计算新的平均值来执行,其包括新的基线测量数据和测量数据之间的新差值。一旦新的测量数据是可用的,更新就尽可能频繁地进行。在某些情况下,当方法步骤在不同地点执行时,由于没有用于传输新确定的测量偏差或测量数据的连接,
在更新测量偏差方面可能会有延迟。然后,如果新确定的测量偏差或测量数据可以被传输,则可以进行更新。
[0059]
在一个实施例中,每个用户的测量偏差可以基于在预先确定的过去时间段期间获得的测量数据,例如过去1至3个月。因此,较旧的测量数据不再有贡献。相反,在任何时间点上,用户的测量偏差代表他在预定的过去时间段内进行的所有测量的平均偏差。也就是说,测量偏差可以基于在预先确定的时间段内创建的测量数据进行更新,以便使用所述时间段内测量偏差的移动平均值来更新测量偏差。替代性地,通过更新测量偏差考虑所有可用的测量数据。也就是说,除了所有旧的测量偏差/测量数据之外,还可以考虑新获得的测量数据(以及因此新确定的测量偏差)。
[0060]
根据上述实施例,测量偏差可以自动适应新的情况,即适应用户增加/减少的测量准确度(例如,在用户已经参加培训后)。
[0061]
根据本发明的另一优选实施例,该方法还可包括确定全机构的偏差的步骤,该全机构的偏差由属于一个预定群组或机构的第一、第二和更多的用户的所有测量偏差的平均值表示。
[0062]
换句话说,全机构的偏差可以是属于所述机构的用户的所有测量偏差的平均值,其中该机构可以是核心实验室、诊所、研究小组等。然而,全机构的偏差可以是由预定数量的用户组成的用户群组的平均偏差。平均值可以是所有数值的总和除以数值的数量。
[0063]
因此,可以容易地客观地评估工作群组的偏差,而不需要评估每个用户的每个独立偏差。此外,不同的群组或机构可容易地相互比较。
[0064]
根据本发明的一优选实施例,该方法还可包括将全机构的偏差与测量偏差中的一个进行比较的步骤,以便获得相对于全机构的偏差的每个用户的偏差。
[0065]
换句话说,每个用户的偏差可以是用户的个人偏差。此外,全机构的偏差可以与上文所概述的相同。因此,每个用户可以相对于属于该机构的所有用户的测量偏差的平均值进行评估。此外,评估的便利之处在于,可以容易地获得哪个用户改善了全机构的偏差,哪个用户降低了全机构的偏差。
[0066]
根据本发明的一优选实施例,将全机构的偏差与测量偏差中的一个进行比较的步骤可以包括:通过用全机构的偏差减去每个测量偏差来确定差值,以便确定属于同一群组或机构的每个用户的差值,并确定在所有用户中具有最高差值的一个用户或多个用户。
[0067]
换句话说,计算出额外的值(即差值),其代表全机构的偏差的平均值和单个的每个用户的测量偏差之间的差值。因此,利于确定哪个用户必须改善他/她的测量准确度。此外,上述实施例允许创建关于哪个用户需要提高他/她的准确度的议程,以便将全机构的偏差改进到预定的水平。
[0068]
根据本发明的另一实施例,至少第一基线测量数据和第二基线测量数据的确定可以在不同的地点进行。换句话说,例如,测量数据可以在获得或接收测量数据的同一地点进行进一步处理(包括基线测量数据的确定和测量偏差的确定)。也就是说,自动测量工具可以存在于获得或接收测量数据的相应地点,以便在本地确定基线测量数据。此外,测量偏差也可以在获得或接收测量数据的同一地点在本地确定。因此,只有基线测量数据和/或测量偏差需要被传送以便进一步处理。
[0069]
根据另一优选实施例,自动测量工具可以使用人工智能来确定基线测量。也就是
cardiac chamber quantification by echocardiography in adults:an update from the american society of echocardiography and the european association of cardiovascular imaging(成人超声心动图的心腔定量建议:美国超声心动图学会和欧洲心血管成像协会的更新)”以及由nagueh等人于2016年4月发表在《美国超声心动图学会杂志》的“recommendations for the evaluation of left ventricular diastolic function by echocardiography:an update from the american society of echocardiography and the european association of cardiovascular imaging(超声心动图对左心室舒张功能的评价建议:美国超声心动图学会和欧洲心血管成像协会的更新)”中示出,上述所有引用文献均通过引用的方式并入本文。此外,测量数据可包括胎儿的尺寸,如冠-臀-长、颈部透明膜、双顶径、股骨长、肱骨长、头围、腹围中的至少一种。此外,测量数据可包括多普勒血流剖面图、心脏瓣膜直径和/或心室尺寸。
[0076]
根据本发明的另一优选实施例,对于测量偏差,可以确定新的测量偏差和旧的测量偏差,其中新的测量偏差可以在确定旧的测量偏差后已经经过预定的时间段时确定,或者新的测量偏差可以在确定旧的测量偏差后预定数量的新的测量数据是可用的时确定,其中新的测量偏差可以与旧的测量偏差进行比较,以便得到测量偏差中的漂移。
[0077]
换句话说,旧的测量偏差可以是在新的测量偏差之前确定的测量偏差。此外,两个测量偏差可以相互比较,其中每个测量偏差可以与另一个测量偏差相隔预定的时间段(例如1至3个月)或预定数量的测量数据(如10至100个测量数据,优选地20至50个),这些数据是自前一个测量偏差被确定后获得的。因此,可以进行趋势分析,以便确定测量偏差以何种方式从旧的测量偏差变化到新的测量偏差。因此,可以识别与先前定义的共识有关的漂移。也就是说,共识可以在确定旧的测量偏差的同时被定义(例如,在数据收集开始时)。这种知识对于核心实验室和长期研究可能特别受关注。
[0078]
根据另一个方面,本发明提供了包括程序代码指令的计算机程序,该程序代码指令由处理器执行时,程序代码指令使处理器能够执行本发明的方法。计算机程序可以是任何代码,尤其是适合计算机视觉应用的代码,尤其是用于医学图像中解剖结构的特征的测量目的的代码。具体来说,计算机视觉(也被称为机器视觉)是一种用于提供基于成像的自动检查和分析的技术。因此,这种技术特别适用于自动测量工具中的使用。
[0079]
在另一方面,本发明涉及一种计算机可读介质,其包括上述定义的计算机程序。计算机可读介质可以是任何数字数据存储装置,如u盘、硬盘、cd-rom、sd卡或ssd卡。当然,计算机程序不需要存储在这样的计算机可读介质上提供给消费者,而是可以通过互联网下载。
[0080]
根据另一个面,本发明涉及一种自动测量工具,其被配置成执行根据上文概述的方法,其中自动测量工具包括接口,该接口被配置成接收由成像系统生成的医学图像并输出通过执行本发明方法确定的结果。结合本发明方法描述的任何特征或有用的实施例也适用于自动测量工具。此外,自动测量工具可包括在用于获得医学图像的成像模态中,或包括在用于基于医学图像创建测量数据的测量装置中。尤其是,测量数据可以被传输到自动测量工具的接口,作为自动测量工具的输入。传输可通过线缆、近场连接、wi-fi、w-lan或其他合适的连接建立。在处理完上述方法步骤后,可以通过自动测量工具的接口输出结果中的至少一个。因此,自动测量工具可以在获得或接收测量数据的地点在本地应用。替代地或另
外,测量工具可以连接到存储多个测量数据的数据库(如pacs)。此外,测量工具可以像服务器一样单独提供,连接到多个客户端(例如,成像模态、测量模态、数据存储装置、单独的用户、机构、团体等)。此外,该方法步骤可由一个以上的自动测量工具执行。也就是说,例如,一个自动测量工具可以确定测量偏差,另一个自动测量工具可以更新所述测量偏差或可以确定全局偏差。此外,自动测量工具可能存在于不同的地点。
[0081]
在自动测量工具在成像系统中实现的情况下,医学图像可以从成像系统内部传输到自动测量工具,并且测量偏差可以由自动测量工具在系统本身内就地计算出。因此,只有测量偏差必须被传送(从自动测量工具输出)以进一步处理。因此,要传输的数据量可以大大减少,而且没有必要为评估测量偏差的目的建立高容量的传输线路。此外,自动测量工具可以在工作站以及pacs(图片存档和通信系统)系统中应用。
[0082]
在一优选的实施例中,成像系统可以是超声系统。
附图说明
[0083]
现在参考附图描述本发明的有用实施例。类似的元件或特征在附图中用相同的附图标记来表示。在图中:
[0084]
图1示出了穿过人体心脏的示意性截面图(四腔室视图);
[0085]
图2是示意地示出了根据本发明的一实施例的自动测量工具;
[0086]
图3是示出了用户的相对于根据本发明的实施例的自动测量工具获得的基线测量数据的测量结果;
[0087]
图4是例示说明根据本发明的一实施例的方法的步骤的流程图;
[0088]
图5示出了根据本发明的一实施例的包括自动测量工具的系统。
具体实施方式
[0089]
为了更可视化用于自动分析在解剖结构的医学图像上执行的测量中的偏差的本发明方法的优选应用,图1示出了人类心脏的结构,作为解剖结构的示例。来自肺部的血液流入左心房2,且从那里通过二尖瓣3进入左心室4。从那里,它通过主动脉瓣5被泵入主动脉6。这一部分也被称为左心室流出道(lvot)。来自身体的血液流入右心房7,且通过三尖瓣8被泵入右心室9。从那里,它通过肺动脉瓣被泵入肺动脉11。心壁12是由围绕心脏腔室2、4、7和9的肌肉组织构成的。左心室和右心室被隔膜13分开。从图1中可以看出,心脏具有复杂的形状,此外还随着心跳不断运动,也就是说,它是一个动态的解剖结构。这样的解剖结构,特别是人的心脏,是使用如超声心动图系统、超声系统、mr、ct等的医学成像系统来记录的,以便获得医学图像。医学图像随后被用来测量解剖结构的特征,例如,在常规临床过程和临床长期研究中。由于解剖结构的复杂性,为了分析解剖结构的特征,测量例如二尖瓣3的形状、轮廓、距离和/或面积是很困难的,而且容易产生个体误差。一般来说,指定的设施执行这种测量,以产生测量数据。也就是说,测量数据可以在诊所或其他医疗设施中产生。为了认证的目的,这些设施(例如超声心动图实验室)必须经过标准化程序(如上文在介绍部分中所述的)。
[0090]
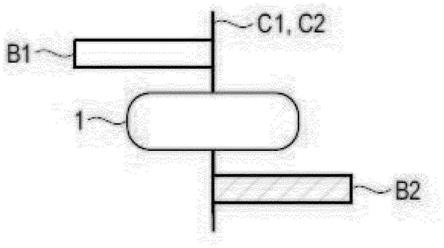
本发明的方法允许在没有附加的工作负荷的情况下,评估并尽量减少同一机构(如诊所或核心实验室)的审阅者(即用户)之间的机构内偏差。在图2所示的本实施例中,来
自同一核心实验室的两个用户独立地审阅研究,也就是说,独立地测量第一患者15和第二患者16的相同解剖结构。第一用户获得第一测量数据r1,第二用户获得第二测量数据r2。核心实验室现在想在用户之间的变化性方面改进质量,且也需要将其记录。但实验室需要与以前的研究一致,因此不能容忍测量的整体漂移。
[0091]
因此,自动测量工具1(基线机器)并行地读取所有研究。也就是说,对于第一用户和第二用户的每一次人工测量,都要执行自动挂机(即第一基线测量数据c1和第二基线测量数据c2)并存储。在本实施例中,基线测量数据c1、c2不显示给相应的用户。随后,对于第一用户,确定基于第一测量数据r1和第一基线测量数据c1的第一测量偏差b1,以及对于第二用户,确定基于第二测量数据r2和第二基线测量数据c2的第二测量偏差b2。换句话说,如图3所示,第一测量偏差b1和第二测量偏差b2分别基于第一测量数据r1和第一基线测量数据c1以及第二测量数据r2和第二基线测量数据c2之间的差值确定。在替代性实施例中,相对偏差b1、b2是基于第一测量数据r1和第一基线测量数据c1以及第二测量数据r2和第二基线测量数据c2的相对差值确定的。此外,每个用户的偏差bx被确定并持续更新。在本实施例中,第一用户的测量偏差b1和第二用户的测量偏差b2。
[0092]
通过比较第一测量偏差b1和第二测量偏差b2,可以计算出两个用户之间的平均偏差。这一结果可用于向用于常规临床超声心动图情景和长期临床研究情景的所有参与的用户反馈,而不需要测量相同的研究。因此,使用自动测量工具1来确定每个用户的测量偏差,提供独立于地点(即可以在地球上任何地方使用)的参考,类似于关于长度测量的“档案局米尺(m
è
tre des archives)”。为了实现上述功能,由用户选择的医学图像可以用来使用自动测量工具1进行分析,以尽量减少用户和自动测量工具1之间的误差源。
[0093]
根据本发明的另一实施例,通过应用上述方法,所有用户和自动测量工具1之间的全机构的偏差bc被确定并持续更新。此外,差值dx=(bx-bc)可以与每个用户相关。在其dx中具有最大差值的用户可被选择以进行共识培训。使所有用户的dx最小化将减少观察者之间的变化性,且不会造成核心实验室的测量中的整体漂移。随着时间的推移,监测全机构的偏差bc,确保整个核心实验室的审阅行为一致。随着时间的推移,监测每个用户的偏差bx,确保每个用户x的审阅一致
‑‑
或由于共识培训而打算改变。所有这些值的记录可用于记录审阅质量、培训的规划和评估培训效果。
[0094]
根据另一实施例,自动测量工具1的确定基本上是以隐藏的方式执行的,也就是说,没有一个用户知道正在后台执行的确定。
[0095]
此外,自动测量工具1也可用于尽量减少机构之间的偏差。自动测量工具1不一定需要与核心实验室的审阅研究的平均方式一致。也就是说,全机构的偏差bc可能较大。换句话说,偏差可能较大,且不会失去其作为用户之间和/或用户群组之间的参考的可用性。
[0096]
arena可以是这种发明的一个落脚点,但作为图像和信息管理系统的intellispace cardiovascular(iscv)也将代表一个很好的选择。此外,这样的系统也可以集成到超声系统中,因为每个用户的偏差bx的数值的通信将足以操作它。也就是说,不需要传输图像数据。
[0097]
关于图4,将更详细地描述用于自动分析在解剖结构的医学图像上执行的测量中的偏差的方法的过程。
[0098]
首先,在步骤90中,接收多个医学图像。多个医学图像至少包括第一批多个医学图
像和第二批多个医学图像,每批多个医学图像包括相同或不同患者的相同解剖结构。在本实施例中,多个医学图像不是由同一自动测量工具1接收的,而是由两个自动测量工具1接收的。也就是说,第一批多个医学图像由第一自动测量工具1接收,第二批多个医学图像由第二自动测量工具1接收。此外,自动测量工具1位于不同的地点。
[0099]
随后,在步骤92中,对于第一批多个医学图像,接收解剖结构的特征的第一测量数据r1。第一测量数据r1是由第一用户获得的。然后在步骤94中,针对第一批多个医学图像,通过自动测量工具1确定解剖结构的特征的第一基线测量数据c1。然后,在步骤96中,基于第一测量数据r1和第一基线测量数据c1,确定第一用户的第一测量偏差b1。
[0100]
同时或随后,在步骤98中,针对第二批多个医学图像,接收解剖结构的特征的第二测量数据r2。第二测量数据r2是由第二用户获得的。第二用户与第一用户不同。也就是说,第一用户和第二用户是彼此不同的人。根据替代性实施例,第一用户和第二用户是同一个人。然后,在步骤100中,针对第二批多个医学图像,通过另一个自动测量工具1确定解剖结构的特征的第二基线测量数据c2。同时,在步骤102中,基于第二测量数据r2和第二基线测量数据c2,确定第二用户的第二测量偏差b2。
[0101]
最后,在步骤104中,将第一测量偏差b1与第二测量偏差b2进行比较。
[0102]
根据另一实施例,该方法附加地在步骤104之后包括步骤106,该步骤106确定由属于一个预定群组或机构的第一、第二和更多的用户的所有测量偏差b1、b2、...、bx的平均值表示的全机构的偏差bc。
[0103]
根据又一实施例,该方法在步骤106之后附加地包括步骤108,该步骤108将全机构的偏差bc与测量偏差b1、b2、...、bx中的一个进行比较,以便获得相对于全机构的偏差bc的每个用户的偏差。
[0104]
根据另一实施例,将全机构的偏差bc与测量偏差b1,b2,...,bx中的一个进行比较的步骤108附加地包括:通过用全机构的偏差bc减去测量偏差b1,b2,...,bx中的每一个确定差值dx1,dx2,...,dxx,以便确定每个用户的差值dx1,dx2,...,dxx,以及确定所有用户中具有最高差值dx1,dx2,...,dxx的一个用户或多个用户。
[0105]
在另一实施例中,在步骤102之后,可以确定全局偏差,该全局偏差由所有可用的测量偏差bx的平均值表示。随后,全局偏差与测量偏差bx中的一个进行比较。
[0106]
在对第一、第二和更多的用户的测量偏差b1、b2、...、bx或全机构的偏差bc进行更新的情况下,上述步骤至少部分地被重复执行。
[0107]
图5示意性地示出了成像系统,在这种情况下它是超声成像机或超声扫描仪的一部分。成像系统包括自动测量工具1。此外,成像系统包括具有触摸式显示屏50的计算机屏幕20。当前在显示屏50上显示超声图像40。成像系统能够控制显示器50上显示的任何图像或元素。自动测量工具1包括处理器60,例如cpu,其被配置成执行本发明方法的实施例。成像系统还包括数据存储介质80,如硬盘,其与自动测量工具1连接。另外,自动测量工具1包括存储装置,在该存储装置上可以存储在自动测量工具1或其处理器60上执行本发明所需的计算机程序。此外,还可以有可插入的计算机可读介质65,例如usb棒,它可以用来将必要的计算机程序加载到自动测量工具1上。最后,成像系统可以包括超声控制单元200,它控制通过超声探头120对超声图像的获取。提供患者床14,供受试者,例如患者,在用户17获取超声图像40的时候躺着。用户17可以是希望执行准确图像评估的任何人,在医学图像的情况
下,通常是放射科医生或放射技师,但也可以是任何其他领域的专家,如妇产科医生、心脏病医生等。
[0108]
虽然本发明已在附图和前述描述中进行了详细例示说明和描述,但这种例示说明和描述应被视为例示说明性或示例性的,而不是限制性的;本发明不限于所公开的实施例。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。