1.本发明涉及通过施用有效量的达泮舒腈(dapansutrile)治疗乳腺癌的方法。
背景技术:
2.肿瘤发生由以下引起:基因组改变,包括点突变,基因缺失,导致细胞转化的染色体重排,自给自足的增殖,对抗增殖信号不敏感,细胞凋亡的逃避和无限的复制潜力,最终导致组织侵袭和转移。然而,肿瘤细胞的扩增与涉及癌症和非癌细胞的复杂事件网络有关。慢性炎症是这种促进条件的典型例子(1,2)。
3.促炎细胞因子il-1β是许多慢性炎症性疾病的有效介质(3)。与癌症与慢性炎症的联系一致,已经表明il-1β在几种肿瘤中过度表达,并作为肿瘤促进机制的诱导剂,包括血管生成、免疫抑制、肿瘤相关巨噬细胞(tam)的募集和转移(4-6)。
4.乳腺癌的类型包括导管原位癌(dcis)、浸润性导管癌(idc)、三阴性乳腺癌(tnbc)、炎症性乳腺癌(ibc)、转移性乳腺癌和妊娠期乳腺癌等。三阴性乳腺癌肿瘤的特征是缺乏雌激素受体(er)、孕激素受体(pr)和升高的人表皮生长因子受体2(her2)蛋白水平(7)。
5.nlrp3(nod样受体家族、含有3的pyrin结构域)也称为nalp3或隐热蛋白(cryopyrin),是炎性体的传感器之一、是参与白细胞介素-1β(il-1β)加工和il-18加工的大分子结构。nlrp3在细胞内感染(细菌和病毒蛋白)或组织损伤(缺血)期间感知细胞内危险。nlrp3活化导致募集asc(含有羧基末端半胱天冬酶募集结构域的凋亡相关的斑点样蛋白)和导致炎性体形成并且最终导致细胞死亡的半胱天冬酶-1。
6.达泮舒腈是β-磺腈的小合成分子,其已被证明选择性地抑制nlrp3炎性体,并且在健康受试者口服时是安全的(8)。
7.需要一种用于治疗乳腺癌的方法。所述方法应当有效并且没有明显的副作用。
附图说明
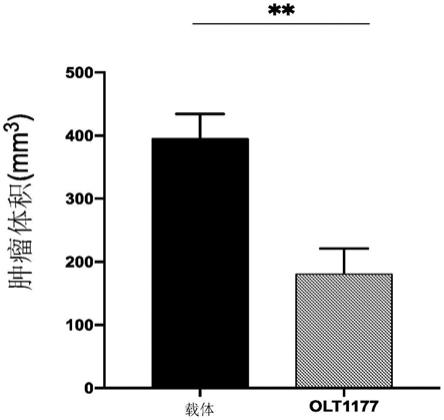
8.图1a-1d.图1a描绘了实验设计的示意图。图1b描绘了显示用达泮舒腈治疗的小鼠中与载体相比的肿瘤体积的图表。在肿瘤切除后进行测量。**p《0.01(n=5)。图1c描绘了显示用达泮舒腈治疗的小鼠中的肿瘤体积与喂食标准饮食的小鼠中的肿瘤相比的生长曲线。在所示的日子对活小鼠进行测量。图1c(n=5).图1d描绘了显示喂食富含达泮舒腈饮食的小鼠的存活百分比的图表。*p《0.05。
9.图2a-2g.图2a描绘了实验设计的示意图。图2b描绘了肿瘤体积分析图表,显示用达泮舒腈治疗的小鼠和用达泮舒腈和抗il1α治疗的小鼠中的肿瘤体积减少。图2c描绘了显示用达泮舒腈治疗的小鼠与用载体对照治疗的小鼠相比的肿瘤的生长曲线。在所示的日子对活小鼠进行测量。图2c(n=5).图2d和2e描绘的图表显示了与用载体对照治疗的小鼠相比,来自用达泮舒腈治疗的小鼠的原发性4t1肿瘤中tslp(图2d)及其相关受体(tslpr;图2e)的相对mrna表达水平。*p《0.05(n=8,两个独立实验)。图2f和2g描绘了显示
使用人tnbc细胞系mda-468体外tslp(图2f)和tslpr(图2g)的相对mrna表达的图表。如所示,用il-1α刺激细胞并用达泮舒腈处理。*p《0.05(n=8,两个独立实验)。
10.图3a-3e.图3a描绘了实验设计的示意图。图3b描绘了显示用达泮舒腈抗pd-1、抗pd-1和达泮舒腈两者或载体治疗的4t1tnbc小鼠中的肿瘤体积的图表。在肿瘤切除后进行测量。图3b(载体vs.抗pd-1,p=0.0069;载体vs.达泮舒腈,p=0.0041;载体vs.达泮舒腈 抗pd-1,p=0.0014)(n=5)。图3c描绘了显示用抗pd-1、达泮舒腈、抗pd-1和达泮舒腈两者或载体治疗的小鼠中超过15天的肿瘤体积的生长曲线。在所示的日子对活小鼠进行测量。图3c(n=5).图3d描绘了显示与载体相比,来自用达泮舒腈治疗的小鼠的4t1肿瘤中的相对pd-l1 mrna表达水平的图表。*p《0.05(n=8,两个独立实验)。图3e描绘了显示使用鼠三阴性乳腺癌细胞(e0771)的体外相对pd-l1 mrna表达的图表。用il-1α刺激e0771细胞,并用指定浓度的载体或达泮舒腈处理。*p《0.05(n=3)。
11.图4a-4c.图4a描绘了实验设计的示意图。图4b描绘了量化用达泮舒腈抗pd-1、抗pd-1和达泮舒腈两者或载体处理的小鼠脾细胞中il-22水平的图表。图4b(载体vs.达泮舒腈,p=0.037;载体vs.达泮舒腈 抗pd-1,p=0.048).图4c描绘了量化用达泮舒腈、抗pd-1、抗pd-1达泮舒腈两者或载体处理的小鼠脾细胞中infγ水平的图表。图4c(载体与达泮舒腈,p=0.044;载体与达泮舒腈 抗pd-1,p=0.022)(n=5)。
具体实施方式
12.nlrp3炎性体的活化会扩大对组织损伤的炎性反应并且介导进一步的损伤。达泮舒腈是选择性的nlrp3炎性体抑制剂;达泮舒腈通过防止活化nlrp3炎症小体来减轻炎症。达泮舒腈在体外抑制小鼠和人细胞中成熟il-1β和il-18的产生。通过此作用机制,达泮舒腈阻止il-1β的产生和/或释放并且抑制在动物和人类受试者中形成nlrp3炎性体。
13.本发明涉及一种治疗乳腺癌的方法,该方法通过将有效量的达泮舒腈施用于受试者。通过抑制il-1β(乳腺肿瘤进展的一种主要驱动因素),达泮舒腈可减少肿瘤体积和/或防止肿瘤进一步生长。
14.化合物
15.本发明使用达泮舒腈的经纯化化合物(3-甲磺酰基-丙腈)或其药学上可接受的盐或溶剂化物。
[0016][0017]
如本文所使用的,“药学上可接受的盐”是保留母体化合物的所需生物活性并且不会产生不希望的毒理学效应的盐。
[0018]
如本文所用,“药学上可接受的溶剂化物”是保留母体化合物的所需生物活性并且不会产生不希望的毒理学作用的溶剂化物。如本文所用,“溶剂化物”是加成络合物,其中化合物以一定固定比例与可接受的共溶剂组合。助溶剂包括但不限于水、乙酸、乙醇和其他合适的有机溶剂。
[0019]
药物组合物
[0020]
在药物组合物中活性化合物达泮舒腈或其药学上可接受的盐或溶剂合物的量一般对于可注射制剂为约0.1-5%,对于片剂制剂为约1-90%,对于胶囊制剂为约1-100%,对于局部制剂为约0.01-20%、0.05-20%、0.1-20%、0.2-15%、0.5-10%或1-5%(w/w),并且对于贴片制剂为约0.1-5%。
[0021]
如本技术所使用的,“约”是指所列举值的
±
10%。
[0022]
本领域技术人员可以使用常规标准来选择作为非活性成分的药学上可接受的载体。药学上可接受的载体包含但不限于非水基溶液、悬浮液、乳液、微乳液、胶束溶液、凝胶和软膏。药学上可接受的载体还可以含有包含但不限于以下的成分:盐水和电解质水溶液;离子和非离子渗透剂,如氯化钠、氯化钾、甘油和葡萄糖;ph调节剂和缓冲剂,如氢氧化物盐、磷酸盐、柠檬酸盐、乙酸盐、硼酸盐;以及三乙醇胺;抗氧化剂,如亚硫酸氢盐、亚硫酸盐、偏亚硫酸氢盐、硫代亚硫酸盐、抗坏血酸、乙酰半胱氨酸、半胱氨酸、谷胱甘肽、丁基化羟基茴香醚、丁基化羟基甲苯、生育酚和抗坏血酸棕榈酸酯的盐、酸和/或碱;表面活性剂,如卵磷脂、磷脂,包含但不限于磷脂酰胆碱、磷脂酰乙醇胺和磷脂酰肌醇;泊洛沙姆(poloxamer)和泊洛沙胺(ploxamine);聚山梨醇酯,如聚山梨醇酯80、聚山梨醇酯60和聚山梨醇酯20;聚醚,如聚乙二醇和聚丙二醇;聚乙烯,如聚乙烯醇和聚维酮;纤维素衍生物,如甲基纤维素、羟丙基纤维素、羟乙基纤维素、羧甲基纤维素和羟丙基甲基纤维素及其盐;石油衍生物,如矿物油和白凡士林;脂肪,如羊毛脂、花生油、棕榈油、豆油;甘油单酯、甘油二酯和甘油三酯;丙烯酸的聚合物,如羧基聚亚甲基凝胶和疏水改性的交联丙烯酸酯共聚物;多糖,如葡聚糖;以及糖胺聚糖,如透明质酸钠。可以使用众所周知的防腐剂来保护这些药学上可接受的载体免受细菌污染,这些防腐剂包含但不限于苯扎氯铵、乙二胺四乙酸及其盐、苄索氯铵、氯己定、氯丁醇、对羟基苯甲酸甲酯、硫柳汞和苯乙醇,或者可以将所述药学上可接受的载体配制成用于单次或多次使用的非防腐制剂。
[0023]
例如,达泮舒腈的片剂制剂或胶囊制剂可以含有不具有生物活性且不与活性化合物反应的其它赋形剂。片剂的赋形剂可以包含填充剂、粘合剂、润滑剂以及助滑剂、崩解剂、润湿剂和释放速率调节剂。粘合剂促进制剂颗粒的粘附并且对片剂制剂很重要。粘合剂的实例包含但不限于羧甲基纤维素、纤维素、乙基纤维素、羟丙基甲基纤维素、甲基纤维素、刺梧桐树胶、淀粉、淀粉和黄蓍胶、聚(丙烯酸)和聚乙烯吡咯烷酮。
[0024]
例如,达泮舒腈的贴片制剂可以包括一些非活性成分,如1,3-丁二醇、氨乙酸二羟基铝、乙二胺四乙酸二钠、d-山梨糖醇、明胶、高岭土、对羟基苯甲酸甲酯、聚山梨醇酯80、聚维酮、丙二醇、对羟基苯甲酸丙酯、羧甲基纤维素钠、聚丙烯酸钠、酒石酸、二氧化钛和纯净水。贴片制剂还可以含有皮肤渗透性增强剂,如乳酸酯(例如,月桂基乳酸酯)或二乙二醇单乙醚。
[0025]
包含达泮舒腈的局部制剂可以是凝胶、霜剂、洗剂、液体、乳液、软膏、喷雾剂、溶液和悬浮液的形式。局部制剂中的非活性成分例如包含但不限于乳酸月桂酯(润肤剂/渗透增强剂)、二乙二醇单乙醚(润肤剂/渗透增强剂)、dmso(溶解度增强剂)、硅氧烷弹性体(流变学/质地改性剂)、辛酸/癸酸甘油三酯(润肤剂)、辛水杨酯(润肤剂/uv过滤剂)、硅油(润肤剂/稀释剂)、角鲨烯(润肤剂)、葵花籽油(润肤剂)和二氧化硅(增稠剂)。在一个实施方案中,二乙二醇单乙醚包含在局部凝胶制剂中。
[0026]
使用方法
[0027]
通过抑制nlrp3炎性体的组装,达泮舒腈防止促炎细胞因子il-1β和il-22的产生和/或释放,并最终治疗乳腺癌肿瘤的生长。
[0028]
本发明涉及一种治疗乳腺癌的方法。所述方法包括向有此需要的受试者施用有效量的达泮舒腈的步骤。如本文所使用的,“有效量”是通过改善病理状况和/或减少、改进和/或消除疾病症状来有效治疗疾病的量。例如,有效量是减少乳腺癌生长和/或减少乳腺肿瘤大小的量。
[0029]
适合通过本方法治疗的乳腺癌包括三阴性乳腺癌(tnbc)、导管原位癌(dcis)、浸润性导管癌(idc)、炎性乳腺癌(ibc)、转移性乳腺癌和妊娠期乳腺癌,以及其他类型。
[0030]
检查点抑制剂疗法是癌症免疫疗法的一种形式。该疗法针对免疫检查点,即免疫系统的关键调节剂,当受到刺激时会抑制对免疫刺激的免疫反应。一些癌症可以通过刺激免疫检查点靶标来保护自己免受攻击。
[0031]
免疫疗法显著提高了乳腺癌患者的护理标准;然而,复发患者的无反应者和数量仍然很高。因此,增加检查点抑制剂疗效的联合疗法代表了重要的临床益处。
[0032]
在一个实施方案中,本发明涉及通过组合达泮舒腈和检查点抑制剂来治疗乳腺癌的组合疗法。该方法包括向有需要的受试者施用有效量的达泮舒腈和有效量的检查点抑制剂。达泮舒腈和检查点抑制剂可以同时或依次施用。达泮舒腈与检查点抑制剂联合施用是有利的,因为达泮舒腈可以提高检查点抑制剂的疗效,并且达泮舒腈具有安全的药物特征。共同施用还可以减少检查点抑制剂的所需剂量,从而减少免疫疗法相关的不良事件。
[0033]
适合与达泮舒腈一起用于治疗乳腺癌的检查点抑制剂包括细胞毒性t淋巴细胞相关蛋白4(ctla-4)、程序性细胞死亡蛋白1(pd-1)和程序性死亡配体1(pd-l1)。
[0034]
pd-1存在于t细胞表面,并且是pd-l1的受体。pd-1通过抑制炎症性t细胞活性在下调免疫反应中发挥作用。这种机制有助于身体预防自身免疫性疾病,但是,这种机制也可以防止癌细胞被杀死(9)。
[0035]
在优选的实施方案中,检查点抑制剂是抗pd-1抗体。该方法包括向有需要的受试者施用有效量的达泮舒腈和有效量的抗pd-1抗体。达泮舒腈和抗pd-1抗体可以同时或依次施用。达泮舒腈与抗pd-1抗体联合施用是有利的,因为达泮舒腈提高了抗pd-1的疗效并且达泮舒腈具有安全的药物特征。共同施用还可以减少抗pd-1抗体的所需剂量,从而减少免疫疗法相关的不良事件。
[0036]
发明人已经证明,与载体相比,达泮舒腈治疗降低了小鼠中4t1 tnbc的肿瘤生长。
[0037]
此外,本发明人已证明达泮舒腈在治疗小鼠的脾细胞中降低了肿瘤促进il-22并增加了infγ。
[0038]
可以通过全身性施用或局部施用来施加本发明的药物组合物。全身性施用包含但不限于口服施用、肠胃外施用(如静脉内施用、肌肉内施用、皮下施用或直肠施用)和吸入施用。在全身性施用中,活性化合物首先到达血浆并且然后分布到靶组织中。口服施用是本发明的优选的施用途径。局部施用包含局部施用。
[0039]
组合物的剂量可以根据受试者的乳腺癌的程度和每个患者的个体反应而变化。对于全身性施用,所递送活性化合物的血浆浓度可以变化;但是通常为1x10-10-1x10-4
摩尔/升,并且优选地为1x10-8-1x10-5
摩尔/升。
[0040]
在一个实施方案中,将药物组合物口服施用给受试者。口服施用的剂量通常为至少1mg/kg/天且小于100mg/kg/天,优选5-100mg/kg/天,这取决于受试者的年龄和状况。例如,对于人类受试者,口服施用的剂量为1-10、或1-50、或1-100、或5-50、或5-100、或10-50、或10-100mg/kg/天。例如,对于人类受试者,口服施用的剂量为100-10,000mg/天,优选地100-2500、500-2500、500-4000、1000-5000、2000-5000、2000-6000或2000-8000mg/天。该药物可以每天口服一次、两次、三次或四次。每天治疗患者,持续14天,直至1个月、2个月或3个月或终生。
[0041]
在一个实施方案中,将药物组合物静脉内施用给受试者。静脉内弹丸注射或静脉内输注的剂量通常为0.03到5mg/kg/天或0.03到1mg/kg/天。
[0042]
在一个实施方案中,将药物组合物皮下施用给受试者。皮下施用的剂量通常为0.3-20mg/kg/天、0.3-3mg/kg/天或0.1-1mg/kg/天。
[0043]
在一个实施方案中,局部施加组合物。根据医学问题和疾病病理学,每天至少局部施加组合物1次或2次或者每天3次到4次。通常,局部组合物包括约0.01-20%、或0.05-20%、或0.1-20%、或0.2-15%、0.5-10或1-5%(w/w)的活性化合物。典型地,向个体施加每剂量0.2-10ml的局部组合物。
[0044]
本领域技术人员将认识到,多种递送机制也适用于本发明。
[0045]
本发明可用于治疗哺乳动物受试者,如人、马和犬和猫。本发明在治疗人类方面尤其有效。
[0046]
以下实施例进一步说明了本发明。这些实施例仅旨在说明本发明并且不应被解释为限制本发明。
[0047]
实施例
[0048]
在下述实施例中使用了以下材料和方案。
[0049]
细胞系.乳腺癌细胞系4t1、e0771和mda-468获自atcc(manassas,va)。将细胞在补充有10%fbs、100单位/ml青霉素、0.1mg/ml链霉素的dmem中培养。将细胞保持在37℃的加湿5%co2气氛中。
[0050]
体外.将肿瘤细胞系以每孔200,000个的浓度粘附过夜。第二天,在加入或不加入达泮舒腈的情况下加入人重组il-1α或il-1β(r&d systems,minneapolis,mn)并温育24小时。然后使用trizol试剂(thermo fisher scientific,waltham,ma)裂解细胞。
[0051]
基因表达.然后使用trizol(thermo fisher scientific)分离rna,并使用superscript iii first-strand(thermo fisher scientific)在cdna中合成。在biorad cfx96实时系统上使用power sybr green pcr master mix(thermo fisher scientific)对cdna进行定量pcr(qpcr)。如所示使用以下引物评估tslp、tslpr和pdcd-11l1 mrna的基因表达:tslp正向,5
’‑
tactctcaatcctatccctggctg-3’(seq id no:1);tslp反向,5
’‑
tgtgaggtttgattcaggcagatg-3’(seq id no:2);tslpr正向,5
’‑
tgacgtcacggggtgatgtc-3’(seq id no:3);tslpr反向,5
’‑
gaggatgcacccggaagtga-3’(seq id no:4);pdcd1l1正向,5
’‑
gctccaaaggacttgtacgtg3’(seq id no:5);pdcd1l1反向,5
’‑
tgatctgaagggcagcatttc3’(seq id no:6)。
[0052]
肿瘤模型.动物方案经科罗拉多大学健康科学中心动物护理和使用委员会批准。给6-8周龄的雌性balb/c小鼠(the jackson laboratory)喂食标准或达泮舒腈
饮食(4),该饮食从4t1注射当天开始。将4t1细胞(2x105)原位注射到乳腺脂肪垫中。用达泮舒腈处理的小鼠随意喂食含有7.5g/kg达泮舒腈的食物颗粒,从4t1注射当天开始并持续15天。小鼠通常每天消耗约4克食物,导致对照组的每日剂量约为0mg/kg/天,治疗组的每日剂量约为1,000mg/kg/天。小鼠食物中的这种食物颗粒浓度(食物中7.5g/kg达泮舒腈)导致的血液水平几乎与口服1000mg/d剂量达泮舒腈的人的血液水平相同(40μg/ml血液水平)(14)。对照(“载体”)小鼠被喂食不含达泮舒腈的对照食物颗粒。4t1注射后15天处死小鼠。
[0053]
抗pd-1联合治疗.如所述注射4t1细胞。滴注4t1细胞后,小鼠开始接受达泮舒腈饮食或按所述继续采用标准饮食,并在第七天腹膜注射针对pd-1的中和抗体(200μg/小鼠;bioxcell,west lebanon,nh)。在b16f10滴注15天后处死小鼠。
[0054]
抗il-1α联合治疗.如所述注射4t1细胞。滴注4t1细胞后,小鼠开始接受达泮舒腈饮食或按所述继续采用标准饮食,并且每三天腹膜注射针对抗il-1α的中和抗体(200μg/小鼠;xbiotech,austin,tx)。在b16f10滴注15天后处死小鼠。
[0055]
脾细胞因子分泌.如所述注射4t1细胞。通过机械解离处理来自荷瘤小鼠的脾脏用于细胞培养。将细胞悬浮在补充有10%fbs、100单位/ml青霉素、0.1mg/ml链霉素的rpmi中,并以5.0e^5铺板并用10μg/ml lps刺激。72小时后,去除上清液并通过elisa(r&dsystems,minneapolis,mn)测量细胞因子。
[0056]
实施例1:达泮舒腈减少4t1 tnbc小鼠的乳腺肿瘤体积
[0057]
在该实施例中,发明人评估了口服nlrp3抑制剂达泮舒腈是否有效减少鼠4t1 tnbc模型中的肿瘤生长。
[0058]
产生4t1 tnbc小鼠并喂食标准饮食或达泮舒腈饮食15天。在指定日子测量肿瘤以产生生长曲线(图1c)。在切除肿瘤后获取最终的肿瘤体积(图1b)。喂食达泮舒腈饮食的荷瘤小鼠显示出显著减少的肿瘤体积(图1b,**p《0.01)。在生存研究中,与标准饮食的小鼠(图1d,n=10,*p《0.05)相比,用达泮舒腈治疗的4t1 tnbc小鼠显示出显著更高的生存率,其中一半的达泮舒腈饮食小鼠存活超过30天。
[0059]
在这些实验中,与载体对照相比,用达泮舒腈治疗的小鼠显示出显著的肿瘤体积减少。总的来说,图1a-1d显示,在三阴性乳腺癌小鼠模型(4t1 tnbc小鼠)中,达泮舒腈可减少肿瘤体积并显著提高存活率。
[0060]
实施例2:达泮舒腈单独和与抗il-1α共同施用时减小乳腺肿瘤体积
[0061]
以前的研究表明,接受il1r拮抗剂阿那白滞素治疗的her2-转移性乳腺癌患者下调了转移性乳腺癌患者中炎症特征的成分(10)。为了进一步评估il-1α和il-1β在驱动4t1肿瘤进展中的作用,发明人用抗il-1α(200μg/小鼠)、达泮舒腈饮食和两者的组合来治疗小鼠。产生4t1 tnbc小鼠并喂食标准饮食或达泮舒腈饮食15天。如所示,每3天给小鼠注射一次抗il1α。随后,分析肿瘤体积。图2b和2c显示单独使用达泮舒腈饮食和与il-1α组合治疗的带肿瘤小鼠当与载体相比时的显著减小的肿瘤体积(*p《0.05)。
[0062]
在这些实验中,用达泮舒腈治疗的小鼠可有效减小肿瘤体积,而抗il-1α单一疗法并未显著减小肿瘤体积。这些数据一起表明,在4t1 tnbc中,il-1β可能比il-1α具有更强的肿瘤促进作用。
[0063]
先前关于三阴性乳腺癌中肿瘤-骨髓细胞相互作用的研究表明,肿瘤来源的il-1α
促进浸润的骨髓细胞以分泌tslp(胸腺基质淋巴细胞生成素),这又对原发性和远处转移的部位至关重要(15)。为了进一步评估阻断nlrp3在4t1肿瘤进展中的作用,发明人通过相对mrna表达测量,量化原发性4t1肿瘤中tslp及其相关受体tslpr的基因表达。图2d和2e显示与载体相比,在用达泮舒腈饮食治疗的荷瘤小鼠中,tslp和tslpr表达显著降低(*p《0.05)。该分析是在与图2b和2c中相同的小鼠上进行的。为了在体外证实这些发现,发明人使用了人tnbc细胞系mda-468。mda-468细胞用il-1α(20ng/ml)刺激,并与达泮舒腈(10μm)或不加达泮舒腈(对照)温育24小时。图2f和2g显示,与对照相比,显著降低的tslp和tslpr表达(*p《0.05)。这些发现表明il-1α和il-1β都促进tslp/tslpr,并且该途径既是肿瘤内在的,也是肿瘤髓系的。
[0064]
实施例3:达泮舒腈单独和与抗pd-1共同施用时减小乳腺肿瘤体积
[0065]
在本实施例中,发明人研究了达泮舒腈和抗pd-1的肿瘤减小作用。
[0066]
产生4t1 tnbc小鼠并喂食标准饮食或达泮舒腈饮食15天。如所示,接受联合治疗的小鼠在第7天注射抗pd-1(图3a)。
[0067]
结果示于图3b和3c中。肿瘤体积测量是在图3c所示的天数在体内从小鼠的肿瘤获取的。在第15天处死后,切除肿瘤并测量肿瘤体积,如图3b所示。与载体相比,接受达泮舒腈单药治疗的荷瘤小鼠显示出显著的肿瘤减小(**p=0.0041)。单独接受抗pd-1的小鼠也显示出显著的肿瘤减小(**p=0.0069)。接受达泮舒腈和抗pd-组合的小鼠表现出更显著的肿瘤减小(**p=0.0014)。
[0068]
为了检查达泮舒腈对pd-l1基因表达水平的影响,对来自图2b和2c的4t1 tnbc小鼠的肿瘤进行了进一步的体内分析。
[0069]
结果如图3d所示。通过相对mrna表达定量,喂食达泮舒腈饮食的小鼠的4t1肿瘤表达的pd-l1基因表达显著低于喂食标准饮食的小鼠。图3d(*p《0.05;n=8,两个独立实验)。这一发现表明了增强抗pd-1治疗效果的可能机制。
[0070]
对鼠三阴性乳腺癌细胞系e0771进行了体外分析,以检查达泮舒腈对细胞死亡信号传导后pd-l1表达水平的影响。il-1α刺激用于模拟肿瘤微环境中的细胞死亡信号。将细胞用10ng/ml的il-1α刺激,和用指定浓度的达泮舒腈处理或未处理(载体)。
[0071]
结果如图3e所示。在il-1α刺激后用达泮舒腈处理的e0771细胞表达显著降低的pd-l1(*p《0.05)(n=3)。
[0072]
实施例4:达泮舒腈在脾细胞中减少il-22并增加infγ
[0073]
最近对细胞因子il-22的研究揭示了其在乳腺癌中的促肿瘤作用,因为它将免疫抑制细胞募集到肿瘤微环境中(11)。在此进行了实验,以检查在达泮舒腈和抗pd-1单药治疗以及联合治疗后来自荷瘤小鼠的脾脏中细胞因子的产生。
[0074]
在本实施例中,产生4t1 tnbc小鼠并喂食标准饮食或达泮舒腈饮食15天。如图4a所示,在第7天的组合研究中给小鼠注射抗pd-1。
[0075]
在这些实验中,达泮舒腈单药治疗和与抗pd-1联合治疗显著降低了il-22水平(*p《0.05)。然而,与载体相比,单独使用抗pd-1治疗未能降低il-22水平。参见图4b。这些数据表明il-1β对il-22的诱导最终在达泮舒腈喂食小鼠中受到抑制。结果还表明,达泮舒腈和联合用药组的ifnγ水平增加,这表明杀肿瘤nk细胞活性增加(*p《0.05)。参见图4c。
[0076]
参考文献
[0077]
1.y.guo,et al.cancer res 77,6429-6441(2017)。
[0078]
2.s.shalapour,et al.j clin invest 125,3347-3355(2015)。
[0079]
3.c.a.dinarello.blood 117,3720-3732(2011)。
[0080]
4.r.n.apte,et al.cancer metastasis rev 25,387-408(2006)。
[0081]
5.c.a.dinarello.cancer metastasis rev 29,317-329(2010)。
[0082]
6.b.guo,et al.sci rep 6,36107(2016)。
[0083]
7.k.l.lee,et al.cancers 11(9),1334(2019)。
[0084]
8.c.marchetti,et al.proc natl acad sci u s a 115,e1530-e1539(2018)。
[0085]
9.n.l.syn,et al.lancet oncology 18(12),pe731-e741(2017)。
[0086]
10.t.c.wu,et al.,cancer res 78(18):5243-5258(2018)。
[0087]
11.c.voigt,et al.proc natl acad sci u s a 114:12994-12999(2017)。
[0088]
12.p.m.ridker et al.lancet 390(10105):1833-1842(2017)。
[0089]
13.i.kaplanov,et al.proc natl acad sci u s a 116(4):1361-1369(2019)。
[0090]
14.c.marchetti,et al.arthritis res ther 20:169(2018)。
[0091]
15.e.l.kuan,et al.nat immunol 19,366
–
374(2018)。
[0092]
从前述内容可以理解,本文已经出于说明的目的描述了本发明的特定实施例,但是在不脱离本公开的精神和范围的情况下可以进行各种修改。因此,本发明不受所附权利要求的限制。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。