编码hpv多肽和il-2的痘病毒与抗pd-l1抗体的组合
技术领域
1.本发明涉及a)编码至少人乳头瘤病毒(hpv)e6和e7多肽和免疫刺激性细胞因子的痘病毒载体,和b)抗pd-l1抗体或其抗原结合片段的组合,用于治疗hpv-阳性的癌症,其中在第一次施用所述抗pd-l1抗体前5至10天进行所述痘病毒的第一次施用,以及进行所述痘病毒和抗pd-l1抗体的后续施用。
2.发明背景
3.人乳头瘤病毒(hpv)是最常见诊断的性传播感染。它与尖锐湿疣、生殖器(宫颈、阴道、外阴、阴茎、肛门)鳞状上皮内病变和恶性肿瘤以及头颈部鳞状细胞癌(scchn) 有关。
4.hpv是一种大约有7900个碱基对的小脱氧核糖核酸(dna)病毒。hpv基因组编码与病毒基因调控和细胞转化相关的六个早期(e)蛋白的dna序列,两种形成病毒外壳的晚期蛋白,以及称为长控制区(long control region)或上游调控区(upstream regulatoryregion)的调控dna序列区域(palefsky j.m.and holly e.a.,cancer epidemiol biomarkersprev.(1995)4(4):415-428)。
5.hpv基因型根据其恶性潜能可大致分为“高风险”(16、18、31、33、35、39、45、 51、52、56、58、59和68)和“低风险”(6、11、40、42、43、44、53、54、61、72、73 和81)。16型和18型是癌症中最常见的hpv类型,其中例如在大约50%的宫颈癌患者中发现16型。除了引起宫颈癌外,hpv还与肛门癌和阴茎癌有关。感染高危(致癌)hpv 亚型:hpv-16基因型,同时也感染hpv-18、31或33型的患者,患口腔癌和口咽癌的风险增加了约2至3倍。hpv相关肿瘤主要出现在舌根或扁桃体区域,尽管在其它部位的小部分肿瘤也是hpv-阳性。目前还不清楚为什么口咽部比其他部位更易感hpv。
6.对已发表的临床试验的综述,无论是单臂临床试验还是随机临床试验,都证明hpv 阳性范围为口咽癌的20-60%(ihloff a.s.et al.,oral oncol.(2010)46(10):705-711)。
7.不仅高风险hpv感染与各种癌症相关,而且还已知其参与hpv-阳性癌症的致癌作用。特别是,研究表明高危hpv感染是scchn发展的独立危险因素,并且需要与例如吸烟或酗酒的传统危险因素一起考虑(d'souza g.et al.,the new england journal ofmedicine.(2007)356(19):1944-1956)。
8.连接hpv感染与癌变的机制已被证明与两种病毒蛋白e6和e7有关。e6和e7被描述为癌蛋白,因为它们具有通过抑制关键调控因子来破坏受感染细胞正常复制控制的能力。e6癌蛋白通过破坏p53通路的泛素介导的过程结合并诱导p53肿瘤抑制蛋白的降解,其导致不受控制的细胞周期进程(chung c.h.and gillison m.l.,clin cancer res. (2009)15(22):6758-6762)。hpv e7蛋白结合并抑制视网膜母细胞瘤蛋白(prb),阻止其抑制转录因子e2f,导致细胞周期失去控制。此外,rb的功能失活导致p16蛋白的上调。p16由cdkn2a肿瘤抑制基因编码,并调节细胞周期蛋白d-cdk4/6复合物的活性,该复合物磷酸化rb,导致启动细胞周期进程的转录因子e2f的释放。
9.针对hpv感染开发了两种预防疫苗;一种是四价疫苗(gardasil),以及另一种是二价疫苗(cervarix)。两者均被批准用于预防hpv感染和hpv相关疾病的对象,这些对象以前
没有经历过暴露于hpv。
10.然而,迄今为止,很少有针对hpv-阳性的癌症,特别是scchn的抗肿瘤疫苗进行过临床评估。疫苗驱动的肿瘤特异性免疫细胞的产生和长期存在是抗肿瘤疫苗被认为对hpv-阳性的癌症尤其是scchn临床有益的目标。
11.tg4001(对应于研究名称mvatg8042)是一种基于非繁殖型高减毒痘苗载体修饰的安卡拉痘苗病毒(mva)的治疗性重组疫苗/免疫治疗产品,该病毒的基因组为约178千碱基对的单线性双链dna分子,其包含编码三种蛋白的插入转基因:经修饰以消除其致癌潜力的hpv e6和e7癌蛋白和作为佐剂的人白细胞介素2(il-2)。
12.tg4001在妇科条件下进行了临床研究。在进行的5项ii期研究中,4项涉及癌前病变患者,特别是宫颈上皮内瘤变(cin)2/3级和外阴上皮内瘤变(vin)3级,以及1项研究包括患有宫颈癌的患者。两项ii期试验涉及21例(tg4001.07)和206例(nv25025)患有hpv-16相关cin 2/3级的患者,证明了tg4001在组织学消退和应答率以及病毒清除方面比安慰剂具有更高的活性和疗效。hpv-16相关cin 2/3级患者的ii期试验中使用的剂量为皮下途径的5
×
107成斑单位(pfu)。就安全性而言,证明了治疗性疫苗产品具有良好的耐受性(未观察到重大毒性),最常见的不良事件是注射部位反应(brun j.l.etal.,am j obstet gynecol.(2011)204(2):169e161-168;harper d.m.et al.,gynecol oncol. (2019)153(3):521-529)。
13.基于从总共313名对象(健康志愿者或cin 2/3患者、宫颈癌或vin患者,用tg4001 在单一疗法中治疗或通过肌肉或皮下途径与免疫调节剂咪喹莫特(imiquimod)组合治疗) 获得的数据显示,tg4001的总体安全性特征显示tg4001在每周或每3周至7周施用 5
×
107pfu至患者,最多6次注射的最高剂量下耐受性良好。与tg4001的免疫刺激性质一致,tg4001的施用与大多数治疗患者注射部位反应的发生有关,这些事件大多是轻到中等强度的。
14.pd-1是t细胞活性的负调节因子,当其与其两个配体pd-l1和pd-l2相互作用时,它在免疫应答的不同阶段限制了t细胞的活性。当通过磷酸酶活性与配体结合时,pd-1 抑制激酶信号通路,而激酶信号通路通常导致t细胞活化。许多破坏pd-1轴的抗体已经进入临床开发。pd-l1也被认为通过与b7相互作用在t细胞上施加负信号,而pd-l1 阻断抗体阻止这种相互作用。免疫检查点抑制剂还能增强肿瘤浸润淋巴细胞(til)的功能,增强肿瘤微环境中的抗肿瘤免疫。til的存在与许多癌症类型的良好预后相关。因此,证明pd-l1
til是对免疫检查点阻断反应的指标,以及缺乏til可能是对pd-1/l1 阻断反应缺乏的预测标志((herbst r.s.et al.,nature.(2014)515(7528):563-567)。
15.已经在各种实体癌的治疗中进行了抗pd-l1抗体临床研究,并发现在各种癌症中提供临床益处(brahmer j.r.et al.,n engl j med.(2012)366(26):2455-2465)。
16.阿维单抗(avelumab)是一种人抗程序化死亡配体-1(pd-l1)抗体。阿维单抗在临床前模型中显示出参与获得性和先天免疫功能。通过阻断pd-l1与pd-1受体的相互作用,已经显示阿维单抗在临床前模型中解除了t细胞介导的抗肿瘤免疫应答的抑制。阿维单抗还显示在体外通过抗体依赖性细胞介导的细胞毒性作用(adcc)诱导nk细胞介导的直接肿瘤细胞裂解。阿维单抗联合阿昔替尼(axitinib)在美国被推荐用于晚期肾细胞癌 (rcc)患者的一线治疗。美国食品和药品监督管理局(fda)还加速批准阿维单抗用于治疗(i)患有转移
性梅克尔细胞癌(mmcc)的12岁及以上的成人和儿科患者和(ii)患有局部晚期或转移性尿路上皮癌(muc)的患者,这些患者在含铂化疗期间或之后具有疾病进展,或在含铂化疗的新辅助或辅助治疗12个月内具有疾病进展。
17.阿维单抗在癌症患者中显示出可接受的安全性。阿维单抗的警告信息和预防措施包括免疫介导的不良反应(如肺炎和肝炎[包括致命性病例]、结肠炎、内分泌疾病、肾炎和肾功能障碍以及其他不良反应[可能是严重的,以及包括致命病例])、输注相关反应、主要心血管不良事件(mace)、和胚胎-胎儿毒性。
[0018]
目前正在进行阿维单抗治疗hpv-阳性的癌症,如scchn的临床试验,但在该阶段尚未公布结果。
[0019]
尽管在癌前病变中使用tg4001或在癌症中单独使用抗pd-l1抗体获得了结果,但仍然高度需要新的治疗方法来提高抗肿瘤疗效和应答者的比例。因此,仍然需要开发新的治疗方法来治疗癌症。特别地,存在治疗癌症的方法的需要,该方法提高(a)编码至少人乳头瘤病毒(hpv)e6和e7多肽以及免疫刺激性细胞因子的痘病毒载体或(b)抗 pd-l1抗体在一种或多种类型的癌症中的效力。本发明提供了用于治疗hpv-阳性的癌症的组合产品,以满足上述需要。
[0020]
已经提出免疫检查点抑制剂(包括抗pd-l1抗体)与许多其他类型的抗癌疗法(包括基于疫苗,如痘病毒载体的免疫疗法)组合。在大多数情况下,实验是在不涉及hpv感染的癌症动物模型中进行的,并且没有对所测试组合的毒性进行具体分析(wo2016/128542、wo 2015/175334、wo 2015/069571、remy-ziller et al.,hum vaccinimmunother.(2018)14(1):140-145)。两项ii期临床试验(nct03353675和nct02823990),联合tg4010(编码muc1和白细胞介素-2的mva载体)和纳武利尤单抗(nivolumab,抗 pd-1抗体)治疗非小细胞肺癌(nscll)仍在进行(oliveres h.et al.,j thorac dis.(2018) 10(suppl 13):s1602-s1614),但试验结果尚未公开。
[0021]
在hpv-阳性的癌症的背景下,也提出了旨在刺激针对hpv抗原的免疫应答的各种疫苗(包括病毒疫苗)和免疫检查点抑制剂的组合(gildener-leapman et al.,oral oncol. (2014)50(9):780-4;wo 2015/103602;rice et al.,cancer gene ther.(2015)22(9):454-62; wo 2016/071306;us 2017/051019;us 2019/142933)。迄今为止,还没有公开的实验数据显示编码hpv抗原的病毒疫苗和抗pd-l1抗体的组合对hpv-阳性的癌症的可接受的毒性和提高的治疗效率。报道了一项正在进行的ib/ii期临床试验(nct03260023),其将 tg4001和阿维单抗组合用于治疗hpv-阳性的scchn(lin et al.,front oncol.(2018)8: 532),但试验结果尚未公开。
技术实现要素:
[0022]
在本发明的背景下,发明人惊讶地发现,在hpv-阳性的癌症患者中使用特定的施用方案,将编码至少人乳头瘤病毒(hpv)e6和e7多肽和免疫刺激性细胞因子的痘病毒载体(优选tg4001)以及抗pd-l1抗体或其抗原结合片段(优选阿维单抗)组合,导致可接受的毒性和增强对hpv e6和e7多肽的免疫应答。特别是,尽管阿维单抗和tg4001(活载体)都具有免疫刺激性作用,但没有观察到两种产品之间的相互作用导致不可接受的毒性,这是无法合理预期的。特别地,鉴于两种产品的免疫刺激性作用,可能导致不可接受的毒性的两种产
品之间的相互作用存在风险,尤其是鉴于美国食品和药品监督管理局(fda)在一名患者死于不良事件并发症后,临床暂停了一项将李斯特菌疫苗与抗 pd-l1抗体结合的研究(nct02291055)。该病例表明,疫苗(另一种活载体)可能放大了免疫检查点抑制剂的已知副作用。此外,组合观察到了有希望的有益免疫变化(包括诱导对hpv e6和e7多肽的免疫应答、在循环和肿瘤组织中cd8 t细胞增加和cd4 t调节细胞减少,以及与“热性”而不是“冷性”肿瘤特性相关的基因上调,并具有更好的预后),这些都是单独治疗从未观察到的。
[0023]
增强可能是累积的增强,或者可能是协同性的增强。组合疗法的增强作用至少是累积的。本发明人惊奇地发现:(a)编码至少人乳头瘤病毒(hpv)e6和e7多肽和免疫刺激性细胞因子的痘病毒载体以及(b)抗pd-l1抗体的组合导致治疗的改善。临床试验的初步结果表明,该组合疗法在治疗癌症如复发/转移性hpv16阳性的癌症方面是有效的(参见实施例1),并且该组合疗法耐受性良好(参见实施例1)。此外,观察到可归因于所述组合的两种治疗中的每一种的效果(参见实施例1),其显示出所述组合疗法的至少一种累积的增强效果。
[0024]
因此,本发明涉及下述的组合:
[0025]
a)编码至少人乳头瘤病毒(hpv)e6和e7多肽和免疫刺激性细胞因子的痘病毒载体,和
[0026]
b)抗pd-l1抗体或其抗原结合片段,
[0027]
其用于hpv-阳性的癌症或hpv-阳性的癌前上皮内病变的治疗,
[0028]
其中在所述抗pd-l1抗体第一次施用的前5至10天进行所述痘病毒的第一次施用,以及进行所述痘病毒和抗pd-l1抗体的后续施用。
[0029]
本发明还涉及一种用于治疗有需要的对象中的hpv-阳性的癌症或hpv-阳性的癌前上皮内病变的方法,其包括对所述对象施用下述组合:
[0030]
a)至少编码人乳头瘤病毒(hpv)e6和e7多肽和免疫刺激性细胞因子的痘病毒载体,和
[0031]
b)抗pd-l1抗体或其抗原结合片段,
[0032]
其中在所述抗pd-l1抗体第一次施用的前5至10天进行所述痘病毒的第一次施用,以及进行所述痘病毒和抗pd-l1抗体的后续施用。
[0033]
本发明还涉及下述组合:
[0034]
a)至少编码人乳头瘤病毒(hpv)e6和e7多肽和免疫刺激性细胞因子的痘病毒载体,和
[0035]
b)抗pd-l1抗体或其抗原结合片段,
[0036]
在制备用于治疗hpv-阳性的癌症或hpv-阳性的癌前上皮内病变的药物的中的用途,
[0037]
其中在所述抗pd-l1抗体第一次施用前5至10天进行所述痘病毒的第一次施用,以及进行所述痘病毒和抗pd-l1抗体的后续施用。
[0038]
本发明还涉及下述组合:
[0039]
a)编码至少人乳头瘤病毒(hpv)e6和e7多肽和免疫刺激性细胞因子的痘病毒载体,和
[0040]
b)抗pd-l1抗体或其抗原结合片段,
[0041]
用于hpv-阳性的癌症或hpv-阳性的癌前上皮内病变的治疗的用途,
[0042]
其中在所述抗pd-l1抗体第一次施用前5至10天进行所述痘病毒的第一次施用,以及进行所述痘病毒和抗pd-l1抗体的后续施用。
[0043]
在所述组合、方法或用途中,所述痘病毒优选为痘苗病毒,更优选为修饰的安卡拉痘苗病毒(mva),并优选编码膜锚定的hpv(优选hpv-16)非致癌e6和e7多肽以及人白细胞介素2(il-2)。最优选地,所述痘病毒是编码膜锚定的hpv-16非致癌e6和e7 多肽以及人il-2的mva病毒。给对象施用的痘病毒每次剂量优选为3
×
10
7-7
×
107pfu,更优选约5
×
107pfu。向对象施用的痘病毒每次剂量优选地被皮下施用。
[0044]
在所述组合、方法或用途中,所述抗pd-l1抗体或其抗原结合片段优选介导抗体依赖性细胞介导的细胞毒性作用(adcc)。在结构上,所述抗pd-l1抗体或其抗原结合片段优选包含重链和轻链,所述重链包含具有seq id no:1、2和3的氨基酸序列的三个互补决定区,所述轻链包含具有seq id no:4、5和6的氨基酸序列的三个互补决定区。更优选地,所述抗pd-l1抗体包含具有seq id no:7或8的氨基酸序列的重链和具有seq id no:9的氨基酸序列的轻链。最优选地,所述抗pd-l1抗体是阿维单抗。所述抗pd-l1抗体或其抗原结合片段的每次剂量优选地为约10mg/kg或约800mg。所述抗pd-l1抗体或其抗原结合片段的每次剂量优选地被静脉内施用,更优选地通过静脉输注。
[0045]
靶向治疗用途是hpv-阳性的癌症的治疗,优选hpv-阳性的口咽癌、宫颈癌、阴道癌、肛门癌、外阴癌、阴茎癌、粘膜癌或非黑色素瘤皮肤癌,或hpv-阳性的癌前上皮内病变的治疗。所述癌或癌前上皮内病变优选为hpv-16阳性,且所述癌可明显为hpv-16阳性的头颈部鳞状细胞癌(hpv-16 scchn)。靶向的癌症进一步优选为复发性和/或转移性hpv-阳性的癌症(优选为复发性和/或转移性hpv16阳性的癌症,最优选为复发性和/或转移性hpv16阳性的scchn)。
[0046]
(a)至少编码人乳头瘤病毒(hpv)e6和e7多肽和免疫刺激性细胞因子的痘病毒载体,和(b)抗pd-l1抗体的组合可以以单个或分开的单位剂型提供。根据特定施用方案施用组合,所述方案包括在所述抗pd-l1抗体第一次施用前5至10天进行所述痘病毒的第一次施用,以及所述痘病毒和抗pd-l1抗体的后续施用。优选地,所述痘病毒和抗 pd-l1抗体的所述后续施用一直进行到疾病进展。更优选地,所述组合以以下施用方案来施用:
[0047]
a)皮下施用3
×
10
7-7
×
107pfu的第一剂量的所述痘病毒,以及随后皮下后续施用 3
×
10
7-7
×
107pfu剂量的痘病毒直至疾病进展:
[0048]
以周为单位连续6周,
[0049]
每2周一次,直至第6个月,和
[0050]
每12周,用于下一次痘病毒剂量;
[0051]
b)在第一次痘病毒剂量后5至10天静脉内施用约10mg/kg或约800mg第一剂量的抗pd-l1抗体,以及随后每2周静脉内施用约10mg/kg或约800mg后续剂量的抗 pd-l1抗体直至疾病进展。
[0052]
根据本发明的特别优选的实施方案如下:
[0053]
a)所述痘病毒是mva病毒,其编码膜锚定的hpv-16非致癌e6和e7多肽以及人 il-2,
[0054]
b)所述抗pd-l1抗体是阿维单抗,并且
[0055]
c)所述痘病毒和抗pd-l1抗体以以下施用方案施用:
[0056]
i)将编码膜锚定的hpv-16非致癌性e6和e7多肽以及人il-2的所述mva病毒以5
×
107pfu的剂量每周一次皮下施用6周,然后每2周施用1次直至第6个月,以及此后每12周施用一次直至疾病进展,
[0057]
ii)从第8天开始,每2周以约10mg/kg或约800mg的剂量通过静脉内输注施用阿维单抗,直至疾病进展。
[0058]
根据本发明所述的组合、方法或用途优选地诱导针对所治疗的对象的癌症或癌前病变的阳性免疫应答。值得注意的是,在循环中,根据本发明用于所述用途的组合物优选地:
[0059]
增加循环hpv e6和/或e7多肽特异性cd8和/或cd4 t细胞的比率,和/或
[0060]
减少循环调节性t细胞的比率。
[0061]
类似地,在肿瘤组织中,根据本发明所述的组合、方法或用途优选地:
[0062]
增加hpv e6和/或e7多肽特异性cd8和/或cd4 t细胞对肿瘤组织的浸润,和 /或
[0063]
减少通过调节性t细胞的肿瘤组织浸润。
[0064]
附图简述
[0065]
图1.在组合治疗期间肿瘤大小的变化。(a)肿瘤大小的最佳变化:根据实施例1 中描述的施用方案,在dl1(5
×
106pfu,纯灰)或dl2(5
×
107pfu,灰色阴影)与10mg/kg 的阿维单抗组合治疗的个体患者中,第43天从基线(从计算的总和)的变化%,根据 recist v1.1的部分反应(pr)由*表示。(b)个体纵向变化:呈现了在各个时间点根据实施例1中描述的施用方案,通过dl1(5
×
106pfu,虚线)或dl2(5
×
107pfu,实线)的tg4001 与10mg/kg的阿维单抗的组合治疗的个体患者中从基线(从计算的总和)的变化%。显示了进行性疾病的阈值(pd:≥20%)、病情稳定(-30%<sd< 20%)、部分反应(pr:≤-30%)。还显示了每位患者的hpv-16阳性的癌症的类型。
[0066]
图2.组合治疗刺激t细胞免疫。在基线和第43天,基于个体患者中肿瘤ffpe样品的免疫组织化学(ihc)染色,肿瘤免疫浸润的cd8/cd3比率(a)或treg(cd4 foxp3)/cd8比率(b)。
[0067]
图3.治疗期间肿瘤组织中基因表达的变化的分析。在基线和治疗后(第43天)评估了一组770个与免疫应答相关的基因的表达。治疗后vs.治疗前的t细胞活化(a)、细胞毒性细胞(b)、病原体防御(c)和nk细胞功能(d)基因表达的变化的火山图。在每个火山图中,黑点对应于所示类别的基因。
[0068]
图4.治疗期间肿瘤组织中基因表达的变化的分析。(a)基因类别的呈现包括在先前描述为15和21(galon et al.,immunity(2013)39(1):11-26; marabelle et al.,society for immunotherapy of cancer(sitc)32
nd annual meeting& pre-conference programs(sitc 2017)on november 8-12,2017at the gaylord nationalhotel&convention center in national harbor,maryland.poster p250)的基因标签中。(b) 15(b)和21(c)基因的火山变化图。在每个火山图中,黑点对应于所示标签的基因。
[0069]
图5.患者0101006中免疫浸润的变化。(a)在基线和第43天,肿瘤免疫浸润中的 cd3、cd8或cd4 foxp3 t细胞/mm2。(b).在表达pd-l1的细胞附近的cd8 t细胞的百分比,取决于表达pd-l1的细胞和cd8 t细胞之间的以μm计的距离。
[0070]
图6.患者0101006治疗过程中肿瘤组织基因表达的变化的分析。与抗原加工和提呈相关的基因表达(a)、与病毒防御应答相关的基因表达(b)、toll样受体表达(c)和21基因表达(d)。
[0071]
图7.疾病/病人特征对客观缓解率(objective response rate,orr)的影响。针对每个特征给出了比值比(odds ratio,or)、95%置信区间和p值。生殖器=外阴/阴道。or大于 1表示该特征的存在与较差的orr相关联,而or小于1表示该特征的存在与较好的 orr相关联。p值《0.05表示该特征与较差或较好的orr显著相关。仅发现一个特征(存在肝转移)与更差的orr(方框)显著相关。
[0072]
图8.疾病/患者特征对无进展生存期(pfs)的影响。针对每个特征给出了风险比(hazard ratio,hr)、95%置信区间和p值,生殖器=外阴/阴道。大于1的hr表示该特性的存在与较差的pfs相关联,而小于1的hr表示该特性的存在与较好的pfs相关联。 p值《0.05表明该特征与与较差或较好的pfs显著相关。发现两个特征(存在肝转移和肛门癌)与较差的pfs显著相关,而发现一个特征(涉及淋巴结)与较好的pfs显著相关(所有三个特征都方框表示)。
[0073]
图9.从ib期和ii期的合并期,23例没有肝转移的患者中肿瘤大小的最佳变化:根据实施例1所述的施用方案,在通过dl2(5
×
107pfu)的tg4001与10mg/kg的阿维单抗的组合治疗的个体患者中,从基线(从计算的总和)的最佳变化%,进行性疾病(pd)以黑色表示,稳定疾病(sd)以浅灰色表示,部分反应(pr)以深灰色表示,以及完全反应(cr) 以中灰色表示。
[0074]
图10.从ib期和ii期的合并期,9例肝转移患者中肿瘤大小的最佳变化:根据实施例1所述的施用方案,在通过dl2(5
×
107pfu)的tg4001与10mg/kg的阿维单抗的组合治疗的个体患者中,从基线(从计算的总和)的最佳变化%,进行性疾病(pd)以黑色表示,并且稳定疾病(sd)以浅灰色表示。
[0075]
图11.火山图显示了基线(就诊)群体中线性模型的yes vs no(肝损害)vs p值的倍数变化。命名了最高差异表达的基因。
[0076]
发明详述
[0077]
一般定义
[0078]
除非上下文另有规定,否则术语“一(a)”和“一个(an)”在整个申请中自始至终以其意指“至少一个”、“至少第一”、“一个或多个”或“多个”所提及的化合物或步骤的意义使用。因此,该术语既包括仅一个所提及的化合物或步骤的情况,也包括不止一个所提及的化合物或步骤的情况。
[0079]
此处可互换使用的术语“大约”或“近似”是指在给定值或范围的5%,优选在4%内,更优选在2%内。在本公开的上下文中,每次用“大约x”来表示近似值x时,其中该值等于x的实施方案也涵盖在本发明的上下文中。
[0080]
在此使用的术语“和/或”包括“和”、“或”和“由所述术语连接的所有或任何其他元素的组合”的含义。例如,“复发和/或转移”是指复发,或转移,或复发和转移两者。
[0081]
本文所用术语“组合”是指两个或更多实体(例如至少本文所述的痘病毒和抗pd-l1 抗体)的任何可能的排列。特别地,“组合”可以指(i)由两种或两种以上经物理、化学或其他方式组合或混合并作为单一实体生产的规定的组分组成的产品;(ii)两个或两个以上
是指两个多肽或核酸序列之间的氨基酸与氨基酸或核苷酸与核苷酸的对应关系。两个序列之间的相同性百分比取决于序列所共有的相同位置的数目,同时考虑到为了最佳全局比对(即两个全长序列的最佳比对)而需要引入的间隙的数目和每个间隙的长度。本领域可使用各种计算机程序和数学算法来确定氨基酸或核酸序列之间的相同性百分比。
[0085]
术语“核酸”、“核酸分子”、“多核苷酸”和“核苷酸序列”可互换使用,并且定义为任何长度的多聚脱氧核糖核苷酸(dna)(例如cdna、基因组dna、质粒、载体、病毒基因组、分离的dna、探针、引物及其任何混合物)或多聚核糖核苷酸(rna)(例如mrna、反义rna、sirna)或混合的多聚核糖-多聚脱氧核糖核苷酸的聚合物。它们涵盖单链或双链、线性或环状、天然或合成、修饰或未修饰的多核苷酸。此外,多核苷酸可包含非天然存在的核苷酸,并且可被非核苷酸组分中断。
[0086]
术语“多肽”、“肽”和“蛋白质”是指氨基酸残基的聚合物,其包含至少九个或更多通过肽键结合的氨基酸。聚合物可以是直链的、支链的或环状的,并且可以包括天然存在的和/或氨基酸类似物,并且它可以被非氨基酸打断。一般而言,如果氨基酸聚合物大于 50个氨基酸残基,则优选称为多肽或蛋白质,而如果其长度为50个氨基酸或更短,则称为“肽”。
[0087]
术语“对象”通常指需要本发明的任何产品和方法或本发明的任何产品和方法对其有益的生物体。通常,所述生物体是哺乳动物。优选地,对象是已经被诊断为患有病理状况或处于患有病理状况的风险中的人,所述病理状况例如是由病原生物体引起或与病原生物体相关的传染病或增殖性疾病(例如癌症)。当涉及人类生物体时,术语“对象”和“患者”可以互换使用,并且涵盖男性和女性。待治疗的对象可以是新生儿、婴儿、年轻人或成人。
[0088]
本技术中所用术语“治疗”和“疗法”是指一组卫生的、药理学的、外科的和/或物理的手段,具有治愈和/或减轻疾病和/或症状的目的,以便治疗健康问题。术语“治疗”和“疗法”包括预防性和治疗性方法,因为二者都针对个体或动物健康的维持和/或恢复。无论症状、疾病和障碍的起源如何,施用合适的药物以减轻和/或治愈健康问题应当解释为本技术的上下文中的治疗或疗法的形式。
[0089]
痘病毒载体
[0090]
根据本发明的组合、方法或用途包含编码至少人乳头瘤病毒(hpv)e6和e7多肽和免疫刺激性细胞因子的痘病毒载体作为第一组分。
[0091]
因此,术语“痘病毒载体”或“痘病毒的载体”应广义理解为包括核酸载体(例如dna 痘病毒载体),其包括痘病毒基因组的至少一个元件且可包装到痘病毒颗粒以及由其产生的痘病毒颗粒中。术语“痘病毒”、“痘病毒粒子(poxvirions)”、“痘病毒颗粒(poxviral particles)”和“痘病毒载体粒子(poxviral vector particle)”可互换使用,是指当根据允许产生痘病毒颗粒的合适条件将核酸载体转导至合适的细胞或细胞系时形成的痘病毒颗粒。术语“感染性”是指痘病毒载体感染并进入宿主细胞或对象的能力。痘病毒载体可以是有复制能力的或复制选择性的(例如,经改造以在特定宿主细胞中更好或选择性地复制),或者可以是遗传上无法复制的或复制缺陷的。
[0092]
痘病毒类型
[0093]
本文所用术语“痘病毒”是指属于痘病毒科的病毒,优选脊椎动物宿主的脊椎动物痘病毒(chordopoxvirinae)亚科,其包括若干属,例如正痘病毒属(orthopoxvirus)、羊痘病毒属(capripoxvirus)、禽痘病毒属(avipoxvirus)、副痘病毒属(parapoxvirus)、兔痘病
毒属 (leporipoxvirus)和猪痘病毒属(suipoxvirus)。在本发明的上下文中优选正痘病毒属以及禽痘病毒属,包括金丝雀痘病毒(canarypoxvirus,例如alvac)和鸡痘病毒(fowlpoxvirus,例如fp9载体)。
[0094]
在本发明的组合、方法或用途的优选实施方案中,痘病毒属于正痘病毒属,以及更优选属于痘苗病毒(vv)种。痘苗病毒是具有长度约为200kb的线性双链dna基因组的大的、复杂的、有包膜病毒,其编码多种病毒酶和因子,使得病毒能够独立于宿主细胞机制复制。存在两种不同的感染性病毒颗粒,即由保留在受感染细胞的胞质溶胶中直到裂解的单个脂质包膜包围的胞内imv(对于胞内成熟病毒体)和从受感染细胞出芽的双包膜eev(对于胞外有包膜病毒体)。
[0095]
在本发明的上下文中,特别合适的痘病毒是mva(修饰的安卡拉痘病毒),这是由于其高度减毒的表型,与未减毒的载体相比,感染后产生更显著的ifn-1型应答,以及其基因组序列的可用性(参见例如genbank登录号u94848)。
[0096]
hpv e6和e7多肽
[0097]
根据本发明所述的组合、方法或用途的痘病毒(优选vv,更优选mva)编码至少人乳头瘤病毒(hpv)e6和e7多肽以及免疫刺激性细胞因子。
[0098]
目前已鉴定出超过100种hpv基因型,根据其致癌潜力分为“低风险”(lr)和“高风险”(hr)血清型。lr-hpv在受感染的对象中引起良性肿瘤,而hr-hpv具有恶性进展的高风险。hr hpv基因型的e6和e7编码的基因产物可能是通过这些病毒蛋白分别与细胞肿瘤抑制基因产物p53和视网膜母细胞瘤(rb)结合,从而涉及感染细胞的致癌转化 (综述参见howley,1996,papillomaviruses and their replication,p 2045-2076.in b.n.fields, d.m.knipe and p.m.howley(ed),virology,3
rd ed.lippincott-raven press,new york, n.y.)。与天然hpv-16 e6多肽和p53结合有关的氨基酸残基已从第118-122残基清楚地定义( 1为第一met残基或从优选使用的第二met残基开始的第111-115残基)(crook etal.,cell(1991)67,547-556),与天然hpv-16 e7多肽和rb结合有关的氨基酸残基位于第21-26残基(heck et al.,proc.natl.acad.sci.usa(1992)89,4442-4446)。
[0099]
在本发明的上下文中,所述痘病毒(优选vv,更优选mva)优选编码hr-hpv的至少e6和e7多肽,优选选自hpv-16、hpv-18、hpv-30、hpv-31、hpv-33、hpv-35、 hpv-39、hpv-45、hpv-51、hpv-52、hpv-56、hpv-58、hpv-59、hpv-66、hpv-68、 hpv-70和hpv-85,更优选选自hpv-16和hpv-18,以及最优选所述hr-hpv是hpv-16。
[0100]
乳头瘤病毒的来源包括但不限于生物样品(例如从已经暴露于乳头瘤病毒的对象收集的生物样品、组织切片、活检标本和组织培养物)、培养的细胞(例如atcc可获得的 caski细胞)以及保藏机构可获得的、商品目录或文献中描述的重组材料。许多乳头瘤病毒基因组的核苷酸序列和编码多肽的氨基酸序列已经在文献中描述,并且可以在专门的数据库例如genbank中获得。关于一般信息,在genbank中描述的hpv-16基因组的登录号在nc_01526和k02718下;hpv-18在nc_001357和x05015下;hpv-31在j04353 下;hpv-33在m12732下;hpv-35在nc_001529下;hpv-39在nc_001535下;hpv-45 在x74479下;hpv-51在nc_001533下;hpv-52在nc_001592下;hpv-56在x74483 下;hpv-58在d90400下;hpv-59在nc_001635下;hpv-68在x67160和m73258 下;hpv-70在u21941下;和hpv-85在af131950下。
[0101]
为了说明,天然hpv-16 e6和e7多肽的氨基酸序列分别示于seq id no:10-11。
[0102]
如上文结合术语“多肽”所定义的,“乳头瘤病毒多肽”涵盖天然的、修饰的乳头瘤病毒多肽及其肽。特别地,本发明涵盖天然hpv e6和e7多肽及其类似物(例如,其片段如肽;和经修饰的那些)的使用/表达,特别是当天然多肽发挥不希望的性质(例如,致癌或转化性质、细胞毒性作用等)时。例如,为了避免hpv e6和e7多肽的致癌性,可以使用或表达非致癌类似物,其分别显示与p53和rb降低的结合的能力。
[0103]
用于本发明的合适的e6多肽涵盖在与细胞肿瘤抑制基因产物p53的结合中有缺陷的非致癌突变体。本领域中描述了非致癌e6多肽的代表性实例(参见例如wo1999/03885)。本文中优选的修饰包括在hpv-16 e6中缺失位于约118位至约122位的一个或多个氨基酸残基( 1代表天然hpv-16 e6多肽的第一个甲硫氨酸残基),特别优选在 hpv-16 e6中缺失118至122位的残基(cpeek)(参见例如seq id no:12)或在hpv-18e6中缺失113至117位的残基(npaek)。
[0104]
用于本发明的合适的e7多肽涵盖在与细胞肿瘤抑制基因产物rb的结合中有缺陷的非致癌突变体。本领域中描述了非致癌性e7多肽的代表性实例(参见例如wo1999/03885)。本文中优选的修饰包括在hpv-16 e7中缺失位于约21位至约26位的一个或多个氨基酸残基( 1代表天然hpv-16 e7多肽的第一氨基酸),特别优选在hpv-16 e7 中缺失21位至26位残基(dlycye)(参见例如seq id no:13)或在hpv-18 e7中缺失24 位至28位残基(dllch)。
[0105]
用于本发明的hpv(优选hpv-16)e6和/或e7多肽可以进一步修饰为膜锚定的,增强多肽在表达宿主细胞表面的高效膜呈递。这可以通过将hpv(优选hpv-16)e6和/或 e7多肽与信号肽和膜锚定肽融合来实现。此类肽是本领域已知的。简单地说,信号肽通常存在于膜上展示的或分泌的多肽的n-末端,并启动它们进入内质网(er)。它们包含 15至35个基本上疏水的氨基酸,然后通过位于er的特异性内肽酶将其去除以产生成熟多肽。膜锚定肽通常在性质上是高度疏水性的,并用于锚定细胞膜中的多肽(例如参见branden and tooze,1991,in introduction to protein structure p.202-214,ny garland)。可用于本发明的上下文的信号肽和膜锚定肽有众多选择。它们可以独立地从任何分泌的或膜锚定的多肽(例如细胞多肽或病毒多肽)获得,例如狂犬病糖蛋白、hiv病毒包膜糖蛋白或麻疹病毒f蛋白,或者可以是合成的。信号肽优选的插入位点是翻译起始密码子的n-末端下游,以及膜锚定肽的插入位点是c-末端,例如终止密码子紧接的上游。如果需要,可以使用连接肽将信号肽和/或膜锚定肽与编码的多肽连接。
[0106]
根据本发明的组合治疗的痘病毒优选地编码hpv(优选hpv-16)膜锚定的和非致癌的e6和e7多肽以及人白细胞介素2(il-2)。
[0107]
在一个特别优选的实施方案中,由本发明所述的组合的痘病毒(优选vv,更优选 mva)编码的hpv e6多肽是hpv-16 e6的膜锚定的和非致癌的变体,其中在hpv-16 e6 中缺失残基118至122(cpeek),特别是氨基酸序列seq id no:12的hpv-16 e6变体。在另一个特别优选的实施方案中,本发明的用于所述用途的组合的痘病毒(优选vv,更优选mva)编码的hpv e7多肽是hpv-16 e7的膜锚定的和非致癌的变体,其中在 hpv-16 e7中缺失21至26位残基(dlyc),特别是氨基酸序列seq id no:13的hpv-16e7变体。在一个特别优选的实施方案中,本发明的用于所述用途的组合的痘病毒(优选 vv,更优选mva)编码的hpv e6多肽是hpv-16 e6的膜锚定的和非致癌的变体,其中在hpv-16 e6中缺失118至122位残基(cpeek),
特别是氨基酸序列seq id no:12的 hpv-16 e6变体,并且本发明的用于所述用途的组合的痘病毒(优选vv,更优选mva) 编码的hpv e7多肽是hpv-16 e7的膜锚定的和非致癌的变体,其中hpv-16 e7中缺失 21至26位残基(dlycye),尤其是氨基酸序列seq id no:13的hpv-16 e7变体。
[0108]
用于驱动由本发明所述的组合、方法或用途中包含的痘病毒载体编码的至少人乳头瘤病毒(hpv)e6和e7多肽和免疫刺激性细胞因子的表达的合适启动子优选是痘病毒启动子,例如痘苗病毒启动子7.5k、h5r、tk、p.28、p.11或k1l。合成启动子以及晚期启动子和早期启动子之间的嵌合启动子也是合适的。这种启动子是本领域公知的。优选地,hpv e6和e7多肽的表达都置于牛痘p7.5启动子的控制下,并将免疫刺激性细胞因子(例如人il-2)的表达置于牛痘ph5r启动子的控制下。
[0109]
免疫刺激性细胞因子
[0110]
除了至少人乳头瘤病毒(hpv)e6和e7多肽(优选上述多肽)之外,根据本发明所述的组合、方法或用途的痘病毒(优选vv,更优选mva)还编码免疫刺激性细胞因子。
[0111]
本文所用术语“免疫刺激性细胞因子”是指具有以特异性或非特异性方式刺激免疫系统的能力的细胞因子。本领域已知大量细胞因子具有发挥免疫刺激性作用的能力。本发明中合适的免疫刺激性细胞因子的实例包括但不限于白细胞介素(例如,il-2、il-6、 il-12、il-15、il-24)、趋化因子(例如,cxcl10、cxcl9、cxcl11)、干扰素(例如, ifnα、ifnβ、ifnγ)、肿瘤坏死因子(tnf)、细胞集落刺激因子(例如gm-csf、c-csf、 m-csf)、生长因子(转化生长因子tgf、成纤维细胞生长因子fgf、血管内皮生长因子 vegf等)。优选地,免疫刺激性细胞因子是白细胞介素或细胞集落刺激因子(例如 gm-csf)。更优选地,免疫刺激性细胞因子是白细胞介素2(il-2),最优选的是人il-2。
[0112]
优选的痘病毒
[0113]
根据本发明所述的组合、方法或用途的优选的痘病毒是编码膜锚定的非致癌 hpv-16 e6和e7多肽和人il-2的mva病毒,更优选以tg4001为代表,如wo 1999/03885中以其研究名称mvatg8042描述的。
[0114]
抗pd-l1抗体或其抗原结合片段
[0115]
根据本发明所述的组合、方法或用途包含作为第二组分的抗pd-l1抗体或其抗原结合片段。
[0116]
抗体或其抗原结合片段
[0117]
术语“抗体”是指能够通过位于免疫球蛋白分子可变区的至少一个抗原识别位点与抗原如碳水化合物、多核苷酸、脂类、多肽等特异性结合的免疫球蛋白分子。在本发明的上下文中,“抗体”(或“ab”)以最广义使用,并涵盖天然产生的抗体以及那些由人工程化的抗体,包括能够结合抗原如pd-l1(因此保留抗原结合部分)的全长抗体或其功能性片段或其类似物。本发明中使用的抗体可以是任何来源的,例如人、人源化的、动物的 (例如啮齿动物或骆驼的抗体)或嵌合抗体。它可以是任何同种型的(例如,igg1、igg2、 igg3、igg4、igm等)。此外,它可以是糖基化的或非糖基化的。术语抗体还包括双特异性或多特异性抗体,只要它们表现出对抗原如pd-l1的结合特异性。本文所用术语“抗体”不仅涵盖完整的多克隆或单克隆抗体,而且,除非另有说明,还涵盖与完整抗体竞争特异性结合的任何抗原结合片段或其抗体片段,包含抗原结合部分的融合蛋白(例如,抗体-药物缀合物),包括抗原
识别位点的免疫球蛋白分子的任何其他修饰的构型,具有多表位特异性的抗体组合物,以及多特异性抗体(例如,双特异性抗体)。然而,优选完整的,即非片段化的单克隆抗体。
[0118]
为了说明目的,全长抗体是由包括两个重(h)链和两个轻(l)链通过二硫键相互连接的糖蛋白。每个重链包括重链可变区(vh)和重链恒定区(ch),其由三个ch1、ch2和 ch3结构域(任选地在ch1和ch2之间具有铰链)组成。每个轻链包含轻链可变区(vl) 和轻链恒定区,其包括一个cl结构域。每个vh和vl区域包括三个高变区域,称为互补决定区(cdr),并穿插着更保守的区域,称为框架区(fr)。每个vh和vl包含cdr 和四个fr组成,顺序如下:fr1-cdr1-fr2-cdr2-fr3-cdr3-fr4。重链和轻链的cdr 区域通常决定结合特异性。
[0119]
与本领域技术人员已知的标准相比,抗体的cdr由其重链和轻链的氨基酸序列定义。已经提出了各种确定cdr的方法,以及定义为cdr的抗体的重链或轻链可变区的氨基酸序列的部分根据选择的方法而变化。在本说明书中,所有cdr的定义符合牛津分子的abm抗体建模软件使用的abm定义(参见例如wo 2013/079174中阿维单抗的 cdr序列)。
[0120]
所述抗体可以是单克隆抗体、人源抗体、嵌合抗体、人源化抗体和/或人抗体,并且可以包括人恒定区。抗体的恒定区域可以被改变,例如,被突变,以修饰抗体的性质 (例如,增强或降低以下一个或多个:fc受体结合、抗体糖基化、半胱氨酸残基的数量、效应细胞功能或补体功能)。
[0121]
在本发明的上下文中,优选使用单克隆抗体。如本文所用,“单克隆抗体”是指包含具有相同和独特抗原特异性的抗体分子的组合物。存在于组合物中的抗体分子可能在其翻译后修饰方面发生变化,以及特别是在其糖基化结构或等电点方面发生变化,但都由相同的重链和轻链序列编码,并因此在任何翻译后修饰之前具有相同的蛋白质序列。与翻译后修饰(例如重链c-末端赖氨酸的断裂、天冬酰胺残基的脱酰胺化和/或天冬氨酸残基的异构化)有关的蛋白质序列中的某些差异可以仍然存在于组合物中存在的各种抗体分子之间。单克隆抗体可以通过杂交瘤技术或通过不使用杂交瘤技术的方法(例如重组方法)制备。人单克隆抗体可以用携带人免疫球蛋白基因的转基因小鼠而不是小鼠系统产生。用感兴趣的抗原免疫的这些转基因小鼠的脾细胞被用来生产杂交瘤,其分泌对人类蛋白质表位具有特异性亲和力的人类mab。
[0122]
对于人类对象的治疗(这是本发明的优选实施方案),抗pd-l1抗体将优选地是嵌合的、人源化的或全人的,从而限制或防止针对抗pd-l1抗体的非人部分的免疫应答。抗体可以是其中可变区或其一部分例如cdr在非人生物体例如大鼠或小鼠中产生的抗体。嵌合的、cdr移植的和人源化的抗体均在本发明范围内。在非人生物体,例如大鼠或小鼠中产生的抗体,并然后进行修饰,例如在可变框架或恒定区域中,以降低人体内的抗原性的这些抗体在本发明范围内。
[0123]
本文所用“嵌合抗体”是指包含一个物种的一个或多个元件和另一个物种的一个或多个元件的抗体,例如,包含人免疫球蛋白的恒定区(fc)的至少一部分的非人抗体。嵌合抗体可以通过本领域已知的重组dna技术产生。
[0124]
本文所用“人源化抗体”指的是非人(例如,小鼠、骆驼、大鼠等)抗体,其蛋白质序列已被修饰以增加其与人抗体(即,在人体内自然产生的)的相似性。抗体可以通过本领域已知的方法人源化。例如,为人类使用而开发的单克隆抗体可以通过替换fr区的一个或多个残基来人源化,以看起来像人免疫球蛋白序列,而可变区(特别是cdr)的绝大多数残基不
被修饰,并与非人免疫球蛋白的残基相对应。对于一般的指导,在每个可变区vh或vl中,fr区的这些氨基酸替换的数量通常不超过20个。在另一个示例中,人源化的或cdr移植的抗体将至少有一个或两个但通常所有三个(重和轻免疫球蛋白链的)受体cdr被供体cdr取代。所述抗体可以被非人cdr的至少一部分取代,或者仅一些cdr可以被非人cdr取代。只需替换人源化抗体与抗pd-l1结合所需的cdr数量。优选地,供体将是啮齿类抗体,例如大鼠或小鼠抗体,而受体将是人类框架或人类一致框架。通常,提供cdr的免疫球蛋白被称为“供体”,以及提供框架的免疫球蛋白被称为“受体”。在一个实施方案中,供体免疫球蛋白是非人(例如啮齿动物)免疫球蛋白。受体框架是天然存在的(例如,人类)框架或一致框架,或与之具有约85%或更高,优选 90%、95%、99%或更高相同性的序列。人源化的或cdr移植的抗体可以通过cdr移植或cdr替换来产生,其中免疫球蛋白链的一个、两个或全部cdr可以被替换。例如参见us 5,225,539,其描述了可用于制备本发明人源化抗体的cdr移植方法。
[0125]
本文所用“人抗体”是指这样的抗体,其中不仅恒定区(如嵌合抗体中的)和fr(如人源化抗体的)区域是人源的,而且重链和轻链的整个氨基酸序列来源于人种系免疫球蛋白序列。例如,这种人抗体可以从插入人种系免疫球蛋白序列的转基因动物或从人抗体文库中获得。
[0126]
任何抗体的“抗原结合片段”是指与抗原结合的完整抗体的一部分。抗原结合片段可以包含完整抗体的抗原决定可变区。所述抗原结合片段可被工程化用于本发明的组合。代表性的实例包括但不限于fab、fab'、f(ab')2、dab、fd、fv、scfv、di-scfv、双特异抗体和任何其他人工抗体。例如,任何抗pd-l1抗体的“pd-l1-结合片段”是指与抗原 pd-l1结合的完整抗体的一部分。更具体地说,在根据本发明的组合、方法或用途中可以使用全长抗pd-l1抗体的下列抗原结合片段:
[0127]
(i)fab片段表现为由vl、vh、cl和ch1结构域组成的单价片段;
[0128]
(ii)f(ab')2片段表现为包括在铰链区由至少一个二硫键连接的两个fab片段的二价片段;
[0129]
(iii)fd片段由vh和ch1结构域组成;
[0130]
(iv)fv片段由抗体单臂的vl和vh结构域组成,
[0131]
(v)dab片段由单个可变域片段(vh或vl域)组成;
[0132]
(vi)包括fv片段的两个结构域vl和vh的单链fv(scfv),这两个结构域融合在一起,任选地与接头一起形成单个蛋白质链;和
[0133]
(vii)任何其他人工抗体。
[0134]
制备抗体、片段及其类似物的方法在本领域中是已知的(例如,参见harlow and lane, 1988,antibodies
–
a laboratory manual;cold spring harbor laboratory,cold spring harborny)。在一个实施方案中,这种抗体可以用pd-l1抗原(优选人pd-l1抗原供人类使用) 在宿主动物中产生。可选地,它可以从杂交瘤(参见kohler and milstein,nature(1975)256: 495-7)、重组技术(例如使用噬菌体展示方法)、肽合成和酶切中产生。抗体片段可以通过本文所述的重组技术产生。它们也可以通过蛋白酶裂解产生,如木瓜蛋白酶产生fab 片段或胃蛋白酶产生f(ab')2片段。类似物(或其片段)可以通过常规分子生物学方法 (pcr、诱变技术)产生。如果需要,可以用与完整抗体相同的方式筛选这些片段和类似物的功能(例如,通过标准elisa分析)。
[0135]
pd-1和pd-l1
[0136]
程序性死亡1(pd-1)是免疫球蛋白(ig)基因超家族的一部分,以及cd28家族的一员。它是一种55kda的1型跨膜蛋白,在抗原刺激的细胞(如活化的b细胞、t细胞和髓系细胞)上表达。在正常情况下,它通过在炎症反应时限制t细胞的活性来保护正常组织免受破坏。pd-1的两个配体被鉴定分别为pd-l1(程序性死亡配体1)和pd-l2(程序性死亡配体2)。pd-l1在20-50%的人类癌症中被鉴别。pd-1和pd-l1之间的相互作用导致肿瘤浸润淋巴细胞减少,t细胞受体介导的增殖减少,以及通过癌细胞的免疫逃避。 pd-1的全长氨基酸序列以登录号为q15116提供于uniprotkb中。
[0137]
根据本发明的组合、方法或用途的抗pd-l1抗体优选识别人pd-l1,其附加信息(包括已知的氨基酸序列)也可在uniprotkb数据库登录号为q9nzq7中获得。
[0138]
抗pd-l1抗体的功能特性
[0139]
术语“抗pd-l1抗体”是指能够以足够的亲和力特异性结合pd-l1,从而阻断pd-l1 与pd-1的结合的抗体,并因此可用作靶向pd-l1的治疗剂(例如阿维单抗)。特别地,抗pd-l1抗体是指阻断癌细胞上表达的pd-l1与pd-1结合的抗体。
[0140]
术语“抗体依赖性细胞介导的细胞毒性作用”或“adcc”是指一种细胞毒性作用形式,其中分泌的ig结合到存在于某些细胞毒性细胞(如自然杀伤(nk)细胞、中性粒细胞和巨噬细胞)上的fc受体(fcr)上,使这些细胞毒性作用效应细胞特异性地结合到携带抗原的靶细胞,并随后用细胞毒素杀死靶细胞。抗体武装细胞毒性细胞,并需要抗体通过这种机制杀死靶细胞。介导adcc的原代细胞nk细胞仅表达fcγriii,而单核细胞表达fcγri、fcγrii和fcγriii。fc在造血细胞上的表达总结于ravetch&kinet,annu revimmunol(1991)9:457-92第464页的表3。因此,包含adcc活性fc区的抗pd-l1抗体可以通过促进癌细胞的adcc溶解来提高本疗法的疗效。本发明的组合、方法或用途的抗pd-l1抗体因此优选介导adcc。特别地,优选使用包含功能性fc区的全长抗体。 fc区可以可能被修饰(在氨基酸或糖基化水平)以进一步提高adcc能力(这种修饰特别包括本领域公知的fc中的一个或多个取代和/或减少的岩藻糖基化)。然而,这种adcc 介导的抗pd-l1抗体没有毒性或不显示毒性增加。
[0141]
抗pd-l1抗体的结构特征
[0142]
与人pd-l1结合并可用于本发明使用的组合的单克隆抗体的实例描述在wo2007/005874、wo 2010/036959、wo 2010/077634、wo 2010/089411、wo 2013/019906、 wo 2013/079174、wo 2014/100079、wo 2015/061668和us 8,552,154、us 8,779,108 和us 8,383,796中。可用作本发明的用于所述用途的组合中的pd-l1抗体的特异性抗人 pd-l1单克隆抗体包括,例如但不限于阿维单抗(msb0010718c)、德瓦鲁单抗 (med4736,在fc域中具有三重突变以去除adcc的工程化igg1κ单克隆抗体)、阿特朱单抗(atezolizumab)(mpldl3280a)、mpdl3280a(igg1工程化抗pd-l1抗体)和 bms-936559(全人、抗pd-l1、igg4单克隆抗体)。
[0143]
阿维单抗和阿特朱单抗在目前使用的抗pd-l1抗体中是独特的,因为它们是具有非突变fc区的完全人igg。因此,阿维单抗包含抗体依赖性细胞细胞毒性作用(adcc) 活性fc区,其已被证明介导adcc(boyerinas et al.,cancer immunol res.(2015) 3(10):1148-1157)。包含adcc活性fc区的抗体可以通过促进癌细胞的adcc溶解来提高本发明疗法的功效。
[0144]
在一个实施方案中,所述抗pd-l1抗体或其抗原结合片段包括重链和轻链,所述重
链包括具有seq id no:1(阿维单抗h-cdr1:syimm)、seq id no:2(阿维单抗 h-cdr2:siypsggitfyadtvkg)和seq id no:3(阿维单抗h-cdr3:iklgtvttvdy) 氨基酸序列的三个互补决定区,所述轻链包括具有seq id no:4(阿维单抗 l-cdr1:tgtssdvggynyvs)、seq id no:5(阿维单抗l-cdr2:dvsnrps)和seq id no:6(阿维单抗l-cdr3:ssytssstrv)氨基酸序列的三个互补决定区。由于已知cdr 区域特别参与抗原识别,这种抗pd-l1抗体或其抗原结合片段预期与pd-l1具有类似于阿维单抗的结合。
[0145]
在抗体产生的过程中,重链的c端赖氨酸(k)经常观察到被切断。这种修饰对抗体
ꢀ‑
抗原结合没有影响。因此,在一些优选实施方案中,抗pd-l1抗体包括具有seq id no:7 氨基酸序列的重链,其中不存在c端赖氨酸(k)(阿维单抗重链: evqllesggglvqpggslrlscaasgftfssyimmwvrqapgkglewvssiypsggit fyadtvkgrftisrdnskntlylqmnslraedtavyycariklgtvttvdywgqgtl vtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfp avlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkkvepkscdkthtcppc papellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhn aktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqp repqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsd gsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg)或具有seq idno:8氨基酸序列的重链,其中存在赖氨酸(k)(vqllesggglvqpggslrl scaasgftfssyimmwvrqapgkglewvssiypsggitfyadtvkgrftisrdnsknt lylqmnslraedtavyycariklgtvttvdywgqgtlvtvssastkgpsvfplapss kstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpss slgtqtyicnvnhkpsntkvdkkvepkscdkthtcppcpapellggpsvflfppkpkd tlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsv ltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeltknq vsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqg nvfscsvmhealhnhytqkslslspgk)和具有seq id no:9的氨基酸序列的轻链(阿维单抗轻链:qsaltqpasvsgspgqsitisctgtssdvggynyvswyqqhpgkapklmi ydvsnrpsgvsnrfsgsksgntasltisglqaedeadyycssytssstrvfgtgtkvt vlgqpkanptvtlfppsseelqankatlvclisdfypgavtvawkadgspvkagvett kpskqsnnkyaassylsltpeqwkshrsyscqvthegstvektvaptecs)。
[0146]
优选的抗pd-l1抗体
[0147]
优选地,根据本发明的用于所述用途的组合的抗pd-l1抗体是阿维单抗或与阿维单抗具有结构相似性的抗体或其抗原结合片段。在wo 2013/079174中描述了阿维单抗、其序列和其许多性质,其中,其被命名为具有根据seq id no:32和33(本文对应于seq id no:7和9)的重链和轻链序列的a09-246-2。阿维单抗发挥抗肿瘤作用的作用机制主要有两个:第一,肿瘤细胞上的pd-l1与活化t细胞上的pd-1或b7-1相互作用。这些相互作用已被证明能显著抑制t细胞的活性。因此,通过抗pd-l1阻断pd-l1与pd-1 或b7-1的相互作用,可以将t细胞从免疫抑制中释放出来,并导致t细胞对肿瘤细胞的清除。第二,与正常组织相比,肿瘤细胞在其表面上可以表达高水平的pd-l1。作为全人igg1单克隆抗体,阿维单抗具有adcc潜能。当阿维单抗与肿瘤细胞上的pd-l1 结合,并且其fc部分与白细胞上的fc-γ受体结合时,阿维单抗可以触发肿瘤定向的 adcc。
[0148]
在本发明的优选实施方案中,抗pd-l1抗体包括阿维单抗的6个cdr(seq idno:1-6),并阻断人pd-1和人pd-l1之间的相互作用。优选地,所述抗pd-l1抗体进一步介导adcc。更优选地,所述抗pd-l1抗体是igg抗体,具有igg1抗体的特异性偏好。
[0149]
在本发明更优选的实施方案中,抗pd-l1抗体包含阿维单抗的重链(seq id no:7 或8)和轻链(seq id no:9)的氨基酸序列,并阻断人pd-1和人pd-l1之间的相互作用。优选地,所述抗pd-l1抗体进一步介导adcc。更优选地,所述抗pd-l1抗体是igg 抗体,具有igg1抗体的特异性偏好。
[0150]
在本发明的最优选实施方案中,抗pd-l1抗体是阿维单抗。
[0151]
待治疗的癌症或癌前病变
[0152]
术语“癌症”是指一组疾病,其可定义为任何不具有生理功能的组织的异常恶性新生长,以及由不受控制的通常是快速的细胞增殖引起,并有可能入侵或扩散到身体的其他部分。术语“癌前病变”是指涉及异常细胞的良性病变,其中这些异常细胞与发展为癌症的风险增加有关。
[0153]
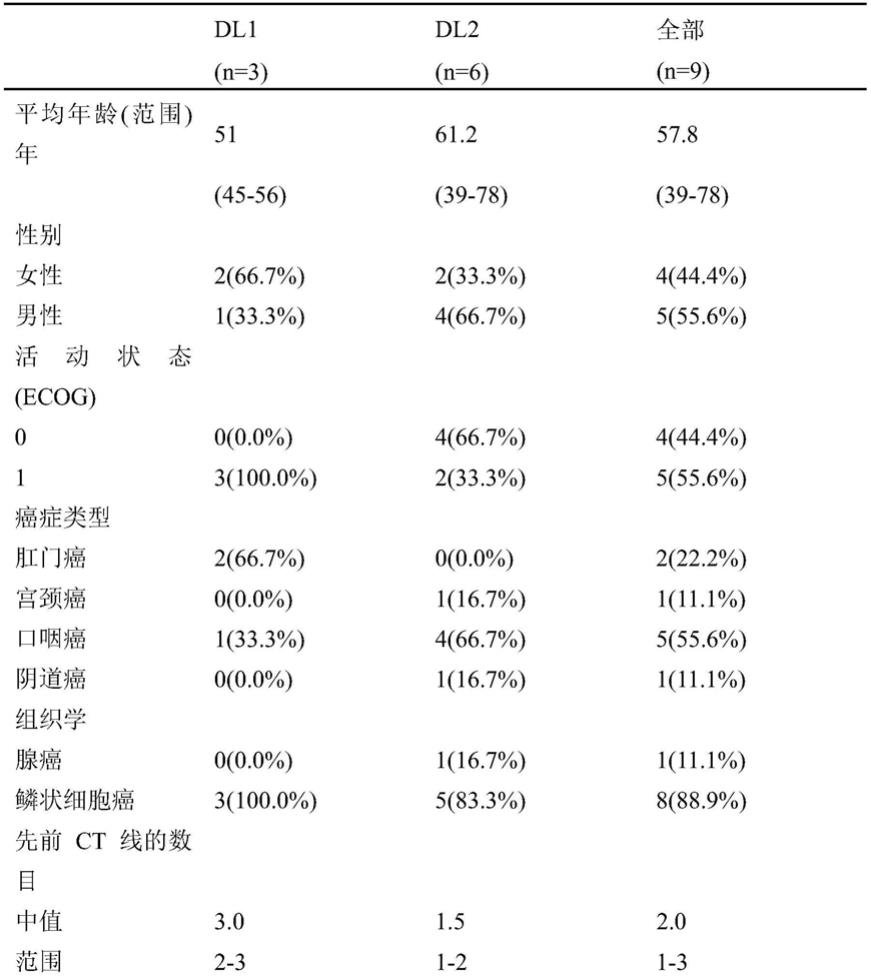
在本发明的一个方面,靶向治疗用途是hpv-阳性的癌症或癌前上皮内病变的治疗。
[0154]
如本文所用,“hpv-阳性的癌症”和“hpv-阳性的癌前上皮内病变”分别是指引起或与hpv感染相关的癌症或癌前上皮内病变,其中可以检测到hpv病毒的存在。
[0155]
hr-hpv产生2种癌蛋白e6和e7,其通过其增殖刺激活性是病毒复制所必需的,并且在恶性转化中起着关键作用。e6癌蛋白通过泛素介导的过程与p53抑癌蛋白结合并诱导其降解,从而破坏p53通路,导致细胞周期进程失控。hpv e7蛋白结合并降解视网膜母细胞瘤蛋白(prb),阻止其抑制转录因子e2f,导致细胞周期失控。此外,rb 的功能性失活导致p16蛋白的上调。p16由cdkn2a肿瘤抑制基因编码,并调节磷酸化rb的细胞周期蛋白d-cdk4/6复合物的活性,导致启动细胞周期进程的转录因子e2f 的释放。hpv-阳性肿瘤的特点是高水平p16的高表达(nevins j.r.,hum mol genet.(2001) 10(7):699-703)。
[0156]
hpv病毒的存在可以通过多种方法来检测,基于对hpv dna、hpv rna、hpv 癌蛋白的检测,或者通过寻找细胞蛋白的改变表达,如p16蛋白的过表达来间接检测。 p16蛋白可通过免疫组织化学(ihc)检测,并且由于一些研究表明口咽部肿瘤与hpv-阳性有非常高的相关性(》90%),因此其被建议是临床有用的替代标记物(mellin dahlstrandh.et al.,anticancer res.(2005)25(6c):4375-4383)。还可以通过检测(1)hpv dna,(2) 病毒e6和/或e7 mrna整合后转录,(3)病毒癌蛋白e6和e7,或(4)细胞蛋白的改变表达,如p16蛋白的过表达来确定hpv的存在(以及因此癌症或癌前上皮内病变的hpv
‑ꢀ
阳性性质)(kim et al.,j pathol clin res.(2018)4(4):213-226)。hpv dna可使用聚合酶链反应(pcr)或原位杂交(ish)进行检测。用聚合酶链反应(rt-pcr)或原位杂交(ish)可以明显检测出hpv rna。用于癌性或癌前病变的hpv状态(阳性或阴性)测定的各种试剂盒可通过市售获得,并可用于本发明的上下文中(参见kim et al.,j pathol clin res.(2018) 4(4):213-226的表1)。
[0157]
在优选的实施方案中,由于hpv-16是在hpv-阳性的癌症中检测到的主要 hr-hpv,因此通过使用hpv-16特异性引物通过pcr检测hpv-16 e7 dna来确定癌症或癌前病变的hpv状态。在更优选的实施方案中,从要通过常规方法治疗的对象的肿瘤样本(例如,固定的肿瘤样本,如甲醛或福尔马林固定的石蜡包埋(ffpe)肿瘤样本) 中提取dna,然后使用hpv-16特异性引物通过pcr扩增hpv-16 e7 dna。如果检测到扩增(例如,通过免疫荧光手段,如sybrgreen或其他),那么样本被认为是hpv-16 阳性。如果通过该方法没有检测到扩增,则使用能够扩增约50个hpv基因型的通用引物通过pcr扩增hpv e7 dna,然后用sanger测序对
扩增的序列进行测序。然后,获得的序列可以确认阴性,以识别样本质量无法获得一线pcr结果的患者,或检测基因型较少的阳性患者。
[0158]
优选的hpv-阳性的癌症包括hpv-阳性的口咽癌、宫颈癌、阴道癌、肛门癌、外阴癌、阴茎癌、粘膜癌或非黑色素瘤皮肤癌。在hpv-阳性的口咽癌中,头颈部鳞状细胞癌(scchn)是优选的。
[0159]
在ib期和ii期临床试验的合并中期分析中,本发明人示出了hpv-阳性肛门癌与较低的无进展生存期(pfs,见图8)显著相关,这实际上是由于肛门癌患者的肝转移患病率较高,而不是由于肛门癌本身。实际上,一些患有肛门癌而没有肝转移(但有其他转移)的患者对这种治疗反应良好。因此,在hpv-阳性的癌症中,特别是在上面列出的那些中,hpv-阳性的癌症优选不是hpv-阳性的肛门癌,因为其肝转移的患病率较高,以及尤其不是伴有肝转移的肛门癌,并因此优选选自hpv-阳性的口咽部(特别是scchn)、宫颈癌、阴道癌、外阴癌、阴茎癌、粘膜癌或非黑色素瘤皮肤癌。
[0160]
相比之下,发明人还观察到hpv-阳性的外阴/阴道癌患者的高应答率(见表11),以及hpv-阳性的生殖器(指外阴/阴道)癌与更好的客观反应率(orr,见图7)和pfs(见图 8)之间的非显著关联趋势。因此,在hpv-阳性的癌症中,hpv-阳性的外阴和阴道癌是优选的。
[0161]
优选的hpv-阳性的癌前上皮内病变包括宫颈上皮内瘤变(cin)2级或3级和外阴上皮内瘤变(vin)2级或3级。宫颈上皮内瘤变(cin)是一种癌前病变,可存在于以下三个阶段中的任一阶段:cin1、cin2或cin3。如果不治疗,cin2或cin3(统称为cin2 ) 可进展为宫颈癌。类似地,外阴上皮内瘤变(vin)是一种癌前病变,可存在于以下三个阶段中的任何一个:vin1、vin2或vin3。如果不治疗,vin2或vin3(统称为vin2 ) 可进展为外阴癌。
[0162]
待治疗的癌症或癌前上皮内病变优选为hr-hpv阳性,其优选对应于痘病毒编码的hpv e6和e7多肽来源的hr-hpv。待治疗的癌症或癌前上皮内病变优选为hr-hpv 阳性,所述hr-hpv选自hpv-16、hpv-18、hpv-30、hpv-31、hpv-33、hpv-35、hpv-39、 hpv-45、hpv-51、hpv-52、hpv-56、hpv-58、hpv-59、hpv-66、hpv-68、hpv-70 和hpv-85,更优选为hpv-16和hpv-18,以及最优选待治疗的癌症或癌前上皮内病变为hpv16阳性。当待治疗的癌症或癌前上皮内病变是hpv-16阳性时,痘病毒优选编码 hpv-16 e6和e7多肽(更优选其非致癌版本,如上所述)。
[0163]
因此,在优选的实施方案中,靶向治疗用途是hpv-16阳性癌症(优选地不是伴有肝转移的hpv-16阳性肛门癌,或者更通常不是hpv-16阳性肛门癌,因为其具有肝转移的高患病率)或hpv-16阳性癌前上皮内病变,并且癌症可以明显地选自hpv-16阳性口咽部(特别是scchn)、宫颈癌、阴道癌、外阴癌、阴茎癌、粘膜或非黑色素瘤皮肤癌。在优选的实施方案中,癌症可选自hpv-16阳性的头颈部鳞状细胞癌(hpv-16 scchn)、 hpv-16阳性的外阴癌和hpv-16阳性的阴道癌。在这种情况下,痘病毒(优选mva)优选编码hpv-16 e6和e7多肽(更优选其非致癌版本,如上所述)。
[0164]
除了其hpv-阳性性质之外,靶向癌症还优选复发和/或转移性hpv-阳性的癌症(更优选复发和/或转移性hpv-16阳性癌症,最优选复发和/或转移性hpv-16阳性scchn)。本文所用术语“癌症”涵盖所有原发性或复发性和/或转移性癌症。“原发癌”是指生长在肿瘤开始发展并最终形成癌块的原始解剖部位(器官或组织)的癌症。“复发癌”是指癌症复发(恢复),通常在一段时间内癌症无法被检测出来。来自原发癌的癌细胞可能扩散到身体其他部
位,并且形成新的或“转移癌”(也称为继发性癌)。
[0165]
实际上,复发和/或转移性癌症通常与更差的预后和更低的治疗反应有关,并且对这些癌症特别需要进行新的组合治疗。转移可能影响各种器官,包括淋巴结、肺、骨骼和肝脏。
[0166]
在其ib期和ii期临床试验的合并中期分析中,发明人惊讶地发现淋巴结转移与更好的pfs显著相关(见图8)。因此,在优选的实施方案中,所述hpv-阳性的癌症是具有淋巴结转移的hpv-阳性(优选hpv16阳性)转移癌。
[0167]
此外,他们还发现肺和骨转移与较低orr或pfs没有显著的相关性(见图8)。事实上,发明人示出了只有一种类型的转移与较低orr和pfs显著相关:肝转移,且特别是当患者有多灶性肝转移时,即发生在肝脏多个部位(至少2个)的肝转移,特别是发生在至少两个不同的叶。肝转移的存在被认为与抗pd-l1治疗的低反应有关,主要在肺癌或混合癌患者中(sridhar s.,et al.clin lung cancer 2019;e601
–
e608;bilen m.,et al. bmc cancer.2019;19:857;reck m.,et al.lancet respir med 2019;7:387-401)。然而,这种观察结果是用不涉及与编码至少人乳头瘤病毒(hpv)e6和e7多肽和免疫刺激性细胞因子的痘病毒载体组合的治疗进行的,并因此不能预期转用到根据本发明的特定治疗。此外,在hpv-阳性的癌症中没有这样的观察结果,以及也不能预期转用到这些特定的癌症。鉴于发明人关于肝转移与较低orr和pfs显著相关的观察结果,但是没有肺或骨转移与低orr和pfs的关联以及淋巴结转移与较高pfs的关联,hpv-阳性的癌症可以优选为无多灶性肝转移(优选无肝转移)的hpv-阳性(优选hpv-16阳性)癌(如口咽癌、宫颈癌、阴道癌、肛门癌、外阴癌、阴茎癌、黏膜或非黑色素瘤皮肤癌),特别是无多灶性肝转移(优选无肝转移)的转移性hpv-阳性(优选hpv-16阳性)癌(如口咽癌、宫颈癌、阴道癌、肛门癌、外阴癌、阴茎癌、黏膜或非黑色素瘤皮肤癌)。
[0168]
更优选地,hpv-阳性的癌症可优选为无肝转移且有淋巴结转移的转移性hpv-阳性 (优选hpv-16阳性)癌。
[0169]
剂量及施用途径
[0170]“施用(administering)”或“施用(administration of)”药物至患者(以及该短语的语法等同词)指直接施用,这可以是由医学专业人员施用给患者,或可以是自我施用,和/或间接施用,其可以是处方药的行为。例如,指导患者自我施用药物或向患者提供药物处方的医生正在给患者施用药物。
[0171]“剂量(dose)”和“剂量(dosage)”是指用于施用的特定量的活性剂或治疗剂。这些量包括在“剂型”中,“剂型”是指适合作为用于人类对象和其他哺乳动物的单一剂量的物理上离散的单位,每个单位包含预定量的活性剂,其与一种或多种合适的药物赋形剂(如载体或佐剂)一起计算以产生所需的起效性、耐受性和治疗效果。
[0172]“药学上可接受的佐剂”是指任何和所有能增强机体对抗原免疫应答的物质。药学上可接受的佐剂的非限制性实例是:明矾、弗氏不完全佐剂、mf59、dsrna的合成类似物如聚(i:c)、细菌lps、细菌鞭毛蛋白、咪唑喹啉、含有特定cpg基序的寡脱氧核苷酸、细菌细胞壁片段如胞壁酰二肽和
[0173]“药学上可接受的载体”或“药学上可接受的稀释剂”是指与药物施用相容的任何和所有溶剂、分散介质、涂层、抗菌和抗真菌剂、等渗和吸收延迟剂。这种介质和试剂用于药
物活性物质的用途在本领域中是众所周知的。在所使用的剂量和浓度下,可接受的载体、赋形剂或稳定剂对受体无毒,并且在不限制本发明范围的情况下,包括:另外的缓冲剂;防腐剂;共溶剂;抗氧化剂,包括抗坏血酸和蛋氨酸;螯合剂,如edta;金属配合物(如锌蛋白配合物);可生物降解的聚合物,如聚酯;形成盐的反离子,如钠、多元糖醇;氨基酸,如丙氨酸、甘氨酸、谷氨酰胺、天冬酰胺、组氨酸、精氨酸、赖氨酸、鸟氨酸、亮氨酸、2-苯丙氨酸、谷氨酸和苏氨酸;有机糖或糖醇,如乳糖醇、水苏糖、甘露糖、山梨糖、木糖、核糖、核糖醇、myoinisitose、肌糖醇、半乳糖、半乳糖醇、甘油、环糖醇(如肌醇)、聚乙二醇;含硫还原剂,如尿素、谷胱甘肽、硫代酸、硫代乙酸钠、硫代甘油、[α]-单硫代甘油和硫代硫酸钠;低分子量蛋白质,如人血清白蛋白、牛血清白蛋白、明胶或其他免疫球蛋白;和亲水性聚合物,如聚乙烯吡咯烷酮。其他药学上可接受的载体、赋形剂或稳定剂,如在remington's pharmaceutical sciences 16thedition,osol,a.ed.(1980)中描述的那些,也可包括在本文所述的药物组合物中,只要它们不对药物组合物的期望特性产生不利影响。
[0174]“治疗有效量”是指本文所述痘病毒(优选编码至少hpv e6和e7多肽和免疫刺激性细胞因子的vv,更优选编码至少hpv e6和e7多肽和免疫刺激性细胞因子的mva,如wo1999/03885中以其研究名称mvatg8042描述的tg4001)的量,和/或抗pd-l1 抗体或其抗原结合片段(如阿维单抗),其具有治疗作用和治疗癌症或癌前病变的能力。在癌症的情况下,例如晚期实体恶性肿瘤,治疗有效量的药物可以减少癌细胞的数量;减轻肿瘤大小或负担;抑制(即在某种程度上减缓以及在某一实施方案中阻止)癌细胞向外周器官的浸润;抑制(即在某种程度上减缓以及在某一实施方案中阻止)肿瘤转移;在一定程度上抑制肿瘤生长;在某种程度上缓解与癌症相关的一种或多种症状;和/或导致有利的反应,例如增加无进展生存期(pfs)、无病存活率(dfs)、或总存活率(os)、完全应答(cr)、部分应答(pr)、或在某些情况下稳定疾病(sd)、进展性疾病的减少(pd)、缩短进展时间(ttp)或其任何组合。在药物能够阻止生长和/或杀死现有癌细胞的程度上,它可以是细胞抑制的和/或细胞毒性作用的。在癌前病变的情况下,药物的治疗有效量可以抑制(即在某种程度上减缓以及在某一实施方案中阻止)向癌症的演变。“预防有效量”是指在所必需的剂量和时间内达到预期预防效果的有效量。通常,但不是必须的,因为预防剂量用于疾病之前或早期阶段的对象,预防有效量将小于治疗有效量。
[0175]
本文所用的“单位剂型”是指适合于待治疗对象的治疗制剂的物理离散单位。然而,应当理解,此处描述的痘病毒载体和抗pd-l1组合物的使用将由主治医师在合理的医学判断范围内确定。对任何特定对象或生物体的特定有效剂量水平将取决于各种因素,包括正在治疗的病症和病症的严重程度;所用特定活性剂的活性;使用的特定组合物;对象的年龄、体重、一般健康状况、性别和饮食;施用时间和所用特定活性剂的排泄率;治疗的持续时间;与所使用的特定化合物联合或同时使用的药物和/或其他疗法,以及医学领域中众所周知的类似因素。
[0176]
痘病毒
[0177]
在根据本发明的组合、方法或用途中,编码至少人乳头瘤病毒(hpv)e6和e7多肽和免疫刺激性细胞因子的痘病毒(优选编码膜锚定的非致癌hpv-16 e6和e7多肽和人 il-2的mva病毒,如wo 1999/03885中以其研究名称mvatg8042描述的tg4001所示)优选地以106至108pfu,更优选地以5
×
106至8
×
107pfu,最优选地以3
×
107至7
×
10
7 pfu,高度优选地以4
×
107至6
×
107pfu,特别高度优选地以约5
×
107pfu的剂量施用。
[0178]
在根据本发明的组合、方法或用途中,编码至少人乳头瘤病毒(hpv)e6和e7多肽和免疫刺激性细胞因子的痘病毒(优选编码膜锚定的非致癌性hpv-16 e6和e7多肽和人 il-2的mva病毒,如wo 1999/03885中以其研究名称mvatg8042描述的tg4001所示)优选地通过皮下、肌肉内、瘤内或静脉途径施用。特别优选的施用途径是皮下途径。
[0179]
抗pd-l1抗体或其抗原结合片段
[0180]
在根据本发明的组合、方法或用途中,抗pd-l1抗体(特别是含有至少6个cdr 或重链和轻链,例如阿维单抗的至少6个cdr或重链和轻链的抗体)优选以以下剂量施用:
[0181]
在某些实施方案中,在本发明的组合、方法或用途中施用治疗有效量的抗pd-l1 抗体(例如,阿维单抗)或其抗原结合片段。所述治疗有效量足以治疗hpv-阳性的癌症的一个或多个症状。在组合疗法中使用抗pd-l1抗体的一些实施方案中,给药方案将包括在整个治疗过程中间隔约7天(
±
2天)、约14天(
±
2天)、约21天(
±
2天)或约30天(
±
2天) 以约1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20mg/kg 体重的剂量施用抗pd-l1抗体。在某些实施方案中,抗pd-l1抗体(例如,阿维单抗) 或其抗原结合片段的治疗有效量约为5至20mg/kg,更优选5至15mg/kg,最优选10 mg/kg。在一些实施方案中,抗pd-l1抗体是阿维单抗,且阿维单抗的治疗有效量约为 10mg/kg。在一些实施方案中,每两周施用一次阿维单抗。在一些实施方案中,在28 天周期的第1天和第15天施用阿维单抗。药代动力学研究表明,10mg/kg剂量的阿维单抗具有良好的受体占用率伴有可预测的药代动力学特征(heery et al.,2015.proc ascoannual meeting:摘要3055)。该剂量耐受性良好,并观察到抗肿瘤活性的迹象(包括持久的反应)。
[0182]
在一些实施方案中,抗pd-l1抗体(例如,阿维单抗)以约80、150、160、200、240、 250、300、320、350、400、450、480、500、550、560、600、640、650、700、720、 750、800、850、880、900、950、960、1000、1040、1050、1100、1120、1150、1200、 1250、1280、1300、1350、1360、1400、1440、1500、1520、1550或1600mg,优选800 mg、1200mg或1600mg的固定剂量,在上下文提到的治疗过程中,以间隔约7天(
±
2 天)、约14天(
±
2天)、约21天(
±
2天)或约30天(
±
2天)施用。在优选实施方案中,抗pd-l1 抗体(例如阿维单抗)优选地每周(qw)、每两周(q2w)或每三周(q3w)施用一次,剂量约为400至1600mg,更优选约800至1600mg,最优选约800至1200mg,高度优选约 800mg。在一个特定的优选实施方案中,抗pd-l1抗体(例如,阿维单抗)以约800mg、 q2w的剂量施用。
[0183]
在根据本发明的组合、方法或用途中,抗pd-l1抗体(特别是含有至少6个cdr 或重链和轻链,例如阿维单抗的至少6个cdr或重链和轻链的抗体)优选地静脉施用(例如作为静脉输注)或皮下施用。更优选地,所述抗pd-l1抗体(特别是含有至少6个cdr 或重链和轻链,例如阿维单抗的至少6个cdr或重链和轻链的抗体)作为静脉输液施用。更优选地,抗pd-l1抗体(特别是含有至少6个cdr或重链和轻链,例如阿维单抗的至少6个cdr或重链和轻链的抗体)施用50-80分钟,高度优选为大约1小时的静脉输注。
[0184]
在一个实施方案中,阿维单抗是用于静脉施用的无菌、澄清且无色的溶液。阿维单抗小瓶的内容物是无热原的,并且不含抑菌防腐剂。阿维单抗配制成20mg/ml溶液,并以一次性玻璃小瓶提供,用橡胶隔片塞住,以及用铝制聚丙烯翻转密封件密封。为了施用的目的,阿维单抗必须用0.9%的氯化钠(生理盐水溶液)稀释。在施用过程中,使用由聚醚砜
(pes)制成的具有直列的、低蛋白结合的0.2微米过滤器的管。
[0185]
联合施用的次数和频率
[0186]
在本发明的一个方面中,根据特定的施用方案施用下述的组合:
[0187]
a)编码至少人乳头瘤病毒(hpv)e6和e7多肽和免疫刺激性细胞因子的痘病毒载体,优选编码膜锚定非致癌hpv-16 e6和e7多肽和人il-2的mva病毒,更优选tg4001,和
[0188]
b)抗pd-l1抗体或其抗原结合片段,优选阿维单抗,
[0189]
其中在第一次施用所述抗pd-l1抗体前5至10天进行所述痘病毒载体的第一次施用,以及进行所述痘病毒和抗pd-l1抗体的后续施用。
[0190]
换句话说,用于根据本发明的组合、方法或用途的施用方案至少涉及:
[0191]
·
第一次施用所述痘病毒,
[0192]
·
其在第一次施用所述抗pd-l1抗体前5至10天进行,以及
[0193]
·
后续施用所述痘病毒和抗pd-l1抗体。
[0194]
在用于根据本发明的组合、方法或用途的施用方案中,在第一次施用所述抗pd-l1 抗体之前进行所述痘病毒的第一次施用。不受理论的约束,该设定首先通过第一次痘病毒施用刺激抗-hpv免疫应答,以及然后通过第一次抗pd-l1施用(通过减少由于肿瘤微环境中pd-1/pd-l1途径引起的免疫抑制)放大该抗-hpv免疫应答,而不改变痘病毒的初代增值。在第一次痘病毒施用后的5-10天内缺乏抗pd-l1施用会阻止抗痘病毒免疫应答的潜在扩增。后续施用所述痘病毒和抗pd-l1抗体维持抗hpv免疫应答。
[0195]
因此,在根据本发明的组合、方法或用途中,痘病毒的第一次施用在所述抗pd-l1 抗体的第一次施用前约5至10天(即5、6、7、8、9或10天,优选1周)进行。
[0196]
在一些实施方案中,组合方案包括以下步骤:(a)在医生的指导或控制下,对象在首次接受pd-l1抗体前约5至10天接受编码至少hpv e6和e7多肽和免疫刺激性细胞因子的痘病毒载体;和(b)在医生的指导或控制下,对象接受pd-l1抗体。在一些实施方案中,组合方案包括,在对象接受编码至少hpv e6和e7多肽和免疫刺激性细胞因子的痘病毒载体的第一次施用后约5至10天,向对象施用抗pd-l1抗体。
[0197]
后续施用所述痘病毒和抗pd-l1抗体的数量和频率可能不同。然而,关于它们的数量,只要组合治疗在治疗对象中产生有益效果而不引起不可接受的毒性,优选进行所述痘病毒和抗pd-l1抗体的后续施用。
[0198]
在一个实施方案中,可进行所述痘病毒和抗pd-l1抗体的后续施用,直到根据 recist v1.1标准定义的疾病进展(eisenhauer ea.et al.,eur j cancer.(2009) 45(2):228-47)。
[0199]
如recist v1.1指南所定义的,“疾病进展”、“进行性疾病”或“已经进展的疾病”是指出现又一个新的病变或肿瘤和/或现有非靶病变的明确进展。疾病进展、进行性疾病或已经进展的疾病也可以指自治疗开始以来肿瘤增长超过20%(无论是由于肿瘤的肿块增加还是扩散)。
[0200]“recist”指实体瘤的反应评价准则。recist指南、准则或标准描述了实体瘤测量的标准方法和用于成人和儿童癌症临床试验的肿瘤大小变化的客观评估的定义。 recist v1.1是指修订后的recist指南的1.1版。
[0201]
在其他实施方案中,只要在患者中观察到有益的生物学效应(见下面的专用部
分),就可以进行所述痘病毒和抗pd-l1抗体的后续施用。
[0202]
关于施用的频率,优选使用以下时间表:
[0203]
后续痘病毒施用的频率可能在约1周至约3个月之间变化。此外,痘病毒施用的频率在整个治疗期间可能不是恒定的,而是可能不同。优选地,随着时间的推移,后续痘病毒施用的频率减少。
[0204]
特别地,当包括第一次痘病毒施用时,可首先每5至10天一次(包括每5、6、7、 8、9或10天一次,优选每周一次)施用4至8次(即,每4、5、6、7或8次,优选6次) 痘病毒(任选地,特定优选单次第一次痘病毒施用,随后每周一次后续施用5次痘病毒 (“第一组痘病毒施用”)。
[0205]
然后,在第一组痘病毒施用之后,可以以减少的频率进行第二组后续的痘病毒施用。优选地,该第二组后续的痘病毒施用包括每1至3周一次(包括每1、2或3周一次,优选地每2周一次)的6至10次(即,6、7、8、9或10,优选8次)后续的痘病毒施用(任选地,特定优选每2周一次后续的痘病毒施用至第6个月)(“第二组痘病毒施用”)。
[0206]
然后,在第二组痘病毒施用之后,可以以进一步减少的频率进行第三组后续的痘病毒施用。优选地,该第三组后续的痘病毒施用可每10-14周一次施用(包括每10、11、12、13或14周一次,优选每12周一次),直到疾病进展(或任选地,只要存在以下描述的至少一种生物学效应)(“第三组痘病毒施用”)。
[0207]
在一个特别优选的实施方案中,痘病毒如下施用:
[0208]
o每周一次施用6周,
[0209]
o每2周一次至第6个月,以及
[0210]
o每12周一次,直到疾病进展(或任选地,只要存在至少一种以下描述的生物学效应)。
[0211]
抗pd-l1施用的频率(包括第一次施用和后续施用)优选在1至3周之间(包括每周一次,或每2或3周一次,优选每2周一次)。
[0212]
所述抗pd-l1抗体优选地将被施用直到疾病进展(或任选地,只要存在以下所述的至少一种生物学效应)。
[0213]
在一个特别优选的实施方案中,每2周施用一次抗pd-l1抗体,直到疾病进展(或者任选地,只要存在下面描述的至少一种生物学效应)。
[0214]
优选的施用方案
[0215]
在优选的实施方案中,组合以以下施用方案施用:
[0216]
a)皮下施用3
×
10
7-7
×
107pfu的第一剂量的所述痘病毒(优选是编码膜锚定的非致癌hpv-16 e6和e7多肽和人il-2的mva病毒,更优选tg4001,如wo 1999/03885 中以研究名称mvatg8042所述),并随后皮下后续施用3
×
10
7-7
×
107pfu剂量的痘病毒,直到疾病进展:
[0217]
·
每周一次施用6周,
[0218]
·
每2周一次,直至第6个月,以及
[0219]
·
每12周一次,用于下一痘病毒剂量;
[0220]
b)在第一痘病毒剂量后5至10天,静脉施用第一剂量约10mg/kg或约800mg的抗pd-l1抗体(优选含有至少6个cdr或重链和轻链,例如阿维单抗的至少6个cdr 或重链和轻链的
抗体,更优选阿维单抗),以及随后每2周一次静脉后续施用约10mg/kg 或约800mg的抗pd-l1抗体剂量,直到疾病进展。
[0221]
在一个甚至更优选的实施方案中,组合以以下施用方案施用:
[0222]
a)皮下施用第一剂量约5
×
107pfu的编码膜锚定的非致癌hpv-16 e6和e7多肽和人il-2的所述mva病毒(优选tg4001,如wo 1999/03885中以研究名称为mvatg8042 所述),并随后皮下后续施用剂量约5
×
107pfu的mva,直到疾病进展:
[0223]
·
每周一次施用6周,
[0224]
·
每2周一次,直至第6个月,以及
[0225]
·
每12周一次,用于下一痘病毒剂量;
[0226]
b)在第一痘病毒剂量后1周静脉施用第一剂量约10mg/kg或约800mg的阿维单抗,随后每2周一次静脉后续施用约10mg/kg或约800mg的阿维单抗剂量直到疾病进展。
[0227]
组合治疗的生物学效应与生物标志物
[0228]
发明人惊讶地发现,将(a)编码至少人乳头瘤病毒(hpv)e6和e7多肽和免疫刺激性细胞因子的痘病毒载体,特别是tg4001(编码膜锚定的非致癌hpv-16 e6和e7多肽和人il-2的mva病毒)和(b)抗pd-l1抗体或其抗原结合片段,特别是阿维单抗组合,在hpv-阳性的癌症患者中导致肿瘤免疫抑制的降低和抗癌反应的改善,其特征在于:
[0229]
·
诱导或增加针对hpv16 e6和e7多肽的免疫应答;
[0230]
·
肿瘤内:
[0231]
o免疫细胞浸润的增加,主要是cd3 t细胞,优选cd8 t细胞的数量及其在cd3 t细胞中的比例的增加(cd8/cd3比率的增加)和/或调节性cd4 t细胞的减少,和/或cd8 t细胞的增加和调节性cd4 t细胞(treg)的减少的联合导致treg/cd8比率的减少;和/ 或
[0232]
o肿瘤细胞上pd-l1表达的升高;
[0233]
·
在血液循环中:
[0234]
o cd8 t细胞增多;和/或
[0235]
o调节性cd4 t细胞减少;和/或
[0236]
·
肿瘤细胞中基因表达的显著重塑,其特征在于:
[0237]
o t细胞活化基因、细胞毒细胞基因、病原体防御基因和nk细胞功能基因表达增加;
[0238]
o选自cxcl10、cxcl11、irf1、gzmk、gzma、cd3d、prf1、tbx21、cxcr3、 stat1、cd69、ccl2、gzmb、cd3g、icos、cd8a、stat4、gzmm、ccr2、cd3e 和il15所组成的组中的一个或多个基因的表达增加;和/或
[0239]
o选自cxcl13、gnly、gzmh、ifng、cxcl9、ccl5和itgae所组成的组的一个或多个基因的表达增加,和/或vegfa、ihh、il17a、prom1、ren、pf4、tslp 和lag3中的一个或多个的表达减少。
[0240]
除另有说明外,所有增加或减少的比较都与基线进行比较(即,在对患者施用组合疗法之前)。
[0241]
因此,在组合疗法的一个实施方案中,所述组合诱导针对hpv-16 e6和e7蛋白的免疫应答的诱导或增加。针对hpv-16 e6和e7蛋白的免疫应答可以通过本领域已知的任何合适的方法来测量。合适的方法可以基于检测针对hpv-16 e6和e7蛋白的cd8和 /或cd4 t细
胞反应,包括细胞因子(特别是干扰素γ(ifnγ)、白细胞介素2(il-2)和肿瘤坏死因子α(tnfα))的分泌和细胞毒性作用。细胞因子分泌可以用常规的方法如elisa 或elispot在体外从外周血单个核细胞(pbmc)测量。细胞毒性作用也可以在体外使用常规试验来测量。在优选实施方案中,所测得的针对hpv-16 e6和e7蛋白的免疫将是 pbmc分泌ifnγ,并将使用elisa、通过流式细胞术或elispot免疫染色进行测量,优选elispot技术。
[0242]
在组合疗法的另一个实施方案中,所述组合在肿瘤内诱导:
[0243]
·
免疫细胞浸润的增加,优选cd3 t细胞的增加,更优选cd8 t细胞的增加,以及最优选cd8/cd3比率的增加;和/或
[0244]
·
调节性cd4 t细胞(treg)的减少,更优选的是treg/cd3比率的减少。
[0245]
最优选地,所述组合诱导肿瘤内treg/cd8比率的降低。这种treg/cd8比率的降低表明肿瘤内免疫抑制的减少和抗癌免疫应答的刺激。
[0246]
在肿瘤内,免疫细胞浸润,以及特别是cd3 t细胞、cd8 t细胞和cd4 t细胞(treg) 的数量可以通过本领域已知的任何合适的方法来表征。t细胞以表面表达cd3为特征,并根据其伴随的表面表达cd8或cd4分为两个亚组。在cd4 t细胞中,那些进一步表达foxp3的细胞被认为是调节性cd4 t细胞(treg)。可以在治疗前(基线时)和治疗后使用任何合适的方法测量cd3 t细胞(cd3 细胞)、cd8 t细胞(cd3 cd8 细胞)和cd4 t 细胞(treg,cd3 cd4 foxp3 细胞)的数量并进行比较。然后cd8/cd3比率、treg/cd3 比率和treg/cd8比率可以很容易地计算出来。
[0247]
如本文所用,cd3、cd8、cd4和foxp3表达是指细胞表面cd3、cd8、cd4和 foxp3蛋白或细胞或组织内cd3、cd8、cd4和foxp3 mrna的任何可检测水平的表达。根据样品的类型,可以在肿瘤组织切片的免疫组织化学(ihc)试验中或通过流式细胞术用诊断性cd3、cd8、cd4和/或foxp3抗体检测细胞表面上的cd3、cd8、cd4和/ 或foxp3蛋白表达。可选地,可以使用特异性结合cd3、cd8、cd4和/或foxp3的结合剂(例如,抗体片段、亲和体等)通过pet成像检测肿瘤细胞的cd3、cd8、cd4和/ 或foxp3蛋白表达。检测和测量cd3、cd8、cd4和/或foxp3 mrna(或cdna)表达的技术包括rt-pcr、实时定量rt-pcr(qrt-pcr)和微阵列杂交。在肿瘤内,cd3、cd8、 cd4和/或foxp3的表达将优选在肿瘤组织切片的免疫组织化学(ihc)试验中用诊断性 cd3、cd8、cd4和/或foxp3抗体检测。当联合疗法治疗后的数量、表达或比率高于/ 低于联合疗法治疗前(基线时)时,检测到增加/减少。
[0248]
在组合疗法的另一个实施方案中,所述组合诱导肿瘤细胞上pd-l1表达的增加。本文所用“pd-l1表达”是指细胞表面pd-l1蛋白或细胞或组织内pd-l1 mrna的任何可检测水平的表达。根据样品的类型,pd-l1蛋白的表达可以在肿瘤组织切片的免疫组织化学(ihc)试验中或通过流式细胞术用诊断性pd-l1抗体检测。可选地,可以使用与 pd-l1特异性结合的结合剂(例如,抗体片段、亲和体等)通过pet成像检测肿瘤细胞的 pd-l1蛋白表达。检测和测量pd-l1 mrna(或cdna)表达的技术包括rt-pcr、实时定量rt-pcr(qrt-pcr)和微阵列杂交。在肿瘤内,优选在肿瘤组织切片的免疫组织化学 (ihc)试验中用诊断性pd-l1抗体检测pd-l1表达。当联合疗法治疗后pd-l1表达高于联合疗法治疗前(基线时)时,检测到增加。肿瘤细胞上pd-l1的高水平表达与对抗pd-l1 抗体治疗的更好临床反应有关。
[0249]
在组合疗法的另一个实施方案中,所述组合在血液循环中诱导:
[0250]
·
cd8 t细胞的增加,优选cd8/cd3比率的增加;和/或
[0251]
·
调节性cd4 t细胞(treg)的减少,更优选的是treg/cd3比率的减少。
[0252]
在血液循环中,cd3、cd8、cd4和foxp3的表达可以在治疗前(基线时)和治疗后使用本领域已知的任何合适的方法来测量,并比较其表达水平。合适的方法包括与上述用于测量肿瘤内cd3、cd8、cd4和foxp3表达的方法相同的方法,但优选通过流式细胞术使用诊断性cd3、cd8、cd4和/或foxp3抗体检测cd3、cd8、cd4和foxp3表达。然后cd8/cd3比率、treg/cd3比率和treg/cd8比率可以很容易地计算出来。
[0253]
优选地,在血液循环和肿瘤内观察到cd8 t细胞的增加。类似地,调节性cd4 t 细胞的减少优选在血液循环和肿瘤内观察到。此外,优选在血液循环和/或肿瘤内观察到 cd8 t细胞的增加和调节性cd4 t细胞的减少,更优选在血液循环和肿瘤内观察到两者。
[0254]
此外,在分子水平上,发明人还惊奇地发现了与先天免疫和获得性免疫的引发一致的基因表达变化,以及从“冷性”肿瘤特性转向“热性”肿瘤特性。“冷性肿瘤”是指缺乏免疫浸润或免疫浸润非常有限的肿瘤,特别是t细胞浸润。在分子水平上,“冷性肿瘤”的特点是与免疫细胞浸润的存在有关的基因表达水平低,以及特别是与t细胞活化、t 细胞分化、t细胞吸引、t细胞粘附、细胞毒性作用、病原体防御和nk细胞功能有关的基因表达水平低。相反,“热性肿瘤”被定义为有明显免疫浸润,特别是t细胞浸润的肿瘤。在分子水平上,“热性肿瘤”的特征在于与免疫细胞浸润的存在有关的基因的高水平表达,特别是与t细胞激活、t细胞分化、t细胞吸引、t细胞粘附、细胞毒性作用、病原体防御和nk细胞功能有关的基因的高水平表达。当治疗导致免疫浸润,特别是t 细胞浸润显著增加时,从“冷性肿瘤”特性向“热性肿瘤”特性的转变被认为是由治疗诱导的。在分子水平上,这反映为与治疗前相比,与t细胞活化、t细胞分化、t细胞吸引、 t细胞粘附、细胞毒性作用、病原体防御和/或nk细胞功能相关的一个或多个基因表达水平的增加。热性肿瘤更有可能对治疗干预做出反应,并与患者改善的临床结果更加一致地相关。相反,冷性肿瘤与免疫应答性低,对治疗干预反应差相关,并可能具有快速的不利临床过程。
[0255]
更特别地,使用一组770种与对癌症的免疫应答相关的基因,本发明人能够示出在基线和组合治疗开始后第43天之间肿瘤中基因表达的变化。这些变化包括数种t细胞活化基因、细胞毒性细胞基因、病原体防御基因和nk细胞功能基因表达的增加。这些变化还包括被haliodx称为和21的基因标签的增加,其被认为反映肿瘤内部和周围自然发生的免疫活动,并因此反映肿瘤的相当冷(不良预后)或热(预后较好)的免疫状态(galon j.et al.,immunity(2013)39(1):11-26;marabelle a. et al.,society for immunotherapy of cancer(sitc)32
nd annual meeting&pre-conferenceprograms(sitc 2017)on november 8-12,2017 at the gaylord national hotel&conventioncenter in national harbor,maryland.poster p250)。
[0256]
具体来说,15是结合以下与t细胞毒性作用、t细胞分化、t细胞吸引、t细胞粘附、免疫定向、血管生成抑制、免疫共抑制和癌症干细胞相关的基因表达数据的算法:cxcl13、gnly、gzmh、ifng、cxcl9、ccl5、itgae、vegfa、 ihh、il17a、prom1、ren、pf4、tslp、lag3。在本发明的上下文中,cxcl13、 gnly、gzmh、ifng、cxcl9、ccl5和itgae中任何一种表达水平的增加和/或 vegfa、ihh、il17a、prom1、ren、pf4、tslp和lag3中任何一种表达水平的降低被认为是向更热的肿瘤状态的转变,其有利于癌症治疗。
[0257]
21是结合以下与t细胞毒性作用、t细胞激活、t细胞吸引和th1 定
向相关的基因表达数据的算法:cxcl10、cxcl11、irf1、gzmk、gzma、cd3d、prf1、tbx21、cxcr3、stat1、cd69、ccl2、gzmb、cd3g、icos、cd8a、stat4、 gzmm、ccr2、cd3e和il15。在本发明的上下文中,这些基因中任何一个的表达水平的增加被认为是向更热的肿瘤状态的转变,其有利于癌症治疗。
[0258]
因此,在本发明的一个方面,组合疗法诱导下列基因类别中的一个或多个的表达增加(发明人惊奇地发现其被组合疗法上调):
[0259]
(i)至少一种与t细胞活化相关的基因的表达增加,所述基因优选选自以下的组: cd47、rps6、cd80、il18r1、cd7、psen2、tnfsf14、dpp4、stat4、ccr1、foxp3、 ctla4、lag3、cd86、lilrb1、il13、cd1c、eomes、ccr4、cd3g、fas、il12b、 il18rap、cd1d、cxcr3、tigit、il4、il12a、ifng、cd70、cd2、cd3e、cd8a、 cd8b、il12rb2、cd5、ccr5、tbx21、il12rb1、irf4、ada、cd274、lck、f2rl1、 icoslg、cxcl11、cxcl10、ido1、cx3cl1、irf1、socs1、il18、slc11a1、egr1、 itga1、cxcr4、cxcl9、ptprc、lcp1、tnfrsf14、psen1、maf、tp53、il4r、 stat6、il13ra1和ifngr1,以及任选地il21r基因;
[0260]
(ii)至少一种与激活细胞毒性t细胞功能相关的基因的表达增加,所述基因优选选自以下的组:gzmm、gzmh、gzmk、gnly、gzmb、prf1、gzma、hla-c 和hla-a基因;
[0261]
(iii)至少一种病原体防御基因的表达增加,优选选自以下的组:cd8a、ctsg、 prg2、ccl22、il1b、prf1、gnly、cxcl10、tyk2和oas3基因;
[0262]
(iv)至少一种nk细胞功能基因的表达增加,优选选自以下的组:klrc1、 klrb1、klrc2、il12b、kir3dl1、klrf1、klrg1、ncr1、klrk1、il12a和klrd1基因;
[0263]
(v)基因类别(i)、(ii)、(iii)和/或(iv)的任何基因组合的表达增加,优选地为包括上述基因类别中每一个的至少一个基因的基因组合。
[0264]
在本发明的另一个方面,可选地或除了上述类别(i)至(v)的基因表达之外,组合疗法诱导以下基因中的一个或多个(存在于21标签中)的表达增加:cxcl10、 cxcl11、irf1、gzmk、gzma、cd3d、prf1、tbx21、cxcr3、stat1、cd69、 ccl2、gzmb、cd3g、icos、cd8a、stat4、gzmm、ccr2、cd3e和il15。特别是,组合疗法可诱导下述基因中的一个或多个的表达增加(见图6d):cxcl10、cxcl11、 irf1、gzmk、gzma、cd3d、prf1、tbx21和cxcr3。
[0265]
在本发明的另一个方面,可选地或除了上述类别(i)至(v)的基因表达和/或21标签的基因之外,组合疗法诱导下述基因(存在于15标签中)中的一个或多个的表达增加或减少,如下所示:
[0266]
·
下述基因中的一个或多个表达增加:cxcl13、gnly、gzmh、ifng、cxcl9、 ccl5和itgae,和/或
[0267]
·
下述基因中的一个或多个表达降低:vegfa、ihh、il17a、prom1、ren、 pf4、tslp和lag3。
[0268]
在上述实施方案中,可以使用本领域已知的任何合适方法在治疗前(在基线处)和治疗后测量所公开的基因类别或特定感兴趣的基因的表达水平,以及比较表达水平。表达水平可以通过测量mrna(或cdna)或蛋白质表达水平来测量。优选地,通过例如 rt-pcr、实时定量rt-pcr(qrt-pcr)和微阵列杂交的技术测量mrna(或cdna)表达水平。
[0269]
上述组合疗法的生物学效应也可在组合疗法之前或期间用作生物标志物。
[0270]
在一个实施方案中,它们可显著地用作组合疗法期间的生物标志物,以确定在患
者中是继续还是停止组合疗法。
[0271]
在生物标志物用于决定在患者中是继续还是停止组合疗法的实施方案中,只要组合治疗诱导或增加针对hpv-16 e6和e7蛋白的免疫应答,就可以进行所述痘病毒和抗 pd-l1抗体的后续施用。
[0272]
在另一个实施方案中,只要组合疗法诱导以下情况,就可以进行所述痘病毒和抗 pd-l1抗体的后续施用:
[0273]
·
肿瘤内免疫细胞浸润的增加(优选cd3 t细胞的增加,更优选cd8 t细胞的增加);和/或
[0274]
·
肿瘤内调节性cd4 t细胞减少。
[0275]
在另一个实施方案中,只要组合治疗诱导肿瘤细胞上pd-l1表达的增加,就可以进行所述痘病毒和抗pd-l1抗体的后续施用。
[0276]
在另一个实施方案中,只要组合治疗在血液循环中诱导,就可以进行所述痘病毒和抗pd-l1抗体的后续施用:
[0277]
·
cd8 t细胞的增加,优选cd8/cd3比率的增加;和/或
[0278]
·
调节性cd4 t细胞(treg)的减少,更优选的是treg/cd3比率的减少。
[0279]
在另一个实施方案中,只要组合治疗诱导以下基因类别中的一个或多个的表达增加(发明人惊奇地发现其被组合疗法上调),就可以进行所述痘病毒和抗pd-l1抗体的后续施用:
[0280]
(i)至少一种与t细胞活化相关的基因的表达增加,优选选自上述的那些基因;
[0281]
(ii)至少一种与激活细胞毒性t细胞功能相关的基因的表达增加,优选选自上述的那些基因;
[0282]
(iii)至少一种病原体防御基因的表达增加,优选选自上述公开的基因;
[0283]
(iv)至少一种nk细胞功能基因的表达增加,优选选自上述的那些基因;
[0284]
(v)基因类别(i)、(ii)、(iii)和/或(iv)的任何基因组合的表达增加,优选地为包括上述基因类别中每一个的至少一个基因的基因组合。
[0285]
在另一个实施方案中,可选地或除了上述类别(i)至(v)的基因表达之外,只要组合治疗诱导以下基因中的一个或多个(存在于21标签中)的表达增加,即可进行所述痘病毒和抗pd-l1抗体的后续施用:cxcl10、cxcl11、irf1、gzmk、gzma、 cd3d、prf1、tbx21、cxcr3、stat1、cd69、ccl2、gzmb、cd3g、icos、cd8a、 stat4、gzmm、ccr2、cd3e和il15。特别地,只要组合治疗诱导以下基因中的一个或多个(见图6d)表达增加,就可以进行所述痘病毒和抗pd-l1抗体的后续施用: cxcl10、cxcl11、irf1、gzmk、gzma、cd3d、prf1、tbx21和cxcr3。
[0286]
在另一个实施方案中,可选地或除了上述类别(i)至(v)的基因表达和/或21标签的基因之外,只要组合治疗诱导以下基因(存在于15 标签中)中的一个或多个表达增加或减少,就可以进行所述痘病毒和抗pd-l1抗体的后续施用,如下:
[0287]
·
以下基因中的一个或多个表达增加:cxcl13、gnly、gzmh、ifng、cxcl9、 ccl5和itgae,和/或
[0288]
·
以下基因中的一个或多个表达降低:vegfa、ihh、il17a、prom1、ren、pf4、tslp和
lag3。
[0289]
在此引用的所有参考文献通过引用并入本发明的公开内容中。
[0290]
下面的实施例仅仅是为了阐明本发明。
实施例
[0291]
实施例1:ib期临床试验nct03260023的结果
[0292]
在nct03260023中,tg4001和阿维单抗组合在hpv16阳性r/m(r/m是指复发性的和/或转移性的)癌症中进行了安全性、有效性和免疫学反应的评估。在本实施例中,给出ib期的初步数据。
[0293]
材料和方法
[0294]
研究设计与处理
[0295]
ib期采用3 3设计的多中心、开放标记、单臂研究,将两种不同剂量水平(dl)的 tg4001(dl1 5x106和dl2 5x10
7 pfu)与10mg/kg的阿维单抗组合。对于ii期,tg4001 以dl2施用。
[0296]
tg4001在第1、8、15、22、29和36天每周皮下施用,然后每2周1次(从第36 天开始),直到第6个月(从研究治疗的第1天开始),此后每12周1次,直到疾病进展、不可接受的毒性或患者因任何原因退出研究,以先发生者为准。从第8天(第一次tg4001 剂量后一周)开始,每2周静脉给药一次阿维单抗,直到疾病进展、不可接受的毒性或患者因任何原因退出研究,以先发生者为准。
[0297]
研究终点和评估
[0298]
tg4001和阿维单抗组合的安全性和有效性、免疫参数(t细胞反应、浸润改变和免疫相关基因的基因表达)。
[0299]
肿瘤反应由recist v1.1评估(eisenhauer ea.et al.,eur j cancer(2009) 45(2):228-47)。在基线和第43天纵向采集pbmc样本,并采集组织样本。
[0300]
研究人群
[0301]
主要纳入标准:
[0302]
·
转移或难治/复发(m/r)hpv16 癌症,包括口咽癌、宫颈癌、外阴癌、阴道癌、阴茎癌和肛门癌
[0303]
·
在中心实验室使用hpv-16特异性引物通过pcr检测hpv-16 e7 dna确定 hpv16阳性
[0304]
·
多达两个先前的全身疗法线程用于治疗转移性或复发性疾病
[0305]
·
ecog活动状态0或1
[0306]
主要排除标准:
[0307]
·
预先暴露于癌症免疫疗法,包括抗癌疫苗、任何靶向t细胞共调节蛋白的抗体,如抗-pd l1、抗-pd 1或抗-ctla-4抗体
[0308]
·
cns转移
[0309]
·
全身皮质类固醇的慢性治疗
[0310]
肿瘤大小测量
[0311]
通过计算机断层扫描(ct)(或磁共振成像(mri))评估肿瘤反应。优选地,在研究治
疗开始前21天内对头颈部、胸部、腹部和所有其他已知的疾病部位进行ct(或mri)。从治疗开始到疾病进展或在研究治疗开始后的9个月内每6周一次对患者进行评估,以先发生者为准。超过9个月的治疗,每12周进行一次评估,直到结果表明进展。所有测量均以公制记法(mm)记录。
[0312]
在基线,肿瘤病变和淋巴结被分为可测量(最小尺寸不小于10mm或淋巴结》15mm) 和不可测量(小病变《10mm,不可测量病变(如胸腔积液)或淋巴结《15mm)。被允许纳入研究的患者通过ct/mri扫描具有至少有一个可测量的病变。记录所有目标病变(所有可测量的病变(结节或非结节),总共最多5个病变)和非目标病变(所有其他可测量的病变或不可测量的病变)。为了评估肿瘤反应,在基线和整个研究中计算所有目标病变的最长直径(sld)之和(和结节病变的短轴)。在每次评估中,首先分别对于基线确定的目标病变和非目标病变评估反应。然后,这些评估被用来计算考虑目标病变和非目标病变以及存在或不存在新发病变的总体病变反应:
[0313]-完全反应(cr):所有目标病变消失。任何病理淋巴结(无论是目标还是非目标)必须在短轴上缩小到《10mm。
[0314]-部分反应(pr):以基线直径之和为参考,目标病变直径之和至少减少30%。
[0315]-进行性疾病(pd):以研究中(包括基线评估)的最小总和为参考,目标病变和新发病变直径之和至少增加20%。除了20%的相对增长,总和还必须显示至少5mm 的绝对增长。一个或多个新发病变的出现也被认为是进展。
[0316]-稳定疾病(sd):既没有足够的收缩来符合pr的资格,也没有足够的增加来符合pd的资格。
[0317]-未评估(ne):进展未被记录,以及一个或多个目标病变未被评估或已使用不同于基线的方法评估。唯一的例外是如果可评估的目标病变的sld已经符合pd。
[0318]
在这种情况下,目标反应将是pd。
[0319]
针对肿瘤反应的可评估患者全部包括在研究治疗开始后第6周进行过至少一次基线和一次基线后可评估ct扫描的患者,其根据recist 1.1评估标准,总体反应评估最佳,不同于“未知”。患者以待达到的最低暴露水平给药两种imp(研究药物产品:tg4001 阿维单抗),除非患者在第一次评估前或在第一次评估时因潜在疾病进展或死亡。
[0320]
免疫数据
[0321]
样本的收集是经患者同意,符合所有与人类对象研究有关的伦理指南,并是在irb 批准后。采用层上的密度梯度法分离外周血单个核细胞(pbmc)。简单地说,肝素化血液与磷酸盐缓冲盐水和培养基混合。然后,以2300g离心20分钟。收集 pbmc层,用缓冲盐水稀释,并在1300g下离心10分钟以除去剩余的溶液。细胞在缓冲生理盐水中重悬并再离心。然后将细胞颗粒重新悬浮在存储培养基(imdm加 10%dmso和20%人血清)中,分布在冷冻容器中并用异丙醇在容器中冷冻。
[0322]
组织样本使用18g或以上的针采用标准芯针活检收集。样本切片厚度为4μm(免疫组化)或10μm(基因表达分析),处理前用福尔马林固定石蜡包埋。
[0323]
针对hpv的elispot t细胞反应
[0324]
在i期研究的患者中,在体外扩增期5天后,通过elispot对产生ifn-γ的细胞进行定量。简而言之,解冻后,用nc200自动细胞计数仪计数细胞,并在含有2%cts 血清替代液
的x-vivo-15培养基中,以及在有或无刺激抗原(每肽2μg/ml的e6或e7 肽池或1μg/ml的对照肽混合池)的情况下,在24孔培养板中每孔接种每500μl 2e 06个细胞。第5天,收集细胞,计数,以及每孔2e 05个细胞一式四份铺种于elispot ifn-γ板。孵育24h后,elispot板按照制造商的说明显色,然后干燥,然后用自动elispot 阅读器计数斑点。
[0325]
在ii期研究的患者中,方法被修改以增加特异性。用elispot对ifn-γ产生细胞进行定量。简单地说,在第0天、第1天(接种前)和第43天(接种后)在患者中通过静脉穿刺将pbmc收集到pct管中,并运到中心实验室(ppd)以聚糖体梯度离心提取。细胞洗涤、计数并在含有10
×
106个细胞的管中分装。在分析前将细胞冷冻并保存在ln中。
[0326]
细胞解冻,并用培养基(阴性对照)、e6肽池(peptivator,miltenyi biotech)、e7肽池 (peptivator,miltenyi biotech)或cef(peptivator,miltenyi biotech;阳性对照:ebv、cmv、 flu)刺激过夜。然后将细胞铺种在抗ifn-γ包被的板上,并孵育(1
×
105个细胞/孔)后显色。在肽疫苗接种前和接种后在患者中收集的并已知已产生t细胞反应的pbmc,在每次分析过程中用作试验对照。对每个条件进行三次重复。隔夜孵育后,elispot板根据制造商的说明显色,然后在用自动elispot阅读器计数斑点之前干燥。当阳性和阴性对照符合预期时,以及当抗原斑点计数高于阴性对照加上2倍的试验变异系数时,患者被视为抗原阳性。
[0327]
用于免疫分数评价的免疫组化
[0328]
采用4μm厚的福尔马林固定包埋组织切片对肿瘤免疫结构进行表征。在基线和第 43天,来自同一活检核心的连续切片用于给定患者的所有分析。每个系列的第一片用于通过病理学家对苏木精和曙红染色后的组织的检查来确认肿瘤性质。cd3和cd8在连续片上按以下方法进行染色:用tris碱缓冲液(ph=8)提取抗原60min,猝灭内源性过氧化物酶活性,与抗cd8抗体在37℃孵育32min,以及与抗cd3抗体在37℃孵育20min;用ultraview universal dab ihc检测试剂盒显色,以及用mayer苏木素染液复染。用于染色免疫细胞的一抗有:兔抗人cd3 vms单克隆(克隆2gv6 ventana)、小鼠抗人cd8 单克隆(克隆c8/144,)。在20
×
倍率和0
·
45μm/像素分辨率下获得染色的组织切片的数字图像。利用haliodx(marseille,france)开发的模块,通过全玻片数字扫描对肿瘤和浸润边缘的cd8和cd3阳性细胞进行定量。
[0329]
cd3/cd8/pd-l1和cd3/cd4/foxp3的多光谱组织学评价
[0330]
将4mm厚的ffpe组织切片脱蜡,通过乙醇梯度复水,以蒸馏水洗涤结束,并在 10%中性缓冲福尔马林中固定20分钟。在抗原回收液中用微波处理进行抗原回收。在每个染色周期中,用蛋白阻断无血清溶液进行蛋白阻断15分钟,并将一抗抗cd3(如上所述从ventana获得)、抗cd4(小鼠抗人cd4单克隆;克隆umab64 clinisciences)和抗 foxp3(小鼠抗人foxp3单克隆;克隆236a/e7;abcam)或抗cd3、抗cd8和抗pdl-1 在室温下孵育30分钟。
[0331]
然后,与hrp标记的聚合物小鼠或兔抗体在室温下孵育15分钟,随后荧光基团孵育10分钟。最后用dapi复染5min,然后用haliodx开发的专有数字病理软件进行全片扫描和定量。结果用graphpad prism软件包制表和绘图。
[0332]
治疗过程中肿瘤组织中基因表达变化的分析:多重免疫基因表达
[0333]
采用nanostring ncounter技术测量福尔马林固定的肿瘤组织(厚度10μm)上肿瘤微环境中免疫基因的相对表达水平。提取后,总rna(300ng)在ncounter数字分析仪上进行
分析,并根据制造商的说明与泛癌免疫图谱组杂交。图谱组包含770个基因,包括关键检查点、趋化因子、细胞因子和相关的对照基因。利用nsolver软件包对数据进行质量控制和归一化处理。将测量的表达值归一化为具有最低变异系数(%cv)的管家基因表达水平的几何平均值。利用nsolver高级分析模块和r软件包进行统计分析。是使用由haliodx开发的商业上可获得的专有算法定义的。
[0334]
实施例1a:ib期研究和结果
[0335]
研究人群
[0336]
9例患者(女4例以及男5例)加入该研究并按上述治疗方案用5
×
106pfu(dl1)或 5
×
107pfu(dl2)的tg4001联合10mg/kg阿维单抗治疗。表1说明了基线时患者的人口统计和特征。
[0337]
表1.患者人口统计学和基线特征。dl:tg4001剂量水平。ct:化疗。
[0338]
[0339][0340]
患者的基线特征如下:中位年龄57.8岁(39-78岁)具有有各种类型的hpv-16阳性癌(肛门癌、宫颈癌、口咽癌和阴道癌),主要是鳞状细胞癌起源的。基线时,所有患者均显示远处转移。
[0341]
治疗相关不良事件总结
[0342]
安全性通过报告不良事件(ae)和临床实验室检查、体检、心电图(ecg)和不同时间点的生命体征来评价。根据国家癌症研究所不良事件共同毒性标准(nci-ctcae)对不良事件和实验室异常进行评估。根据nci-ctcae 4.03版进行毒性分级。治疗相关的不良事件数据按剂量水平进行汇总,并在下表2中报告。
[0343]
表2.治疗相关不良事件总结。n:病人人数。%:患者百分比。#ae:不良事件数。 *:一名患者出现两个3级不良事件。
[0344]
[0345][0346]
如表2所示,所有患者至少经历过一次ae。具体来说,在9名患者中共观察到68 个不良事件:23个在dl1和45个在dl2。tg4001和阿维单抗组合治疗耐受性好。事实上,没有观察到与治疗相关的严重不良事件(sae),以及在一名dl1治疗的患者(5
×
10
6 pfu)中只观察到两个3级事件。
[0347]
肿瘤大小变化
[0348]
组合治疗期间肿瘤大小的变化如图1a和1b所示。如图所示,大多数dl2治疗的患者经历了肿瘤大小的缩小或稳定。
[0349]
在临床研究过程中,部分反应(pr)、稳定疾病(sd)和进行性疾病(pd)的数量和百分比,根据recist 1.1标准评价,也列于下表3。
[0350]
表3.部分反应(pr)、稳定疾病(sd)和进行性疾病(pd)的数量和百分比。
[0351]
[0352][0353]
表3和图1a和1b的结果表明,组合治疗能够在所有患者中的三分之二稳定疾病或诱导部分反应。tg4001(5
×
107pfu)的dl2剂量越大,疗效看起来越好,约83%的患者具有稳定疾病或部分反应。
[0354]
免疫数据
[0355]
针对hpv的特异性t细胞反应
[0356]
4例患者在第43天可评估针对hpv-16、e6和e7的elispot反应。下表4列出 elispot反应。
[0357]
表4.在第43天针对hpv-16 e6和e7的elispot反应。
[0358][0359]
n/a:不适用;-:观察到0个点;=:观察到《10个点; :观察到10-100个点; :观察到》100个点。
[0360]
表4显示elispot可评估的4例患者中有3例在第43天有e6或e7反应性t细胞。
[0361]
在治疗中til的变化
[0362]
在基线和第43天的cd8/cd3比率和treg(cd4 foxp3)/cd8比率如图2a和2b所示,表明治疗期间与cd8/cd3比率浸润的总体增加和treg(cd4 foxp3)/cd8比率的降低有关,这表明更有利的免疫状态(免疫刺激性因子cd8 t细胞的增强和免疫抑制因子 treg的降低)。
[0363]
在治疗中til和肿瘤细胞中pd-l1的表达
[0364]
7例患者在基线和第43天(以及1例患者也在85天)评估til和肿瘤细胞上pd-l1 的表达,其中5例在基线和第43天都可检测。结果呈现于下表5。
[0365]
表5.在基线、第43天和第85天(1例患者)用免疫组织化学(ihc)和免疫细胞评分测量pd-l1 肿瘤细胞的百分比。na:不适用。*患者在基线和第43天均可评估。
[0366]
[0367][0368]
表5的结果显示,在基线和第43天可评估的5例患者中,有4例在第43天在肿瘤细胞中pd-l1表达显著增加,这预期与对免疫疗法治疗的反应的倾向性增加有关。
[0369]
治疗过程中在肿瘤组织中基因表达变化分析
[0370]
为了探索疗法诱导的肿瘤组织中基因表达变化,在基线和治疗后(第43天)评估了 770个与免疫应答相关的基因的组的表达。特别是,研究了先前描述为15 和21的基因标签的表达(galon et al.,immunity(2013)9(1):11-26; marabelle et al.,society for immunotherapy of cancer(sitc)32
nd annual meeting& pre-conference programs(sitc 2017)on november 8-12,2017 at the gaylord nationalhotel&convention center in national harbor,maryland.poster p250)。
[0371]
治疗后与治疗前相比,鉴定为过表达的基因表达和通路中的变化的火山图如图3 和图4所示。黑点代表参与指示的机制的相关基因(如图3a中的t细胞激活等),与对数比例尺中的位置相关的表达水平(0值右侧为高表达以及0值左侧为低表达)。
[0372]
图3显示,与病毒疫苗应答(病原体防御,见图3c)和抗肿瘤免疫引发(t细胞激活,细胞毒性细胞和nk细胞功能,见图3a,3b和3d)相关的通路在治疗过程中过表达。
[0373]
此外,图4a显示先前描述为15和21的基因标签中包括的基因类别的描述,以及图4b和4c显示15和21标签的许多基因在治疗期间过表达。
[0374]
观察到的基因表达变化与先天免疫和适应性免疫的引发一致,并向“更热性”的肿瘤特性转移,这与患者改善的临床结果更一致地相关。
[0375]
患者0101006的病例分析
[0376]
对于患有宫颈癌的患者0101006提供了更详细的数据。
[0377]
免疫浸润的变化:
[0378]
患者0101006表现为肿瘤的浸润水平低,pd-l1在肿瘤细胞和浸润的免疫细胞上中
度表达,以及,cd8细胞和pd-l1表达的肿瘤细胞之间空间共定位程度低。所有这些特征在基线上与冷性肿瘤是一致的。
[0379]
图5显示免疫浸润的变化,以及下表6显示基线和第43天til和肿瘤细胞上pd-l1 的表达。
[0380]
表6.患者0101006在基线和第43天通过免疫组织化学(ihc)和免疫细胞评分测量 pd-l1 肿瘤细胞的百分比。
[0381]
时间点pd-l1 肿瘤细胞百分比(%)免疫细胞评分基线活检401第43天活检802
[0382]
图5和表6显示,在第43天,肿瘤的浸润明显增加,其中cd3浸润增加了4倍以上,cd8浸润增加了3倍,以及肿瘤和免疫表达pd-l1的浸润增加了一倍。通过免疫抑制细胞的浸润水平在治疗过程中没有观察到明显变化。
[0383]
此外,样本的数字病理学分析显示浸润的cd8聚集在pd-l1阳性的肿瘤细胞周围 (图5b),表明对检查点阻断的反应更有利的特性。
[0384]
基因表达的变化:
[0385]
患者肿瘤组织的基因表达谱也显示了治疗期间的显著变化,如770个免疫相关基因的彩色图所示(数据未显示)。
[0386]
对基因表达变化的分析进一步显示,与抗原加工和呈递(图6a)、对病毒的反应(图 6b)和toll样受体表达(图6c)相关的基因表达强烈增加。这些通路的激活与针对病毒疫苗的适应性反应的发展是一致的。
[0387]
此外,21标签的9个基因强烈过表达(图6e),表明免疫排斥表型向“热性”肿瘤的转移可能受益于免疫治疗干预。
[0388]
结论
[0389]
nct03260023 ib期初步结果显示:
[0390]
tg4001和阿维单抗的组合对于在已接受多个先前治疗线程的hpv阳性癌症患者中研究的tg4001的两个剂量水平是安全的并且是良好耐受的。
[0391]
组合在dl2提供有希望的疗效信号,并且在正在进行的ii期部分中进行评估。
[0392]
治疗与肿瘤微环境的变化有关,即使在严重预治疗的患者中,所述变化也可能通过将肿瘤从冷态转变为较热的免疫状态而改变病理过程。
[0393]
如个别研究病例所示,这可能对“免疫排除”肿瘤表型的患者特别有用。
[0394]
这些结果表明,(a)至少编码人乳头瘤病毒(hpv)e6和e7多肽和免疫刺激性细胞因子的痘病毒载体以及(b)抗pd-l1抗体的组合在治疗hpv-阳性的癌症患者中是安全的、耐受性好的和有效的(至少是累积的疗效)。
[0395]
例1b:ii期研究和合并中期分析
[0396]
病人/疾病特征
[0397]
对于ii期,tg4001在dl2施用。dl2是ib期结束后推荐的ii期剂量,并且得到以下结果的支持:显示tg4001和阿维单抗组合是安全的,以及在报告的ae的性质和严重程度上,dl1和dl2之间没有观察到明显差异。对于按照方案计划进行的中期分析,25例患者参加了这项研究,其中3例无法评估肿瘤反应。在22例可评估的患者中, 11例(50%)表现为肛门
癌,4例(18.2%)表现为宫颈癌,4例(18.2%)表现为阴道/外阴癌,以及3例(13.6%)表现为口咽癌。在纳入中期分析之前,另有7例患者被纳入其中,其中 1例患者的肿瘤反应无法评估。在6例可评估的患者中,4例(66.6%)表现为肛门癌,以及各有1例分别表现为口咽癌(16.6%)和宫颈癌(16.6)。
[0398]
对于亚组分析,在ib期部分接受tg4001 dl2治疗的患者(n=6)与在ii期部分接受治疗的患者(n=28如上文所述)合并。在ib期治疗的6例患者中,4例(66.6%)表现为口咽癌,以及各有1例分别表现为阴道癌(16.6%)和宫颈癌(16.6)。在汇集的数据集(n=34) 中,15例(44.1%)表现为肛门癌,8例(23.5%)表现为口咽癌,6例(17.6%)表现为宫颈癌,以及5例(14.7%)表现为阴道/外阴癌。已观察到orr为20.6%。
[0399]
合并的患者人群根据肝转移的存在(w/o相对于w如表7所示、疾病特征(表8)和先前化疗(表9)进行分层。
[0400]
表7提供了有肝转移和无肝转移患者亚组的性别和活动状态(ps)的概述。具体地说,无肝转移的患者亚组代表23例患者(非肝病患者),而有肝转移的患者亚组代表11 例患者(肝表现为患者)
[0401]
表7:无肝转移患者(非肝病患者)或有肝转移患者(肝病患者)的tg4001.12分层。ps:活动状态。pts:患者。
[0402][0403]
关于汇集数据集(n=34)中的疾病特征,如表8所示,15例患者表现为肛门癌,8 例患者表现为口咽癌,6例患者表现为宫颈癌,以及5例患者表现为阴道/外阴癌。观察到orr为20.6%。
[0404]
表8:按合并患者群体的疾病特征进行的分层。pts:患者。
[0405]
[0406][0407]
表9:按先前化疗方案或以前没有治疗的调查患者人群的分层。pts:患者。
[0408][0409]
患者/疾病特征与orr和pfs的相关性
[0410]
基于上述分层,评估每个患者/疾病特征与客观反应率(orr)或无进展生存期(pfs) 的相关性。
[0411]
每个患者/疾病特征与orr和pfs的相关性分别见图7和8。
[0412]
就orr而言,只有一个疾病特征(如图7所示)发现与较差的orr显著相关:肝转移的存在(见图7,显示or为100,95%区间为5-100,以及p值为0.012)。
[0413]
关于pfs,发现有三个特征与较差或较好的pfs显著相关(如图8方框中所示):
[0414]
肝转移的存在与较差的pfs显著相关(见图8,显示hr为4.390,95%区间为 1.728-11.152,以及p值为0.002),
[0415]
肛门癌,与较差的pfs显著相关(见图8,显示hr为3.214,95%区间为 1.269-8.143,以及p值为0.014),以及
[0416]
淋巴结转移的存在与较好的pfs显著相关(见图8,显示hr为0.388,95%区间为0.151-0.998,以及p值为0.049)。
[0417]
关于肛门癌与低pfs的关联性,应当注意,这种关联可以通过肛门癌患者中较高的肝转移患病率来间接解释。实际上,已经在肝脏中而不是在其它器官中呈现转移的肛门癌的患者中证明了应答。
[0418]
此外,就pfs而言,虽然与合并中期分析中分析的患者数量没有发现显著性 (p=0.073),观察到生殖器(外阴/阴道)癌与更好的pfs之间的相关性趋势。
[0419]
因此,与orr和pfs显著相关的唯一特征是肝转移的存在,其与更差的orr和 pfs显著相关。
[0420]
这种分层因此已经进行更透彻的研究。
[0421]
下表10进一步显示有或无肝转移患者的分布,其取决于疗效参数(recist1.1反应、 12周时的稳定疾病、12周前/时的进展和中位pfs),并显示,当采用组合治疗时,无肝转移患者与有肝转移的患者相比在12周时有更高的反应和稳定疾病,较低的12周前/ 时的进展和更高中位pfs。
[0422][0423]
表10.取决于疗效参数的具有或不具有肝转移患者的分布。*患者表现为12mm单个肝脏病变。
[0424]
图9显示了23例合并ib期和ii期中期结果无肝转移的患者肿瘤大小最佳变化的图形表示,图10显示了9例合并ib期和ii期中期结果有肝转移的患者相同的图形表示。
[0425]
下表11显示了根据原发肿瘤类型(肛门、口咽、颈部、外阴/阴道)有或无肝转移患者的分布,并显示,无论原发肿瘤如何,无肝转移患者的反应高于有肝转移患者(无论原发肿瘤如何,在这些患者中没有观察到反应)。表11还显示了无肝转移的外阴/阴道癌患者的高反应率(66.7%),尽管这一高反应率需要谨慎对待,因为分析的患者数量少(只有3例)。
[0426][0427]
表11.依据原发肿瘤的位置的有或无肝转移患者的分布。
[0428]
免疫数据
[0429]
针对hpv的特异性t细胞反应
[0430]
11例患者在第43天可评估针对hpv-16、e6和e7的elispot反应。表12显示, 11例患者中有7例在接种疫苗后通过离体elispot具有可检测的反应。在接种疫苗之前,没有一个病人在这个实验设定中有预先存在的反应。下表12列出elispot反应。
[0431]
表12.在基线和第43天,通过elispot评估具有针对hpv e6和e7的抗原反应性t细胞的患者。
[0432][0433]
n/a:不适用;-:0无反应; :》背景 2sd, :》背景 3sd观察到的点。
[0434]
免疫浸润
[0435]
在研究的i期进行的观察在2期得到证实,与标签相关的基因上升,并且cd3阳性细胞的浸润上升。
[0436]
转录组分析
[0437]
对有或无肝肿瘤转移的患者收集的肿瘤进行转录组分析,如材料和方法所述。
[0438]
本发明人能够显示肝转移中基因表达的变化。值得注意的是,如表13和图11所示,st6gal1(p《0.001)和hamp(p《0.0001)基因过表达(log2变化分别为2.74和7.15)。与补体途径相关的基因过表达包括c8a(log2变化6.71;p《0.001)、c8b(log2变化7.25; p《0.001)、c3
(log2变化3.41;p《0.001)、c6(log2变化5.87;p《0.001)和c2(log2变化 2.06;p《0.001)。
[0439]
st6gal1与许多癌症的侵袭性有关,以及hamp已知通过改变铁代谢调节免疫细胞活性。
[0440]
补体对肿瘤免疫的影响尚有争议,补体途径的高表达已被证明对包括效应子cd4 和cd8的免疫细胞具有细胞毒作用。鉴于肝脏是补体因子合成和调节的主要部位,这是有趣的。
[0441]
此外,与炎症相关的细胞因子也有代表性,并可以有助于免疫抑制肿瘤环境的产生。这种免疫抑制对效应免疫细胞是有害的,并可以驱动肿瘤的免疫逃逸和疾病的进展。
[0442]
因此,这些独特的转录组特征与具有肝转移的患者对免疫干预的抗性是一致的。
[0443]
[0444][0445]
表13:有或无肝转移患者间基因差异表达
[0446]
总之,对患者的临床观察强调了肝转移是对治疗的反应和临床结果的决定因素。基因组数据表明,肿瘤肝转移的特征是与免疫系统下调或肿瘤侵袭性相关的基因和通路的表达。
[0447]
结论
[0448]
总之,ib期和ii期的合并中期分析表明,肝转移的存在与orr降低和pfs缩短有关。事实上,通过对存在或不存在肝转移的患者进行分层,观察到无肝转移患者亚组中的orr为30.4%(n=23),相比之下有肝转移患者亚组的orr为0%(n=11)。类似地,无肝转移患者(n=23)的pfs中位数为5.6,而有肝转移患者(n=11)的pfs中位数仅为1.4。
[0449]
此外,ib期和ii期的合并中期分析还表明,由于肛门癌患者中肝转移的患病率较高,肛门癌与较低的pfs相关,而外阴/阴道癌表现出较高的pfs趋势。
[0450]
最后,淋巴结转移与较好的pfs相关。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。