1.本发明属于生物医药领域,具体涉及一种化疗免疫凝胶及其制备方法与应用。
背景技术:
2.影像引导下的微波消融(microwave ablation,mwa)技术已被一些临床指南纳为实体肿瘤的一线治疗方法。随着工程技术的发展,mwa不断完善、优势不断提升,并逐渐在中国以及欧美国家推广,但由于肿瘤大小、位置等因素导致的肿瘤微波消融不彻底(inadequate microwave ablation,imwa)仍然是一个亟待解决的临床难题。据报道,肿瘤消融治疗后局部复发率约为15%。然而,当采用经皮消融法或肿瘤体积较大(直径大于3cm)时,肿瘤治疗后局部复发率可高达60%。更重要的是,研究证据表明,mwa治疗后的残余肿瘤具有高度侵袭性的表型,是导致患者病情迅速恶化和预后不良的主要原因,也是限制mwa广泛应用的关键因素。因此,确定并进一步抑制imwa后导致残余肿瘤迅速进展的潜在原因是特别必要和紧迫的。
3.如今,肿瘤mwa治疗后通常选择化疗、放疗的单一或者联合应用来治疗。然而,由于肿瘤非特异性引发正常细胞的细胞毒性致使临床副作用极大。此外,大多数患者在经过规律治疗后仍会复发或转移。目前,基于消融技术和免疫治疗的肿瘤联合治疗策略不断发展,利用自我免疫或适应性免疫来对抗肿瘤的临床疗效已经得到了有力的验证。因此,人们强烈要求了解肿瘤不完全消融的促癌作用的免疫学机制,并开发新的免疫治疗策略,积极调控肿瘤免疫微环境,以期最大程度地提高现有局部消融疗法的临床疗效。
技术实现要素:
4.本发明旨在至少解决上述现有技术中存在的技术问题之一。为此,本发明提出一种化疗免疫凝胶,能够用于微波消融不彻底(imwa)后的残余肿瘤的治疗,有效杀灭残余肿瘤及抑制肿瘤复发和转移。
5.本发明还提出上述化疗免疫凝胶的制备方法。
6.本发明还提出上述化疗免疫凝胶的应用。
7.根据本发明的一个方面,提出了一种化疗免疫凝胶,所述化疗免疫凝胶为包含奥沙利铂和ipi549的纤维蛋白水凝胶;所述ipi549为磷酸肌肽3-激酶γ抑制剂,其化学式如下所示:
[0008][0009]
奥沙利铂(oxaliplatin),又称乐沙定、草酸铂,属于铂类衍生物,是继顺铂、卡铂之后的第三代新型铂类抗肿瘤化合物,也是迄今为止唯一对结肠直肠癌具有显著活性的络铂类药物。奥沙利铂的抗肿瘤作用原理是通过产生烷化结合物作用于dna,形成链内和链间交联抑制dna的合成及复制。
[0010]
pi3k是一种胞内磷脂酰肌醇激酶,与v.src和v.ras等癌基因的产物相关,且pi3k本身具有丝氨酸/苏氨酸(ser/thr)激酶的活性,也具有磷脂酰肌醇激酶的活性。pi3k抑制剂目前抑制4种pi3k亚型,磷酸肌肽3-激酶γ(pi3kγ)为其中一种。
[0011]
在本发明的一些实施方式中,所述奥沙利铂的浓度为1~2mg/ml;和/或所述ipi549的浓度为0.2~0.4mg/ml。
[0012]
在本发明的一些实施方式中,所述纤维蛋白水凝胶为纤维蛋白原溶液与凝血酶反应后形成的纤维蛋白凝胶支架;所述奥沙利铂和所述ipi549负载于所述纤维蛋白凝胶支架中。
[0013]
根据本发明的再一个方面,提出了上述化疗免疫凝胶的制备方法,包括以下步骤:
[0014]
s1:将奥沙利铂和ipi549加入纤维蛋白原溶液,经超声波处理,并37度孵育后,得到混合溶液;
[0015]
s2:将凝血酶溶液和所述混合溶液混合,得到所述化疗免疫凝胶。
[0016]
在本发明的一些实施方式中,步骤s2中所述经超声波处理的时间约为3分钟,所述37度孵育的时间约为半小时。在本发明的一些实施方式中,步骤s1中所述纤维蛋白原溶液的浓度为40~60mg/ml。
[0017]
在本发明的一些实施方式中,步骤s2中所述凝血酶溶液和所述混合溶液按1:(1~3)的体积比混合;所述凝血酶溶液的浓度为300~800iu/ml。
[0018]
根据本发明的再一个方面,提出了上述化疗免疫凝胶在制备治疗微波消融后残余肿瘤的药物中的应用。
[0019]
在本发明的一些实施方式中,所述微波消融后残余肿瘤包括在进行微波消融术后残留或复发的肿瘤。
[0020]
在本发明的一些实施方式中,所述治疗微波消融后残余肿瘤的药物为能够抑制微波消融后残余肿瘤复发和转移的药物。
[0021]
在本发明的一些实施方式中,所述药物具有以下i~iii特征中的至少一个:
[0022]
i、局部给药治疗;
[0023]
ii、调节肿瘤微波消融术后免疫抑制微环境;
[0024]
iii、诱发长期免疫记忆效应。
[0025]
在本发明中,针对残余肿瘤所处的免疫抑制微环境,优化免疫治疗组合的设计,以克服耐药机制。
[0026]
本发明至少具有以下有益效果:本发明的化疗免疫凝胶包含有效药物成分奥沙利铂(ox)和磷酸肌3-激酶γ抑制剂(ipi549)的纤维蛋白水凝胶,该化疗免疫凝胶将一种免疫性的细胞死亡诱导化疗剂(ox)和一种药物性的pi3kγ抑制剂(ipi549)混合起来,针对imwa后肿瘤特有的免疫抑制微环境以逆转消融后的免疫抑制;同时,所述化疗免疫凝胶通过pi3kγ依赖性免疫抑制效应的阻断和ox治疗带来的免疫原性肿瘤表型的增强,可以实现强大的全身性抗癌免疫,抑制远处肿瘤和转移,并提高长期生存率,特别是对于不完全微波消融治疗(imwa)后的残余肿瘤具有较好的治疗效果。
附图说明
[0027]
下面结合附图和实施例对本发明做进一步的说明,其中:
[0028]
图1为本发明实施例1中小鼠模型imwa构建的实验流程图、荧光成像实验和rna-seq检测实验结果图;
[0029]
图2为本发明实施例1中小鼠模型imwa的多重免疫组化(mihc)和流式(fcm)分析实验结果图;
[0030]
图3为本发明实施例2中化疗免疫凝胶的制备方法图和表征结果数据图;
[0031]
图4为本发明实施例3中化疗免疫凝胶对局部残癌的肿瘤抑制结果图以及ox产生免疫原性细胞死亡相关物质的表达;
[0032]
图5为本发明实施例3中化疗免疫凝胶对局部残癌的fcm和mihc分析实验结果图;
[0033]
图6为本发明实施例4中化疗免疫凝胶对转移瘤的局部肿瘤抑制实验结果图;
[0034]
图7为本发明实施例4中化疗免疫凝胶对转移瘤的mihc实验结果图;
[0035]
图8为本发明实施例4中化疗免疫凝胶对转移瘤的肺转移抑制实验结果图;
[0036]
图9为本发明实施例5中化疗免疫凝胶对诱发长期免疫记忆效应评估实验结果图。
具体实施方式
[0037]
以下将结合实施例对本发明的构思及产生的技术效果进行清楚、完整地描述,以充分地理解本发明的目的、特征和效果。显然,所描述的实施例只是本发明的一部分实施例,而不是全部实施例,基于本发明的实施例,本领域的技术人员在不付出创造性劳动的前提下所获得的其他实施例,均属于本发明保护的范围。实施例中所使用的试验方法如无特殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,均可从商业途径得到的试剂和材料。
[0038]
实施例1:小鼠模型imwa建立及分析
[0039]
建立小鼠模型imwa加速了肿瘤的进展并诱导免疫抑制,小鼠模型的建立和实验过程为:balb/c小鼠(6-8周大)在右侧斜腹部接种ct26结直肠癌细胞(每只小鼠接种含有1x106个细胞的pbs100μl)。当肿瘤体积增长到约100mm3时(肿瘤植入后第7天)开始治疗,并
随机分组和处理。使用微波治疗仪(eco-100e,中国南京颐高微波电器研究所)建立不完全消融的小鼠模型。麻醉荷ct26肿瘤小鼠后,经皮将1厘米活性针头的冷尖mwa针放置在肿瘤长轴的中间,消融的功率和时间分别控制在5瓦和1-1.5分钟。然后通过拍照和生物发光信号监测残留的肿瘤负担(tumor burden)。同时用数字卡尺仔细测量肿瘤,并按以下公式计算体积(mm3)(长径
×
短径2)/2。在治疗后第3天,收集、切除肿瘤通过rna-seq检测到编码促炎症细胞因子和趋化因子的基因以及免疫抑制相关的基因在残余肿瘤中被上调。通过流式细胞仪分析和多重免疫组化检测揭示了由骨髓细胞介导的免疫抑制作用而促进癌症的发展。
[0040]
实验结果分析:
[0041]
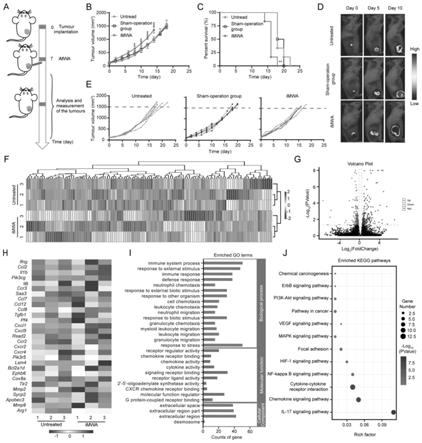
图1中a为小鼠模型imwa构建的实验流程图,图1中b-e的实验结果图显示了相比较于未处理组和假手术组,imwa明显促进了肿瘤的生长,具体的,图中untreated:未处理组、sham-operation group:假手术组、imwa:不完全微波消融组,结果为相比较于对照组(未处理的小鼠)和假手术组(在小鼠肿瘤对侧皮肤消融的小鼠)而言,不完全微波消融小组的肿瘤整体的生长速度明显增加,生存期减少;图1中h-j为rna-seq检测结果图,rna-seq分析显示imwa与对照组之间不同基因的表达差异,显示了rna-seq检测到imwa组编码促炎症细胞因子和趋化因子的基因以及免疫抑制相关的基因在残余肿瘤中被上调。
[0042]
图2中a-j为多重免疫组化(mihc)和流式(fcm)结果图,显示了由骨髓细胞介导的免疫抑制作用而促进癌症的发展。其中cd11b
骨髓细胞、粒性骨髓来源的抑制性细胞(cd11b
ly6g
hi
)、m2型巨噬细胞免疫抑制细胞上调,而具有杀伤作用的cd8
t细胞下调。
[0043]
本发明首次系统地用小鼠肿瘤模型探索imwa后残余肿瘤的基因特征和浸润性免疫细胞表型,通过rna-seq分析探索了imwa后残余肿瘤的基因特征,并通过流式细胞仪分析和多重免疫组化检测揭示了深入浸润的免疫细胞表型。本发明提出的消融后肿瘤微环境应该代表了一种高杠杆的环境,在这种环境下,可以允许实施基于mwa的抗癌免疫疗法。证明了骨髓细胞介导的免疫抑制作用在不充分消融后的肿瘤快速残留进展中发挥了重要作用。
[0044]
实施例2:化疗免疫凝胶药物的制备和鉴定
[0045]
本实施例制备了一种化疗免疫凝胶药物,其制备方法具体包括以下步骤:
[0046]
将纤维蛋白原溶液(50mg/ml)溶解在去离子水或pbs中并在超声下混匀3分钟。然后将纤维蛋白原溶液加热到37℃,持续30分钟。然后将凝血酶(500iu/ml)溶于去离子水或pbs(含26mg/l nacl和7mg/l cacl2)。载药凝胶的制备是通过将预定量的ox(终浓度1mg/ml)和ipi549(终浓度0.25mg/ml)加入到上述纤维蛋白原溶液中(在此步骤中,当分别只加ox或ipi549时,可分别制备出用于对照实验的ox@gel和ipi549@gel)。然后用双管注射器将凝血酶和纤维蛋白原溶液以1:2的体积比混合,几秒内形成纤维蛋白凝胶(200μl)。制备得到的化疗免疫凝胶在后续实施例中命名为“ox&ipi549@gel”。
[0047]
化疗免疫凝胶药物的表征:通过以下实验验证并分析了凝胶支架和化疗免疫的材料表征。通过低温扫描电子显微镜(cryo-sem)确认了纤维蛋白凝胶的多孔和松散的网络结构,通过压汞测试其孔径的大小约为6μm,通过流变学特性分析(如弹性模量(g
′
)、粘性模量(g
″
)),当弹性模量g
′
超过粘性模量g
″
时,证明凝胶的成功合成。进一步测试了纤维蛋白凝胶的成功形成,拍照记录体内外的缓慢降解,he染色证实其良好的生物相容性和安全性,以及化疗免疫凝胶中药物的均匀分布和缓慢释放(如图3中i在共聚焦显微镜下,用荧光代替
药物可以看到荧光呈现的均匀分布)。
[0048]
实验结果分析:
[0049]
图3中a-b为成功制备得到的化疗免疫凝胶,混合后状态成胶状。图3中c-f为化疗免疫凝胶多孔和松散的网络结构电镜图和流变学特性实验结果图,验证其凝胶结构的成功制备。图3中g-h显示了化疗免疫凝胶缓慢降解以及生物安全性和相容性。图3中j-l显示了化疗免疫凝胶成功装载药物并缓慢释放。
[0050]
针对imwa后肿瘤特有的免疫抑制微环境,本实施例合理地开发了一种水凝胶支架支持的化疗免疫凝胶药物组合治疗策略,将一种免疫性的细胞死亡诱导化疗剂(ox)和一种药物性的pi3kγ抑制剂(ipi549)混合起来,以逆转消融后的免疫抑制。
[0051]
全身给药是临床上常用的给药方式,会对正常组织产生明显的毒性和其他副作用。因此,与静脉注射相比,局部治疗方法应该对癌症治疗有相当大的吸引力,因为它们具有强大的针对性,可以改变药物在体内的再分布。工程输送支架可以控制药物的释放,具有理想的生物安全性和生物相容性,目前是一种有吸引力的药物输送工具。因此,本发明在原位纤维蛋白水凝胶支架启用的化疗免疫治疗策略的基础上,通过混合免疫原性细胞死亡诱导化疗药物ox和药理学pi3kγ抑制剂(ipi549)来逆转消融性肿瘤的免疫抑制作用,开发出一种高效的肿瘤联合治疗模式。相应的纤维蛋白水凝胶支架的制备,材料表征验证,成功载药和缓慢的药物释放结果以及材料的生物安全性和生物相容性验证。
[0052]
实施例3:化疗免疫凝胶对局部残癌的治疗研究
[0053]
化疗免疫凝胶在局部残癌小鼠模型中的抗肿瘤研究:在局部残癌小鼠模型中验证化疗免疫凝胶(ox&ipi549@gel)疗效并分析抗肿瘤免疫机制。具体的实施方法如下:
[0054]
将ct26
luc
结直肠癌细胞植入balb/c小鼠的右侧斜腹中。当肿瘤体积增长到100mm3时(肿瘤植入后第7天),用上述方法建立imwa模型,然后在残留的肿瘤周围植入不同的药物体系,包括vehicle(凝胶)、ox@gel(ox,每千克小鼠10mg)、ipi549@gel(ipi549,每只小鼠50μg)和ox&ipi549@gel(ox,每千克小鼠10mg;ipi549,每只小鼠50μg)。用游标卡尺仔细测量肿瘤的大小。同时,还使用体内生物发光成像系统来检测肿瘤的生长情况:腹腔注射溶解在pbs中的d-荧光素(15毫克/毫升),剂量为10微升/克,10分钟后对小鼠进行成像,曝光时间为60秒。进一步切除肿瘤进行fcm分析、h&e染色、毛细血管充盈试验(crt)、hmgb1免疫荧光染色和mihc分析。
[0055]
实验结果分析:
[0056]
图4中c-i显示了化疗免疫凝胶(ox&ipi549@gel)相比较于对照组以及只用ox@gel和ipi549@gel具有良好的抑制imwa后肿瘤的生长,并显著延长其生存期。h显示了ipi549对pi3kγ的抑制作用。
[0057]
图5中a-j为fcm和mihc分析实验结果图,显示了免疫粒性骨髓来源的抑制性细胞(cd11b
ly6g
hi
)明显被抑制,而具有杀伤作用的cd8
t细胞被激活以及m1/m2的比例明显上调。
[0058]
上述实验结果表明,ox&ipi549@gel的植入可以提高特异性细胞毒性t淋巴细胞(cytotoxic lymphocytcs,ctl)的频率,减少免疫抑制性细胞成分,从而将肿瘤免疫微环境(time)改变为一个更有利于发挥抗肿瘤免疫疗法的环境。
[0059]
化疗免疫凝胶(ox&ipi549@gel)成功制备后在动物模型上验证疗效,本实施例首
先是在局部残癌模型中验证疗效并分析抗肿瘤免疫机制。
[0060]
实施例4:化疗免疫凝胶对转移瘤的治疗研究
[0061]
化疗免疫凝胶在转移瘤小鼠模型中的抗肿瘤研究:在模拟转移瘤模型和肺转移模型上验证疗效并分析抗肿瘤免疫机制。具体的实施方法如下:
[0062]
4.1模拟转移瘤模型实验
[0063]
为了评估对小鼠ct26模拟转移瘤的治疗效果,将悬浮在pbs中的1
×
106个ct26luc细胞接种到小鼠的左右两侧斜腹部位。等到生长到第七天,和之前一样进行部分消融,右侧的肿瘤用不同治疗方式处理,包括vehicle(凝胶)、ox@gel(ox,每千克小鼠10mg)、ipi549@gel(ipi549,每只小鼠50μg)和ox&ipi549@gel(ox,每千克小鼠10mg;ipi549,每只小鼠50μg)。而左侧的肿瘤完全不处理。在注射d-荧光素后的第0、5和10天检测这两个肿瘤的生物发光图像,同时每两天用游标卡尺监测肿瘤大小,直到小鼠达到终点。进一步切除肿瘤进行fcm分析和mihc分析。
[0064]
4.2肺转移模型实验
[0065]
为了评估小鼠肿瘤肺转移的治疗效果,6只balb/c小鼠(6-8周大)在右侧斜腹植入ct26细胞后7天,和之前一样进行部分消融imwa后用ox&ipi549@gel治疗并通过尾静脉静脉输注ct26luc细胞(1
×
105)构建肺转移模型。选择6只性别和年龄匹配的小鼠作为对照,同样通过尾静脉静脉输注ct26luc细胞(1
×
105)。用ivis成像系统监测和记录肿瘤的肺部转移。最后,收集肺部并固定在bouin溶液中。通过显微镜观察肺叶的转移情况,随后通过病理分析进行研究。结果示ox&ip549@gel治疗的局部肿瘤抑制效果明显,对侧部位的肿瘤生长也明显减少。与治疗结果一致,远处肿瘤中免疫抑制性淋巴细胞的比例,包括粒性骨髓来源的抑制性细胞(cd11b
ly6g
hi
)、m2样巨噬细胞和tregs明显减少,这与cd45
白细胞和活化的cd8
t细胞浸润增强,以及ctl/tregs和m1/m2比值增加相一致。
[0066]
实验结果分析:
[0067]
图6中a-d显示了ox&ip549@gel治疗后的局部肿瘤抑制效果明显,对侧部位的肿瘤生长也明显减少,小鼠生存期明显延长。
[0068]
图7为fcm和mihc实验结果图,显示了粒性骨髓来源的抑制性细胞(cd11b
ly6g
hi
)m2样巨噬细胞和tregs明显减少,cd8 t细胞浸润增强,以及ctl/tregs和m1/m2比值也显著增加。
[0069]
图8中a-c显示了在ox&ip549@gel组几乎没有观察到明显的肺转移迹象,其活体荧光值和结节的数量明显减少,表明这种局部化疗免疫疗法对肿瘤转移的抑制作用很强。
[0070]
由于残留的肿瘤细胞具有固有的侵袭性,微波消融不彻底的患者很有可能发生肿瘤转移。因此,普遍认为,理想的癌症治疗方案不仅要切除原发肿瘤,而且要抑制或消除任何残留的癌细胞。因此本实施例在模拟转移瘤模型和肺转移模型上验证疗效并分析抗肿瘤免疫机制。
[0071]
实施例5:化疗免疫凝胶对诱发长期免疫记忆效应评估
[0072]
对化疗免疫凝胶药物组合策略诱发长期免疫记忆效应进行评估,具体实验方法为:为了评估ox&ipi549@gel治疗后的长期抗癌免疫记忆效果,单侧局部小鼠治疗模型中接受ox&ipi549@gel处理的12只小鼠中,有4只痊愈无瘤存活。在第70天的时候对这些小鼠的对侧(左侧)斜腹部重新接种ct26luc细胞,以评估长期免疫记忆治疗效果(图9中d)。同时,
四个性别和年龄匹配的小鼠接种相同数量的ct26luc肿瘤细胞,作为对照。肿瘤再接种后的第20天收集小鼠的脾脏,通过流式细胞仪测定记忆t细胞。结果显示,在接受基于ox&ipi549@gel的化疗的小鼠中,cd8
和cd4
t细胞群中效应记忆t细胞的比例都明显增加,而对免疫记忆不太重要的tcm的比例却没有受到影响,甚至有所下降。此外,在ox&ip549@gel治疗组中,观察到更高的血清ifn-γ和tnf-α水平,这表明联合治疗策略建立了强大的抗肿瘤免疫反应。
[0073]
实验结果分析:
[0074]
图9中e-k为记忆模型小鼠肿瘤生长评估以及免疫分析其效应记忆t细胞,显示了在接受基于ox&ipi549@gel的化疗后再接种肿瘤的小鼠肿瘤的生长明显抑制,并且fcm显示了效应记忆t细胞的比例明显增加。
[0075]
免疫记忆反应是适应性免疫的一个标志,通过它,免疫系统可以记住入侵生物体的病原体并赋予持久的免疫力。本实施例对化疗免疫凝胶药物组合策略诱发长期免疫记忆效应评估。
[0076]
目前,根据临床实践指南,微波消融越来越被确立为众多难以治疗的实体肿瘤的可靠治疗方法。尽管局部治疗对一些患者有良好的效果,但病变复发或不完全消融仍是一个治疗上的难题。了解不完全消融的促癌作用的免疫学机制,并开发新的调节消融术后免疫抑制微环境的药物组合策略,积极调控肿瘤免疫微环境,才能最大限度地提高现有局部消融疗法的临床治疗效能。
[0077]
本发明实施例至少具有以下有益效果:
[0078]
(1)针对imwa后肿瘤特有的免疫抑制微环境优化免疫治疗组合,合理地开发了一种水凝胶支架支持的化疗免疫凝胶药物组合治疗策略,将一种免疫性的细胞死亡诱导化疗剂(ox)和一种药物性的pi3kγ抑制剂(ipi549)混合起来,以逆转消融后的免疫抑制;
[0079]
(2)通过pi3kγ依赖性免疫抑制效应的阻断和ox治疗带来的免疫原性肿瘤表型的增强,可以实现强大的全身性抗癌免疫,抑制远处肿瘤和转移,并提高长期生存率,实现精准医疗的抗癌治疗计划;
[0080]
(3)与相关技术中用于输送化疗或免疫药物的纳米载体的未解决或有争议的生物安全问题相比,本发明中构建的基于ox&ipi549@gel的化疗免疫凝胶药物组合中的所有成分都已被fda批准用于临床使用,因此其临床转化潜能较大。
[0081]
上面结合附图对本发明实施例作了详细说明,但是本发明不限于上述实施例,在所属技术领域普通技术人员所具备的知识范围内,还可以在不脱离本发明宗旨的前提下作出各种变化。此外,在不冲突的情况下,本发明的实施例及实施例中的特征可以相互组合。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。