用于治疗多发性硬化症的少突胶质细胞来源的细胞外囊泡
1.关于联邦资助的研究或开发的声明
2.本发明是在美国国立卫生研究院(nih)授予的基金号5-ro1-ai106026-13的政府支持下完成的。政府对本发明享有一定的权利。
背景技术:
3.多发性硬化症(ms)是一种中枢神经系统(cns)的自身免疫性疾病,其中免疫系统攻击由少突胶质细胞产生的cns髓鞘质的一种或多种组分。髓鞘质含有多种组分,并且尚不清楚它们中哪些是ms患者中自身免疫反应所靶向的。缺乏对免疫系统靶向的一种或多种髓鞘质组分的了解、患者之间的变异性以及疾病过程期间自身免疫反应特异性的可能变化,使得难以开发针对ms的抗原特异性疗法。到目前为止,已经提出了许多抗原特异性疗法。然而,没有一个在临床上显示出有希望的结果。因此,本领域需要一种不要求确定多发性硬化症中免疫系统靶向的具体髓鞘质组分的治疗ms的策略。本公开内容解决了该需要。
技术实现要素:
4.在一个方面,提供了在有需要的受试者中治疗和/或防止多发性硬化症(ms)的方法,该方法包括向受试者施用有效量的少突胶质细胞来源的细胞外囊泡(o1-ev)。在一些实施方式中,ol-ev包含髓鞘质抗原(ag)。在一些实施方式中,髓鞘质ag包含髓鞘质碱性蛋白(mbp)、髓鞘质少突胶质细胞糖蛋白(mog)和/或髓鞘质蛋白脂蛋白(plp)。在一些实施方式中,方法是ag特异性的。在一些实施方式中,施用诱导免疫抑制性单核细胞。在一些其他实施方式中,免疫抑制性单核细胞表达pd-l1。在一些实施方式中,施用不会对受试者的免疫系统造成任何有害或不期望的影响。在仍其他实施方式中,少突胶质细胞来源的细胞外囊泡被配制在包含至少一种药学上可接受的载体的药物组合物中。在一些实施方式中,药物组合物静脉内、皮下、皮内、经皮、口服或鼻腔施用。在一些实施方式中,受试者是哺乳动物。在一些实施方式中,受试者是人。在一些实施方式中,ms是慢性ms或复发-缓解型ms。
5.在另一个方面,提供了包含少突胶质细胞来源的细胞外囊泡(o1-ev)和至少一种药学上可接受的载体的药物组合物。在一些实施方式中,ol-ev包含髓鞘质抗原(ag)。在一些实施方式中,髓鞘质ag包含髓鞘质碱性蛋白(mbp)、髓鞘质少突胶质细胞糖蛋白(mog)和/或髓鞘质蛋白脂蛋白(plp)。在一些其他实施方式中,组合物被配制用于静脉内、皮下、皮内、经皮、口服或鼻腔施用。
附图说明
6.当结合附图阅读时,将更好地理解以下对本发明的所选的实施方式的详细描述。为了说明本发明,在附图中示出了所选的实施方式。然而,应当理解,本发明不限于附图中所示的实施方式的精确设置和手段。
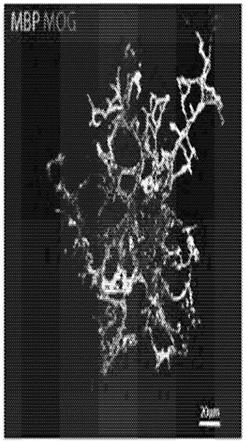
7.图1a-1g图示了成熟的少突胶质细胞(ol)释放含有髓鞘质蛋白的细胞外囊泡(ev)。(图1a)对于mbp(绿色)、mog(红色)和细胞核(蓝色)染色的成熟ol的代表性免疫荧光
(if)。比例尺20μm,放大倍数60
×
。(图1b)纯化的ol-ev的冷冻电子显微镜;比例尺200nm。(图1c)根据misev 2018指南,来自定量质谱分析的与ev相关的显著富集蛋白质的热图。表达基于z评分的无标记定量(lfq)并表示为log2。显示了每个条件的三个重复的平均值。(图1d)质谱法测定的ol-ev的相关髓鞘质蛋白含量。显示了每个条件的三个重复的平均值。将值对opc来源的ev标准化,并显示为log2。(图1e)在ol-ev团粒中通过elisa(平均值
±
sem)定量mbp、mog和plp,n=10/组。(图1f)用ol-ev或hek-ev i.v.处理的首次用于试验的c57bl/6小鼠的存活曲线,n=15/组。(图1g)通过elisa(平均值
±
sem)测定注射ol-ev(红点)的首次用于试验的c57bl/6小鼠血清中的抗mog ig浓度。从未注射的首次用于试验的小鼠(假试验组(sham),空心圆圈)或从用rmog
1-125
(ctrl ,黑点)免疫的eae小鼠收集对照血清,n≥5/组。所有实验至少执行两次。(e和g)通过bonferroni事后检验的单因素anova,****p《0.00001。
8.图2a-2g图示了ol-ev/i.v.预防性和治疗性地抑制活性eae。(图2a-2f)在c57bl/6、b10.pl或sjl/j小鼠中i.v.注射(红色箭头)大约10
10
个同系(syngeneic)ol-ev或hek-ev,小鼠分别用mog
35-55
、mbp
ac1-11
或plp
139-151
免疫用于eae诱导。ol-ev处理是预防性的(图2a-2c;在c57bl/6和b10.pl eae小鼠中1、4和7d.p.i.;或sjl/j eae小鼠中的-7和-2d.p.i.)或治疗性的(图2d-2f;在c57bl/6和b10.pl eae小鼠中11、14和17d.p.i.;或在sjl/j eae小鼠中24、27和30d.p.i.)。将肽mog
35-55
(200μg/小鼠)、mbp
ac1-11
(400μg/小鼠)和plp
139-151
(100μg/小鼠)i.v.并行注射进行比较。每种肽的剂量/i.v.与eae诱导免疫中使用的剂量相同。这些实验至少进行了两次并且具有相似的结果(每次实验n=10只小鼠/组)。符号描绘每日平均值
±
s.e.m。通过bonferroni多重比较的双因素anova分析数据;*p《0.01;**p《0.001;***p《0.0005;****p《0.00001。(图2g)如(d-f)中所述处理的eae小鼠的存活率(%),n=15-30只小鼠/组。通过gehan-breslow-wilcoxon检验分析数据,***p《0.0001。
9.图3a-3k图示了来自ol-ev的髓鞘质ag在体内呈递给t细胞,并且通过ol-ev对eae的抑制是髓鞘质ag依赖性的。(图3a)使用ol-ev或对照hek-ev,或mog
35-55
肽(100μg)(每次实验n=5/组)i.v.处理mog特异性tcr转基因小鼠(2d2)后6、24和48小时的循环血液cd4 t细胞的时程(平均值
±
sem)。(图3b和图3c)从注射ol-ev的2d2小鼠的循环血液cd4 t细胞中的胱天蛋白酶3表达(平均值
±
sem)。(图3d-3i)将用cfse标记的5
×
106个2d2或ot-ii幼稚cd4 t细胞注射到cd45.1 受体小鼠中。48小时后,用含有mog
35-55
cfa或ova
323-339
cfa的乳液s.c.免疫小鼠,或用10
10
个hek-ev或ol-ev i.v.注射小鼠。72小时后,收集脾脏并通过流式细胞术分析cd45.2
cd4
t细胞(2d2和ot-ii)。2d2和ot-ii细胞的(图3d、3f)细胞因子产生(ifn-γ、il-17a)、pd-1表达(图3e、3i)和增殖(cfse稀释,图3g和图3h)(平均值
±
sem)。这些实验进行了两次,具有相似的结果(每次实验n=5只小鼠/组)。(图3a、3f、3h和3i)中的数据通过bonferroni事后检验的双因素anova进行分析;*p《0.05;**p《0.001;***p《0.0005;****p《0.00001。未配对t检验(针对ot-ii cd4 t细胞组);***p《0.0001;p《0.00001。(图3j)来自mog缺陷型ol、对照ol、hek-ev或pbs(假试验组)的大约10
10
个ol-ev i.v.注射到mog
35-55
免疫的c57bl/6小鼠中。在图中通过红色箭头所示的d.p.i.上给予注射。(图3k)将来自wt(mbp
/
)或mbp-/-(颤抖(shiverer)小鼠)b10.pl ol的ol-ev i.v.注射到用mbp
ac(1-11)
免疫的b10.pl eae小鼠中。对照小鼠被注射hek-ev或pbs(假试验组)。这些实验进行了两次,具有相似的结果(每次实验n=5-7只小鼠/组)。符号描绘每日平均值
±
s.e.m。通
过bonferroni多重比较的双因素anova分析数据;****p《0.00001。
10.图4a-4f图示了ol-ev被单核细胞、中性粒细胞和cdc摄取,但后两者对于ol-ev对eae抑制是可有可无的。(图4a、图4b)门控策略鉴定来自cns和脾脏的td-tomato
cd11b
中性粒细胞(ly6g
ly6c
)和单核细胞(ly6g-ly6c
)。这些实验进行了两次,具有相似的结果(每次实验n=5只小鼠/组)。(图4c、4d)用mog
35-55
免疫的转基因c57bl/6rosa26.stop.td-tomato小鼠在疾病发作时i.v.注射大约10
10
个含有cre重组酶的ol-ev,或也含有cre的hek-ev。两天后,通过流式细胞术分析脾脏和cns细胞。在脾脏(图4c)和cns(图4d)中表达td-tomato的cd4
t细胞、b细胞(cd19
)、小神经胶质细胞(cd45
低
ly6c-cd11b
)、中性粒细胞(ly6g
)和单核细胞(ly6c
)的代表性直方图。来自注射了cre
hek-ev和cre
ol-ev(如图所示)的小鼠的td-tomato
细胞的分布相似。(图4e)c57bl/6eae小鼠通过在疾病发作(13和16d.p.i.)时i.p.注射抗ly6g ab(克隆1a8,200μg/小鼠/注射)耗尽中性粒细胞。对照小鼠注射同工型对照ab。14、17和20d.p.i.i.v.注射ol-ev或hek-ev(红色箭头)。符号描绘每日平均值
±
s.e.m。(图4f)照射cd45.1
小鼠和用zbtb46 idtr或cd45.1
骨髓移植,并用mog
35-55
免疫。在eae发作后每三天i.p.注射dtx(20ng/克)完成cdc耗尽(zbtb46
mhcii
cd11c
)。在13、15和18d.p.i.i.v.注射ol-ev或hek-ev(红色箭头)。符号描绘每日平均值
±
s.e.m。所有eae实验进行了至少两次,具有相似的结果(n=5-7只小鼠/组)。通过bonferroni多重比较的双因素anova分析eae实验;****p《0.00001。
11.图5a-5j图示了ol-ev诱导免疫抑制性modc。(图5a)在cre
hek-ev或cre
ol-ev注射后2天,从rosa26.stop.td-tomato eae小鼠中分选脾脏和cns单核细胞(cd45
cd11b
ly6c
高
ccr2
ly6g-td-tomato
),通过qpcr进行基因表达分析。值相对于cre
hek-ev处理小鼠的单核细胞进行标准化,并显示为log2。使用未配对t检验分析数据;不显著(ns);*p《0.05;**p《0.001;***p《0.0005;****p《0.00001。(图5b、5c)来自接受hek-或ol-ev的eae小鼠的脾脏和cns il-10
和pd-l1
单核细胞的百分比(平均值
±
sem)(每次实验n=5只小鼠/组)。使用未配对t检验分析数据;****p《0.00001。(图5d-5g)流式细胞术分析用于在疾病发作时开始的用hek-或ol-ev注射3次的eae小鼠的脾脏和cns cd4
t细胞中的胱天蛋白酶3和pd-1(平均值
±
sem)。使用未配对t检验分析数据;**p《0.001;***p《0.0005。这些实验进行了两次,具有相似的结果(每次实验n=5只小鼠/组)。(图5h)脾脏和cns单核细胞(pd-l1
ccr2
ly6c
)与胱天蛋白酶3
和pd-1
cd4 t细胞的spearman相关性分析(n=10)。(图5i)c57bl/6eae小鼠在疾病高峰期移植2
×
106个分选的来自用ol-ev(红色)或hek-ev(黑色)处理的eae小鼠的cns的td-tomato
modc(红色箭头)。(图5j)在12和15d.p.i.用阻断性抗pd-l1 ab(200μg/小鼠/注射;克隆10f.9g2)或同工型对照ab i.p.注射c57bl/6eae小鼠。在13、16和19d.p.i.i.v.注射hek-或ol-ev(红色箭头)。符号描绘每日平均值
±
s.e.m。所有eae实验至少进行两次,具有相似的结果(n=7只小鼠/组)。在(i)中通过mann-whitney检验分析eae实验;*p《0.01。在(j)中通过bonferroni多重比较的双因素anova;*p《0.01和****p《0.00001。
12.图6a-6g示出了ol-ev以il-10依赖性方式诱导pd-l1。(图6a)用大约10
10
个ol-ev或hek-ev注射3次wt和il-10rb-/-eae小鼠(红色箭头)的临床病程。eae实验至少进行了两次,具有相似的结果(n=7只小鼠/组)。通过bonferroni多重比较的双因素anova分析数据;****p《0.00001。(图6b)疾病严重程度的累积评分(平均值
±
sem)。(c)小鼠在p.i.第25天被处死,并且通过流式细胞术和血细胞计数器测定从cns获得的cd45
白细胞数量。数据
表示为平均值
±
s.e.m,来自每次实验n=7/组。(图6d-6f)在10d.p.i.从mog
35-55
免疫的wt和il-10-/-小鼠的脾脏和淋巴结中分离apc和总cd4
t细胞。不匹配的细胞共培养物(wt apc wt cd4
;wt apc il-10-/-cd4;il-10-/-apc wt cd4
;il-10-/-apc il-10-/-cd4
)用ol-ev、hek-ev或pbs处理三天。流式细胞术分析单核细胞/树突状细胞(cd11b
mhcii
cd19-ly6g-)中的pd-l1表达(图6d、6f),以及cd4
t细胞中的pd-1(图6e、6g)。这些实验进行了两次,具有相似的结果。数据表示为平均值
±
s.e.m,来自每次实验n=5/组。(图6b、6c、6f和6g)通过bonferroni事后检验的双因素anova,*p《0.05;**p《0.01;***p《0.0005;****p《0.00001。
13.图7a-7d图示了hol释放含有多种髓鞘质蛋白的ev。(图7a)纯化的hol-ev的冷冻电子显微镜;比例尺200nm。(图7b)质谱数据的主组分分析(pca),显示opc-ev和ol-ev的相关性。(图7c)显示opc和ol-ev中存在的蛋白质表达量的热图。(图7d)通过elisa测量的hek-、hopc-和hol-ev团粒中髓鞘质蛋白(mbp、mog、plp)的浓度(平均值
±
sem)。通过bonferroni事后检验的单因素anova,**p《0.001;****p《0.00001。
14.图8a-8h图示了ol和ol-ev的表征。(图8a)流式细胞术分析从5日龄小鼠幼崽的cns分离的opc和成熟ol中的cnpase。(图8b)通过qpcr对opc和ol中的pdgfrα、ng2、sox10、olig2、olig4、mobp、mag、plp、mog、cnp、mbp和galc mrna进行基因表达分析。值相对于opc中的值进行了标准化,并显示为log2。这些实验进行了两次,具有相似的结果(每次实验n=3/组)。使用未配对t检验分析数据;ns(不显著);*p《0.05;**p《0.001;***p《0.0005;****p《0.00001。(图8c)针对cnpase(绿色)和细胞核(dapi)染色的成熟ol的代表性免疫荧光(if)。比例尺20μm,放大倍数60
×
。(图8d-8e)在培养中分化三周后通过流式细胞术测定mbp
、mog
和plp
cnpase
ol的百分比(平均值
±
sem)。这些实验进行了两次,具有相似的结果(每次实验n=5/组)。使用未配对t检验分析数据;****p《0.00001。(图8f)用于从opc、ol和hek细胞培养上清液中纯化ev的方案。(图8g)由nta测定的ol-ev的尺寸谱(profile)。(图8h)ol-ev团粒中alix、flot-1、tsg101、anax1和gapdh的蛋白质印迹。
15.图9a-9b图示了ol-ev/i.v.停止过继性eae小鼠的eae进展。将源自mog
35-55
免疫供体小鼠的1
×
107个th17细胞移植到wt c57bl/6小鼠,并在细胞移植后第0天和第2天注射ptx。在疾病发作时每三天一次i.v.注射三次大约10
10
个ol-ev(由c57bl/6ol制备)或hek-ev(图9a)。符号描绘每日平均值
±
s.e.m。eae实验至少进行了两次,具有相似的结果(n=7只小鼠/组)。eae实验通过bonferroni多重比较的双因素anova进行分析;*p《0.05。(图9b)(a)中所示的过继性eae的累积分数(平均值
±
sem)。数据表示为每日平均值
±
s.e.m,来自每次实验n=7/组,**p《0.05;通过bonferroni的事后检验的单因素anova。
16.图10a-10h图示了ol-ev在eae中保护小鼠免受cns组织损伤。(图10a、图10b)。在用mog
35-55
免疫进行eae诱导的小鼠中s.c.注射(红色箭头)约10
10
个ol-ev(由c57bl/6ol制备)或hek-ev。在1、4和7d.p.i防止性给予(图10a)、或在13、16和19d.p.i.治疗性给予(图10b)ol-ev处理。这些实验进行了两次,具有相似的结果(每次实验n=5只小鼠/组)。符号描绘每日平均值
±
s.e.m。通过bonferroni多重比较的双因素anova分析数据。脊髓切片的(图10c)kluber barrera和(图10d)银染色用于分析脱髓鞘和轴突损失。在8个不同水平截取的脊髓/小鼠的5个横截面上平均量化脱髓鞘面积和轴突损失,并表示为受损面积的百分比(平均值
±
sem)。未配对的双尾t检验用于分析(n=5/组);****p《0.00001。(图10e、10f)来自用mog
35-55
免疫的和用hek-ev、ol-ev或mog
35-55 i.v.注射的(三次注射)具有eae的小鼠的总
cns cd45
和cd4
细胞数,如流式细胞术测定的(n=5/组)。(图10g、10h)用分离自用hek-ev、ol-ev或肽(自动-ag)i.v.注射,并用自动-ag(20μg/ml)重新攻击的具有eve的小鼠的脾细胞的增殖测定(每次实验n=5/组)。(图10e-10h)数据表示为平均值
±
s.e.m。*p《0.01;**p《0.001;***p《0.0005;****p《0.00001,通过bonferroni事后检验的单因素anova。
17.图11a-11c图示了ol-ev处理诱导脾脏2d2 cd4
t细胞中的胱天蛋白酶3表达。(图11a)在用ol-ev、hek-ev或mog
35-55
肽(100μg)i.v.处理mog特异性tcr转基因小鼠(2d2)后6、24和48小时脾脏cd4
t细胞含量的时程(每次实验n=5/组,进行两次)。(图11b和图11c)处理后6、24和48小时,注射ol-ev、hek-ev或mog
35-55
肽(100μg)的2d2小鼠的脾脏cd4
t细胞中的胱天蛋白酶3表达(平均值
±
s.e.m),(每次实验n=5/组,共两次)。
18.图12a-12e图示了ol中mog的敲除。(图12a)用于敲除rosa26-lsl-cas9 ol中的mog的crispr/cas9质粒。(图12b、12c)用表达cre和杂乱(scrambled)(对照)grna(图12b),或cre和mog特异性grna(图12c)的慢病毒转导并由嘌呤霉素(2μg/ml)选择的cas9
gfp
opc的代表性图像。比例尺200μm。(图12d)t7核酸内切酶消化来自用表达cre和mog特异性grna的慢病毒转导的cas9
ol的pcr产物。敲除mog基因(在pcr产物中)与阳性对照(用相同慢病毒转导的cas9细胞系)进行比较。(图12e)通过elisa在杂乱grna和mog grna转导的ol和来源于它们的ev中进行mog量化。数据表示为平均值
±
s.e.m,来自3个独立的实验。****p《0.00001,通过bonferroni事后检验的单因素anova。
19.图13a-13m图示了ol-ev在eae中的治疗效果依赖于髓鞘质ag。(图13a)用于hek细胞中的mog表达的慢病毒质粒。(图13b)用慢病毒转导并用嘌呤霉素选择的mog
hek细胞(红色)的代表性图像。细胞用第一αmog mab和第二山羊αmouse-alexafluor546 ab染色。比例尺10μm和放大倍数20
×
。(图13c)通过elisa,在hek、mog
hek和ol来源的ev中进行mog定量(平均值
±
s.e.m)(n=5/组)。(图13d)大约10
10
个ol-ev(由c57bl/6ol制备)、hek-ev或mog
hek-ev在用mog
35-55
免疫的具有eae的小鼠(n=7只小鼠/组)中在疾病发作时i.v.注射3次。符号描绘每日平均值
±
s.e.m。(图13e)(d)中显示的eae的累积疾病评分。符号描绘平均值
±
s.e.m。eae实验通过bonferroni多重比较的双因素anova进行分析;***p《0.0005。(图13f)在p.i.第25天处死小鼠,通过流式细胞术测定cd45
白细胞数量。(图13g)流式细胞术图显示来自(d)中所示的具有eae的小鼠的cns的淋巴(1)和浸润的骨髓(2)细胞。(图13h、13i)来自注射了ol-ev、hek-ev或mog
hek-ev的eae小鼠的cns cd4
t细胞中pd-1和膜联蛋白v染色的强度(平均值
±
s.e.m),如由流式细胞术测定的。(图13j、13k)来自(d)中所示的具有eae的小鼠的cns的cd25
foxp3
treg细胞的百分比和绝对数(平均值
±
s.e.m)。(图13l、13m)来自(d)中所示的具有eae的小鼠的cns的单核细胞中il-10和pd-l1染色的强度(平均值
±
s.e.m)。图13e、13f、13i和13m中的数据(n=5-7/组)表示为平均值
±
s.e.m。**p《0.001;****p《0.00001,通过bonferroni事后检验的单因素anova。
20.图14图示了培养中的ol表达很少的mhc ii类。流式细胞术图比较了从opc体外发展的ol和骨髓来源的dc的mhcii表达。
21.图15a-15d图示了ol-ev/i.v注射到首次用于试验的r26.stop.td-tomato报告小鼠中的细胞分布。(图15a)将大约10
10
个cre
或cre-o1-ev i.v.注射到首次用于试验的rosa26-stop-td-tomato报告小鼠中。(图15b)在注射ol-ev后6、24和48小时血液、cns、淋巴结和脾脏中td-tomato
细胞的流式细胞术分析。(图15c、15d)注射ol-ev后24小时脾脏和血
液中td-tomato
细胞的百分比(n=3/组)。实验进行两次。
22.图16a-16f图示了ly6g
和zbtb46
细胞耗尽。(图16a、图16b)用mog
35-55
免疫进行eae诱导后18天小鼠血液中用抗ly6g mab或同工型ab的中性粒细胞的耗尽的流式细胞术分析。(图16c、16d)bm嵌合小鼠(cd45.1
受体小鼠)血液中bm供体细胞(cd45.2
cd4
和cd11b
)的百分比。(图16e、16f)在具有eae的bm嵌合体zbtb46-dtr
→
cd45.1
小鼠中用dtx(20ng/g)耗尽脾脏cd11c
zbtb46
经典dc。
23.图17a-17b图示了ol-ev处理诱导单核细胞中的il-10和pd-l1表达。在疾病发作时三次用hek-ev或ol-ev注射的具有eae的小鼠的脾脏(图17a)和cns(图17b)的单核细胞(cd11b
ly6g-cd11c
mhcii
)的流式细胞术分析。该实验进行两次,具有相似的结果(每次实验n=5只小鼠/组)。
24.图18a-18d图示了ol-ev对eae抑制不需要pd-l2。(图18a、图18b)来自用hek-ev或ol-ev处理的具有eae的小鼠的脊髓切片的代表性共聚焦显微镜图像,这些图像对cd11b(红色)和精氨酸酶1(绿色)染色。比例尺100μm;放大倍数20
×
和40
×
。(图18c)在11和14d.p.i.用阻断性抗pd-l2 ab(200μg/注射;克隆ty25)或同工型对照ab i.p.注射具有eae的c57bl/6小鼠。在13、16和19d.p.i.i.v.注射hek-ev或ol-ev。(图18d)用来自wt或pd-1-/-小鼠的5
×
106个总cd4
t细胞重建rag1-/-小鼠。重建后72小时,免疫受体小鼠进行eae诱导,并从eae发作开始i.v.3次给予ol-ev或hek-ev。所有eae实验都进行两次,具有相似的结果(n=5-7只小鼠/组)。符号描绘每日平均值
±
s.e.m。eae实验通过bonferroni多重比较的双因素anova进行分析;***p《0.0005;****p《0.00001。
具体实施方式
25.由于对特异性自身抗原(ag)的外周免疫耐受性失败,发生例如多发性硬化症(ms)的自身免疫性疾病。在实验性自身免疫性脑脊髓炎(eae)——ms的动物模型——中已经证明了许多用于ag特异性抑制自身免疫性神经炎症的方法。一种这样的方法是通过注射用于eae诱导的髓鞘质抗原进行静脉内(i.v.)耐受性诱导。然而,由于与ms患者中相关髓鞘质抗原相关的不确定性,阻碍了将这种和类似的实验策略转化为ms治疗。为了解决这个问题,开发了一种新的治疗策略,该策略依赖于少突胶质细胞(ol)来源的细胞外囊泡(ol-ev),其天然含有多个髓鞘质ag。i.v.注射的ol-ev在几种eae模型中,以髓鞘质ag依赖性方式在预防和治疗二者上抑制疾病。通过诱导免疫抑制性单核细胞和使自身反应性致脑炎cd4
t细胞凋亡,该处理是安全的并恢复了免疫耐受性。最后,本文所述的结果表明,人ol还释放含有最相关的髓鞘质ag的ev,这为它们在ms疗法中的使用提供了基础。这些发现介绍了以鞘质ag-特异性的方式抑制中枢神经自身免疫性的新方法。
26.定义
27.除非另有定义,否则本文使用的所有技术和科学术语具有与本发明所属领域的普通技术人员通常理解的相同含义。尽管与本文所述的那些相似或等效的任何方法和材料可在实践中用于测试本发明,但本文描述了所选择的材料和方法。在描述和要求保护本发明时,将使用以下术语。
28.还应理解,本文使用的术语仅用于描述具体实施方式的目的,而不是旨在限制性的。
29.冠词“一个”和“一种”在本文中用于指代冠词的语法对象中的一个或多于一个(即,至少一个)。举例来说,“一个元件”是指一个元件或多于一个元件。
30.如本文所用的“大约”在提及例如量、持续时间等的可测量值时,意在包括指定值的
±
20%或
±
10%、更优选
±
5%、甚至更优选
±
1%和仍更优选
±
0.1%的变化,因为这样的变化适合于执行所公开的方法。
31.如果疾病或紊乱的症状的严重性、患者经历这种症状的频率或两者降低,则疾病或紊乱得到“缓解”。
32.如本文所用,术语“组合物”或“药物组合物”是指至少一种可用于本发明的化合物与药学上可接受的载体的混合物。药物组合物有助于将化合物施用于患者或受试者。本领域中存在多种施用化合物的技术,其包括但不限于静脉内、皮下、口服、气雾剂、肠胃外、眼部、肺部和局部施用。
33.化合物的“有效量”或“治疗有效量”是足以向被施用化合物的受试者提供有益效果的化合物的量。递送运载体的“有效量”是足以有效结合或递送化合物的量。
34.如本文所用,“细胞外囊泡”是指由几乎所有细胞分泌并含有蛋白质、脂质、dna和不同rna的蛋白质-脂质膜包裹的颗粒。术语细胞外囊泡包括外泌体(30nm-100nm)和微泡(100nm-1μm)。
35.如本文所用,“少突胶质细胞来源的细胞外囊泡”是指由少突胶质细胞产生的或分离自少突胶质细胞的细胞外囊泡。
36.术语“患者”、“受试者”、“个体”等在本文中可互换使用,并且是指适用于本文所述的方法的任何动物或其无论是体外还是原位的细胞。在某些非限制性实施方式中,受试者是非人类哺乳动物。非人类哺乳动物包括例如家畜和宠物,例如羊、牛、猪、猫、狗、小鼠和大鼠。在某些非限制性实施方式中,患者、受试者或个体是人。
37.如本文所用,术语“药学上可接受的”是指例如载体或稀释剂的材料,其不会废除化合物的生物活性或性质,并且是相对无毒的,即该材料可以被施用至个体而不会引起不期望的生物学效应或以有害方式与包含它的组合物的任何组分相互作用。
38.如本文所用,术语“药学上可接受的载体”是指药学上可接受的材料、组合物或载体,例如液体或固体填充剂、稳定剂、分散剂、助悬剂、稀释剂、赋形剂、增稠剂、溶剂或包封材料,其涉及在患者体内携带或运输在本发明中有用的化合物或将其携带或运输至患者,以使其可以执行其预期功能。通常,这种构建体从一个器官或身体的一部分被携带或运输到另一个器官或身体的一部分。在与制剂的其他成分(包括在本发明中有用的化合物)相容性的意义上,每种载体必须是“可接受的”,并且对患者无害。可用作药学上可接受的载体的材料的一些实例包括:糖,例如乳糖、葡萄糖和蔗糖;淀粉,例如玉米淀粉和马铃薯淀粉;纤维素及其衍生物,如羧甲基纤维素钠、乙基纤维素和醋酸纤维素;粉状西黄芪胶;麦芽;明胶;滑石;赋形剂,例如可可脂和栓剂蜡;油,例如花生油、棉花籽油、红花油、芝麻油、橄榄油、玉米油和豆油;二醇类,例如丙二醇;多元醇类,例如甘油、山梨糖醇、甘露醇和聚乙二醇;酯类,例如油酸乙酯和月桂酸乙酯;琼脂;缓冲剂,例如氢氧化镁和氢氧化铝;表面活性剂;海藻酸;无热原水;等渗盐水;林格氏液(ringer’s solution);乙醇;磷酸盐缓冲溶液;和其他用于药物制剂的无毒相容物质。如本文所用,“药学上可接受的载体”还包括与可用于本发明的化合物的活性相容并且是患者生理学上可接受的任何和所有包衣、抗菌剂和抗
真菌剂以及吸收延迟剂等。补充的活性化合物也可以掺入组合物中。“药学上可接受的载体”可进一步包括可用于本发明的化合物的药学上可接受的盐。可以包含在本发明实践中使用的药物组合物中的其他另外的成分是本领域已知的并且例如在雷明顿医药科学(remington's pharmaceutical sciences)(genaro,ed.,mack publishing co.,1985,easton,pa)中描述,通过引用将其并入本文。
39.如本文所用,“治疗疾病或紊乱”是指降低患者经历疾病或紊乱的症状的频率。疾病和紊乱在本文中可互换使用。
40.如本文所用,术语“处理”或“治疗”包括预防和/或疗法。因此,本发明的组合物和方法不限于治疗应用并且可以用于预防应用。因此,状态、紊乱或病症的“治疗”或“处理”包括:(i)防止或延迟在可能患有或易患该状态、紊乱或病症但尚未经历或显示该状态、紊乱或病症的临床或亚临床症状的受试者中发展的该状态、紊乱或病症的临床症状的出现,(ii)抑制该状态、紊乱或病症,即阻止或减少该疾病或其至少一种临床或亚临床症状的发展,或(iii)缓解疾病,即导致该状态、紊乱或病症或其临床或亚临床症状中的至少一种的消退。
41.范围:在整个本公开内容中,本发明的各个方面可以以范围格式呈现。应当理解,范围格式中的描述仅仅是为了方便和简洁,不应理解为对本发明范围的僵化限制。因此,范围的描述应该被认为已经具体公开了所有可能的子范围以及该范围内的个体数值。例如,对例如1到6的范围的描述应该被认为具有具体公开的子范围,例如从1到3、从1到4、从1到5、从2到4、从2到6、从3到6等,以及该范围内的个体数字,例如1、2、2.7、3、4、5、5.3和6。无论范围的广度如何,这都适用。
42.描述
43.多发性硬化症(ms)是最常见的中枢神经系统(cns)的自身免疫性脱髓鞘疾病(1,2)。基于恢复抗原(ag)特异性外周免疫耐受性的ms疗法一直是ms研究的长期目标,因为所有当前的ms疗法都以ag非特异性方式靶向免疫系统(3)。ag特异性疗法的先决条件是自身免疫反应所靶向的相关自身ag的知识。普遍认为,ms发病机制是由针对少突胶质细胞(o1)产生的髓鞘质ag的自身免疫性驱动的。然而,ms中的一种或多种相关ag仍然是推测性的,具有这些ag在患者之间不同并且在同一患者中超时(overtime)的可能性(4)。基于ms实验模型中的发现,已经提出了数种诱导ag特异性耐受性的方法,并且其中一些方法已经进行临床测试(3,4)。先前有报道称,经由多种途径[静脉内(i.v.)、口服、鼻腔等]施用游离的致脑炎肽或与纳米颗粒或凋亡细胞(5-10)偶联的肽诱导ag特异性免疫耐受性并改善疾病。耐受性诱导机制包括引发致耐受性树突状细胞(dc)和免疫抑制性巨噬细胞,减少致病性th1和th17细胞反应(11),以及诱导t调节性(tregs)和1型调节性t(tr1)细胞(12)。即使i.v.耐受性诱导已在实验性自身免疫性脑脊髓炎(eae)中显示出显著的疗法效果,但这种方法的安全性仍然是值得关注的问题,这是因为i.v.注射的髓鞘质ag可以使疾病恶化而不是改善它的可能性(3,4,13)。
[0044]
在本文所述的研究中,开发了一种新的治疗性方法,用于通过使用自然含有最相关的髓鞘质ag的ol衍生的细胞外囊泡(ol-ev)恢复cns自身免疫中的免疫耐受性(14)。ev是由几乎所有细胞分泌的蛋白质-脂质膜包裹的颗粒,其在细胞间通信中发挥重要作用(15,16)。多项研究已使用ev用于实验性自身免疫性疾病的疗法,报告了其安全性,并有望用于
临床使用(17-20)。表明在慢性和复发缓解型eae模型中,i.v.注射ol-ev预防性和治疗性地抑制临床疾病。鉴于缺乏用于eae诱导的髓鞘质ag的ol-ev无法抑制eae,ol-ev的效果是髓鞘质ag依赖性的。ol-ev在eae中的有益作用依赖于单核细胞,因为它们以il-10依赖性方式上调pd-l1表达,这导致了致脑炎cd4
t细胞凋亡。
[0045]
总体而言,本文的研究描述了以ag特异性方式治疗cns自身免疫性脱髓鞘疾病的新治疗疗法。本文所述的研究表明,静脉内注射少突胶质细胞来源的细胞外囊泡在多发性硬化症动物模型中具有抗原特异性疗法效果,这证明了这种新方法用于人类疾病疗法上的潜力。
[0046]
不希望受理论限制,本发明部分基于以下发现:施用从少突胶质细胞来源的细胞外囊泡可通过诱导对一种或多种髓鞘质抗原的耐受性来治疗多发性硬化症。少突胶质细胞来源的细胞外囊泡含有多种髓鞘质蛋白,和因此向受试者的施用同时诱导对可能成为ms相关自身免疫攻击靶标的任何抗原的耐受性。因此,在一个方面,本发明提供了在有需要的受试者中治疗或防止多发性硬化症的方法,该方法包括向受试者施用有效量的少突胶质细胞来源的细胞外囊泡(o1-ev)。在另一个方面,本发明提供了在受试者中诱导对髓鞘质抗原的耐受性的方法,该方法包括向受试者施用有效量的少突胶质细胞来源的细胞外囊泡(o1-ev)。
[0047]
在某些实施方式中,ol-ev包含髓鞘质抗原(ag)。在某些实施方式中,髓鞘质ag选自髓鞘质碱性蛋白(mbp)、髓鞘质少突胶质细胞糖蛋白(mog)和髓鞘质蛋白脂蛋白(plp)。
[0048]
在某些实施方式中,ol-ev包含外泌体。在某些实施方式中,ol-ev包含微泡。在某些实施方式中,ol-ev包含外泌体和微泡。
[0049]
在某些实施方式中,施用ol-ev以ag特异性方式治疗ms。
[0050]
在某些实施方式中,施用诱导免疫抑制性单核细胞。在某些实施方式中,施用以il-10依赖性方式诱导免疫抑制性单核细胞。
[0051]
在某些实施方式中,单核细胞是表达pd-l1的单核细胞。
[0052]
在某些实施方式中,施用不会对受试者的免疫系统造成任何有害或不希望的影响。
[0053]
在多种实施方式中,少突胶质细胞来源的细胞外囊泡被配制在包含至少一种药学上可接受的载体的药物组合物中。在多种实施方式中,药物组合物是静脉内、皮下、皮内、经皮、口服或鼻腔。在多种实施方式中,受试者是哺乳动物。在多种实施方式中,受试者是人。在多种实施方式中,少突胶质细胞来源的细胞外囊泡来源于人少突胶质细胞。
[0054]
在多种实施方式中,多发性硬化症是慢性多发性硬化症。在多种实施方式中,多发性硬化症是复发缓解型多发性硬化症。
[0055]
在多种实施方式中,少突胶质细胞来源的细胞外囊泡来源于少突胶质细胞的体外培养物。在多种实施方式中,少突胶质细胞来源的细胞外囊泡来源于人少突胶质细胞的体外培养物。不受理论束缚,据信来源于少突胶质细胞体外培养物的少突胶质细胞来源的胞外囊泡可以具有与体内少突胶质细胞释放的囊泡不同的特征。在一些实施方式中,用于疗法的ev表达相对高水平的数种髓鞘质蛋白,而不表达主要组织相容性复合体蛋白。在一些实施方式中,ev的来源细胞经过遗传改变以优化其ev的质量。
[0056]
在多种实施方式中,可以通过以下方式获得少突胶质细胞来源的细胞外囊泡:对
少突胶质细胞培养上清液进行第一离心步骤、过滤所得上清液、对滤液进行超离心步骤并收集沉淀的细胞外囊泡(casella g等人,2018.pmd:30017878;colombo f等人,2018.pmd:29467770)。
[0057]
在多种实施方式中,少突胶质细胞来源的细胞外囊泡不表达主要组织相容性复合体蛋白。在多种实施方式中,细胞外囊泡所来源的少突胶质细胞不表达mhc ii类分子。在多种实施方式中,可以使用本领域已知的任何手段来防止mhc i类分子表达。在多种实施方式中,
[0058]
在另一个方面,提供了包含少突胶质细胞来源的细胞外囊泡和至少一种药学上可接受的载体的药物组合物。在另一个方面,提供了分离的少突胶质细胞来源的细胞外囊泡。在多种实施方式中,分离的少突胶质细胞来源的细胞外囊泡用于治疗多发性硬化症(ms)。在仍另一方面,提供了用于治疗多发性硬化症(ms)的药物组合物,该组合物包含少突胶质细胞来源的细胞外囊泡和药学上可接受的载体。在另一个方面,提供了少突胶质细胞来源的细胞外囊泡在治疗多发性硬化症(ms)中的用途。在多种实施方式中,多发性硬化症是慢性多发性硬化症。在多种实施方式中,多发性硬化症是复发缓解型多发性硬化症。
[0059]
在某些实施方式中,少突胶质细胞来源的细胞外囊泡(ol-ev)包含髓鞘质抗原(ag)。在某些实施方式中,少突胶质细胞来源的细胞外囊泡来源于人少突胶质细胞。在多种实施方式中,髓鞘质ag包含髓鞘质碱性蛋白(mbp)、髓鞘质少突胶质细胞糖蛋白(mog)和/或髓鞘质蛋白脂蛋白(plp)。在多种实施方式中,包含少突胶质细胞来源的细胞外囊泡的组合物包含外泌体。在某些实施方式中,组合物包含微泡。在某些实施方式中,组合物包含外泌体和微泡。在多种实施方式中,组合物被配制用于静脉内、皮下、皮内、经皮、口服或鼻腔施用。在多种实施方式中,组合物被配制用于静脉内施用。
[0060]
本文还证明,ol-ev的作用取决于其中存在的髓鞘质ag,而不是由ol-ev特异性产生的其他组分。因此,在另一方面,提供了源自细胞的细胞外囊泡,其中所述细胞外囊泡包含髓鞘质抗原(ag)。该细胞可以是少突胶质细胞之外的细胞。在某些实施方式中,细胞表达髓鞘质抗原。在某些实施方式中,细胞经工程化以表达髓鞘质抗原。在多种实施方式中,髓鞘质抗原是髓鞘质碱性蛋白(mbp)、髓鞘质少突胶质细胞糖蛋白(mog)或髓鞘质蛋白脂蛋白(plp)。在多种实施方式中,细胞经工程化以表达一种或多种类型的髓鞘质抗原。在多种实施方式中,细胞经工程化以表达选自以下的至少一种髓鞘质抗原:髓鞘质碱性蛋白(mbp)、髓鞘质少突胶质细胞糖蛋白(mog)和髓鞘质蛋白脂蛋白(plp)。在某些实施方式中,细胞是哺乳动物细胞。在某些实施方式中,细胞是人类细胞。
[0061]
另一方面提供了在有需要的受试者中治疗或防止多发性硬化症的方法,该方法包括向受试者施用有效量的包含髓鞘质抗原的细胞外囊泡(ev)。本发明的另一个方面提供了在受试者中诱导对髓鞘质抗原的耐受性的方法,该方法包括向受试者施用有效量的包含髓鞘质抗原的细胞外囊泡(ev)。
[0062]
在多种实施方式中,ev来源于表达髓鞘质抗原的细胞。在某些实施方式中,细胞经工程化以表达髓鞘质抗原。在某些实施方式中,细胞经工程化以高水平表达髓鞘质抗原。在某些实施方式中,细胞不表达主要组织相容性蛋白(例如,mhc i类、mhc ii类分子)或具有其降低的表达。在某些实施方式中,细胞被遗传修饰以减少或消除主要组织相容性蛋白(例如,mhc i类、mhc ii类分子)的表达。
[0063]
在某些实施方式中,ev包含髓鞘质抗原(ag)。在某些实施方式中,髓鞘质ag选自髓鞘质碱性蛋白(mbp)、髓鞘质少突胶质细胞糖蛋白(mog)和髓鞘质蛋白脂蛋白(plp)。
[0064]
在某些实施方式中,ev包含外泌体。在某些实施方式中,ol-ev包含微泡。在某些实施方式中,ev包含外泌体和微泡。
[0065]
在某些实施方式中,施用不会对受试者的免疫系统造成任何有害或不希望的影响。
[0066]
在多种实施方式中,将细胞外囊泡配制在包含至少一种药学上可接受的载体的药物组合物中。在多种实施方式中,药物组合物是静脉内、皮下、皮内、经皮、口服或鼻腔地。在多种实施方式中,受试者是哺乳动物。在多种实施方式中,受试者是人。在多种实施方式中,细胞外囊泡来源于人类细胞。
[0067]
在多种实施方式中,多发性硬化症是慢性多发性硬化症。在多种实施方式中,多发性硬化症是复发缓解型多发性硬化症。
[0068]
在另一个方面,提供了药物组合物,其包含含有髓鞘质抗原的细胞外囊泡,以及至少一种药学上可接受的载体。在另一个方面,提供了包含髓鞘质抗原的分离的细胞外囊泡。在多种实施方式中,分离的细胞外囊泡用于治疗多发性硬化症(ms)。在仍另一方面,提供了用于治疗多发性硬化症(ms)的药物组合物,其中所述组合物包含含有髓鞘质抗原的细胞外囊泡以及药学上可接受的载体。在另一个方面,提供了细胞外囊泡在治疗多发性硬化症(ms)中的用途,其中该细胞外囊泡包含髓鞘质抗原。在多种实施方式中,髓鞘质抗原是髓鞘质碱性蛋白(mbp)、髓鞘质少突胶质细胞糖蛋白(mog)或髓鞘质蛋白脂蛋白(plp)。在多种实施方式中,细胞外囊泡包含选自髓鞘质碱性蛋白(mbp)、髓鞘质少突胶质细胞糖蛋白(mog)或髓鞘质蛋白脂蛋白(plp)的一种或多种髓鞘质抗原。在多种实施方式中,多发性硬化症是慢性多发性硬化症。在多种实施方式中,多发性硬化症是复发缓解型多发性硬化症。
[0069]
施用/给药
[0070]
在临床环境中,本文所述组合物的递送系统可以通过多种方法中的任一种引入受试者,其中每种方法在本领域中是熟悉的。例如,组合物的药物制剂可以通过吸入或全身性(例如通过静脉注射)施用。
[0071]
施用方案可能会影响有效量的构成。治疗制剂可以在与疾病或病症相关的症状表现之前或之后施用于受试者。此外,可以每天或依次施用数个分开的剂量以及交错的剂量,或者剂量可以连续输注,或者可以是弹丸注射。进一步地,治疗制剂的剂量可以根据治疗或预防情况的迫切情况指示的,按比例增加或减少。
[0072]
将本发明的组合物施用于受试者,优选哺乳动物,更优选人,可以使用已知的程序,以有效治疗受试者的疾病或病症的剂量和时间段来进行。达到治疗效果所必需的组合物的有效量可以根据例如以下的因素而变化:施用时间;施用的持续时间;与该组合物结合使用的其他药物、化合物或材料;疾病或紊乱的状态;接受治疗的受试者的年龄、性别、体重、病症、一般健康状况和既往病史;以及医学领域中众所周知的类似因素。可以调整剂量方案以提供最佳治疗反应。例如,可以每天施用数个分开的剂量,或者可以根据治疗情况的迫切情况指示的,按比例减少剂量。本领域普通技术人员将能够研究相关因素并确定关于组合物的有效量而无需过度实验。制剂可以与常规赋形剂混合使用,即适用于口服、肠胃外、鼻腔、静脉内、皮下、肠内或本领域已知的任何其他合适的施用模式的药学上可接受的
offset)以及受控的例如持续释放、延迟释放和脉冲释放制剂。
[0082]
术语持续释放以其常规含义使用,是指这样的药物制剂,其可在延长的时间段内逐渐释放药物,并且可能(但不一定)导致在延长的时间段内基本上恒定的血药水平。时间段可以长达一个月或更长,并且应该是比以弹丸形式施用的相同量的药剂更长的释放。
[0083]
对于持续释放,化合物可以与为化合物提供持续释放性质的合适的聚合物或疏水材料一起配制。因此,用于本发明方法的化合物可以以微粒的形式施用,例如通过注射或通过以晶片或圆盘的形式植入。
[0084]
在某些实施方式中,使用持续释放制剂,将本发明的化合物单独或与另一种药剂组合施用于患者。
[0085]
术语延迟释放在本文中以其常规含义使用,是指这样的药物制剂,其在药物施用后的一些延迟之后提供药物初始释放,并且尽管不是必须的,其包括约10分钟至多至约12小时的延迟。
[0086]
术语脉冲释放在本文中以其常规含义使用,是指这样的药物制剂,其提供药物释放,以在药物施用后产生药物的脉冲血浆谱。
[0087]
术语立即释放以其常规含义使用,是指这样的药物制剂,其在药物施用后立即提供药物释放。
[0088]
如本文所用,短期是指长达并包括在药物施用后约8小时、约7小时、约6小时、约5小时、约4小时、约3小时、约2小时、约1小时、约40分钟、约20分钟或约10分钟及在药物施用后其任何或所有整体或部分增量的任何时间段。
[0089]
如本文所用,快速抵消是指长达并包括在药物施用后约8小时、约7小时、约6小时、约5小时、约4小时、约3小时、约2小时、约1小时、约施用后40分钟、约20分钟或约10分钟,以及其任何和所有全部或部分增量的任何时间段。
[0090]
给药
[0091]
本发明的化合物或药剂(例如,细胞外囊泡(ev))的治疗有效量或剂量取决于患者的年龄、性别和体重、患者的当前医学病症和本文在被治疗的患者中考虑的疾病或紊乱的进展。普通技术人员能够根据这些和其他因素确定合适的剂量。
[0092]
本发明化合物的合适剂量可以在每天约0.001mg至约5,000mg的范围内,诸如每天约0.01mg至约1,000mg,例如约1mg至约500mg,诸如约5mg至约250mg。剂量可以单剂量或多剂量施用,例如每天1至4次或更多次。当使用多个剂量时,每个剂量的量可以相同或不同。例如,每天1mg的剂量可以以两次0.5mg的剂量施用,其中剂量之间间隔约12小时。
[0093]
应当理解,在非限制性实例中,每天给药的化合物的量可以每天、每隔1天、每2天、每3天、每4天或每5天施用。例如,利用每隔一天施用时,可以在星期一开始5mg每天的剂量,然后在星期三施用第一后续5mg每天的剂量,在星期五施用第二后续5mg每天的剂量,依此类推。
[0094]
可以改变本发明药物制剂中细胞的实际剂量水平,以获得对于具体受试者、组合物和施用方式有效实现所期望的治疗反应而不会对受试者有毒的组合物的量。
[0095]
此类治疗方案的毒性和治疗功效任选地在细胞培养物或实验动物中确定,包括但不限于确定ld
50
(对50%种群致死的剂量)和ed
50
(对50%种群治疗有效的剂量)。毒性与治疗作用的剂量比为治疗指数,其表示为ld
50
与ed
50
之比。从细胞培养试验和动物研究中获得
的数据可任选地用于制定用于人类的剂量范围。此类化合物的剂量优选地位于包括具有最小毒性的ed
50
的循环浓度范围内。根据所使用的剂型和所利用的施用途径,剂量任选地在该范围内变化。
[0096]
本文引用的每个专利、专利申请和出版物的公开内容均通过引用以其整体并入本文。
[0097]
虽然本发明已经参考具体实施方式进行了公开,但显然本领域的其他技术人员可以设计本发明的其他实施方式和变化而不背离本发明的真实精神和范围。所附权利要求旨在被解释为包括所有这样的实施方式和等效变体。
[0098]
实验实施例
[0099]
通过参考以下实验实施例进一步详细描述本发明。提供这些实施例仅用于说明性目的,并且不旨在是限制性的,除非另有说明。因此,本发明绝不应被解释为限于以下实施例,而是应被解释为包括由于本文提供的教导而变得明显的任何和所有变体。
[0100]
在没有进一步描述的情况下,相信本领域的普通技术人员可以使用前面的描述和以下说明性实施例来制备和利用本发明的化合物并实践所要求保护的方法。因此,以下工作实施例具体指出了本发明所选定的实施方式,并且不应解释为以任何方式限制本公开内容的其余部分。
[0101]
现在描述这些实验中使用的材料和方法。
[0102]
小鼠
[0103]
年龄和性别匹配的b10.pl、sjl、c56bl/6wt、b6.ly5.1(cd45.1
)、rag1-/-、2d2、ot-ii、zbtb46 idtr、rosa26-stop-tdtomato、il-10rβ-/-、il-10-/-和rosa26-lsl-cas9小鼠购自the jackson laboratory(bar harbor,me,usa)。将小鼠保持在特定的无病原体条件下,每个笼子最多5只小鼠,整个实验程序中在12/12时的光/暗循环和随意进食中。尽一切努力减少老鼠的痛苦。使用小鼠的实验方案得到了托马斯杰斐逊大学机构动物护理和使用委员会(the institutional animal care and use committee of thomas jefferson university)的批准。
[0104]
hek细胞
[0105]
hek细胞在达尔伯克改良伊格尔培养基(dulbecco modified eagle's medium)(dmem,gibco)中培养,其补充有10%ev耗尽的胎牛血清(fbs)、青霉素、链霉素(100u/ml)和2mm l-谷氨酰胺。收获所有细胞培养上清液用于分离ev,培养基中补充有耗尽ev的fbs,通过在4℃下以110,000g超速离心过夜。所有细胞均保持在37℃和5%co2下。
[0106]
pdgfrα
细胞分离
[0107]
从5日龄的c56bl/6和rosa26-lsl-cas9幼崽身上收获整个小鼠大脑,手动解离,并使用神经解离试剂盒(miltenyi)进行酶消化。悬浮液用补充有10%ev耗尽的fbs的dmem(gibco)淬火,并以1200rpm的转速离心5分钟。然后通过穿过18号针将组织均质化,然后通过70μm细胞过滤器(fisher)过滤以去除任何残留的碎片。使用磁珠分离试剂盒(miltenyi)的阳性选择从该细胞悬浮液中分离出pdgfrα
细胞。
[0108]
培养opc和成熟的ol
[0109]
将pdgfrα
细胞平板接种于由dmem/f2、n-2、b-27、glutamax(2mm)、shh(200ng/ml)、β-fgf、pdgf-aa(20ng/ml)和诺尔霉素(normycin)组成的opc分化培养基中,并在37℃
和5%co2中温育。在3-5天后,用由加入dmem/f2、n-2和b-27和glutamax(2mm)、t3(40ng/ml)、shh(200ng/ml)、头蛋白(noggin)(100ng/ml)、camp(50μm)、tgf(100ng/ml)和nt3(10ng/ml)组成的新鲜的o1成熟培养基替换培养基。细胞保持在o1成熟培养基中长达3周,其中每5天更换培养基。
[0110]
根据millipore协议,源自nih批准的h9人esc(millipore)的人opc生长了三周并分化为成熟的ol。
[0111]
细胞转导
[0112]
用编码cre重组酶(lv-cre;addgene#12106)或小鼠mog(lv-mog,origene)的慢病毒转导opc和hek细胞。简而言之,在用于hek细胞的补充有10%ev耗尽血清的完全培养基中用lv-cre或lv-mog转导大约2
×
106个细胞,而对于opc,我们使用之前部分中描述的相同培养基。在2-3天后从hek细胞的细胞培养上清液中纯化ev,在2-3周后从成熟ol的上清液中纯化ev。
[0113]
mog-/-ol生成
[0114]
从rosa26-lsl-cas9幼崽的大脑中分离出pdgfrα
细胞。用表达cre和mog sgrna或杂乱sgrna的慢病毒转导opc。通过嘌呤霉素选择获得成熟的mog-/-ol。在ol和ol-ev中,通过pcr和duoset elisa(lsbio)确认了mog敲除。
[0115]
mog
hek细胞生成
[0116]
用编码mog的慢病毒转导hek细胞。mog
hek细胞通过嘌呤霉素选择,在补充有10%ev耗尽的血清的完全培养基中获得。在hek细胞和hek-ev中,通过免疫荧光和duoset elisa(lsbio)确认了mog表达。
[0117]
crispr/cas9
[0118]
lenticrispr v2购自addgene(质粒#52961)。使用正向引物:tactagtggcgcgccaccatgcccaagaagaagagg(seq id no:1)和反向引物:ggatccagcgtaatctggaacatcgt(seq id no:2)扩增cre基因,并用于通过xbai和bamhi酶位点替换lenticrispr v2中的cas9序列(随后,xbai位点在连接后去除)。然后在kpni位点之后引入了新的xbai位点,用于多个sgrna表达。最终的质粒被命名为lenti-sgrna主链-efs-cre-p2a-puro。
[0119]
mog sgrna是使用benchling(https://www.benchling.com/crispr/)设计的,从idt合成寡核苷酸并在室温下退火以得到sgrna。sgrna片段分别地通过bsmbi插入plenti-sgrna主链-efs-cre-p2a-puro。在n2a-cas9细胞系中分析sgrna活性,选择活性较高的sgrna进一步使用。
[0120]
表1.sgrna寡核苷酸和检测引物的序列。
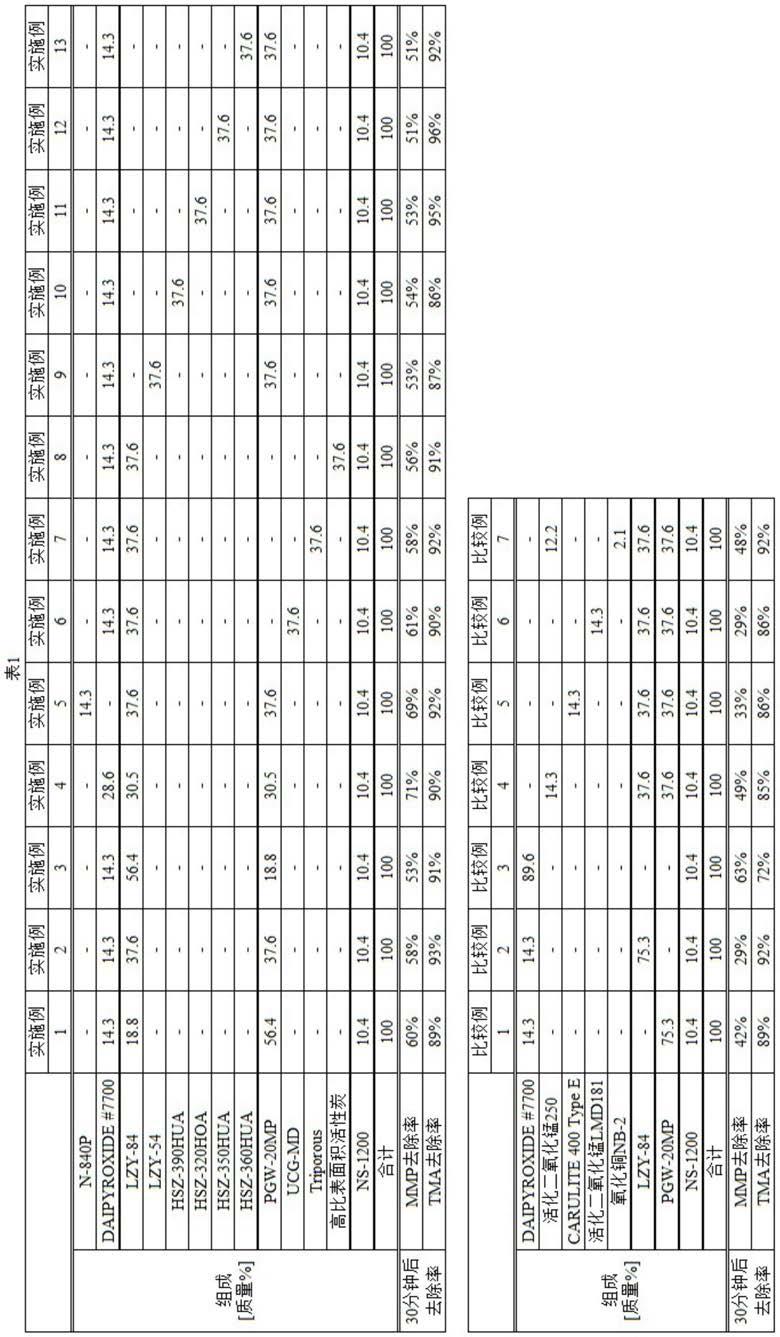
[0121]
名称序列mmog sgrna1正向caccgagcaagcacctgaataccg(seq id no:3)mmog sgrna1反向aaaccggtattcaggtgcttgctc(seq id no:4)mmog sgrna2正向caccgtcacctctaccgaaatggca(seq id no:5)mmog sgrna2反向aaactgccatttcggtagaggtgac(seq id no:6)mmog dp正向tcccactcttgtgtcttgga(seq id no:7)mmog dp反向agcaggtgtagcctccttca(seq id no:8)
[0122]
ev纯化
[0123]
使用标准化方案(17)从细胞培养上清液中纯化ev:收集上清液并以300g离心10分钟以去除细胞和碎片。通过0.45μm注射器式过滤器(millex,millipore)进一步澄清所得上清液,然后以100,000g超离心2小时以沉淀ev。根据ev的预期用途,将团粒悬浮在具有蛋白酶抑制剂、0.1μm过滤的pbs的裂解缓冲液或固定剂二者之一中。
[0124]
ev的纳米粒子跟踪分析(nta)
[0125]
将ev重新悬浮在0.1μm过滤的pbs中并按1:100或1:1000稀释。使用nta 3.1build 3.1.46软件和ns 300仪器(malvern instruments,ma)分析样品。
[0126]
质谱和数据处理
[0127]
使用与nano-acquity uplc系统(waters)联接的q exactive hf质谱仪(thermofisher scientific)进行液相色谱串联质谱(lc-ms/ms)分析。用胰蛋白酶在凝胶内消化样品并注入uplc symmetry捕集柱(180μm i.d.
×
2cm填充有5μm c18树脂;waters)。胰蛋白酶消化肽段通过反相hplc在beh c18纳米毛细管分析柱(75μm i.d.
×
25cm,1.7μm粒径;waters)上使用溶剂a(水中0.1%甲酸)和溶剂b(乙腈中0.1%甲酸)形成的240分钟梯度进行分离。洗脱的肽通过质谱仪进行分析,该质谱仪设置为以正离子模式重复扫描m/z从400到2000。以60,000的分辨率收集完整的ms扫描,然后以15,000的分辨率对超过10,000的最小阈值的20个最丰富的离子进行数据依赖的ms/ms扫描。肽匹配设置为优选;启用排除同位素选项和电荷状态筛选以拒绝未分配的和单电荷离子。使用maxquant 1.6.2.3(39)鉴定肽序列。针对uniprot小鼠蛋白质数据库(2017年10月)和常见污染物数据库使用具有最多两个错过切割的完整胰蛋白酶特异性、cys的静态羧酰胺甲基化、met的可变氧化和蛋白质n端乙酰化搜索ms/ms谱图。“运行之间的匹配”特征用于帮助跨实验转移鉴定,以最小化错过值。生成共识鉴定列表,将蛋白质和肽鉴定的错误发现率设置为1%。
[0128]
eae诱导和评分
[0129]
如前所述(11,40,41)诱导eae。eae免疫方案在表2中概括。
[0130]
每天对小鼠称重并根据临床征兆评分。根据以下评分标准对eae进行临床评估:0=健康;1=软尾(limp tail);2=共济失调和/或后肢轻瘫;3=后肢瘫痪和/或前肢轻瘫;4=四肢瘫痪(tetraparalysis);5=705垂死或死亡(42)。
[0131]
表2:eae模型
[0132]
[0133][0134]
骨髓嵌合体
[0135]
b6.ly5.1(cd45.1
)同类宿主用2
×
2.5gy进行致死性照射,照射之间间隔8小时,并通过尾静脉注射来自wt或zbtb46-dtr供体的5
×
106cd45.2
骨髓细胞进行重建。使用前允许小鼠重建6周。
[0136]
dt消融
[0137]
在i.v.注射ev前1天,以200μl的pbs中1μg/20g小鼠i.p.施用白喉毒素(dtx;sigma-aldrich)。小鼠接受2次dtx注射。
[0138]
pd-l1阻断和ly6g耗尽
[0139]
在ev注射前1天,用200μg/小鼠的αpd-l1 ab(克隆10f.9g2,bioxcell)或200μg/小鼠的αly6g ab(克隆1a8,bioxcell)i.p.注射wt和r26-stop-tdtomato eae小鼠。小鼠在每次处理中接受2次ab注射。
[0140]
i.v.施用自动ag和ev
[0141]
如前所述(11)诱导i.v.耐受性。简而言之,在疾病发作后,每只小鼠每三天接受溶解在pbs中的200μg mog
35-55
、400μg mbp
ac(1-11)
、100μg plp
139-151
或至少10
10
个ev,总共3次。对照小鼠仅接受pbs。
[0142]
ag特异性回忆反应
[0143]
解剖eae小鼠,并且其引流淋巴结和脾脏通过70μm过滤器解离以制备imdm中的单细胞悬浮液——补充有10%热灭活胎牛血清、青霉素(100u)、链霉素(10μg/ml)、l-谷氨酰胺(0.3mg/ml)和2-巯基乙醇(55μm)。用rbc裂解缓冲液(biolegend,ca,usa)处理后,通过在4℃下以1,300rpm离心5分钟,用完全imdm彻底清洗细胞,并将细胞密度调整为2
×
106个/ml。将100μl调整后的细胞悬浮液添加到96孔板的每个孔中。添加mog
35-55
到最终浓度为20μg/ml。细胞在37℃下温育72小时。对于阴性对照,细胞在没有mog
35-55
的情况下培养。收集细胞培养上清液并储存在-20℃直至使用,并通过流式细胞术分析细胞的增殖和细胞因子产生。
[0144]
wt和rag1-/-小鼠的重建
[0145]
wt eae小鼠i.v.接受来自rosa26-stop-tdtomato eae小鼠的脾脏和cns的2
×
106个facs分选的tdtomato
cd11b
cd11c
ly6c
细胞。用来自wt和pd1-/-小鼠脾脏的3
×
106个磁珠分离的总cd4
t细胞i.v.重建rag1-/-小鼠。在过继性转移72小时后,免疫小鼠进行eae诱导。
[0146]
组织学评估
[0147]
每组至少有五只小鼠通过左心室用含有0.5mm edta的盐水灌注10分钟,然后用冷的4%多聚甲醛(pfa;sigma-aldrich)固定。解剖出eae小鼠的脊髓和大脑,并在2%pfa中固
定过夜。使用以下染色:kluver barrera(脱髓鞘)、bielshowsky(轴突损伤)。计算血管周围炎性浸润数量并表示为每平方毫米的炎性浸润数量;脱髓鞘面积和轴突损失表示为受损面积的百分比。
[0148]
低温电子显微镜
[0149]
将3微升ev样品施加到200目铜网格(quantifoil r1.2/1.3)上,进行60秒的辉光放电。过量溶液用滤纸吸干6秒,在4℃下使用vitrobot mark iv(fei荷兰),通过将网格快速插入-165℃的液体乙烷中,立即将网格快速冷冻。两种样品的cryoem数据均在以200kev运行的tecnai f 200kev tem显微镜上收集。图像在falcon iii直接电子探测器上以25,000倍的放大倍数记录。每个显微照片通过平均以40帧/秒的速率持续4秒曝光收集的个体剂量分段帧而生成。这些帧经过运动校正并汇总为单一的显微照片。收集的显微照片在焦点下的范围为2.0-4.0μm。
[0150]
荧光显微镜
[0151]
ol在4℃下用4%pfa固定15分钟,用0.1m甘氨酸淬火,并进行间接免疫荧光处理。nikon nx1(nikon microsystems)共聚焦显微镜用于图像采集。用imagej软件(graphpad)分析图像。抗mbp(thermofisher)、抗mog(millipore)用作第一抗体。
[0152]
eae小鼠的脊髓切片用pbs 1
×
洗涤2次,并在封闭溶液pbs、10%第二抗体种类血清中温育,其中含有或不含有triton 0.1%(取决于ag的性质),在室温下最多1小时。第一抗体在封闭混合物(1%血清)中稀释,并在 4℃下温育过夜。nikon nx1(nikon microsystems)共聚焦显微镜用于图像采集。用imagej软件(graphpad)分析图像。抗cd11b(abcam)和抗精氨酸酶1(genetex)用作第一抗体。
[0153]
elisa
[0154]
通过elisa(biomatik和lsbio)在ev团粒中测量小鼠和人mbp和plp1。mog在wt ol、ol-ev、mog-/-ol和mog-/-ol-ev elisa(lsbio)中测量。
[0155]
eae小鼠血清中mog特异性ig的测量
[0156]
在4℃下,在pbs中用10μg/ml mog
35-55
肽包被elisa板过夜。将板在37℃下用pbs中的2%bsa封闭2小时。用封闭缓冲液按1:100稀释血清,然后将其添加到板中,在4℃下温育过夜。将来自注射了ol-ev的wt c57bl/6小鼠的血清施加到板上而无需事先稀释。用过氧化物酶缀合的山羊α-小鼠第二抗体(thermo scientific)在室温下持续30分钟和四甲基联苯胺(biofx实验室)检测来自血清的结合αmog ab。
[0157]
蛋白质印迹分析
[0158]
用laemmli缓冲液稀释20μg细胞蛋白质和5-10μg ev,并上样到8-14%聚丙烯酰胺凝胶上。将纯化的ev重新悬浮在补充有蛋白酶抑制剂混合物(sigma-aldrich)的裂解缓冲液中。用bca(micro bca,pierce)测量蛋白质浓度。使用小鼠抗小鼠阀蛋白1(bd bioscience)、兔抗alix(millipore)、山羊抗tsg101(millipore)、小鼠抗mog(millipore)、兔gapdh(cell signaling)作为第一抗体。
[0159]
cns浸润白细胞的分离
[0160]
脑和脊髓组织在37℃和0.4mg/ml iv型胶原酶(sigma-aldrich)中温育30min并使用19号针解离以获得均匀的细胞悬浮液。最后,如前所述,通过在percoll梯度上离心来富集cns细胞(43)。
[0161]
流式细胞术和细胞分选
[0162]
使用facsaria ii(becton dickinson)进行流式细胞术,并使用flowjo软件(tree star)进行分析。对cd45(克隆30-f11)、cd45.1(a20)、cd11b(m1/70)、cd3(17a2)、cd8α(53-6.7)cd4(rm4-5)、cd19(1d3/cd19)、cd11c(n418)、pdca1(927)、ly6c(al-21)、f4/80(mb8)、ly6g(1a8)、mhc-ii(m5/114.15.2)、pd-1(29f.1a12)、pd-l1(10f.9g2)、胱天蛋白酶3(货号550480)、ccr2(47503)、mbp(p82h9 fitc)、mog(sc-166172pe)和plp(ab28486)特异性的荧光染料缀合的mab购自bd biosciences、r&d、biolegend、santa cruz、或abcam。
[0163]
对于细胞内染色,在存在golgiplug(1:1000,bd pharmigen)情况下,用佛波醇12-肉豆蔻酸酯13-乙酸盐(50ng/ml,sigma-aldrich)和离子霉素(500ng/ml,sigma-aldrich)刺激细胞4小时,使用cytofix/cytoperm plus试剂盒(bd bioscience)进行透化,并用以下荧光染料缀合的mab染色:cnpase(836408alexa fluor 647)、gm-csf(mp1-22e9)、il-17a(tc11-18h10.1)、il-10(jes5-16e3)、ifn-γ(xmg1.2)、zbtb46(u4-1374),其来自biolegend和bd pharmingen。使用l/d bd pharmingen排除死细胞。
[0164]
qpcr
[0165]
使用rneasy mini kit(qiagen)从opc、成熟的ol、modc和中性粒细胞中提取总rna。通过用dnase i型(qiagen)处理去除基因组dna。使用thermoscripttm rt-pcr系统(invitrogen)进行cdna合成。pdgfrα(mm00440701_m1);ng2(mm00507257_m1);sox10(mm01300162_m1);olig2(mm01210556_m1);mobp(mm02745649_m1);mag(mm00487538_m1);plp1(mm01297210_m1);mog(mm01279062_m1);cnp(mm01306641_m1);mbp(mm01262037_m1);galc(mm01337517_m1);arg-1(mm00475988_m1);pd-l1(mm03048248_m1);stat3(mm01219775_m1);irf1(mm01288580_m1);il-10(mm00439614_m1);tim-3(mm00454540_m1);pd-l2(mm00451734_m1);tgf-β(mm01178820_m1);tgf-α(mm00446232m1);icosl(mm00497237m1);il-27(mm00461162m1);casp3(mm01195085_m1);ccl2(mm00441242_m1);tnf-α(mm00443258_m1);il-23(mm00518984_m1);inos(mm00440502_m1);il-1β(mm00434228_m1);cd-80(mm00711660_m1);cd-86(mm00444540_m1)和gapdh(4352339e)。通过实时rt-pcr(applied biosystems,invitrogen)测量mrna水平。2-δδct方法用于计算基因表达的相对变化(44)。
[0166]
统计分析
[0167]
通过graphpad prism 8软件进行统计分析。统计评估表示为平均值
±
s.d.或平均值
±
s.e.m.,视情况而定。使用双因素或单因素anova分析结果,并使用bonferroni和未配对双尾学生t检验进行后测。统计显著性分级*p《0.05;**p《0.001;***p《0.0001。
[0168]
现在描述实验的结果。
[0169]
实施例1:成熟的ol释放含有最相关的髓鞘质ag的ev
[0170]
为了生成ol-ev,收获小鼠cns pdgfr
细胞,其分化为ol祖细胞(opc),并最终分化为成熟的ol(21)。培养3周后,超过60%的opc变为成熟的ol(cnpase
和galc
高
)并表达髓鞘质蛋白:髓鞘质碱性蛋白(mbp)、髓鞘质少突胶质细胞糖蛋白(mog)和髓鞘质蛋白脂蛋白(plp)(图1a和图8a-8e)。opc和成熟的ol产生了大量平均直径为240nm的ev,如通过cryo-em和纳米粒子跟踪分析(nta)测定的(图1b和图8g)。根据细胞外囊泡(misev)指南的研究的最少信息(22),ol-ev和主要ev标志物的质谱分析显示在图1c和图8h中。还检测了多种髓鞘质
蛋白,包括mbp、mog和plp(图1d),并通过elisa定量它们的水平(图1e)。
[0171]
为了确定ol-ev是否可对小鼠有害,ol-ev每三天i.v.施用到首次用于试验的c57bl/6小鼠,共注射6次。作为对照,注射了hek细胞来源的ev(hek-ev)。没有注意到ol-ev和hek-ev注射对小鼠的影响(图1f),并且在开始ol-ev施用后一个月未检测到针对mog(包含在注射的ol-ev中)的抗体(图1g)。总体而言,这些数据表明成熟的ol释放含有多种髓鞘质ag的ev,并且ol-ev在体内具有良好的耐受性。
[0172]
实施例2:ol-ev i.v.注射在数种活性eae模型中抑制疾病
[0173]
为了确定ol-ev是否可以恢复eae中的免疫耐受性,ol-ev的作用在三种活性eae模型中进行了测试,其代表慢性(mog
35-55
/c57bl/6、mbp
ac(1-11)
/b10.pl)和复发缓解型(plp
139-151
/sjl)临床病程。pbs中的同系ol-ev(ol-ev/i.v.)是在临床疾病发展之前或疾病发作之后i.v.间隔三天施用三次。对照小鼠i.v.注射pbs(假试验组处理)、pbs中的免疫肽或pbs中的hek-ev。在所有三种eae模型中,ol-ev在预防性和治疗性方案中都显著改善了临床疾病,而hek-ev没有效果(图2a-2f)。在最后一次注射后,当小鼠被处死时,治疗效果持续至少2周。在plp
139-151
/sjl eae模型中,ol-ev处理具有显著的治疗效果,但在抑制持续疾病方面的效率稍微低于其他两种eae模型。其他研究人员已经报道了plp
139-151
/sjl eae对i.v.耐受性诱导的相对抗性(23)。还测试了ol-ev在过继性eae中的治疗效果,其中受体首次用于试验的c57bl/6小鼠移植了来自供体eae小鼠的mog
35-55
特异性cd4
t细胞。ol-ev处理阻止了eae进展(图9a-9c),因此在活性和过继性eae中表现出相似的治疗效果。与i.v.施用时相比,皮下(s.c.)注射的ol-ev没有改善eae(图10a、图10b),这表明i.v.路径可能对于ol-ev诱导耐受性至关重要。
[0174]
与临床疾病的改善一致,ol-ev处理保护eae小鼠免受神经病理征兆、脱髓鞘和轴突损伤(图10c、图10d)。此外,ol-ev处理减少了cns中浸润性cd45
和cd4
细胞的数量,脾细胞显著降低了对免疫肽的回忆反应(图10e-10h)。
[0175]
即使i.v.注射游离致脑炎肽在eae中产生显著的治疗益处,但它们的重复注射可在许多小鼠中诱发过敏性休克和死亡(24)。总体而言,ol-ev的效果与包括在这些实验中作为阳性对照的肽的效果相似;然而,ol-ev/i.v.被证明比肽/i.v.更安全(图2g)。
[0176]
这些数据表明在多个eae模型中,i.v.注射ol-ev抑制正在进行的临床疾病。
[0177]
实施例3:ol-ev在eae中的抑制作用是髓鞘质ag依赖性的
[0178]
为了阐明ol-ev抑制eae的机制,首先使用mog
35-55
特异性t细胞受体转基因2d2小鼠确定ol-ev对血液t细胞的时间作用。ol-ev/i.v.注射到2d2小鼠中减少外周血(图3a)和脾脏(图11a-11c)中cd4
t细胞的数量,但其动力学显著低于mog
35-55
/i.v.注射。cd4
t细胞在ol-ev注射24小时后变为胱天蛋白酶3
,而mog
35-55
仅在6小时后诱导稳健的胱天蛋白酶3表达(图3b、图3c)。这些数据表明cd4
t细胞的凋亡是ag特异性的,因为它不是由hek-ev处理诱导的。与游离肽相比,ol-ev效果的延迟可能归因于从囊泡中处理和呈递全长mog蛋白所需的时间,而注入的mog
35-55
肽的呈递通过不同的途径发生并且是更快速的。可能地,与通过处理来自囊泡的mog蛋白生成的肽相比,更大量的注射的游离肽也有助于对肽的快速反应。
[0179]
为了进一步探索ol-ev对t细胞活化的影响,cfse标记的对mog(2d2)或ova(ot-ii)特异性的幼稚cd4
t细胞被过继转移到cd45.1
首次用于试验的小鼠体内,两天后我们注射了ol-ev/i.v.。ol-ev的作用是ag特异性的,因为它只诱导mog特异性而非ova特异性cd4
t
ev处理eae小鼠期间,中性粒细胞被抗ly6g ab耗尽(血液中的中性粒细胞数量减少约75%;图16a、图16b)。中性粒细胞耗尽本身对病程没有影响(图4e),这与疾病发作后中性粒细胞耗尽对eae没有影响的发现一致(30)。令人惊讶的是,中性粒细胞耗尽不影响ol-ev对eae的抑制(图4e),这表明中性粒细胞不介导ol-ev的作用。
[0186]
接下来,研究了cdc(cd11c
mhcii
zbtb46
)的作用。首先生成辐射诱导的zbtb46-dtr(cd45.2
)
→
cd45.1
骨髓嵌合体小鼠以限制白喉毒素(dtx)对cdc的作用(31)(图16c、图16d)和重建6周之后在这些小鼠中诱导eae。在疾病发作后开始i.p.注射dtx,然后在ev处理期间每隔一天i.p.注射,并证实dtx处理减少了脾脏cdc(图16e、图16f)。cdc的耗尽对于ol-ev对eae的抑制也是可有可无的(图4f)。单核细胞的作用无法直接测试,因为它们的耗尽将破坏eae发展(32)。总之,这些数据表明单核细胞/modc介导了ol-ev对eae的抑制,因为发炎的cns中的几乎所有这些细胞都获得了ol-ev,并具有在mhc ii类的背景下呈递髓鞘质ag的能力。
[0187]
实施例5:ol-ev/i.v.诱导免疫抑制性单核细胞
[0188]
鉴于数据表明单核细胞/modc介导ol-ev在eae中的作用,然后检查了它们的表型。eae小鼠用ol-ev i.v.注射,然后对它们的脾脏和cns td-tomato
单核细胞进行facs分选(与图4a、图4b所示的相同策略)并分析它们的mrna。与对照相比,ol-ev处理诱导了数种调节基因的显著上调:arg1、pdl1、il10、irf1、havcr2(tim-3)和stat3等(图5a)。有趣的是,来自cns而非脾脏的单核细胞也显著降低了在eae发病机制中起重要作用的一些促炎性介质(ccl2、tnf、inos、il23a和il1b)(33)的表达(图5a)。这些发现中的一些通过相应蛋白质的免疫染色得到验证。用ol-ev处理的eae小鼠在脾脏和cns二者(图5b、图5c和图17a、图17b)中具有显著更高百分比的il-10
和pd-l1
单核细胞,接受ol-ev的eae小鼠的脊髓具有更多数量的arg1
cd11b
细胞(图18a、图18b)。
[0189]
用ol-ev处理的eae小鼠在脾脏和cns二者中具有更高百分比的凋亡的(胱天蛋白酶3
和pd-1
)致脑炎cd4
t细胞(图5d-5g和图13h、图13i),类似于i.v.注射ol-ev的首次用于试验的2d2小鼠(图3a-3k)。测试了免疫抑制性单核细胞(pd-l1
ccr2
ly6c
)和凋亡的t细胞(胱天蛋白酶3
pd-1
cd4
)的数量之间是否存在相关性,并发现了稳健的正相关性(图5h)。这支持了单核细胞和致脑炎t细胞之间的相互作用导致t细胞凋亡并改善疾病的观点。还研究了ol-ev/i.v.是否影响了foxp3
cd25
treg的数量或频率,与对照相比没有发现差异(图13j和图13k),这表明treg不介导o1-ev在eae中的抑制作用。
[0190]
最后,为了在功能上验证ol-ev诱导的modc的免疫抑制性表型,将facs分选的cns来源的td-tomato
modc从用cre
ol-ev处理的eae小鼠移植到患有持续疾病的小鼠中(图5i)。td-tomato
modc的单次转移诱导由疾病快速恢复,而对照td-tomato
modc从用cre
hek-ev处理的eae小鼠的转移没有改变病程(图5i)。
[0191]
这些数据表明,在用ol-ev/i.v.处理eae小鼠后,单核细胞/modc通过导致致脑炎t细胞死亡获得免疫抑制性表型并改善疾病。
[0192]
实施例6:单核细胞中ol-ev/i.v.诱导的pd-l1对eae抑制至关重要
[0193]
鉴于pd-1及其配体在免疫耐受性中的重要性(34-36),研究了ol-ev是否经由pd-1/pd-l1相互作用抑制eae。抗pd-l1 ab是在疾病发作后、ol-ev注射前24小时i.v.注射的。在抗pd-l1处理后,eae小鼠出现了对ol-ev/i.v.处理没有反应的严重疾病(图5j)。相反,用
ab阻断pd-l2并不能防止ol-ev对eae的抑制(图18c)。为了确认pd-l1在不使用抗pd-l1 ab的情况下在ol-ev的作用中的重要性,将pd-1-/-或wt cd4
t细胞移植到rag1-/-小鼠中,用mog
35-55
免疫它们进行eae诱导,和在疾病发作后,将它们i.v.注射ol-ev。囊泡抑制了用wt cd4
t细胞转移的小鼠中的eae,但在用pd-1-/-cd4
t细胞转移的小鼠中没有抑制eae(图18d)。
[0194]
总体而言,这些数据证明pd-1/pd-l1相互作用,而不是pd-l2,对ol-ev在eae中的治疗效果至关重要。
[0195]
实施例7:ol-ev以il-10依赖性的方式诱导pd-l1
[0196]
ol-ev/i.v.在脾脏和cns的单核细胞中诱导il-10表达(图5a-5j和图6a-6g)。由于il-10的免疫调节功能,它可能有助于ol-ev对eae的抑制,例如通过诱导pd-l1表达(6)。为了测试这一点,首先在缺乏il-10受体β亚基(il-10rb-/-)的小鼠中诱导eae,和在疾病发作时i.v.注射ol-ev或hek-ev。在没有il-10rb的情况下,ol-ev未能抑制eae(图6a、图b),并且从ol-ev处理的il-10rb-/-小鼠的cns分离的白细胞数量没有减少,就像在wt小鼠中一样(图6c)。接下来,为了研究在ol-ev处理后哪个细胞群产生il-10并在单核细胞上诱导pd-l1,与来自mog
35-55
免疫的小鼠的wt或il-10-/-cd4
t细胞和apc产生错配共培养物,并添加ol-ev或hek-ev(图6d和图6f)。骨髓apc(cd11b
cd11c
mhcii
cd19-细胞)中的il-10缺乏阻止了ol-ev对骨髓细胞的pd-l1诱导,而cd4
t细胞中的il-10缺乏则没有影响。这些数据表明,ol-ev在单核细胞/dc中诱导il-10,其又以自分泌方式诱导pd-l1表达。
[0197]
实施例8:人ol释放含有髓鞘质ag的ev
[0198]
使用ol-ev/i.v.作为ms的疗法的先决条件是人ol(hol)释放含有多种髓鞘质ag的ev。为了确定是否是这种情况,将源自nih批准的h9人esc的人opc(millipore)分化为成熟的hol,并从培养上清液中收获ev。hol释放了大量ev,通过cryo-em确定平均直径为300nm(图7a)。通过质谱分析hopc来源的ev和ho1-ev的蛋白质组学谱,发现它们的蛋白质谱实质上不同(图7b、图7c)。与小鼠ol-ev相似,hol-ev含有大量的髓鞘质蛋白,例如mbp和mog(图7d),而opc来源的ev包含的这些蛋白质要少得多。
[0199]
这些数据表明,体外分化的hol释放含有大量髓鞘质ag的ev,这提供了hol-ev在性质上与小鼠ol-ev相似的原理验证,因此在ms患者中可能具有与eae中小鼠ol-ev具有的效果相似的有益效果。
[0200]
实施例9:
[0201]
目前的ms疗法以ag非特异性方式靶向免疫系统,由于全身性免疫抑制,可能会产生严重的副作用(4)。ms研究的一个长期目标是设计抗原特异性疗法,该疗法仅抑制有害的免疫反应,同时保持免疫系统的其余部分完整。ag特异性疗法的先决条件是靶ag的鉴定。据信ms中的自身免疫反应靶向ol产生的髓鞘质蛋白,例如mog、mbp和plp(41)。还认为,相关的一种或多种髓鞘质ag在ms患者中不一定相同,并且随着时间的推移,自身免疫反应的特异性可以从最初的髓鞘质抗原表位转变至另一个表位或ag(41)。这种致病反应的ag特异性进化概念,称为“表位扩散”,还提出新开发的针对另外的髓鞘质ag的反应会有助于疾病发作和慢性化(24)。总体而言,ms中相关的一种或多种ag的身份仍然未知,患者之间和随着时间的推移可能具有异质性。正是这种对ag的知识缺乏阻碍了ag特异性ms疗法的发展,尽管它在实验动物模型中取得了成功。在动物中测试的一些疗法解决了抗原复杂性的问题,但以
需要了解抗原导致疾病的方式(4)。基于eae中的发现,已经提出了在ms中诱导ag特异性耐受性的数种方法(4)。一种方法是通过i.v.注射游离致脑炎肽或通过与纳米颗粒或凋亡细胞联接的肽诱导耐受性(5-10)。i.v.耐受性通过引发致耐受性apc、减少致病性th1和th17细胞反应(11,42)以及诱导treg和tr1细胞来抑制eae(37)。我们最近示出在持续的eae中i.v.诱导耐受性取决于il-27(11)和半乳凝素1(42)。
[0202]
测试s.c.递送改变的mbp肽效果的临床试验表明这种方法确实会使一些ms患者的疾病恶化(43)。在ms患者中的试验表明,向进展性ms患者(n=32)i.v.输注免疫显性mbp肽(每6个月500mg,共24个月)是安全的(44)。在24个月时,该治疗仅在具有hla单倍型dr2和/或dr4的患者(n=20)中具有显著益处。对这些应答患者的长期随访显示,进展的中位时间为78个月,与之相比,安慰剂处理为18个月。在另一个试验中,单次i.v.输注与7种免疫显性髓鞘质肽共价偶联的自体白细胞也是安全的(9)。这些试验的发现表明髓鞘质ag的i.v.递送对ms患者可以是安全且有益的。基于在实验动物中的发现,认为以颗粒形式(细胞、纳米颗粒)输注髓鞘质ag(也适用于ol-ev)是比输注可溶性游离ag更安全的方法(45)。
[0203]
ev领域在过去十年期间发展迅速(20)。ev是几乎所有细胞分泌的蛋白质-脂质膜包裹的颗粒(15,16),它们在生理和病理条件下在细胞间通信中起主要作用。数项研究报告称,在脑脊液和血液二者中都存在源自cns驻留细胞(如小神经胶质细胞和星形胶质细胞)的ev,它们的数量在例如ms和eae的炎性条件下增加(46)。ol也释放ev,但关于ol-ev在维持体内平衡或疾病期间的作用知之甚少。
[0204]
由于ev生物学取得的重大进展,目前正在研究ev作为数种疾病的疗法(20)。多项研究已使用ev用于实验性自身免疫性疾病的疗法(17-19),这报告了它们通过靶向小神经胶质细胞/巨噬细胞、引发致耐受性dc和诱导treg在调节eae炎症中的功效(18-20)。我们表明,体外培养的ol释放ev(外泌体和微泡二者),其含有最相关的髓鞘质蛋白。在大多数将ev描述为药物递送工具的报告中,仅使用外泌体(18),因为具有某些治疗优势(17,48)。已经表明,由于髓鞘质蛋白在不同类别的ol-ev中的不同分选机制(49),plp在外泌体中富集,而mbp和mog主要存在于膜来源的微泡中(50)。我们使用了总ol-ev、外泌体和微泡,它们的施用以ag依赖性方式,在数种eae模型中预防性地和治疗性地抑制神经炎症。该处理没有可观察到的副作用,并且比输注游离肽更安全。输注的ol-ev优先被吞噬细胞、单核细胞、中性粒细胞和cdc摄取,但只有单核细胞证明对于ol-ev诱导的耐受性是必不可少的。摄取ol-ev的单核细胞上调了数种抗炎分子的表达,例如pd-l1和il-10,这些分子介导了疾病抑制。最后,我们表明hol也释放含有髓鞘质蛋白的ev。
[0205]
携带多个髓鞘质ag的ol-ev减少致脑炎t细胞对多种髓鞘质抗原/表位的反应,并在数种eae模型中抑制神经炎症。据报道,使用合成的多表位ag(组合成单一人工蛋白质的数个髓鞘质表位)在抑制eae方面比单个肽更有效(23,38)。ol-ev的作用是ag依赖性和特异性的。使用mog和mbp特异性t细胞受体转基因小鼠表明,ol-ev通过它们携带的一个或过个髓鞘质抗原诱导自身反应性t细胞的凋亡和无反应性。此外,本文显示,缺乏mog或mbp的ol-ev未能抑制mog
35-55
诱导或mbp
ac(1-11)
诱导的eae。
[0206]
ev大小和蛋白质含量的异质性是影响受体细胞摄取ev的变量,其可经由多种途径发生(16)。已知纳米颗粒通过清道夫受体依赖性机制被内吞(7);然而,尽管ev摄取的细节尚未完全阐明(15),但据描述,吞噬细胞,例如单核细胞/modc、dc、巨噬细胞和小神经胶质
细胞可以通过受体介导的内吞作用、吞噬作用和微胞饮作用将ev内化(51)。
[0207]
modc在eae中的作用已被广泛描述(32)。modc通常不存在于健康的cns中,但在炎症期间,它们会浸润到脑膜和实质中,并通过获得对ag处理和呈递的增强能力而有助于cns病理学。与描述脾脏吞噬细胞“捕获ag”对恢复eae中免疫耐受性的重要性的数项研究相反(7),本文的数据表明,浸润到cns中的modc获得ol-ev并介导eae的抑制。事实上,将来自用ol-ev处理的eae小鼠的cns来源的modc转移到患有持续疾病的小鼠体内迅速抑制了eae炎症。
[0208]
本文显示,在用ol-ev/i.v.处理eae小鼠后,cd4
t细胞上pd-1上调,modc上pd-l1和pd-l2上调。鉴于pd-1及其配体在免疫耐受性中的重要性(38),研究了ol-ev是否经由pd-1/pd-l1和/或pd-1/pd-l2相互作用抑制eae。用ab阻断pd-l1废除了ol-ev对eae的抑制,而阻断pd-l2没有效果。这表明t细胞上的pd-1和modc上的pd-l1之间的相互作用导致致脑炎t细胞的无反应性和凋亡以及疾病改善,这与报道的pd-l1在eae中诱导i.v.耐受性中的作用一致(6)。
[0209]
il-10是抗炎细胞因子,具有重要的免疫调节作用,抑制炎症反应和自身免疫,包括eae(6)。已经表明eae中的肽/i.v.耐受性诱导需要il-10。研究表明,可以通过不同的方式在eae中诱导il-10并促进免疫耐受性(6,7),并且阻断il-10废除耐受性(6)。本文证明,ol-ev对eae的抑制也需要apc产生il-10,而不是cd4
t细胞产生。显然地,il-10用于诱导modc上的pd-l1表达并抑制疾病。
[0210]
建立和维持外周耐受性的重要机制依赖于treg。因此,探索了是否ol-ev/i.v.影响treg,但未发现它们在cd4
t细胞中的总数或频率变化。这表明ol-ev/i.v.通过不依赖treg的机制抑制eae,髓鞘质特异性cd4
t细胞与致耐受性modc之间的直接相互作用导致t细胞凋亡和无反应。然而,即使可以独立于treg诱导modc的致耐受性表型,treg仍有助于其诱导,而不是扩展自身。在与我们的系统相似的系统中报告了适度的treg有助于eae中ag特异性i.v.耐受性,但使用了与微珠联接的髓鞘质ag(7)。这些报告的发现支持这样的观点:treg可能对ol-ev抑制eae做出一些贡献,但可能不是必不可少的。
[0211]
总之,鉴于ol-ev含有大部分或可能所有相关的髓鞘质ag,它们有可能诱导ag特异性耐受性并抑制针对髓鞘质ag由免疫反应驱动的疾病。因此,ol-ev的使用将回避鉴定每位患者中一种或多种相关髓鞘质抗原的需要,这提高了ol-ev/i.v.可能是普遍适用的ag特异性ms疗法的可能性。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。