一种同时靶向rna与dna病毒的药物及应用
技术领域
1.本发明属于生物医药技术领域,具体涉及一种用于抗击病毒的药物及其应用。
背景技术:
2.纵观历史,人类数次遭遇多种不同类型、未知且突发的病毒攻击,却缺乏有力的对 抗“武器”,并且,目前只有少数已知病毒的疫苗与抗病毒药物被批准上市。我们还是缺乏 强有力的手段来应对许多突如其来的未知病毒的袭击。
3.到目前为止,对于病毒的控制与治疗主要依赖于疫苗,小分子药物,传统中药,抗体 等等。其中,研发疫苗与抗体需要耗费数年,小分子药物抑制病毒的复制是通过激活宿 主细胞合成抗病毒功能性蛋白或者抑制病毒dna转录活性的蛋白。这些抗病毒方法需要 对理想病毒以及宿主靶蛋白有很全面的了解,并且主要依赖于病毒宿主的免疫反应。因 此,开发一种只需了解病毒基因组序列就可以应对其爆发的技术是非常重要的。
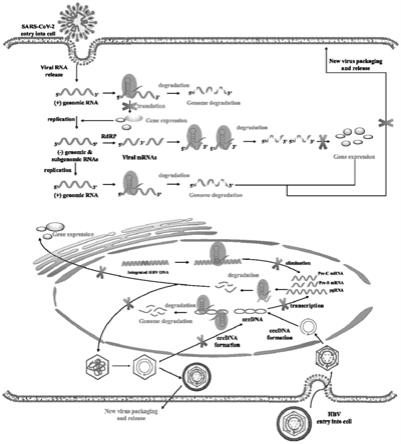
4.另外,目前有些病毒的基因组甚至可以整合到宿主基因组中,不断转录和表达组装病 毒蛋白,使患者“与病毒共存”。例如,乙型肝炎病毒(hbv)在侵染宿主后会释放并形 成共价闭合环状dna(cccdna)侵入宿主基因组dna,cccdna将会始终存在于细胞 核中,进而导致宿主终生携带病毒。最近的一些研究还声称sars-cov-2有时可能会将其 遗传物质整合人类染色体中。因此,直接攻击病毒的根本要害遗传物质“基因组核酸”, 在抗病毒治疗中可以做到釜底抽薪、一劳永逸。
5.crispr系统可以代表这种靶向病毒核酸的抗病毒药物。crispr-cas9系统已成功应 用于直接破坏dna病毒的必需基因,如单纯疱疹病毒1(hsv-1)、人类巨细胞病毒 (hcmv)和hbv。crispr-cas9系统还能够靶向带有dna中间体的rna病毒,例如丙 型肝炎病毒(hcv)和人类免疫缺陷病毒(hiv)。因此crispr-cas9系统,可以防御和治愈 大约三分之一的病毒(dna病毒和带有dna中间体的rna病毒)。对于其他三分之二的 病毒,它们是rna病毒且他们的基因组在哺乳动物细胞中不会形成dna中间体,包括 sars-cov-2、沙粒病毒淋巴细胞脉络丛脑膜炎病毒(lcmv)、甲型流感病毒(iav)和水泡 性口炎病毒(vsv),crispr-cas13系统可以被用于破坏rna病毒的必需基因。已有 pacman(人类细胞中的预防性抗病毒crispr)被开发用于对抗sars-cov-2和iav。 此外,另一种基于核酸的抗病毒药物sirna/shrna也可用于抑制ssrna基因组和mrna成分。然而,还没有一种基于核酸的抗病毒药物,它不仅可以对抗dna病毒,还 可以对抗ssrna病毒,而无需dna中间体。
6.最近,本课题组开发并报道了一种新型基因编辑工具hpsgn系统。该系统由fen1 蛋白与发夹dna探针组成,并且被证实可以实现对基因组dna的调控并可以降解 mrna。hpsgn有如下优点1)对于靶标的序列没有限制(如pam或pfs序列),理论 上可以在靶标的任何位置作用。2)可以同时切割dna与rna靶标。3)hpsgn的蛋白 fen1分子量较小(35kda,337个氨基酸)有利于体内递送。
7.本发明开发了hpsgn系统作为一种抗病毒策略(以下称为antiv-sgn策略)来破坏 ssrna病毒的病毒基因组rna和dna病毒的病毒基因组dna。对于没有dna中间体 的ssrna病
毒sars-cov-2,该病毒将其rna基因组释放到细胞质中,并合成负义基因 组和亚基因组rna,进而转录形成病毒mrna以及合成阳性病毒基因组。antiv-sgn能 够同时捕获和降解正义基因组及其产生的病毒mrna,以抑制病毒的复制和病毒基因表 达。对于dna病毒hbv,病毒感染细胞并形成共价闭合环状dna(cccdna),它整合到 宿主基因组dna中并伴随宿主细胞终生。antiv-sgn可以破坏cccdna以及整合到宿主 基因组dna中的病毒片段。在本发明中,将在体外和体内测试这种可编程antiv-sgn策 略的可行性。我们假设antiv-sgn的这种概念验证抗病毒策略具有潜在的临床价值,可 针对多种已知和新发现的人类病原体。
技术实现要素:
8.本发明的目的是针对背景技术所指出的现有抗病毒药物的不足,提供一种新型抗病毒 药物作为补充,该药物是既可靶向破坏dna病毒的核酸,也可靶向破坏rna病毒的核 酸的小型广谱抗病毒治疗药物。
9.本发明的目的可通过以下技术方案实现:
10.antiv-sgn系统在制备用于治疗真核细胞中病毒感染药物中的应用,该antiv-sgn 系统包含:
11.(i)至少一个寡核苷酸探针,所述的寡核苷酸探针由两部分组成,一部分为能够与靶标 病毒核酸底物互补的引导序列(该引导序列至少能够与靶病毒的一种核酸序列杂交),另 一部分具有核酸二级结构;
12.(ii)antiv-sgn蛋白分子或者编码该蛋白分子的多核苷酸,所述的antiv-sgn蛋白分 子能够识别所述寡核苷酸探针的核酸二级结构,从而与寡核苷酸探针结合,再被寡核苷 酸探针引导,与靶标病毒核酸序列相结合破坏或降解所述靶标病毒的核酸序列。
13.本发明通过向真核细胞中引入可以用于抗病毒的外源antiv-sgn系统,由所述 antiv-sgn蛋白分子或编码该蛋白分子的多核苷酸与寡核苷酸探针组合形成的antiv
‑ꢀ
sgn系统,能够破坏或降解入侵感染真核细胞中的rna病毒与dna病毒的核酸序列。
14.本发明中的antiv-sgn系统中可以降解游离在细胞中的病毒核酸,也可以清除整合 入细胞基因组中的病毒核酸。
15.作为一种优选技术方案,所述的antiv-sgn蛋白分子含一个或多个核定位信号或核 导出信号,编码所述antiv-sgn蛋白分子的多核苷酸为dna或rna。
16.进一步优选的,所述的antiv-sgn蛋白分子为以下(1)~(5)中的至少一种:
17.(1)afufen或其突变体的部分功能域或全酶片段;
18.(2)pfufen或其突变体的部分功能域或全酶片段;
19.(3)mjafen或其突变体的部分功能域或全酶片段;
20.(4)mthfen或其突变体的部分功能域或全酶片段;
21.(5)homo sapiens fen或其突变体的部分功能域或全酶片段。
22.本发明实施例中所采用的antiv-sgn蛋白分子为如seq id no.2所示的a.fulgidusfen1蛋白,其编码序列如seq id no.1所示;但不限于此。
23.作为一种优选技术方案,所述的靶标病毒为rna或/和dna病毒。
24.进一步优选的,所述的rna病毒为sars-cov-2、沙粒病毒淋巴细胞脉络丛脑膜炎 病毒(lcmv)、甲型流感病毒(iav)和水泡性口炎病毒(vsv)中的至少一种;所述的dna 病毒
为乙肝病毒(hbv)、单纯疱疹病毒1(hsv-1)和人类巨细胞病毒(hcmv)中的至少一 种;更进一步优选的,所述的rna病毒为sars-cov-2,所述的dna病毒为乙肝病毒 (hbv)。
25.所述sars-cov-2病毒的核酸底物包含在真核细胞中游离的sars-cov-2病毒基因组 的序列中,或者包含在sars-cov-2病毒的mrna序列中。
26.所述hbv病毒的核酸底物包含在没有整合到真核细胞基因组中的游离病毒核酸分子 基因组的序列中,或者包含在共价闭合环状dna(cccdna)序列中,或者包含在整合到真 核细胞的基因组中的hbv序列中,或者包含在整合入基因组的hbv与游离cccdna转 录出的pgrna,pre-c mrna或pre-s mrna中。
27.作为一种优选技术方案,设计所述的寡核苷酸探针时,依据尽量能够覆盖最多基因 型和靶标病毒亚型保守区域的原则,设计出至少一个寡核苷酸探针(一个、两个或两个 以上),以实现高效特异性清除靶标病毒。
28.在引入真核细胞中的antiv-sgn系统中引入多个靶向病毒核酸的寡核苷酸探针,可 以最大程度的破坏病毒核酸序列,使其片段化,从而使病毒失去再次复制和传播的可 能,从根本上消除病毒感染,进一步消除病毒逃逸的可能。
29.进一步优选的:所述的靶标病毒核酸底物为hbv病毒核酸或sars-cov-2病毒核 酸,我们在选择探针时依据尽量能够覆盖最多基因型和病毒亚型保守区域的原则,设计 出至少一对探针,从而实现高效特异性清除病毒。
30.与未被antiv-sgn系统处理过的对照组相比,antiv-sgn系统能够通过降解真核细 胞中sars-cov-2病毒基因组游离核酸和其mrna来减少真核细胞中病毒核酸的载量。 所述的降解是经由antiv-sgn系统向该病毒基因组rna和mrna引入的一个或多个单 链断裂。
31.与未被antiv-sgn系统处理过的对照组相比,antiv-sgn系统能够通过降解真核细 胞中hbv病毒基因组游离核酸和cccdna来减少真核细胞中病毒游离的核酸。当病毒 hbv靶序列被包含在整合到该真核细胞的基因组中的hbv序列时,antiv-sgn系统能够 清除整合在基因组中的所有或部分靶hbv序列。所述的降解包括向该病毒cccdna或整 合的病毒dna引入的一个或多个双链断裂;或者在整合入基因组的hbv与游离 cccdna的转录出的pgrna,pre-c mrna,pre-s mrna等中引入的一个或多个单链断 裂。所述一个或多个双链断裂或所述一个或多个单链断裂导致在该病毒cccdna序列和 整合的病毒dna序列中一个或多个插入和缺失突变(indel)的形成。
32.在此描述的方法之中,本发明的antiv-sgn系统中的寡核苷酸探针引导序列能够杂 交到靶病毒核酸序列上,靶病毒核酸序列是没有整合到生物基因组中的游离核酸分子, 可以降解游离的病毒核酸。优选其中游离核酸分子是双链dna多核苷酸分子和单链 rna分子。antiv-sgn靶序列是乙型肝炎病毒(hbv)核酸的情况下,该游离双链dna多 核苷酸分子是病毒核酸共价闭环dna(cccdna),游离单链rna分子是病毒核酸pgrna, pre-c mrna,pre-s mrna等。当antiv-sgn靶向病毒核酸是sars-cov-2核酸分子的情 况下,靶病毒核酸序列是病毒基因组和mrna。
33.在此描述的方法之中,本发明中的antiv-sgn系统中的寡核苷酸探针引导序列能够 杂交到靶病毒核酸序列上,该靶病毒核酸序列是整合到真核细胞基因组中的病毒核酸, 可以清除整合入基因组中的病毒核酸,解决“终生带毒”问题。当antiv-sgn靶向病毒 核酸是乙型肝炎病毒(hbv)核酸的情况下,该整合至基因组中的核酸是cccdna整合至真 核细胞
基因组之中的。
34.一种用于治疗真核细胞中病毒感染的药物,该药物中包含有上述的antiv-sgn系 统。
35.一种治疗抗sars-cov-2或/和hbv病毒感染的药物,该药物中包含有上述的antiv
‑ꢀ
sgn系统。
36.本发明的有益结果:
37.1)本发明提供的新型基因调控工具及方法,普适性强,适用于不同类型病毒及其不 同亚型(如图1所示)。antiv-sgn系统同时破坏rna病毒和dna病毒基因组,而且只 需改变hpdna的引导序列(仅-20nt),就可以靶向不同类型不同亚型的病毒基因组,只 需很小的经济和时间成本,弥补了现在传统抗病毒药物的不足。
38.2)本发明提供的新型基因调控工具及方法,可以在急性动物模型中抑制hbv基因 的表达,可以作为一种理想的抗乙肝的候选药物。
39.3)本发明提供的新型基因调控工具及方法,分子量小,有利于体内递送。本项目研 发的antiv-sgn系统,其fen1蛋白只有35kda,是目前报道的基因编辑工具及基因药 物中体积最小的(仅336个氨基酸)。
40.4)本发明提供的新型基因调控工具及方法,系统组分合成简单,作为药物可以显著 降低成本。antiv-sgn的主要组分是hpdna是长度约为50-nt的单链dna,相较于 sirna和crispr系统的sgrna,hpdna的合成较为成熟便宜。
附图说明
41.图1为本发明与最接近现有技术的原理示意图。
42.图2为antiv-sgn在哺乳动物细胞水平抑制sars-cov-2报告质粒的表达;
43.其中,a为四种靶向n基因的探针hpdna设计示意图;b为antiv-sgn在a549细 胞中抑制sars-cov-2报告质粒表达的实验流程;c为转染不同探针hpdna组别sars
‑ꢀ
cov-2报告质粒表达情况;d为转染不同探针hpdna组别中egfp 细胞比例;e为转染 不同探针hpdna组别中sars-cov-2报告质粒mrna表达量。
44.图3为antiv-sgn在哺乳动物细胞水平抑制hbv报告质粒的表达;
45.其中,a为三种靶向x基因的探针hpdna设计示意图;b为antiv-sgn在hepg2 细胞中抑制hbv报告质粒表达的实验流程;c为转染不同探针hpdna组别hbv报告质 粒表达情况;d为转染不同探针hpdna组别hbv报告质粒mrna表达量。
46.图4为antiv-sgn与现有基因编辑工具rnai和crispr的比较;
47.其中,a为antiv-sgn、sirna和crispr-cas13在hek293a,a549,与hepg2 细胞中对sars-cov-2报告质粒编辑效率对比;b为antiv-sgn、sirna和crispr
‑ꢀ
cas13在hek293a与hepg2细胞中对hbv报告质粒编辑效率对比。
48.图5为antiv-sgn在哺乳细胞中抑制sars-cov-2的增殖;
49.其中,图a为antiv-sgn在vero细胞中抑制病毒增殖的实验流程;b为在antiv
‑ꢀ
sgn作用下,不同组别中上清病毒的表达量。
50.图6为在antiv-sgn作用下sars-cov-2靶标位置的突变情况。
51.图7为antiv-sgn在人类细胞hepg2.2.15中的抗病毒作用;
52.其中,图a为研究antiv-sgn在人类细胞hepg2.2.15中的抗病毒作用的实验流程; 图b为三种不同探针在100个hbv分离株中的覆盖率分析;图c为在antiv-sgn作用 下,转染探针集合(pool)与无关探针(nt)与未经任何处理(mock)中,cccdna表 达含量;图d和图e为研究antiv-sgn在人类细胞hepg2.2.15中转染探针集合(pool) 与无关探针(nt)中病毒表达量。
53.图8为antiv-sgn在动物水平能够抑制急性肝炎模型中hbv的表达;
54.其中,图a为利用水动力注射法将1.3
×
wt hbv、antiv-sgn递送至c57bl/6小 鼠的肝脏;图b为三对靶向探针hpdna在质粒上的分布位置;图c为在antiv-sgn作 用下,在指定时间各组别小鼠肝脏中hbv mrna的表达量;图d为在antiv-sgn作用 下,在指定时间各组别小鼠血液中hbsag的含量;图e为小鼠心、脾、肺和肾的h&e 染色免疫组化结果;图f为在antiv-sgn作用下,在指定时间各组别小鼠体重变化。
具体实施方式
55.为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明 进行进一步详细说明。应当理解,此处所描述的具体实施例仅用以解释本发明,并不用 于限定本发明,凡在本发明的精神和原则之内所做的任何修改、等同替换和改进等,均 应包含在本发明的保护范围之内。
56.实施例1 antiv-sgn能够在哺乳细胞中抑制sars-cov-2报告质粒的表达水平
57.rna病毒sars-cov-2的ssrna基因组有30,000-nt,包含12个编码功能性开放阅 读框。根据之前的研究,其基因组末端是核衣壳蛋白(n)基因,是一段高度保守的区域, 该基因编码用于病毒包装的衣壳蛋白。由于我们的antiv-sgn系统没有目标序列的限制 (如pam/pfs),理论上n基因中的任何位置都可以成为hpdna的候选位置。我们在 排除了在人类转录组中可能结合的引导序列,设计并合成了四种靶向n基因的hpdna如 图2-a(hp-cov-1、hp-cov-2、hp-cov-3、hp-cov-4)。
58.为了验证antiv-sgn(核苷酸序列如seq id no.1所示,编码的氨基酸序列如seqid no.2所示)能否成功在哺乳动物细胞中抑制rna病毒sars-cov-2报告质粒的表 达,我们合成了一个编码a.fulgidus fen1蛋白(1011bp,336个氨基酸,35kda)的基 因,并在c端连接了一个nes以保证其在细胞质中进行最佳表达获得fen1-nes质粒 1.。
59.然后构建sars-cov-2报告质粒:首先采用限制性内切酶hindiii和kpni进行酶 切,将pegfp-n1质粒线性化,其次通过pcr扩增得到含有n蛋白序列的dna片段并 用限制性内切酶hindiii和kpni酶切得到具有粘性末端的dna片段(引物分别为n
‑ꢀ
cov-f-hindiii和n-cov-r-kpni),最后通过t4 dna连接酶将线性化载体与含有n蛋 白序列的dna片段进行酶连,得到sars-cov-2报告质粒(该报告质粒的靶标核苷酸序 列如seq id no.3所示)。
60.如图2-b所示,将sars-cov-2报告质粒与fen1-nes质粒
1.和hpdna转染到 a549细胞中,然后利用流式细胞仪检测egfp报告基因表达水平,real-time qpcr检测 cov-n片段表达量(引物分别为cov-n-f/r,内参基因为gapdh,引物为gapdh
‑ꢀ
f/r)。
61.结果如图2-c、d和e所示,相较于转染无关探针(nt)对照组,转染hp-cov-1、 hp-cov-2、hp-cov-3和hp-cov-4实验组中egfp报告基因表达量分别下调了52%、 54%、51%和45%。hp-cov-1、hp-cov-2、hp-cov-3、hp-cov-4组egfp阳性细胞比 例相较于对照组的
25.5%则分别下降至8.18%、8.24%、8.72%和10.8%。另外,在共同转 染hp-cov-1、hp-cov-2、hp-cov-3和hp-cov-4的混合物的实验组中,cov-n片段表 达量较对照组下降了39%。这些结果与egfp报告基因表达水平一致。
[0062][0063][0064]
seq id no.1
[0065]
atgggtgcggatattggtgacctctttgagagggaagaggtcgagcttgagtacttctcaggaaagaaaattgc cgttgatgctttcaacacgctataccagttcatctcgataataaggcagcctgacggtacgccgttaaaggact cacagggcagaatcacctctcacctttccggaatcctatacagagtctccaacatggtcgaggtgggaatcagg ccggtgtttgtattcgacggagagccaccggagttcaagaaggctgaaattgaggagaggaaaaagagaagggc tgaggcagaggagatgtggattgcggctttgcaggcaggagataaggacgcgaaaaagtatgctcaggctgcag ggagggttgacgagtacattgttgactccgcaaagacgcttttaagttacatggggattccctttgtcgatgcc ccgtctgaaggagaggcgcaggctgcttacatggcagcaaaaggcgatgtggagtacacaggaagccaggatta cgattctctgctcttcggaagcccgagactcgccagaaatctcgcaataacgggaaaaaggaagcttcccggca aaaatgtctatgtggatgtaaagccggagataataattctggaaagcaacctcaaaaggctgggtttgacgagg gagcagctcatcgacatagcgattctggtcgggacggactacaatgagggtgtgaagggtgtcggcgtcaagaa ggctttgaactacatcaagacctacggagatattttcagggcactcaaggctctgaaagtaaatattgaccacg tagaggagataaggaatttcttcctgaatcctcctgtgactgacgactacagaatagagttcagggagcctgac tttgagaaggccatcgagttcctgtgcgaggagcacgacttcagcagggagagggtcgagaaggccttggagaa gctcaaagctctgaagtcaacccaggccacgcttgagaggtggttctga
[0066]
seq id no.2
[0067]
mgadigdlfereeveleyfsgkkiavdafntlyqfisiirqpdgtplkdsqgritshlsgilyrvsnmvevgir pvfvfdgeppefkkaeieerkkrraeaeemwiaalqagdkdakkyaqaagrvdeyivdsaktllsymgipfvda psegeaqaaymaakgdveytgsqdydsllfgsprlarnlaitgkrklpgknvyvdvkpeiiilesnlkrlgltr eqlidiailvgtdynegvkgvgvkkalnyiktygdifralkalkvnidhveeirnfflnppvtddyriefrepd fekaieflceehdfsrervekaleklkalkstqatlerwf-[0068]
seq id no.3
[0069]
atgtctgataatggaccccaaaatcagcgaaatgcaccccgcattacgtttggtggaccctcagattcaactgg cagtaaccagaatggagaacgcagtggggcgcgatcaaaacaacgtcggccccaaggtttacccaataatactg cgtcttggttcaccgctctcactcaacatggcaaggaagaccttaaattccctcgaggacaaggcgttccaatt aacaccaatagcagtccagatgaccaaattggctactaccgaagagctaccagacgaattcgtggtggtga
cgg taaaatgaag
[0070]
实施例2 antiv-sgn能够在哺乳细胞中抑制hbv报告质粒的表达水平
[0071]
为了验证antiv-sgn能否成功在哺乳动物细胞中抑制dna病毒hbv报告质粒的表 达,我们合成了一个编码a.fulgidus fen1蛋白(1011bp,336个氨基酸,35kda)的基 因,并在n端连接了一个nls以保证其在细胞核中进行最佳表达nls-fen1质粒
1.。
[0072]
然后将构建hbv报告质粒,首先采用限制性内切酶hindiii和kpni进行酶切,将 pegfp-n1质粒线性化,其次通过pcr扩增得到含有x蛋白序列的dna片段并用限制 性内切酶hindiii和kpni酶切得到具有粘性末端的dna片段(引物分别为hbx-f
‑ꢀ
hindiii和hbx-r-kpni),最后通过t4 dna连接酶将线性化载体与含有x蛋白序列的 dna片段进行酶连,得到hbv报告质粒(该报告质粒的靶标核苷酸序列如seq id no.4 所示)。并设计了三对靶向x蛋白基因序列的探针如图3-a(hp-hbx-1-l/r、hp-hbx-2
‑ꢀ
l/r、hp-hbx-3-l/r),如图3-b所示,将这hbv报告质粒和nls-fen1质粒
1.和 hpdna转染到hepg2细胞中,然后利用流式细胞仪检测egfp报告基因表达水平,real
‑ꢀ
time qpcr检测hbv-x片段表达量(引物分别为hbx-f/r,内参基因为gapdh,引物为 gapdh-f/r)。
[0073]
结果如图3-c和d所示,相对于转染无关探针(nt)的对照组,转染了hp-hbx-1
‑ꢀ
l/r、hp-hbx-2-l/r和hp-hbx-3-l/r的实验组中egfp报告基因表达水平分别下调 43%、56%和66%。hbv-x片段表达量较对照组分别降低了36%、27%和29%。
[0074][0075]
seq id no.4
[0076]
atggctcgggtgtgctgccaactggatcctgcgcgggacgtcctttgtctacgtcccgtcggcgctgaatcccg cggacgacccgtctcggggccgtttgggcctctaccgtcccttgctttctctgccgttccagccgaccacgggg cgcacctctctttacgcggtctccccgtctgtgccttctcatctgccggaccgtgtgcacttcgcttcacctct gcacgtcgcatggagaccaccgtgaacggccaccaggtcttgcccaagctcttacataagaggactcttggact ctcagcaatg
[0077]
实施例3 antiv-sgn与现有基因编辑工具rnai和crispr的比较
[0078]
crispr系统与rnai都是目前较为广泛应用于基因编辑技术。其中crispr系统由 于cas蛋白体积比较大(1367个氨基酸~422个氨基酸)一直存在体内递送不方便的问 题,尽管最近一些研究报道了rna靶向cas9(rcas9)可用于以编辑rna,但是,在具 体研究中,
cas9通常被用来编辑dna病毒,cas13通常被用来编辑rna病毒。而 antiv-sgn系统在针对不同病毒的不同亚型时,只需要改变hpdnas的引导序列(20
‑ꢀ
nt),不需要改变蛋白,使antiv-sgn成为传统抗病毒药物低成本和时间的理想补充。
[0079]
为了证明antiv-sgn系统的优势,我们首先在hek293、a549和hepg2细胞中对 比了其与crispr-cas13、sirna的差异,我们在实施例1中的sars-cov-2报告质粒上 随机选取了三个不同的靶位点(t1,t2,t3),并根据靶位点设计相应的hpdna(hp
‑ꢀ
cov-t1,hp-cov-t2,hp-cov-t3),sirna(sirna-cov-t1,sirna-cov-t2,sirna
‑ꢀ
cov-t3)和crrna(crrna-cov-t1,crrna-cov-t2,crrna-cov-t3)。分别将 sars-cov-2报告质粒和fen1-nes质粒、cas13共转染,60小时后转染探针,24小时 后收取细胞提取总rna,利用real-time qpcr检测编辑效率(引物分别为cov-n-f/r,内 参基因为gapdh,引物为gapdh-f/r)。结果如图4-a所示,antiv-sgn在a549细 胞中的t2位点抑制率为24.4%,在hepg2细胞中的t2/t3位点抑制率分别为23.7%和 49.2%,表现优于crispr-cas13和sirna。cas13在hek293a细胞t1位点抑制率为 89.9%、在hepg2细胞t3位点抑制率为49.2%和在a549细胞t1/t3位点23.0%抑制率和 37.0%抑制率,表现最优。rnai在hek293a细胞中的t2/t3位点达到31.6%和20.3%的 抑制率,表现最优。
[0080]
接下来我们又在hek293a和hepg2细胞中对比了antiv-sgn与crispr-cas13、 sirna的差异。选取实施例2中的hbv报告质粒上的一个随机位点,设计相对应的 hpdna(hp-hbx-t-l/r),sirna(sirna-hbx-t)和crrna(crrna-hbx-t)。利用 real-time qpcr检测编辑效率(引物分别为hbx-f/r,内参基因为gapdh,引物为 gapdh-f/r)结果如图4-b所示,crispr-cas9在hek293a和hepg2细胞中效率分别 为37%和61%。antiv-sgn在该位点的效率分别为28%和39%。与antiv-sgn相比, rnai在hepg2细胞中编辑效率很差。
[0081]
antiv-sgn与rnai和crispr的编辑能力差异可能是由于不同靶点的序列、细胞系 的特征和递送效率不同而导致。对于antiv-sgn系统来说,fen1蛋白的小尺寸(336个 氨基酸,35kda)更有利于体内递送,没有靶序列限制(pam或pfs序列)使其拥有更 大的使用范围,在某些情况下这些优点是更有利于实际应用的。综上,antiv-sgn是可 以成为其他两种经典方法(rnai和crispr-cas13)的替代补充选择。
[0082]
[0083][0084]
实施例4 antiv-sgn在哺乳细胞中具有抑制sars-cov-2的增殖
[0085]
为了验证antiv-sgn作为可编程抗病毒平台的潜力,我们选择了ssrna病毒sars
‑ꢀ
cov-2作为测试对象。如图5-a所示,首先在vero细胞中转染fen1-nes质粒,48小时 后,分别用moi为0.008与0.016的sars-cov-2接种细胞,1小时后撤掉病毒,24小 时后转染一组靶向sars-cov-2基因组rna的hpdna探针(hp-cov-1,hp-cov-2, hp-cov-3,hp-cov-4)。24小时后,收集来自细胞上清液的病毒rna(vrna)进行绝对 定量qpcr(引物分别为sars-cov-2-n-f/r,taqman探针为sars-cov-2-n-p)以检测 vrna水平,进而检测antiv-sgn系统的抗病毒能力。
[0086]
结果如图5-b所示,在moi为0.008的情况下,感染病毒48小时后,转染探针的实 验组(pool)与仅感染病毒的对照组(virus only)和转染无关探针(nt)的对照组相 比,上清液中的病毒水平分别下降了60%和44%。在moi为0.016的情况下,转染探针 的实验组(pool)与仅感染病毒的对照组(virus only)和转染无关探针(nt)的对照组 相比,上清液中的病毒水平分别下降了42%和39%。表明antiv-sgn可以在24小时内 抑制vero细胞中约50%的sars-cov-2的复制。
[0087][0088]
实施例5 antiv-sgn不会诱导sars-cov-2靶标位置的突变
[0089]
众所周知,病毒的dna和rna在体内会不断的进化使其编码序列发生突变以逃避 基于核酸的抗病毒药物。靶位点突变会降低许多抗病毒方法的效力,因此,我们需要检 测在antiv-sgn作用后,sars-cov-2的编码序列是否发生突变以逃避被识别捕获。为 了解决这个问题,我们收集细胞上清液中的sars-cov-2提取rna进行测序。结果如图 6所示,在我们挑选的40个测序样本中,靶位点处的序列均未发生突变。说明antiv
‑ꢀ
sgn并不会诱导病
毒编码序列突变从而发生逃逸。
[0090]
实施例6 antiv-sgn在人类细胞中具有很强的抗病毒作用
[0091]
为了验证antiv-sgn能否作用于dna病毒,如图7-a所示,我们选取hepg2.2.15 细胞作为研究对象,它能够稳定表达hbv病毒,是一个较为理想的细胞模型。首先根据 hbv基因组上的不同保守区域设计三对不同的探针如图7-b(hp-cccdna-1-l/r,hp
‑ꢀ
cccdna-2-l/r,hp-cccdna-3-l/r),使这三对探针能尽可能的覆盖更多的hbv基因型 已达到可以具备对抗多种不同亚型hbv病毒的能力。接下来将nls-fen1质粒转染入 hepg2.2.15细胞,60小时转染探针混合物,24小时后提取了细胞核中的cccdna,进行 绝对qpcr定量分析效率(引物分别为cccdna-f/r,taqman探针为cccdna-p)。结果 如图7-c所示,转染靶向探针的实验组与转染fen1编码质粒和无关探针hpdna的对 照组和未经过任何处理hepg2.2.15的对照组相比,cccdna的含量分别下降了90.4%和 96.4%。
[0092]
由于hbv病毒的cccdna会被整合入细胞的基因组,从而使得宿主终生带毒,而 antiv-sgn系统相较于crispr系统而言在进行基因编辑时更倾向于产生大片段缺失, 于是我们为了验证antiv-sgn系统能否清除整合入基因组的hbv,从而达到一劳永逸的 目的。因此如图7-d所示,我们提取了转入nls-fen1与靶标探针的hepg2.2.15细胞的 总基因组,利用胶层析法分离去除了总基因组中的cccdna,利用real-time qpcr定量, 分析清除效率。结果如图所示,antiv-sgn系统可以清除约25%的hepg2.2.15细胞中整 合的基因组。同时,我们也提取这些细胞的总rna,进行real-time qpcr检测hbvmrna的含量(引物分别为hbs-f/r,内参基因为gapdh,引物分别为gapdh
‑ꢀ
f/r),与上述结果相对应的是,图7-e所示,与转染无关探针(nt)的对照组相比,转 染了nls-fen与hpdna组的mrna水平下调了25%。
[0093]
上述结果表明,用antiv-sgn靶向hbv的多个保守区域可以抑制病毒转录、消除 cccdna和消除整合的hbv dna。
[0094][0095]
实施例7 antiv-sgn能够抑制急性肝炎模型中hbv的表达
[0096]
为了考察antiv-sgn系统能否在肝原代细胞中正常发挥作用,我们计划在小鼠体内 验证antiv-sgn对hbv的抗病毒能力。如图8-a,我们选取了4~6周龄的雄性c57bl/6 小鼠,利用水动力注射法通过尾静脉向小鼠体内递送hbv报告质粒以及nls-fen1和 fen1-nes
质粒和靶向不同保守区域的hpdna如图8-b(hp-hbv-1-l/r,hp-hbv-2-l/r,hp-hbv-3-l/r,hp-hbv-4-l/r),并在第1/2/3/4/5天时,取出小鼠肝脏提取mrna利用real-timeqpcr(引物分别为hbs-f/r,内参基因为gapdh,引物分别为gapdh-f/r)检测hbv质粒表达情况,以及眼球取血,检测小鼠血清中hbsag的含量来验证antiv-sgn系统的抗病毒能力。结果如图8-c和d所示,与对照组相比,antiv-sgn系统对hbv的抑制表现出一个逐渐抑制的状态,在第二天与第三天时,hbv的mrna水平下降了90%,与之相对应的,小鼠血清中的hbsag的含量在指定时间点下降至几乎检测不到。这个结果证明了antiv-sgn系统能够在动物体内显著性抑制hbv的表达。
[0097]
另外为了考察antiv-sgn系统的表达对小鼠的生长有没有产生毒副作用,我们在水动力注射后的每一天都会称量小鼠的体重,并且在1/2/3/4/5天时分别取出了小鼠的心脏,脾脏,肺脏和肾脏做组织切片的h&e染色。结果如图8-e和f所示,fen1的表达并未对其他器官的细胞产生明显毒性,且小鼠的体重也未出现明显的下降,综上,antiv-sgn系统在体内拥有很强的抗病毒能力,并伴随着很低的毒副作用,是一种理想的抗病毒候选药物。
[0098][0099]
参考文献
[0100]
1.tian,k.,guo,y.j.,zou,b.j.,wang,l.,zhang,y.,qi,z.,zhou,j.y.,wang,x.t.,zhou,g.h.,wei,l.b.etal.(2020)dnaandrnaeditingwithoutsequencelimitationusingtheflapendonuclease1guidedbyhairpindnaprobes.nucleicacidsres,48.
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。