5-甲基-1-苯基-2-(1h)-吡啶酮颗粒制剂和其制备方法
1.本技术是国际申请日为2017年3月27日的发明名称为“5-甲基-1-苯基-2-(1h)-吡啶酮颗粒制剂和其制备方法”的pct/us2017/024280号发明专利申请的分案申请,原申请进入中国国家阶段获得的国家申请号为201780019644.7。
技术领域
2.本公开涉及吡非尼酮的颗粒制剂和制备吡非尼酮的颗粒制剂的方法。
背景技术:
3.5-甲基-1-苯基-2-(1h)-吡啶酮(也称为吡非尼酮)是非肽合成分子,分子量为185.23道尔顿。其化学元素表示为c
12h11
no,并且其结构是已知的。吡非尼酮通过以下方式具有抗纤维化特性:降低的tnf-α表达,降低的pdgf表达和降低的胶原蛋白表达。
4.已知吡非尼酮的一个重要用途是为患有纤维化病症的患者提供治疗益处,如赫曼斯基-普德拉克综合症(hps)相关的肺纤维化和特发性肺纤维化(ipf)。吡非尼酮具有预防或去除与包含肺、皮肤、关节、肾、前列腺和肝脏的受损组织相关的纤维化中发现的过多瘢痕组织的药理学能力。已发表和未发表的基础和临床研究表明,吡非尼酮可以安全减缓或抑制纤维化病变的进行性增大,消除已存在的纤维化病变,并防止组织损伤后形成新的纤维化病变。
5.应理解,吡非尼酮发挥其治疗作用的一种机制是调节细胞因子作用。吡非尼酮是纤维化细胞因子和tnf-α的有效抑制剂。已充分证明吡非尼酮抑制过量的生物合成或释放各种纤维化细胞因子,如tgf-β 1、bfgf、pdgf和egf。zhang s等人,澳大利亚和新英格兰眼科杂志(australian and new england journal ophtha]mology),第26卷;第s74页到s76页,1998年。实验报告还显示吡非尼酮阻断巨噬细胞和其它细胞中过量tnf-α的合成和释放。cain等人,国际免疫药理学杂志(internationaljournal immunopharmacology),第20卷:第685页到695页(1998年)。
技术实现要素:
6.根据本公开的实施例,一种吡非尼酮的颗粒制剂可以包含吡非尼酮和助流剂的颗粒以及任选地与颗粒混合的一种或多种额外的药学上可接受的赋形剂。
7.根据本公开的实施例,制备5-甲基-1-苯基-2-(1h)-吡啶酮的颗粒制剂的方法可以包含在流化床制粒机中混合5-甲基-1-苯基-2-(1h)-吡啶酮和颗粒内赋形剂以形成颗粒,其中颗粒包括助流剂;以及任选地向颗粒中添加一种或多种颗粒外赋形剂以形成颗粒制剂。
8.在任何前述实施例中,助流剂可以按制剂的总重量计至少1重量%的量包含在颗粒内。
9.在任何前述实施例中,制剂可以包含颗粒内助流剂和颗粒外崩解剂。
10.在任何前述实施例中,制剂可以包含具有吡非尼酮、填充剂、粘合剂和助流剂的颗
粒。在一些实施例中,制剂可以进一步包含崩解剂、润滑剂和另外的助流剂作为添加到颗粒的颗粒外组分。
11.根据本公开的实施例,片剂可以包括本文公开的任何前述实施例或实施例的制剂。根据本公开的其它实施例,片剂可以由本文公开的任何前述实施例或实施例的制剂组成。根据本公开的其它实施例,片剂可以基本上由本文公开的任何前述实施例或实施例的制剂组成。
附图说明
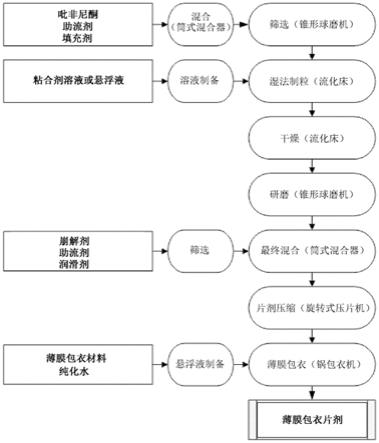
12.图1是根据本公开的实施例的形成颗粒制剂和薄膜包衣片剂的方法的示意图;
13.图2a是处理不含颗粒内助流剂的制剂后的制粒机碗的照片;
14.图2b是根据本公开的实施例的处理具有颗粒内助流剂的制剂后的制粒机碗的照片;
15.图3是示出从两种不同源,源1和源2,供应的吡非尼酮的粒度分布差异的图示;
16.图4a是从源2供应的吡非尼酮的扫描电子显微镜图像;
17.图4b是从源1提供的吡非尼酮的扫描电子显微镜图像;
18.图5是示出根据本公开的实施例的制剂的崩解时间和片剂核心固体分数之间的相关性的图示;
19.图6是示出根据本公开的实施例的制剂的三个剂量强度的崩解时间和片剂核心厚度之间的相关性的图示;
20.图7是示出根据本公开的实施例的压缩压力对压缩剂型的拉伸强度的影响的图示;
21.图8是示出根据本公开的实施例的固体分数百分比对压缩剂型的拉伸强度的影响的图示;
22.图9是在900ml hcl 0.1n、乙酸盐ph 4.5或磷酸盐ph 6.8中溶出267mg市售吡非尼酮胶囊时作为时间的函数的溶出的药物物质百分比的图不;
23.图10是根据本公开的实施例的溶出吡非尼酮片剂时作为时间的函数的溶出的药物物质百分比的图示,所述吡非尼酮片剂在900ml hcl 0.1n中具有267mg、534mg和801mg的剂量强度;
24.图11是根据本公开的实施例的溶出吡非尼酮片剂时作为时间的函数的溶出的药物物质百分比的图示,所述吡非尼酮片剂在ph 4.5的900ml乙酸盐中具有267mg、534mg和801mg的剂量强度;
25.图12是根据本公开的实施例的溶出吡非尼酮片剂时作为时间的函数的溶出的药物物质百分比的图示,所述吡非尼酮片剂在ph 6.8的900ml磷酸盐中具有267mg、534mg和801mg的剂量强度;
26.图13是根据本公开的实施例的溶出吡非尼酮片剂时作为时间的函数的溶出的药物物质百分比的图示,所述吡非尼酮片剂在900ml蒸馏水中具有267mg、534mg和801mg的剂量强度;
27.图14是根据本公开的实施例的在1000ml蒸馏水中溶出267mg吡非尼酮片剂时作为时间的函数的溶出的药物物质百分比的图示;
28.图15是根据本公开的实施例的在1000ml蒸馏水中溶出534mg吡非尼酮片剂时作为时间的函数的溶出的药物物质百分比的图示;
29.图16是根据本公开的实施例的在1000ml蒸馏水中溶出801mg吡非尼酮片剂时作为时间的函数的溶出的药物物质百分比的图示;
30.图17是根据本公开的实施例的在900ml hcl 0.1n、乙酸盐ph 4.5或磷酸盐ph 6.8中溶出267mg吡非尼酮片剂时作为时间的函数的溶出的药物物质百分比的图示;
31.图18是根据本公开的实施例的在900ml hcl 0.1n、乙酸盐ph 4.5或磷酸盐ph 6.8中溶出534mg吡非尼酮片剂时作为时间的函数的溶出的药物物质百分比的图示;
32.图19是根据本公开的实施例的在900ml hcl 0.1n、乙酸盐ph 4.5或磷酸盐ph 6.8中溶出801mg吡非尼酮片剂时作为时间的函数的溶出的药物物质百分比的图示;
33.图20是根据本公开的实施例的溶出801mg吡非尼酮片剂时作为时间的函数的溶出的药物物质百分比的图示,示出了压缩压力和药物物质粒度对溶出的影响;
34.图21是根据本公开的实施例的溶出534mg吡非尼酮片剂时作为时间的函数的溶出的药物物质百分比的图示,示出了压缩力对早期溶出的影响;并且
35.图22是根据本公开的实施例的溶出267mg吡非尼酮片剂时作为时间的函数的溶出的药物物质百分比的图示,示出了压缩力对早期溶出的影响。
具体实施方式
36.吡非尼酮胶囊以商品名商业可得,并且作为大小#1267mg的胶囊被提供。对于许多治疗方案,包含例如治疗特发性肺纤维化,通常开出每天三次801mg的剂量,需要患者每天服用9粒胶囊。对于一些患者,片剂制剂可以代表更加患者友好和顺应的方案。例如,根据本公开的实施例,片剂可以包含801mg吡非尼酮,允许施用一片,一天三次或总共三片。根据本公开的实施例的片剂可以包含100mg至1200mg的吡非尼酮。例如,根据本公开的实施例,对于单位剂量,剂量强度可以是200mg、267mg、534mg、600mg或801mg吡非尼酮。剂量强度的变化可以使患者给药变得容易,例如,当剂量滴定时。根据本公开的实施例的片剂可以是薄膜包衣的。薄膜包衣可以着色,例如,以区分不同的剂量强度。
37.鉴于剂量要求,吡非尼酮的口服剂型,特别是片剂,通常需要高浓度的吡非尼酮,以提供口服给药的可控制大小的片剂大小。然而,作为活性成分的吡非尼酮具有差的粉末流动性特征,例如用于制剂加工。鉴于剂型中所需的高浓度活性成分,赋形剂几乎没有空间来帮助改善吡非尼酮粉末的流动性和可加工性。通常,制剂方法将使用更高浓度的赋形剂,特别是难以加工的活性成分。然而,在需要高浓度活性物质的情况下,不能使用这种常规制剂技术。已经发现,本文公开的制剂提供了在制粒过程中表现出良好流动性的制剂,能够在标准压缩条件下压制成片剂,并产生抗裂的稳定片剂,同时保持所需的溶出性质。
38.吡非尼酮是一种高度结晶,不吸湿的固体,熔点范围在106℃至112℃之间。已经发现吡非尼酮的粒度可以根据供应商而变化。参考图3,例如,发现来自两个不同供应商(源1和源2)的吡非尼酮具有不同的粒度分布。特别地,发现来自来源1的吡非尼酮具有50μm到64μm之间的d90粒度,而发现源2供应的吡非尼酮具有114μm到151μm之间的d90粒度。图4a和图4b是扫描电子显微镜图像,其进一步示出用不同来源的吡非尼酮观察到的粒度差异。如图4a和图4b所示,吡非尼酮由不规则形状的初级颗粒组成。初级颗粒的形状在两个源之间是
相当的。发现较小的初级颗粒具有形成附聚物的趋势。与源2相比,源1中发现较高水平的附聚物,并且在一些源1源药物物质中,发现较大尺寸的附聚物。
39.发现药物物质的粒度变化影响由颗粒制剂形成的片剂的硬度(拉伸强度)。然而,令人惊讶地发现,根据本公开的片剂的固体分数而非拉伸强度影响药物释放特性。因此,确定控制固体分数的片剂厚度可用作片剂压缩步骤中的参数而不是片剂硬度,以确保所需的药物释放特性。图5和图6分别示出了根据本公开的实施例的片剂的崩解时间与固体分数和片剂厚度之间的相关性。
40.已经进一步发现,形成吡非尼酮颗粒并将这些制剂压制成片剂的方法可以使得到的片剂的性质对活性成分的粒度变化和通过如高剪切混合方法等各种湿法制粒方法制备的制剂的水含量敏感。令人惊讶的是,使用流化床制粒方法处理根据本公开的实施例的吡非尼酮制剂可以允许某种制剂方法,所述制剂方法对颗粒的水分含量明显不太敏感并且可以适应活性成分的粒度变化。如下面详细讨论的,形成根据本公开的实施例的颗粒制剂的方法还可以允许随后形成没有微裂纹并且具有足够硬度的片剂,不管药物的可能发生的例如从供应商到供应商的粒度变化。这可以有利地提供更稳健的商业规模工艺,其可以适应粒度的变化而无需改变片剂制造工艺或片剂压缩条件。
41.根据本公开的实施例,颗粒制剂可以包含颗粒,所述颗粒包含吡非尼酮和一种或多种药学上可接受的赋形剂。如本文所用,“颗粒内组分”是指颗粒中包含的成分。除颗粒外,颗粒制剂还可以包括一种或多种赋予颗粒的赋形剂作为颗粒外组分。如本文所用,“颗粒外组分”是指添加到刚形成的颗粒中的成分。在各种实施例中,制剂可以包含作为颗粒内组分吡非尼酮和助流剂。已经发现,在颗粒中包含制剂的按重量至少约1%的量的助流剂有利地改善了颗粒和颗粒制剂的流动性和可加工性。在各种实施例中,制剂包含有效量的颗粒内助流剂以改善粉末和/或颗粒流动特性,例如,通过约4到约20、约5到约15或约10到约14的流函数系数测量。在各种实施例中,预制粒粉末,颗粒和/或颗粒制剂可以具有约4、约5、约6、约7、约8、约9、约10、约11、约12、约13、约14、约15、约16、约17、约18、约19或约20的流函数系数。
42.通常,助流剂仅在颗粒外使用以改善压片机中形成的颗粒的流动,但通常不用于或预期改善制粒过程中药物物质的流动。然而,有利且令人惊讶地发现,使用具有吡非尼酮的当前制剂中的颗粒内助流剂可以改善粉末形式的颗粒内组分的流动,改善颗粒的加工和流动,并且在如压片过程等压缩期间添加或不添加颗粒外组分的情况下改善颗粒的流动。在一些实施例中,本公开的制剂可以被压缩,例如压片,而不需要添加助流剂作为颗粒外组分。
43.参考图2a和图2b,测试了具有和不具有助流剂的制剂。使用将粘合剂喷射到混合物上的湿法制粒法在制粒机碗中将吡非尼酮、填充剂和助流剂的粉末混合物制粒。观察到当颗粒含有颗粒内助流剂时,减少量的颗粒和残留粉末粘附在制粒机碗的侧面(图2b)。如图2a所示,没有颗粒内助流剂,观察到颗粒粘附在碗的侧面,并且大量残留的粉末仍粘附在制粒机碗上,这表明制剂的内聚性质。
44.在一些实施例中可以包含额外的赋形剂。赋形剂的实例包含粘合剂、填充剂、崩解剂、润滑剂和另外的助流剂,其可以作为颗粒内和/或颗粒外组分提供。例如,在实施例中,制剂包含作为颗粒内组分的吡非尼酮、填充剂、粘合剂和助流剂,以及作为颗粒外组分的崩
解剂、润滑剂和另外的助流剂。
45.对于包含包衣的剂型,如薄膜包衣片剂,除非另有说明,否则本文所用制剂中吡非尼酮或赋形剂的重量百分比(w/w%)是指按核心(例如,片剂核心)的总重量计的重量并且不包含任何重量的外部包衣。
46.按制剂总重量计,制剂可以包含约60wt%到95wt%的吡非尼酮。其它合适的量包含约70wt%到约95wt%、约65wt%到约90wt%、约80wt%到约95wt%。例如,制剂可以包含吡非尼酮,其量为按制剂总重量计的约60wt%、约62wt%、约64wt%、约66wt%、约68wt%、约70wt%、约72wt%、约74wt%、约76wt%、约78wt%、约80wt%、约82wt%、约84wt%、约86wt%、约88wt%、约90wt%、约92wt%、约94wt%和约95wt%。根据本公开的实施例,单位剂量可以提供有剂量范围在约100mg到约1100mg的吡非尼酮。例如,剂量强度可以包含200mg、267mg、534mg、600mg和801mg吡非尼酮。在替代性实施例中,剂量强度可以包含266mg、268mg、533mg、535mg和800mg吡非尼酮。在实施例中,单位剂量是压缩剂型,例如片剂。
47.根据本公开的实施例,吡非尼酮的制剂可以包含选自由粘合剂、崩解剂、助流剂、润滑剂和填充剂组成的组的一种或多种赋形剂。常规用作粘合剂、填充剂、助流剂、润滑剂和填充剂的赋形剂可用于本公开的制剂中。以下提供合适的赋形剂的实例列表。
48.粘合剂可以选自由以下组成的组:羟甲基纤维素、羟丙基纤维素、聚乙烯吡咯烷酮、碳酸钙、磷酸二钙、卡波姆、醋酸邻苯二甲酸纤维素、共聚维酮、羟丙基甲基纤维素、乙二醇和乙烯基二醇接枝共聚物、异麦芽酮糖醇、泊洛沙姆、聚环氧乙烷、聚甲基丙烯酸酯和其组合。
49.粘合剂的含量可以在以下范围内:按制剂总重量计的约1wt%到约10wt%、约2wt%到约10wt%、约2wt%到约5wt%、约4wt%到约8wt%、约3wt%到约7wt%以及约3wt%到约5wt%。粘合剂的其它合适量包含按制剂总重量计的约1wt%、约1.5wt%、约2wt%、约2.5wt%、约3wt%、约3.5wt%、约4wt%、约4.5wt%、约5wt%、约5.5wt%、约6wt%、约6.5wt%、约7wt%、约7.5wt%、约8wt%、约8.5wt%、约9wt%、约9.5wt%和约10wt%。已经有利地发现,粘合剂的量大于4wt%可以改善压片过程中的颗粒流动性和压实行为。发现粘合剂量的范围为约3.9wt%到约4.8wt%改善了颗粒的压实行为,而对制剂的溶出和崩解特性没有显著影响。设想粘合剂量用于任何合适的粘合剂,包含聚乙烯吡咯烷酮。
50.崩解剂可以选自由以下组成的组:琼脂、褐藻胶、碳酸钙、羧甲基纤维素和其盐、纤维素、粘土、玉米淀粉、交联羧甲基纤维素钠、交聚维酮、树胶、甲基纤维素、波拉克林钾、海藻酸钠、交联聚乙烯吡咯烷酮、羟乙酸淀粉钠、淀粉和其组合。在各种实施例中,崩解剂可以在颗粒制剂内(颗粒内)和颗粒外制剂中提供。替代性地,崩解剂可以仅包含在颗粒内或仅包含在颗粒外。
51.崩解剂的含量可以在以下范围内:按制剂总重量计的约0wt%到约10wt%、约0wt%到约10wt%、约1wt%到约10wt%、约2wt%到约10wt%、约2wt%到约5wt%、约4wt%到约8wt%、约3wt%到约7wt%以及约3wt%到约5wt%。崩解剂的其它合适量包含约0wt%、约0.5wt%、约1wt%、约1.5wt%、约2wt%、约2.5wt%、约3wt%、约3.5wt%、约4wt%、约4.5wt%、约5wt%、约5.5wt%、约6wt%、约6.5wt%、约7wt%、约7.5wt%、约8wt%、约8.5wt%、约9wt%、约9.5wt%和约10wt%。
52.润滑剂可以选自由以下组成的组:琼脂、硬脂酸钙、油酸乙酯、月桂酸乙酯、甘油、山嵛酸甘油酯、硬脂酸棕榈酸甘油酯、氢化植物油、氧化镁、硬脂酸镁、甘露醇、泊洛沙姆、二醇、苯甲酸钠、月桂基硫酸钠、硬脂酸硬脂酸钠、山梨糖醇、硬脂酸、滑石、硬脂酸锌和其组合。
53.润滑剂的含量可以在以下范围内:按制剂总重量计的约0.05wt%到约2wt%、约0.1wt%到约1.8wt%、约0.5wt%到约1.5wt%、约1wt%到约2wt%、约0.05wt%到约0.5wt%、约0.1wt%到约0.8wt%或约0.2wt%到约0.6wt%。润滑剂的其它合适量包含按制剂总重量计的约0.05wt%、约0.06wt%、约0.07wt%、约0.08wt%、约0.1wt%、约0.2wt%、约0.3wt%、约0.4wt%、约0.5wt%、约0.6wt%、约0.7wt%、约0.8wt%、约0.9wt%、约1wt%、约1.2wt%、约1.4wt%、约1.6wt%、约1.8wt%和约2wt%。
54.填充剂可以选自由以下组成的组:碳酸钙、磷酸钙、磷酸氢钙、硅酸钙、硫酸三钙、羧甲基纤维素钙和其盐、纤维素、糊精衍生物、糊精、右旋糖、果糖、异麦芽酮糖醇、高岭土、乳糖醇、乳糖、碳酸镁、氧化镁、麦芽糖醇、麦芽糖糊精、麦芽糖、甘露糖醇、微晶纤维素、碳酸氢钠、碳酸钠、山梨糖醇、淀粉、蔗糖、糖、木糖醇和其组合。
55.填充剂的含量可以在以下范围内:按制剂总重量计的约2wt%到约30wt%、约4wt%到约20wt%、约10wt%到约30wt%、约2wt%到约10wt%以及约6wt%到约15wt%。其它合适量包含按制剂总重量计的约2wt%、约3wt%、约4wt%、约5wt%、约6wt%、约7wt%、约8wt%、约9wt%、约10wt%、约11wt%、约12wt%、约13wt%、约14wt%、约15wt%、约16wt%、约17wt%、约18wt%、约19wt%、约20wt%、约21wt%、约22wt%、约23wt%、约24wt%、约25wt%、约26wt%、约27wt%、约28wt%、约29wt%和约30wt%。设想填充剂量用于任何合适的填充剂,包含微晶纤维素。
56.助流剂可以选自由以下组成的组:二氧化硅、气相二氧化硅、硅化纤维素、硬脂酸钠、硅酸镁铝、热解二氧化硅、水合硅铝酸钠、纤维素、磷酸钙、月桂基硫酸钠、预胶化淀粉、滑石和其物理或共处理组合。助流剂可以是二氧化硅,并且可以是亲水性气相二氧化硅(也称为胶体二氧化硅)。助流剂可以在颗粒内和任选地颗粒外提供。在颗粒内和颗粒外提供助流剂的实施例中,助流剂可以是相同或不同的材料。
57.助流剂在颗粒内的含量可以为按制剂总重量计的至少约1wt%、至少约1.5wt%、至少约2wt%、至少约2.5wt%、至少约3wt%、至少约3.5wt%或至少约4wt%。例如,当包含在颗粒内时,助流剂的量可以为约1wt%到约5wt%、约1.5wt%到约4.5wt%、约1.5wt%到约3.5wt%、约2wt%到约5wt%或约1wt%到约4wt%。其它合适量的颗粒内助流剂包含按制剂总重量计的约1wt%、约1.1wt%、约1.2wt%、约1.3wt%、约1.4wt%、约1.5wt%、约1.6wt%、约1.7wt%、约1.8wt%、约1.9wt%、约2wt%、约2.1wt%、约2.2wt%、约2.3wt%、约2.4wt%、约2.5wt%、约2.6wt%、约2.7wt%、约2.8wt%、约2.9wt%、约3wt%、约3.1wt%、约3.2wt%、约3.3wt%、约3.4wt%、约3.5wt%、约3.6wt%、约3.7wt%、约3.8wt%、约3.9wt%、约4wt%、约4.1wt%、约4.2wt%、约4.3wt%、约4.4wt%、约4.5wt%、约4.6wt%、约4.7wt%、约4.8wt%、约4.9wt%和约5wt%。
58.助流剂的颗粒外含量可以为约0wt%到约5wt%、约0wt%到约5wt%、约0.01wt%到约1wt%、约0.03wt%到约0.8wt%、约1wt%到约5wt%、约0.01wt%到约0.05wt%、约0.5wt%到约3wt%、约0.01wt%到约0.2wt%以及约0.05wt%到约1wt%。颗粒外助流剂的
其它合适量包含按制剂总重量计的约0wt%、约0.01wt%、约0.02wt%、约0.04wt%、约0.06wt%、约0.08wt%、约0.1wt%、约0.2wt%、约0.4wt%、约0.6wt%、约0.8wt%、约1wt%、约1.5wt%、约2wt%、约2.5wt%、约3wt%、约3.5wt%、约4wt%、约4.5wt%和约5wt%。设想助流剂量用于任何合适的助流剂,包含二氧化硅。
59.在一种类型的实施例中,颗粒外组分占压缩制剂的10wt%或更少。例如,颗粒外组分可以是10wt%或更少、10wt%或更少、8wt%或更少、7wt%或更少、6wt%或更少、5wt%或更少、4wt%或更少、3wt%或更少、2wt%或更少,或者在以下范围内:0.01wt%到10wt%、或0.01wt%到8wt%、或0.01wt%到6wt%、或0.01wt%到5wt%、或0.01wt%到4wt%、或0.01wt%到3wt%、或0.01wt%到2wt%、或0.01wt%到1wt%。
60.在各种实施例中,可将颗粒制剂压制成片剂制剂。有利地发现,根据本公开的片剂具有与固体分数相关的药物释放特性。固体分数是使用片剂核心的尺寸(压缩工具的大小和片剂的厚度),片剂重量和最终混合物的真密度(与堆积密度相反)计算的标准化工艺参数。在标准片剂压缩操作期间,对于给定的剂量强度,除片剂厚度外,限定固体分数的所有其它因素保持不变。因此,已经确定,在标准片剂压缩操作中控制片剂的厚度可以用于在片剂压缩期间靶向预定义的固体分数,其反过来可以用于靶向预定义的吡非尼酮释放特性。
61.在各种实施例中,制剂是立即释放制剂。在这种实施例中,可能需要在约15分钟内释放至少80%的药物物质。为了获得这种释放参数,压缩的单位剂量,例如片剂,可以具有至少80%的固体分数。在一些实施例中,固体分数大于80%。例如,单位剂量可以具有以下固体分数:约80%到约95%、约85%到约90%、约90%到约95%、大于约80%到约90%、约81%到约95%以及约82%到约94%。其它合适的固体分数包含80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%和95%。
62.通常,根据本公开的实施例的片剂可以具有以下厚度:约2mm到约10mm、约2mm到约8mm、约3mm到约8mm以及约5mm到约10mm。虽然崩解时间与固体分数之间的关系通常不依赖于测试的实施例中的剂量而变化,但是当使用片剂厚度作为参数时存在一些变化,如图6所示。已经发现,在具有801mg吡非尼酮的片剂厚度为约5mm到约10mm的压缩剂型中;在具有534mg吡非尼酮的片剂厚度为约3mm到约8mm的压缩剂型中;在具有267mg吡非尼酮的片剂厚度为约2mm到约8mm的压缩剂型中,可以在15分钟内实现至少约80%的药物释放。
63.参考图1,在实施例中,根据本公开的实施例的用于形成颗粒的方法可以包含使用流化床制粒将吡非尼酮与一种或多种赋形剂混合。在各种实施例中,使用流化床制粒将吡非尼酮与助流剂混合以形成颗粒。可以将一种或多种赋形剂添加到颗粒中(颗粒外)。已经有利地发现,使用流化床制粒方法不仅可以改善制剂的可加工性和吡非尼酮粒度变化的耐受性,而且还提供制粒中水分含量的改善的耐受性。例如,当使用高剪切湿法制粒方法时,观察到颗粒的可压缩性取决于水分含量,需要如通过干燥损失测量的1.5%到2.0%的水分含量以便加工成具有合适的物理特性(片剂压缩至合适的硬度值)的片剂核心。然而,根据本公开的利用流化床制粒加工的方法对水分含量较不敏感,允许水分含量小于3%,例如0%到2.9%,从而适应颗粒的变化(过度干燥和干燥不足)同时允许实现具有合适物理特性的片剂。
64.还发现用常规高剪切湿法制粒技术加工的制剂对来自吡非尼酮的不同源的吡非尼酮粒度分布的变化敏感,导致片剂具有差的硬度值并且通常在片剂中形成微裂纹。相比
之下,根据本公开的制剂和方法对吡非尼酮粒度变化和水分含量的敏感性显著较低,如下面详细讨论的。例如,可以使用流化床制粒。流化床制粒可以允许在同一容器中进行多步湿法制粒过程,例如,进行预热、制粒和干燥粉末中的一种或多种。
65.在一个实例实施例中,制备根据本公开的制剂的方法可包含将吡非尼酮和颗粒内赋形剂混合以形成颗粒。在各种实施例中,吡非尼酮可与助流剂和粘合剂或粘合剂溶液或悬浮液混合以形成颗粒。颗粒可以进一步包含与吡非尼酮和助流剂混合的填充剂。在各种实施例中,粘合剂可以作为溶液或悬浮液加入。例如,可以将粘合剂喷射到吡非尼酮和颗粒内赋形剂上。粘合剂可以例如以水溶液、水悬浮液、醇溶液、醇悬浮液或在水-醇混合物中提供,所述水-醇混合物可以是溶液或悬浮液。在一些实施例中,吡非尼酮和颗粒内赋形剂可以在添加粘合剂之前预混合。
66.可以将颗粒干燥至目标水分含量。例如,干燥可用于除去可能已经例如从粘合剂溶液或悬浮液中引入的过量水分。混合和干燥可以例如使用流化床制粒机完成。然后在一些实施例中可以筛选颗粒。例如,可以使用2mm的筛网来帮助颗粒的过筛。然后可以将干燥和任选筛选的颗粒与颗粒外组分混合。在实施例中,这可以包含将颗粒与崩解剂和/或另外量的助流剂和/或润滑剂混合。在实施例中,将颗粒与崩解剂和另外量的助流剂混合,并且然后将所得混合物与润滑剂混合。在另一个实施例中,在单个步骤中将颗粒外组分预混合并添加到颗粒中。
67.所述方法可任选地包含在添加粘合剂溶液或悬浮液之前和/或期间加热吡非尼酮和赋形剂(颗粒内)。预热可以帮助在开始喷射粘合剂时确保混合物处于流化的混合状态。
68.当向颗粒中添加多种颗粒外组分时,可以同时或连续添加。例如,在实施例中,在单个步骤中在颗粒外添加崩解剂、润滑剂和额外的助流剂。在另一个实施例中,在第一步中在颗粒外添加崩解剂和助流剂并混合,然后在第二步中添加润滑剂并进一步混合。可以使用任何合适数量的添加步骤。
69.任选地,制剂中的药物物质和赋形剂中的任何或所有可以在制粒之前预混合和/或筛选,例如,在将组分装入制粒机碗之前。(例如)在将颗粒内组分装入混合器或制粒机或将颗粒外赋形剂添加到颗粒之前,在给定阶段预混合赋形剂可以帮助确保组分的良好分布。在添加之前筛选赋形剂和/或预混合物可以在装入制粒机之前进一步帮助制剂组分过筛。
70.在各种实施例中,可以将颗粒制剂压制成压缩剂型,例如片剂。例如,可以使用以下压缩压力压制制剂:约50mpa到约500mpa、约100mpa到约400mpa、约200mpa到约300mpa、约100mpa到约170mpa以及约75mpa到约200mpa。其它合适的压缩压力包含约50mpa、约55mpa、约60mpa、约65mpa、约70mpa、约75mpa、约80mpa、约85mpa、约90mpa、约95mpa、约00mpa、约110mpa、约120mpa、约130mpa、约140mpa、约150mpa、约160mpa、约170mpa、约180mpa、约190mpa、约200mpa、约210mpa、约220mpa、约230mpa、约240mpa、约250mpa、约260mpa、约270mpa、约280mpa、约290mpa、约300mpa、约310mpa、约320mpa、约330mpa、约340mpa、约350mpa、约360mpa、约370mpa、约380mpa、约390mpa、约400mpa、约410mpa、约420mpa、约430mpa、约440mpa、约450mpa、约460mpa、约470mpa、约480mpa、约490mpa和500mpa。
71.在一些实施例中,可以在施加完全主压缩力之前在压缩过程(例如,制片剂)期间施加预压缩力一段时间。例如,可以施加主压缩力的20%到30%的预压缩力。
72.压缩力可以影响溶出早期阶段的溶出曲线,通常在最初的15分钟内的。图21和图22示出了两种剂量强度(分别为534mg片剂和267mg片剂)的早期溶出曲线的变化,其可以由改变压缩力产生。
73.在各种实施例中,压缩剂型进一步涂覆有薄膜包衣。例如,片剂可以涂覆有薄膜包衣。在一些实施例中,包衣是立即释放包衣。示例性包衣包含例如opadry ii黄色、0padry ii粉色和opadry ii紫色。例如,包衣可以用于使剂型着色以通过颜色、不同剂量来识别。在一些实施例中,包衣还可以包含光屏蔽剂,所述光屏蔽剂可以帮助维持剂型的光稳定性。可以使用涂覆压缩剂型的任何包衣和方法。包衣可以包含二氧化钛、氧化铁、滑石、聚乙二醇和聚乙烯醇中的一种或多种。可以使用任何合适的涂覆技术将包衣作为溶液施加。包衣可以着色,例如,以区分剂量强度。在各种实施例中,着色可以由彩色氧化铁提供,例如氧化铁黑、氧化铁红、氧化铁黄和其组合。在各种实施例中,包衣向制剂,例如片剂核心,添加1%到5%重量。可以使用任何合适的包衣量、包衣重量和增加的重量百分比。
74.有利地,根据本公开的实施例的制剂可以压缩成压缩剂型而不形成微裂纹并具有合适的片剂物理性质,包含拉伸强度。根据本公开的方法和制剂能够容忍药物物质的粒度差异。图3和图4示出了由两个不同供应商提供的药物物质吡非尼酮的粒度分布的差异。如实例中详细所示,制剂的可压片性和可压实性可受粒度差异的影响。本文中公开的例如使用流化床制粒的制剂以及制备此类制剂的方法可以允许形成具有合适物理特性的压缩剂型,尽管药物物质的粒度可变。这可以允许商业规模的方法和制剂,所述方法和制剂可以适应药物物质,而不管供应商和粒度的任何变化。此外,虽然观察到粒度变化可能导致拉伸强度的差异,但确定这种差异不影响剂型的溶出行为,所述溶出行为相反由固体分数控制。
75.根据本公开的实施例的制剂可以包括本文公开的赋形剂的任何组合。根据本公开的实施例的制剂可以由本文公开的赋形剂的任何组合组成。根据本公开的实施例的制剂可以基本上由本文公开的赋形剂的任何组合组成。例如,根据本公开的实施例的制剂可以由以下各项组成:吡非尼酮、颗粒内助流剂、粘合剂以及任选地填充剂、崩解剂、另外的助流剂和润滑剂中的一种或多种。
76.颗粒制剂的任何前述实施例可以口服剂型提供。例如,本文公开的颗粒制剂中的任何颗粒制剂可以作为压缩剂型提供,例如片剂。片剂可以包括本文公开的赋形剂的任何组合。片剂可以由本文公开的赋形剂的任何组合组成。片剂可以基本上由本文公开的赋形剂的任何组合组成。例如,根据本公开的实施例的片剂可以由以下各项组成:吡非尼酮、颗粒内助流剂、粘合剂以及任选地填充剂、崩解剂、另外的助流剂和润滑剂中的一种或多种。
77.治疗适应症
78.本公开的一个实施例提供了治疗纤维化病状和其它细胞因子介导的病症的方法。这些方法包括向有需要的患者施用本公开的制剂。如本文所用,“需要吡非尼酮疗法”的患者是将受益于吡非尼酮给药的患者。患者可能患有吡非尼酮治疗可用于改善症状的任何疾病或病状。吡非尼酮是已知的抗纤维化剂,因此这些病症包含纤维化病症,如肺、肾、肝、心脏或其它器官的纤维化病症。将从吡非尼酮治疗中获益的其它病症包含炎性病症或自身免疫病症。然而,将从吡非尼酮治疗中受益的其它病症包含导致纤维化的疾病,或伴随纤维化是所述疾病的症状或并发症的部分原因,如梗塞(组织死亡)、感染、癌症、肝硬化等。例如,此类疾病或病状包含肺纤维化、特发性肺纤维化、闭塞性细支气管炎、慢性肺移植排斥、硬
皮病、原发性局灶节段性肾小球硬化(fsgc)或膜增生性肾小球肾炎(mpgn)、特发性间质性肺炎、系统性硬化症中的间质性肺病、肺纤维化病、自身免疫性肺病、良性前列腺肥大、冠状动脉或心肌梗死、心房颤动、脑梗塞、心肌纤维化、肌肉骨骼纤维化、术后粘连、肝硬化、肾纤维化疾病、纤维化血管疾病、硬皮病、赫曼斯基-普德拉克综合症(hermansky-pudlak syndrome)、神经纤维瘤病、阿尔茨海默氏病、糖尿病性视网膜病和/或皮肤病变、与艾滋病相关的淋巴结纤维化、慢性阻塞性肺病(copd)、炎性肺纤维化、类风湿性关节炎;类风湿性脊椎炎;骨关节炎;痛风、其它关节炎病状;败血症;感染性休克;内毒素休克;革兰氏阴性败血症;中毒休克综合症;肌筋膜疼痛综合症(mps);细菌性痢疾;哮喘;成人呼吸窘迫综合症;发炎性肠病;克罗恩病;银屑病;湿疹;溃疡性结肠炎;肾小球肾炎;硬皮病;慢性甲状腺炎;格雷夫病;奥蒙德病;自身免疫性胃炎;重症肌无力;自身免疫性溶血性贫血;自身免疫性中性粒细胞减少症;血小板减少症;胰腺纤维化;慢性活动性肝炎,包含肝纤维化;急慢性肾病;肾纤维化;糖尿病肾病;肠道易激综合症;热病;再狭窄;脑疟疾;中风和缺血性损伤;神经创伤;阿尔茨海默氏病;亨廷顿氏病;帕金森病;急性和慢性疼痛;过敏,包含过敏性鼻炎和过敏性结膜炎;心肌肥厚,慢性心力衰竭;急性冠状动脉综合症;恶病质;疟疾;麻风;利什曼病;莱姆病;瑞特综合症;急性滑膜炎;肌肉变性,滑囊炎;肌腱炎;腱鞘炎;突出,破裂或脱垂的椎间盘综合症;石骨症;血栓形成;矽肺;肺水肿;骨吸收疾病,如骨质疏松症或多发性骨髓瘤相关骨病;癌症,包括但不限于转移性乳腺癌,结肠直肠癌,恶性黑素瘤,胃癌和非小细胞肺癌;移植物抗宿主反应;和自身免疫性疾病,如多发性硬化,狼疮和纤维肌痛;艾滋病和其它病毒性疾病,如带状疱疹、单纯疱疹i或ii、流感病毒、严重急性呼吸系统综合症(sars)和巨细胞病毒;和糖尿病。此外,实施例的方法可以用于治疗增生性病症(包含良性和恶性增生两者),包含急性髓性白血病、慢性髓性白血病、卡波西氏肉瘤、转移性黑素瘤、多发性骨髓瘤、乳腺癌、包含转移性乳腺癌;大肠癌;恶性黑色素瘤;胃癌;非小细胞肺癌(nsclc);骨转移等;疼痛症,包含神经肌肉疼痛,头痛,癌症疼痛,牙痛和关节炎疼痛;血管生成障碍,包含实体瘤血管生成,眼部新生血管形成和婴儿血管瘤;与环加氧酶和脂氧合酶信号通路有关的病症,包含与前列腺素内过氧化物合酶-2相关的病症(包含水肿、发热、镇痛和疼痛);器官缺氧;凝血酶诱导的血小板聚集;原生动物疾病。例如,ipf和硬皮病(或系统性硬化症)相关的间质性肺病(ssc-ild)共享重叠的病理途径,最显著的是成纤维细胞的活化和增殖、纤维化细胞因子和生长因子的表达以及进行性间质纤维化(tzouvelekis等人,2005年;castro和jimenez,2010年;collard等人,2010年;hummers,2010年;van den blink等人,2010年;richards等人,2012年;vij和noth,2012年)。ipf和ssc-ild也具有共同的生物标志物,包含ccl 18、sp-a、spd、kl 6、icam-1、vcam 1、ccl 2、ykl-40和vwp。
79.在本文所述的任何方法或用途中,患者可患有选自由以下组成的组的疾病:肺移植/慢性排斥、闭塞性细支气管炎、硬皮病、原发性局灶节段性肾小球硬化(fsgs)、膜增生性肾小球肾炎(mpgn)、肠道充气、susac综合症,慢性导管插入时微血管损伤,hamartomatous病、脊髓损伤后血脊髓屏障功能障碍、角膜穿孔、副肿瘤性疾病、横纹肌溶解症、肺毛细血管炎、慢性高同型半胱氨酸血症、额皮质下综合症、wegener肉芽肿病、急性肠道微血管功能障碍、动脉粥样硬化性疾病、角膜炎、巩膜外层炎/巩膜炎、囊性纤维化、多囊肾病、镰状细胞病、痴呆、糖尿病性溃疡、微血管病或小血管病、甲状腺功能减退症、血栓性血小板减少性紫癜、缺血再灌注损伤和溶血性尿毒症综合症。
80.在本文所述的任何方法或用途中,患者可患有选自以下各项的疾病或病症:中枢神经系统(cns)的一种或多种“自身免疫性”病症;不是阿尔茨海默氏病的痴呆;需要吡非尼酮治疗的患者;可以从吡非尼酮给药中受益的人,其任选条件是患者不患特发性肺纤维化;失神发作;获得性免疫缺陷综合症(艾滋病)脑炎;急性成人呼吸窘迫综合症;急性冠状动脉综合症;急性肠道微血管功能障碍;急性髓性白血病;急性或慢性疼痛;急性或慢性肾病;急性滑膜炎;急性组织损伤;腺病毒感染;成人呼吸窘迫综合症;晚期良性前列腺肥大(男性前列腺bph非癌性纤维性增大);艾滋病;气道基底膜胶原沉积;气道高反应性;气道炎症;气道重塑;运动性癫痫发作;过敏原引起的慢性气道炎症;过敏性和创伤性疾病;过敏性结膜炎;过敏性鼻炎;过敏;同种异体移植血管病变;阿尔茨海默氏病;偏头痛性侧索硬化症;急性缺血性事件;动脉粥样硬化病;自身免疫性疾病;炎症性疾病;镇痛;血管生成障碍;阻止肿瘤组织的增殖,然后杀死异常细胞,对健康的正常细胞和组织没有严重或致命的伤害;动脉硬化;关节炎病状;由微生物感染引起的关节炎;由寄生虫引起的关节炎;由医疗产品或药物(包含小合成分子以及纯化的天然或合成的肽或蛋白质)引起的关节炎;关节炎疼痛;腹水;哮喘;动脉粥样硬化;脑血管系统的动脉粥样硬化;心脏血管系统的动脉粥样硬化;外周血管系统的动脉粥样硬化;肾血管的动脉粥样硬化;动脉粥样硬化病;失张力发作;心房颤动;自身免疫疾病;自身免疫性胃炎;自身免疫性溶血性贫血;自身免疫性肺病;自身免疫性中性粒细胞减少症;细菌感染;细菌性脑膜炎;良性和恶性增生;良性和恶性肿瘤淋巴瘤;良性或恶性增生;良性前列腺肥大;博莱霉素诱导的肺纤维化;脊髓损伤后血脊髓屏障功能障碍;骨转移;骨吸收疾病;脑震荡或挫伤;脑水肿;乳腺癌;支气管哮喘;闭塞性细支气管炎;滑囊炎;恶病质;癌症;癌痛;心脏纤维化;心脏肥大;心血管损伤;球囊血管成形术后颈动脉内膜增生;脑梗塞;脑疟疾;南美锥虫病;慢性活动性肝炎;慢性支气管炎;慢性肾小球肾炎;慢性心力衰竭;慢性高同型半胱氨酸血症;慢性肺移植排斥反应;慢性粒细胞白血病;慢性阻塞性肺疾病;慢性甲状腺炎;经典过敏反应;中枢神经系统中风和梗死;结直肠癌;与细胞因子活性相关的病症;与p38活性相关的条件;与前列腺素内过氧化物合酶-2相关的病症;与环加氧酶或脂氧合酶信号传导路径有关的病症;充血性心力衰竭;角膜穿孔;冠状动脉或心肌梗死;冠状动脉再狭窄;克罗恩病;囊性纤维化;巨细胞病毒;痴呆;牙痛;真皮水疱;皮肤烧伤;皮肤损伤;皮肤纤维化;皮肤疤痕;糖尿病;糖尿病(ii型);糖尿病肾病;糖尿病性视网膜病变;糖尿病性溃疡;湿疹;浮肿;内毒素血症休克综合症;内毒素休克;嗜酸性肉芽肿;癫痫病;巩膜外层炎/巩膜炎;细胞过度增殖;排除急性心肌梗死;排除肺移植;排除伤口愈合;血管外渗出或血管破裂出血进入邻近组织的血管闭塞(凝块或狭窄);发热;纤维肌痛;纤维化;伴随癌症组织损伤的纤维化;伴随肝硬化组织损伤的纤维化;伴随梗死组织损伤的纤维化;伴随感染组织损伤的纤维化;与受损组织相关的纤维化,包含关节的受损组织的纤维化;与受损组织相关的纤维化,包含肾脏的受损组织的纤维化;与受损组织相关的纤维化,包含肝脏的受损组织的纤维化;与受损组织相关的纤维化,包含肺的受损组织的纤维化;与受损组织相关的纤维化,包含前列腺的受损组织的纤维化;与受损组织相关的纤维化,包括皮肤的受损组织的纤维化;继发于哮喘的纤维化;继发于移植物抗宿主反应的纤维化;继发于肺癌的纤维化;继发于病毒性疾病的纤维化;细胞因子介导的纤维化病症和其它疾病;纤维化疾病;心脏纤维化疾病;肾脏纤维化疾病;肝纤维化疾病;肺纤维化疾病;纤维化血管疾病;组织损伤后形成新的纤维化病变;额皮质下综合症;真菌感染;胃癌;一般或真
皮创伤或挫伤;肾小球肾炎;杯状细胞增生;痛风;移植排斥;移植物宿主病;骨髓移植后移植物宿主病;移植物抗宿主反应;革兰氏阴性败血症;大癫痫发作;格雷夫病;溶血性尿毒症综合症;hamartomatous病;头痛;心脏衰竭;失血性休克;赫曼斯基-普德拉克综合症;赫曼斯基-普德拉克综合症(hps)相关肺纤维化;突出、破裂或脱垂的椎间盘综合症;单纯疱疹i或ii;单纯疱疹感染;疱疹病毒感染;带状疱疹;艾滋病病毒感染;亨廷顿氏病;粘液腺增生;肥厚(烧伤后)疤痕;肥厚性瘢痕(瘢痕疙瘩);甲状腺功能减退症;特发性间质性肺炎;特发性或常见的间质性肺炎;特发性肺纤维化;免疫现象;婴儿血管瘤;婴儿痉挛;发炎性肠病;炎症;炎性肺纤维化;流感病毒;流感病毒感染;抑制术后手术粘连;抑制tgf-β 1诱导的肺和真皮成纤维细胞培养物中胶原蛋白输出的升高;抑制tnf-α合成和释放的作用;昆虫叮咬;胰岛素抵抗;2型糖尿病患者的胰岛素抵抗;系统性硬化症中的间质性肺病;肠道易激综合症;缺血再灌注损伤;缺血性损伤;卡波西肉瘤;角膜炎;平滑肌瘤;利什曼病;麻风;白血病;肝硬化;肝损害;肝脏炎症性疾病;局部水肿;肺结节病;肺移植/慢性排斥反应;狼疮;莱姆病;与艾滋病相关的淋巴结纤维化;淋巴瘤;疟疾;恶性黑色素瘤;膜增生性肾小球肾炎;转移性乳腺癌;转移性黑色素瘤;微血管病或小血管病;与糖尿病无关的微血管病变或小血管疾病;微血管疾病;慢性导管插入术中的微血管损伤;微血管完整性;粘液分泌过多;多发性骨髓瘤;多发性骨髓瘤相关骨病;多发性硬化;肌肉退化;肌肉骨骼纤维化;重症肌无力;心肌纤维化;肌阵挛发作;肌筋膜疼痛综合症;肌成纤维细胞肥大;肿瘤性疾病;神经创伤;神经纤维瘤病;神经损伤;神经肌肉疼痛;非小细胞肺癌;空值;眼部新生血管;器官缺氧;奥蒙德病;骨关节炎;石骨症;骨质疏松症;其它关节炎病状;其它纤维化疾病;其它病毒性疾病;疼痛;疼痛症;胰腺损伤;胰腺纤维化;副肿瘤性疾病;帕金森综合症;帕金森病;小癫痫发作;肠道充气;多囊肾病;肾后透析综合症;术后粘连;先兆子痫;压力瘀伤;防止组织损伤后形成新的纤维化病变;原发性和继发性多发性硬化;原发性局灶节段性肾小球硬化;增生性疾病;原生动物疾病;银屑病;肺石棉沉着症;肺毛细血管炎;胶原血管病引起的肺纤维化;过敏性肺炎引起的肺纤维化;吸入接触剂引起的肺纤维化;结节病引起的肺纤维化;肺水肿热病;辐射和药物诱导的肺纤维化;辐射照射;辐射伤害;瑞特综合症;复发缓解型多发性硬化症;重塑或去除疤痕组织或纤维化;去除先前存在的纤维化病变;肾小球硬化症;脑或心肌再灌注损伤;再狭窄;横纹肌溶解症;类风湿关节炎;类风湿性关节炎相关的间质性肺病;类风湿性脊椎炎;硬皮病;硬皮病伴肺纤维化;羊瘙痒病;选择性自身免疫性疾病;选择性地阻止瘢痕增大;败血症;感染性休克;严重急性呼吸系统综合症;严重的肺纤维化;细菌性痢疾;镰状细胞病;矽肺;皮肤病,包含特应性皮炎荨麻疹;皮损;缓慢或抑制纤维化病变的进行性增大;实体瘤血管生成;脊髓多发性硬化;中风;上皮下纤维化;晒伤;手术;瘢痕疙瘩切除后立即手术部位;susac综合症;系统性红斑狼疮;肌腱炎;腱鞘炎;热灼伤;凝血酶诱导的血小板聚集;血小板减少症;血栓形成;血栓性血小板减少性紫癜;组织纤维化;细菌或真菌感染引起的组织损伤;创伤引起的组织损伤;中毒休克;中毒休克综合症;创伤引起的关节炎;治疗呼吸器官或皮肤炎症;溃疡性结肠炎;血管再狭窄;春季结膜炎;发疱反应(水泡);病毒感染;cns的病毒或细菌感染;以及韦格纳肉芽肿病。
81.根据实施例,患者可患有动脉粥样硬化疾病,包含但不限于肾血管系统、心脏血管系统、脑血管系统和/或外周血管系统的动脉粥样硬化。作为另一个实例,根据任何实施例,患者可能患有血栓形成、急性缺血事件、手术或急性组织损伤。
82.剂量可以是每日两次或三次,每次摄入一个或多个单位剂量。根据具体实施例,每日总摄入量为至少1200mg吡非尼酮。每日总摄入量可以根据患者概况而变化,包含患者的人口统计学特征、生理和遗传状况以及疾病预后等。例如,儿童或老年人每天的给予量可以低于给予普通成年人的量。
83.吡非尼酮的抗纤维化活性在体内动物纤维化模型中以及用人或动物肺成纤维细胞、真皮成纤维细胞和成纤维细胞样细胞进行体纾细胞培养研究中证实。这些数据表明,吡非尼酮可能是预防和治疗术后粘连、心肌纤维化、肾纤维化、肝硬化、动脉粥样硬化和其它纤维化疾病的有效药剂。人间质样细胞(包含肺成纤维细胞、皮肤成纤维细胞、前列腺基质细胞和肾小球系膜细胞等)的体外细胞培养已经示出吡非尼酮对细胞因子生长因子(tgf-β 1、bfgf、pdgf和egf)诱导的过度细胞增殖的药理学抑制作用。在细胞培养基中,吡非尼酮的梯度浓度在比对细胞发挥任何药理毒性作用的水平低十到二十倍的水平处有效。
84.在损伤部位,否则正常的驻留细胞(例如,成纤维细胞、周细胞、肾小球膜细胞、星形胶质细胞、小胶质细胞和少突胶质细胞)制造高浓度的生长因子并将其排放到邻近的组织空间中。这些病理学上高水平生长因子的常驻来源直接导致持续过量水平的生长因子。它们导致过量和有害的胶原蛋白或淀粉样蛋白基质的形成以及邻近细胞的损伤、相关的器官功能障碍以及常常的器官畸形。
85.tgf-β1是一种有效的生长相关肽,其效果可以在飞摩尔浓度下观察到。它似乎无处不在,并且是体外细胞增殖的双功能调节剂。根据组织浓度和细胞融合状态,它充当促分裂原或生长抑制剂(l.j.striker等人,实验室研究杂志(lab.invest.)第64卷:第446页到456页,1991年)。在皮肤切口中,在吸引巨噬细胞和成纤维细胞后,tgf-β 1通过增加胶原蛋白和纤连蛋白基因的转录、减少蛋白酶的分泌、增加蛋白酶抑制剂的分泌以及增加基质蛋白的细胞受体转录来增强细胞外基质的形成。
86.吡非尼酮的抗纤维化活性已经在具有纤维化病变的实验动物体内、在体外用人肺成纤维细胞(wi38)细胞培养物中证实,并且通过在严重肺纤维化、良性前列腺肥大或瘢痕疙瘩患者中的试验性开放试验观察到。吡非尼酮可以选择性地阻止瘢痕增大,并且重塑或去除瘢痕组织或纤维化。纤维化病变引起的功能障碍可以通过吡非尼酮治疗后纤维化病变的减少或去除来改善。显然,即使在存在纤维化数年之后,器官和组织功能也可以恢复。当在如创伤、感染或过敏等损伤后立即给予组织时,吡非尼酮也可以防止形成过多的瘢痕组织或纤维化病变,从而有助于保持组织的正常功能和外观。
87.吡非尼酮可能通过局部成纤维细胞的吞噬作用导致过多的胶原纤维组织的去除。已经通过以下观察到了这一点:在光学显微镜下检查来自用吡非尼酮治疗的肺纤维化的狗、小鼠、大鼠和仓鼠的肺组织的组织切片,以及还有从患有用吡非尼酮治疗的实验性诱发的石棉沉滞症的仓鼠取得的肺组织的组织切片的电子显微照片。没有发生炎症诱导的中性粒细胞、pmn细胞、单核细胞、淋巴细胞的浸润。
88.体外暴露于pdgf或bfgf后wi38成纤维细胞的增强的增殖可以被添加到细胞生长培养基中的吡非尼酮阻断。吡非尼酮还可以抑制tgf-β1引起的肺和真皮成纤维细胞培养物中胶原蛋白输出的升高。
89.用吡非尼酮治疗后的人体临床表现与实验动物中观察到的抗纤维化作用一致。已经对患有肺石棉沉滞症、博来霉素诱导的肺纤维化、特发性肺纤维化、具有肺纤维化的硬皮
病和以肺纤维化为特征的赫曼斯基-普德拉克综合症的患者进行口服吡非尼酮的试验性开放性临床试验。
90.最初几个月对吡非尼酮有益反应的临床标准包含减少咳嗽发生率、减少补充氧气需求、增加运动耐量、减少运动时呼吸困难、改善肺心病、恢复正常的日常任务、增加体重以及存活。在早期月份,通过胸部x射线、肺活量测定或co扩散(dlco)测量的肺功能显示很少(如果有的话)改变。然而,在吡非尼酮治疗4至6个月后,通过肺功能测试、肺活量(vc)、肺部对一氧化碳(dlco)的扩散能力来证实抑制或阻止肺功能的进一步恶化。这些总体观察结果与van barneveld等人(《美国呼吸疾病评论(amer.rev.respr.dis.)》,第135卷,第48页到51页,1987年)描述的观察结果相当,在博来霉素诱导的肺性肺炎(早期纤维化)患者的自发恢复期间。
91.martinet等人(《新英格兰医学期刊(ne jour.med.)》,第317卷,第202页到209页,1987年)已经描述了特发性肺纤维化患者中肺泡巨噬细胞对pdgf的过度释放。吡非尼酮对有丝分裂发生的抑制和由生长因子(bfgf、pdgf和tgf-β 1)引起的胶原蛋白的增强形成的体外证明可部分解释吡非尼酮的有益的体内抗纤维化作用。
92.在吡非尼酮用于具有临床上晚期良性前列腺肥大(bph,男性前列腺非癌性纤维性增大)的老年男性的开放性试验中,患者根据客观标准进行了功能改善。在服用口服吡非尼酮后,尿频膀胱尿急改善,并且夜尿症很少复发。在另一项试验性开放试验中,在瘢痕疙瘩切除后立即将吡非尼酮软膏局部应用于手术部位可防止瘢痕疙瘩复发,如在患者的两年随访中所观察到的。那些患者中的每一个都具有在此类手术后重复的早期瘢痕疙瘩再生长的先前病史。吡非尼酮可以引起皮肤纤维化病变的重塑,以减少或去除瘢痕疙瘩、减少或去除皮肤瘢痕并且去除或减轻肥厚(烧伤后)瘢痕的挛缩。在类似的情况下,吡非尼酮还起到抑制术后手术粘连的作用。
93.因此,在受控方案设计和开放标记试验下的临床研究已经证明吡非尼酮发挥抗纤维化和细胞保护作用。口服给药后观察到的副作用相对温和(嗜睡、胃恶心或光敏性皮疹)。没有报告严重的不良反应。
94.基于吡非尼酮的tnf-α抑制剂(细胞保护性)活性,可以根据本公开的某些实施例给予本公开的制剂以治疗患有以下病症的患者:
95.1)中枢神经系统综合症:复发缓解型多发性硬化症、原发性和继发性多发性硬化症、脊髓多发性硬化症、脑疟疾、cns病毒或细菌感染、细菌性脑膜炎、中枢神经系统(cns)的“自身免疫性”疾病、cns中风和梗塞、脑水肿、帕金森综合症、阿尔茨海默氏病、偏头痛性侧索硬化症(als)和脑震荡或挫伤;
96.2)肌肉-骨骼综合症:类风湿性关节炎、创伤引起的关节炎、由微生物感染或寄生虫引起的关节炎、肌腱炎以及由医疗产品或药物(包含小的合成分子以及纯化的天然或合成的肽或蛋白质)引起的关节炎;
97.3)肺综合症:急性成人呼吸窘迫综合症、哮喘、过敏性鼻炎、过敏性结膜炎、慢性阻塞性肺病(copd)和肺结节病;
98.4)全身性免疫、炎症或中毒综合症:内毒素血症休克综合症、脓毒性休克、移植物宿主病、同种异体移植血管病变、失血性休克、脑或心肌再灌注损伤、热灼伤、放射性损伤、全身或皮肤创伤或挫伤、嗜酸性肉芽肿、糖尿病(ii型)或系统性红斑狼疮;
99.5)胃肠综合症:克罗恩病、溃疡性结肠炎和肝脏炎症;以及
100.6)充血性心力衰竭。此外,基于吡非尼酮的抗纤维化活性,可以根据其它实施例施用本公开的制剂以治疗患有以下病症的患者:肺纤维化、放射和药物诱导的肺纤维化、肝纤维化、心脏纤维化、瘢痕疙瘩,术后粘连、人类良性前列腺肥大、动脉硬化、皮肤纤维化和冠状动脉再狭窄。
101.实例
102.实例1和2:制剂
103.制备具有良好可制造性的片剂制剂,其具有以下组分:
104.表1:颗粒制剂
[0105][0106]
实例3:与不含助流剂的制剂的比较
[0107]
将吡非尼酮制剂与(实例1的制剂)和不含(对比实例)颗粒内助流剂进行比较。比较制剂具有以下组分:
[0108]
表2:对比实例
[0109][0110]
使用流化床制粒处理实例1的制剂和对比实例(表2)的制剂。如图2a所示,对比实例导致残留的粉末粘附在流化床制粒机的侧壁上。这种粉末的粘附表明颗粒内制剂的内聚性质,并且发现这是对比实例的制剂的商业规模加工的障碍。相比之下,如图2b所示,实例1的制剂没有大量残留的粉末粘附在流化床制粒机的侧壁上,从而产生能够以商业规模加工的颗粒制剂。
[0111]
实例4:流动性分析
[0112]
流函数系数(ffc)是粉末流动的量度。小于约4的值被认为是差的并且对于粉末加工来说是次优的。4到10之间的值被认为是粉末加工的可接受的流动值。分析纯吡非尼酮(不含赋形剂)和吡非尼酮与微晶纤维素的二元粉末混合物的流动行为,所述二元粉末混合物混合有约1%重量的二氧化硅或约2%重量的二氧化硅,如下表3中所示。将组分在turbula混合器中混合,并测量共混物的不同流动性质。
[0113]
表3:具有和不具有二氧化硅的对比测试制剂
[0114][0115]
测试证实纯吡非尼酮具有差的流动行为,ffc值为2.3。添加1%二氧化硅略微改善流动性,产生具有适合商业加工的边界线的流动性质的混合物。1%二氧化硅混合物的ffc为3.9。添加2%二氧化硅导致流动行为的显着改善,导致fcc为5,这表明良好的流动性。
[0116]
表4:流函数系数
[0117][0118]
实例5:制片
[0119]
通过施加约100mpa到170mpa的压缩力并利用作为主压缩力的20%到30%的预压缩力,由实例1的制剂形成片剂。这种压缩力产生的片剂核心的固体分数值在87%与93%之间,并且拉伸强度值大于1.6mpa。片剂显示出良好的磨损特性(磨损少于0.5%)。
[0120]
图7和图8示出了具有801mg(三角形符号)、267mg(菱形符号)和534mg(方形符号)的吡非尼酮剂量的片剂的可压片性和可压实性曲线。
[0121]
实例6:崩解控制
[0122]
令人惊讶地发现,根据本公开的实施例的吡非尼酮片剂的崩解可以通过固体分数百分比(标准化片剂厚度)来控制,不依赖于片剂剂量强度。虽然发现吡非尼酮的粒度影响片剂核心硬度,但是发现固体分数而不是拉伸强度影响片剂核心的药物释放特性。这种关系在广泛的吡非尼酮粒度范围内得到证实,d90为50μm到150μm。鉴定这种关系允许控制固体分数的片剂核心厚度用作片剂压缩步骤中的目标参数而不是片剂核心硬度。
[0123]
固体分数是使用片剂核心的尺寸(压缩工具的大小和片剂的厚度)、片剂重量和最终混合物的真密度计算的标准化工艺参数。在标准片剂压缩操作期间,除片剂厚度外,限定固体分数的所有其它因素保持不变。因此,控制片剂的厚度可以用于在片剂压制期间靶向预定义的固体分数。文献研究表明,片剂固体分数可能对所得片剂核心的机械强度(或硬度)和其崩解特性产生强烈影响(hancock等人,“药物粉末、混合物、干燥颗粒和即时释放片剂的相对密度”,发泰科技有限公司,2003年;第27卷,第4期:第64页到80页)。然而,令人惊讶地发现,对于根据本公开的吡非尼酮制剂,固体分数(标准化片剂厚度)与片剂的崩解特性之间的关系不依赖于片剂机械强度。
[0124]
对于固体分数的计算(pitt等人,“来自小规模压实研究的用于产生压力机的压缩预测精度”,粉末技术,2015年;第270卷(部分-b):第490页到493页),最终混合物的真密度通过使用纯吡非尼酮的真密度估算。吡非尼酮薄膜包衣片剂组合物中的药物负荷非常高,并且预期最终混合物的真密度接近纯吡非尼酮的密度。
[0125][0126]
图5示出了崩解时间与固体分数百分比的相关性,并且图6示出了崩解时间与片剂核心厚度的相关性。鉴定片剂核心厚度与药物释放特性之间的这种关系有利地提供了通过容易测量和可控制的参数-片剂厚度来控制药物释放性质。
[0127]
实例7:生物等效性
[0128]
进行生物等效性研究,展示具有根据本公开的制剂的薄膜包衣片剂与可商购胶囊制剂(作为胶囊销售)之间的生物等效性,所述制剂是不含颗粒内助流剂的吡非尼酮制剂。
[0129]
表5:用于生物等效性研究的制剂
[0130][0131]
当基于auc0-∞、auc0-24和cmax与禁食状态下的胶囊相比时,薄膜包衣片剂符合90%置信区间(80.00%到125.00%)的生物等效性标准。当关于auc0-∞和auc0-24与进食状态下的胶囊相比时,薄膜包衣片剂符合生物等效性标准,但对于c
max
,90%置信区间的上限稍微超出125.00%的限制。
[0132]
总体而言,生物等效性结果表明吡非尼酮口服暴露预计不会因制剂从胶囊到薄膜包衣片剂的变化而改变。
[0133]
表6:禁食状态下的生物等效性结果概述
[0134][0135]
缩写:auc0-∞==从0到无穷大的曲线下的区域;auc0-24==从零到24小时的曲线下区域;ci=置信区间;cmax=最大浓度。
[0136]
表7:进食状态下的生物等效性结果概述
[0137][0138]
缩写:auc0-∞==从0到无穷大的曲线下的区域;auc0-24==从零到24小时的曲线下区域;ci=置信区间;cmax=最大浓度。
[0139]
两种低剂量片剂(267mg和534mg)的生物等效性通过对生物等效性研究中测试的801mg片剂的对比溶出来证实。
[0140]
在不含表面活性剂的三种不同介质,即0.1n hcl、乙酸盐缓冲液ph 4.5、磷酸盐缓冲液ph 6.8中以及在所提出的商业溶出介质(水)中提供所有三种强度的比较溶出曲线。用
以50rpm运行的桨式设备(设备ii)记录曲线。在37℃下在900ml上述溶出介质中测量十二个样品。
[0141]
图9示出了用于生物等效性研究的硬胶囊(267mg)的溶出曲线。
[0142]
图10到图13分别示出了在四种不同介质中测试的不同片剂强度的对比溶出曲线:hcl 0.1n;乙酸盐缓冲液ph 4.5;磷酸盐缓冲液ph 6.8和水。
[0143]
对于在所有测试介质中测试的所有强度(801mg、534mg和267mg),发现薄膜包衣片剂在15分钟时具有至少85%的平均溶出度。由此得出结论,低剂量片剂也与胶囊生物等效。
[0144]
实例8:溶出度测试
[0145]
具有实例6中公开的制剂的根据本公开的薄膜包衣片剂的体外性能根据下文所示的条件的基质使用ph进行评估。eur./usp装置ii、旋转桨或ph。eur./usp装置i、旋转篮和37℃下1000ml所述介质。
[0146]
表8:溶出条件
[0147][0148]
缩写:dist.==蒸馏。
[0149]
以5分钟的间隔对等分试样进行取样,以确保生成反映曲线的上升部分和稳定阶段的数据。对于每种剂量和测试的介质,产生[%平均溶出度]对时间的曲线图。最小值/最大值反映在误差条上。图14到图16分别示出了267mg、534mg和801mg剂量的蒸馏水中随时间的%平均溶出度。图17到图19分别示出了267mg、534mg和801mg剂量的hcl、乙酸盐和磷酸盐中随时间的%平均溶出度。
[0150]
通过使用旋转篮(ph.eur./usp设备i)以75rpm搅拌或使用桨(ph.eur./usp设备ii)以50/75rpm搅拌而在蒸馏水中溶出导致快速溶出曲线(15分钟后》85%)并示出在测试开始到15分钟之间的上升曲线,对于801mg,在15-分钟到20分钟达到稳定水平,并且对于其它强度更快。在所有工作条件下,15分钟后可观察到约1%到3%的标准偏差。在常规usp缓冲液(hcl 0.1n;50mm乙酸盐ph 4.5和50mm磷酸盐ph 6.8)中溶出表现出类似的快速溶出曲线,如使用伴有50rpm旋转桨的水观察到的。
[0151]
实例9:药物物质粒度对片剂性质的影响
[0152]
未发现本公开的制剂中的药物物质粒度影响由制剂形成的片剂的溶出,其中片剂具有相同的固体分数。评估了具有来自两种不同源的药物物质的制剂。以下片剂提供测试源的粒度分布信息。
[0153]
表9:两种吡非尼酮源的粒度分布
[0154][0155]
缩写:ds==药物物质;psd==粒度分布。
[0156]a药物物质源和批号在括号中给出。
[0157]
在溶出测试期间,在10分钟后达到稳定水平并且两个批号反映了在测试的工艺参数范围内的快速溶出。所有测试的片剂的强度为801mg。测试了10kn、20kn和21kn的主压缩力。粒度分布差异导致所得片剂的硬度差异,如下表所示。
[0158]
表10:作为具有不同粒度分布的吡非尼酮的片剂的压缩力的函数的片剂硬度
[0159][0160]
如图20所示,尽管硬度存在这些差异,但数据表明溶出对药物物质粒度分布的变化不敏感。而且,片剂压缩至相似厚度值(7.5mm到7.7mm对7.0mm到7.1mm)导致片剂具有显著的硬度差异,但表现出更可比的溶出药物释放曲线。
[0161]
实例10:压缩力对溶出的影响
[0162]
压缩力可以在溶出的早期阶段影响溶出曲线,通常在少于15分钟后。在5kn到25kn的范围内研究压缩力对三种剂量强度(801mg、534mg和267mg)的溶出的影响。溶出曲线可能受压缩力的影响,并且通常表现为在早期溶出阶段(约0到15分钟之间)的图形形状的变化。图21和图22分别示出了534mg片剂和267mg片剂的早期溶出曲线的变化,其可以由改变压缩力产生。
[0163]
实例11:流化床制粒工艺参数
[0164]
制备八个批号,每个批号处于所关注的八个流化床制粒和干燥设置之一,并将所述八个批号加工成最终混合物。将每种最终混合物分成两批,每批压制成片剂至不同的硬度设置(120n和200n)。
[0165]
表11:流化床制粒条件
[0166][0167]a进气温度和进气体积的相同的设置在制粒和干燥阶段中使用。
[0168]b喷射率和进气流体积一起合并成标称因子并且同时变化。相应的空气流量:1600(低)/1850(目标)/2100m3/h(高)。
[0169]c标准化喷射率范围相当于3.3g/分钟/kg到-4.6g/分钟/kg。
[0170]
在适用的情况下,测量颗粒、最终混合物和片剂核心的不同材料属性作为响应,指定可接受的范围。测量干燥结束时的产品温度和颗粒干燥失重作为响应以确定所述两种响应之间是否存在相关性。测量最终混合物的筛分分析(以确定粉末的量)、堆积密度和流函数系数作为响应,其指示颗粒的流动行为。在产生预定硬度值的片剂的情况下,测量主压缩力和片剂厚度作为响应。还研究了片剂核心属性udu(通过质量变化)、15分钟时的溶出度和
崩解时间作为120n和200n所得片剂核心的响应。
[0171]
所有批次均使用单一药物源生产,并使用相同的工具压缩成801mg强度的片剂(20.0
×
9.3mm)。
[0172]
表12示出了对所得颗粒的材料属性的影响的综述。
[0173]
表12:颗粒材料属性的结果
[0174][0175]
缩写:doe=实验设计;ffc=流函数系数;lod=干燥损失。
[0176]a伪-中心点。
[0177]
表13示出了对片剂核心的材料属性的影响的综述。
[0178]
表13:片剂核心材料属性的结果
[0179][0180]
表13续
[0181][0182]
表13续
[0183][0184]
缩写:avg=平均;doe=实验设计;hard.=片剂核心厚度;rsd=相对标准偏差;temp.=温度。
[0185]a近似拉伸强度=1.7-1.8mpa。
[0186]b近似拉伸强度=0.9-1.0mpa。
[0187]c伪-中心点。
[0188]
前述内容描述和举例说明了本发明,但并不意图限制由所附权利要求书限定的本发明。根据本公开,无需过度实验即可制造和执行本文公开和要求保护的所有制剂和方法。虽然已经根据具体实施例描述了本发明的材料和方法,但是对于所属领域的技术人员来说显而易见的是,在不脱离本发明的概念、精神和范围的情况下,可以对本文所述的材料和/或方法以及步骤或步骤顺序应用变化。
[0189]
本文引用的所有专利、出版物和参考文献均通过引用全部并入本文。在本公开与所结合的专利、出版物和参考文献之间存在冲突的情况下,应当以本公开为准。
[0190]
在整个本技术中,术语“约”用于表示某个值包含用于确定值的装置或方法的误差
的标准偏差。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。