1.本发明涉及生物技术领域领域,尤其涉及抗真菌脂肽及链霉菌在抗真菌脂 肽制备中的应用。
背景技术:
2.脂肽类物质是由微生物代谢产生的一类具有很强表面活性剂,是由多个氨 基酸构成的多肽环和一条疏水脂肪酸侧链组成的两亲性分子。脂肽类物质包括 表面活性素、丰原素、伊枯草菌素、罗克霉素和脂肽a等。已经报道发现脂 肽类物质具有抗细菌、抗真菌、抗肿瘤和抗病毒等多种生物学活性。脂肽类物 质的合成是由非核糖体肽合成酶(nonribosomal peptide synthetases)和聚酮合 酶(polyketide synthases)共同编码合成,这些基因一般是成簇存在的,所以 这一类物质大多是以同系物的形式同时存在,分离纯化这些结构类似物非常困 难,因此当前的研究大多是脂肽复合物的抑制活性,但这些物质结构上的轻微 变化,可能引起活性上的巨大差异,因此开发一种制备脂肽单体的方法尤为重 要。
3.发明人在实验室中分离出一株链霉菌(streptomyces sp.xy006),经研 究,该链霉菌的主要次级代谢产物是脂肽a(lipopeptin a)和与脂肽a相差 一个亚甲基的脂肽b(lipopeptin b)(暂定名称),前期试验发现,脂肽a和 b结构上虽仅相差一个亚甲基,但其活性差异显著。且经过试验论证,脂肽a 和脂肽b的混合初提物对多种重要的农业病原真菌均有明显的抑制作用,而 相应的研究报道目前暂未见有披露。在此基础上,申请人为进一步研究其拮抗 机制,通过一系列的分离纯化方法制备得到脂肽a和b的活性单体。
技术实现要素:
4.有鉴于此,本发明的目的在于提出一种实施可靠、制备过程高效、便利和 可控的抗真菌脂肽及链霉菌在抗真菌脂肽制备中的应用。
5.为了实现上述的技术目的,本发明所采用的技术方案为:
6.一种抗真菌脂肽,其化学式为c
53h82n10o19
,其结构式如下:
7.。
8.基于上述,本发明还提供链霉菌在抗真菌脂肽制备中的应用,其包括将链 霉菌及其培养基进行冷冻处理后,再对其进行解冻和加压过滤处理以获得菌 液,所得菌液经浓缩和醇提取后,获得粗提物,该粗提物经复溶、正丁醇等体 积萃取多次后,收集有机相进行浓缩,再将浓缩物调整至预设浓度后,通过固 相萃取柱,然后经多级梯度洗脱处理,再收集洗脱物,对其进行分离纯化后, 制得抗真菌脂肽,所述抗真菌脂肽包括脂肽a和脂肽b,其中,所述脂肽a 的化学式为c
54h84n10o19
,其结构式为:
[0009][0010]
所述脂肽b的化学式为c
53h82n10o19
,其结构式为:
[0011]
。
[0012]
作为一种可能的实施方式,进一步,所述链霉菌为链霉菌xy006,其被 命名为链霉菌streptomyces sp.,已于2021年12月13日保藏于中国微生物菌 种保藏管理委员会普通微生物中心,保藏地址为北京市朝阳区北辰西路1号院 3号,保藏编号为cgmcc no.24090。
[0013]
作为一种较优的实施选择,优选的,所述应用具体包括如下步骤:
[0014]
(1)将链霉菌xy006在ms培养基上划板活化后,于30℃环境下培养 3天;然后挑取单菌落于myg培养基,并在28℃和200rpm的条件下培养2 天,然后按1.0%量转接到myg培养基进行培养,使其在28℃、200rpm条 件下摇床培养6天,然后6000g离心处理,舍弃部分上清液后,将菌液用于 ms固体培养基涂板;每皿100μl,涂布均匀,于30℃培养七天;
[0015]
(2)将培养好的链霉菌xy006转入-80℃低温冷冻24h,然后室温完全 解冻,通过多层纱布包裹再施压挤出菌液,余下培养基残渣于甲醇中浸泡4 h,再经多层纱布包裹施压过滤,最后合并两次的滤出液,将其置于旋转蒸发 仪浓缩到预设体积;继而12000g离心10min,取上清,加入终浓度为70%的 甲醇于4℃静置提取,再12000g离心10min保留上清,继而通过旋转蒸发 仪浓缩到预设体积,再置于冷冻干燥仪中冷冻干燥,制得粗提物,将其保存于
ꢀ‑
20℃环境下;
[0016]
(3)将粗提物用纯水完全复溶后,用正丁醇进行等体积液液萃取,萃取三 次,合并三次的有机相,静置过夜,再收集有机相,对其进行浓缩处理至干, 再用纯水复溶后,对其进行冷冻干燥,制得产物a,且将其保存于-20℃;
[0017]
(4)将产物a调整至上样浓度为500mg/ml,以3~5ml的上样体积将 其通过固相萃取柱进行萃取处理,再经多级梯度洗脱处理,再收集洗脱物;
[0018]
(5)对洗脱物进行复溶,然后离心去除沉淀后,进行液相色谱分离纯化 处理,制得抗真菌脂肽。
[0019]
作为一种较优的实施选择,优选的,步骤(4)中,多级梯度洗脱处理的 洗脱液依序为100%h2o、20%meoh、40%meoh、60%meoh、80% meoh、100%meoh,其中,meoh质量浓度为非100%的溶液中,其余部分 为水。
[0020]
作为一种较优的实施选择,优选的,步骤(5)中,对洗脱物进行复溶, 然后离心去除沉淀后,将溶液依序通过甲醇和水为流动相、乙腈和水为流动相 的液相色谱进行分离纯
化处理,制得抗真菌脂肽。
[0021]
作为一种较优的实施选择,优选的,步骤(5)中,甲醇和水为流动相的液 相色谱进行分离纯化处理的条件为:色谱柱为xbridge prep obd
tm c18,其规 格为5μm,19
×
150mm,进样浓度200mg/ml,进样体积200μl;流动相 的流速5ml/min,吸收波长200~300nm,在预设hplc洗脱梯度条件下,每分 钟收集一管,根据吸收峰的位置合并同一吸收峰的洗脱液,然后通过旋转蒸发 仪浓缩干,再保存于-20℃环境下。
[0022]
作为一种较优的实施选择,优选的,步骤(5)中,乙腈和水为流动相的 液相色谱进行分离纯化处理的条件为:色谱柱为xbridge prep obd
tm c18,其 规格为5μm,19
×
150mm,进样浓度200mg/ml,进样体积200μl;流动相 流速5ml/min,吸收波长为200~300nm,在预设hplc洗脱梯度条件下,根 据吸收峰的位置收集洗脱液,然后通过旋转蒸发仪浓缩干,称重,保存于
‑ꢀ
20℃环境下。
[0023]
基于上述,本发明还提供一种农业病原真菌抑制药物,其包括抗真菌脂 肽,所述抗真菌脂肽包括脂肽a和脂肽b,其中,所述脂肽a的化学式为 c
54h84n10o19
,其结构式为:
[0024][0025]
所述脂肽b的化学式为c
53h82n10o19
,其结构式为:
[0026]
。
[0027]
作为一种较优的实施选择,优选的,所述农业病原真菌包括稻瘟病、香蕉 枯萎病、黄瓜枯萎病、炭疽病病原真菌;
[0028]
作为一种较优的实施选择,优选的,所述抗真菌脂肽的制备方法包括:
[0029]
(1)将链霉菌xy006在ms培养基上划板活化后,于30℃环境下培养 3天;然后挑取单菌落于myg培养基,并在28℃和200rpm的条件下培养2 天,然后按1.0%量转接到myg培养基进行培养,使其在28℃、200rpm条 件下摇床培养6天,然后6000g离心处理,舍弃部分上清液后,将菌液用于 ms固体培养基涂板;每皿100μl,涂布均匀,于30℃培养七天;
[0030]
(2)将培养好的链霉菌xy006转入-80℃低温冷冻24h,然后室温完全 解冻,通过多层纱布包裹再施压挤出菌液,余下培养基残渣于甲醇中浸泡4 h,再经多层纱布包裹施压过滤,最后合并两次的滤出液,将其置于旋转蒸发 仪浓缩到预设体积;继而12000g离心10min,取上清,加入终浓度为70%的 甲醇于4℃静置提取,再12000g离心10min保留上清,继而通过旋转蒸发 仪浓缩到预设体积,再置于冷冻干燥仪中冷冻干燥,制得抗真菌脂肽。
[0031]
本方案中,脂肽a的研究最早出现于20世纪80年代,也是目前为止唯 一的研究报道,目前已公开的文献中,还未见有脂肽b的相关研究,且几乎 没有关于脂肽a和b拮抗农业重要病原真菌的研究。
[0032]
采用上述的技术方案,本发明与现有技术相比,其具有有益效果为:本方 案巧妙性通过链霉菌的代谢物进行提取脂肽a和脂肽b,且结合本方案的制 备方法,可制得纯度高于95%的脂肽a和脂肽b的单体,这对于后续解析其 拮抗病原真菌的机制及植株生防效果的试验都有重要的帮助;同时,脂肽a 和脂肽b拮抗机制的差异,也能为后续脂肽a和脂肽b的生物合成研究指出 方向。
附图说明
[0033]
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施 例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述 中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付 出创造性劳动的前提下,还
可以根据这些附图获得其他的附图。
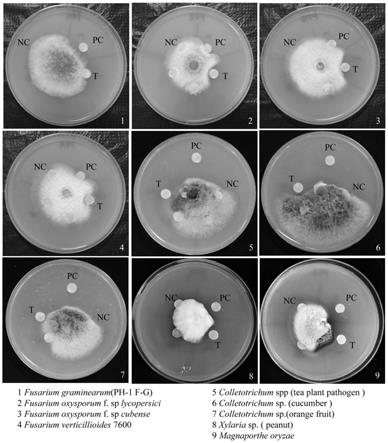
[0034]
图1是正丁醇萃取粗提物后活性层的总离子流色谱图;
[0035]
图2是经poly-sery hlb固相萃取小柱分离后六个活性层的总离子流色谱 图;
[0036]
图3是脂肽a和b的总离子流色谱图;
[0037]
图4是脂肽a(m/z 1177.6021)与脂肽b(m/z 1163.5846)的二级质谱图;
[0038]
图5为脂肽a和b的初提物对主要农业病原真菌的抑制作用的对比表征 图。
具体实施方式
[0039]
下面结合附图和实施例,对本发明作进一步的详细描述。特别指出的是, 以下实施例仅用于说明本发明,但不对本发明的范围进行限定。同样的,以下 实施例仅为本发明的部分实施例而非全部实施例,本领域普通技术人员在没有 作出创造性劳动前提下所获得的所有其它实施例,都属于本发明保护的范围。
[0040]
本方案公开了链霉菌在抗真菌脂肽制备中的应用,其包括如下步骤:
[0041]
1链霉菌xy006的扩大培养
[0042]
链霉菌xy006(下称xy006)分离自福建农林大学茶园一株铁观音茶树的 叶片,其经过菌种鉴定,被命名为链霉菌streptomyces sp.,已于2021年12 月13日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏地址为 北京市朝阳区北辰西路1号院3号,保藏编号为cgmcc no.24090。
[0043]
扩大培养:将xy006于ms培养基上划板活化,30℃培养三天,挑取单菌 落于myg(3ml)培养基,28℃,200rpm摇床培养两天,按1%的接菌量转 接于myg(250ml)培养基,28℃,200rpm摇床培养六天,6000g离心弃部 分上清,菌液用于ms固体培养基涂板;每皿100μl,涂布均匀,于30℃培 养七天。
[0044]
2粗提物的制备
[0045]
上述培养好的xy006转入-80℃冰箱低温冷冻24h,室温完全解冻,四层 纱布挤出菌液,培养基残渣于甲醇(meoh)中浸泡4h,四层纱布过滤,合并两 次的滤出液,旋转蒸发仪浓缩到小体积(约10倍浓缩倍数)。12000g离心10 min,取上清,加入终浓度为70%的甲醇于4℃静置提取,12000g离心10min 保留上清,旋转蒸发仪浓缩到小体积,冷冻干燥仪冷冻干燥,称重,保存于-20℃ 冰箱。
[0046]
3抗菌活性物质的分离纯化
[0047]
3.1液液萃取
[0048]
粗提物用纯水完全复溶后,用正丁醇进行等体积液液萃取。萃取三次,合并 三次的有机相,静置过夜,收集有机相,浓缩至干,用纯水复溶后,冷冻干燥, 保存于-20℃冰箱。
[0049]
waters uplc-synapt g2-si hdms qtof-ms(uplc-qtof/ms)检测活性层纯 度,如图1所示。从图中可以看出,脂肽a在3.09min出峰,脂肽b在2.67 min出峰,两个物质出峰时间接近。在脂肽a和b出峰位置的前后有很多杂峰, 说明经过液液萃取的活性层纯度还较低,仍需进一步纯化。
[0050]
3.2 poly-sery hlb固相萃取小柱分离纯化
[0051]
3.2.1活化柱子:依次加2ml的甲醇,2ml的纯水。
[0052]
3.2.2上样:上样浓度为500mg/ml,上样体积3~5ml,待样品完全过柱, 开始洗脱。
[0053]
3.2.3洗脱:按下表梯度洗脱。
[0054]
表1 cnw poly-sery hlb固相萃取小柱洗脱梯度
[0055][0056]
3.2.4收集洗脱层:将上述六层洗脱层浓缩至小体积,冷冻干燥,称重。
[0057]
3.2.5 75%色谱纯甲醇溶解活性层,10000g离心去除沉淀,稀释到0.1mg/ml, 待uplc-qtof/ms检测,筛选活性层,结果如图2所示。
[0058]
从图中可以看出,100%水和100%甲醇两个洗脱层均未检测到脂肽a和b, 其余四个洗脱层均检测到脂肽a和b,且两个物质在每个洗脱层的比例略有差 别,在60%甲醇和80%甲醇洗脱层中以脂肽a为主,在20%甲醇和40%甲醇 洗脱层中,两者所占比例相对一致。通过峰面积积分,计算脂肽a和b的纯度, 这四个活性层中脂肽a和b的纯度相比液液萃取获得的活性层的纯度有较大的 提高。
[0059]
3.3制备液相色谱甲醇分离纯化
[0060]
对3.2分离纯化得到的活性层分别进行复溶,10000g离心去除沉淀,进行 液相色谱分离纯化,以甲醇和水为流动相。
[0061]
分离纯化条件:色谱柱xbridge prep obd
tm c18(5μm,19
×
150mm), 进样浓度200mg/ml,进样体积200μl。流动相为甲醇和水,流速5ml/min, 吸收波长200~300nm,hplc洗脱梯度如下表所示,每分钟收集一管,根据吸收 峰的位置合并同一吸收峰的洗脱液,旋转蒸发仪浓缩干,称重,保存于-20℃ 冰箱。
[0062]
表2 hplc分离纯化洗脱梯度
[0063][0064]
75%色谱纯甲醇溶解各洗脱层,10000g离心去除沉淀,稀释到0.01mg/ml, 待uplc-qtof/ms检测筛选活性层。
[0065]
3.4制备液相色谱乙腈分离纯化
[0066]
对3.3中筛选得到的活性层分别进行复溶,10000g离心去除沉淀,分别进 行液相色谱分离纯化,以乙腈(acn)和水为流动相。
[0067]
分离纯化条件:色谱柱xbridge prep obd
tm c18(5μm,19
×
150mm),进 样浓度200mg/ml,进样体积200μl。流动相为乙腈和水,流速5ml/min, 吸收波长200~300nm,hplc洗脱梯度如下表所示,根据吸收峰的位置收集洗脱 液,旋转蒸发仪浓缩干,称重,保存于-20℃冰箱。
[0068]
表3 hplc分离纯化洗脱梯度
[0069][0070]
各活性层用75%色谱纯甲醇复溶,10000g离心去除沉淀,稀释到0.01 mg/ml,待uplc-qtof/ms检测筛选活性层,结果如表4所示,共获得九个纯度 90%以上的活性层,其中两个为脂肽a和脂肽b的活性单体,其总离子流色谱图 如图3所示,70%甲醇为溶剂空白,ms blank为培养基空白,经峰面积积分计 算,脂肽a和b的纯度均在95%以上。
[0071]
表4经多次分离纯化最终得到的高纯度活性层
[0072][0073][0074]
3.5脂肽a和b结构鉴定
[0075]
对脂肽a的母离子[m h]
(m/z 1177.6021)进行ms/ms分析,离子碎片信息 如图4
所示。将其二级质谱信息上传至gnps(global natural products social) 数据库,离子碎片匹配到lipopeptin a。文献检索发现其与nishii等研究中 的lipopeptin a(c
54h84n10o19
)一致,m/z 1199([m na]
),推测其可能的断裂 方式如下,碎片离子162.0910对应脂肽a中的甲基苯丙氨酸(mephe),离子 1177.6021与1049.5417相差128,对应脂肽a中的甲基天冬氨酸(measn),离 子306.1458与162.0910相差144,对应脂肽a中的羟基谷氨酰胺(hygln), 离子435.1892与306.1376相差129,对应脂肽a中的谷氨酸(glu),离子 760.4507与435.1892相差325,对应脂肽a中的脂肪酸与苏氨酸(c15 fa thr), 脂肽a的化学结构如式一所示,脂肽a的化学式chemical formula为c
54h84n10o19
。
[0076]
对脂肽b的母离子[m h]
(m/z 1163.5846)进行ms/ms分析,离子碎片信息 如图4所示。其母离子与脂肽a母离子相差14,两者结构上可能相差一个-ch
2-, 主要碎片离子有162.0916、306.1454、435.1884、746.4335、861.4587、948.4932 和1035.5247,并且碎片离子746.4335、861.4587、948.4932和1035.5247与 脂肽a的碎片离子760.4507、875.4780、962.5101和1049.5417均相差14。 将其二级质谱信息上传gnps数据库,匹配到的物质为lipopeptin b,其结构 与脂肽a在脂肪酸链上相差一个亚甲基-ch
2-。脂肽b的化学结构式如式二所示, 脂肽b的化学式chemical formula为:c
53h82n10o19
;当前文献检索并未发现记载 脂肽b。
[0077][0078]
4脂肽a和b初提物对农业重要病原真菌的抑制作用
[0079]
将步骤2中制得的脂肽a和脂肽b的初提物(纯度对照图1)应用于拮抗主 要农业病原真菌,其试验结果如图5所示,阳性对照(pc)为制霉菌素,阴性 对照(nc)为培养基空白,处理(t)为脂肽a和b的初提物。该结果说明以脂 肽a和b为主要成份的初提物对包括稻瘟病、香蕉枯萎病、黄瓜枯萎病、炭疽 病等病原真菌有明显的拮抗作用。
[0080]
以上所述仅为本发明的部分实施例,并非因此限制本发明的保护范围,凡 是利用本发明说明书及附图内容所作的等效装置或等效流程变换,或直接或间 接运用在其他相关的技术领域,均同理包括在本发明的专利保护范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。