基于质谱法定量检测狂犬病疫苗中g蛋白含量的多肽序列及其应用
技术领域
1.本发明涉及生物工程技术领域,尤其涉及一种基于质谱法定量检测狂犬病疫苗中g蛋白含量的多肽序列及其应用。
背景技术:
2.狂犬病病毒抗原含量是狂犬病疫苗的主要质量指标之一,其中糖蛋白(g蛋白)是狂犬病毒唯一能诱导宿主产生中和抗体并与之结合的蛋白。狂犬病疫苗的保护效价主要由g蛋白起作用,一定程度上可以认为疫苗中g蛋白含量的高低决定了疫苗的保护效价。由于小鼠法效价测定反映的是疫苗的体内生物活性,eia方法能检测出产品中糖蛋白抗原相对含量,两种检测方法的结果在病毒抗原生物活性良好的条件下呈正相关性。因此,当前国内狂犬病疫苗的研制和生产中普遍采用小鼠法和eia方法,对疫苗的有效成分进行质量控制。
3.小鼠法包括病毒滴度测定、nih法效力测定等,其试验周期需要14~28天、实验动物的使用有严格的伦理制约、试验结果易受动物个体差异等不可控因素影响,因此该类方法测定结果稳定性差,存在明显的局限性。
4.eia方法是利用抗狂犬病病毒g蛋白单克隆抗体与g蛋白抗原特异结合的特点建立的检测方法,包括单向辐射状免疫扩散试验(srd)、酶联免疫吸附试验(elisa)和时间分辨免疫荧光分析(trfia)等。相比小鼠法,eia方法相对简便、快速、特异性强,且具有可相对定量检测等优点;但该类方法同样存在诸多缺点:
5.(1)抗体特异性无法覆盖狂犬病毒株,通常只能检测特定病毒株;
6.(2)抗原-抗体结合反应对试验条件要求苛刻,常需精确控制反应温度、时间;
7.(3)测定结果受缓冲液及样品组成成分影响,样品非抗原成分变化常导致试验发生偏离,无法准确评估工艺开发过程的抗原含量。
8.因此,结合上述情况,基于质谱分析的蛋白质平行反应监测(prm)定量技术,具有高灵敏度、高特异性、不依赖于抗体、可定量等特点,有望克服上述eia方法的缺点,开发用于测定狂犬病病毒g蛋白含量的定量检测方法具有重要意义,该方法有望成为区别于eia原理的新一代质控技术。
技术实现要素:
9.针对现有技术的不足,本发明所要解决的技术问题在于提供一种基于质谱法定量检测狂犬病疫苗中g蛋白含量的多肽序列,将其应用于质谱法定量检测狂犬病疫苗中g蛋白含量,能够提高狂犬病疫苗的质控水平。
10.为了解决上述技术问题,本发明提供了一种基于质谱法定量检测狂犬病疫苗中g蛋白含量的多肽序列,包括10个可重复检测的狂犬病病毒g蛋白的特异性多肽序列组,其氨基酸序列如下:
11.(1)vgyisaik;
12.(2)yeeslhnpypdyh;
13.(3)ttkesliiispsvtdldpydk;
14.(4)esliiispsvtdldpydk;
15.(5)lmdgtwvamqtsdetk;
16.(6)sdeiehlvveelvk;
17.(7)lvpgfgk;
18.(8)twneiipsk;
19.(9)mhpladpstvfk;
20.(10)egdeaedfvevhlpdvyk。
21.未来得到上述多肽序列,本发明提供了一种多肽序列的筛选方法,包括如下步骤:
22.(1)已灭活狂犬病病毒样本fasp酶解;
23.(2)lc-ms/ms(dda实验),采用软件进行数据分析,筛选重复出现、且质谱信号响应好的肽段,选定17个多肽序列;
24.(4)lc-ms/ms(prm实验);筛选特异性好、可重复出现的狂犬病病毒g蛋白的多肽序列,将上述筛选到的17个肽段序列信息导入软件中进行prm方法设置,狂犬病病毒g蛋白标准品取0.5μg肽段进行色谱分离;分离后的肽段直接进入质谱仪thermo scientific q exactive进行prm质谱检测;采用软件进行rpm实验数据分析,扣除背景、筛选出质谱信号响应好的肽段,最终得到如权利要求1中所述的10个多肽序列。
25.其中,所述步骤(1)中已灭活狂犬病病毒样本fasp酶解包括如下具体步骤:
26.(1)取3个不同批次含已灭活狂犬病病毒的样本:加入tcep置60℃反应1小时,加入mmts室温45分钟进行还原烷基化;
27.(2)将还原烷基化后的蛋白溶液加至10k超滤管中,4℃12000g离心20min;
28.(3)加入8m尿素(ph 8.5),4℃12000g离心20min,弃废液,重复2次;
29.(4)加入0.25m teab,4℃12000g离心20min,弃废液,重复3次;
30.(5)更换新的收集管,加入0.5m teab、胰蛋白酶(胰蛋白酶与蛋白质量比1:50),37℃过夜;
31.(6)次日加入胰蛋白酶(胰蛋白酶与蛋白质量比1:100),37℃反应4小时;12000g离心20min;
32.(7)酶解消化后的肽段溶液离心于收集管底部;向超滤管中加入0.5m teab,4℃12000g离心20min,收集管底部溶液与上步合并,得到酶解后的样品;
33.(8)将酶解后的样品真空抽干,以便进行下一步实验。
34.另外,为了提高狂犬病疫苗的质控水平,本发明还提供了一种基于质谱法定量检测狂犬病疫苗中g蛋白含量的方法,该方法选择所述的多肽序列为目标序列,采用狂犬病病毒g蛋白或灭活狂犬病病毒样本进行系列稀释作为标准品,采集目标序列的质谱信号,以“狂犬病病毒g蛋白浓度/含量-目标序列的质谱信号”建立坐标系,拟合线性回归方程,实现狂犬病病毒g蛋白的含量测定。
35.优选地,该方法中采用权利要求1中所述的多肽序列,制备重标定量肽作为内标物加至待测样本中,实现狂犬病病毒g蛋白含量的准确定量。
36.优选地,该方法包括如下具体步骤:
37.(1)样本和标准品的fasp酶解,所述标准品为狂犬病病毒g蛋白或灭活狂犬病病毒样本进行系列稀释所得的标准品;
38.(2)lc-ms/ms(prm实验):将样本和按照梯度稀释的标准品,加至进样杯中进行lc-ms/ms;
39.(3)实验完成后,对目标多肽序列中离子强度最高的3个二级子离子信号求和作为目标多肽序列的质谱离子强度信号值,将质谱数据导出进行数据分析,以狂犬病病毒g蛋白标准品溶液的浓度为横坐标,质谱离子强度信号值为纵坐标绘制标准曲线,得到线性拟合方程,将待测样本目标多肽序列的质谱离子强度信号值代入上述方程式中,结合样本上机测试溶液的浓度,根据样本预处理过程,计算出待测样本的狂犬病病毒g蛋白含量。
40.其中,所述步骤(1)中样品和标准品的fasp酶解具体为:
41.分别取200μg的标准品和待测样本(蛋白质含量157μg/ml,取1274μl进行酶解),加入4μl tcep,置60℃反应1小时,加入2μl mmts,室温反应45分钟进行还原烷基化;加至10k的超滤管中,4℃12000g离心20min;弃滤液,再加入8m尿素(ph 8.5)100μl,4℃12000g离心20min,弃废液,重复2次;加入0.25m teab 100μl,4℃12000g离心20min,弃废液,重复3次;更换新的收集管,在超滤管中加入50μl 0.5m teab,加入胰蛋白酶(胰蛋白酶与蛋白质量比1:50),37℃反应过夜;次日加入胰蛋白酶(胰蛋白酶与蛋白质量比1:100),37℃反应4小时,12000g离心20min,酶解消化后的肽段溶液离心于收集管底部;向超滤管中加入50μl 0.5m teab,4℃12000g离心20min,收集管底部溶液与上步合并,共得到酶解后的样品100μl,真空抽干。
42.其中,所述步骤(2)中lc-ms/ms(prm实验)具体为:
43.(1)在质谱仪(thermo scientific q exactive)软件xcalibur中进行prm方法设置,输入包括质荷比、电荷数、肽段序列、蛋白名称、时间在内的目标多肽序列信息;
44.(2)将标准品抽干的肽段用样品溶解液(0.1%甲酸、5%乙腈)200μl溶解,得浓度为1μg/μl的狂犬病病毒g蛋白标准品溶液储备液;分别吸取标准品溶液储备液5μl、7.5μl、10μl、12.5μl、15μl和20μl,补加样品溶解液至40μl,制成浓度125ng/μl、187.5ng/μl、250ng/μl、312.5ng/μl、375ng/μl和500ng/μl的标准品溶液,加至进样杯中进行lc-ms/ms,设置上机进样量为8μl/次;
45.(3)样本抽干的多肽用样品溶解液(0.1%甲酸、5%乙腈)200μl溶解,得浓度为1μg/μl的待测样本多肽溶液储备液;吸取该储备液12.5μl,加入样品溶解液27.5μl使其总体积为40μl,加至进样杯中进行lc-ms/ms,设置上机进样量为8μl/次。
46.本发明的技术方案相比于现有技术至少包含如下有益效果:
47.本发明的方案利用质谱技术筛选到了狂犬病病毒糖蛋白(g蛋白)的特异性多肽序列,其应用于狂犬病疫苗质控的定量检测,具体而言,本方法首先筛选出样品中g蛋白特异性的多肽序列,采用相应的重标定量肽、狂犬病病毒g蛋白或包含相应肽段序列的灭活狂犬病病毒样本进行系列稀释作为标准品,绘制标准曲线,利用质谱仪的平行反应监测(prm)技术,对预设目标肽段的检测信号进行分析,从而实现狂犬病病毒g蛋白的定量检测。该方法具有可扩展性,且灵敏度高、特异性强、不依赖于抗体、可定量检测,有望应用于狂犬病疫苗原液、成品的含量测定与质量评估。
附图说明
48.为了更清楚地说明本发明实施例的技术方案,下面将对实施例的附图作简单地介绍。
49.图1:重组狂犬病病毒g蛋白纯化图。其中,lanem:sds-page protein marker,lane1:包涵体溶解离心后上清,lane2:上清同ni-ida孵育后流出液,lane3:50mm imidazole的洗脱组分,lane4-9:300mm imidazole的洗脱组分。
50.图2:重组狂犬病病毒g蛋白鉴定图。其中,lanem:wester blot marker,lane1:重组狂犬病病毒g蛋白。
51.图3:狂犬病病毒g蛋白定量检测计算用标准曲线。
具体实施方式
52.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
53.实施例1:狂犬病病毒g蛋白稳定肽的筛选
54.1已灭活狂犬病病毒样本fasp酶解
55.(1)取3个不同批次含已灭活狂犬病病毒的样本:加入tcep置60℃反应1小时,加入mmts室温45分钟进行还原烷基化;
56.(2)将还原烷基化后的蛋白溶液加至10k超滤管中,4℃12000g离心20min;
57.(3)加入8m尿素(ph 8.5),4℃12000g离心20min,弃废液,重复2次;
58.(4)加入0.25m teab,4℃12000g离心20min,弃废液,重复3次;(5)
59.更换新的收集管,加入0.5m teab、胰蛋白酶(胰蛋白酶与蛋白质量比1:50),
60.37℃过夜;
61.(6)次日加入胰蛋白酶(胰蛋白酶与蛋白质量比1:100),37℃反应4小时;12000g离心20min;
62.(7)酶解消化后的肽段溶液离心于收集管底部;向超滤管中加入0.5m teab,4℃12000g离心20min,收集管底部溶液与上步合并,得到酶解后的样品;
63.(8)真空抽干。
64.2 lc-ms/ms(dda实验)
65.2.1实验内容
66.(1)流动相信息:
67.流动相a:0.1%甲酸,
68.流动相b:0.1%甲酸,80%acn
69.(2)色谱操作:
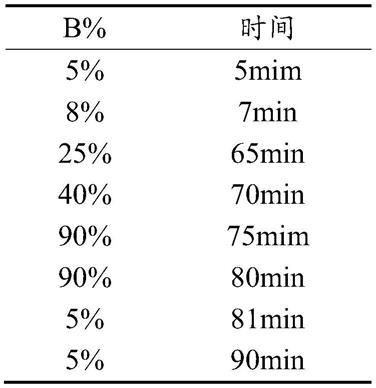
70.肽段用样品溶解液(0.1%甲酸、5%乙腈)溶解,充分振荡涡旋,13500rpm,4℃离心20min,上清转移到上样管中,每个样本做3个上机重复,每个样本取7μl进行二维液相色谱分离。洗脱条件如下,每个样本的分析时间为90min,流速为300nl/min。
[0071][0072]
(3)质谱参数:
[0073]
分离后的肽段直接进入质谱仪进行在线检测,具体参数如下:
[0074]
一级质谱参数:
[0075]
分辨率resolution:70,000
[0076]
最大离子强度agc target:3e6
[0077]
最大注入时间maximum it:60ms
[0078]
扫描范围scan range:350to 1800m/z
[0079]
二级质谱参数:
[0080]
分辨率resolution:17,500
[0081]
最大离子强度agc target:5e4
[0082]
最大注入时间maximum it:100ms
[0083]
母离子选择20个:topn:20
[0084]
碰撞能量nce/stepped nce:27
[0085]
2.2数据分析
[0086]
采用软件(skyline)进行数据分析,筛选重复出现、且质谱信号响应好的肽段;最终选定17个多肽序列,序列信息见表1。
[0087]
表1 dda筛选的可重复、信号响应好的多肽序列信息
[0088][0089]
3lc-ms/ms(prm实验)
[0090]
将上述筛选到的17个肽段序列信息导入软件(xcalibur)中进行prm方法设置。狂犬病病毒g蛋白标准品取0.5μg肽段进行色谱分离;分离后的肽段直接进入质谱仪thermo scientific q exactive进行prm质谱检测;采用软件进行rpm实验数据分析,扣除背景、筛选出质谱信号响应好的肽段,分别为:
[0091]
(1)vgyisaik(seq id no:3);
[0092]
(2)yeeslhnpypdyh(seq id no:4);
[0093]
(3)ttkesliiispsvtdldpydk(seq id no:5);
[0094]
(4)esliiispsvtdldpydk(seq id no:6);
[0095]
(5)lmdgtwvamqtsdetk(seq id no:7);
[0096]
(6)sdeiehlvveelvk(seq id no:8);
[0097]
(7)lvpgfgk(seq id no:9);
[0098]
(8)twneiipsk(seq id no:10);
[0099]
(9)mhpladpstvfk(seq id no:11);
[0100]
(10)egdeaedfvevhlpdvyk(seq id no:12)。
[0101]
实施例2:重组狂犬病病毒g蛋白的制备
[0102]
1基因合成与载体构建
[0103]
采用密码子优化软件maxcodontm optimization program(v13)对狂犬病病毒g蛋白的基因序列(序列表:seq id no.2)进行优化,然后通过全基因合成的方法合成该序列,通过限制性酶切位点ndei和hindiii将g蛋白基因插入到表达载体pet30a(kan )中,并通过
酶切法和测序确认最终表达载体的正确性。
[0104]
2狂犬病病毒g蛋白表达纯化与鉴定
[0105]
2.1表达载体转化与诱导表达
[0106]
将构建好的含有狂犬病病毒g蛋白基因的质粒转化到bl21(de3)感受态细胞中,然后均匀涂布lb平板上(含50μg/ml的硫酸卡那霉素),倒置于37℃培养箱过夜。从转化的平板中挑选单克隆,接种到4ml的lb培养基中(含50μg/ml的硫酸卡那霉素),待培养至od600为0.5-0.8,向试管培养液中加入终浓度0.2mm iptg,分别置于15℃、37℃诱导表达,并进行鉴定。
[0107]
2.2工程菌培养
[0108]
经分析鉴定,确认工程菌及其诱导表达条件。培养28l工程菌,待生长至od600为0.8,加终浓度0.2mm iptg,15℃诱导16h后收集菌体。
[0109]
2.3目标蛋白纯化
[0110]
经ni-ida亲和层析纯化分析,狂犬病病毒g蛋白表达在包涵体中,包涵体采用20mm pb(ph7.8),300mm nacl含1%triton x-100,2mm edta,5mm dtt洗涤后,以20mmpb(ph7.8),300mm nacl,8murea,20mm imidazole缓冲液溶解包涵体同时平衡ni-ida柱,最后用不同浓度咪唑的平衡缓冲液洗脱目标蛋白,并收集每个洗脱组分进行sds-page分析检测,结果参见附图1,收集lane 4-8,将其加入到处理后的透析袋中,4℃条件下,透析到缓冲液[1
×
pbs(ph7.8),4mm gsh,0.4mm gssg,0.4ml-arginine,1m urea,5%glycerol]中复性,复性后的g蛋白最终透析于储存液1
×
pbs(ph7.8),5%glycerol溶液约6-8h。透析复性结束后,上清用0.22μm滤器过滤后分装,并将其冻存至-80℃。
[0111]
2.5目标蛋白的鉴定
[0112]
取1.2μg纯化好的狂犬病病毒g蛋白(氨基酸序列:seq id no:1),经电泳、转膜、封闭,分别经一抗、二抗孵育,显影结果参见附图2:目标蛋白鉴定结果符合预期,可作为prm法检测狂犬病病毒g蛋白含量用标准品。
[0113]
实施例3:样本中狂犬病病毒g蛋白含量的检测
[0114]
1样本fasp酶解
[0115]
分别取200μg的标准品和待测样本(蛋白质含量157μg/ml,取1274μl进行酶解),加入4μl tcep,置60℃反应1小时,加入2μl mmts,室温反应45分钟进行还原烷基化;加至10k的超滤管中,4℃12000g离心20min;弃滤液,再加入8m尿素(ph 8.5)100μl,4℃12000g离心20min,弃废液,重复2次;加入0.25m teab 100μl,4℃12000g离心20min,弃废液,重复3次;更换新的收集管,在超滤管中加入50μl 0.5m teab,加入胰蛋白酶(胰蛋白酶与蛋白质量比1:50),37℃反应过夜;次日加入胰蛋白酶(胰蛋白酶与蛋白质量比1:100),37℃反应4小时,12000g离心20min,酶解消化后的肽段溶液离心于收集管底部;向超滤管中加入50μl 0.5m teab,4℃12000g离心20min,收集管底部溶液与上步合并,共得到酶解后的样品100μl,真空抽干。
[0116]
2prm操作步骤
[0117]
(1)在质谱仪(thermo scientific q exactive)软件xcalibur中进行prm方法设置,输入选定的目标多肽序列信息(以“sdeiehlvveelvk”为例),具体包括:质荷比、电荷数、肽段序列、蛋白名称、时间等。
[0118]
(2)将标准品抽干的肽段用样品溶解液(0.1%甲酸、5%乙腈)200μl溶解,得浓度为1μg/μl的狂犬病病毒g蛋白标准品溶液储备液;分别吸取标准品溶液储备液5μl、7.5μl、10μl、12.5μl、15μl和20μl,补加样品溶解液至40μl,制成浓度125ng/μl、187.5ng/μl、250ng/μl、312.5ng/μl、375ng/μl和500ng/μl的标准品溶液,加至进样杯中进行lc-ms/ms,设置上机进样量为8μl/次。
[0119]
(3)样本抽干的多肽用样品溶解液(0.1%甲酸、5%乙腈)200μl溶解,得浓度为1μg/μl的待测样本多肽溶液储备液;吸取该储备液12.5μl,加入样品溶解液27.5μl使其总体积为40μl,加至进样杯中进行lc-ms/ms,设置上机进样量为8μl/次。
[0120]
3prm结果计算
[0121]
实验完成后,对目标多肽序列中离子强度最高的3个二级子离子信号求和作为目标多肽序列的质谱离子强度信号值,将质谱数据导出进行数据分析。
[0122]
以狂犬病病毒g蛋白标准品溶液的浓度为横坐标,质谱离子强度信号值为纵坐标绘制标准曲线(图3),线性拟合方程为:
[0123]
y=(4.31e 07)x-(4.20e 09),r2=0.9933
[0124]
将待测样本目标多肽序列的质谱离子强度信号值代入上述方程式中,计算样本上机测试溶液的浓度为145ng/μl。
[0125]
根据样本预处理过程,可知待测样本的狂犬病病毒g蛋白含量为:
[0126]
即72.8μg/ml。
[0127]
结合上述实施例可以看出,本方法首先筛选出样品中g蛋白特异性的多肽序列,采用相应的重标定量肽、狂犬病病毒g蛋白或包含相应肽段序列的灭活狂犬病病毒样本进行系列稀释作为标准品,绘制标准曲线,利用质谱仪的平行反应监测(prm)技术,对预设目标肽段的检测信号进行分析,从而实现狂犬病病毒g蛋白的定量检测。该方法具有可扩展性,且灵敏度高、特异性强、不依赖于抗体、可定量检测,有望应用于狂犬病疫苗原液、成品的含量测定与质量评估。
[0128]
以上所揭露的仅为本发明的较佳实施例而已,当然不能以此来限定本发明之权利范围,因此依本发明权利要求所作的等同变化,仍属本发明所涵盖的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。