1.本发明属于生物医用材料技术领域,具体涉及一种有效保护药物活性的透皮给药微针。
背景技术:
2.随着科技的进步,新药和生物制药的发展如火如荼,用于实现最佳治疗效果的药物递送系统的开发在制药、生物技术和医学界受到越来越多的关注。研究人员一直在探索各种通过不同途径将药物输送到体内的输送系统,以实现疾病的局部和系统预防和治疗。目前,最常见的药物输送方式是口服和注射,口服给药起效慢、药物利用率不高;注射使用硬质针头会产生出血和疼痛。
3.为了将药物送入体内循环,同时避免疼痛反应,微针透皮给药技术提供了一个有力的选择。市面上也有金属材料和硅材料微针给药的产品。但是,金属和硅的生物相容性较差,发生断裂容易造成皮肤损伤。与机体相容性更高的聚合物微针是更为合适的选择。
4.cn 110812688 a公开了一种透皮给药的微针及其制备方法,通过制备微针针体溶液、微针基底溶液、构建微针针体、构建微针基底步骤制备得到,其原料安全性高、生物相容性好,在机体中可降解,在保证具有较好的机械性能的同时,还可以实现对微针基底负载的各种活性药物的有序控释,减少活性药物损失,显著提高药物疗效。
5.cn 110882209 a提供了一种石墨烯透皮给药微针,基材为具有生物相容性的有机高分子聚合物,有机高分子聚合物选自聚乙烯吡咯烷酮、聚乙烯醇、透明质酸、聚乳酸羟基乙酸共聚物、羧甲基纤维素中的一种;石墨烯材料为石墨烯或者经化学、物理方法处理的石墨烯中的一种。该发明的石墨烯透皮给药微针具有很好的机械性能,微针容易穿透角质层;具有很好的控制药物释放的能力,且可通过红外光的方式控制药物释放。
6.现有技术中的聚合物微针中,药物负载一般负载在聚合物微针上;可溶性聚合物微针则是药物与针体原料共混。基于药物容易失去活性导致微针失效,提供一种有效保护药物活性的透皮给药微针是很有必要的。
技术实现要素:
7.有鉴于现有技术的缺陷,本发明所要解决的技术问题是:(1)提供一种具有微创、安全、高效等优点的透皮给药微针;(2)提高透皮给药微针药物释放率、提高药物利用率、有效保护药物活性。
8.目前市场上常见的微针普遍存在断裂和生物相容性等问题,这也是目前微针之所以没有大批量地投入市场应用的最大挑战。众多的微针设计中,可溶性微针只要能够保证其具有一定的力学强度,使其顺利刺入皮肤中,即使尖端发生断裂也不会造成残留,对皮肤造成任何危害和损伤,与人体相容性更高的可溶性微针可能是最符合市场需求的选择。微针结构主要由衬底和针体组成,基于现有的生物性相容性材料,衬底和针体的材料主要为聚乙烯吡咯烷酮、聚乙烯醇、透明质酸、羧甲基纤维素钠、聚乳酸-羟基乙酸共聚物。它们安
全无刺激,与人体作用时能快速被吸收,已经取得了较好的效果。因此。作为微针主体结构的生物性相容性材料无需做过多选择,加入功能性的物质提高药物的释放率、利用率、保护药物的活性应该为研究的重点方向。
9.选择适当的材料对药物进行负载有益于提高药物的稳定性、保护药物的活性。发明人在大量的试验中发现,微针贴合在皮肤上时大量药物进入血流,随着药物的释放,导致贴合前后血液中药物浓度变化量很大,血液中高浓度的药物可能会对肝、肾等器官造成较大的毒副作用。同时,一些神经退性疾病需要根据行为来给药。开发出药物释放可控的透皮给药微针是提高药物的利用率和改善治疗效果的有效途径。为此,发明人在针体材料中加入近红外材料并将其作为药物的载体,依托近红外材料的光触发作用选择性驱动给药的释放速度。
10.为了实现上述目的,本发明提供了一种有效保护药物活性的透皮给药微针,由衬底材料和针体材料组成;所述的衬底材料为生物相容性的有机高分子聚合物的水溶液制备而成;所述的针体材料为分散有药物活性成分的生物相容性的有机高分子聚合物的水溶液制备而成。
11.优选的,所述的衬底材料和针体材料中的生物相容性的高分子聚合物的水溶液的浓度各自独立地为10~40wt.%。
12.优选的,所述的衬底材料和针体材料中的生物相容性的高分子聚合物各自独立地为聚乙烯吡咯烷酮、聚乙烯醇、透明质酸、羧甲基纤维素钠中一种。
13.所述的针体材料中药物活性成分的浓度为30~50mg/ml。
14.所述的药物活性成分的制备方法为:将药物与水搅拌混合,加入近红外材料,搅拌反应,离心收集不溶物,洗涤、干燥,得到药物活性成分。
15.具体的,所述的药物活性成分的制备方法,以重量份计为:将0.2~0.5份药物与100~120份水在转速300~500rpm搅拌混合10~20min,加入0.2~0.5份近红外材料,搅拌反应16~24h,过滤收集不溶物,洗涤、干燥,得到药物活性成分。
16.所述的近红外材料为纳米过渡金属氧化物、纳米过渡金属硫化物、纳米聚多巴胺、纳米载过渡金属的聚多巴胺、改性纳米载过渡金属的聚多巴胺中的一种。
17.所述的药物为具有功能性治疗疾病的物质。
18.聚多巴胺具有优异的生物相容性、生物降解性和光热稳定性,具有宽广波长范围的光吸收性能。聚多巴胺存在于人体,与其他的近红外材料相比有得天独厚的优势。基于表面存在大量的氨基和羟基,聚多巴胺对过渡金属有很好的亲和能力。一些研究也表明,在聚多巴胺表面引入过渡金属元素能提高光热转换效率。然而,发明人在生产实践中发现,过渡金属的引入容易引起原本高分散的聚多巴胺发生团聚,这可能会降低聚多巴胺与药物之间的作用,降低有效的光热转换。发明人发现在制备过程中引入一定的稀土金属元素,能抑制团聚作用的发生,还能进一步提高光热转换效率。
19.优选的,所述的近红外材料为纳米载过渡金属的聚多巴胺,其制备方法为:将盐酸多巴胺、可溶性过渡金属盐、乙醇的水溶液搅拌混合,加入氨水,搅拌反应8~16h;离心收集不溶物,洗涤、干燥,得到纳米载过渡金属的聚多巴胺。
20.具体的,所述的纳米载过渡金属的聚多巴胺的制备方法为,以重量份计:将0.1~0.3份盐酸多巴胺、0.1~0.2份可溶性过渡金属盐、100~150份50~75wt.%乙醇的水溶液
在转速300~500rpm混合10~20min,加入1.5~3份氨水,搅拌反应8~16h;离心收集不溶物,洗涤、干燥,得到纳米载过渡金属的聚多巴胺。
21.优选的,所述的近红外材料为改性纳米载过渡金属的聚多巴胺,其制备方法为:将盐酸多巴胺、可溶性过渡金属盐、可溶性稀土金属盐、乙醇的水溶液搅拌混合,加入氨水,搅拌反应8~16h;离心收集不溶物,洗涤、干燥,得到纳米载过渡金属的聚多巴胺。
22.具体的,所述的改性纳米载过渡金属的聚多巴胺的制备方法为,以重量份计:将0.1~0.3份盐酸多巴胺、0.08~0.16份可溶性过渡金属盐、0.02~0.04份可溶性稀土金属盐、100~150份50~75wt.%乙醇的水溶液在转速300~500rpm混合10~20min,加入1.5~3份氨水,搅拌反应8~16h;离心收集不溶物,洗涤、干燥,得到纳米载过渡金属的聚多巴胺。
23.羟丙基-β-环糊精可包络各种化合物分子,不仅能作为药物载体,还能增加被包络物对光热、氧的稳定性。发明人用羟丙基-β-环糊精对近红外材料修饰以提高对药物的保护,并进一步将羟丙基-β-环糊精进行交联改性,不仅提高了对药物活性的保护,还提高了药物的负载效果。
24.进一步优选的,所述的近红外材料为羟丙基-β-环糊精修饰改性纳米载过渡金属的聚多巴胺或交联羟丙基-β-环糊精修饰改性纳米载过渡金属的聚多巴胺中的一种。
25.所述的羟丙基-β-环糊精修饰改性纳米载过渡金属的聚多巴胺的制备方法为:将盐酸多巴胺、可溶性过渡金属盐、可溶性稀土金属盐、乙醇的水溶液搅拌混合,加入氨水,搅拌反应8~16h;离心收集不溶物,洗涤、干燥,得到纳米载过渡金属的聚多巴胺;将纳米载过渡金属的聚多巴胺、羟丙基-β-环糊精、水搅拌混合,升温搅拌反应,自然冷却,过滤、洗涤、干燥,得到羟丙基-β-环糊精修饰改性纳米载过渡金属的聚多巴胺。
26.具体的,所述的羟丙基-β-环糊精修饰改性纳米载过渡金属的聚多巴胺的制备方法,以重量份计为:将0.1~0.3份盐酸多巴胺、0.08~0.16份可溶性过渡金属盐、0.02~0.04份可溶性稀土金属盐、100~150份乙醇的水溶液在转速300~500rpm混合10~20min,加入1.5~3份氨水,搅拌反应8~16h;离心收集不溶物,洗涤、干燥,得到纳米载过渡金属的聚多巴胺;将2~3份改性纳米载过渡金属的聚多巴胺、0.2~0.5份羟丙基-β-环糊精、100~120份水在转速300~500rpm混合10~20min,升温至60~80℃搅拌反应3~6h,自然冷却,过滤、洗涤、干燥,得到羟丙基-β-环糊精修饰改性纳米载过渡金属的聚多巴胺。
27.所述的交联羟丙基-β-环糊精修饰改性纳米载过渡金属的聚多巴胺的制备方法为:将盐酸多巴胺、可溶性过渡金属盐、可溶性稀土金属盐、乙醇的水溶液搅拌混合,加入氨水,搅拌反应8~16h;离心收集不溶物,洗涤、干燥,得到纳米载过渡金属的聚多巴胺;将纳米载过渡金属的聚多巴胺、交联羟丙基-β-环糊精、水搅拌混合,升温搅拌反应,自然冷却,过滤、洗涤、干燥,得到羟丙基-β-环糊精修饰改性纳米载过渡金属的聚多巴胺。
28.具体的,所述的羟丙基-β-环糊精修饰改性纳米载过渡金属的聚多巴胺的制备方法,以重量份计为:将0.1~0.3份盐酸多巴胺、0.08~0.16份可溶性过渡金属盐、0.02~0.04份可溶性稀土金属盐、100~150份乙醇的水溶液在转速300~500rpm混合10~20min,加入1.5~3份氨水,搅拌反应8~16h;离心收集不溶物,洗涤、干燥,得到纳米载过渡金属的聚多巴胺;将2~3份纳米载过渡金属的聚多巴胺、0.2~0.5份交联羟丙基-β-环糊精、100~120份水在转速300~500rpm混合10~20min,,升温至60~80℃搅拌反应3~6h,自然冷却,过滤、洗涤、干燥,得到羟丙基-β-环糊精修饰改性纳米载过渡金属的聚多巴胺。
29.优选的,所述的交联羟丙基-β-环糊精的制备方法为:将2-丙烯酰胺基2-甲基丙烷磺酸、羟丙基-β-环糊精、n,n'-亚甲基双丙烯酰胺、水在搅拌下混合,加入过硫酸铵,升温回流反应,自然冷却,过滤、洗涤、干燥得到交联羟丙基-β-环糊精。
30.具体的,所述的交联羟丙基-β-环糊精的制备方法为,以重量份计,将2~3份2-丙烯酰胺基2-甲基丙烷磺酸、1~2份羟丙基-β-环糊精、2~3份n,n'-亚甲基双丙烯酰胺、100~150份水在搅拌下混合,加入0.1~0.3份过硫酸铵,升温至65~80℃,回流反应4~6h,自然冷却,过滤、洗涤、干燥,得到交联羟丙基-β-环糊精。
31.优选的,所述的可溶性过渡金属盐为铁、锰、铜、锌的可溶性盐中的至少一种。
32.所述的可溶性稀土金属盐为铈、镧、钇、镱的可溶性盐中的至少一种。
33.本发明还提供了上述的有效保护药物活性的透皮给药微针的制备方法,包括以下步骤:
34.s1称取各原料及配制所需的溶液;
35.s2将针体材料倒入微针模具,离心使得针体材料填充至模具底部;将衬底材料浇注至模腔中形成透皮给药微针的衬底,随后干燥脱模得到所述有效保护药物活性的透皮给药微针。
36.优选的,所述的离心速度为9000~13000rpm,时间为10~15min。
37.所述针体材料离心后完全填充模具的1/2~3/4。
38.所述的干燥条件为,在相对湿度10~20%、温度为40~60℃下,保持12~15h。
39.所述的衬底材料干燥后的厚度为0.5~1mm。
40.本发明的有益效果:
41.本发明将过渡金属元素载入聚多巴胺并进一步以稀土元素对其改性,制备了光热转化效率更高的近红外材料;用羟丙基-β-环糊精或交联羟丙基-β-环糊精对所得的近红外材料进行修饰,显著增强了多药物的固载作用。本发明制备的微针能有效保护药物的活性,药物保存后有效成分保持率高;微针力学性能高,可以穿透人体皮肤。
具体实施方式
42.本发明实施例中使用的部分原料及材料介绍:
43.聚乙烯吡咯烷酮、左旋多巴、盐酸多巴胺均购于上海阿拉丁生化科技有限公司。
44.氨水,浓度28%购于国药基团化学试剂有限公司。
45.其余未提及的化学试剂均为本领域常用试剂,级别为分析纯或分析纯以上。
46.微针模具,为聚甲基丙烯酸甲酯微针模板,主模10
×
10的金字塔状针形结构,微针底边距为250μm,微针高度600μm,针尖距离为550μm。
47.实施例1
48.一种有效保护药物活性的透皮微针,制备方法如下:
49.s1称取聚乙烯吡咯烷酮、药物活性成分、水,配置30wt.%聚乙烯吡咯烷酮水溶液;将药物活性成分与30wt.%聚乙烯吡咯烷酮水溶液在300rpm下搅拌10min获得浓度为50mg/ml的针体材料;
50.s2将步骤s1所得的针体材料倒入微针模具,以10000rpm转速离心10min,使得针体材料填充至模具底部占得模具针尖体积的1/2;将30wt.%聚乙烯吡咯烷酮水溶液浇注至模
腔中形成透皮给药微针的衬底,随后,将模具转移至相对湿度20%、温度50℃下干燥12h,脱模得到透皮给药微针,最终所得的透皮给药微针的衬底厚度为1mm。
51.所述的药物活性成分制备方法为:将0.2g左旋多巴与100g水在转速300rpm搅拌混合10min,加入0.5g近红外材料,搅拌反应24h,过滤收集不溶物,用水洗涤3次、在40℃下干燥12h,得到药物活性成分。
52.所述的近红外材料为纳米载过渡金属的聚多巴胺,其制备方法为:将0.3g盐酸多巴胺、0.2g六水合硝酸铜、100g 75wt.%乙醇的水溶液在转速300rpm混合10min,加入2g氨水,搅拌反应12h;8000rpm离心15min收集不溶物,用水洗涤3次,在80℃干燥5h,得到纳米载过渡金属的聚多巴胺。
53.实施例2
54.一种有效保护药物活性的透皮微针,制备方法同实施例1;唯一区别之处仅仅在与所用的近红外材料为改性纳米载过渡金属的聚多巴胺。
55.所述的改性纳米载过渡金属的聚多巴胺的制备方法为:将0.3g盐酸多巴胺、0.16g六水合硝酸铜、0.04g六水合三氯化钇、100g 75wt.%乙醇的水溶液在转速300rpm混合10min,加入2g氨水,搅拌反应12h;8000rpm离心15min收集不溶物,用水洗涤3次,在80℃干燥5h,得到改性纳米载过渡金属的聚多巴胺。
56.实施例3
57.一种有效保护药物活性的透皮微针,制备方法同实施例1;唯一区别之处仅仅在与所用的近红外材料为羟丙基-β-环糊精修饰改性纳米载过渡金属的聚多巴胺。
58.所述的羟丙基-β-环糊精修饰改性纳米载过渡金属的聚多巴胺的制备方法为:将0.3g盐酸多巴胺、0.16g六水合硝酸铜、0.04g六水合三氯化钇、100g 75wt.%乙醇的水溶液在转速300rpm混合10min,加入2g氨水,搅拌反应12h;8000rpm离心15min收集不溶物,用水洗涤3次,在80℃干燥5h,得到改性纳米载过渡金属的聚多巴胺;将0.3g改性纳米载过渡金属的聚多巴胺、0.2g羟丙基-β-环糊精、100g水在转速300rpm混合10min,升温至75℃搅拌反应6h,自然冷却,过滤,用水洗涤3次、在80℃干燥5h,得到羟丙基-β-环糊精修饰改性纳米载过渡金属的聚多巴胺。
59.实施例4
60.一种有效保护药物活性的透皮微针,制备方法同实施例1;唯一区别之处仅仅在与所用的近红外材料为交联羟丙基-β-环糊精修饰改性纳米载过渡金属的聚多巴胺。
61.所述的交联羟丙基-β-环糊精修饰改性纳米载过渡金属的聚多巴胺的制备方法为:将0.3g盐酸多巴胺、0.16g六水合硝酸铜、0.04g六水合三氯化钇、100g 75wt.%乙醇的水溶液在转速300rpm混合10min,加入2g氨水,搅拌反应12h;8000rpm离心15min收集不溶物,用水洗涤3次,在80℃干燥5h,得到改性纳米载过渡金属的聚多巴胺;将0.3g改性纳米载过渡金属的聚多巴胺、0.2g交联羟丙基-β-环糊精、100g水在转速300rpm混合10min,升温至75℃搅拌反应6h,自然冷却,过滤,用水洗涤3次、在80℃干燥5h,得到交联羟丙基-β-环糊精修饰改性纳米载过渡金属的聚多巴胺。
62.所述的交联羟丙基-β-环糊精的制备方法为:将2g 2-丙烯酰胺基2-甲基丙烷磺酸、1g羟丙基-β-环糊精、3g n,n'-亚甲基双丙烯酰胺、150g水在350rpm搅拌下混合30min,加入0.2g过硫酸铵,升温至80℃,回流反应6h,自然冷却,过滤、用水洗涤3次、在80℃干燥
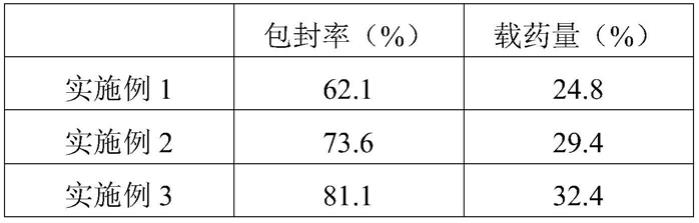
5h,得到交联羟丙基-β-环糊精。
63.对比例1
64.一种有效保护药物活性的透皮微针,制备方法同实施例1;唯一区别之处仅仅在与所用的近红外材料为聚多巴胺,其制备方法为:将0.5g盐酸多巴胺100g 75wt.%乙醇的水溶液在转速300rpm混合10min,加入2g氨水,搅拌反应12h;8000rpm离心15min收集不溶物,用水洗涤3次,在80℃干燥5h,得到纳米载过渡金属的聚多巴胺。
65.测试例1
66.本发明通过远红外材料负载药物,作为透皮给药微针的药物活性成分,远红外材料对药物的负载作用是很重要的评价指标。用高效液相色谱测试了本发明制备的远红外材料对药物的包封率和载药量,包封率和载药量分别通过下述式子计算:
67.包封率=(初始药物的质量-反应结束后液相中的药物质量)/初始药物的质量
×
100%;
68.载药量=(初始药物的质量-反应结束后液相中的药物质量)/远红外材料的质量
×
100%。
69.结果如表1所示。
70.表1包封率和载药量结果
[0071][0072][0073]
从表1的测试结果,对比实施例1和对比例1可以看出,通过在聚多巴胺上负载金属铜降低了对左旋多巴的包封率和载药量。这是因为金属铜的负载引起了聚多巴胺的团聚,降低了聚多巴胺表面与左旋多巴结合的位点。值得注意的是,加入稀土元素钇后,包封率和载药量明显上升,这可能是因为钇的引入降低了聚多巴胺对铜的螯合作用,降低了聚多巴胺的团聚。实施例3加入羟丙基-β-环糊精对改性纳米载过渡金属的聚多巴胺进行修饰,增多了表面的结合位点,引入了更多的官能团,进一步提高了左旋多巴和聚多巴胺的结合率。实施例4加入交联羟丙基-β-环糊精修饰改性纳米载过渡金属的聚多巴胺,对左旋多巴具有最好的结合性能,这可能是因为交联羟丙基-β-环糊精可以与聚多巴胺发生一定的相互作用,增加材料的比表面积和结合位点,引入了更多更稳定的官能团。
[0074]
将本发明制备的远红外材料与水混合以300rpm搅拌30min;配置成浓度为200μg/ml的分散液,以808nm近红外光(功率1.6w/cm2)照射5min通过红外热传感设备测量了远红外材料分散液的温度变化和光热图像,计算出光热转换效率,结果如表2所示。
[0075]
表2光热转换效率结果
[0076] 光热转换效率(%)实施例143.21实施例252.36实施例351.22实施例452.34对比例141.21
[0077]
从表2的测试结果可以看出,引入铜元素可以提高聚多巴胺的光热转换效率,但并不显著。实施例2具有最高的光热转换效率这是因为钇的引入降低了聚多巴胺对铜的螯合作用,降低了聚多巴胺的团聚,增强了对光热的利用率。实施例3和实施例4相对于实施例2,光热转换效率没有明显变化,这表明羟丙基-β-环糊精和交联羟丙基-β-环糊精修饰后不会降低改性纳米载过渡金属的聚多巴胺的光热转换效率。
[0078]
测试例2
[0079]
通过纳米压痕测试,对本发明制备透皮给药微针的力学性能进行分析,对微针的针头施以50mn力,测试出微针针尖的一个加载、卸载循环过程的载荷位移结果如表3所示。
[0080]
表3压缩型变量结果
[0081][0082]
有研究表明最小刺入人体皮肤的压力为10mn。从表3的结果可以看出本发明制备的透皮微针在50mn的荷载下形变都低于10μm,这表明本发明制备的透皮微针有足够的力学强度可以刺入人体皮肤。其中实施例4制备的微针压缩型变量最低,这可能是因为铜、钇的引入增强了聚多巴胺的强度,羟丙基-β-环糊精的修饰与聚多巴胺具有一定的相互作用,进一步提高了微针的强度。
[0083]
将本发明制备的透皮微针分为两组每组3个,一组溶于水用高效液相色谱测试得到初始浓度,另一组在相对湿度50%、40℃环境中保持14天,测试保存后的浓度,计算药物的含量保持率。
[0084]
表4药物的含量保持率结果
[0085]
ꢀꢀ
保持率(%)实施例172.1实施例273.4实施例378.1
实施例484.4对比例162.3
[0086]
从表4的测试结果可以看出本发明实施例4制备的透皮微针能有效保护药物的活性。这可能是因为交联羟丙基-β-环糊精可以与聚多巴胺发生一定的相互作用,增加材料的比表面积和结合位点,引入了更多更稳定的官能团,使得药物在透皮微针中更为稳定。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。