1.本发明属于生物材料技术领域,具体涉及一种与血细胞膜结合的脂质体药物载体及其制备方法和用途。
背景技术:
2.由于广谱疏水性化疗药的非靶向释放,使用该类药物的常规化疗通常会引起严重的毒副作用(脱发、消化道反应、心脏毒性和神经系统损伤),并且缺少肿瘤靶向性,从而导致治疗效果不理想。近年来,载药纳米粒、脂质体和微球等新型微粒给药系统因其负载效率高、释放行为可控等显著优势而受到越来越多的关注,但其半衰期短,所需剂量高,同时作为外源性物质而造成给药后易被人体免疫系统清除,生物利用率低。血细胞存在于血液,随血液的流动遍及全身,其数量多。以人体自身血细胞作为新型的药物递送载体,有望有效地避免机体免疫系统的清除功能,提高生物利用率,同时提高半衰期达到低给药浓度实现好治疗效果的目的。
3.红细胞(red blood cell,rbc)作为内源性血细胞,能提高免疫逃避能力,具有高生物利用度、良好生物相容性和较长循环寿命(在小鼠和人类中分别为45天和120天)的优点。同时,红细胞的特殊形状和几何形状(高表面积与体积比)以及它们的膜结构和成分使它们拥有极强的变形能力和耐用性。此外,红细胞是血液中最丰富的血细胞,获取容易。因此,红细胞是一种极具吸引力和应用前景的新型药物递送系统。
4.目前以血细胞载药的方法包括:通过电穿孔、低渗、内吞等方式将药物或载药载体直接包封于血细胞内部;二是通过偶联等方式将载药载体连接于血细胞膜表面或与血细胞膜融合。例如1981年,denmark团队与pedro cabrales团队将多柔比星(doxorubicin,dox)分别通过dox溶液与红细胞孵育和电穿孔的方式将dox跨膜运输至细胞内部。但是,现有方法存在一些局限:直接将药物包封于细胞内时,在制备与递送过程中都存在相应的缺陷,例如现有多项研究表明药物本身的生物毒性对于机体的各个健康组织与器官都有实质性的损害,因此对于血细胞也可能存在较大损伤,使血细胞丧失功能,同时疏水性药物由于其脂溶性特征,会导致其溶解性大大降低,大幅度削弱其治疗效果;载药载体通过偶联或电穿孔方式的容易改变血细胞原本的膜结构,很难保证药物释放效率,此外易使红细胞溶血而导致递送效率降低,同时导致细胞结构与功能完整性受到损害、易被体内免疫系统清除而无法实现长时间的循环递送。文献《a splenic-targeted versatile antigen courier:ipsc wrapped in coalescent erythrocyte-liposome as tumor nanovaccine》公开了使用红细胞膜融合甘露糖脂质体。专利jp5571706b2公开了脂质体与红细胞融合将其内容物运输到细胞中。但目前与红细胞融合的方法基本是先提取红细胞血影,再去载药,红细胞失去活性,无法拥有长循环时间。上述存在的问题使红细胞载药在临床应用受到限制,如何利用活的血细胞载药,不失去血细胞活性和功能,提高药物利用率,对于血细胞载药递送系统的研究具有重要意义。
技术实现要素:
5.本发明的目的是提供一种与血细胞膜结合的脂质体药物载体及其制备方法和用途。
6.本发明提供了一种与血细胞膜结合的脂质体药物载体,它是脂质体与血细胞混合后而得;所述脂质体粘附于血细胞膜表面或脂质体与血细胞膜融合。
7.进一步地,所述脂质体药物载体是脂质体与血细胞共同孵育后而得;
8.优选地,所述孵育的时间为1~6小时;和/或,所述孵育温度为2~40℃;
9.更优选地,所述孵育时间为4小时;和/或,所述孵育温度为37℃。
10.进一步地,所述血细胞为红细胞或血小板;
11.优选地,所述血细胞为红细胞。
12.进一步地,所述脂质体与血细胞孵育时,脂质体浓度为1~6μmol,血细胞个数为1~6
×
108;
13.优选地,所述脂质体与血细胞孵育时脂质体浓度为2μmol,血细胞个数为3
×
108。
14.进一步地,所述脂质体由黄卵磷脂、1-棕榈酰基-2-油酰基卵磷脂、大豆磷脂、二棕榈酰磷脂酰胆碱、二油酰基卵磷脂、二油酰磷脂酰乙醇胺、二油酰基卵磷脂、二硬脂酰基磷脂酰胆碱中的一种、两种或三种以上原料与胆固醇混合后,采用薄膜水化法制备而得;
15.优选地,所述脂质体由如下重量配比的原料制备而成:二棕榈酰磷脂酰胆碱50~60份、胆固醇1~5份;
16.或者,所述脂质体由如下重量配比的原料制备而成:二棕榈酰磷脂酰胆碱40~50份、二油酰磷脂酰乙醇胺10~20份、胆固醇1~5份;
17.更优选地,所述脂质体由如下重量配比的原料制备而成:二棕榈酰磷脂酰胆碱59.5份、胆固醇3.5份;
18.或者,所述脂质体由如下重量配比的原料制备而成:二棕榈酰磷脂酰胆碱46.2份、二油酰磷脂酰乙醇胺13.4份、胆固醇3.5份。
19.进一步地,所述脂质体的制备方法包括如下步骤:
20.(1)按重量配比,将制备脂质体的原料溶于有机溶剂中,采用薄膜法真空旋蒸;
21.(2)将步骤(1)制备得到的薄膜水化,即得;
22.优选地,
23.步骤(1)中,所述有机溶剂选自甲醇、三氯甲烷、乙醇或异丙醇;
24.和/或,步骤(1)中,所述薄膜法真空旋蒸的温度为30-70℃;
25.和/或,步骤(1)中,所述薄膜法真空旋蒸的时间为10-60min;
26.和/或,步骤(2)中,所述水化使用的溶剂为pbs或hepes;
27.和/或,步骤(2)中,所述水化温度为37-70℃;
28.和/或,步骤(2)中,所述水化时间为30-60min;
29.和/或,步骤(2)中,所述水化后产物依次过孔径为0.4μm、0.2μm和0.1μm的聚碳酸脂膜3-5次;
30.更优选地,步骤(2)中,所述水化使用的溶剂为ph=7.4的磷酸盐缓冲液。
31.本发明还提供了一种前述的与血细胞膜结合的脂质体药物载体的制备方法,它包括如下步骤:
32.1)配置脂质体溶液,将脂质体溶液与血细胞混合孵育;
33.2)将孵育后的产物离心,去上清即得;
34.优选地,步骤1)中,所述脂质体溶液的溶剂为pbs缓冲液;
35.和/或,步骤1)中,所述孵育的时间为1~6小时;和/或,所述孵育温度为2~40℃;
36.和/或,步骤2)中,所述离心条件为3500~5000g离心10~30min;
37.更优选地,步骤1)中,所述孵育时间为4小时;和/或,所述孵育温度为37℃。
38.本发明还提供了前述的与血细胞膜结合的脂质体药物载体在制备药物载体制剂中的用途;
39.优选地,所述药物载体制剂是由前述的与血细胞膜结合的脂质体药物载体载药后而得;
40.更优选地,所述药物为抗肿瘤、抗菌、抗炎、抗过敏、抗病毒药物;
41.进一步地优选地,所述药物为紫杉醇、地塞米松、多柔比星。
42.本发明还提供了一种药物制剂,它是由前述的与血细胞膜结合的脂质体药物载体载药后而得;
43.优选地,所述载药的方法为在制备脂质体时加入药物制备载药脂质体,然后载药脂质体与血细胞按照前述方法制备而得;
44.更优选地,所述药物为抗肿瘤、抗菌、抗炎、抗过敏、抗病毒药物;
45.进一步地优选地,所述药物为紫杉醇、地塞米松、多柔比星。
46.本发明还提供了一种药物组合物,它包括前述的药物制剂。
47.本发明中,药物载体制剂是一种新型药物制剂,即药物载体载药后形成的制剂。本发明药物制剂可以根据载药的类型,制备成抗肿瘤、抗菌、抗炎、抗过敏、抗病毒药物制剂。
48.与现有技术相比,本发明的有益效果在于:
49.本发明制备了与血细胞膜结合的脂质体药物载体,该脂质体药物载体可载不同种类的药物,其对药物的包封率和载药量均较高,可以有效地提高药物的递送效率。同时,本发明药物载体将脂质体与具有生物活性的血细胞的细胞膜相结合,结合后血细胞仍然可以保持完整的形态和良好的活性与功能,可有效延长药物半衰期,更好的避免自身免疫系统的清除,实现以更低的药物剂量达到更有效的药物缓释、临床治疗效果,具有良好的应用前景。
50.传统抗癌药物紫杉醇进行治疗,通常直接将紫杉醇注射液注入0.9%氯化钠溶液中,以静脉滴注的方式给药,往往会因组胺的释放而引发面部发红、恶心呕吐、皮疹等诸多不良反应,难以有效改善患者的综合生活质量,疗效不佳;随后出现的紫杉醇脂质体疗法采用紫杉醇脂质体进行治疗,将紫杉醇脂质体用5%的葡萄糖溶液注入振荡器震摇至充分溶解后再注入500ml的5%葡萄糖溶液,以静脉滴注的方式给药,其能够在一定程度上改善药物的溶解性、延长药物的药理作用,同时降低不良反应发生率以及传统紫杉醇的神经毒性,有利于强化患者机体的耐受力,进一步提高治疗效果,但脂质体作为外源药物容易被体内自身的免疫系统攻击、清除,导致利用率低。
51.因此为了提高紫杉醇在体内的循环时间,避免其被体内免疫系统击杀,提高其利用率和治疗效果,本发明研究了一种新的药物载体,提出一种新的给药方式,先抽取20-50ml病人的血液,通过离心法,获得红细胞,然后将紫杉醇脂质体与红细胞共同孵育,脂质
体与红细胞膜结合,从而使红细胞负载紫杉醇,将红细胞回输注入患者体内,达到避免被机体免疫系统清除、延长半衰期、减少给药剂量、获得良好治疗效果的目的,同时利用脂质体和红细胞结合方式还可以实现靶向给药,可减少紫杉醇的用药剂量和耐药情况的发生。通过控制脂质体与红细胞的孵育时间,可以得到两种脂质体与红细胞膜结合的方式,分别是粘附和融合,当脂质体粘附在红细胞膜表面时,红细胞变形通过毛细血管时发生挤压现象,脂质体脱落并滞留在毛细血管,可以实现靶向性给药。当脂质体与红细胞膜发生融合后,药物通过红细胞在血管里流动而释放,半衰期大大延长。膜融合过程将脂质体对细胞膜的不利影响降到最小、保持细胞原有状态的完整性、更好的避免自身免疫系统的清除,实现以更低的药物剂量达到更有效的药物缓释、临床治疗优化的条件把控与技术途径。
52.显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。
53.以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。
附图说明
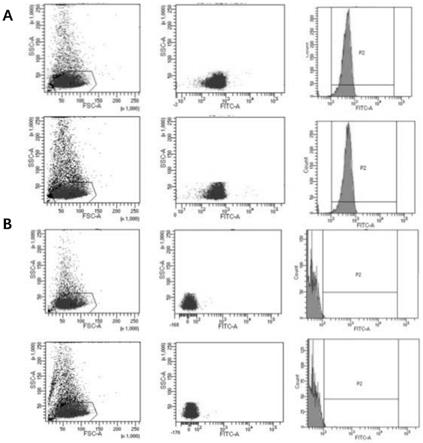
54.图1为流式细胞仪检测rbc-ptx-liposome的表面膜蛋白cd47与凋亡率结果;a为表面膜蛋白cd47;b为凋亡率。
55.图2为各组肺移植瘤c57bj/6j小鼠给药(dppc脂质体)之后的肿瘤体积的生长曲线。
56.图3为各组肺移植瘤c57bj/6j小鼠给药(dope脂质体)之后的肿瘤体积的生长曲线。
57.图4为荧光共振能量转移法(fret)测定脂质体与rbc膜的融合性结果。
58.图5为不同融合时间制备的rbc-ptx-liposome(dppc)的脏器富集情况。
59.图6为不同融合时间制备的rbc-ptx-liposome(dope)的脏器富集情况。
具体实施方式
60.除另有说明外,本发明具体实施方式中使用的原料、设备均为已知产品,通过购买市售产品获得。
61.实施例1、载药脂质体与红细胞膜融合制备药物载体制剂
62.1、载紫杉醇脂质体的制备
63.将59.5mg二棕榈酰磷脂酰胆碱(dppc)与3.5mg胆固醇(cho)溶于3ml三氯甲烷中,并加入1.8mg紫杉醇(ptx)溶解,然后在45-50℃条件下进行薄膜法真空旋蒸60min,随后加入5ml ph=7.4的磷酸盐缓冲液(pbs),在50-55℃条件下水化30min。水化后的产物依次过孔径为0.4μm、0.2μm和0.1μm的聚碳酸脂膜各3-5次,得载紫杉醇脂质体溶液。经过hplc检测载紫杉醇脂质体的包封率高达91.14%
±
1.84%。载紫杉醇脂质体命名为ptx-liposome(dppc)。
64.2、载地塞米松脂质体的制备
65.将59.5mg二棕榈酰磷脂酰胆碱(dppc)与3.5mg胆固醇(cho)溶于3ml三氯甲烷中,
并加入1.8mg地塞米松(dexamethasone,dex)溶解,然后在45-50℃条件下进行薄膜法真空旋蒸60min,随后加入5ml ph=7.4的磷酸盐缓冲液(pbs),在50-55℃条件下水化30min。水化后的产物依次过孔径为0.4μm、0.2μm和0.1μm的聚碳酸脂膜各3-5次,得载地塞米松脂质体溶液。经过hplc检测载地塞米松脂质体的包封率高达89.6%
±
1.2%。载地塞米松脂质体命名为dex-liposome(dppc)。
66.3、将载紫杉醇脂质体与红细胞膜融合
67.将步骤1所得载紫杉醇脂质体溶液重新悬浮在pbs缓冲液(ph=7.4)中。将60μl浓度为1μmol的载紫杉醇脂质体溶液与人红细胞(3
×
108个rbc)进行孵育(37℃,4h)后,离心(3500g,10min)三次,将未融合脂质体的红细胞与融合了脂质体的红细胞分离,去上清得到融合了脂质体的红细胞药物载体制剂,命名为rbc-ptx-liposome(dppc)。通过检测,与红细胞膜融合后的载紫杉醇脂质体中ptx的包封率可达66.47%。
68.4、将载地塞米松脂质体与红细胞膜融合
69.将步骤2所得载地塞米松脂质体溶液重新悬浮在pbs缓冲液(ph=7.4)中。将60μl浓度为1mg/ml的载地塞米松脂质体溶液与人红细胞(3
×
108个rbc)进行孵育(37℃,4h)后,离心(3500g,10min)三次,将未融合脂质体的红细胞与融合了脂质体的红细胞分离,去上清得到融合了脂质体的红细胞药物载体制剂,命名为rbc-dex-liposome(dppc)。通过检测,与红细胞膜融合后的载地塞米松脂质体中dex的包封率可达48.13%。
70.实施例2、载药脂质体与红细胞膜融合制备药物载体制剂
71.1、载紫杉醇脂质体的制备
72.载紫杉醇脂质体(ptx-liposome)的制备方法同实施例1。
73.2、载地塞米松脂质体的制备
74.载地塞米松脂质体(dex-liposome)的制备方法同实施例1。
75.3、将载紫杉醇脂质体与红细胞膜融合
76.将步骤1所得载紫杉醇脂质体溶液重新悬浮在pbs缓冲液(ph=7.4)中。将120μl浓度为2μmol的载紫杉醇脂质体溶液与人类红细胞(3
×
108个rbc)进行孵育(37℃,4h)后,离心(3500g,10min)三次,将未融合脂质体的红细胞与融合了脂质体的红细胞分离,去上清得到融合了脂质体的红细胞药物载体制剂,命名为rbc-ptx-liposome(dppc)。通过检测,与红细胞膜融合后的载紫杉醇脂质体中ptx的包封率达75.20%。
77.4、将载地塞米松脂质体与红细胞膜融合
78.将步骤2所得载地塞米松脂质体溶液重新悬浮在pbs缓冲液(ph=7.4)中。将120μl浓度为2mg/ml的载地塞米松脂质体溶液与人红细胞(3
×
108个rbc)进行孵育(37℃,4h)后,离心(3500g,10min)三次,将未融合脂质体的红细胞与融合了脂质体的红细胞分离,去上清得到融合了脂质体的红细胞药物载体制剂,命名为rbc-dex-liposome(dppc)。通过检测,与红细胞膜融合后的载地塞米松脂质体中dex的包封率可达70.82%。
79.实施例3、载药脂质体与红细胞膜融合制备药物载体制剂
80.1、载紫杉醇脂质体的制备
81.载紫杉醇脂质体(ptx-liposome)的制备方法同实施例1。
82.2、载地塞米松脂质体的制备
83.载地塞米松脂质体(dex-liposome)的制备方法同实施例1。
84.3、将载紫杉醇脂质体与红细胞膜融合
85.将步骤1所得载紫杉醇脂质体溶液重新悬浮在pbs缓冲液(ph=7.4)中。将180μl浓度为3μmol的载紫杉醇脂质体溶液与人类红细胞(3
×
108个rbc)进行孵育(37℃,4h)后,离心(3500g,10min)三次,将未融合脂质体的红细胞与融合了脂质体的红细胞分离,去上清得到融合了脂质体的红细胞药物载体制剂,命名为rbc-ptx-liposome(dppc)。通过检测,与红细胞膜融合后的载紫杉醇脂质体中ptx的包封率达52.33%。
86.4、将载地塞米松脂质体与红细胞膜融合
87.将步骤2所得载地塞米松脂质体溶液重新悬浮在pbs缓冲液(ph=7.4)中。将180μl浓度为3mg/ml的载地塞米松脂质体溶液与人红细胞(3
×
108个rbc)进行孵育(37℃,4h)后,离心(3500g,10min)三次,将未融合脂质体的红细胞与融合了脂质体的红细胞分离,去上清得到融合了脂质体的红细胞药物载体制剂,命名为rbc-dex-liposome(dppc)。通过检测,与红细胞膜融合后的载地塞米松脂质体中dex的包封率可达50.31%。
88.实施例4~6、载药脂质体与红细胞膜融合制备药物载体制剂
89.按照实施例1~3所述方法,将红细胞个数替换为2
×
108个,分别制备实施例4~6融合了脂质体的红细胞药物载体制剂rbc-ptx-liposome(dppc)和rbc-dex-liposome(dppc)。
90.实施例7、载药脂质体与红细胞膜融合制备药物载体制剂
91.1、载紫杉醇脂质体的制备
92.将46.2mg dppc、13.4mg二油酰磷脂酰乙醇胺(dope)和3.5mg胆固醇于3ml三氯甲烷中,并加入1.8mg紫杉醇(ptx)溶解,然后在45-50℃条件下进行薄膜法真空旋蒸60min,随后加入5ml ph=7.4的磷酸盐缓冲液(pbs),在50-55℃条件下水化30min。水化后的产物依次过孔径为0.4μm、0.2μm和0.1μm的聚碳酸脂膜各3-5次,得含dope的载紫杉醇脂质体溶液。载紫杉醇脂质体命名为plx-liposome(dope),简写为liposome-dope。
93.2、将载紫杉醇脂质体与红细胞膜融合
94.将载紫杉醇脂质体与红细胞膜融合的方法同实施例2,得到融合了脂质体的红细胞药物载体制剂,命名为rbc-ptx-liposome(dope),又命名为4h-rbc-lipo(dope)。
95.以下通过具体试验例证明本发明的有益效果。
96.试验例1、载药脂质体与红细胞膜融合后的载药量
97.1、实验方法
98.(1)将rbc-ptx-liposome(实施例1~6制备)用去离子水洗涤三次,沉淀后弃去上清,加入900μl乙腈破膜;
99.(2)10000g离心10min;
100.(3)将上清与沉淀分离,hplc检测上清得到相应峰面积,从而计算出rbc-ptx-liposome的药物浓度,并计算包封率和载药量。
101.2、实验结果
102.经过计算,载紫杉醇脂质体(ptx-liposome)和红细胞(rbc)膜融合后的载药量和包封率如表1所示。
103.表1.ptx-liposome和rbc融合后的载药量和包封率
[0104][0105]
注:包封率是rbc-ptx-liposome的包封率,rbc负载ptx是rbc-ptx-liposome负载ptx的量。
[0106]
根据表1结果可知:本发明载药脂质体与红细胞膜融合后对于药物有良好的包封率和载药量。
[0107]
试验例2、载药脂质体与红细胞膜融合后红细胞的活性研究
[0108]
1、实验方法
[0109]
1.1溶血率检测:
[0110]
(1)准备好血浆游离血红蛋白测定试剂盒;
[0111]
(2)按照表2要求配置好相应溶液;
[0112]
表2.相关溶液的配置
[0113][0114][0115]
(3)混匀后,37℃反应20min,于生化分析仪或酶标仪上测定,光径10mm,波长505nm,空白管调零比色,计算方程:
[0116]
测定管吸光度/标准管吸光度
×
0.1=血浆游离血红蛋白(g/l)
[0117]
1.2红细胞膜表面磷脂酰丝氨酸(phosphatidylserine,ps)检测:
[0118]
ps是一类广泛存在于生物体内的磷脂,通常位于细胞膜内层,与膜功能密切相关。在细胞老化和凋亡的过程中,ps会外翻到细胞膜外侧,ps外翻率(阳性表达率)是细胞老化过程中的特异性指标。红细胞膜表面ps检测方法如下:
[0119]
(1)将洗涤后的rbc-ptx-liposome以及单纯红细胞用生理盐水将其浓度稀释至2
×
10
10
个/l;
[0120]
(2)吸取100μl红细胞在fcm专用管中和5μl的fitc-annexinv轻轻混匀,室温避光
孵育15min;
[0121]
(3)添加等渗pbs 400μl,在24h内上流式细胞仪进行fcm分析,激发光488nm,用单纯红细胞补偿后以ssc、fsc联系识别红细胞,获取10000个红细胞的信息。
[0122]
1.3细胞膜表面cd47(亦称整合素相关蛋白,integrin-associatedprotein)检测:
[0123]
cd47是红细胞膜表面的重要自体识别分子,cd47与sirpa的相互识别和作用对于维持红细胞功能,避免被巨噬细胞吞噬具有重要的作用,膜上确实cd47的红细胞会被机体识别为异物而清除,cd47的丢失是红细胞老化的标志性事件。细胞膜表面cd47检测方法如下:
[0124]
(1)将洗涤后的rbc-ptx-liposome以及单纯红细胞用生理盐水将其浓度稀释至2
×
10
10
个/l;
[0125]
(2)吸取100μl红细胞和fitc-igg1、fitc-抗cd47各20μl在fcm专用试管中轻轻混匀;
[0126]
(3)添加等渗pbs 400μl,在24h内上流式细胞仪进行fcm分析,激发光488nm,用单纯红细胞补偿后以ssc、fsc联系识别红细胞,获取10000个红细胞的信息。
[0127]
2、实验结果
[0128]
采用本发明实施例2备的rbc-ptx-liposome(rbc-lipo)进行上述实验,结果如图1a、1b以及表3所示。经过流式细胞仪检测后发现,本发明中rbc膜与ptx-liposome融合后,rbc膜的ps阳性率为0.22%
±
0.016%,cd47检测水平为98.37%
±
0.5%,(原有单纯红细胞膜的ps阳性率与cd47检测水平分别为0.25%与98.74%)。说明本发明将红细胞膜与脂质体融合后,可以维持红细胞原有的活性,即便在达到较高药物负载量时,也不会改变rbc自身的形态、细胞膜活性以及溶血率。本发明将载药脂质体与红细胞膜融合后得到的药物载体制剂具有红细胞活性,可以更好的避免自身免疫系统的清除,实现以更低的药物剂量达到更有效的药物缓释、临床治疗效果。
[0129]
表3.ptx-liposome与rbc膜融合后溶血率(g/l)
[0130][0131]
试验例3、载药脂质体与红细胞膜融合后的药物载体制剂对肿瘤的抑制作用
[0132]
1、实验方法
[0133]
按照常规方法建立肺移植瘤c57bj/6j小鼠模型,在其体内进行药效学实验,每三天以尾静脉注射的方式给药(给药剂量:5mg/kg),一共给药4次。每天监测肿瘤体积变化以及移植瘤小鼠体重。药物为实施例2制备的rbc-ptx-liposome(4h-rbc-lipo(dppc))。此外,设置对照药物,对照药物1为实施例1制备的ptx-liposome(dppc),对照药物2为按照实施例2方法将载紫杉醇脂质体溶液与人类红细胞在37℃孵育1h得到的制剂(1h-rbc-lipo(dppc))。
[0134]
按照上述方法,分别给药实施例7制备的liposome-dope、4h-rbc-lipo(dope),以及为按照实施例7方法将载紫杉醇脂质体溶液与人类红细胞在37℃孵育1h得到的制剂(1h-rbc-lipo(dope))。
[0135]
2、实验结果
[0136]
动物实验结果显示(图2),与ptx-liposome组相比,rbc-ptx-liposome组的肿瘤生长速度在第四天开始明显减缓,肿瘤体积小于ptx-liposome组(p<0.05)。此外,与红细胞孵育4h的rbc-ptx-liposome抗肿瘤生长效果显著优于与红细胞孵育1h的rbc-ptx-liposome。
[0137]
当在脂质体原有dppc的组分上添加一定比例的二油酰磷脂酰乙醇胺dope之后,动物实验结果显示(图3),与liposome-dope组相比,rbc-ptx-liposome(dope)组的肿瘤生长速度在第五天开始明显减缓,肿瘤体积小于liposome-dope组,与此同时,4h-rbc-lipo(dope)的治疗效果明显优于1h-rbc-lipo(dope)(p<0.05),与图2结果一致。
[0138]
上述结果说明利用红细胞作为药物运输系统,可以显著提高载药脂质体对肿瘤的抑制作用,而与红细胞孵育4h后的效果显著优于与红细胞孵育1h后的效果。
[0139]
试验例4、载药脂质体与红细胞孵育不同时间对药物载体制剂的影响
[0140]
1、实验方法
[0141]
1.1 ptx-liposome和rbc孵育不同时间后载药量的检查
[0142]
(1)按照实施例1所述方法制备好ptx-liposome以及洗涤过的3
×
108个红细胞;
[0143]
(2)将浓度为2μmol的ptx-liposome溶液与红细胞在37℃条件下分别孵育1h、2h、3h和4h;
[0144]
(3)将孵育好的rbc-ptx-liposome洗涤三次,加入1ml乙腈进行破膜;
[0145]
(4)10000g离心10min;
[0146]
(5)取上清液,hplc检测得到相应峰面积,从而计算出不同孵育时间rbc-ptx-liposome的药物浓度,并计算包封率和载药量。
[0147]
1.2脂质体与红细胞膜融合能力评价
[0148]
荧光共振能量转移(fluorescence resonance ener y transfer,fret)是指两个荧光基团在相互间距离足够近时(10~100a)所发生的能量非放射性地由一个荧光基团向另一个荧光基团转移的现象。荧光共振能量转移的程度与两个荧光分子之间的距离有关,距离近,能量转移充分;距离远,能量转移弱,直至能量转移消失。利用以上原理,使用红色荧光和绿色荧光标记的磷脂一同构建脂质体,当不同荧光物质标记的脂质体间距离足够近的时候,即可发生荧光共振能量转移的现象。通过测量nbd或者rh荧光发射光强度的变化,可以间接评价融合程度和能力。
[0149]
2、实验结果
[0150]
经过计算,载紫杉醇脂质体(ptx-liposome)和红细胞孵育不同时间后得到的药物载体制剂的载药量和包封率如表4所示。
[0151]
表4.ptx-liposome和红细胞孵育不同时间后载药量和包封率
[0152][0153]
由表4可知:通过改变脂质体与红细胞的孵育时间,rbc-ptx-liposome的载药量也不同,检测结果表明,孵育1h、2h、3h和4h的rbc-ptx-liposome的包封率分别为:25.27%
±
0.4、56.44%
±
4.17%、69.45%
±
2.83%和75.88%
±
3.32%,载药量分别是10.2
±
0.16、
22.78
±
1.68、28.44
±
1.48和30.63
±
1.34μg。随着孵育时间增加,包封率和载药量增加。
[0154]
表5和图4为荧光共振能量转移法(fret)测定脂质体与rbc膜的融合性结果。
[0155]
表5.荧光共振能量转移法(fret)测定的脂质体与rbc膜的融合性结果
[0156][0157]
fret的结果显示:孵育1h的时候脂质体与红细胞融合率(fusion%)在38.5%/40.57%,随着孵育时间的延长,融合率也逐渐升高,当孵育时间为4h时,融合率达到73.26%/72.61%,证明在4h的孵育条件下,脂质体与红细胞膜进行了有效的膜融合。
[0158]
试验例5、载药脂质体与红细胞膜融合后的药物载体制剂在小鼠体内分布的研究
[0159]
1、实验方法
[0160]
(1)制备染有dii荧光的2μmol载药脂质体溶液以及洗涤过的3
×
108个红细胞。染有dii荧光的载药脂质体的制备方法同实施例1或实施例7,只是在水化步骤前加入10μl的20mm的dii(细胞膜红色荧光探针)共同水化,即可得到dii染色的载药脂质体。
[0161]
(2)将载药脂质体溶液与红细胞在37℃条件下分别孵育1h、2h、3h和4h。
[0162]
(3)将孵育好的与红细胞融合的脂质体(药物载体制剂)洗涤三次,按照5kg/mg剂量以尾静脉的方式注射于小鼠体内。
[0163]
(4)6h后剥离小鼠脏器于小动物活体成像(ivis)下成像观察脏器富集情况。
[0164]
2、实验结果
[0165]
小动物活体成像结果显示(图5):1h孵育条件下,制剂富集于肝脏与肺部,证明了经过1h孵育的rbc-ptx-liposome具有“红细胞搭便车”的特征,脂质体与红细胞膜通过粘附的方式进行结合,到达肺毛细血管时由于外力挤压脱落从而富集于肺部;4h孵育结果显示,脂质体与红细胞进行了膜融合,从而使脂质体与红细胞的结合更加稳固,脂质体会随着红细胞循环至全身但并未富集于某个脏器,能够大大的提升体内循环的半衰期,从而提高疗效。
[0166]
脂质体中的磷脂成分改变会影响其在小鼠体内脏器富集情况的不同。如图6所示,在dppc脂质体中添加一定成分的dope后,与单纯的dppc脂质体相比,dppc-dope脂质体与红细胞进行1h孵育后,由于dope的ph敏感的特殊性质,脂质体不仅富集于肝与肺,还实现了肿瘤的靶向递送;经过4h孵育后,脂质体在达到肿瘤靶向递送的同时,依旧富集于肝脏,猜测这是由于dope的ph敏感性导致红细胞破裂后被肝脏清除从而导致的结果。
[0167]
综上,本发明制备了与血细胞膜结合的脂质体药物载体,该脂质体药物载体可载不同种类的药物,其对药物的包封率和载药量均较高,可以有效地提高药物的递送效率。同时,本发明药物载体将脂质体与具有生物活性的血细胞的细胞膜相结合,结合后血细胞仍然可以保持完整的形态和良好的活性与功能,可有效延长药物半衰期,更好的避免自身免疫系统的清除,实现以更低的药物剂量达到更有效的药物缓释、临床治疗效果,具有良好的应用前景。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。