1.本发明涉及治疗或预防乙肝病毒(hbv)感染的药物领域。具体地,本发明涉及脂肪酸合酶抑制剂用于治疗或预防hbv感染的用途、包含脂肪酸合酶抑制剂和其它抗hbv剂的药物组合物,以及脂肪酸合酶抑制剂的制药用途。
背景技术:
2.乙型肝炎病毒(hbv)是一种肝细胞性的包膜的有部分单链区的环状双链dna病毒。它通常在出生时在母婴之间传播(围产期传播),也可以通过血液或体液传播。
3.hbv产生共价闭合的环状dna(cccdna),分泌hbv表面抗原以抑制免疫系统,并引起难以根除的持续性(慢性)感染。hbv感染是世界上主要的公共卫生威胁,每年有超过2.57亿人被慢性感染,并造成887,000多人死亡(revill,p.a.等人,lancet gastroenterol.hepatol,2019,4(7),545-558)。在亚太地区,慢性乙型肝炎病毒(hbv)感染导致该地区一半以上的死亡是由肝硬化引起的,约一半是该地区肝细胞癌的病例(sarin,sk等人,《柳叶刀胃肠病》,hepatol,2020,5(2):167-228)。在对27项研究的汇总分析中,据报道,2013年至2017年中国普通人群中hbv感染的合并估计患病率为6.89%(wang,h.et al bmc infect dis,2019,19(1),811)。
4.当前,针对hbv感染的治疗非常有限。批准的治疗方法包括核苷酸抑制剂,例如替诺福韦酯(viread),替诺福韦阿拉芬酰胺(vemlidy),恩替卡韦(baraclude),替比夫定(tyzeka或sebivo),拉米夫定(epivir-hbv,zeffix或heptodin)和例如聚乙二醇化干扰素(pegasys)。因此,迫切需要新的hbv感染的治疗方法(fanning,g.c,nat.rev.drug discov,2019,18(11),827-844)。
技术实现要素:
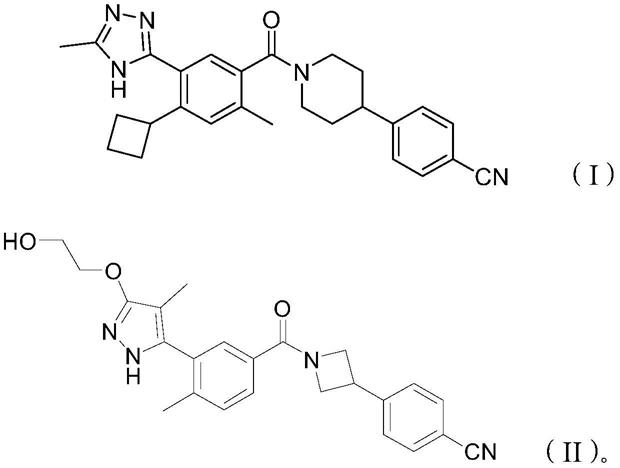
5.本发明的发明人发现,式(i)和式(ii)所示的脂肪酸合酶抑制剂具有抗hbv活性。体外原代人肝细胞感染试验结果表明,式(i)和式(ii)所示的脂肪酸合酶抑制剂能有效抑制hbv dna和hbsag。
6.因此,本发明涉及式(i)或式(ii)所示的脂肪酸合酶抑制剂用于治疗或预防hbv感染的用途、包含式(i)或式(ii)所示的脂肪酸合酶抑制剂和其它抗hbv剂的药物组合物及式(i)和式(ii)所示的脂肪酸合酶抑制剂的制药用途。
7.定义
8.为了解释本说明书的目的进行以下定义,并且在适当时,单数形式的术语也包括复数形式,反之亦然。
9.如本文所使用的,术语“药学上可接受的辅料”可以包括本领域技术人员已知的溶剂、分散介质、包衣、表面活性剂、抗氧化剂、防腐剂(例如,抗菌剂和抗真菌剂)、等渗剂、吸收延迟剂、盐、药物稳定剂、粘合剂、赋形剂、崩解剂、润滑剂、甜味剂、调味剂、颜料等及其组合。除非任何常规载体与所述活性成分不相容,否则均可考虑将其用于所述治疗组合物或
药物组合物中。
10.如本文所使用的,术语“乙型肝炎病毒”或“hbv”是指具有约3,200个碱基对的小的双链dna基因组和肝细胞嗜性的嗜肝dna病毒科成员。“hbv”包括感染各种哺乳动物(例如人,非人灵长类动物等)和禽类(鸭等)宿主中的任何一种的乙型肝炎病毒。“hbv”包括任何已知的hbv基因型,例如血清型a、b、c、d、e、f和g;任何hbv血清型或hbv亚型;任何乙肝病毒分离株;hbv变异体,例如,hbeag阴性变异体,耐药性hbv变异体(例如,拉米夫定抗性变异体、阿德福韦抗性变异体、替诺福韦抗性变异体、恩替卡韦抗性变异体等);等等。
11.如本文所使用的,术语“治疗有效量”是指本发明化合物或分子的量,当将其给予受试者时,(i)治疗或预防特定的疾病、病症或失调;(ii)减轻、改善或消除特定疾病、病症或障碍的一种或多种症状;或(iii)预防或延迟本文所述的特定疾病、病症或障碍的一种或多种症状的发作。治疗有效量取决于化合物、所治疗的疾病状态、所治疗疾病的严重程度、受试者的年龄和相对健康状况、给药途径和形式、主治医学或兽医的判断。
12.除非另有说明,术语“式(i)或式(ii)所示的脂肪酸合酶抑制剂”,或者“式(i)或式(ii)化合物”包括具有式(i)或式(ii)结构的脂肪酸合酶抑制剂、其前药、该化合物的盐和/或该化合物前药的盐、该化合物的水合物或溶剂化物,以及该化合物的立体异构体(包括非对映异构体和对映异构体)、互变异构体、同位素标记的化合物(包括氘取代)和多晶型物。术语“式(i)或式(ii)化合物”包括单独使用式(i)化合物、单独使用式(ii)化合物,以及同时使用式(i)化合物和式(ii)化合物。
13.术语“药学上可接受的盐”中所包括的盐是指本发明化合物的无毒盐。优选的是羧酸的碱金属盐,例如钠、钾、锂、钙、镁、铝、锌、n,n
′-
二苄基乙二胺、氯普鲁卡因、胆碱、二乙醇胺、乙二胺、n-甲基葡糖胺和普鲁卡因盐。其他药学上不可接受的盐也可用于制备本发明的化合物,并且应认为它们构成了本发明的另一方面。本发明化合物的盐可以通过本领域技术人员已知的方法制备。例如,在适当的溶剂中用适当的碱或酸处理本发明的化合物得到相应的盐。
14.用于合成本发明化合物的所有起始原料、试剂、酸、碱、溶剂和催化剂是可商购的,或者可以通过本领域技术人员已知的有机合成方法来生产。除非本文另外指出或与上下文明显矛盾,否则本文描述的所有方法可以以任何合适的顺序执行。本文提供的任何和所有示例或示例性语言(例如,诸如)的使用仅旨在更好地阐明本发明,并且不对以其他方式要求保护的本发明的范围构成限制。
15.一方面,本发明提供了一种治疗或预防hbv感染的方法,该方法包括向有需要的人或动物施用治疗有效量的式(i)或式(ii)所示的脂肪酸合酶抑制剂、其药学上可接受的盐、酯或立体异构体:
16.[0017][0018]
在本发明的一些实施方案中,可以采用以下路线制备式(i)化合物(具体可参见cn110177551a,p461-464化合物152的制备,本技术将其引用作为参考):
[0019][0020]
在本发明的一些实施方案中,可以采用以下路线制备式(ii)化合物(具体可参见cn105980376b,p34化合物2的制备,本技术将其引用作为参考):
[0021]
[0022][0023]
根据本发明提供的治疗或预防hbv感染的方法,所述式(i)或式(ii)所示的脂肪酸合酶抑制剂、其药学上可接受的盐、酯或立体异构体(简称:式(i)或式(ii)化合物)可以通过适合于待治疗病症的任何途径施用。合适的途径包括口服、直肠、鼻、局部(包括颊和舌下)、透皮、阴道和肠胃外(包括皮下、肌内、静脉内、皮内、鞘内和硬膜外)等给药方式。应当理解,优选的给药途径可以随着例如受试者的状况而变化。
[0024]
根据本发明提供的治疗或预防hbv感染的方法,可以基于医师的判断,在治疗或预防过程中调节式(i)或式(ii)化合物的剂量或给药频率。式(i)或式(ii)化合物的剂量频率将由各个患者的需求决定,并且可以是例如每天一次,或者每天两次或更多次。式(i)或式(ii)化合物的给药持续至治疗或预防hbv感染所需的时间。
[0025]
根据本发明提供的治疗或预防hbv感染的方法,其中,可以将所述式(i)或式(ii)化合物、其药学上可接受的盐、酯或立体异构体与一种或多种其它抗hbv剂组合使用。其中,可以将式(i)或式(ii)化合物与其它抗hbv剂以混合物的形式作为一种药物组合物使用,或者可以分别作为不同的药物组合物中共同施用。当处于不同的药物组合物中时,可以按照受试者的时间表,通过相同或不同的给药途径来管理式(i)或式(ii)化合物与其它抗hbv剂的给药方式。共同施用包括在施用单位剂量的一种或多种其它抗hbv剂之前或之后施用单位剂量的式(i)或式(ii)化合物。在一些实施方式中,式(i)或式(ii)化合物可在施用一种或多种其它抗hbv剂的数秒、数分钟或数小时内进行施用。在另一些实施方式中,首先施用单位剂量的式(i)或式(ii)化合物,接着在数秒、数分钟或数小时内施用一种或多种其它抗hbv剂。
[0026]
根据本发明提供的治疗或预防hbv感染的方法,其中,所述其它抗hbv剂可以是可以是除式(i)和式(ii)化合物外的任何抗hbv剂,本发明对此没有特别限定。例如,所述其它抗hbv剂可以选自靶向病毒mrna的反义寡核苷酸、短干扰rna(sirna)、b和t淋巴细胞减毒剂抑制剂、ccr2趋化因子拮抗剂、靶向hbcag的化合物、靶向乙肝核心抗原(hbcag)的化合物、共价闭合环状dna(cccdna)抑制剂、亲环蛋白抑制剂、细胞因子、核酸内切酶调节剂、表观遗传修饰剂、基因修饰剂或编辑剂、法尼醇x受体激动剂、乙型肝炎表面抗原(hbsag)抑制剂、hbsag分泌或组装抑制剂、hbv抗体、hbv dna聚合酶抑制剂、hbv复制抑制剂、hbv rnase抑制剂、hbv疫苗、hbv病毒进入抑制剂、hbx抑制剂、乙型肝炎结构蛋白调节剂、乙型肝炎病毒e抗原抑制剂、乙型肝炎病毒复制抑制剂、肝炎病毒结构蛋白抑制剂、il-2激动剂、il-7激动剂、
免疫调节剂、核糖核苷酸还原酶抑制剂、干扰素激动剂、干扰素α1配体、干扰素α2配体、干扰素α5配体调节剂、干扰素α配体、干扰素α配体调节剂、干扰素α受体配体、干扰素β配体、干扰素配体、干扰素受体调节剂、白介素2配体、赖氨酸脱甲基酶抑制剂、微rna(mirna)基因治疗剂、b7-h3调节剂、b7-h4调节剂、cd 160调节剂、cd161调节剂、cd27调节剂、cd47调节剂、cd70调节剂、gitr调节剂、tigit调节剂、tim-4调节剂、钠-牛磺胆酸盐共转运多肽(ntcp)抑制剂、天然杀伤细胞受体2b4抑制剂、nod2基因刺激剂、核蛋白抑制剂、核蛋白调节剂、pd-1抑制剂、pd-l1抑制剂、peg-干扰素λ、肽基脯氨酰异构酶抑制剂、视黄酸诱导型基因1激动剂、逆转录酶抑制剂、核糖核酸缓和抑制剂、rna dna聚合酶抑制剂、短合成发夹rna(sshrna)、干扰素基因激动剂(sting)的激动剂、nod 1激动剂、t细胞表面糖蛋白cd28抑制剂、tlr-3激动剂、tlr-7激动剂、tlr-8激动剂、tlr-9激动剂、tlr9基因刺激剂、toll样受体(tlr)调节剂、病毒核糖核苷酸还原酶抑制剂、锌指核酸酶或合成核酸酶(talen)等。
[0027]
在本发明优选的实施方案中,所述其它抗hbv剂选自hbv疫苗、hbv dna聚合酶抑制剂、免疫调节剂、toll样受体(tlr)调节剂、干扰素α受体配体、法尼醇x受体激动剂、乙型肝炎表面抗原(hbsag)抑制剂、亲环蛋白抑制剂、hbv病毒进入抑制剂、靶向病毒mrna的反义寡核苷酸、短干扰rna(sirna)和ddrnai核酸内切酶调节剂、核糖核酸核苷酸还原酶抑制剂、hbv e抗原抑制剂、共价闭合环状dna(cccdna)抑制剂、hbv抗体、ccr2趋化因子拮抗剂、视黄酸诱导基因1激动剂、nod2激动剂、pd-1抑制剂、pd-l1抑制剂、kdm抑制剂和hbv复制抑制剂中的一种或多种。
[0028]
在一种实施方案中,所述其它抗hbv剂是核苷酸。hbv dna聚合酶抑制剂的实例包括阿德福韦(hepsera*)、安卓西他宾滨(emtriva)、反丁烯二酸替诺福韦双索酯替诺福韦埃拉酚胺、替诺福韦、替诺福韦双索酯、反丁烯二酸替诺福韦埃拉酚胺、替诺福韦迪皮夕(tenofovir dipivoxil)、替诺福韦阿拉福韦酯,替诺福韦十八烷氧基乙酯、cmx-157、拜斯福韦(besifovir)、恩替卡韦顺丁烯二酸恩替卡韦、替比夫定(tyzeka)、帕拉德福韦、德威定、利巴韦林、拉米夫定(epiv)、迭氮膦(phosphazide)、泛昔洛韦、弗索林、美他卡韦、snc-0 19754、fmca、agx-1009、ar-ii-04-26、hip-1302、天冬胺酸替诺福韦双索酯、乳清酸替诺福韦双索酯和hs-10234。hbv dna聚合酶抑制剂的其他例子包括非洛西韦。
[0029]
在一个具体的实施方案中,将本发明的式(i)化合物与恩替卡韦或替诺福韦组合。
[0030]
在另一种实施方案中,所述其它抗hbv剂是免疫调节剂。所述免疫调节剂的实例包括tlr激动剂ro7020531、gs-9620、gs-9688。免疫调节剂的实例还包括pd-1抑制剂,例如纳武利尤单抗(nivolumab)、派姆单抗(pembrolizumab)、皮立珠单抗(pidilizumab)、bgb-108、shr-1210、pdr-001、萨善利单抗(sasanlimab)(pf-06801591)、ibi-308、测米匹单抗(cemiplimab)、坎立珠单抗(camrelizumab)、斯迪利单抗(sintilimab)、缇勒珠单抗(tislelizumab)(bgb-a317)、bcd-100、西利单抗(cetrelimab)(jnj-63723283)、zimberelimab(gls-010,wbp-3055),巴替利单抗(balstilimab)(agen2034)、多斯利单抗(dostarlimab)(tsr-042)。免疫调节剂的实例还包括pd-l1抑制剂,例如阿特珠单抗(atezolizumab)(rg-7446)、艾维路单抗(avelumab)、bgb-a333、德瓦鲁单抗(durvalumab)、cx-072、gx-p2和恩沃利单抗(kn035、asc022)。所述pd-l1抑制剂还可以为小分子抑制剂,例
如gs-4224和incb086550。
[0031]
在一个具体的实施方案中,将式(i)化合物与恩沃利单抗组合。
[0032]
在又一种实施方案中,所述其它抗hbv剂是法尼醇x受体激动剂。所述法尼醇x受体激动剂的实例包括akn-083、cilofexor、edp-305、eyp-001、met-409、terns-101和tropifexor。
[0033]
在一个具体的实施方案中,将本发明的式(i)化合物与脂肪酸合成酶抑制剂tvb-2640和/或tvb-3567组合。
[0034]
在又一种实施方案中,所述其它抗hbv剂是普通或长效干扰素。所述干扰素的实例包括派格宾、派罗欣(pegasys)、佩乐能(peg-intron)
[0035]
在一个具体的实施方案中,将式(i)化合物与派罗欣组合。
[0036]
在又一种实施方案中,所述其它抗hbv剂是hbv疫苗。所述hbv疫苗包括预防和治疗疫苗。hbv预防性疫苗的实例包括vaxelis、hexaxim、heplisav、mosquirix、dtwp-hbv疫苗、bio-hep-b、d/t/p/f1bv7m(lbvp-0101;lbvw-0101)、dtwp-hepb-fiib-ipv疫苗、heberpenta l、dtwp-hepb-hib、v-419、cvi-hbv-001、tetrabhay、乙型肝炎预防性疫苗(advax super d)、hepatrol-07、gsk-223 192a、重组乙型肝炎疫苗(肌内注射,康泰生物制品)、重组乙型肝炎疫苗(多形汉酵母,肌内,华兰生物工程公司)、重组乙型肝炎表面抗原疫苗、bimmugen、euforavac、eutravac、anrix-dtap-ipv-hep b、hbai-20、infanrix-dt ap-ipv-hep b-hib、pentabio vaksin dtp-hb-hib、comvac 4、twinrix、euvax-b、tritanrix hb、infanrix heb b、comvax、dtp-hib-hbv疫苗、dtp-hbv疫苗、heberbiovac hb、trivac hb、gervax、dtwp-hep b-hib疫苗、倍尔来福(bilive)、hepavaxgene、supervax、comvac5、shanvac-b、hebsulin、recombivax hb、revac b mcf、revac b 、fendrix、dtwp-hepb-hib、dna-001、shan5、shan6、rhhbsag疫苗、hbi五价疫苗、lbvd、infanrix hexa和dtap-rhb-hib疫苗。
[0037]
在一个具体的实施方案中,将本发明的式(i)化合物与abx203、aic 649、ino-1800、hb-110、tg1050、heptcell、vr-chb01、vbi-2601和cag-201中的一种或多种组合。
[0038]
在再一种实施方案中,所述其它抗hbv剂是靶向病毒mrna的反义寡核苷酸(aso)。反义寡核苷酸的例子包括ionis-hbvrx和ionis-hbv-lrx。
[0039]
在再一种实施方案中,所述其它抗hbv剂短干扰rna(sirna)。短干扰rna的例子包括jnj-3989(aro-hbv),vir-2218(aln-hbv02)和dcr-hbvs。
[0040]
在再一种实施方案中,所述其它抗hbv剂是肝炎表面抗原(hbsag)抑制剂。hbsag抑制剂的例子包括hbf-0259、pbhbv-001、pbhbv-2-15、pbhbv-2-1、rep-9ac、rep-9c、rep-9、rep-2139、rep-2l39-ca、rep-2165、rep-2055、rep-2163、rep-2165、rep-2053、rep-203和rep-006、rep-9ac以及针对papd 57的抑制剂。
[0041]
在再一种实施方案中,所述其它抗hbv剂是hb病毒进入抑制剂,例如myrcludex b、贺普拉肽,或靶向pres的抗体。
[0042]
在再一种实施方案中,所述其它抗hbv剂是衣壳抑制剂。hbsag抑制剂的实例包括abi-h0731、abi-h2158、abi-h3733、cb-hbv-001、jnj-6379、jnj-0440、ql-007、rg-7907和ro7049389。
[0043]
在本发明最优选的实施方案中,所述其它抗hbv剂选自恩替卡韦、替诺福韦、恩沃
利单抗和派罗欣中的一种或多种。
[0044]
另一方面,本发明还提供了式(i)或式(ii)所示的脂肪酸合酶抑制剂、其药学上可接受的盐、酯或立体异构体在制备抗hbv药物中的应用。其中,所述式(i)或式(ii)所示的脂肪酸合酶抑制剂、其药学上可接受的盐、酯或立体异构体如前文所定义。
[0045]
根据本发明提供的应用,其中,所述抗hbv药物包含作为活性成分的式(i)或式(ii)所示的脂肪酸合酶抑制剂、其药学上可接受的盐、酯或立体异构体以及一种或多种其它抗hbv剂。其中,所述其它抗hbv剂如前文所定义。
[0046]
再一方面,本发明还提供了一种抗hbv药物组合物,所述药物组合物包含治疗有效量的式(i)或式(ii)所示的脂肪酸合酶抑制剂、其药学上可接受的盐、酯或立体异构体和一种或多种其它抗hbv剂,以及药学上可接受的辅料。其中,所述式(i)或式(ii)所示的脂肪酸合酶抑制剂、其药学上可接受的盐、酯或立体异构体如前文所定义。其中,所述其它抗hbv剂如前文所定义。
[0047]
本发明的抗hbv药物组合物适合于口服、直肠、鼻、局部(包括颊和舌下)、透皮、阴道和肠胃外(包括皮下、肌内、静脉内、皮内、鞘内和硬膜外)等给药方式。具体的给药方式取决于所治疗疾病的性质和严重程度以及活性成分的性质。所述药物组合物可以方便地以单位剂型存在,并且可以通过药学领域技术人员公知的任何方法制备。
[0048]
本发明的药物组合物适用于各种给药途径,包括口服给药。所述组合物可以单位剂型存在,并且可以通过药学领域公知的任何方法制备。此类方法包括使活性成分(例如,本发明的式(i)或式(ii)所示的脂肪酸合酶抑制剂或其药用盐)与一种或多种药学上可接受的赋形剂结合的步骤。可以通过将活性成分与液体赋形剂或固体赋形剂或两者均匀且紧密地结合在一起,然后,如果需要,将产品成型来制备组合物。本文描述的适合于口服施用的组合物可以以离散单位(单位剂型)的形式存在,包括但不限于分别包含预定量的活性成分的胶囊、扁囊剂或片剂。在一个实施方案中,药物组合物是片剂。
[0049]
所述式(i)或式(ii)所示的脂肪酸合酶抑制剂可以有效量施用于个体。可以与非活性成分组合以产生剂型的活性成分的量可以根据预期的治疗对象和特定的给药方式而变化。例如,在一些实施方案中,用于对人口服给药的剂型可以包含约1至1000mg的活性材料,其与适当和方便量的药学上可接受的赋形剂一起配制。在某些实施方案中,药学上可接受的赋形剂为总组合物的约5%至约95%。
[0050]
基于给药医师的判断,可以在治疗过程中调节本发明的式(i)或式(ii)化合物的剂量或给药频率。式(i)或式(ii)化合物的剂量频率将由各个患者的需求决定,并且可以是例如每天一次或每天两次或多次,或者更多次。化合物的给药持续至治疗hbv感染所需的时间。
附图说明
[0051]
为了更清楚地说明本发明的实施例中的技术方案,下面将简要描述用于描述本发明实施例的附图。显然,以下描述中的附图仅是本发明的一些实施例。
[0052]
图1为phh细胞中抑制hbv dna的ec50曲线;
[0053]
图2为phh细胞中hbsag抑制的ec50曲线;
[0054]
图3为hepg2-ntcp细胞中hbsag抑制的ec50曲线;
[0055]
图4为hepg2-ntcp细胞中hbeag抑制的ec50曲线。
具体实施方式
[0056]
参照以下实施例进一步说明本发明。需要说明的是,以下实施例仅用于举例说明,并不用于限制本发明。本领域技术人员根据本发明的教导做出的各种改变应在本发明的权利要求所述的范围内。
[0057]
实施例1:式(i)化合物的制备
[0058]
(1)化合物1b(4-溴-2-甲基苯甲酸甲酯)的制备
[0059][0060]
历经约3分钟向4-溴-2-甲基苯甲酸(5.11g,23.8mmol,1.0当量)的甲醇(25ml)溶液中逐滴添加硫酸(2.0ml)(轻微放热)。所得混合物回流4小时。冷却至室温后,将反应混合物在饱和nahco3水溶液(100ml)中小心地淬灭(注意:大量气体逸出)且用二氯甲烷(200ml
×
1,随后50ml
×
1)萃取。合并的有机相用盐水/饱和nahco3的混合物(9∶1)(50ml)洗涤,干燥(na2so4)并且在减压下浓缩,获得呈无色油状的化合物1b(5.28g,收率97%)。
[0061]1h nmr(400mhz,cdcl3):δ7.78(d,j=8.0hz,1h),7.42(d,j=1.6hz,1h),7.38(dd,j=1.6hz,1h),3.89(s,3h),2.58(s,3h)。
[0062]
(2)化合物1c(4-环丁基-2-甲基苯甲酸甲酯)的制备
[0063][0064]
将环丁基溴化锌(ii)(50ml,0.5m于thf中,25.0mmol)添加至4-溴-2-甲基苯甲酸甲酯(5.2g,22.7mmol)与pdcl2(dppf)ch2cl2(1.85g,2.27mmol)的混合物中。将混合物脱气且经由气囊用氩气填充烧瓶。混合物在氩气下,在65℃下加热24小时。将混合物冷却至0℃且用水(10ml)淬灭。混合物用etoac(200ml)稀释,用水及盐水依次洗涤。etoac层经干燥(na2so4),在减压下浓缩,且使用柱(硅胶)层析(己烷∶etoac为30∶1至20∶1)纯化。产量:4.1g,透明油状物,收率89.1%。
[0065]1h nmr(400mhz,氯仿-d):δ7.86(d,1h),7.12-7.02(m,2h),3.88(s,3h),3.59-3.48(m,1h),2.59(s,3h),2.35(m,2h),2.22-1.96(m,3h),1.86-1.84(m,1h)。
[0066]
(3)化合物1d(4-环丁基-5-碘-2-甲基苯甲酸甲酯)的制备
[0067][0068]
在0℃下将n-碘代丁二酰亚胺(3.52g,15.6mmol)逐份添加至4-环丁基-2-甲基苯甲酸甲酯(3.2g,15.6mmol)的浓硫酸(25ml)溶液中。混合物在0℃下搅拌30分钟且在室温下
搅拌2小时。混合物变得极稠。混合物再冷却至0℃且添加meoh(30ml)。混合物在60℃下加热2小时。在减压下移除甲醇且将残余物倾入冰水(100ml)中。用etoac萃取混合物。合并的有机层用盐水及1n nahco3水溶液依次洗涤(注意:大量气体逸出),干燥(na2so4)且浓缩。使用柱(硅胶)层析(己烷∶etoac为30∶1至20∶1)纯化残余物。产量:4.17g,浅黄色油状物,收率81%。
[0069]1h nmr(400mhz,氯仿-d):δ8.33(s,1h),7.14(s,1h),3.87(s,3h),3.67-3.54(m,1h),2.57(s,3h),2.51-2.40(m,2h),2.14-1.97(m,3h),1.82-1.79(m,1h)。
[0070]
(4)化合物1e(5-氰基-4-环丁基-2-甲基苯甲酸甲酯)的制备
[0071][0072]
将4-环丁基-5-碘-2-甲基苯甲酸甲酯(4.17g,12.64mmol),zn(cn)2(2.96g,25.21mmol)及pd(pph3)4(0.73g,0.63mmol)于dmf(30ml)中的混合物脱气且经由气囊用氩气填充烧瓶。混合物在氩气下,在100℃下加热过夜。冷却至环境温度后,混合物用饱和feso4水溶液(20ml)淬灭且用etoac(200ml)稀释。通过经硅藻土过滤移除淡绿色固体。使滤液分配于水与etoac之间。etoac层用盐水洗涤,干燥(na2so4)且浓缩。使用柱(硅胶)层析(己烷∶etoac为30∶1至20∶1)纯化残余物。产量:2.55g,白色固体,收率88%。
[0073]1h nmr(400mhz,氯仿-d):δ8.16(s,1h),7.28(s,1h),3.90(s,3h),3.86-3.82(m,1h),2.68(s,3h),2.55-2.45(m,2h),2.27-2.04(m,3h),1.89-1.87(m,1h)。
[0074]
(5)化合物1f(5-硫代氨基甲酰基-4-环丁基-2-甲基苯甲酸甲酯)的制备
[0075][0076]
向圆底烧瓶中添加5-氰基-4-环丁基-2-甲基苯甲酸甲酯(3.63g,0.015mol)、二硫代磷酸o,o
′-
二乙酯(10ml)及水(1ml)。反应混合物加热至80℃持续3小时(注意:出现大量气体逸出;本文中所述的此反应及所有其他反应均应在通风良好的通风橱中进行)。冷却至室温后,反应混合物分配于乙酸乙酯(50ml)与水(50ml)之间。合并的有机层用nahco3饱和水溶液(50ml)及盐水(50ml)依次洗涤,经na2so4干燥且在真空中浓缩。通过sio2快速层析(己烷/乙酸乙酯=80/20至50/50)纯化,得到呈黄色固体状的5-硫代氨基甲酰基-4-环丁基-2-甲基苯甲酸甲酯(3.06g,收率78%)。
[0077]
m/z(es )264(m h)
。1h nmr(400mhz,cdcl3):δ7.93(s,1h),7.82(s,1h),7.26(s,1h),6.92(s,1h),4.19(m,1h),3.89(s,3h),2.64(s,3h),2.40(m,2h),2.29-2.15(m,2h),2.12-2.00(m,1h),1.95-1.84(m,1h)。
[0078]
(6)化合物1g(4-环丁基-5-(亚氨基(甲硫基)甲基)-2-甲基苯甲酸甲酯)的制备
[0079][0080]
向圆底烧瓶中添加含5-硫代氨基甲酰基-4-环丁基-2-甲基苯甲酸甲酯(861mg,3.27mmol)的thf(10ml)。逐滴添加碘甲烷(mei)(912mg,6.42mmol)且反应混合物在室温下搅拌7小时。反应混合物在真空中浓缩且通过sio2快速层析(乙酸乙酯至乙酸乙酯/甲醇=95/5)纯化,得到呈淡黄色油状的4-环丁基-5-(亚氨基(甲硫基)甲基)-2-甲基苯甲酸甲酯(807mg,收率89%)。
[0081]
m/z(es )278(m h)
。1h nmr(400mhz,dmso-d6):δ7.67(s,1h),7.40(s,1h),3.88-3.71(m,4h),2.57(s,3h),2.44(s,3h),2.22-2.19(m,2h),2.12(m,2h),.1.98-1.86(m,1h),1.82-1.70(m,1h)。
[0082]
(7)化合物1h(4-环丁基-2-甲基-5-(5-甲基-4h-1,2,4-三唑-3-基)苯甲酸甲酯)的制备
[0083][0084]
向圆底烧瓶中添加含4-环丁基-5-(亚氨基(甲硫基)甲基)-2-甲基苯甲酸甲酯(556mg,0.002mol)及乙酰肼(223mg,0.003mol)的6ml乙酸溶液。将反应混合物加热至90℃持续3小时。冷却至室温后,反应混合物分配于水(50ml)与乙酸乙酯(50ml)之间。有机层用盐水(2
×
50ml)洗涤,经na2so4干燥且在真空中浓缩。经由sio2快速层析(己烷/乙酸乙酯=50/50至30/70)纯化,得到呈白色固体状的标题化合物(243mg,收率43%)。
[0085]
m/z(es )286(m h)
。1h nmr(400mhz,cdcl3):δ8.23(s,1h),7.32(s,1h),4.24-4.05(m,1h),3.89(s,3h),2.69(s,3h),2.54(s,3h),2.23-2.20(m,2h),2.16-2.05(m,2h),2.05-1.88(m,1h),1.88-1.71(m,1h)。
[0086]
(8)化合物1i(4-环丁基-2-甲基-5-(5-甲基-4h-1,2,4-三唑-3-基)苯甲酸)的制备
[0087][0088]
向4-环丁基-2-甲基-5-(5-甲基-4h-1,2,4-三唑-3-基)苯甲酸甲酯(240mg,0.842mmol)的甲醇(5ml)溶液中添加naoh水溶液(6ml,1m)。所得混合物加热至50℃持续6小时。冷却至环境温度后,反应混合物用1n hcl酸化至ph 2并且用乙酸乙酯(3
×
50ml)萃取。合并的有机层用盐水(50ml)洗涤,经na2so4干燥且在真空中浓缩,得到呈白色固体状的4-环丁基-2-甲基-5-(5-甲基-4h-1,2,4-三唑-3-基)苯甲酸(260mg,定量)。
[0089]
m/z(es )272(m h)
。
[0090]
(9)化合物1(4-(1-(4-环丁基-2-甲基-5-(5-甲基-4h-1,2,4-三唑-3-基)苯甲酰基)哌啶-4-基)苯甲腈,即本发明式(i)化合物)的制备
[0091][0092]
向4-环丁基-2-甲基-5-(5-甲基-4h-1,2,4-三唑-3-基)苯甲酸(260mg,0.95mmol)的dmf(4ml)溶液中添加4-(哌啶-4-基)苯甲腈盐酸盐(232mg,1.045mmol)、edc(272mg,1.425mmol)、hobt(39mg,0.285mmol)及diea(367.7mg,2.85mmol)。所得混合物在室温下搅拌16小时。混合物用nahco3饱和水溶液(20ml)淬灭并且用乙酸乙酯(2
×
50ml)萃取。合并的有机层用盐水(50ml)洗涤,经na2so4干燥,过滤且在真空中浓缩。经由sio2柱层析(二氯甲烷/甲醇=95/5)纯化,得到呈白色固体状的4-(1-(4-环丁基-2-甲基-5-(5-甲基-4h-1,2,4-三唑-3-基)苯甲酰基)哌啶-4-基)苯甲腈(193mg,收率44%)。
[0093]
m/z(es )440(m h)
。
[0094]1h nmr(300mhz,cd3od):δ7.69(d,j=5.4hz,2h),7.56-7.30(m,4h),1个质子由甲醇溶剂峰遮蔽,4.10-3.98(m,1h),3.64(t,j=10.7hz,1h),3.33-3.21(m,1h),3.00(t,j=8.9hz,2h),2.58(s,3h),2.48及2.38(2个单峰,酰胺旋转异构体,arch3,3h),2.28-1.92(m,6h),1.92-1.55(m,4h)。
[0095]
1h nmr(400mhz,dmso-d6):δ13.66(s,1h),7.77(d,j=8.0hz,2h),7.62-7.34(m,4h),4.78-4.63(m,1h),4.31(br s,1h),3.45(br s,1h),3.15(app t,j=12.3hz,1h),2.99-2.78(m,2h),2.44-1.80(m,12h),1.80-1.37(m,4h)。
[0096]
实施例2:式(ii)化合物的制备
[0097]
(1)化合物2b(3-甲酰基-4-甲基苯甲酸)的制备
[0098][0099]
在用氮气惰性气氛净化和维持的3000ml三颈圆底烧瓶中,放入3-溴-4-甲基苯甲酸(100g,465mmol,1.00当量)的四氢呋喃(1500ml)溶液。在-78℃向其逐滴加入n-buli(2.5m的thf溶液)(411ml,1023mmol,2.20当量)并搅拌30min。在-78℃向反应物中加入n,n-二甲基甲酰胺(101g,1.38mol,3.00当量)。将得到的溶液在液氮浴中在-78℃搅拌30min,然后用1000ml水淬灭。将水层用1000ml乙酸乙酯洗涤,并将溶液的ph值用6n氯化氢调至3-4。过滤收集固体并在烘箱中干燥,得到45g黄色固体,即3-甲酰基-4-甲基苯甲酸,收率59%。
[0100]
(2)化合物2c(3-(1-羟丙基)-4-甲基苯甲酸)的制备
[0101][0102]
在用氮气惰性气氛净化和维持的2000ml圆底烧瓶中,放入3-甲酰基-4-甲基苯甲酸(40g,243.67mmol,1.00当量)的thf(1000ml)溶液。在0℃向其逐滴加入溴(乙基)镁(244ml,3n的乙醚溶液,3.00当量)。将得到的溶液在20℃搅拌2-3h,然后用500ml nh4cl饱和溶液淬灭。将溶液的ph值用氯化氢(6mol/l)调至4-5。将水相用2
×
500ml乙酸乙酯萃取,并将合并的有机层经无水硫酸钠干燥,并在真空下浓缩。得到50g粗制的3-(1-羟丙基)-4-甲基苯甲酸,黄色固体。
[0103]
(3)化合物2d(4-甲基-3-丙酰基苯甲酸)的制备
[0104][0105]
在2000ml圆底烧瓶中放入粗制的3-(1-羟丙基)-4-甲基苯甲酸(50g,1.00当量)的二氯甲烷(1000ml)溶液,dess-martin periodinane(戴斯-马丁氧化剂)(131g,309.28mmol,1.20当量)。将得到的溶液在25℃搅拌2h,然后用500ml 2m na2s2o3(水溶液)淬灭。将固体滤出,将水相用2
×
500ml乙酸乙酯萃取并在真空下浓缩。得到45g(粗制的)作为黄色固体的4-甲基-3-丙酰基苯甲酸。
[0106]
(4)化合物2e(4-甲基-3-丙酰基苯甲酸甲酯)的制备
[0107][0108]
在用氮气惰性气氛净化和维持的2000ml圆底烧瓶中,放入粗制的4-甲基-3-丙酰基苯甲酸(45,1.00当量)的甲醇(1000ml)溶液。向其逐滴加入硫酸(45.9g,468.4mmol,2.00当量)。将得到的溶液在油浴中在80℃搅拌4h,然后在真空下浓缩。将反应物用500ml水/冰淬灭。将水相用2
×
500ml乙酸乙酯萃取。将合并的有机层用1
×
200ml碳酸氢钠(饱和)、2
×
200ml盐水洗涤,经无水硫酸钠干燥和在真空下浓缩。用乙酸乙酯/石油醚(1/50)将残余物施加到硅胶柱上。得到22g(收率46%)作为浅黄色固体的4-甲基-3-丙酰基苯甲酸甲酯。
[0109]
(5)化合物2f(3-(3-甲氧基-2-甲基-3-氧代丙酰基)-4-甲基苯甲酸甲酯)的制备
[0110][0111]
在0℃向4-甲基-3-丙酰基苯甲酸甲酯(5.0g,24.24mmol,1.00当量)在碳酸二甲酯(70ml)中的溶液中分份加入氢化钠(60%)(1.5g,62.50mmol,1.50当量),并在氮气下在90
℃搅拌2.0h。然后将反应物用50ml nh4cl(饱和)淬灭,并用3
×
100ml乙酸乙酯萃取。将有机相用2
×
100ml盐水洗涤和经无水硫酸钠干燥,然后在真空下浓缩,得到6.8g(粗制的)作为黄色油的3-(3-甲氧基-2-甲基-3-氧代丙酰基)-4-甲基苯甲酸甲酯。
[0112]
(6)化合物2g(4-甲基-3-(4-甲基-5-氧代-2,5-二氢-1h-吡唑-3-基)苯甲酸甲酯)的制备
[0113][0114]
向3-(3-甲氧基-2-甲基-3-氧代丙酰基)-4-甲基苯甲酸甲酯(3.3g,12.49mmol,1.00当量)的乙醇(30ml)溶液中加入nh2nh2.h2o(98%)(1.33g,26.66mmol,2.00当量)。将得到的溶液回流搅拌4.0h,然后在真空下浓缩。将残余物通过硅胶色谱法纯化,用ch2cl2/meoh(50/1至40/1)作为洗脱液,得到1.8g(收率59%)作为浅黄色固体的4-甲基-3-(4-甲基-5-氧代-2,5-二氢-1h-吡唑-3-基)苯甲酸甲酯。
[0115]
(7)化合物2h(3-(3-(2-羟基乙氧基)-4-甲基-1h-吡唑-5-基)-4-甲基苯甲酸甲酯)的制备
[0116][0117]
向4-甲基-3-(4-甲基-5-氧代-2,5-二氢-1h-吡唑-3-基)苯甲酸甲酯(40g,163mmol,1.00当量)的dma(800ml)溶液中加入碳酸钾(112g,813mmol,5.00当量)和2-溴乙烷-1-醇(141g,1138mmol,7.00当量)。将混合物在25℃搅拌4h,然后用1000ml h2o稀释。将水相用5
×
1000ml乙酸乙酯萃取,并将合并的有机层用2
×
1000ml盐水洗涤,经无水硫酸钠干燥和在真空下浓缩。将残余物施加到硅胶柱上,用乙酸乙酯/石油醚(1:10至1:1)作为洗脱液,得到30g(收率64%)作为浅黄色油的3-(3-(2-羟基乙氧基)-4-甲基-1h-吡唑-5-基)-4-甲基苯甲酸甲酯。
[0118]
(8)化合物2i(3-(3-(2-羟基乙氧基)-4-甲基-1h-吡唑-5-基)-4-甲基苯甲酸)的制备
[0119][0120]
向3-(3-(2-羟基乙氧基)-4-甲基-1h-吡唑-5-基)-4-甲基苯甲酸甲酯(30g,
103mmol,1.00当量)的甲醇(500ml)溶液中加入氢氧化钠(41g,1025mmol,10.0当量)的水(300ml)溶液。将混合物在室温搅拌2h。将得到的混合物在真空下浓缩,并将溶液的ph值用氯化氢(2mol/l)调至4-5。将固体通过过滤进行收集。得到20g(收率71%)作为浅黄色固体的3-(3-(2-羟基乙氧基)-4-甲基-1h-吡唑-5-基)-4-甲基苯甲酸。
[0121]
(9)化合物2(4-(1-(3-(3-(2-羟基乙氧基)-4-甲基-1h-吡唑-5-基)-4-甲基苯甲酰基)氮杂环丁烷-3-基)苄腈,即本发明式(ii)化合物)的制备
[0122][0123]
向3-(3-(2-羟基乙氧基)-4-甲基-1h-吡唑-5-基)-4-甲基苯甲酸(20.0g,72.5mmol,1.00当量)的dcm(500ml)溶液中加入edci(16.7g,87.0mmol,1.20当量)、4-二甲基氨基吡啶(1.77g,14.5mmol,0.20当量)、diea(23.4g,181mmol,2.50当量)和4-(氮杂环丁烷-3-基)苄腈盐酸盐(15.5g,79.7mmol,1.10当量)。将得到的溶液在室温搅拌过夜。将得到的溶液用500ml h2o稀释。将得到的溶液用3
×
500ml乙酸乙酯萃取,并将合并的有机层用2
×
500ml nh4cl(饱和)、2
×
500ml盐水洗涤,并经无水硫酸钠干燥和在真空下浓缩。将残余物通过硅胶色谱法纯化,用ch2cl2/meoh(50/1至30/1)作为洗脱液,得到21.0g(收率67%)白色固体的4-(1-(3-(3-(2-羟基乙氧基)-4-甲基-1h-吡唑-5-基)-4-甲基苯甲酰基)氮杂环丁烷-3-基)苄腈。
[0124]
m/z(es )417.3(m h)
。
[0125]
生物学实施例
[0126]
化合物1和化合物2在hbv细胞中活性的测定
[0127]
phh(原代人肝细胞)分析:细胞系和化合物治疗
[0128]
将phh细胞以1.32
×
105细胞/孔的密度接种到48孔板中。将phh细胞的接种日期定义为第0天。在第1天以1600ge/细胞的hbv(d型)感染phh细胞。在第2、4、6和8天更新包含化合物的培养基。收集第9天的上清液,并通过qpcr分析hbv dna,通过elisa分析hbsag。
[0129]
在10000.0、3000.0、1000.0、300.0、100.0、30.0和10.0nm下测试化合物,在0.2000、0.0667、0.0222、0.0074、0.0025、0.0008和0.0003nm下测试恩替卡韦(etv)。用1%dmso作为非治疗对照。
[0130]
hbv dna和hbsag的测定
[0131]
根据手册,使用qiaamp 96dna血液试剂盒分离培养上清液中的dna,并通过qpcr进行定量。用80μl的培养上清液样品提取dna。洗脱体积为120μl。将pcr混合物(8μl/孔)和样品(2μl/孔)或质粒标准品(2μl/孔)添加到384孔光学反应板中,并使用以下程序进行:95℃下10分钟,然后在95℃下15秒,60℃下1分钟循环40个循环。
[0132]
参照antu hbsag elisa kit说明书,应用chemiluminescence apparatu检测hbsag的含量。
[0133]
剂量反应曲线
[0134]
hbv dna抑制率(%)=(1-化合物组样品的hbv dna拷贝数/dmso组的hbv dna拷贝数)
×
100
[0135]
hbsag抑制率(%)=(1-样品的hbsag值/dmso对照组hbsag值)
×
100
[0136]
结果分析
[0137]
如图1、2所示,其中图1是phh细胞中抑制hbv dna的ec50曲线;图2是phh细胞中hbsag抑制的ec50曲线。在phh分析中,化合物1和2对细胞外hbv dna和hbsag具有剂量依赖性抑制作用。作为对照,etv表现出对hbv dna的显著抑制,但对hbsag无显著抑制。
[0138]
hepg2-ntcp细胞分析:细胞系和化合物治疗
[0139]
将hepg2-ntcp细胞以7.5
×
104细胞/孔的密度接种到48孔板中。将hepg2-ntcp细胞的接种日期定义为第0天。在第2天以2000ge/细胞的hbv(d型)感染hepg2-ntcp细胞。第3天和第6天更换一次含化合物的培养液。第9天,收集细胞上清用于检测hbeag(elisa)和hbsag(elisa)。
[0140]
在10000.0、3000.0、1000.0、300.0、100.0、30.0和10.0nm下测试化合物,在5.000、1.250、0.313、0.078、0.020、0.005和0.001nm下测试恩替卡韦(etv)。用1%dmso作为非治疗对照。
[0141]
hbsag和hbeag的测定
[0142]
参照antu hbsag elisa kit和antu hbeag elisa kit说明书,应用酶标仪检测hbsag和hbeag的含量。
[0143]
剂量反应曲线
[0144]
hbsag抑制率(%)=(1-样品的hbsag值/dmso对照组hbsag值)
×
100hbeag抑制率(%)=(1-样品的hbeag值/dmso对照组hbeag值)
×
100结果分析
[0145]
如图3、4所示,其中图3是hepg2-ntcp细胞中抑制hbsag的ec50曲线;图4是hepg2-ntcp细胞中hbeag抑制的ec50曲线。在hepg2-ntcp分析中,化合物1和2对细胞外hbsag和hbeag具有剂量依赖性抑制作用。作为对照,etv对hbsag和hbeag均无显著抑制。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
